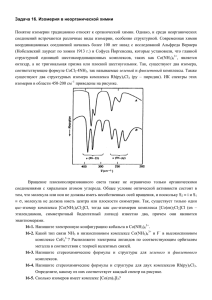
План лекции комплексные соединения переходных металлов по
реклама

1 При подготовке настоящей лекции использовались материалы следующих книг: Ю.Н.Кукушкин “Химия координационных соединений” 1985, L.S.Hegedus “Transition Metals in the synthesis of complex organic molecules” 1999, K.C.Nicolaou, E.G.Sorensen ‘Classic in total synthesis” 1996. “Я должен читать Вам методику, но не буду, потому что полагаю, что науки методики нет. А что бы хорошо учить, нужно знать впятеро больше, чем говоришь, и тогда никакие методики тебе не потребуются” А.Н.Попов цитировано по М.Л.Гаспарову “Записки и выписки.” Комплексные соединения Комплексные соединения имеют центральный атом (комплексообразователь), вокруг которого координируются нейтральные молекулы или кислотные остатки. Эти группы называют лигандами. Совокупность центрального атома и окружающего его лигандов – внутренняя сфера комплексного соединения, а все остальное – внешняя сфера. При координации изменяются как свойства лигандов, так и свойства металла комплексообразователя. Координированные лиганды и ион металла (металл) часто невозможно обнаружить с помощью реакций, характерных для них в свободном (не координированном состоянии). Это используется для установления строения комплексного соединения. Например, в результате реакции (1) образуется комплексное соединение состава СoCl3 5NH3: CoCl3 + NH3 → CoCl3 5NH3 (1) 2 Соединение не дает реакции на Сo (III) и аммиак. Следовательно, они входят во внутреннюю сферу комплексного соединения. Нитрат серебра осаждает в виде хлорида серебра только два из трех атомов хлора. Следовательно, один из трех атомов хлора входит вo внутреннюю сферу и комплекcный ион имеет строение [Co(NH3)3Cl]2+ Принято обозначать связи лигандов с центральным атомом черточками и клиньями, указывающими направления. Примеры: L L Pt L L L L L L Pt L Pt L L L L L Степень окисления Под степенью окисления центрального атома металла, понимают заряд, который появляется на атоме после отщепления лиганда с парой электронов. Ниже представлены примеры определения степени окисления. M-Cl .. .. _ + : Cl : M-H M :H (+1) M-CO _ :C + O: M (0) M-PPh3 _ M+ (+1) : PPh3 M (0) H H H M .. CH2 _ + M M (+1) M H (0) 3 OR M M H (0) OR : M M H (0) êàðáåí M : CN CN _ M+ (+1) M : NH3 NH3 M (0) Переходные металлы с 4-ой по 11-ую группу, их электронная конфигурация как функция степени окисления. Номер 4 5 6 7 8 9 10 11 Ti V Cr Mn Fe Co Ni Cu Zr Nb Mo Tc Ru Rh Pd Ag Hf Ta W Re Os Ir Pt Au группы Степень окисления Число валентных электронов 0 4 5 6 7 8 9 10 _ I 3 4 5 6 7 8 9 10 II 2 3 4 5 6 7 8 9 III 1 2 3 4 5 6 7 8 IV 0 1 2 3 4 5 6 7 Типы связей для лигандов моно анионов. Гаптность лиганда (η) и число отдаваемых электронов. 4 Под гаптностью понимают число атомов лиганда, связанных с цетральным атомом. Примеры гаптности лигандов представлены ниже. R-M 1 2e M 2e 1 H R= àëêèë, àëêåí èë, àðèë M H 4e 3 5 _ H 1 4e H M M 3 .. M 3 2e - 4e 6e - M 5 6e - M Типы связей для лигандов нейтральных молекул. Гаптность лиганда (η) и число отдаваемых электронов. R3P-M 1 M 2 2e 2e R3N-M 1 4 M 2e - 4e 2e OC-M 1 - 6 6 e- M 2e M 2 4 M Координационно насыщенные и координационно ненасыщенные комплексные соединения. Правило 18 электронов. 4e -1 - 5 По Сэджвику центральный атом комплексообразователь, присоединяя лиганды, стремится дополнить свою электронную оболочку до электронной оболочки ближайшего благородного газа: Kr 36 , Xe 54 , Rn 86 . Числа 36, 54, и 86 он назвал эффективными атомными номерами. Центральный атом комплексообразователь дополнивший свою электронную оболочку до 36, 54 или 86 электронов называют координационно-насыщенным. В последние годы многие химики при определении координационной насыщенности все чаще используют правило 18 электронов, которое по существу является иной формой правила эффективного атомного номера Сэджвика. Это правило гласит: в координационно-насыщенных соединениях комплексных соединений переходных металлов число валентных электронов на (n-1) d-орбитали и n-s и n-p орбиталях центрального атома равно 18. Примеры определения координационной насыщенности. Âû âî ä Fe OC Fe CO Ðàñ÷åò II Fe II 2 CO _ : - _ : 6e 6e 2e 4e 2 CO _____________ 18 e - 6 Ðàñ÷åò Zr - 2 Zr H Cl IV 0 e - Âû âî ä IV Zr _ :H _ Cl : 12 e- 2 _ :H _ 2 e 2 e: Cl _____________ 16 e Ph3P : PPh3 Rh _ 3 PPh3 Cl Ph3P Cl Âû âî ä Rh Ðàñ÷åò I Rh I - 8 e- 6 e3 PPh3 2eCl ____________ 16 e - : CO CO CO Cr CO 5 CO CO PPh3 CO : H Rh H Âû âî ä 0 Cr Ðàñ÷åò 0 Cr 6e 5 CO 10 e Rh 2e H ___________ 18 e - : K3 NC CN CN Fe NC CN CN 3- 6 CN 6-3=+3 Âû âî ä III Fe Ðàñ÷åò III 5eFe 12 e 6____________ CN 17 e 7 4- NC CN CN Fe NC CN CN K4 6 CN - Âû âî ä II Fe 6 - 4= +2 Cl : Cl Pd Pd Pd Cl Ðàñ÷åò II 6 eFe 12 e 6____________ CN 18 e Ðàñ÷åò Âû âî ä II Pd Pd Cl Pd - : Cl :- Cl Pd Pd Pd II 8 e- Pd 2 e Cl 2e - 4e ______________ 16 e Cl : Примеры устойчивых комплексных соединений с 16 , 17 и 19 электронами. K3 NC CN CN Fe NC CN CN 3 6 CN - Âû âî ä Ðàñ÷åò III 5e Fe 12 e 6____________ CN III Fe 6-3=+3 17 e NH3 NH3 NH3 Cu NH3 NH3 2+ 5 NH3 - Cl2 Âû âî ä Ðàñ÷åò Cu(II) Cu(II) 9eNH3 10 e 5___________ 19 e - - 8 Механизмы элементарных реакций комплексных соединений переходных металлов. I. Замещение лигандов. I.1. Механизм типа SN2. MLn + L' êî î ðäèí àöèî í í î í åí àñû ø åí í û é ' L _ MLn _' L ML n-1 + L M= PtII, PdII, NiII, RhI, IrI Cкорость реакции зависит от природы металла (Ni>Pd>>Pt), от природы уходящего лиганда Х (NO3->H2O>Cl->Br->I->N3-> SCN->NO2->CN-), от природы входящего лиганда (PPh3>Py>NH3>Cl->H2O>OH-), а так же от лиганда находящегося в транс- положении (R3Si>H->≈CH3≈CN- олефин ≈СO>PR3≈NO2-≈I-≈SCN->Br->Cl->RNH2>NH3>OH->NO2≈H2O). Пример: Y Y Lc II Pd Lt X Lc Lc + Y X II Pd Lt Lc Lc êâàäðàòí àÿ ï èðàì èäà Lc II Pd Lt Y Lc X êâàäðàòí àÿ ï èðàì èäà I. 2. Механизм типа SN1. Lc Lt II Pd Y + Lc X II Pd X Lc Lt òðèãî í àëüí àÿ áèï èðàì èäà 9 ML n L + L' MLn-1 ' L- MLn-1 êî î ðäèí àöèî í í î í àñû ù åí í û é Пример: H H L Rh H L L L L + L R Rh Rh L OC R CO CO L=PPh3 I.3. “Понижение” (“sleeppage”). Для таких лигандов как η3-аллил, η5-циклопентадиенл, η6-арен возможно посредством “понижения” уменьшение гаптности: M M η3-аллил η1-аллил M M M η5-Ср η3-Ср η1-Сp M M η6-арен M η4-арен η1-арен L 10 II. Окислительное присоединение/восстановительное отщепление. Окислительное присоединение восстановительное отщепление важнейшая стадия во многих органических реакциях с участие комплексных соединений переходных металлов. Этот процесс возможен постольку, поскольку переходные металлы в отличие от непереходных металлов способны менять свою степень окисления. M n + A-B M n A A A M n B M B n=0, 1 n-2 B êî î ðäèí ï öèî í í î í àñû ù åí êî î ðäèí àöèî í í î í åí àñû ù åí M= Ni0, Pd0, Rh1, Ir1 A-B: 1. Полярные электрофилы X2, HX, R-X, Ar-X, R-CO-X, R-SO2-X + CH3 L I Cl + Ir L 16 e - CO L ì åäëåí î Cl Ir CH3-I L CO I - áû ñòðî Cl L CH3 III L Ir CO I 18 e 11 Br L L L Pd L L L L + L Pd L Pd L Ph H Pd Br H L L L + L Br Pd Ph L Ph 2. Неполярные молекулы Н2, R2Si-H, R-CO-H, R-H, Ar-H H L Cl I Rh 16 e - + L I Rh H-H L L L L Rh L Cl H H H L L H L 3. Кратные связи O2, S2, C≡C, C=C O O O O R R R- -R M M R R R R M 4. Малые циклы M III. Миграционное внедрение / миграционное извлечение. H L Cl L Cl III Rh 18 e - 12 Это процесс, при котором ненасыщенный лиганд Х - обычно СО, RNC, олефины, алкины - формально внедряется по соседней (цис-) связи металллиганд Y . Термин внедрение, некоторым образом, вводит в заблуждение: в действительности происходит миграция лиганда Y к ненасыщенному лиганду X. X L L M M Y X=CO, RNC, C=C, C X Y Y X M Y= H, R, PhCH2 , àëëèë, àðèë, âèí èë C III.1. Внедрение СО. M M R R + O+ M k-1 O M L k1 O R O L R Способность к миграции зависит от природы лиганда: Et>Me>CH2Ph>η1 аллил > винил> арил. Гидрид анион (Н), СН3СО, СF3 обычно не мигрируют. Редко мигрируют RO-, R2N-. Миграция протекает с сохранение конфигурации. III.2. Внедрение С=С. M M R öèñ R öèñ Склонность к миграции зависит от природы лиганда: 13 H>>R> винил , арил>RCO>>RO-, R2N- . Миграция протекает с сохранение конфигурации. III. 3. Внедрение С≡С. M M R R öèñ öèñ Миграция протекает с сохранение конфигурации. IV. Нуклеофильная атака на лиганд координированный к переходному металлу. L n M C + O Ln M C O + Ln R-Li M C - O R E+ E E R âî ññòàí î âèòåëüí î å î òù åï ëåí èå Ln M Ln - M O R O C C O R àëüäåãèäû , êåòî í û , ï ðî èçâî äí så êèñëî ò. Ln O-E M R ì åòàëë êàðáåí Направление атаки зависит от природы металла и электрофила. Жесткие электрофилы R3O+BF4-, RO-Tf, ROSO2F атакуют кислород, тогда как мягкие металл. Суммарная таблица реакций нуклеофилов с комплексными соединениями переходных металлов. 14 IV..1. Cr(CO)6 + O - (CO)5 Cr CH3 Li CH 3 Et NH 2 Cl IV.2. + Pd + Et2NH Pd NR Cl 2 NR 2 Cl Fe(CO)4 IV. 3. Cl - + Fe(CO)3 CH3-Li -Fe(CO) 3 N - H :CH2CN IV 4. - Cr(CO)3 Cr(CO)3 O PPh3 Pd OH O Cl + - OH O : O HO Pd HO PPh3 + Cl 15 V. Электрофильная атака на комплексные соединения переходных металлов. V.1. Электрофильрое расщепление сигма связи алкил металла. E R M + + âî ññòàí î âèòåëüí î å î òù åï ëåí èå R-M+ E R-E ñî õðàí åí èå êî í ô èãóðàöèè Nu R-Nu + î áðàù åí èå êî í ô èãóðàöèè M-E V.2. Атака α-положения. M CH Ph + + C(Ph) M CH Ph 3 H R M + + + H R M H V.3. Атака β-положения. M CH CH2 + V.4. Атака γ-полоения + E + + M CH CH2 E M 16 M + + E M E A M B + + - A M M A  B V.5. Атака координированного полиена. H + H + + Ñ(Ph)3 + M M M VI. Трансметаллирование R M + M' X M= Zn, D, Hg, Si, Sn, Ge R M' + M X M'= ï åðåõî äí û å ì åòàëëû Механизмы важнейшиx реакций с участием комплексных соединений переходных металлов: Реакция Смидта (ваккер процесс), реакции гидрирования, реакция карбонилирования, реакции Хекка, Сузукки, Стилла, Соногашира, реакция метатезиса, реакция Тебе, реакция Паусона-Ханда. 17 1.Карбонилирование спиртов. - + CH3CO2 H HI OC Rh HOH CH3I I CH3OH + I OC - O CH3 OC I H3C I Rh I OC I H3C O CO C I Rh O C I Rh I OC - CH3 I OC I I CO 2. Гидрирование алкенов Для гидрирования алкенов нашел применение катализатор Уилкинсона трис-трифенилфосфин родийхлорид. Его достоинства: эффективность, селективность, отсутствие гидрирования функциональных групп, отсутствие изомеризации алкена, Реакционная способность алкенов изменяется симбатно их способности к координации: R R R R = R R R R IH 18 Три и тетра - замещенные алкены не гидрируются, а этилен, вследствие сильной координации, является каталитическим ядом. L L H-H Rh L Cl L S L Rh Cl H H H-H L H Rh Rh Cl S Cl L H L L L L RCH2CH3 S H L S L H H Rh Cl R Rh Cl L CH3 H L H Rh Cl H Rh L CH3 R L Cl R L R L= PPh 3 Для избирательного гидрирования терминальной (концевой) двойной связи нашел применение трис-трифенилфосфинкарбонилродийгидрид. В процессе гидрирования не затрагеваются альдегиды, кетоны, сложные эфиры, нитрилы, галогенопроизволные, а также алкены с интернальной (внутреней). Главным недостатком этого катализатора являетя то, что L 19 гидрирование сопровождается изомеризацией алкена, причем образовавшийся интернальный алкен далее не гидрируется. H L L Rh L L L + H Rh R CO L CO H H H R L Rh L R CO L OC H H L H H Rh L Rh L R H2 CO R + 1 R 3. Реакция Хекка R-X + 2 R R=àðèë, âèí èë. Õ= Br, I Pd(0) B R 2 R + (BH)X L H Rh L CO 20 L L L Pd L Pd L L L L (BH)X R Pd + L R-X L B R R L Pd 2 X L HPdL2 X R2 H 2 R R H H PdL2 X R H H H 2 R 2 R L Pd X R PdL2 X L L= PPh3 4.Реакция Сузуки R-X + R1BY2→ R-R1 R= арил, аллил, алкенил, X=Br, I, если X=I, то и алкил R1= алкенил, арил, алкил. Y= OH, OR. 21 L L L Pd L Pd L L L Pd L + L R-X L R 1 R R L Pd L X R L 2 R-ONa Pd L R1 NaX 2 RO-BY2 R Pd 1 L BY 2 Реакция Стилла R-X + R L 1 R-SnBu 3 Pd(0) 1 R-R + X-SnBu 3 2 OR 22 L L L Pd L Pd L L L L Pd + L R-X L 1 R-R R L Pd L X 1 R L 1 R-SnBu3 Pd R L X-SnBu 3 R L R 1 Pd L 5. Реакция Соногашира R-X + 1 R PdL2 Cl 2 CuI, Et 2 NH R=винил, арил R 1 R 23 Cl L Pd Cl L 1 R H CuI, Et2 NH R L Pd L 1 R R L Pd 1 R 1 R R R-X L R L Pd L X R1 H CuI, Et 2NH (Et NH) X 2 R1 L Pd L R 6. Реакция Смидта (Ваккер процесс) O PdCl2 R R L Pd CuCl2 / O2 H2 O R L 1 R 24 Реакция специфична для терминальных алкенов, интернальные алкены значительно труднее координируют. CuCl2 /O2 R Pd Cl Cl R O Pd(0) R HCl Cl Pd H Cl R OH Cl S Pd S S HOH R OH R HCl Cl Pd Cl Pd S OH S S Как правило, гидроксильная группа оказывается у вторичного атома углерода, что приводит к образованию метилкетона. Однако, если алкен содержит функциональные группы способные координировать с паладием с образованием пяти или шестичленных циклов, гидроксильная группа оказывается связанной с терминальным атомом углерода, что приводит к образованию альдегида. O O O R PdCl2 O Pd Cl Cl O R O HOH O R 25 7. Реакция метатезиса (от греческого перестановка) 1 R R 3 R 4 R R R 2 + R5 7 R êàò. 1 R 5 R 6 R 8 R 3 R 6 R H H H H + H (CH2)n H êàò. êàò. (CH 2)n R 7 2 R R 1 + +3 8 R R R H H H H H H H + 4 R 5 2 R R 6 R + 4 R 7 R 8 R 26 L Cl Ph Ru R Cl R L R L Ph L Cl Cl Ru Ru Cl L Cl Cl L L R R Ru Cl L Ph L Cl R Ru Cl L L R R Cl L Ru Cl Cl Ru L Cl R R Ph L 8. Реакция Тебе O + R Cp2 Ti X R X Cp Cp2 Ti Cl 2 + AlMe X= R, H, OR, NR2 9.Реакция Паусона-Ханда Al Ti 3 Cp Cl Cp2 Ti 27 O + (CO) 4 CO Co + OTGP Co(CO)4 Co (CO) 3 (CO) Co 4 (CO)3 Co Co(CO) 4 Co(CO)3 + OTGP 2 CO Co(CO) 3 O TGPO Co(CO) 3 Co(CO) 3 Co (CO) O Co (CO) 3 OTGP 3 O TGPO Co (CO) 3 Co(CO) 3 Co (CO) 2 CO Co (CO) O 2 TGPO Co(CO) 3 Co (CO) OTGP 3 Co(CO) TGPO Co(CO) CO Co(CO) TGPO 2 Co(CO) 2 3 OTGP 3