План урока химии 8 класс (2 часа) Тема занятия:
advertisement
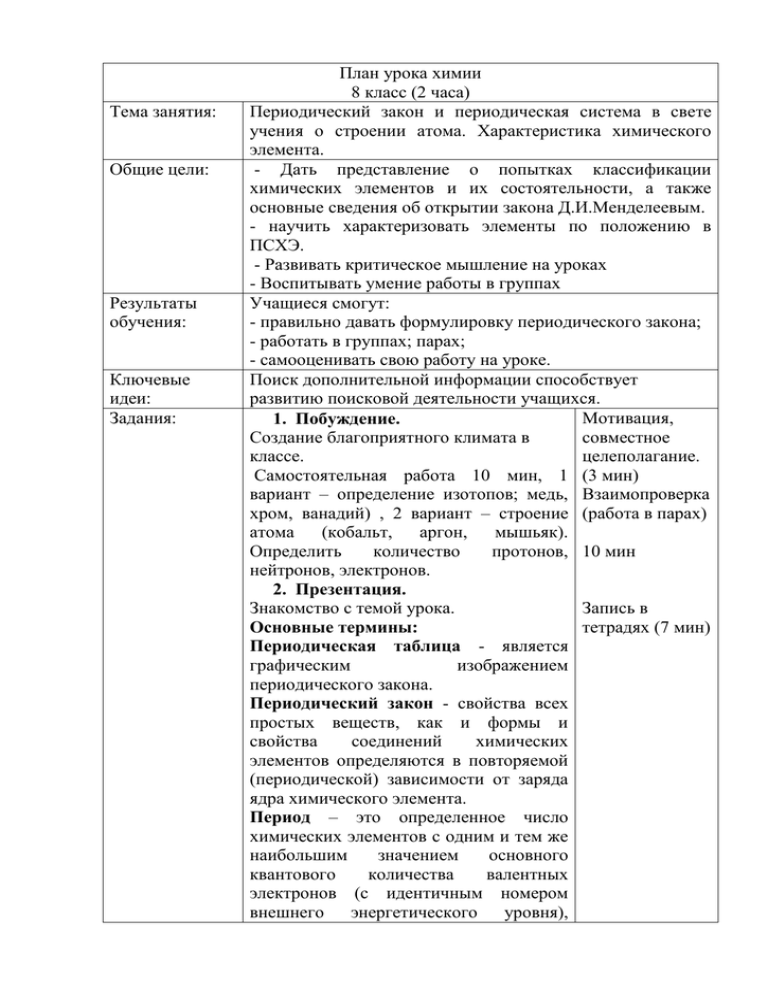
Тема занятия: Общие цели: Результаты обучения: Ключевые идеи: Задания: План урока химии 8 класс (2 часа) Периодический закон и периодическая система в свете учения о строении атома. Характеристика химического элемента. - Дать представление о попытках классификации химических элементов и их состоятельности, а также основные сведения об открытии закона Д.И.Менделеевым. - научить характеризовать элементы по положению в ПСХЭ. - Развивать критическое мышление на уроках - Воспитывать умение работы в группах Учащиеся смогут: - правильно давать формулировку периодического закона; - работать в группах; парах; - самооценивать свою работу на уроке. Поиск дополнительной информации способствует развитию поисковой деятельности учащихся. Мотивация, 1. Побуждение. Создание благоприятного климата в совместное классе. целеполагание. Самостоятельная работа 10 мин, 1 (3 мин) вариант – определение изотопов; медь, Взаимопроверка хром, ванадий) , 2 вариант – строение (работа в парах) атома (кобальт, аргон, мышьяк). Определить количество протонов, 10 мин нейтронов, электронов. 2. Презентация. Знакомство с темой урока. Запись в тетрадях (7 мин) Основные термины: Периодическая таблица - является графическим изображением периодического закона. Периодический закон - свойства всех простых веществ, как и формы и свойства соединений химических элементов определяются в повторяемой (периодической) зависимости от заряда ядра химического элемента. Период – это определенное число химических элементов с одним и тем же наибольшим значением основного квантового количества валентных электронов (с идентичным номером внешнего энергетического уровня), равняющимся номеру периода. Группа – это совокупность химических элементов с идентичным количеством валентных электронов, которые равняются номеру группы. Химические символы – это не просто сокращенные имена химических элементов, а и выражение их конкретного количества, т.е. каждый символ означает или один атом химического элемента, или один моль его атомов, или массу элемента, равную молярной массе этого элемента. Задание № 1: С. 135, 138, 152, прочитать Индивидуальная И ответить на вопросы: работа 1. Почему группы делятся на (7 мин) главные и побочные? 2. Почему периоды делят на большие и малые? 3. Поясните, в чем физический смысл периодичности изменения свойств, порядкового номера, подгруппы, элемента? Задание № 2: «РАССКАЖИ МНЕ ОБО МНЕ» 1. дать характеристику элементу № 6 2. дать характеристику элементу №13 3. дать характеристику элементу № 20 10 мин 4. дать характеристику элементу №26 Задание № 3: - Научный подвиг Д.И. Менделеева с.156-160 Задание № 4. Просмотр видеофильма. Обсуждение. Учащиеся должны ответить на следующие вопросы: 1. Кем и когда был открыт периодический закон? 2. Где родился ДИ. Менделеев? Кто были его родители? 3. Как читается периодический закон по Кластер Групповая работа (10 мин) Кластер – элемент критического мышления. (7 мин) Д.И. Менделееву? 4. Современная формулировка периодического закона. 5. Какие подтверждения периодического закона, известные еще при жизни Менделеева, вы знаете? Закрепление. С. 139 у. 4,5,6,7 10 мин С. 153 у. 6,7,8 С. 154-155 прочитать 10 мин Задача 1 Назвать элемент по таким данным: находится в III группе, относительная молекулярная масса высшего оксида 102. а) Алюминий; б) Скандий; в)Галлий. Дано: R2O3 Mr(R2O3)=102 R-? Решение: Mr(R2O3)=102, Ar(O)=16 2x+16*3=102 2x=102-48 2x=54 x=27 Данная Аг соответствует элементу Al. Ответ: Алюминий. Задача 2. Назвать элемент по таким данным: находится во II группе, относительная молекулярная масса гидроксида 235. а) Кальций; б) Меркурий; Стронций в) 13 мин Дано: Решение: R(OH)2 Mr(R(OH)2 Mr(R(OH)2=235, Ar(O)=16, Ar(H)=1 R-? x+34=235, x=235-34=201 Данная Аг соответствует элементу Hg. Ответ: Меркурий Задача 3. Назвать элемент по таким данным: находится в IV группе, относительная молекулярная масса высшего оксида 60. а) Станум; б) Силиций; Карбон Дано: RO2 в) Решение: Mr(RO2)=60, Ar(O)=16 Mr(RO2)=60 x+32=60 R-? x=60-32=28 Данная Аг соответствует элементу Si. Ответ: Силиций Рефлексия Подведение итогов урока. Что понравилось? Что узнал (а)? 3 мин Источники: Учебник химии 8 класс, ресурсы сети Интернет Вариант 1. 1.Дать характеристику элементу №6 по плану. 2.Назвать элемент по таким данным: находится в VI группе,относительная молекулярная масса водородного соединения 34. а) Сульфур, б) Хром, в) Селен. 3.При взаимодействии 6,85 г. металла с водой выделяется 1,12 л водорода ( н.у. ). Определить этот металл, зная что в соединениях он двухвалентен. a) Ba,б) Ca, в)Sr. Вариант 2. 1.Дать характеристику элементу №3 по плану . 2. Назвать элемент по таким данным - молекулярная масса гидроксида 102 а) Натрий, б) Купрум, в) Рубидий. 3.При взаимодействии 32 г двухвалентного металла с кислородом образуется 44,8 г оксида. Определить этот металл. а)Mg, б)Ca, в)Ba. Вариант 1. 1.Дать характеристику элементу №6 по плану. 2.Назвать элемент по таким данным: находится в VI группе,относительная молекулярная масса водородного соединения 34. а) Сульфур, б) Хром, в) Селен. 3.При взаимодействии 6,85 г. металла с водой выделяется 1,12 л водорода ( н.у. ). Определить этот металл, зная что в соединениях он двухвалентен. a) Ba,б) Ca, в)Sr. Вариант 2. 1.Дать характеристику элементу №3 по плану . 2. Назвать элемент по таким данным - молекулярная масса гидроксида 102 а) Натрий, б) Купрум, в) Рубидий. 3.При взаимодействии 32 г двухвалентного металла с кислородом образуется 44,8 г оксида. Определить этот металл. а)Mg, б)Ca, в)Ba.






