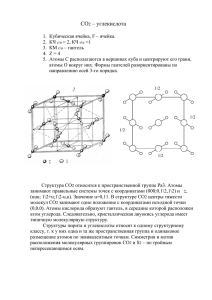
Девиз урока: подгруппы;
advertisement

Девиз урока: Удивим мы весь народ, изучая углерод! Тема: Кислородные соединения углерода. Тип урока: изучение нового материала. Цель урока: Систематизировать и расширить знания учащихся об оксидах и их свойствах. - продолжить знакомить учащихся с элементами IV группы главной подгруппы; - изучить состав, строение, свойства и применение углерода (II и IV); - формировать умение сравнивать состав и строение оксидов углерода, указать причины их сходства и отличия; - уметь доказывать химические свойства оксидов (II и IV), записывать уравнения в молекулярном и ионном виде; - продолжить формирование логического мышления, умения проводить сравнения, анализ, обобщение, давать теоретическое обоснование; - развивать навыки самообразовательной работы: умение работать с таблицами, учебником, составлять схемы сравнения; - продолжить экологическое образование, воспитание учащихся; - способствовать повышению интереса к предмету. Оборудование: Прибор для собирания газов СаСО3, НСl, Са(ОН)2; растворы Nа2СО3, NaCl, Na2SO4, NаОН; химические стаканы, стекло, пипетка, пробирки, набор горных пород и минералов; презентации. Виды деятельности: работа с текстом учебника и дополнительной литературой, наблюдение демонстрируемых опытов, работа в группах, индивидуальная работа, химический диктант, сообщения учащихся, заполнение карты урока, сравнение строения и свойств веществ. Словарь: - Аллотропия Адсорбция Фуллерен Парниковый эффек I. Организационный момент. II. Актуализация знаний. Опрос домашнего задания. ( 1 учащийся готовится к ответу у доски по домашнему упражнению) 1. Разминка: работа по карточкам. 1.1. В чем сходство и различие в составе веществ НСl Н2СО3 Определите степень окисления углерода. Как распознать СI-ион (написать уравнение у доски). 1.2. Дать название веществам: СаСО3 ,СО2, Са(ОН)2 1.3. Что такое оксиды, какие они бывают? 2. Химический диктант: 1) Химический элемент IV группы главной подгруппы, у которого наиболее выражены неметаллические свойства (окислительные). (С) 2) Химический элемент, у которого три энергетических уровны (три слоя), на внешнем 4 электрона (Si) 3) Химический элемент IV группы главной подгруппы, у которого наибольший радиус атома (металл) (Рb) 4) Оксид углерода (II) 5) Явление, при котором один элемент образует несколько простых веществ (Аллотропия) /проверка/ 4. Работа у доски: а)первому учащемуся задача; б) дать характеристику С, Si. 5. Работа по карточке. (индивидуальная работа) 6. Фронтальная беседа по вопросам: 1. перечислить элемента IV группы главной подгруппы (А) 2. как меняются свойства в группе сверху вниз а) радиус атома; б) металлические свойства; в) окислительные свойства. 3. Что общего в строении элементов IV группы главной подгруппы? 4. Выбрать степени окисления углерода: А) -3; +4;0+2 Б) -4; 0+2+4 В) -1; 0+2+4 5. Что такое аллотропия (пример)? 6. Чем алмаз отличается от графита, в чем сходство? Как доказать, что они состоят из одного элемента? 7. Что такое адсорбция (где применятся)? 8. Закончить уравнение химических реакций: а) С+Н2= б) С+О2(изб)= в) С+О2(нед)= г) СuО+С= д) СаСО3+НСl= Итог: III. Основная часть. Изучение нового материала. Прочитайте на доске девиз урока. Тема нашего урока? Цель урока? 1. Используя учебник, блок-схему заполнить таблицу: СО СО2 I. Номенклатура 1. 1. 2. 2. II. Строение молекул С О С О С III. Физические свойства Цвет: Цвет: Вкус: Вкус: Запах: Запах: М(СО)= IV. М(СО2)= Д (возд)= М(СО) М(возд) V. Д (возд)= М(СО2) М(возд) Вывод: легче воздуха? или тяжелее Вывод: легче воздуха? VI. Растворимость в воде или тяжелее VII. Яд? Сообщения: 1. О блокировке гемоглобина. 2. Долина смерти. 2. Получение (виртуальная лаборатория) СаСО3+2НСl=СаСl2+СО2^+Н2О СаСО3+2Н+= СО2+Н2О+СО2+ (демонстрация опыта) Л/о «Получение СО2» Мел + НСl 3. Химические свойства: (работа 2 групп) Первая группа (СО -химические свойства._ Вторая группа (СО2 –химические свойства) СО Несолеобразующ. 1) горит 2) 2СО+О2=2СО2 СО2 Кислотный оксид 1) не горит с основными оксидами: СаО + СО2 = СаСО3 с щелочами СаО + Са (ОН)2=СаСО3+Н2О (качеств. реакция) 4. Экология. «Парниковый эффект» (сообщение учащегося) IV. Закрепление. В чем сходство и отличие СО и СО2? 1. Сходство: 1)качественный состав, оксиды углерода; 2) газы без цвета, вкуса и запаха; 3) связь ковалентная полярная. Различие: в строении, составе количественном, физические свойства, химические свойства, вредность, применение. Тестирование. V. Подведение итога урока, оценки VI.Домашнее задание: § , упр. 1,4 Таблица: СО СО2 I. Номенклатура 1. 1. 2. 2. II. Строение молекул С О С О С III. Физические свойства Цвет: Цвет: Вкус: Вкус: Запах: Запах: М(СО)= IV. М(СО2)= Д (возд)= М(СО) М(возд) V. Д (возд)= М(СО2) М(возд) Вывод: легче воздуха? или тяжелее Вывод: легче воздуха? VI. Растворимость в воде или тяжелее VII. Яд?