Составьте тестовые задания по вопросам содержательного блока «Вещество». Количество вопросов - тесты на тему «Экспериментальные основы химии» и т.д. Задание.
реклама
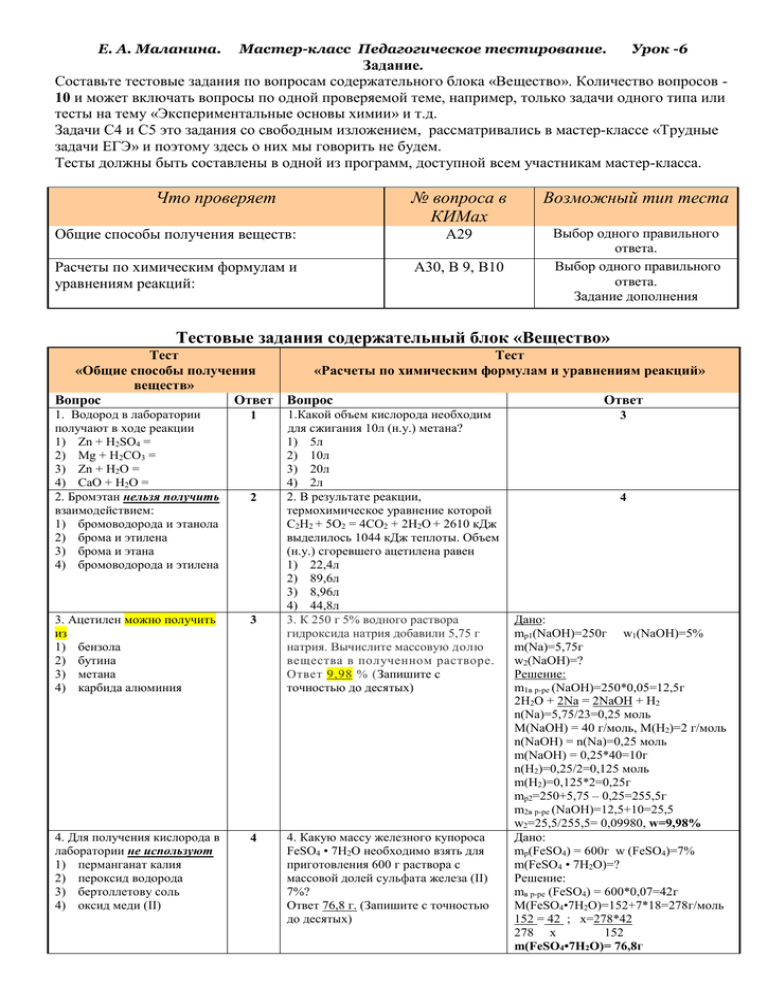
Е. А. Маланина. Мастер-класс Педагогическое тестирование. Урок -6 Задание. Составьте тестовые задания по вопросам содержательного блока «Вещество». Количество вопросов 10 и может включать вопросы по одной проверяемой теме, например, только задачи одного типа или тесты на тему «Экспериментальные основы химии» и т.д. Задачи С4 и С5 это задания со свободным изложением, рассматривались в мастер-классе «Трудные задачи ЕГЭ» и поэтому здесь о них мы говорить не будем. Тесты должны быть составлены в одной из программ, доступной всем участникам мастер-класса. Что проверяет № вопроса в КИМах Возможный тип теста Общие способы получения веществ: А29 Расчеты по химическим формулам и уравнениям реакций: А30, В 9, В10 Выбор одного правильного ответа. Выбор одного правильного ответа. Задание дополнения Тестовые задания содержательный блок «Вещество» Тест Тест «Общие способы получения «Расчеты по химическим формулам и уравнениям реакций» веществ» Вопрос Ответ Вопрос Ответ 1. Водород в лаборатории получают в ходе реакции 1) Zn + H2SO4 = 2) Mg + H2CO3 = 3) Zn + H2O = 4) CaO + H2O = 2. Бромэтан нельзя получить взаимодействием: 1) бромоводорода и этанола 2) брома и этилена 3) брома и этана 4) бромоводорода и этилена 1 3. Ацетилен можно получить из 1) бензола 2) бутина 3) метана 4) карбида алюминия 3 4. Для получения кислорода в лаборатории не используют 1) перманганат калия 2) пероксид водорода 3) бертоллетову соль 4) оксид меди (II) 4 2 1.Какой объем кислорода необходим для сжигания 10л (н.у.) метана? 1) 5л 2) 10л 3) 20л 4) 2л 2. В результате реакции, термохимическое уравнение которой C2H2 + 5O2 = 4CO2 + 2H2O + 2610 кДж выделилось 1044 кДж теплоты. Объем (н.у.) сгоревшего ацетилена равен 1) 22,4л 2) 89,6л 3) 8,96л 4) 44,8л 3. К 250 г 5% водного раствора гидроксида натрия добавили 5,75 г натрия. Вычислите массовую долю вещества в полученном растворе. Ответ 9,98 % (Запишите с точностью до десятых) 4. Какую массу железного купороса FeSO4 • 7Н2О необходимо взять для приготовления 600 г раствора с массовой долей сульфата железа (II) 7%? Ответ 76,8 г. (Запишите с точностью до десятых) 3 4 Дано: mp1(NaOH)=250г w1(NaOH)=5% m(Na)=5,75г w2(NaOH)=? Решение: m1в р-ре (NaOH)=250*0,05=12,5г 2H2O + 2Na = 2NaOH + H2 n(Na)=5,75/23=0,25 моль M(NaOH) = 40 г/моль, M(H2)=2 г/моль n(NaOH) = n(Na)=0,25 моль m(NaOH) = 0,25*40=10г n(H2)=0,25/2=0,125 моль m(H2)=0,125*2=0,25г mp2=250+5,75 – 0,25=255,5г m2в р-ре (NaOH)=12,5+10=25,5 w2=25,5/255,5= 0,09980, w=9,98% Дано: mp(FeSO4) = 600г w (FeSO4)=7% m(FeSO4 • 7Н2О)=? Решение: mв р-ре (FeSO4) = 600*0,07=42г M(FeSO4•7Н2О)=152+7*18=278г/моль 152 = 42 ; х=278*42 278 х 152 m(FeSO4•7Н2О)= 76,8г Е. А. Маланина. 5. При какой реакции можно получить многоатомный спирт 1) гидратация этилена 2) реакция Кучерова 3) гидролиз 1,2 дихлорэтана 4) окисление этаналя Мастер-класс Педагогическое тестирование. 3 5. Объем газа (н. у.), который выделиться при реакции металлического натрия массой 9,2 г с избытком фенола ___ 4,5 л. (Запишите с точностью до десятых) Урок -6 Дано: m(Na)=9,2г, Vm=22,4л/моль Решение: 2C6H5OH + 2Na = 2C6H5ONa + H2 n(Na)=9,2/23=0,4 моль n(H2)=0,4/2=0,2 моль V(H2)=0,2*22,4=4,48л V(H2)=4,5л





