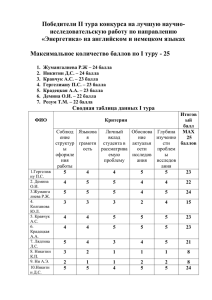
Задания и решения школьной олимпиады 2012 года
реклама

Задания для проведения школьного тура олимпиады по химии в 8 классе 2012 – 2013 учебный год разрабатывается учителями самостоятельно Задания для проведения школьного тура олимпиады по химии в 9 классе 2012 – 2013 учебный год . Инструкция по выполнению работы. На выполнение работы по химии даётся 1,5 часа ( 90 минут). Работа состоит из трёх частей и включает 18 заданий. Часть А включает 10 заданий (А1 – А10) одно задание может содержать несколько правильных ответов, вторая часть состоит из 5 заданий (В1 – В5) – сопоставить и дать правильный ответ. Часть С состоит из трёх заданий. Предполагает свободный ответ. Желаем успеха! Тесты. Задания уровня А. А 1. Укажите, какую из взаимосвязей отражает Периодический закон Д.И. Менделеева. А) между массами веществ, вступивших в реакцию, и массами веществ, образующихся в результате реакции, Б) между свойствами химических элементов и величиной заряда ядра атома, В) между составом вещества и независимостью его от способа и места получения. А 2. Выберите символы и названия химических элементов одного малого периода: А) углерод, Б) Si, В) хлор, Г) Сu , Д) сера, Е) Са А3. Электронная схема строения атома химического элемента: +Х )2 )8 )8 )2 Выберите электронную формулу наиболее сходного по свойствам химического элемента: А) 1s22s22p2 Б) 1s22s22p63s2 В) 1s22s22p63s1 Г ) 1s22s1 А 4. Второй энергетический уровень завершён в атомах: А) гелия Б) кальция В) бериллия Г) неона Д) фтора Е) алюминия А 5. В каких парах химических элементов число нейтронов в ядре атома у одного из них вдвое больше чем у другого: 108 56 А) Б) 2010 Ne и 94 Be В) 126 С и 1327 Аl 47 Аg и 26 Fe Г) 20 10 Nе и 2040 Са Д) 39 19 К и 40 20 Са А 6. Выберите электронную формулу иона кальция: А) 1s22s22р63s2 3р6 Б) 1s22s22р63s2 3р6 4s2 В) 1s22s22р6 Г) 1s22s22р63s2 3р6 4s1 А 7. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса: А) Li Na К Rb Б) Sr Ca Mg Be В) In Ga Al B Г) Sn Ge Si C А 8. Дана электронная формула внешнего энергетического уровня химического элемента: …3s23р2, выберите название химического элемента, которому она соответствует: А) кремний Б) магний В) алюминий Г) углерод А 9. Из списка условий протекания и признаков химической реакции выберите признаки: А) соприкосновение веществ, Б) образование нерастворимого вещества (осадка) В) облучение светом, Г) нагревание, Д) выделение газа Е) изменение цвета А 10. Укажите, где речь идёт о физических явлениях: А) твёрдый углекислый газ – « сухой лёд» превращается в газ, минуя жидкую фазу, Б) углекислый газ собирается на дне стакана и постепенно вытесняет находившийся там воздух, В) углекислый газ и вода в процессе фотосинтеза образуют крахмал Г) углекислый газ вызывает помутнение известковой воды Задания уровня В. В 1.Соотнесите: Обозначение атомных частиц 1) 3919 К и 4020 Са 2) 35 17 Сl и 37 Различия их строения а) разное число нейтронов 3) 22 11 Na и 12 4) 7 Li и 7 3 Сl 17 24 3 Мg2+ Li+ В 2. Соотнесите: Место химического элемента в периодической системе Д.И. Менделеева 1) 2 период, 6 группа, 2) 3 период, 2 группа 3) 4 период, 2 группа, побочная подгруппа 4) 4 период, 2 группа главная подгруппа В 3. Соотнесите: Атомы химического элемента 1) сера 2) кислород 3) кремний В 4. Соотнесите: Номер периода или группы 1) 4 период содержит 5 электронов, 2) 5 группа главная подгруппа 3) 3 группа главная подгруппа б) разное число протонов в) разное число электронов г) разное число протонов и нейтронов химический знак а) О в) К д) Zn ж) Сa б) Мn г) Мg е) Сl состав атомной частицы а) 8р 8n 8е б) 14р 16n 14е в) 16р16n16е г) 8р 9n 8е д) 16р 20n16е е) 16р 16n 18е ж) 8р 10n 8е общие признаки строения атомов данной совокупности химических элементов а) внешний энергетический уровень . б) электроны в атоме распре делены по четырём энергетическим уровням, в) внешний энергетический уровень содержит 4 электрона, г) электроны в атоме распределены по пяти энергетическим уровням д) внешний энергетический уровень содержит 3 электрона е) электроны в атоме распределены по трем энергетическим уровням В 5. Распределите в порядке возрастания металлических свойств, следующие химические элементы: 1- калий а) 1, 2, 3, 4 2 - натрий 3 - литий 4 - рубидий б) 3,2,1,4 в) 4, 3, 2, 1, г)2,3,1, 4 Задания со свободным ответом. Выберите правильный ответ: Уровень С. С 1. Опишите два пути завершения внешнего энергетического уровня :А) характерный для атомов химических элементов неметаллов и Б) металлов. Покажите это на конкретном примере. С 2. На столе расположены: пробирки, спиртовка, держатель для пробирок, спички, склянка с раствором соли. Вам надо налить раствор вещества в пробирку и нагреть. Опишите ваши действия, соблюдая правила техники безопасности и правила обращения с реактивами и оборудованием. С3. В смеси находятся: железные опилки, оксид меди, кристаллы поваренной соли, порошок серы. Предложите способы разделения этих смесей. На каких свойствах веществ основаны выбранные вами способы. Ответы. А-1 б А-3 бвд А-4 б г А-5 б г А-6 А-7 А-8 А-9 А-10 а а а б, д, е аб В-2 В-3 В-4 В-5 В -1 1-б 2-а 3-г 4-в А-2 1-а 2-г 3-д 4-ж 1-в 2-а 3-б 1-б 2-а 3-д 3214 (б) Задания для проведения школьного тура олимпиады по химии в 10 классе 2012 – 2013 учебный год 1. В стратосфере на высоте 20 – 30 км находится слой озона О3, защищающий Землю от мощного ультрафиолетового излучения Солнца. Если бы не « озоновый экран» в атмосфере, то фотоны с большой энергией достигали бы поверхности Земли и уничтожали бы на ней всё живое. Посчитано, что на каждого жителя Москвы в воздушном пространстве над городом приходится по 150 моль озона. Сколько молекул и какая масса озона приходится на каждого жителя Москвы? (4 балла) 2. Как разделить смесь железа, парафина, поваренной соли, речного песка и древесных опилок. (6 баллов) 3. Напишите уравнения химических реакций, при помощи которых можно осуществить превращение, определите вещества Х и У, назовите их и укажите к какому классу соединений они относятся. (10 баллов) Сu --- СuО ---- Х ---- Сu(ОН)2 --- У --- Сu (12 баллов) 4. Допишите УХР, расставьте коэффициенты методом электронного баланса: КМgО4 + КВr + H2SO4 = MgSO4 +Br2 + … +… Определите окислитель и восстановитель. (14 баллов) 5. Сколько граммов лития и воды необходимо взять для приготовления 240 граммов 10% раствора гидроксида лития? (16 баллов) 6. Химический завод в качестве сырья использует природный газ – метан и воду. Какие продукты он может получать? Напишите уравнения реакции, укажите условия их проведения, назовите эти продукты. (4 балла) 7. Какой из элементов третьего периода образует амфотерный гидроксид? Ответ иллюстрируйте уравнениями реакций в молекулярной и ионной форме. ( 8 баллов) Задания для проведения школьного тура олимпиады по химии в 11 классе 2012 – 2013 учебный год Программированное задание 1. Какая электронная формула соответствует химическому элементу меди? А)1s22s22p63s23p64s23d9 Б) 1s22s22p63s23p64s13d10 B) 1s22s22p63s23p64s23d10 Г) 1s22s22p63s23p64s13d8 2. Какая связь из предложенных является наименее прочной? А) ионная Б) ковалентная полярная В) ковалентная неполярная Г) водородная 3. Какая из кислот является наиболее сильной? А)H2SO3 Б) H2S В) H2SO4 4. В каком из соединений максимальная массовая доля углерода? А) СО2 Б) С2Н4Cl2 В) Na2CO3 Г) Са(НСО3)2 5. Для полного хлорирования 1 г какого из углеводородов требуется больший объём хлора? А) метан Б) пропин В) этин Г)этан 6. В каком из хлоридов полярность связи наименьшая? А) CCl4 Б) BeCl2 В) BCl3 Г) NCl3 7. Сколько граммов брома может присоединиться к 2,1 г этилена, взятого при нормальных условиях? А) 5 г Б) 10 г В) 15 г Г) 20 г 8. Какое из веществ является катализатором при проведении реакции Кучерова? А) CuCl2 Б) FeSO4 В) AlCl3 Г) HgSO4 9. Сколько структурных изомеров имеет соединение С5Н10? А) 3 Б) 5 В) 8 Г)6 10. Сколько литров кислорода необходимо для сгорания 10 граммов гептана? А) 11,24 л Б) 24,64 л В) 12,32 л Г) не знаю Задача №1. Водород, полученный при разложении 12, 6 г гидрида кальция водой, пропустили над 40 г нагретого оксида меди (II). Определите массу образовавшегося металла? Задача №2. Вычислите массу осадка, который образуется при прибавлении 280 г 20% - ного раствора гидроксида калия к 160,2 г 25% - ного раствора хлорида алюминия. Задача №3. Подберите коэффициенты в уравнении реакции: FeSO4 + KMnO4 + H2SO4 = Fe2(SO4)3 + MnSO4 + K2SO4 + H2O Ответы к заданиям школьного тура олимпиады по химии 11 класс Программированное задание 1 Б 2 Г 3 В 4 А 5 6 А Б Итого: 10 баллов 7 В 8 Г 9 В 10 Б Задача №1 (4 балла) 1. За составление уравнения реакции взаимодействия гидрида кальция с водой – 1 балл СаН2 +2Н2О = Са(ОН)2 + 2Н2↑ 2. За составление уравнения реакции восстановления оксида меди водородом – 0,5 балла Н2 + СuO = Сu + H2O 3. За нахождение количества вещества гидрида кальция – 0,5 балла n(CaH2)=0,3моль 4. За нахождение вещества, взятого в недостатке – 1 балл В недостатке оксид меди (II), его количество вещества 0,5 моль 5. За определение массы металла – 1 балл m(Cu)=32 г Задача №2 (6 баллов) 1. За составление уравнения реакции взаимодействия хлорида алюминия с гидроксидом калия – 0,5 балла AlCl3 + 3KOH = Al(OH)3↓ + 3KCl 2. За вычисление массы и количества вещества хлорида алюминия и гидроксида калия по 0,5 балла (итого 2 балла) m (KOH)=56г; n(KOH)=1 моль; m (AlCl3)=40,05г; n (AlCl3)=0,3моль 3. За определение вещества, взятого в недостатке – 0,5 балла в недостатке хлорид алюминия 4. За определение количества вещества Al(OH)3 – 0,5 балла 5.За составление уравнения реакции взаимодействия гидроксида алюминия с гидроксидом калия – 0,5 балла Al(OH)3 + КОН =К[Al(OH)4] 6. За определение вещества в недостатке – 0,5 балла, в недостатке гидроксид калия. 7. За вычисление количества вещества растворившегося Al(OH)3 – 0,5 балла Количество вещества прореагировавшего Al(OH)3 = 0,1 моль 8. За вычисление количества вещества нерастворившегося Al(OH)3 – 0,5 балла n (Al(OH)3) = 0,3 – 0,1 =0,2 моль 9. За вычисление массы нерастворившегося гидроксида алюминия – 0,5 балла Масса (Al(OH)3) = 15,6 г Задача №3 (3 балла) 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O