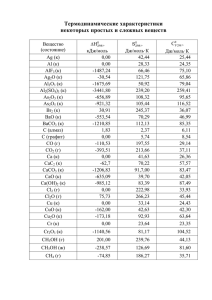
13 а) КН2РО4 + 2КОН = К3РО4 + 2Н2О Вещества реагируют друг
реклама

№ 13 а) КН2РО4 + 2КОН = К3РО4 + 2Н2О Вещества реагируют друг с другом согласно их эквивалентам. 1 моль КН2РО4 взаимодействует с 2 моль КОН. Эквивалент КОН равен 1, следовательно, эквивалент КН2РО4 равен 1/2. Рассчитаем эквивалентную массу КН2РО4: Mr(КН2РО4)=Ar(К)+2Ar(Н)+Ar(Р)+4Ar(О)=39+2*1+31+4*16=136. M(КН2РО4)= 136 г/моль. Мэкв(КН2РО4)=136/2=68 г/моль. б) Bi(OH)2NO3 + KOH = KNO3 + Bi(OH)3 Вещества реагируют друг с другом согласно их эквивалентам. 1 моль KOH взаимодействует с 1 моль Bi(OH)2NO3 . Эквивалент КОН равен 1, следовательно, эквивалент Bi(OH)2NO3 равен 1. В этом случае эквивалентная масса вещества совпадает с молярной массой. Mr(Bi(OH)2NO3)=Ar(Bi)+2Ar(Н)+Ar(N)+5Ar(О)=209+2*1+14+5*16=305. M(Bi(OH)2NO3)= 305 г/моль Мэкв (Bi(OH)2NO3)= 305 г/моль №33 а) N=21 химический элемент Sc 1s22s22p63s23p63d14s2 У скандия 4 свободных d-орбитали, на которых могут разместиться еще 9 электронов. б) N=23 химический элемент V 1s22s22p63s23p63d34s2 2 У ванадия 2 свободных d-орбитали, на которых могут разместиться еще 7 электронов. № 53 Чем ниже степень окисления элемента, тем сильнее выражены основные свойства его оксида и гидроксида. а) Cu+1OH; Cu+2(OH)2 более сильным основанием будет CuOH; б) Fe+2(OH)2; Fe +3(OH)3 более сильным основанием будет Fe(OH)2; в) Sn+2(OH)2; Sn +4(OH)4 более сильным основанием будет Sn(OH)2. Для доказательства амфотерности Sn(OH)2 напишем его реакции с кислотой и щелочью: Sn(OH)2 + 2HCl = SnCl2 + 2H2O Sn(OH)2 + 2KOH = K2 [Sn(OH)4] №73 Ионная связь – это результат электростатического взаимодействия противоположно заряженных ионов, обладающих обособленными друг от друга электронными оболочками. Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и фтором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и фторид-анион. Они образуют соединение за счет электростатического притяжения между ними: 3 Ионная связь возникает только между атомами различных химических элементов. Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот, поэтому почему ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому «молекулой» ионного соединения следует считать весь кристалл. Перечисленные свойства отличают ионную связь от ковалентной. Примерами соединений с ионной связью могут служить: NaCl – хлорид натрия; CaF2 – фторид кальция. Катионы и анионы в случае присоединения или отдачи электронов могут быть превращены в нейтральные атомы. Например: Na+ + ē = Na Cl- - ē = Cl № 93 CH3OH(ж) + 3/2 O2(г) = CO2(г) + 2H2O(ж) Для определения ∆Н реакции необходимо узнать теплоту образования CH3OH(ж). Находим ее из данных задачи CH3OH(ж) = CH3OH(г); ∆Н = +37,4 кДж. Из фазового перехода определим теплоту образования жидкого CH3OH: 4 ∆Н0=∆Н0(CH3OH(г)) – ∆Н0(CH3OH(ж)) ∆Н0(CH3OH(г)) = - 201,17 кДж/моль 37,4=-201,17 -∆Н0(CH3OH(ж)) ∆Н0(CH3OH(ж))= -238,57 кДж/моль Вычислим ∆Н реакции горения метилового спирта, применяя следствие из закона Гесса: ∆Нхр=(∆Н(CО2(г))+2∆Н(H2O(ж)))- ∆Н(CH3OH(ж))=(-393,51+2*285,84)-(-238,57) = -726,62 кДж/моль. Ответ: ∆Н реакции горения метилового спирта составляет 726,62 кДж/моль. № 113 Fe2O3(k) + 3H2(г) = 2Fe(к) + 3 Н2О(г) ∆Н0298=3∆Н0 (Н2О(г)) – ∆Н0 (Fe2O3(k)) = 3(-241,84) – (-822,2) = 96,68 кДж/моль ∆S0298=2∆S0 (Fe(к)) + 3∆S0 (Н2О(г)) – (3∆S0 (H2(г)) + ∆S0 (Fe2O3(k))) =(2*27.1+3*188.7) – (3*130.52+87.5)=141 Дж/моль К = 0,14 кДж/моль К ∆G0298=∆Н0298- T∆S0298=96,68-298*0,14=54,96 кДж/моль. Рассчитаем ∆G при температурах 500 и 2000 К. ∆G0500=96,68-500*0,14=26,68 кДж/моль. ∆G0500>0, при температуре 500 К реакция восстановления Fe2O3 невозможна. ∆G02000=96,68-2000*0,14= -183,32 кДж/моль. ∆G02000<0, при температуре 2000 К реакция восстановления Fe2O3 водородом возможна. 5 Ответ: для ∆Н0298=96,68 кДж/моль; реакции восстановления ∆S0298=0,14 кДж/моль; Fe2O3 водородом ∆G0298=54,96 кДж/моль; ∆G0500=26,68 кДж/моль; ∆G02000=-183,32 кДж/моль. № 133 С(т) +Н2О(г) ↔ CO(г) +Н2(г) Напишем выражение для константы равновесия гетерогенной системы: Для того, чтобы сместить равновесие в сторону обратной реакции (образования водяных паров) необходимо: а) увеличить концентрацию СО и (или) Н2; или уменьшить концентрацию водяных паров; б) увеличить давление в системе. №153 Рассчитаем нормальность раствора NaOH. Mr(NaOH)=Ar(Na)+Ar(O)+Ar(H)=23+16+1=40 M(NaOH)=40 г/моль V(NaOH)=40см3=0,04л 6 Зная, что cн(NaOH)* V(NaOH)= cн(кисл)* V(кисл) рассчитаем объем 0,3н раствора кислоты, необходимого для нейтрализации гидроксида натрия: гидроксида натрия необходимо 26,67 см3 0,3 н раствора кислоты. № 173 Рассчитаем молярную массу этилового спирта: Mr (C2H5OH) = 2Ar(C) + 6 Ar(H) + Ar(O) = 2*12+6*1+16=46 M (C2H5OH) =46 г/моль Концентрация раствора этилового спирта составляет 2%, следовательно, 100 г раствора содержат 2 г этилового спирта и 98 г воды. Согласно законам Рауля: tзам(р-ра) = tзам(H2O) - ∆ tзам = 0ºС – 0,82ºС = – 0,82ºС Ответ: температура кристаллизации 2% раствора этилового спирта составляет – 0,82ºС. 7 № 193 а) 2Na3PO4 + 3CaCl2 = Ca3(PO4)2↓+6NaCl 6Na+ + 2PO42- +3Ca2+ + 6Cl- = Ca3(PO4)2↓+6Na+ + 6Cl2PO42- +3Ca2+ = Ca3(PO4)2↓ б) K2CO3 + BaCl2 = BaCO3↓ + 2KCl 2K+ + CO32- + Ba2+ + 2Cl- = BaCO3↓ + 2K+ + 2ClCO32- + Ba2+ = BaCO3↓ в) Zn(OH)2↓ + 2KOH = K2ZnO2+2H2O Zn(OH)2↓ +2K+ +2OH- = 2K+ + ZnO22- + 2H2O Zn(OH)2↓ +2OH- = ZnO22- + 2H2O № 213 Чем меньше константа диссоциации кислоты Ккисл, тем в большей степени протекает гидролиз. Для Н2CO3 К1=4,5*10-7; К2=4,7*10-11. Для Н2SO3 К1=1,6*10-2; К2=6,3*10-8. Следовательно, в большей степени подвергается гидролизу соль Na2CO3. Гидролиз Na2CO3: I ступень: Na2CO3 + H2O → NaHCO3 + NaОН CO32- + H2O → HCO3- + ОНII ступень: NaHCO3 + H2O → H2CO3 + NaОН HCO3- + H2O → H2CO3 + ОН- 8 Гидролиз Na2SO3: I ступень: Na2SO3 + H2O → NaHSO3 + NaОН SO32- + H2O → HSO3- + ОНII ступень: NaHSO3 + H2O → H2SO3 + NaОН HSO3- + H2O → H2SO3 + ОНЧем слабее основание, тем в большей степени подвергается гидролизу образованная им соль. Гидроксид железа (III) более слабое основание, чем гидроксид железа (II), поэтому соль хлорид железа (III) в большей степени подвергается гидролизу, чем хлорид железа (II). Гидролиз FeCl3 I ступень: FeCl3 + H2O → FeОНCl2+ НCl Fe3+ + H2O → FeОН2+ + H+ II ступень: FeОНCl2+ H2O → Fe(ОН)2Cl+ НCl FeОН2+ + H2O → Fe(ОН)2+ + H+ III ступень: Fe(ОН)2Cl + H2O → Fe(ОН)3↓+ НCl Fe(ОН)2+ + H2O → Fe(ОН)3↓ + H+ Гидролиз FeCl2 I ступень: FeCl2 + H2O → FeОНCl+ НCl 9 Fe2+ + H2O → FeОН+ + H+ II ступень: FeОНCl+ H2O → Fe(ОН)2↓+ НCl FeОН+ + H2O → Fe(ОН)2↓ + H+ 10