Государственное бюджетное образовательное учреждение дополнительного образования детей 350000 г. Краснодар,
реклама
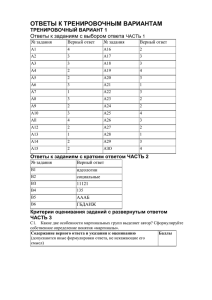
Государственное бюджетное образовательное учреждение дополнительного образования детей «Центр дополнительного образования для детей» 350000 г. Краснодар, ул. Красная,76 тел. 259-84-01 E-mail:[email protected] КРАЕВЫЕ ЗАОЧНЫЕ КУРСЫ «ЮНИОР» Химия 8 класс ответы, решения и критерии оценки заданий к работе № 2, 2011-2012 уч. год Задание № 1 (11 баллов) За каждый правильный ответ по 1 баллу Задание № 2 (10 баллов) Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Электрон – одна из элементарных частиц материи, обладающая массой покоя и элементарным отрицательным зарядом Электронная оболочка – совокупность движущихся вокруг ядра электронов Атомное ядро – центральная, положительно заряженная, сложно организованная часть атома, состоящая из нуклонов, связанных между собой ядерными силами Нуклоны – общее название двух типов частиц, протонов и нейтронов. Массовое число – сумма числа протонов и нейтронов в ядре данного атома. Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом, т.е разным числом нейтронов в ядре. Баллы 1 1 1 1 1 1 1 Химический элемент – вид атомов, с определённым зарядом ядра. Абсолютная масса атома – масса атома, выраженная в кг. Относительная атомная масса – безразмерная величина, равная отношению абсолютной массы данного атома к 1/12 части массы нуклида 12C. 1 1 1 Задание № 3 (11 баллов) Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) φ = Vгаза/Vсмеси 2 H2S + 3 O2 → 2 H2O + 2 SO2 Обозначим через 2х объем сероводорода в исходной смеси и выразим через х объем кислорода, вступившего в реакцию, и объем образовавшегося оксида серы (IV). V1(O2) = 3x V(SO2) = 2x Обозначим через y объем кислорода, не вступившего в реакцию.V2(O2) = у Составим систему уравнений с двумя неизвестными: 2х +3х + у =100 2х +у = 62,5 и решим ее: х =12,5 у =37,5 Вычислим объемы газов в исходной смеси. V3(O2) = 3x + y = 75 мл V(H2S) = 2х = 25 мл Вычислим объемные доли газов в исходной смеси. φ(O2) = 75 мл/ 100 мл = 0,75 φ (H2S) = 1 – 0,75 = 0,25 Баллы 1 2 2 1 3 1 1 Задание № 4 (7 баллов) Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Пусть x и y – атомные номера элементов. Тогда по членным сложением левой и правой частей уравнений x + y = 47 и x − y = 21 получаем 2x = 68 и далее x = 34 и y = 13. Эти элементы – селен и алюминий. При образовании селенида алюминия атом алюминия отдает 3 электрона, а атом селена принимает 2 электрона. Электроположительный элемент записывается первым. Формула соединения Al2Se3. Баллы 1 3 2 1 Задание № 5 (8 баллов) Содержание верного ответа и указания по оцениванию Баллы (допускаются иные формулировки ответа, не искажающие его смысла) Массовая доля серной кислоты в 1 растворе 1 0,3 = m(Н2SО4)/mp-pa (Н2SО4) (1) Массовая доля кислоты во втором растворе 2 0,1 = m (Н2SО4))/m p-pa (Н2SО4) + 300 (2) Выразим из 1 уравнения m (Н2SО4) 1 m (Н2SО4)=0,3 m p-pa (Н2SО4 Обозначим за х –массу 30% раствора серной кислоты 1 тогда m (Н2SО4)=0,3 *х и подставим во второе уравнение 1 0,1 = 0,3*х/х+300 1 Решая уравнение, получаем х=150 г 1 Задание № 6 (5 баллов) Содержание верного ответа и указания по оцениванию Баллы (допускаются иные формулировки ответа, не искажающие его смысла) СаСO3 CaO+ CO2 1 Определяем количество вещества: 1 = V \Vm , (CO2) = 11,2\22,4 = 0,5 моль Из уравнения следует, что (CO2) = (СаСO3) =0,5 моль 1 Находим массу карбоната кальция, используя формулу: = m / M m (CaCO3) =0,5*100= 50 г. 1 Рассчитываем число молекул CO2 по формуле: n = *NA , где NA - постоянная 23 22 Авогадро, n = 0,5 * 6,02 * 10 = 3,02*10 Плотность одного газа относительно другого равна отношению их молярных 1 масс D (H2) = M(CO2) /M (H2) D (H2) = 44/2= 22 Задание № 7 (2 балла) 1Б, 2Д, 3Г, 4Ж; 0,5 балла за правильное соответствие. Задание № 8 (6 баллов) Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) 2NaOH+ H2SO4 Na2SO4+2H2O Находим по формуле количество вещества щелочи (NaOH) = m / М = 16/40 = 0,4 моль Находим количество вещества кислоты, используя коэффициенты в уравнении реакции: (H2SO4) = 0,4/2 = 0,2 моль Находим массу серной кислоты: m (H2SO4 )= * М m (H2SO4 )=0,2*98=19,6 г Выразим массу раствора серной кислоты из формулы: ω = m (H2SO4)/ m (p-pa) , m (p-pa H2SO4 ) = 19,6/0,1 =196 г Используя формулу: m p-pa = V* p, находим объем раствора V p-pa (H2SO4) = 196/1,07 = 183,18 мл Баллы 1 1 1 1 1 1 Задание № 9 (7 баллов) 2б 2Al + O3 = Al2O3 1б 4Al + 3C = Al4C3 1б 3C + 2O3 = 3CO2 1б C + 2H2 = CH4 1б 3H2 + 2O3 = 3H2O 1б Задание № 10 (5 баллов) Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) 2Al + 3S → Al2S3 На основании закона сохранения массы веществ максимальное количество сульфида алюминия должно составить 3 г, что произойдет в случае, если оба вещества прореагируют друг с другом без остатка. В случае избытка алюминия или серы выход сульфида алюминия будет меньше Количество вещества получающегося сульфида алюминия равно 3 г / 150 г/моль = 0.02 моль. По уравнению реакции для синтеза такого количества сульфида алюминия нужно взять 0.04 моль алюминия (или 1.08 г алюминия) и 0.06 моль серы (1.92 г серы). Баллы 1 2 1 1