Тема: «Алкины»
реклама
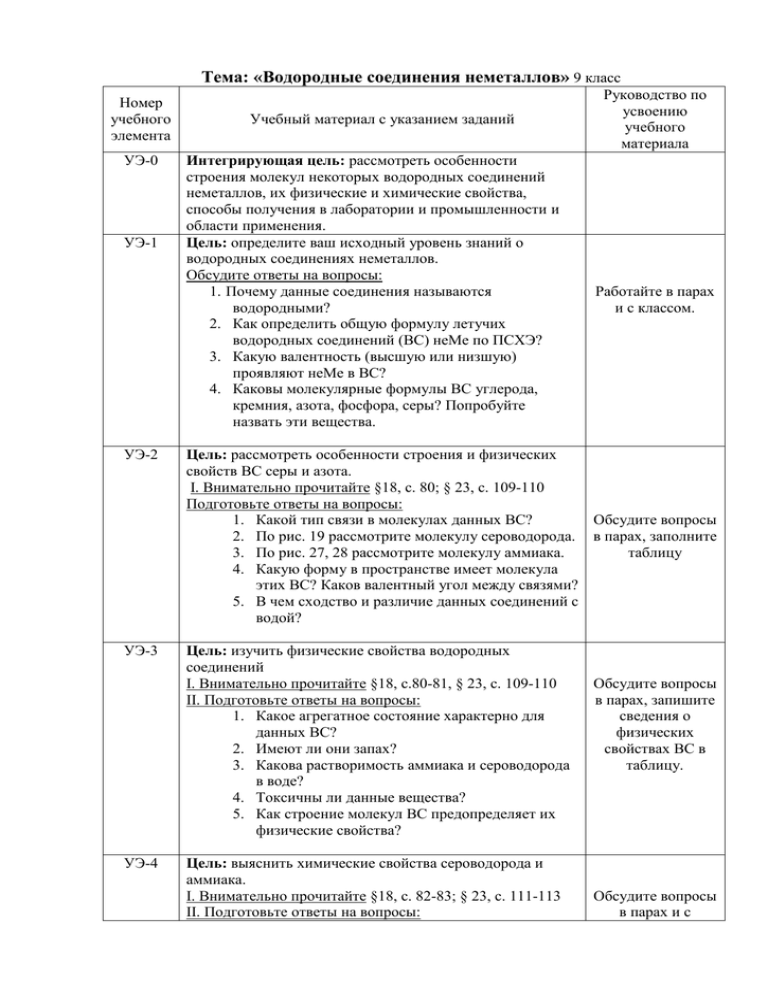
Тема: «Водородные соединения неметаллов» 9 класс Номер учебного элемента УЭ-0 УЭ-1 Учебный материал с указанием заданий Интегрирующая цель: рассмотреть особенности строения молекул некоторых водородных соединений неметаллов, их физические и химические свойства, способы получения в лаборатории и промышленности и области применения. Цель: определите ваш исходный уровень знаний о водородных соединениях неметаллов. Обсудите ответы на вопросы: 1. Почему данные соединения называются водородными? 2. Как определить общую формулу летучих водородных соединений (ВС) неМе по ПСХЭ? 3. Какую валентность (высшую или низшую) проявляют неМе в ВС? 4. Каковы молекулярные формулы ВС углерода, кремния, азота, фосфора, серы? Попробуйте назвать эти вещества. Руководство по усвоению учебного материала Работайте в парах и с классом. УЭ-2 Цель: рассмотреть особенности строения и физических свойств ВС серы и азота. І. Внимательно прочитайте §18, с. 80; § 23, с. 109-110 Подготовьте ответы на вопросы: 1. Какой тип связи в молекулах данных ВС? Обсудите вопросы 2. По рис. 19 рассмотрите молекулу сероводорода. в парах, заполните 3. По рис. 27, 28 рассмотрите молекулу аммиака. таблицу 4. Какую форму в пространстве имеет молекула этих ВС? Каков валентный угол между связями? 5. В чем сходство и различие данных соединений с водой? УЭ-3 Цель: изучить физические свойства водородных соединений І. Внимательно прочитайте §18, с.80-81, § 23, с. 109-110 ІІ. Подготовьте ответы на вопросы: 1. Какое агрегатное состояние характерно для данных ВС? 2. Имеют ли они запах? 3. Какова растворимость аммиака и сероводорода в воде? 4. Токсичны ли данные вещества? 5. Как строение молекул ВС предопределяет их физические свойства? УЭ-4 Цель: выяснить химические свойства сероводорода и аммиака. І. Внимательно прочитайте §18, с. 82-83; § 23, с. 111-113 ІІ. Подготовьте ответы на вопросы: Обсудите вопросы в парах, запишите сведения о физических свойствах ВС в таблицу. Обсудите вопросы в парах и с 1. Можно ли сказать, что сероводород и аммиак – химически активные вещества? 2. Какие свойства, окислительные или восстановительные, проявляют сероводород и аммиак? С чем это связано? (обоснуйте) 3. Как изменяется цвет лакмуса в водных растворах сероводорода и аммиака? 4. Разберите механизм образования иона аммония, пользуясь материалом учебника (стр. 111) и приложения. III. Внимательно посмотрите видеоопыты о свойствах сероводорода и аммиака классом, заполните соответствующие графы в таблице, запишите уравнения в тетрадь, укажите условия их протекания и назовите продукты реакций. ІV. Выполните задания: 1. Напишите уравнения химических реакций: А) характеризующих восстановительные свойства сероводорода и аммиака ( с кислородом (изб/нед/катализатор), для сероводорода – с галогенами); Б) характеризующие общие с кислотами свойства водного раствора сероводорода; качественной реакции на сероводород; В) реакций присоединения к аммиаку кислот: соляной, серной, азотной. УЭ-5 Цель: познакомиться со способами получения сероводорода и аммиака в лаборатории и промышленности; распространением в природе І. Внимательно прочитайте §18, с. 81, 83; § 23, с. 109 II. Внимательно посмотрите видеоопыты о получении сероводорода и аммиака III. Подготовьте ответы на вопросы: 1. Где встречаются сероводород и аммиак в природе? 2. Перечислите способы получения сероводорода и аммиака. 3. Какие из перечисленных реакций наиболее приемлемы в лаборатории, а какие – в промышленности? УЭ-6 Цель: выяснить области применения сероводорода, аммиака и их соединений І. Внимательно прочитайте материал приложения и § 23, с. 114-115 II. Выполните задания: Составьте кластер, отражающий области применения сероводорода, аммиака и их соединений Обсудите вопросы в парах и с классом, заполните соответствующие графы в таблице, запишите необходимые уравнения в тетрадь, укажите условия их протекания и назовите исходные вещества и продукты реакций. Обсудите вопросы в парах и с классом, составьте кластер по теме УЭ-7 Цель: проверьте полученные знания о водородных соединениях серы и азота I Выполните тест: 1. Молекулярная формула аммиака и сероводорода соответственно: А) H2Sи NH4Б)NH4 и H2SO4В)NH3и H2S Г) NH3и SH2 2. Связь в ионе аммония образована А) за счет водородных связей Б) по ионному механизму В) по донорно-акцепторному механизму Г) по ковалентному механизму 3. Качественной реакцией на сероводород является: А) обесцвечивание бромной воды Б) горение В) взаимодействие с солями тяжелых металлов Г) изменение цвета индикатора 4. Выпишите верные утверждения: А) аммиак химически инертен Б) сероводород не токсичен и используется в медицине В) повышенное содержание аммиака в воздухе приводит к поражению глаз и воспалению легких Г) аммиак имеет запах тухлых яиц 5. Продуктами взаимодействия аммиака с кислотами являются: А) азот и водород Б) соли аммония и вода В) водород и соли аммония Г) соли аммония 6. В пространстве молекула аммиака имеет: А) угловое строение Б) пирамидальную форму В) зигзагообразное строение Г) сферическую форму 7. Выпишите правильные суждения: А) жидкий аммиак применяют в холодильных установках Б) сероводородная кислота является слабым электролитом В) в химических реакциях аммиак является окислителем Г) сероводород проявляет свойства восстановителя 8. 10%-ный раствор аммиака в воде называют: А) нашатырь Б) аммоний В) нашатырный спирт Г) щелок (макс. 10 баллов) II. Напишите уравнения реакций, с помощью которых можно осуществить следующее превращения: Работайте индивидуально, произведите взаимоконтроль знаний в парах. N2 - -- NH3 --- (NH4)2SO4 --- NH3 --- NO (5 баллов) III.Решите расчетную задачу (5баллов): Вар-т 1:Какой объем аммиака необходимо пропустить через 200 г 9,8%-ного раствора серной кислоты, чтобы образовалась кислая соль? Вар-т 2: При взаимодействии 37 г гидроксида кальция с сульфатом аммония было получено 15 г аммиака. Вычислите массовую долю выхода аммиака. УЭ-8 Прочитайте еще раз цели урока. Удалось ли вам достичь поставленных целей? В какой степени? Подсчитайте количество набранных баллов за выполненный тест. Поставьте себе оценку за урок, используя критерии оценок. Количество Оценка правильных ответов 20-18 «отлично» 17-14 «хорошо» 13-10 «удовлетворительно» менее 9 плохо усвоили тему Домашнее задание: §18, 23, стр. 84 № 6, стр. 115 № 4, 5



