Занятие № 1 Уважаемые коллеги! Предлагаю Вам
advertisement
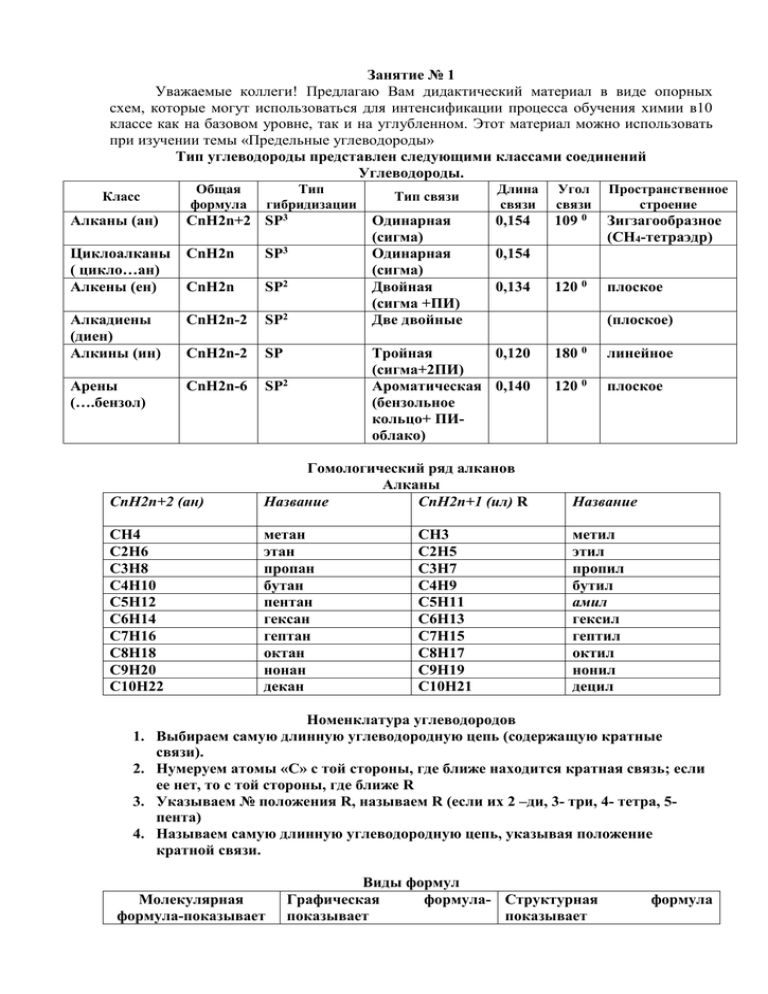
Занятие № 1 Уважаемые коллеги! Предлагаю Вам дидактический материал в виде опорных схем, которые могут использоваться для интенсификации процесса обучения химии в10 классе как на базовом уровне, так и на углубленном. Этот материал можно использовать при изучении темы «Предельные углеводороды» Тип углеводороды представлен следующими классами соединений Углеводороды. Класс Общая формула Тип гибридизации Алканы (ан) CnH2n+2 SP3 Циклоалканы ( цикло…ан) Алкены (ен) CnH2n SP3 CnH2n SP2 Алкадиены (диен) Алкины (ин) CnH2n-2 SP2 CnH2n-2 SP Арены (….бензол) CnH2n-6 SP2 Тип связи Одинарная (сигма) Одинарная (сигма) Двойная (сигма +ПИ) Две двойные Длина связи Угол связи Пространственное строение 0,154 109 0 Зигзагообразное (СН4-тетраэдр) 120 0 плоское 0,154 0,134 Тройная 0,120 (сигма+2ПИ) Ароматическая 0,140 (бензольное кольцо+ ПИоблако) (плоское) 180 0 линейное 120 0 плоское CnH2n+2 (ан) Гомологический ряд алканов Алканы Название CnH2n+1 (ил) R Название СН4 С2Н6 С3Н8 С4Н10 С5Н12 С6Н14 С7Н16 С8Н18 С9Н20 С10Н22 метан этан пропан бутан пентан гексан гептан октан нонан декан метил этил пропил бутил амил гексил гептил октил нонил децил СН3 С2Н5 С3Н7 С4Н9 С5Н11 С6Н13 С7Н15 С8Н17 С9Н19 С10Н21 Номенклатура углеводородов 1. Выбираем самую длинную углеводородную цепь (содержащую кратные связи). 2. Нумеруем атомы «С» с той стороны, где ближе находится кратная связь; если ее нет, то с той стороны, где ближе R 3. Указываем № положения R, называем R (если их 2 –ди, 3- три, 4- тетра, 5пента) 4. Называем самую длинную углеводородную цепь, указывая положение кратной связи. Молекулярная формула-показывает Виды формул Графическая формула- Структурная показывает показывает формула состав молекулы последовательность соединения атомов в молекуле СН4 (молекула состоит Каждый атом водорода из 1 атома углерода и 4 соединен сигма связями с атомов водорода) атомом углерода Н Н С пространственное молекулы строение Молекула тетраэдрическое угол связи Н имеет строение, 109 Н С Н Н Вещества сходные по строению и химическим свойствам, но отличающиеся друг от друга на одну или несколько СН2 групп, называются гомологами. Например: СН3-СН(СН3)-СН3 2метилпропан СН3-СН(СН3)-СН2-СН3 2-метилбутан 0. Н Н Вещества, имеющие одну молекулярную формулу, но разные структурные формулы, называются изомерами. Например: СН3-СН2-СН2-СН3 бутан СН3-СН(СН3)-СН3 2-метилпропан Физические свойства углеводородов Алканы Циклоалканы Алкены Диены Алкины Арены С1-С4 газы, С3-С4 газы, С2-С4 газы, Газы или С2-С4 газы С6Н6 без цвета и С5-С16 С5-С16 легкокипящие С5-С15 жидкость запаха, С5- жидкости, жидкости, жидкости жидкости, С17 остальные остальные остальные жидкости с твердые твердые твердые запахом вещества. вещества вещества бензина, от С18 твердые вещества Все углеводороды не растворимы в воде, хорошо растворяются в неполярных органических растворителях. Углеводороды с неразветвленной углеродной цепью имеют температуры кипения выше, чем углеводороды с разветвленной цепью. С ростом углеводородной цепи и увеличением ее разветвленности реакционная способность углеводородов уменьшается. Химические свойства углеводородов. АЛКАНЫ Химические свойства Способы получения 1.Горение (полное окисление) 1. р Вюрца (удвоение числа СН4+2О2→CО2+2Н2О атомов «С») CnH2n+2 + (1,5n+0,5)O2→nCO2+(n+1)H2O 2CH3Cl+2Na→C2H6+2NaCl 2. Характерны реакции замещения (радикальный 2.*а) Декорбаксилирование сплавление солей карбоновых механизм): (свет) А) галогенирование СН4+Cl2 → CH3Cl+HCl кислот с щелочами (уменьшение *у гомологов по правилу Зайцева СH3-СН2-СН3+ Br2→CH3-CHBr-CH3+HBr Б) нитрование СH4+НО-NO2→ CH3NO2+H2O *у гомологов по правилу Зайцева СH3-СН2-СН3+НО-NO2→ CH3-CHNO2-CH3+H2O 3 Термическое разложение: А) полное СН4→С+2Н2 Б) неполное (дегидрирование) С2Н6→С2Н4+Н2 2СН4→С2Н2+3Н2 4 Изомеризация (получение изомерных веществ при нагревании алканов в присутствии катализатора AlCl3) CH3-CH2-CH2-CH3→СH3-CH-CH3 CH3 числа атомов «С») (р.Дюма) СH3COONa+NaOH→CH4+Na2CO3 б) Электролиз солей карбоновых кислот (р.Кольбе) 2СH3COONa+2Н2О→ С2Н6+2СО2+Н2+NaOH 3.Гидрирование циклоалканов и непредельных углеводородов: СН2=СН2 +Н2→СН3-СН3 4. Восстановление СО или СО2 СО+3Н2→СН4+Н2О nCO+(2n+1) H2→ CnH2n+2+ nH2O 5.Спец способ получения метана-гидролиз карбида алюминия: Al4C3+12HCl→3CH4+4Al(OH)3 ЦИКЛОАЛКАНЫ Химические свойства 1.Горение (полное окисление) С4Н8+6О2→4CО2+4Н2О CnH2n + 1,5n+O2→nCO2+nH2O 2. Характерны реакции замещения (радикальный механизм): (свет) А) галогенирование СН2-СН2 СН2-СН2 СН2 +Br2→ CHBr +HBr СН2 СН2 СН2 СН2 Б) нитрование СН2-СН2 CH2-CH2 CH2 +HO-NO2→ CHNO2 +H2O CH2-CH2 CH2-CH2 3 Свойства отличные от алкановприсоединения: А) гидрирование С4Н8+Н2→С4Н10 Б)*С3Н6 и С4Н8 могут вступать в присоединения С3Н6 + Br2 (вода)→CH2Br-CH2-CH2Br С3Н6 + HBr→ CH3-CH2-CH2Br Способы получения 1.* гидрирование аренов С6Н6+3Н2→С6Н12 2. Из дигалогеналканов: СlCH2-CH2-CH2-CH2Cl+Mg→ CH2-CH2 + MgCl2 CH2-CH2 реакции реакции Обратите внимание, что * выделен материал для тех, кто изучает предмет на углубленном уровне. Для подбора дидактического материала для проверки знаний и умений учащихся предлагаю Вам воспользоваться контролирующими тестовыми заданиями предложенными учащимся во втором занятии (см папку для ученика)