Модульный урок Свойства серной кислоты
advertisement
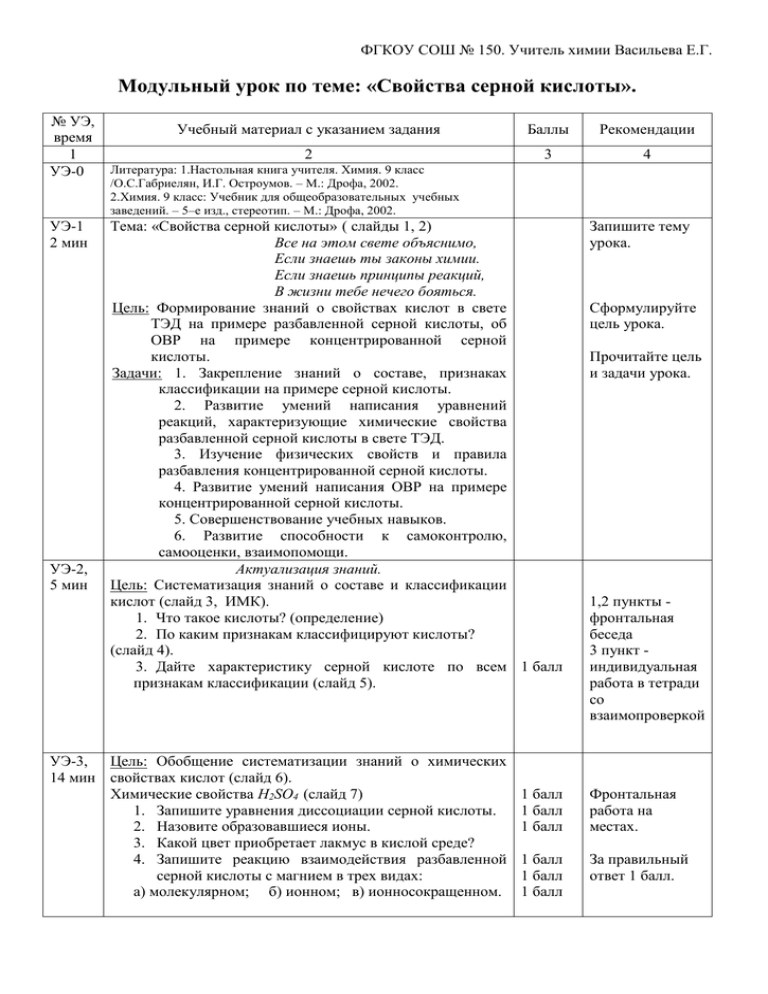
ФГКОУ СОШ № 150. Учитель химии Васильева Е.Г. Модульный урок по теме: «Свойства серной кислоты». № УЭ, время 1 УЭ-0 УЭ-1 2 мин УЭ-2, 5 мин Учебный материал с указанием задания Баллы Рекомендации 2 3 4 Литература: 1.Настольная книга учителя. Химия. 9 класс /О.С.Габриелян, И.Г. Остроумов. – М.: Дрофа, 2002. 2.Химия. 9 класс: Учебник для общеобразовательных учебных заведений. – 5–е изд., стереотип. – М.: Дрофа, 2002. Тема: «Свойства серной кислоты» ( слайды 1, 2) Все на этом свете объяснимо, Если знаешь ты законы химии. Если знаешь принципы реакций, В жизни тебе нечего бояться. Цель: Формирование знаний о свойствах кислот в свете ТЭД на примере разбавленной серной кислоты, об ОВР на примере концентрированной серной кислоты. Задачи: 1. Закрепление знаний о составе, признаках классификации на примере серной кислоты. 2. Развитие умений написания уравнений реакций, характеризующие химические свойства разбавленной серной кислоты в свете ТЭД. 3. Изучение физических свойств и правила разбавления концентрированной серной кислоты. 4. Развитие умений написания ОВР на примере концентрированной серной кислоты. 5. Совершенствование учебных навыков. 6. Развитие способности к самоконтролю, самооценки, взаимопомощи. Актуализация знаний. Цель: Систематизация знаний о составе и классификации кислот (слайд 3, ИМК). 1. Что такое кислоты? (определение) 2. По каким признакам классифицируют кислоты? (слайд 4). 3. Дайте характеристику серной кислоте по всем 1 балл признакам классификации (слайд 5). УЭ-3, Цель: Обобщение систематизации знаний о химических 14 мин свойствах кислот (слайд 6). Химические свойства H2SO4 (слайд 7) 1. Запишите уравнения диссоциации серной кислоты. 2. Назовите образовавшиеся ионы. 3. Какой цвет приобретает лакмус в кислой среде? 4. Запишите реакцию взаимодействия разбавленной серной кислоты с магнием в трех видах: а) молекулярном; б) ионном; в) ионносокращенном. Запишите тему урока. Сформулируйте цель урока. Прочитайте цель и задачи урока. 1,2 пункты фронтальная беседа 3 пункт индивидуальная работа в тетради со взаимопроверкой 1 балл 1 балл 1 балл Фронтальная работа на местах. 1 балл 1 балл 1 балл За правильный ответ 1 балл. ФГКОУ СОШ № 150. Учитель химии Васильева Е.Г. 1 2 5. С какими металлами серная кислота не будет взаимодействовать? 6. Запишите реакцию раствора серной кислоты с гидроксидом натрия в трех видах: а) молекулярном; б) ионном; в) ионносокращенном. 7. Запишите реакцию раствора серной кислоты с карбонатом кальция в трех видах: а) молекулярном; б) ионном; 8. Назовите и запишите признак предыдущей реакции (слайд 8) 9. Запишите реакцию раствора серной кислоты с оксидом натрия в трех видах: а) молекулярном; б) ионном; в) ионносокращенном. 10. Назовите и запишите признак предыдущей реакции. 11. Какой из реактивов можно использовать для обнаружения серной кислоты и ее соли – сульфата натрия: хлорид натрия или хлорид бария? Составьте уравнения реакций в трех видах: а) молекулярном; б) ионном; в) ионносокращенном. Изучение нового материала. УЭ-4, Цель: Изучение физических свойств серной кислоты и 6 мин правила разбавления концентрированной серной кислоты. 1. Запишите физические свойства серной кислоты в тетрадь. 2. Подумайте и запишите свой ответ на следующий вопрос: почему нельзя приливать воду к кислоте (слайд 9)? Проверьте задание друг у друга. Проставьте баллы. УЭ-5, Цель: Изучение химических свойств концентрированной 15 мин серной кислоты. 1. Как отличается по свойствам концентрированная от разбавленной серной кислоты (слайд 10)? 3 1 балл 2. Запишите уравнения ОВР между концентрированной серной кислотой и медью. 3. Расставьте коэффициенты методом электронного баланса (слайд 11, 12). 4. Запишите уравнения ОВР между концентрированной серной кислотой и цинком. 5. Расставьте коэффициенты методом электронного баланса (слайд 13). Проверьте выполнение заданий, проставьте баллы. 1 балл 4 Ответы запишите в тетрадь. 1 балл 1 балл 1 балл 1 балл 1 балл 1 балл 1 балл 1 балл 1 балл 1 балл 2 балла 2 балла 2 балла 1 балл Прочитайте учебник на стр. 101 2 балла 1 балл Прочитайте учебник на стр. 102, запишите ответ в тетрадь. Учебник стр.102. 2 балла 1 балл 2 балла Учебник стр.102. ФГКОУ СОШ № 150. Учитель химии Васильева Е.Г. 1 УЭ-6, 3 мин 2 Цель: Подведение итогов. 1. Запишите ДЗ (слайд 14).: стр. 101-104; №7, 8 стр.107. 2. Прочитайте еще раз цель и задачи урока. 3. Достигли ли вы поставленных перед собой целей и задач? 4. Оцените себя (слайд 12): «5» - 34-32 балла; «4» - 31-27 баллов; «3» - 26-22 балла. Менее 22 баллов – «неудовлетворительно». Проставьте полученную отметку в тетрадь и сдайте тетрадь учителю. Спасибо за работу! (слайд 13) 3 4

