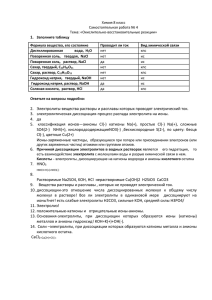
1. Использование ИКТ на уроках химии.Электролитическая
реклама

Использование ИКТ на уроках химии. Учитель: Кузьмина Светлана Ниловна, учитель химии высшей квалификационной категории МОУ «Гимназия №1» г. Чебоксары. Использование информационных технологий позволяет решить множество проблем. Всем учителям химии знакомы сложности, связанные с постановкой и проведением отдельных опытов, сопровождающихся выделением вредных веществ. Или опыты попросту небезопасные. В этих случаях целесообразна демонстрация виртуальных опытов. Другая проблема, связана с необходимостью объяснения механизмов протекания тех или иных процессов. На словах – нет наглядности, а показать невозможно. И снова на помощь может прийти демонстрация видеофрагментов. В настоящее время имеется значительное количество электронных учебников, существуют сайты, пользуясь которыми, учителя могут обогатить свои уроки наглядностью и интересным материалом. Помимо этого учителя широко используют на уроках собственные и ученические мультимедиапрезентации. Всё это, в конечном итоге, направлено на активизацию познавательной деятельности учащихся. На своих уроках в различных классах я использую и электронные учебные пособия, и презентации, и самостоятельную работу учащихся по поиску материала как в сети Интернет, так и работу с электронными учебниками. Порой оказывается целесообразным объединить несколько форм работы и видов деятельности в рамках одного урока. Одним из таких примеров является урок по теме «Электролитическая диссоциация» в 9 классе. Для урока химии по теме «Электролитическая диссоциация» заранее необходимо подготовить презентацию в Power Point, которая будет сопровождать весь урок. В этой презентации будет и тема урока, и вопросы учащимся перед определёнными этапами работы, и необходимые таблицы, а также видеофрагменты отдельных демонстрационных опытов по механизму электролитической диссоциации. Время, затраченное на подготовку данной презентации, окупится с лихвой. Поскольку позволит, и разнообразить урок, и не объяснять «на пальцах» механизм процесса, и сэкономит время. Т.к.1) весь необходимый к уроку материал можно скомпоновать так, как учителю необходимо, 2) к нужным видеофрагментам переходить по гиперссылке, а не искать необходимые диски на столе или материал в компьютере. Тема «Электролитическая диссоциация» Цели и задачи урока: - рассмотреть поведение веществ с разным типом связи в водных растворах, дать понятие о веществах электролитах и неэлектролитах; - развитие представлений учащихся о влиянии строения вещества на его свойства; - совершенствование навыков самостоятельной работы учащихся по приобретению знаний Используемые реактивы и оборудование: прибор для определения электропроводимости веществ, поваренная соль, вода дистиллированная, растворы гидроксида натрия и соляной кислоты. Используемые электронные учебные пособия: «Химия, 8,9», изд-во «Просвещение» «Уроки химии Кирилла и Мефодия, 8-9 классы», изд-во «Виртуальная школа Кирилла и Мефодия.» Оборудование кабинета: компьютерный класс, мультимедиапроектор. Ход урока. 1. Организационный момент. Учащимся объясняются цели и задачи урока. 2. Повторяем, какие бывают типы кристаллических решёток и типы химической связи. Затем ученики заполняют таблицу, которая демонстрируется на экране Вещество Вода NaCl NaOH HCl Тип кристаллической решётки Тип химической связи 3. Проверяем правильность заполнения 2 и 3 столбиков таблицы. Вспоминаем, пользуясь знаниями физики, что такое электрический ток и чем обуславливается электропроводность. На следующем слайде выводим ту же таблицу, но с дополнительным 4-ым столбиком. Учащимся предлагается подумать и высказать свои предположения насчёт электропроводности веществ и растворов веществ, т.е. заполнить 4-ый столбик таблицы. Вода Тип кристаллической решётки молекулярная Тип химической связи ковалентная полярная NaCl ионная ионная NaOH ионная HCl молекулярная Вещество ионная (Na-OH) и ков. полярная (-О-Н) ковалентная полярная Проводит ли электрический ток NaCl (кристаллич.) NaCl (раствор) NaOH (раствор) HCl (раствор) 4. Выслушиваем предположения и проверяем на практике правильность этих предположений. Учитель демонстрирует опыт по электропроводности веществ и растворов. Проверяем электропроводность дистиллированной воды, кристаллов поваренной соли, раствора поваренной соли, растворов гидроксида натрия и раствора соляной кислоты. Заполняем таблицу. Вода Тип кристаллической решётки молекулярная Тип химической связи ковалентная полярная NaCl ионная ионная NaOH ионная ионная (Na-OH) и ков. полярная (-О-Н) HCl молекулярная ковалентная полярная Вещество Проводит ли электрический ток не проводит NaCl (кристаллич.) не проводит NaCl (раствор) проводит NaOH (раствор) проводит HCl (раствор) проводит 5. Возникает вопрос, почему вещества с ионной связью не проводят электрический ток в кристаллах, несмотря на то, что заряженные частицы имеются, почему проводит ток раствор соляной кислоты, хотя и сама вода, и HCl не имеют ионов? Вновь выслушиваются предположения учащихся. Затем демонстрируется видеофрагмент, объясняющий механизм диссоциации веществ с ионной связью на примере хлорида натрия и его раствора, а также видеофрагмент, объясняющий механизм образования заряженных частиц в растворе соляной кислоты. Записываем уравнения электролитической диссоциации. NaCl = Na+ + ClNaOH = Na+ + OHHCl = H+ + Cl - 6. Затем учащиеся занимают места за компьютерами и самостоятельно работают по материалу урока (по электронному пособию «Химия,8,9»), отвечая на вопросы, которые выводятся на экран: Что такое электролиты? Приведите 2-3 примера Что такое неэлектролиты? Приведите 2-3 примера. Какие электролиты относятся к сильным? Приведите 2-3 примера. Какие электролиты относятся к слабым? Приведите 2-3 примера. 7. После того, как ученики ответили на вопросы, обсуждаем ответы. 8. Закрепление материала проводим по тесту электронного пособия «Уроки химии Кирилла и Мефодия» темы «Электролитическая диссоциация». Задания выводятся на экран. A. B. C. D. E. Вопросы контрольного теста: Электролитом является раствор: 1) сахара в воде, 2) соли в воде, 3) спирта в воде Положительно заряженные ионы называются: 1) катионами, 2) анионами, 3) ионитами К сильным электролитам относятся: 1) нерастворимые соли, 2) вода, 3) щелочи При диссоциации кислот в водных растворах образуются: 1) катионы металла и анионы кислотного остатка, 2) катионы металла и водорода и анионы кислотного остатка, 3) катионы водорода и анионы кислотного остатка При диссоциации средних солей в водных растворах образуются: 1) катионы металла и анионы кислотного остатка, 2) катионы металла и водорода и анионы кислотного остатка, 3) катионы водорода и анионы кислотного остатка Отвечаем все вместе, нажимаем нужные пункты в ответах, которые выбирают ученики, и в конце ответов получаем электронную оценку на экране. Скорее всего, если работали хорошо, оценка будет «пять». Согласитесь, это приятное завершение урока. 9. Ну и последний момент, - подводим итог урока: достигли ли поставленных задач в начале урока, получили ли новые знания и удовольствие от урока.