doc металл кислота и др. Размер: 50 кБ
реклама
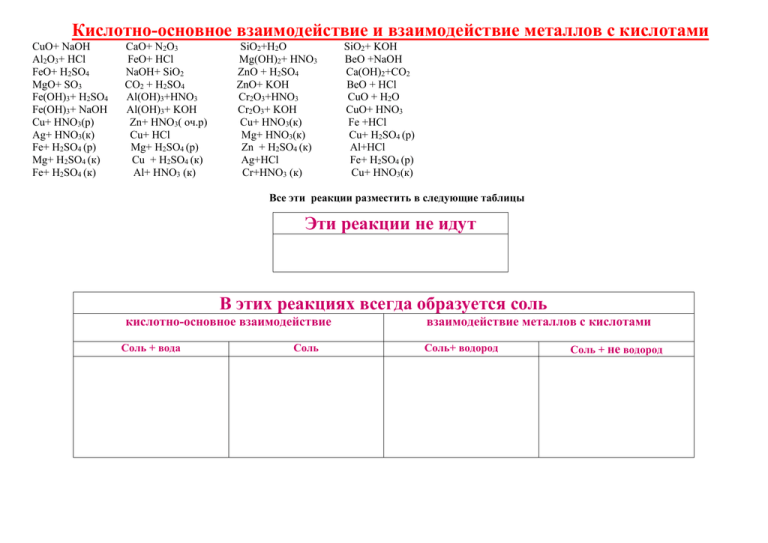
Кислотно-основное взаимодействие и взаимодействие металлов с кислотами CuO+ NaOH Al2O3+ HCl FeO+ H2SO4 MgO+ SO3 Fe(OH)3+ H2SO4 Fe(OH)3+ NaOH Cu+ HNO3(р) Ag+ HNO3(к) Fe+ H2SO4 (р) Mg+ H2SO4 (к) Fe+ H2SO4 (к) CaO+ N2O3 FeO+ HСl NaOH+ SiO2 СO2 + H2SO4 Al(OH)3+HNO3 Al(OH)3+ KOH Zn+ HNO3( оч.р) Cu+ HСl Mg+ H2SO4 (р) Сu + H2SO4 (к) Al+ HNO3 (к) SiO2+H2O Mg(OH)2+ HNO3 ZnO + H2SO4 ZnO+ KOH Cr2O3+HNO3 Cr2O3+ KOH Cu+ HNO3(к) Mg+ HNO3(к) Zn + H2SO4 (к) Ag+HCl Cr+HNO3 (к) SiO2+ KOH BeO +NaOH Ca(OH)2+CO2 BeO + HCl CuO + H2O CuO+ HNO3 Fe +HCl Cu+ H2SO4 (р) Al+HCl Fe+ H2SO4 (р) Cu+ HNO3(к) Все эти реакции разместить в следующие таблицы Эти реакции не идут В этих реакциях всегда образуется соль кислотно-основное взаимодействие Соль + вода Соль взаимодействие металлов с кислотами Соль+ водород Соль + не водород НЕМНОГО ТЕОРИИ: Реакции с изменением степени окисления (ОВР). Взаимодействие простых веществ: Например, реакции горения металлов: 2Mg+О2→2MgO или неметаллов: С+О2→ CO2 Взаимодействие кислот с металлами Например, реакции взаимодействия Mg, Zn, Al, Fe, Cr, Cu, Ag со следующими кислотами: HCl, H2SO4(р), H2SO4(к), HNO3(р), HNO3(к) Металлы, стоящие в ряду напряжений до водорода отдают электроны любой кислоте, при этом образуется соль данного металла и какой-то продукт восстановления: водород, если кислота окисляет ионом водорода HCl, H2SO4(разб.),CH3COOH, H3PO4 и т.д. соединения серы: SO2, S, H2S если это H2SO4(к), соединения азота: NO2, NO, N2 , NН4NO3 ,если это HNO3(к) или HNO3(р), Чем более концентрирована кислота, тем меньше электронов достаётся азоту и меньше изменяется его степень окисления. Обычно восстановление серы проходит до +4 (SO2 ) , а азота до +2 или +4 (NO, NO2), но наиболее активные металлы восстанавливают и глубже: Mg,Zn,Al + HNO3(р) → нитрат+ NH4NO3(N2) Mg,Zn + HNO3(к) → нитрат+ (NO2, N2O, N2) Mg,Zn,Al + H2SO4(к) → сульфат+H2S(S) Пример: Взаимодействие Fe и Cr с кислотами: Поскольку железо (и хром) находится в ряду напряжений металлов до водорода, то оно окисляется кислотами, в которых элементом-окислителем является водород. При этом железо(и хром) окисляется до +2, т.к. Н+ - слабый окислитель: Fe + 2HСl→ FeСl2 + H2 Fe + H2SO4(р) → FeSO4+ H2 Концентрированные азотная и серная кислоты пассивируют алюминий, железо(и хром) на холоде. При нагревании взаимодействие идёт по уравнениям: Fe + H2SO4(к,t0) → Fe2(SO4)3+ SO2+ H2O Fe + HNO3(к,t0) → Fe(NO3)3+NO+ H2O Металлы, стоящие в ряду напряжений после водорода не отдают свои электроны иону водорода, а значит не могут быть окислены HCl, H2SO4(р),CH3COOH, H3PO4 . Такие металлы окисляются H2SO4(к), HNO3(р), HNO3(к) Например: Cu+H2SO4 (к) → CuSO4+SO2+H2O Cu + HNO3(к) → Cu(NO3)2+NO2+H2O Cu + HNO3(р) → Cu(NO3)2+NO+H2O Кислотно-основное взаимодействие (без изменением степени окисления) . Кислоты и кислотные оксиды реагируют с основаниями и основными оксидами, при этом образуется соль и вода: НСl + NaOH H2SO4 + BaO SO2 + NaOH (или только соль, если взаимодействуют два оксида, например: SO2 + BaO) Амфотерность (взаимодействие некоторых оксидов и гидроксидов с сильными кислотами, и со щелочами). Задание: докажите амфотерный характер свойств оксидов и гидроксидов цинка, алюминия, бериллия, хрома(III). На примере гидроксида цинка: В реакциях с кислотами Zn(OH)2 проявляет основные свойства Молекулярное уравнение: Zn(OH)2↓ +2HCl ↔ ZnCl2 +2H2O Сокращённое ионное уравнение: Zn(OH)2↓ +2H+ ↔ Zn2+ +2H2O В реакциях со щелочами Zn(OH)2 проявляет кислотные свойства Zn(OH)2 + 2NaOH →Na2ZnO2 + 2H2O

