Document 404799
advertisement
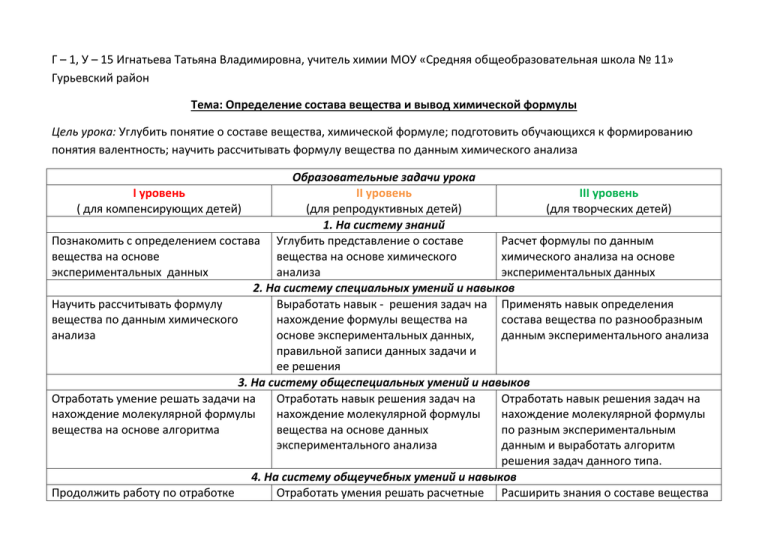
Г – 1, У – 15 Игнатьева Татьяна Владимировна, учитель химии МОУ «Средняя общеобразовательная школа № 11» Гурьевский район Тема: Определение состава вещества и вывод химической формулы Цель урока: Углубить понятие о составе вещества, химической формуле; подготовить обучающихся к формированию понятия валентность; научить рассчитывать формулу вещества по данным химического анализа Образовательные задачи урока I уровень II уровень III уровень ( для компенсирующих детей) (для репродуктивных детей) (для творческих детей) 1. На систему знаний Познакомить с определением состава Углубить представление о составе Расчет формулы по данным вещества на основе вещества на основе химического химического анализа на основе экспериментальных данных анализа экспериментальных данных 2. На систему специальных умений и навыков Научить рассчитывать формулу Выработать навык - решения задач на Применять навык определения вещества по данным химического нахождение формулы вещества на состава вещества по разнообразным анализа основе экспериментальных данных, данным экспериментального анализа правильной записи данных задачи и ее решения 3. На систему общеспециальных умений и навыков Отработать умение решать задачи на Отработать навык решения задач на Отработать навык решения задач на нахождение молекулярной формулы нахождение молекулярной формулы нахождение молекулярной формулы вещества на основе алгоритма вещества на основе данных по разным экспериментальным экспериментального анализа данным и выработать алгоритм решения задач данного типа. 4. На систему общеучебных умений и навыков Продолжить работу по отработке Отработать умения решать расчетные Расширить знания о составе вещества умений решать расчетные задачи по химии задачи на вывод химических формул и выводе молекулярной формулы на по разным экспериментальным основе экспериментальных данных данным полученных разными путями 5. Развивающие задачи урока Развитие памяти Развитие речи Развитие воображения Выучить наизусть алгоритм решения Довести до автоматизма умение Доказать, что состав вещества можно задач на вывод молекулярной решать задачи на вывод химических определить на основе разных формулы вещества формул по алгоритму количественных данных Ход урока 1. Организационный момент (приветствие учителя, проверка готовности класса к уроку. 2. Актуализация опорных знаний (работа с раздаточным материалом, фронтальный опрос, проверка домашнего задания). З человека у доски работают с карточками. Класс: 1. Что называется химической формулой? 2. Что показывает химическая формула? 3. Что мы понимаем под количественным составом вещества? 4. Что такое массовая доля элемента в веществе? Как она определяется? 5. Зачем нужно уметь определять массовую долю элемента в веществе? Где применяются эти знания? 6. Как, используя периодическую таблицу, определить общую массу вещества? Задание1. (работа в парах) Определите молярную массу следующих веществ: а) CuO; б) NaOH; в) H3PO4 Задание 2. (работа в парах) Определите и выразите в разных единицах массовую долю: а) Cu и O; б) Na, H и O; в) H, P и O. Пока школьники работают над заданиями, учитель выборочно проверяет выполнение домашнего задания. 3. Изучение нового материала Учитель: 1. Прочтите формулы предложенных вам в заданиях веществ (читают по очереди). 2. Задумывались ли вы, откуда берутся молекулярные формулы? Кто и как их составляет? Один ученик очень увлекся составлением химических формул. Он исписал ими целые страницы и очень удивился, когда узнал, что некоторые формулы не существуют. Оказывается, символы и значки в формулах нельзя писать, как заблагорассудиться. Формула показывает состав вещества, который является важнейшей его характеристикой. Сегодня нам предстоит увлекательное занятие, мы поработаем учеными. На основе экспериментальных данных, мы попытаемся, вывести формулы разнообразных веществ, играющих большое значение в жизни человека. Для этого мы организуем три лаборатории, задача которых будет на основе экспериментальных данных вывести молекулярные формулы неизвестных веществ. 3. Что же нужно знать, что бы правильно составить молекулярную формулу? Обратимся к экспериментальным данным. Задача1. При разложении воды, одна пробирка полностью заполняется газом водородом, а кислородом, одновременно, заполняется только половина пробирки. Можно проводить опыт до тех пор, пока кислородом не заполнится пробирка полностью, тогда, для выделившегося водорода понадобиться две пробирки. Представим, что пробирка вмещает 10 мл. Тогда при разложении воды первый раз выделилось 5 мл кислорода и 10 мл водорода, а второй раз – 10 мл кислорода и 20 мл водорода. При комнатной температуре плотность водорода равна 0,09 г/л, а кислорода – 1,43 г/л. Рассчитаем массы газообразных кислорода и водорода. Поскольку мы измеряли газы в мл, а в размерности плотности присутствуют литры, то увеличим объемы кислорода и водорода в 1 000 раз. Возьмем объем водорода равный 10 литрам, а кислорода 5 литрам. Отношение количеств двух веществ при этом не изменяется, а расчет вести проще. РЕШЕНИЕ 1. Вычислим массы полученных газов: m (H2) = 0,09 г/л х 10 л = 0,9 г; m (О2) = 1,43 г/л х 5 л = 7,15 г. 2. Найдем количество элементов, входящих в состав разложенной воды. (Помните! Массы всех атомов данного элемента в простом веществе, составляет массу, как самого простого вещества, так и массу элемента.) m(Н) = 0,9 г; m(О) = 7,15 г n (Н) = 0,9 г : 1 г/моль = 0,9 моль; n (О) = 7,15 г : 16 г/моль = 0,45 моль. 3. Определим, в каком отношении находятся количества элементов воде. Для этого поделим все члены отношения на мольную величину (0,45) и получим: n (Н) : n (О) = 0,9 : 0,45 = 0,9/0,45 : 0,45/0,45 = 2 : 1. Зная количества водорода и кислорода, можно составить химическую формулу, подставив вместо индексов полученные числа. Ответ: Н2О Сделаем вывод. Что нужно сделать, чтобы определить формулу вещества по данным анализа? Ученик: Чтобы определить молекулярную формулу вещества надо узнать, какие элементы входят в состав вещества и рассчитать их количественное отношение в веществе. Учитель: А теперь я вам предлагаю каждому занять место в своей лаборатории (предварительно дети получают кружки разного цвета 1 группа – красные; 2 группа – желтые; 3 группа – зеленые) Работа в группах. 1 группа. Карточка 1. Задание. Решите задачи. Задача 1. (решают все вместе) В состав оксида магния входит 14,6 г магния и 9,6 г кислорода. Рассчитайте химическую формулу оксида магния, используя алгоритм. Задача 2. Используя алгоритм, определите формулы оксидов меди: а) В одном оксиде содержится 3,2 г меди и 0,8 г кислорода. Найдите формулу оксида; б) В оксиде содержится 9,6 г меди и 1,2 г кислорода. Найдите формулу оксида. . 1. 2. 3. 4. 5. АЛГОРИТМ РЕШЕНИЯ ЗАДАЧИ НА ВЫВОД МОЛЕКУЛЯРНОЙ ФОРМУЛЫ Запишите данные задачи. Определите молярную массу данных в задаче элементов (М (эл) = Мr(эл)) Определите количество каждого, предложенного в задаче, элемента по формуле n – m/M Найдите соотношение количеств каждого элемента в 1 моль вещества ( для этого необходимо записать отношение количеств каждого элемента и разделить все члены отношения на меньшую величину). Запишите формулу полученного вещества, учитывая, что элемент-металл принято записывать в формуле на первом месте. 2 группа Карточка 2. Задание. Используя алгоритм, решите предложенные задачи: Задача 1. Элемент азот образует большое количество оксидов, которые играют большую роль в жизни человека. Определите формулы оксидов азота, если известно, что: а) «веселящий газ» содержит 0,28 г азота и 0,16 г кислорода; б) «бурый газ» - азота 1,05 г и кислорода 2,4 г по массе; в) высший оксид азота при разложении дает 0,7 г азота и 2 г кислорода. Сравните полученные молекулярные формулы. Задача 2. В кислороде сожгли 14,6 г магния, при этом образовалось 24,2 г оксида магния, рассчитайте его молекулярную формулу. Обсудите в группе, что нового появилось в решении данной задачи. Проверьте правильность решения задач друг у друга. 3 группа. Карточка 3. Задание. Решите предложенные задачи. Составьте план решения каждой задачи. Сопоставьте ход решения задач данного типа и предложите общий алгоритм их решения. Задача 1. (групповая) Рассчитайте формулу углекислого газа, если известно, что при сжигании 2,4 г углерода образовалось 8,8 г его оксида. P.S. Для решения последующих задач Задача 2. (работа в парах) Для обеззараживания воды в походных условиях используется раствор вещества, содержащий 24,7% калия; 34,8% марганца и 40,5% кислорода. Определите формулу данного вещества. Задача 3. (работа в парах) Для побелки помещений используется «негашеная известь», в состав которой входит кальций 54,1%, кислород 43,2% и водород 2,7%. Рассчитайте молекулярную формулу негашеной извести. Задача 4. (работа в парах) Драгоценный камень шпинель, который любила царица Елизавета Петровна, состоит из магния (17, 1%), алюминия (37,9%) и кислорода (45%). Рассчитайте молекулярную формулу камня. 4. Актуализация опорных знаний Учитель: От каждой лаборатории предлагаю пройти одного представителя к доске и оформить одну из своих задач (задачи комментируются и проговариваются). 1. Что общего в решении всех этих задач? 2. С какими трудностями встретилась 1, 2, 3 группы? 3. Что непонятного в решении и оформлении задач данного типа? 4. Сравните алгоритмы решения задач данного типа, предложенных участниками 3 группы и предложенный для 1 и 2 групп (вынести на экран). 5. Домашнее задание Учитель: Прочитать параграф 11 учебника. Рассмотреть примеры предложенные автором учебника. Выполнить упражнения к параграфу 1, 2, 3, и 4 (1 и 2 группы). Составить три типа разнообразных задач на вывод молекулярной формулы вещества (3 группа).

