Календарный лекционных и семинарских занятий план
реклама

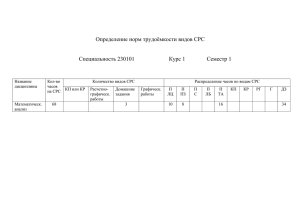
№ Л1 ПЗ 1 Л2 ПЗ 2 Л3 ПЗ 3 Календарный лекционных и семинарских занятий план для групп ВМ весна 2016 Дата Вид занятий ВМ-15-3 ВМ-15-4 Лекция 1. Химия. Роль химии в развитии современной 15.02 науки. Основные понятия и законы химии: материя, вещество, материалы, смеси; атом, Химический элемент, молекула. Количественные характеристики атомов химических элементов и молекул. Законы сохранения массы, постоянства состава, Авогадро. Задания для СРС. [1] №1 (а,б); 2 (а,е); 3 (а,г); 4 (а,б); 5 (1,4); 6 (а,б); 7; 8. П.З. 1. Классы неорганических соединений: кислоты, 15.02 основания, оксиды, соли (классификация, номенклатура, 22.02 свойства, получение). Задания для СРС [1] №14 (а,б); 15 (а,б,г); 16 (в,г,д,з) Лекция 2. Основы строения атома. Периодический закон. 29.02 Периодическая система элементов Д.И. Менделеева. Свойства атомов элементов и их соединений (оксидов, гидроксидов). Задания для СРС [1] № 17; 18 (а,б); 19. 29.02 ПЗ 2.Упражнения по теме строение атома (электронные 21.03 формулы атомов и ионов в максимальной и минимальной степенях окисления. Характеристика элемента по положению в ПСЭ). Задания для СРС [1] № 17; 18 (а,б); 19. КР1 по темам: основные законы и понятия химии, классы неорганических соединений. 14.03 Лекция 3. Понятие о химической связи. Классификация химической связи по способу перекрывания электронных облаков (сигма и пи-связь), по полярности (ионная, ковалентная полярная, ковалентная неполярная. Задания для СРС [1] № 20 (а,д); 21(а,в). Окислительно-восстановительные свойства атомов элементов. Понятие об окислителях и восстановителях. ОВР. Задания для СРС [1] № 20 (а,д); 21(а,в) ПЗ 3. Классификация химической связи по способу 14.03 перекрывания электронных облаков (σ и π-связь), по – полярности (ионная, ковалентная полярная, ковалентная неполярная. Окислительно-восстановительные свойства атомов элементов. Л4 ПЗ 4 Л5 ПЗ 5 Л6 ПЗ 6 28.03 28.03 4.04 11.04 11.04 18.04 25.04 25.04 16.05 Лекция 5. Скорость химических реакций: влияние температуры и концентрации на скорость химической реакции. Химическое равновесие. Принцип Ле-Шателье. Задания для СРС № 42,43, 45, 53-55. ПЗ. 5. Упражнения: расчет скоростей элементарных реакций при изменении концентрации, Объема системы, давления, температуры. Влияние давления, концентрации, температуры на смещение химического равновесия. Лекция 6. Растворы электролитов. Электролитическая диссоциация, степень диссоциации, константа диссоциации. Реакции в растворах электролитов. Диссоциация воды. Понятие о рН. Понятие о гидролизе солей. Понятие о дисперсных системах. Задания для СРС [2] № 159(а)–162(а), 163,164. Задания для СРС [2] №179 (а). П.З. 6 Упражнения по темам: электролитическая диссоциация, гидролиз солей, рН среды. 23.05 Лекция 7. Способы количественного выражения состава растворов. Массовая доля, молярная концентрация, массовая концентрация. Растворимость. Задания для СРС [2] № 62, 63, 88, 98, 114, 117, 119, 154, 155, 156. 23.05 30.05 КР 3 по темам: концентрация, термодинамика, кинетика, диссоциация, гидролиз. Л7 ПЗ 7 Лекция 4. Основные понятия и законы термодинамики: энергия, работа, теплота, первый закон термодинамики. Основные понятия химической термодинамики: энтальпия, энтропия, энергия Гиббса. Термохимия. Закон Гесса и следствие из него. Второй закон термодинамики. Постулат Планка. Задания для СРС [2] № 24 (а, г); 25(а, е); 26 (см. 24 а, г); 27(1б, 2б, 3е). КР2 по темам: Строение атома, химическая связь, ОВР. Литература 1. Методические указания ч.1. Карташева М.Н. Электронный носитель 2. Методические указания ч.2. Карташева М.Н. Электронный носитель 3. Задачи и упражнения по общей химии. Н.Л. Глинка. Москва. ИнтегралПресс. 1997.