Исследование реакции прямого окисления метана в метанол
реклама

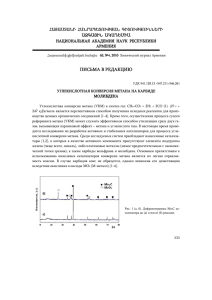
КРАТКАЯ АННОТАЦИЯ РАБОТЫ «Исследование реакции прямого окисления метана в метанол закисью азота на цеолите FeZSM-5» Парфенов Михаил Владимирович Введение Огромные природные запасы метана и способность ферментов метанмонооксигеназ (ММО) вести его селективное окисление в метанол многие годы привлекают пристальное внимание химиков, подталкивая их к новым и новым попыткам осуществить эту реакцию каталитическим путем. Однако уже в течение многих десятилетий эта проблема не поддается успешному решению. Уникальные свойства ММО обусловлены способностью их Feсодержащих центров генерировать чрезвычайно активные частицы кислорода, способные при обычных условиях внедряться в С-Н связи метана [1, 2]. Получить столь активные формы кислорода на искусственных системах ранее не удавалось. В связи с этим большой интерес представляют цеолиты FeZSM-5, содержащие центры, то есть особые комплексы железа, способные при разложении закиси азота (N2O), образовывать анион-радикальную форму адсорбированного кислорода (-кислород, О) [3, 4]. Исследованию -кислорода посвящен ряд экспериментальных и квантово-химических работ [5-14]. О по химическим свойствам похож на активный кислород ММО [5, 13-18], и при комнатной температуре легко окисляет метан. В результате гидролиза образовавшихся в ходе реакции поверхностных метоксильных групп получается метанол. При подготовке данного проекта мы провели ряд поисковых экспериментов на образцах FeZSM-5 нового поколения, имеющих особенно высокую концентрацию кислорода, достигающую 100 мкмоль О/г. Была проведена реакция СН4 + N2O при 50оС, которая дала весьма неожиданный результат. В ходе реакции образуется адсорбированный метанол, присутствие которого убедительно регистрируется методом ИКС (п.п.2860, 2965 см-1, рис. 1). При проведении реакции СН4 + N2O при 200°С обнаружен удивительный факт: количество молекул прореагировавшего метана в 1,9 раза больше, чем количество -центров катализатора. В условиях стехиометрического окисления метана образуются стабильные метоксильные и гидроксильные группы на α-центрах и блокируют их. При этом стехиометрическое отношение Nα : СН4 не может быть больше, чем 1:1. В данном случае активные центры освобождаются в ходе реакции и, вероятно, способны вести каталитическое окисление метана с образованием метанола. 1 2920 2860 2965 2823 0,3 3 F(r) 0,2 2 0,1 1 2700 2800 2900 , см 3000 3100 -1 Рис. 1. ИК-спектры образца FeZSM-5 1 – после стандартной тренировки при 550°С; 2 - после реакции N2O + CH4, 50°С; 3 – после адсорбции CH3OH при 25°С. Цель работы Основной целью работы является исследование механизма и условий протекания реакции прямого окисления метана N2O с образованием метанола, адсорбированного на поверхности цеолита. Реакция протекает в условиях одновременного присутствия N2O и CH4 при температурах 50-200C, то есть в условиях, близких к условиям катализа. Основные задачи С использованием адсорбционно-кинетичеких методов, метода ИК-спектроскопии и экстракции будет исследована реакция смеси СН4 с N2O на цеолите FeZSM-5, что позволит получить ответы на следующие вопросы: 1. Каков механизм реакции, приводящий к образованию адсорбированного метанола? 2. Возможно ли обеспечить десорбцию СН3ОН с цеолита в газовую фазу, что дало бы возможность реализовать каталитический режим протекания реакции? 3. Протекают ли вторичные превращения метанола при этих условиях? Какие продукты кроме метанола будут экстрагироваться с поверхности после проведения реакции при числе оборотов реакции больше 1? Предполагаемые подходы к решению задач (этапы исследований) Для решения этих задач мы планируем: 1. Исследовать кинетику поверхностной реакции СН4 + N2O при 50-200°С в условиях, когда не происходит выделения продуктов окисления метана в газовую фазу. Установить, лимитируется ли окисление метана скоростью образования α-кислорода при разложении N2O, или же наблюдается эффект активации метана на цеолите. 2 2. Определить стехиометрию реакции, то есть соотношения между количеством реагирующих молекул СН4 : N2O. Идентифицировать образующиеся поверхностные частицы методом ИКС. Особое внимание уделить образованию из метана адсорбированного метанола из метана, что на этих системах наблюдается впервые. 3. Экстрагировать продукты реакции с поверхности катализатора, провести их идентификацию и количественный анализ методами газовой хроматографии, ХМС, ЯМР. Определить максимальное число оборотов реакции, N, путем сопоставления количества образовавшегося метанола с количеством -центров на образце. Определить зависимость N от условий реакции. 4. Обобщить экспериментальные результаты с целью установления механизма окисления метана в метанол. Используя дополнительные возможности, которые дает знание числа активных центров, попытаться внести ясность в давнюю и трудноразрешимую альтернативу окислительного катализа, связанную с действием диссоциативного или слитного механизма реакции. 5. Попытаться провести каталитическое окисление метана N2O с вымораживанием метанола в ловушку, охлаждаемую жидким азотом. Экспериментальное оборудование, имеющийся научный задел Ранее автор проекта принимал непосредственное участие в исследовании взаимодействия метана с N2O на FeZSM-5. Была исследована стехиометрическая реакция метана с α-кислородом, и разработана методика экстракции продуктов реакции с поверхности катализатора. По результатам этой работы подготовлена в печать статья. Также было установлено, что диссоциация метана в процессе окисления α-кислородом происходит по механизму отрыва водорода. Предлагаемый проект является логичным продолжением успешно проводимой в нашей лаборатории работы по данной тематике. У автора проекта есть все необходимое оборудование для выполнения поставленных задач. Все адсорбционные и кинетические эксперименты, а также подготовка образцов для последующих спектроскопических исследований, будут проведены на статической вакуумной установке, позволяющей проводить надежные адсорбционные и кинетические измерения. ИК-спектроскопические исследования будут проведены на Фурье спектрометре Shimadzu 8300 с использованием специального герметичного реактора-кюветы. Хроматографический анализ будет проведен на хроматографе «Кристалл 2000М», оснащенном капиллярной колонкой HP-PLOT U, предназначенной для анализа легкокипящих продуктов, и автоматическим жидкостным дозатором. 3 Список литературы 1. M. Baik, M. Newcomb, R.A. Friesner, S.J. Lippard, Chem. Rev. 103 (2003) 2385-2419. 2. W. Nam (Ed.). Dioxygen Activation by Metalloenzymes and Models, Special Issue of Accounts of Chem. Res., 2007, vol. 40, Number 7, p. 465-634. 3. G.I. Panov, CATTECH 4 (2000) 18-32. 4. G.I. Panov, A.S. Kharitonov, K.A. Dubkov, in N. Mizuno (Ed.) Modern Heterogeneous Oxidation Catalysis. Wiley-VCH, Ch. 7, 2009. 5. K.A. Dubkov, V.I. Sobolev, E.P. Talsi, M.A. Rodkin, N.H. Watkins, A.A. Shteinman, G.I. Panov, J. Mol. Cat. A: Chem. 123 (1997) 155-161. 6. E.V. Starokon, K.A. Dubkov, L.V. Pirutko, G.I. Panov, Topics in Catal. 23 (2003) 137-143. 7. J. Jia, B. Wen, W.M.H. Sachtler, J. Catal. 210 (2002) 453. 8. J.A. Ryder, A.K. Chakkaborty, A. Bell, J. Catal. 106 (2002) 7059. 9. L. Kiwi-Minsker, D.A. Bulushev, A. Renken, J. Catal. 219 (2003) 273. 10. P.K. Roy, G.D. Pirngruber, J. Catal. 227(2004) 164. 11. M.V. Parfenov, E.V. Starokon, S.V. Semikolenov, G.I. Panov, J. Catal. 263 (2009) 173180. 12. M.F. Fellah, R.A. van Santen, I. Onal, J. Phys. Chem. C, 113 (2009) 15307. 13. S. Malykhin, I. Zilberberg, G.M. Zhidomirov, Chem. Phys. Lett. 414 (2005) 434. 14. A. Rosa, G. Ricciardi, E.J. Baerends, Inorg. Chem. 49 (2010) 3866-3880. 15. A.A. Shteinman, Успехи химии, 77 (2008) 1013-1030. 16. A.E. Shilov, Metal Complexes in Biomimetic Chemical Reactions, CRC Press, New York, 1997. 17. G.I. Panov, V.I. Sobolev, K.A. Dubkov, V.N. Parmon, N.S. Ovanesyan, A.E. Shilov, A.A. Shteinman, React. Kinet. Catal. Lett. 61 (1997) 251. 18. R.A. Sheldon, in: B. Meunier (Ed.), Metal-Oxo and Metal-Peroxo Species in Catalytic Oxidations, Structure and Binding, vol. 97, Springer Verlag, Berlin 2000, Chapt. 14, p. 613. 4