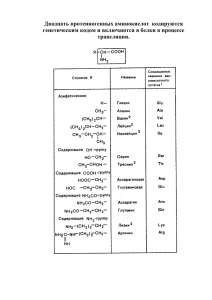
Министерство образования и науки Республики Казахстан Семипалатинский государственный педагогический институт
реклама

Министерство образования и науки Республики Казахстан Семипалатинский государственный педагогический институт Факультет естественно-математических наук Кафедра химии и географии УЧЕБНО-МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ ДИСЦИПЛИНЫ «БИОХИМИЯ» для студентов 3 и 4 курса специальности 050113 «Биология» Семей 2015г. Составитель: доцент Нуркасымова Б.Н _____________________ Утверждено на заседании кафедры химии: Протокол №10____от 19,05_2015 год Зав. Кафедрой химии к.п.н._____________Онтагарова Д.Р Обсуждено на заседании учебно-методического совета факультета естественных наук: Протокол №_5_от 20, 05___2015 год Председатель УМС факультета естественных наук ___________З.В,Абдишева Утверждено ученым советом факультета естественных наук Протокол №6_от_11,06___20015 г Декан факультета естественных наук, к.х.н. ________________Ибраева Л.С. 2 Содержание Глоссарий Введение. Химический состав организмов и свойства молекул биохимических процессов Элементарный состав живых организмов Общие закономерности обмена веществ Основные разновидности обмена веществ Методы изучения обмена веществ Строение и свойства биоорганических молекул Белки Углеводы Липиды Витамины Ферменты Гормоны Обмен углеводов Обмен липидов Обмен белков Биосинтез белка Обмен нуклеотидов и нуклеиновых кислот Обмен веществ и энергии Биохимия дыхания Лабораторные работы 4 5 6 6 7 9 10 10 11 24 31 35 44 47 52 60 73 88 91 94 99 107 3 Глоссарий по дисциплине «Биохимия» Метаболиты – вещества, возникающие в организме в качестве промежуточных продуктов при различных химических реакциях. Биологически активные вещества (БАВ) – вещества, обладающие мощным физиологическим действием и выполняющие роль ускорителей или замедлителей жизненных процессов. Фермент – вещество белковой природы, способное каталитически ускорять протекание биохимических реакций. Активаторы ферментов – вещества, повышающие активность фермента Ингибиторы ферментов – вещества, тормозящие действие фермента. Оксидоредуктазы – ускорители реакций окисления – восстановления. Трансферазы – ускорители реакций переноса атомных групп и молекулярных остатков. Гидролазы – ускорители реакций гидролитического распада и синтеза. Лиазы – ускорители негидролитического отщепления от субстрата отдельных групп атомов с образованием двойной связи или присоединения группы атомов по двойной связи. Изомеразы – ускорители внутримолекулярных превращений. Лигазы – ускорители реакций синтеза, сопряженные с распадом донаторов энергии. Витамины – группа низкомолекулярных веществ различной химической природы, необходимая для роста, жизнедеятельности и размножения организма. Витамеры – сходные по физиологическому действию вещевтва витаминного действия. Протеины – простые белки, распадающиеся при гидролизе до аминокислот. Протеиды – сложные белки, распадающиеся при гидролизе на белковую аминокислотную часть и небелковую компоненту. Простетическая группа – это небелковая компонента сложных белков. Катаболизм (диссимиляция) – процесс обмена веществ, состоящий в их разрушении и выделении продуктов распада из организма. Анаболизм (ассимиляция) – процесс обмена веществ, выраженный в поглощении, накоплении, усвоении организмом веществ окружающей среды и создании, синтезе за их счет структурных единиц нового организма. ДНК – дезоксирибонуклеиновая кислота. РНК – рибонуклеиновая кислота. Нуклеопротеиды – это высокомолекулярные соединения включающие азотистые гетероциклические основания, сахаристую часть и фосфорную кислоту. АТФ – аденазинтрифосфат. АДФ – аденазиндифосфат. АМФ – аденазинмонофосфат. 4 КРАТКИЙ КОНСПЕКТ ЛЕКЦИЙ Лекция № 1-2 ВВЕДЕНИЕ. ХИМИЧЕСКИЙ СОСТАВ ОРГАНИЗМА ЧЕЛОВЕКА. ОБЩИЕ ЗАКОНОМЕРНОСТИ ОБМЕНА ВЕЩЕСТВ Биохимия – наука о качественном химическом составе живых организмов, количественном содержании веществ и химических преобразованиях, лежащих в основе их жизнедеятельности. Для живых организмов характерно наличие определенной структуры, включающей наружную и внутреннюю клеточные мембраны, разнообразные субклеточные органеллы, на которых развиваются все биохимические процессы. Живой организм находится в неразрывной связи с окружающей средой. Из внешней среды он получает необходимые питательные вещества, воду и кислород. Из поступивших веществ в организме образуются сложные биоорганические соединения, участвующие в биопревращениях, в результате которых во внешнюю среду выделяются продукты распада Одна из наиболее важных задач современной биохимии заключается в том, чтобы на основе глубоких знаний химических превращений, происходящих в живом организме, найти действенные пути управления обменом веществ. В зависимости от подхода к изучению живой материи, биохимию делят на три крупных отдела: 1. Статическая биохимия (статика); 2. Динамическая биохимия (динамика); 3. Функциональная биохимия. Первая (статика) занимается исследованием химического состава организмов, причем в понятие «химический состав» включается качественный состав и строение соединений, и количественное их содержание в различных объектах. Вторая (динамика) занимается изучением превращений химических соединений и взаимосвязанных с ними изменений энергии в процессе жизнедеятельности органических форм. К третьей (функциональной) биохимии относятся области биохимических знаний, где изучаются особенности протекания биохимических процессов при различных функциональных состояниях организмов в частности связанные со здоровьем (медицинская биохимия) и физическими нагрузками – биохимия спорта. ХИМИЧЕСКИЙ СОСТАВ ОРГАНИЗМОВ И СВОЙСТВА МОЛЕКУЛ БИОХИМИЧЕСКИХ ПРОЦЕССОВ Молекулы органических соединений исключительно разнообразны и довольно сложны. Одни являются строительным материалом, другие – поставщиками энергии, третьи – обладают и той и другой функциями. К важнейшим типам органических молекул следует отнести углеводы, липиды, Углеводы и липиды – это основной источник химической энергии почти для всех форм жизни. Белки – структурные элементы живой клетки, катализаторы и регуляторы внутриклеточных процессов. 5 Нуклеиновые кислоты играют первостепенную роль в хранении и передаче наследственной информации, необходимой для синтеза специфических белков и некоторых других веществ. Среди названных органических молекул, входящих в состав живых организмов, преобладают молекулы воды. Вода выполняет роль растворителя для минеральных солей и других веществ, а также являются дисперсной средой для коллоидного состояния протоплазмы клеток организма. ЭЛЕМЕНТАРНЫЙ СОСТАВ ЖИВЫХ ОРГАНИЗМОВ Живые организмы избирательно относятся к окружающей среде. Из более чем 100 химических элементов обнаруженных в земной коре, только 22 входят в состав живых организмов. Для построения биоорганических молекул в наибольших количествах используются водород, кислород, углерод и азот. Суммарное содержание этих элементов составляет 99% от общей массы живых клеток. В соответствии с концентрацией элементы живых организмов следует разделить на 3 группы: 1. Основные элементы, куда входят водород, кислород, азот, углерод. Это элементы универсалы. Они используются для построения подавляющего большинства молекул, и их содержание составляет приблизительно от 2 до 60 ат.% . 2. Микроэлементы: натрий, магний, фосфор, сера, хлор, калий, кальций. Их содержание составляет от 0,02 до 0,1 ат.%, причем многие находятся в виде ионов металлов и анионов неметаллов (фосфат-анион, сульфат-анион, хлорид-анион). Количество и баланс этих ионов в организме постоянен. 3. Ультрамикроэлементы - висмут, кремний,ванадий, марганец, железо, кобольт, медь, цинк, молибден. Их содержание – менее 0,001 ат.%. Роль ультрамикроэлементов заключается во влиянии на активность ферментов и, следовательно, на скорость происходящих в организме биохимических реакций. Атомы водорода, углерода, кислорода, азота, фосфора и серы это шесть так называемых «легких» атомов, которые широко используются в живых организмах из-за их способности образовывать ковалентные связи путем спаривания электронов. Набор из указанных атомов позволяет построить почти все необходимые биоорганические молекулы. Лишь изредка, для построения молекул с уникальными свойствами возникает необходимость в др. атомах. Важным в биоорганическом отношении имеет свойство атома углерода, способного взаимодействовать друг с другом, образуя углерод-углеродные связи и органичские молекулы с разнообразными углеродными каркасами: прямые, разветвленные (предельные и непредельные), циклические, ароматические, гетероциклические. В состав биоорганических молекул могут включаться функциональные группы: Н – алканы, -ОН (спирты), -СН=О (альдегиды), -СО- (кетоны), -СООН (кислоты), простые эфиры, сложные эфиры, амиды карбоновых кислот, амины, меркаптаны. 6 Атомы, составляющие молекулы биоорганических соединений, связаны между собой химическими связями, которые чаще свего ковалентные неполярные и ковалентные полярные, одинарные, двойные, тройные. Они отличаются длиной, энергией, валентным углом. Так, тетраэдрическая структура для алканов обуславливает явление ассиметрии биоорганических молекул, многие из которых обладают оптической активностью, в частности все углеводы и аминокислоты. Важной связью для биоорганических и органических молекул является водородная связь для таких соединений, как вода, спирты, карбоновые кислоты, белки, азотистые основания в молекулах ДНК (примеры). ОБЩИЕ ЗАКОНОМЕРНОСТИ ОБМЕНА ВЕЩЕСТВ Обмен веществ постоянно протекающий, самосовершенствующийся, саморегулирующийся процесс химического обновления живых организмов. Это сложнейшая цепь процессов, заключаемых в усвоении веществ из окружающей среды, их химических превращений в организме и выделении в окружающую среду конечных продуктов этих превращений. В процессе обмена из окружающей среды поступают продукты питания и кислород, которые в желудочно-кишечном тракте подвергаются пищеварению, т.е. распадаются на более простые молекулы, лучше растворимые в воде и более легко усвояемые организмом – из белков приблизительно 20 аминокислот, из углеводов – несколько моноз (главная – глюкоза). Продукты пищеварения, а также кислород, вода и некоторые минеральные вещества поступают в кровь и разносятся ею по всему организму. Попадая в клетки различных органов и тканей, они используются для следующих целей: 1. Обновления тканей организма; 2. Роста организма, т.е. увеличения объема тканей и органов; 3. Получения энергии; 4. Синтеза веществ – гормонов, ферментов, различных секретов, слизей и т. п 5. Таким образом, образующиеся в организме вещества распадаются на более простые – конечные продукты обмена, которые выделяются из организма. В обмене веществ следует выделить две стороны – ассимиляцию и диссимиляцию. Ассимиляция заключается в усвоении веществ окружающей среды и превращении их в вещества организма. Диссимиляция – это распад веществ организма на конечные продукты и устранение их из организма. Ассимиляцию и диссимиляцию следует рассматривать ни как отдельные процессы, а как две стороны теснейшим образом связанные в одном процессе. Например, синтез специальных веществ относится к ассимиляции, но он требует затраты энергии, которая может быть получена в процессе биоокисления, т. е. в процессе диссимиляции. Следует помнить о возрастных изменениях обмена веществ. Так, молодой растущий организм характеризуется заметным преобладанием ассимиляции над диссимиляцией, т. е. скорость синтеза превышает скорость распада, что обеспечивает рост молодого организма приблизительно до 17 – 19 лет, затем наступает динамическое равновесие и рост организма прекращается. К 7 старости преобладают процессы диссимиляции, в организме уменьшается синтез жизненно важных веществ, уменьшается количество клеток в органах и тканях, таких как головной мозг, сердце, внутренних органах, мышцах, ухудшается качество нервной регуляции. На протяжении жизни меняется общая интенсивность обменных процессов. Скорость обменных процессов в различных органах и тканях различна. Наиболее высокая она в активно функционирующих тканях: нервных, мозга, печени, крови, мышц. Экспериментально установлено, что ферменты печени крыс обновляются приблизительно за 80 – 90 часов, а волокна скелетных мышц за 30 дней. В обмене веществ следует учитывать адаптационные изменения, которые являются основой приспособляемости живых организмов. Установлено, что на соотношение ассимиляции и диссимиляции существенное влияние оказывают мышечная активность, температура окружающей среды и самого организма, например, при заболевании, качественный и количественный состав пищи и многие другие факторы. При интенсивной мышечной работе резко усиливается диссимиляция, обеспечивающая энергией мышечную деятельность. В этом случае ассимиляция замедляется, так как для неё необходима энергия. По завершении работы происходит переключение энергетического обмена на ассимиляцию – возобновляется синтез жизненно важных белков – ферментов и других нужных веществ.Усиление диссимиляции происходит при понижении температуры окружающей среды На протекание обменных процессов существенное влияние может оказывать питание. Избыток питания ведет к усилению ассимиляции, т. е. преобладает синтез липидов, над процессами их расщепления (ожирение). Недостаток и неполноценное питание может привести к снижению общей интенсивности обменных процессов и преобладанию диссимиляции над ассимиляцией. Многие факторы внешней среды воздействуют на отдельные стороны обменных процессов. Например, пребывание на солнце усиливает реакции синтеза и накопления в кожных покровах ферментов, предохраняющих организм от УФ-лучей. Все изменения в обменных процессах, происходящие под влиянием внешних факторов носят выраженный адаптационный (приспособительный) характер и обеспечивают повышение устойчивости организма к воздействию этих факторов. Именно благодаря тому, что обмен веществ может изменяться, обеспечивая необходимые сдвиги, или постоянство организма, несмотря на внешние изменения среды, живые организмы обладают высокой приспособительной способностью. ОСНОВНЫЕ РАЗНОВИДНОСТИ ОБМЕНА ВЕЩЕСТВ К основным разновидностям обмена веществ относятся следующие: 1. Пластический обмен; 2. Функциональный обмен; 3. Энергетический обмен; 4. Обмен с внешней средой; 5. Промежуточный обмен. 8 Под пластическим обменом следует понимать комплекс химических реакций, приводящий к синтезу специфических для организма веществ: структурных, гормонов, ферментов, различных секретов, запасных источников энергии. Функциональный обмен – это комплекс реакций, обеспечивающий функциональную активность клетки, органа, ткани, который связан в основном с процессами преобразования энергии. Между пластическим и функциональным обменами имеет место конкуренция за обладание различными субстратами и АТФ. Следует отметить, что АТФ является универсальным, непосредственным источником энергии для всех энергетических процессов. Энергетический обмен организма – это комплекс химических реакций, в процессе которых за счет энергии, освобождающейся при распаде углеводов, жиров, продуктов белкового обмена, происходит новообразование (ресинтез) молекул АТФ, распавшихся в процессе энергетического обеспечения функциональной и пластической деятельности клеток. Под обменом веществ с внешней средой следует понимать поступление в организм продуктов питания, кислорода и выделение в окружающую среду конечных продуктов обмена. Промежуточный обмен (межуточный) – это комплекс химических реакций, происходящий в организме с поступившими химическими соединениями. Вещества, образующиеся в ходе промежуточного обмена, принято называть метаболитами. МЕТОДЫ ИЗУЧЕНИЯ ОБМЕНА ВЕЩЕСТВ К настоящему времени разработано большое число разнообраных методов изучения и обмена веществ, но не один из них не дает полного представления об обмене веществ в целом. Более полную информацию можно получить при комплексном исследовании различными методами обмена с внешней средой и промежуточного обмена. Так о процессах ассимиляции и диссимиляции можно судить на основе качественного и количественного состава поступивших продуктов питания и устраняемых метаболитов. Изучение скорости потребления кислорода дает информацию об интенсивности энергетического обмена. Отношение выделяемого углекислого газа к потребленному кислороду называется дыхательным коэффициентом (ДК). По ДК устанавливают субстрат – источник энергии. Если ДК=1, окислению подвергались углеводы; при ДК=0,7 – окислялись жиры; при ДК=0,85 в состоянии покоя, окислялись оба субстрата, т.е. углеводы и жиры. Изучение промежуточного обмена проводится путем определения концентрации в различных органах и тканях промежуточных метаболитов, путем прослеживания в организме судьбы и скорости превращений меченого радиоактивной меткой вещества. Промежуьочные метаболиты определяют в крови, в пробах различных органов и тканей для чего используют метод микробиопсии. Чаще такие исследования предпочитают проводить на животных, а не человеке. СТРОЕНИЕ И СВОЙСТВА БИООРГАНИЧЕСКИХ МОЛЕКУЛ. 9 Молекулы в живых организмах выполняют различные функции. Поэтому они должны обладать определенными свойствами. Их свойства определяются и зависят: 1. От числа углеродов в молекуле и их расположения (ациклические, циклические, ароматические. 2. Природы химической связи в молекуле (простая, двойная, тройная). 3. Природой функциональных групп в молекуле ( алканы, алкены, спирты, альдегиды, кислоты, амины и т. д. ). Функциональные группы – это активные атомные группы, обладающие специфическими свойствами. В биоорганических молекулах одновременно могут присутствовать несколько одинаковых или различных функциональных групп, и они приобретают специфические свойства с реакциями для каждой из функциональных групп. Биоорганические молекулы имеют огромные размеры из-за водородных связей и надмолекулярных взаимодействий Ван – Дер – Вальса, что обуславливает их структурную жесткость и специфичность. Для каждого живого организма характерен состав биологических молекул, который формируется в следующей последовательности: 1. Из внешней среды поступают малые молекулы с атомной массой от 18 до 44 у.е. Это азот, вода, углекислый газ. 2. Промежуточные соединения с молекулярной массой от 50 до 250 у.е. Это рибоза, карбомоилфосфат, альфа-кетокислоты, фосфопируват, малат, ацетат, малонат. 3. Строительные блоки с молекулярной массой от 100 до 350 у.е. Это мононуклеотиды, аминокислоты, простые сахара, жирные кислоты, глицерин. 4. Макромолекулы с молекулярной массой от 103 – 109 у.е. Это нуклеиновые кислоты, белки, полиозы, липиды. Такой набор входит в сократительные системы. Макромолекулы из четвертого пункта посредством водородных связей и других слабых ковалентных связей объединяются, образуя: 5. Надмолекулярные образования, включающие рибосомы, ферментные комплексы, из котрых формируются 6. Внутренние органы. Это миофибриллы, митохондрии, ядро и клетка. Экспериментальные химические исследования простых организмов показали, что первичные живые клетки на земле были построены из 30 различных органических соединений, куда вошли: 20 аминокислот, пять азотистых оснований группы пурина (2) и пиримидина (3), два сахара (рибозо, глюкоза), жирная пальметиновая кислота, амин холин (строение всех веществ приводится ниже). От этих первичных биоорганических молекул происходят сотни других, выполняющих специализированные и обособленные функции в различных организмах. Биоорганические молекулы самые простые из всех возможных, наилучшим образом соответствуют многочисленным функциям в клетке. 10 Лекция № 3. Белки. План лекции 1. Аутотрофы и геьеротрофы. 2. Общий состав живых тел. 3. Промежуточные продукты живых тел 4. Разделение белков и критерии чистоты 5. Белки простые и сложные. 6. Строение простых белков. Круговорот веществ в живой природе неразрывно связан с затратой энергии. Все живые организмы можно разбить на две группы. Одни (аутотрофы) способны строить сложные вещества своего тела из простых минеральных веществ: воды, углекислоты и ряда неорганических солей. Все эти вещества содержат немного свободной энергии, а для синтеза богатых энергией, сложных органических веществ, требуется постоянный приток энергии извне. В основном это лучистая энергия солнца, поглощаемая зелеными листьями растений и водорослями. Другие организмы (гетеротрофы) не могут сами синтезировать все сложные органические вещества, необходимые им для жизни. Эти вещества должны поступать в организм с пищей в готовом виде. Гетеротрофы получают нужную им энергию, окисляя сложные органические вещества в процессе дыхания. Эти взаимоотношения в природе схематически изображены на рис. 1. Солнце Кислород Углеводы Жиры пища Белки Растения (аутотрофы) Животные (гетеротрофы) СО2 + Н2О Рис. 1. Основной обмен веществ в природе Общий состав живых тел. Ведущее место в образовании живых организмов принадлежит водороду, кислороду, углероду и азоту. Эти элементы называют органогенами, подчеркивая их значение для организмов. В построении тонких структур и в организации всего обмена веществ в целом первое место по значимости для самого явления жизни принадлежит белку, возникновение которого создало предпосылки для перехода от неживого к живому. 11 В состав некоторых сложных белков входят нуклеиновые кислоты, занимающие центральное место в организации сложных жизненных процессов. По количественному содержанию белки занимают первое место при анализе сухого остатка животных и микроорганизмов. Следующими веществами по значению и количественному содержанию в живых организмах являются углеводы и липиды. Живой организм получает энергию, необходимую для поддержания его жизнедеятельности, главным образом из углеводов и липидов пищи, но это не значит, что белки не принимают участия в энергетическом обмене или что углеводы и липиды не участвуют в построении тончайших структур живого организма. Следующая группа веществ – это минеральные вещества, остающиеся в золе после сжигания организма, куда относятся макро и микро элементы. К макро элементам относятся фосфорнокислые соли кальция, ионы натрия, калия, хлора, сера, фосфор, железо и др. Очень важной для живого организма является группа органических веществ, в которую включены три класса веществ гормоны, витамины, ферменты. Эти вещества выполняют важную роль регуляторов биохимических процессов, поэтому их называют биоактиваторы. Гормонами называются специфические вещества, вырабатываемые тканями, а у животных – некоторыми специализированными органами – железами внутренней секреции. Отдельные частные реакции каталитически ускоряются многочисленными специфическими катализаторами – ферментами или энзимами. Следует подчеркнуть, что все ферменты имеют белковую природу. Многие живые организмы в процессе эволюции утратили способность к синтезу некоторых веществ и поэтому должны поступать с пищей. Эти вещества получили название витаминов. Присутствуя в пище в очень малых количествах, они необходимы животному организму для построения ферментов. Кроме перечисленных основных веществ, входящих в состав живых организмов, всегда находим в них еще многочисленные вещества, являющиеся промежуточными продуктами синтеза или распада основных групп. Таким образом, общий состав живых организмов можно представить в виде схемы на рисунке 2. Основная среда Вода Основные органические вещества Белки Основа жизни Полупродукты → Углеводы Основные энергетические синтеза и распада Липиды вещества Биоактиваторы Ферменты Витамины 12 Гормоны Минеральные вещества Макроэлементы Микроэлементы Рис. 2. Общий состав живых организмов Белки. Белками называют высокомолекулярные полимеры аминокислот, составляющие основу живых структур. Они чрезвычайно разнообразны. Природные системы белков в организме существуют в виде коллоидов, образуя морфологически различные микро- и макроструктуры клетки и межклеточного вещества. Макромолекулы белка несут на своей поверхности большое количество полярных группировок (NH2, COOH, OH, SH и др.), которые способствуют гидратации белковой молекулы. В водных растворах большое количество воды удерживается белковыми макромолекулами, т. е. они гидратированы, что придает им повышенную устойчивость. Белки сравнительно легко при воздействии различных физических и химических агентов изменяют структуру своих макромолекул, теряя ряд своих первоначальных свойств, и, прежде всего растворимость. Это явление получило название денатурации. Белки денатурируют при нагревании, под действием растворов солей тяжелых металлов, трихлоруксусной кислоты, фосфорномолибденовой кислоты и др., при этом меняется их структура. Но можно осадить белки без изменения их структуры, при этом они не теряют свойства растворимости. Для разделения природных смесей белков наиболее часто используют следующие методы: 1. Фракционное осаждение белков растворами солей (сернокислый аммоний, хлористый натрий и др.), концентрацию которых все время повышают. Процесс ведут при 0 0С. 2. Фракционное осаждение белков метиловым или этиловым спиртами повышающихся концентраций при минусовых температурах (-5 10 оС). 3. Фракционное извлечение белков из тканей растворами солей при различных рН. 4. Разделение белков путем электрофореза в аппарате Тизелиуса. При разделении небольших количеств с успехом используется электрофорез на бумаге. 5. Разделение белков в поле центрифуги. 6. Разделение белков хроматографическим методом на колонках с эктиолцеллюлозой. При изолировании белков критерием чистоты принято считать следующие показатели: 1. Получение белков в кристаллическом состоянии 13 2. Дальнейшая неразделимость при электрофорезе и ультрацентрифугировании. 3. Постоянство аминокислотного состава. 4. Определенная молекулярная масса. 5. Для многих белков – постоянство специфических биологических свойств, таких как ферментативная и гормональная активность и Основные свойства белков. Все белки – высокомолекулярные вещества, при диализе не проходят через полупроницаемые перепонки, могут давать некоторые общие цветные реакции. К цветным реакциям относится биуретовая реакция на пептидную связь, нингидринная реакция на аминокислоты, реакции осаждения, ксантопротеиновая реакция на аминокислоты с ароматическим кольцом, реакция Милона на присутствие фенольных групп, реакции на присутствие аргинина и триптофана и многие другие. В основу классификации белков положена их химическая структура и способность к гидролизу. Если в гидролизате обнаруживаются только аминокислоты, такие белки называют простыми или протеинами. Если в гидролизате кроме аминокислот обнаруживают простетические группы т. е. небелковую часть, их называют сложными белками или протеидами. Простые белки отличаются друг от друга растворимостью в солевых растворах. Альбумины - это простые белки растворимые в чистой воде или в слабых солевых растворах, осаждаются из растворов только при полном насыщении сернокислым аммонием. Глобулины – это простые белки не растворимы в чистой воде, растворяются в разбавленных солевых растворах (1%-ный раствор хлорида натрия) и осаждаются из раствора при полунасыщении его сернокислым аммонием. Протеноиды или склеропротеины – это группа простых белков не растворимых ни в воде, ни в солевых растворах, ни в слабых кислотах и щелочах. Особую группу простых белков составляют некоторые растительные белки, растворяющиеся в 70% этиловом спирте, их называют проламины. Белки – амфотерные полиэлектролиты, в кислой зоне рН ведут себя как катионы, в щелочной зоне – как анионы. В зависимости от соотношения кислых и основных групп для конкретного белка существует особая зона рН, при которой белковая молекула не будет ни катионом, ни анионом, т. е. будет находиться в виде незаряженной частицы. Эта зона получила название изоэлектрической зоны. Большинство белков имеют изоэлектрическую точку, близкую к нейтральной или лежащую в слабо кислой зоне. Другие имеют отчетливо выраженный основной характер, это гистоны и протамины – их выделяют в особую группу основных белков. 14 Все белковые вещества – полимеры аминокислот, значительно отличающиеся друг от друга по количественному аминокислотному составу, последовательному расположению аминокислот, по степени полимеризации, по характеру складывания полипептидных цепей в макромолекулу белка. Полимерные цепи могут образовывать различные по форме белковые молекулы, которые делят на два класса: глобулярные белки – имеют сферическую форму молекулы, и фибриллярные белки - имеют форму вытянутых длинных тонких нитей. Сложные белки (протеиды) различаются по небелковой компоненте. Наиболее распространены следующие сложные белки: Нуклеопротеиды – соединение простых белков с нуклеиновыми кислотами. Липопротеиды – белки, содержащие в своем составе те или иные липиды. Глюкопротеиды – сложные белки при гидролизе распадаются на белковую часть, состоящую из аминокислот и простетическую не белковую часть, состоящую из простых или сложных углеводов. Хромопротеиды – белки, несущие в качестве простетической группы, окрашенные в тот или иной цвет хромогены. Фосфопротеиды – белки богатые остатками фосфорной кислоты. Многие белки, обладающие свойствами катализаторов, являются ферментами, энзимами. Это по большей части сложные белки, отличные друг от друга либо природой белкового носителя, либо небелковой компонентой. И та и другая части определяют активность и специфичность действия таких белков – ферментов. Строение белков. План 1. Простые белки 2. Аминокислотный состав. Аминокислоты и их классификация 3. Образование полипептидов. 4. Сложные белки. Нуклеотиды. ДНК, РНК, химическая природа. 5. Хромо-, фосфо-, глюко-, липопротеиды. Простые белки. Все простые белки при гидролизе распадаются до аминокислот. Гидролиз белка осуществляют при нагревании с кислотами (20%-ная хлороводородная или 8%-ная серная кислоты), щелочами (4 н. гидроксид бария), или при действии ферментов. Образовавшуюся при полном гидролизе аминокислотную смесь делят чаще всего методом хроматографии. К настоящему времени обнаружено около 25 аминокислот, входящих в состав белков. Все аминокислоты, образующие белок, являются α-аминокислотами с общей структурой H │ R-C-COOH 15 │ NH2 Присутствие в молекуле аминокислоты основной и кислотной групп способствует образованию биполярного иона: H3N – CH – COO│ R Аминокислоты реагируют друг с другом за счет карбоксильной группы одной молекулы и аминогруппы другой, образовавшаяся связь –СО-NHназывается пептидной связью. В зависимости от количества соединенных аминокислот различают дипептиды, трипептиды, тетра-, пента- и полипептиды, которые составляют основу всех белков. Все наиболее распространенные аминокислоты в зависимости от групп, входящих в радикал, можно разделить на 9 классов: + 1. Основной ряд моноаминомонокарбоновых кислот включает: Гликокол (глицин) – H2N-CH2-COOH, аланин - CH3-CH(NH2)-COOH, α – аминомасляная кислота - CH3-CH2-CH(NH2)-COOH, норвалин CH3- (CH2)2-CH(NH2)-COOH, норлейцин - CH3-(CH2)3-CH(NH2)-COOH. 2. Изомеры основного ряда: валин – СН3- СН-СН-СООН, лейцин – СН3-СН-СН2-СН-СООН, │ │ │ │ H3C NH2 H3C NH2 изолейцин – СН3-СН2-СН-СН-СООН. │ │ Н3С NH2 3. Оксиаминокислоты: серин – СН2-СН-СООН, треонин - СН3- СН-СН-СООН │ │ │ │ ОН NH2 OH NH2 4. Диаминокислоты: орнитин - СН2- СН2-СН2-СН-СООН, лизин – СН2-(СН2)3-СН-СООН │ │ │ │ NH2 NH2 NH2 NH2 5. Дикарбоновые аминокислоты: аспарагиновая кислота – НООС-СН2- СН-СООН, │ NH2 глутаминовая кислота - НООС-СН2-СН2-СН-СООН │ 16 NH2 6. Гуанидоаминокислота: аргинин – H2N-C-NH-CH2-(CH2)2-CH-COOH ║ │ NH NH2 7. Тиаминокислоты: цистеин – СН2-СН-СООН, метионин - СН2-СН2-СН-СООН │ │ │ │ HS NH2 H3C-S NH2 8. Ароматические аминокислоты: фенилаланин–С6Н5-СН2СН-СООН, тирозин – НО-С6Н4-СН2-СН-СООН │ │ NH2 NH2 9. Гетероциклические аминокислоты: триптофан - CН2-СН-СООН │ │ N NH2 гистидин - -СН2-СН-СООН │ NH2 N HN пролин – Н2С │ Н2С СН2 │ СН-СООН NH оксипролинНО-СН │ Н2С СН2 │ СН-СООН NH В молекулах полипептидав должна быть строгая последовательность соединения аминокислот посредством пептидных связей, что определяет первичную структуру белка. Закручивание полипептидной цепи за счет водородных связей между карбонильным кислородом и водородом иминогруппы каждого третьего звена 17 обуславливает вторичную структуру белковой макромолекулы. Третичная структура белка обусловлена межцепным взаимодействием свободных функциональных групп с образованием дисульфидного мостика, сложноэфирной группировки и солевого мостика. Сложные белки. Из сложных белков хорошо изучены нуклеопротеиды, играющие важную роль в жизнедеятельности организмов. Под влиянием крепких солевых растворов нуклеопротеиды распадаются на простой белок (часто это гистоны и протамины) и нуклеиновые кислоты. Нуклеиновые кислоты так же, как и простой белок – полимеры, поэтому их называют полинуклеотидами. Нуклеотиды построены из фосфорной кислоты, сахаристой части, представленной пентозами, чаще всего это рибоза и гетероциклических оснований. Известно два основных типа нуклеиновых кислот, различающихся сахаристой частью. Если сахаристая составляющая нуклеиновых кислот представлена рибозой, эти кислоты называют рибонуклеиновые или РНК. Строение рибозы циклическое и носит название рибофуранозы. Второй тип объединяет нуклеиновые кислоты, содержащие дезоксирибозу, т. е. частично восстановленную рибозу, тогда это дезоксирибонуклеиновые кислоты или ДНК. О Н │ │Н НО │ НО О СН2ОН │ Н │ │ Н ОН Н │ │ НО Н │ Н СН2ОН │ Н │ │ Н ОН Рибофураноза 2-дезоксирибофураноза ДНК и РНК отличаются друг от друга и некоторыми входящими в их состав гетероциклическими основаниями: РНК содержит урацил, а ДНК содержит тимин – HN C=O HN C=O │ │ │ │ O=C CH O=C C-CH3 │ ║ │ ║ HN CH HN CH урацил тимин Другие основания, встречающиеся в нуклеиновых кислотах, в равной мере входят в состав, как РНК, так и ДНК. Это пиримидиновое основание цитозин и два пуриновых основания – аденин и гуанин: N====C-NH2 N====C-NH2 N====C-OH │ │ │ │ │ │ O=C CH HC C–N H2N-C C–N │ ║ ║ ║ CH ║ ║ CH HN CH N C – NH N C –NH 18 цитозин аденин гуанин Нуклеотиды, из которых построены нуклеиновые кислоты, имеют следующую схему строения: Гетероциклическое основание - сахар – фосфорная кислота. РНК – полимер, образованный четырьмя различными нуклеотидами уридиловой, цитидиловой, адениловой и гуаниловой кислотами: О НС===CH O=C HN HO OH H OH │ │ │ │ N - C — C — C — C — C — O — P—OH │ │ │ │ │ ║ C H H H H H O ║ O уридиловая кислота O HC===CH H2NC N C ║ O HO OH H OH │ │ │ │ N - C — C — C — C — C — O — P—OH │ │ │ │ │ ║ H H H H H O цитидиловая кислота NH2 │ C N C N O CH HC N HO OH H OH │ │ │ │ C N C—C—C—C—C—O—P—OH │ │ │ │ │ ║ H H H H H O адениловая кислота 19 OH │ C N C N O CH H2N-C C N N HO OH H OH │ │ │ │ C—C—C—C—C—O—P—OH │ │ │ │ │ ║ H H H H H O гуаниловая кислота В ДНК входят также четыре различных нуклеотида, имеющие аналогичное строение, но только содержащие вместо рибозы – дезоксирибозу (дезоксицитидиловая, дезоксиадениловая и дезоксигуаниловая кислоты), а вместо уридиловой кислоты - дезокситимидиловую кислоту: О СН3 │ C===CH O=C HN H OH H OH │ │ │ │ N - C — C — C — C — C — O — P—OH │ │ │ │ │ ║ C H H H H H O ║ O дезокситимидиловая кислота О HC===CH H2NC N C H OH H OH │ │ │ │ N - C — C — C — C — C — O — P—OH │ │ │ │ │ ║ H H H H H O 20 ║ О дезоксицитидиловая кислота NH2 │ C N C N O CH HC C N N H OH H OH │ │ │ │ C—C—C—C—C—O—P—OH │ │ │ │ │ ║ H H H H H O дезоксиадениловая кислота OH │ C N C N O CH H2N-C C N N H OH H OH │ │ │ │ C—C—C—C—C—O—P—OH │ │ │ │ │ ║ H H H H H O дезоксигуаниловая кислота Полимеризация нуклеотидов происходит за счет образования эфирной связи между фосфорной кислотой одного нуклеотида и третьим гидроксидом пентозы: основание – сахар фосфорная кислота основание – сахар фосфорная кислота основание – сахар 21 фосфорная кислота основание – сахар Четыре различных основания в ДНК (аденин – А, гуанин – Г, тимин – Т, цитозин – Ц), чередуясь в цепи полинуклеотида в различной последовательности, создают специфическое строение той или иной молекулы ДНК. Каждый вид живых организмов имеет свое характерное для него чередование нуклеотидов в ДНК. Именно в этом чередовании нуклеотидов «закодирована» вся информация, нужная для развития и существования данного вида и передачи наследственных свойств. Анализы ДНК различного происхождения показали, что хотя в разных ДНК процентное содержание различных оснований неодинаково, но отношение аденин/ тимин и гуанин /цитозин всегда близко к единице. Рибонуклеиновые кислоты имеют более простое строение. По молекулярной массе, строению и функциям РНК можно разделить на три класса: информационные РНК – это ВМ-полинуклеотиды меньшей молекулярной массы, чем ДНК, имеющие расположение нуклеотидов, соответствующее их расположению на отдельных участках ДНК. Так, в положении, где в ДНК находится тимин, у информационной РНК стоит уридин. Они синтезируются в ядре клетки, как бы «считывают» информацию с части ДНК и несут ее в цитоплазму клетки. Поэтому их называют информационными РНК. Растворимые или транспортные РНК – это низкомолекулярные полинуклеотиды, выполняющие функции доставки, транспорта аминокислот к рибосомам клетки, где идет синтез белка. В соответствии с наличием 20 различных аминокислот в клетке имеется столько же различных транспортных РНК. Рибосомальная РНК – это высокополимерная РНК, входящая в состав рибосом клетки. Не обладает видовой специфичностью. Принимает участие в синтезе белка. Хорошо изучены хромопротеиды, окрашенные белки. К этой группе принадлежит гемоглобин – окрашенный в красный цвет белок эритроцитов крови. Он состоит из простого белка глобина и окрашенной простетической группы – гемма, в основе строения гемма лежит порфириновый цикл. (привести строение). Этот же цикл является основой зеленого вещества растений – хлорофилла. Фосфопротеиды – белки, у которых к оксигруппе остатков сенина и треонина присоедена фосфорная кислота или пирофосфаты. Выполняют функции запасных источников фосфорной кислоты и активно участвуют в фосфорном обмене. Глюкопротеиды - построены из простых белков, соединенных с комплексными полисахаридами. В состав последних кроме простых сахаров входят аминосахара, гексуроновые кислоты, сернокислые эфиры сахаров. Соединение полисахарида с белком осуществляется за счет солеобразных и 22 дипольных связей. Важную роль в присоединении полисахарида играют остатки тирозина и аргинина, входящие в белок. Липопротеиды – белки, соединенные с триглицеридами и фосфолипидами. Связи липидов с белками не всегда ясны. В ряде случаев связь осуществляется или путем непрочных солевых мостиков, или за счет более устойчивых ковалентных связей. Лекция № 4 Углеводы План 1. Простые углеводы. 2. Дисахариды. 3. Полисахариды. 4. Комплексные полисахариды. В животных и растительных организмах мы встречаемся с простыми сахарами с общей формулой СnH2nOn, дисахаридами, которым соответствует общая формула С12Н22О11, полисахаридами – CnH2mOm и комплексными полисахаридами. Поскольку тема «Углеводы» подробно рассматривается в курсе «Органическая химия», мы остановимся лишь на вопросах, необходимых при изучении биохимических процессов. Простые углеводы. Из простых углеводов наибольшее распространение имеют гексозы с общей формулой С6Н12О6, в частности глюкоза (альдогексоза) и фруктоза (кетогексоза). Им пренадлежит ведущая роль в обмене веществ. Находясь в водном растворе, они могут быть в виде двух форм – линейной и циклической. Переход одной формы в другую осуществляется через енольную форму. Поэтому в водном растворе имеет место следующее равновесие: Н │ │ НО СН2ОН │ │ О Н НО Н │ │ Н ОН Н │ │ ОН α-, D- глюкопираноза ↔ ↔ Н Н НО Н │ │ │ │ СН2 - С - С - С - С - СН=О ↔ │ │ │ │ │ ОН ОН ОН Н ОН D-глюкоза Н Н НО │ │ │ СН2 - С - С - С - С = СНОН ↔ 23 │ │ │ │ │ ОН ОН ОН Н ОН общая енольная форма Н Н НО О │ │ │ НОН2С СН2ОН ↔ СН2 - С - С - С - С- СН2ОН ↔ │ │ │ │ │ │ ║ │ Н НО │ ОН ОН ОН Н О Н │ │ ОН D-фруктоза НО Н α-, D-фруктофураноза Все простые сахара оптически активные соединения, так как содержат ассиметрические атомы углерода, могут существовать в α- и –β-пиранозных и фуранозных формах. Реже в биохимических процессах встречаются галактоза и манноза. Из пентоз в природе наиболее распространены - рибоза и дезоксирибоза, менее ксилоза и арабиноза: СН=О СН=О СН=О СН=О │ │ │ │ Н-С-ОН Н-С-Н НО-С-Н Н-С-ОН │ │ │ │ Н-С-ОН Н-С-ОН Н-С-ОН НО-С-Н │ │ │ │ Н-С-ОН Н-С-ОН Н-С-ОН Н-С-ОН │ │ │ │ СН2ОН СН2ОН СН2ОН СН2ОН D – рибоза D – дезоксирибоза D - арабиноза D – ксилоза При биохимическом распаде и синтезе гексоз важную роль выполняют глицериговый альдегид и диоксиацетон: СН=О │ Н-С-ОН │ СН2ОН D-глицериновый альдегид СН2-ОН │ С=О │ СН2ОН диоксиацетон Все простые углеводы хорошо растворимы в воде, обладают сладким вкусом и могут быть обнаружены по их восстановительным свойствам. Наряду со свободными сахарами в организме широко распространены фосфорнокислые эфиры простых сахаров. Чаще всего встречаются 1-фосфат 24 глюкоза, 6-фосфат глюкоза, 6-фосфат фруктоза, 1,6-дифосфатфруктоза, 5фосфатрибоза, 3-фосфатглицериновый альдегид: Н │ │ НО СН2ОН │ │ О Н НО Н │ │ Н ОН Н Н Н НО Н │ ОН │ │ │ │ │ │ СН2 - С - С - С - С - СН=О О-Р=О │ │ │ │ │ │ О ОН ОН Н ОН ОН │ 1-фосфатглюкопираноза О=Р(ОН)2 6-фосфатглюкоза СН2ОН СН2-О-Р(ОН)2 │ │ ║ С=О С=О О СН=О СН=О │ │ │ │ НО-С-Н НО-С-Н Н-С-ОН Н-С-ОН │ │ │ │ Н-С-ОН Н-С-ОН Н-С-ОН СН2-О-Р(ОН)2 │ │ │ ║ Н-С-ОН Н-С-ОН Н-С-ОН О │ │ │ 3-фосфатглицеСН2О-Р(ОН)2 СН2О-Р(ОН)2 СН2О-Р(ОН)2 риновый ║ ║ ║ альдегид О О О 5-фосфатрибоза 6-фосфатфруктоза 1,6-дифосфатфруктозы Все они принимают самое активное участие в биохимических процессах, протекающих в живых объектах. Фосфорилирование (т. е. введение в молекулу моносахарида остатка фосфорной кислоты) – это первый, подготовительный этап, как к распаду простых углеводов, так и к биосинтезу из них наиболее сложных углеводов. Важными производными простых сахаров являются продукты их окисления – глюкуроновая кислота и галактуроновая кислота, а подуктами восстановления – многоатомные спирты – D- сорбит и D- маннит: СН=О СН=О СН2ОН СН2ОН │ │ │ │ Н-С-ОН Н-С-ОН Н-С-ОН НО-С-Н │ │ │ │ НО-С-Н НО-С-Н НО-С-Н НО-С-Н │ │ │ │ Н-С-ОН НО-С-ОН Н-С-ОН Н-С-ОН │ │ │ │ 25 Н-С-ОН │ СООН глюкуроновая кислота Н-С-ОН │ СООН галактуроновая кислота Н-С-ОН │ СН2ОН D-сорбит Н-С-ОН │ СН2ОН D-маннит Аминопроизводные простых сахаров – 2-глюкозамин и 2-галактозамин: Н Н НО Н │ │ │ │ СН2 - С - С - С - С - СН=О │ │ │ │ │ ОН ОН ОН Н NН2 2-аминоглюкоза Н НО НО │ │ │ СН2 - С - С - С │ │ │ │ ОН ОН Н Н 2-аминогалактоза Н │ С - СН=О │ NН2 Сложные углеводы. К категории сложных относятся углеводы, распадающиеся при гидролизе с образованием простых углеводов. Состав сложных углеводов выражается общей формулой CmH2nOn , где m>n. Среди сложных углеводов выделены две группы: 1. Олигосахариды – сложные углеводы, характеризующиеся сравнительно невысокой молекулярной массой, хорошо растворимые в воде, легко кристаллизующиеся, и, как правило, сладкие на вкус. Молекулы олигосахаридов составлены из небольшого числа остатков простых углеводов. 2. Полисахариды – высокомолекулярные сложные углеводы, составленные из многих сотен остатков простых углеводов. Их молекулярные массы составляют обычно сотни тысяч углеродных единиц. Они не дают ясно оформленных кристаллов, и лишь некоторые из них обладают псевдокристаллическим строением. Полисахариды либо не растворимы в воде, либо дают растворы, напоминающие по свойствам коллоидные. Для полисахаридов не характерен сладкий вкус. Олигосахариды. В зависимости от количества остатков моноз, входящих в молекулы олигосахаридов, последние делят на дисахариды, трисахариды, тетрасахариды и т. д. Наибольшее значение в обмене растительных организмов и как пищевые вещества для животных имеют дисахариды. В растениях наиболее распространенный дисахарид – сахароза (свекловичный сахар, тростниковый 26 сахар). Сахароза – это гликозидо-гликозид, образованный из остатков α- Dглюкопиранозы и β-D-фруктофуранозы за счет полуацетальных гидроксидов обеих составляющих. (Привести строение). Дисахариды лактоза (молочный сахар), мальтоза (виноградный сахар), трегалоза (грибной сахар) принимают участие в биохимических процессах, переходя в монозы (привести строение). Полисахариды. К числу наиболее важных природных полисахаридов принадлежат крахмал, гликоген (животный крахмал) и клетчатка. Все три полисахарида при гидролизе дают только D-глюкозу. Молекулы того или иного индивидуального полисахарида обычно бывают составлены главным образом из многих остатков какого-либо одного моносахарида. Так, полисахарид инулин при гидролизе дает только фруктозу, маннан – маннозу, галактан – галактозу, арабан – арабинозу и т. п. Полисахариды разнообразны по биологическому значению. Многие из них (крахмал, гликоген, инулин и др.) являются в растительных и животных организмах запасными питательными веществами. Некоторые полисахариды, например клетчатка, несут исключительно опорные и защитные функции. Ряд полисахаридов (маннаны, галактаны и др.) используются и как строительный и как питательный материал. Химическое строение полиоз однообразно. Все они являются полигликозидами, в молекулах которых за счет эфирных кислородных мостиков объединяются сотни, тысячи, а иногда и десятки тысяч остатков моносахаридов. При этом непременными партнерами в образовании кислородных мостиков служат гликозидные гидроксиды моносахаридов, а вторым партнером оказывается один из спиртовых гидроксидов моносахарида, чаще всего в положении 4 (у линейных полисахаридов) или 4 и 6 (у разветвленных форм). Полисахариды сравнительно легко гидролизуются при кипячении с разбавленными растворами кислот или инкубации с соответствующими ферментами. Щелочи для ускорения гидролиза полисахаридов, как и дисахаридов, не используются, ибо они вызывают осмоление освобождающихся моноз. Характерно, что ферментативный гидролиз таких распространенных полисахаридов, как крахмал и клетчатка, приводит к дисахаридам, в случае крахмала образуется мальтоза, а в случае клетчатки - целлобиоза. При кислотном гидролизе образуются монозы. В растениях, в результате фотосинтеза, образуются два наиболее распространенных полисахарида: крахмал и клетчатка. Крахмал – накапливается в качестве запасного питательного вещества в виде аморфных глыбок, различных по форме, у разных растений в зеленых листьях, в зерне, картофеле, плодах и овощах. Содержание крахмала в зернах пшеницы, кукурузы, риса достигает 70 – 80%. В клубнях картофеля-12-14%. Природный крахмал представляет собой систему из двух полимеров глюкозы - а м и л о з ы и а м и л о п е к т и н а. Амилоза – линейный, неразветвленный полимер α-глюкозы, построенный из 200-300 ее молекул. Амилоза растворяется в воде, с йодом дает синее 27 окрашивание. Реакция с раствором йода часто используется для открытия крахмала. Окрашивание обусловлено сорбцией атомов йода амилозой. При нагревании, вследствие десорбции, окрашивание исчезает, но при охлаждении появляется вновь. Реакция с йодом очень чувствительна и позволяет обнаружить ничтожные следы крахмала. Второй компонент крахмала амилопектин – полимер глюкозы с разветвленными цепями, что снижает его растворимость и придает получаемым при нагревании коллоидным растворам крахмала способность застывать при охлаждении в студень, гель. Молекулы амилопектина составлены из множества (нескольких сотен) коротких полигликозидных цепочек, каждая из которых в среднем составлена из 20 остатков α-D-глюкопиранозы. В пределах каждой короткой цепи глюкозные остатки соединены 1,4-связями. Друг с другом цепи соединяются посредством 1,6-связей. С раствором йода амилопектин дает фиолетовое окрашивание. (Привести строение амилозы и амилопектина). При кратковременном нагревании порошкообразного крахмала его гиганские молекулы претерпевают распад, образуя смесь более простых полисахаридов меньшего молекулярного веса, так называемых декстринов. Распад молекул крахмала до декстринов особенно интенсивно идет при нагревании крахмального клейстера с10-процентным раствором серной кислоты, конечным продуктом распада является D-глюкоза. Крупномолекулярные декстрины окрашиваются йодом в красный цвет, низкомолекулярные окраски с йодом не дают. Таким образом, гидролиз крахмала проходит ступенчато, что можно представить схемой: [C6H10O5]n → x[C6H10O5]m → → nC6H12O6 у[C6H10O5]p крахмал эритродекстрины ахродекстрины D-глюкоза где n > m > p. Декстринизация и осахаривание крахмала широко применяются промышленности. в Гликоген служит резервным, питательным веществом в организме человека и животных, вследствие чего за ним сохраняется название «животный крахмал». Однако он найден также в грибах, дрожжах и в зернах кукурузы. Содержание гликогена в печени животных достигает 20%, а в мышцах – 4%. Распадаясь до простых продуктов довольно сложным путем, который носит название гликогенолиза, гликоген обеспечивает потребность организма в энергии для поддержания температуры тела, осуществления мышечного сокращения, протекания биохимических процессов и т. п. Следовательно, его биологическая роль весьма велика. Гликоген сравнительно хорошо растворяется в горячей воде, хотя некоторые виды натурального гликогена трудно растворимы. Подобно крахмалу, гликоген дает цветную реакцию с йодом, причем тон окраски (красно-фиолетовый или красно-коричневый) свидетельствует о том, что он ближе к амилопектину, нежели к амилозе. Причина близости свойства гликогена и амилопектина лежат 28 в сходстве их строения, т. е. оно аналогично, а различие состоит лишь в том, что в молекуле гликогена средняя длина коротких цепей, которые сочетаются 1,6связями, равна 12 остаткам α-D-глюкопиранозы. Таким образом, молекула гликогена несколько плотнее, компактнее, чем молекула амилопектина. Клетчатка – главный структурный полисахарид растений. В древесине содержится 50 – 70 % клетчатки, в стеблях волокнистых растений, например, льна, еще больше, а хлопчатник (вата) почти чистая клетчатка. При гидролизе клетчатки в присутствии кислот почти с количественным выходом образуется глюкоза (привести строение и гидролиз). Клетчатка является β полигликозидом с молекулярной массой 10-20 миллионов. В молекуле клетчатки реакционными являются 2, 3, и 6-ой спиртовые гидроксилы, которые способны к реакциям с азотной кислотой, уксусным ангидридом, щелочью, сероуглеродом. Эти реакции используются в технике для получения искусственных волокон, целлофана, целлулоида, фотопленок, взрывчатых веществ и др. Комплексные полисахариды, это большая группа полисахаридов, построенных не только из глюкозы, но и включающих в свой состав другие сахара, такие как гексуроновые кислоты, аминосахара и эфирносвязанные кислоты (серную, фосфорную, уксусную и др.). Комплексные полисахариды присутствуют в малых количествах, но выполняют ответственные, специфические функции в организме, входят в состав сложных белков мукополисахаридов, мукоидов, глюкопротеидов. Наиболее распространенными комплексными полисахаридами являются следующие: хондроитинсерная кислота – смешанный полимер, построенный из аминосахаров и глюкуроновой кислоты. Аминогруппы в этом полисахариде ацилированны, а многие спиртовые гидроксилы этерифицированны серной кислотой. Хондроитинсерная кислота участвует в построении соединительной и хрящевой тканей животных организмов. Гиалуроновая кислота – смешанный полимер, построенный из ацилированного глюкозамина и глюкуроновой кислоты. Имеет большую молекулярную массу и дает очень вязкие растворы. Входит в состав соединительной ткани кожи, стенок капилляров, стекловидного тела и роговицы глаза. Гепарин – низкомолекулярный смешанный полимер глюкозамина и глюкуроновой кислоты. Для него характерно наличие эфирносвязанной серной кислоты. Присутствует во всех тканях живого организма, выполняет ответственные функции регулятора вязкости живой плазмы. Гепарин задерживает свертывание крови, поэтому применяется как стабилизатор при хранении крови и как лечебное средство в борьбе с тромбозами. Пектиновые вещества – комплексные полисахариды, весьма распространенные в растительном мире, входят в состав многих фруктов. Состоят из галактозы, арабинозы, метилированной галактуроновой кислоты и др. В присутствии сахара и кислоты пектины образуют желеобразные студни, что позволяет их широко использовать в кондитерской промышленности для приготовления желе, джема, пастилы, мармелада и др. 29 Контрольные вопросы 1. Основы номенклатуры и классификации углеводов. 2.Составить цепные и циклические формулы извесных вам моноз. 3. Составить схему перехода от маннозы к глюкозе через кето-енольную таутомерию. 4. Составить схему динамического равновесия между цепной и циклическими формами глюкозы. 5. Напишите полные циклические и полуциклические формулы лактозы и целлобиозы. 6.Охарактеризовать физические и химические свойства крахмала, гликогена и клетчатки. 7. Составить схему реакции гидролиза целлюлозы. Лекция № 5 Липиды. План 1. Классификация липидов. 2. Химическая природа липидов. 3. Нейтральные жиры. Воска. 4. Фосфатиды: лецитин, кефалин и др. Липиды – сложная группа веществ, обладающая общими свойствамирастворятся в неводных растворителях: эфире, бензине, бензоле, хлороформе, горячем спирте. В живом организме они играют роль неводной фазы в тонком строении тканей и клеток организма. Многие липиды, как и углеводы, выполняют функции запасных, богатых энергией питательных веществ. Липиды различаются по свойствам и функциям в зависимости от строения. Все наиболее распространенные липиды подразделяют на пять классов: простые липиды – нейтральные жиры, воска; сложные липиды – жироподобные вещества (липоиды) ациклические, моноциклические и полициклические – фосфатиды, цереброзиды, стерины и стериды. Большинство липидов представляют собой сложные эфиры спирта и кислоты. В состав наиболее распространенных липидов входят следующие спирты: 1. Глицерин (СН2ОН-СНОН-СН2ОН) – входит в состав нейтральных жиров и фосфатидов. 2. Высшие одноатомные спирты: цетиловый спирт (С16Н33ОН), мерициловый спирт (С30Н61ОН) и другие – входят в состав восков. 3. Аминоспирты, например сфингозин (С13Н27-СН=СН-СН-СН-СН2) │ │ │ ОН NH2OH входит в состав цереброзидов и некоторых фосфатидов. 4. Циклические спирты – производные циклопентанпергидрофенантрена образуют группу стеринов и стеридов. 5. Гидроароматический спирт инозит (гексаоксициклогексан) входит в состав некоторых фосфатидов. 30 Второй существенный компонент большинства липидов – жирные кислоты. Их около 30, причем они содержат четное количество атомов углерода и могут быть насыщенными и ненасыщенными. Насыщенные жирные кислоты: масляная (4), капроновая (6), пальмитиновая (16), стеариновая (18), церотиновая (26). Ненасыщеные жирные кислоты: олеиновая (18), линолевая (18), линоленовая (18), арахидоновая (20) – СН3-(СН2)3-[СН2-СН=СН]4-(СН2)3-СООН. Оксикислоты: цероброновая (24) – СН3-(СН2)21-СНОН-СООН, рицинолевая (18) – СН3-(СН2)5-СНОН-СН2-СН=СН-(СН2)7-СООН. Нейтральные жиры – это смеси сложных эфиров глицерина и высших жирных кислот с общей формулой СН2-О-СО-R1 │ CH-O-CO-R2 │ CH2-O-CO-R3 где R1, R2, R3 – различные радикалы высших жирных кислот. Жиры характеризуются по температуре плавления, йодным числом и числом омыления. Воска – построены в основном из сложных эфиров высших спиртов и жирных кислот с общей формулой R-O-CO-R1, где R – радикал таких спиртов, как цетиловый, цериловый, мирициловый, а R1 – радикал жирных кислот – пальметиновой, церотиновой и др. Воска в химическом отношении сравнительно инертные вещества, мало изменяются при хранении. Фосфатидами (или фосфолипидами) называют липоиды, содержащие эфирообразно связанную фосфорную кислоту. Они распространены в природе, входят в состав почти всех тканей и клеток. Особенно много их в нервной ткани, мозге, желтке яйца, эритроцитах и сперме. Наиболее распространенные фосфатиды имеют общую формулу: СН2-О-СО-R1 │ СН-О-СО-R2 │ СН2-О-Р-(ОН)-О-А ║ О где А – эфирно связанный спирт. Фосфатиды делятся на несколько групп в зависимости от природы аминоспирта. Лецитины – в качестве аминоспирта содержат холин СН2(ОН)-СН2-N(CH3)3 │ OH Общее строение лецитинов: СН2-О-СО-R1 │ СН-О-СО-R2 │ 31 СН2-О-Р(ОН)-О-СН2-СН2-N(CH3)3 ║ │ O OH Кефалины – с аминоспиртом коламином НО-СН2-СН2-NН2 Общее строение кефалинов: СН2-О-СО-R1 │ СН-О-СО-R2 │ СН2-О-Р(ОН)-О-СН2-СН2-NН2 ║ O Серинфосфатиды – с фосфорной кислотой соединена аминокислота серин за счет спиртового гидроксида серина с общим строением: СН2-О-СО-R1 │ СН-О-СО-R2 │ СН2-О-Р(ОН)-О-СН2-СН-NН2 ║ │ O СООН Вещества этих групп очень близки друг к другу, могут легко превращаться одно в другое и в нейтральные жиры. Цереброзиды – липоиды, в значительном количестве присутствуют в мозговой ткани. Характеризуются присутствием в молекуле сахара галактозы и ненасыщенного аминоспирта сфингозина, а так же высшей жирной кислоты. Общая структура цереброзидов: СН3-(СН2)12СН=СН=СН(ОН) – СН-СН2 – О-СН │ │ NH H-C-OH │ │ CO-R HO-C-H O │ HO-C-H │ H-C │ CH2OH 32 Цереброзиды, благодаря наличию сильно гидратированной молекулы сахара, обладают гидрофобными и гидрофильными свойствами. В природе широко распространены спирты, производные циклопентанпергидрофенантрена – стеролы и их эфиры с жирными кислотами – стериды. В живых организмах наиболее распространенным стеролом является холестерин и его эфиры, в дрожжах – эргостерол: СН(СН3)-СН2-СН2-СН2-СН(СН3)2 │ СН3 │ │ СН3 НОхолестерол СН3 │ СН(СН3)-СН=СН-СН-СН(СН3)2 │ СН3 │ │ СН3 НОэргостерол Эргостирол – предшественник витамина D. К этой же группе веществ принадлежат многие биологически активные вещества, такие как половые гормоны, желчные кислоты, гормоны коры надпочечников и другие. Контрольные вопросы. 1. Дайте определение классу липидов и укажите принципы их номенклатуры и классификации. 2. Какова зависимость между составом и свойствами у триглицеридов? 3. Приведите формулы высших жирных кислот, найденных в составе триглицеридов, фосфатидов, гликолипидов. 4. Приведите формулы строения холестерола и эргостерола. 33 5. Дать определение понятиям «число омыления», «йодное число». Лекция № 6 Витамины. План. 1. Определение, номенклатура и классификация витаминов. 2. Водорастворимые витамины. Отдельные представители. Гиповитаминоз. 3. Жирорастворимые витамины. Отдельные представители. Авитаминоз. Витамины характеризуются как группа органических веществ, обладающих разнообразным строением и физико-химическими свойствами, не синтезируемых или частично синтезируемых в организме и выполняющих каталитические функции непосредственно или в составе специфических биокатализаторов. Известно три вида номенклатуры: буквенная, химическая (официально признанная международная) и физиологическая (по отношению к человеку). Например: витамин А – ритинол, антиксерофтальмический; витамин D – кальциферол, антирахитический; витамин Е - токоферол, антистерильный; витамин К – филлохинон, антигеморрагический; витамин В1-тиамин, антиневрический; витамин В2 - рибофлавин, витамин роста; витамин В3 - пантотеновая кислота, антидерматитный фактор; витамин В5 (РР) – никотиновая кислота и никотинамид, антипеллагрический; витамин В6 - пиридоксин, антидерматитный; витамин В12 - цианкобаломин, антианемический; витамин С - аскорбиновая кислота, антискорбутный; витамин Н - биотин, антисеборрейный; витамин Р - рутин, капилляроукрепляющий. Классификацию витаминов осуществляют по их растворимости в воде и жировых растворителях, т. е. группа водорастворимых витаминов и группа жирорастворимых витаминов. Витамины А, D, К, Е – жирорастворимые; витамины группы В, С, Н, Р – водорастворимые. При отсутствии витаминов в пище развиваются заболевания – авитаминозы. Жирорастворимым и некоторы водорастворимым витаминам свойствена витамерия; явление это состоит в том, что физиологическим действием, характерным для того или иного витамина, обладает не одно, а несколько сходных по химическому строению соединений. Такие вещества носят название витамеров. Жирорастворимые витамины. Витамин А (ретинол) имеет несколько витамеров. Аитамин А1 имеет строение полиизопреноида: 34 СН3 │ Н3С-С Н2С │ Н2С СН3 СН3 │ │ С-СН=СН-С=СН-СН=СН-С=СН-СН2ОН ║ С-СН3 СН2 Витамин А2 отличается от витамина А1 добавочной двойной связю в шестичленном цикле: СН3 │ Н3С-С СН3 СН3 │ │ Н2С С-СН=СН-С=СН-СН=СН-С=СН-СН2ОН │ ║ НС С-СН3 СН Витамины группы А легко окисляются как в лабораторных условиях (посредством двуокиси марганца), так и в организме. Окисление в организме осуществляется при участии биокатализаторов, ретинол превращается в ретиналь: СН3 │ Н3С-С Н2С │ Н2С СН3 СН3 │ │ С-СН=СН-С=СН-СН=СН-С=СН-СН2ОН ║ С-СН3 - 2 Н▪ СН2 СН3 │ Н3С-С Н2С │ Н2С СН3 СН3 │ │ С-СН=СН-С=СН-СН=СН-С=СН-СН=О ║ С-СН3 35 СН2 При отсутствии кислорода ретинол даже при 100 оС и выше достаточно устойчив. В живых организмах и тканях витамин А часто находится в форме сложных эфиров с уксусной и пальмитиновой кислотами. В таком виде он полностью активен и более устойчив. При отсутствии витамина А в пище в организме развивается ослабление зрения («куриная» слепота), поражение эпителиальных тканей, в том числе роговицы глаза. Источники витамина А: рыбий жир, сливочное масло и красномякотные овощи (морковь, перец, томаты и др.). Витамин D (кальциферол)- существует в виде нескольких витамеров, наиболее распространены D2 и D3. Их можно рассматривать как производные стеролов. Провитаминами D2 и D3 являются соответственно эргостерол и холестерол, которые переходят в активную форму в результате размыкания связи между 9 и 10-м углеродными атомами кольца В под действием солнечной радиации. При отсутствии в рационе детей витамина D развивается широко известное заболевание – рахит. Источники витамина D: рыбий жир, сливочное масло, желток яйца, печень животных, молоко. Витамин Е (токоферол) – имеет витамеры α-, β- и γ - токоферолы (токо – потомство, ферро – несу). Разработан промышленный синтез α- токоферола. Его строение таково: СН3 │ С СН2 НО-С С СН2 СН3 СН3 СН3 │ ║ │ │ │ │ Н3С-С С С-(СН2)3-СН-(СН2)3-СН-(СН2)3-СН-СН3 С О СН3 │ СН3 β- токоферол отличается от α– токоферола отсутствием метильной группы в 7-ом положении: СН3 │ С СН2 НО-С С СН2 СН3 СН3 СН3 │ ║ │ │ │ │ НС С С-(СН2)3-СН-(СН2)3-СН-(СН2)3-СН-СН3 С О СН3 │ СН3 36 У γ – токоферола нет метильного радикала в пятом положении: СН НО-С │ Н3С-С СН2 С ║ С СН2 СН3 СН3 СН3 │ │ │ │ С-(СН2)3-СН-(СН2)3-СН-(СН2)3-СН-СН3 СН3 С О │ СН3 Токоферолы оптически активны, устойчивы, выдерживают нагревание на воздухе до 170 оС. Разрушаются при действии УФ-лучей. Е-авитаминоз выражается в отсутствии условий нормального развития эмбриона в организме у матери и дегенеративном изменении репродуктивных органов, сопровождающихся развитием мышечной дистрофии. Источники витамина Е: растительные масла, салат, капуста и зерновые продукты. Витамин К (филлохинон) существует в виде двух витамеров К1 и К2 , являются производными нафтохинона: О ║ С СH HC │ HC C ║ C СН3 СН3 │ │ C–СН2-СН=С-[(СН2)3-СН]3-CH3 ║ C -CH3 CH C ║ O Витамин К регулирует процесс свертывания крови. Аналогичным физиологическим действием обладают многие производные нафтохинона. Из них широкое практическое применение нашел синтетический препарат викасол: О ║ СH С HC C CН │ ║ ║ HC C C -CH3 CH C HO ОSO2Na Витамин К очень неустойчив при нагревании в щелочной среде и при УФоблучении. Витамин К способствует синтезу компонентов, участвующих в свертывании крови, положительно влияет на состояние эндотелиальной оболочки кровеносных сосудов. При его недостатке могут возникнуть 37 произвольные кровотечения (носовые, кровавая рвота, внутренние кровоизлияния). Источники витамина К: томаты, зеленые части растений, печень животных. Водорастворимые витамины. Витамин В1 (тиамин, антианеврин) содержит пиримидиновый цикл и тиазольный и имеет строение: СН N │ H3C-C + C - CH2 - N ║ ║ C – NH2 HC N C-CH3 ║ C- CH2-CH2-OH)ClS При В1-авитаминозе развивается заболевание, получившее название полиневрита (бери-бери). Оно состоит в прогрессирующей дегенерации нервных окончаний и проводящих пучков. Механизм действия витамина детально исследован. В организме человека и животных он превращается в тиаминопирофосфат, который является активной группой специфических биокатализаторов, ускоряющих распад в организме пировиноградной кислоты путем ее прямого декарбоксилирования или путем окислительного декарбоксилирования: СН N │ H3C-C N + C - CH2 - N ║ ║ C – NH2 HC C-CH3 ОН ОН ║ │ │ C- CH2-CH2-O-Р-О-Р-ОН S ║ ║ О О тиаминпирофосфат СН3-СО-СООН → СО2 + СН3-СН=О СН3-СО-СООН + (О) → СО2 + СН3-СООН Пировиноградная кислота в значительных количествах возникает в организме при окислении углеводов. Подвергаясь декарбоксилированию, она связывает превращения углеводов с превращениями белков и липидов, являясь, таким образом, одним из центральных звеньев в биохимических процессах. Если декарбоксилирование пировиноградной кислоты не происходит (при отсутствии тиаминпирофосфата), нарушаются процессы взаимопревращения углеводов, белков и липидов, вследствие чего возникают тяжелые патологические изменения в организме, так как накапливающаяся пировиноградная кислота представляет собой сильный яд для нервной системы. При В1-авитаминозе 38 нарушаются процессы декарбоксилирования и других кетонокислот, таких как щавелевоуксусная, кетоглутаровая и др., что сильно сказывается на состоянии организма. Источники витамина В1: хлеб и крупы с зародышами и оболочкой, пивные и пекарские дрожжи. Витамин В2 (рибофлавин, витамин роста) – состоит из диметилированного цикла изоаллоксазина, соединенного с остатком рибозы, принадлежит к группе флавинов. Наличие в нем остатка рибозы дало основание назвать его рибофлавином: СН2- (СНОН)3-СН2ОН │ CH N N H3C-C C C C=O │ ║ │ │ H3C-C C C NH CH N C ║ O В живом организме рибофлавин легко фосфорилируется, образуя простетическую группу ряда ферментов, катализирующих окислительновосстановительные процессы. При недостатке витамина В2 нарушается синтез окислительновосстановительных ферментов, искажается течение окислительновосстановительных процессов, дающих энергию для роста и развития организма – рост организма приостанавливается. Поэтому витамин В2 называют растворимым витамином роста. Авитаминоз В2 выражается в остановке роста, выпадении волос, поражении слизистых оболочек, нарушении нормального синтеза гемоглобина; возникают патологические изменения в нервной системе. Источники витамина В2: молоко, зеленые овощи, печень и почки животных, пивные и пекарские дрожжи. Витамин В5 или РР (никотиновая кислота, никотинамид, антипелларгический). Никотинамид и никотиновая кислота извесны очень давно и имеют строение: СН СН НС С-СООН НС С-СОNH2 │ ║ │ ║ HC CH HC CH N N никотиновая кислота амид никотиновой кислоты Эти вещества предохраняют от заболевания пеллагрой и излечивают уже возникшие заболевания. Механизм действия никотиновой кислоты и ее амида выяснен. Установлено, что амид никотиновой кислоты входит в состав ряда важнейших соединений, принимающих активное участие в окислительновосстановительных реакциях в организме. Один из них никотинамидадениндинуклеотид (НАД). 39 Никотиновая кислота и ее амид широко распространены в растительных и животных объектах. Источники витамина РР: пшеничный хлеб, печень и почки животных, картофель и многие др. продукты. Витамин В6 (пиридоксин, антидерматитный) – рассматривают как сочетание трех индивидуальных веществ: пиридоксола, пиридоксаля и пиридоксамина: СН2-ОН СН=О СН2-NH2 │ │ │ C C C HO-C C-CH2-OH HO-C C-CH2OH HO-C C-CH2OH │ ║ │ ║ │ ║ H3C-C CH H3C-C CH H3C-C CH N N N Пиридоксол Пиридоксаль Пиридоксамин Каждое из них обладает свойствами витамина, так как в организме способно переходить в пиридоксальфосфат, который и принимает участие в химических реакциях, связанных с деятельностью данного витамина: СН=О │ C HO-C C-CH2 – O - Р(ОН)2 │ ║ ║ H3C-C CH О N Пиридоксальфосфат Пиридоксальфосфат является составной частью биокатализаторов, ускоряющих реакции декарбоксилирования ряда аминокислот, а также реакции переаминирования аминокислот с кетонокислотами. Примером реакции переаминирования может служить следующий процесс: пиридоксальфосфат НООС-СН2-СН2-СН(NH2)-COOH + CH3-CO-COOH Глутаминовая кислота Пировиноградная кислота НООС-СН2-СН2-СО-COOH + CH3-C(NH2)-COOH α-кетоглутаровая кислота аланин Эта реакция особенно важна, так как она занимает центральное место в превращениях аминокислот, обеспечивая необходимый фонд их для синтеза белков в организме. Отсутствие в пище пиридоксина сопровождается резким нарушением обмена белков, нарушается кроветворение, развиваются различные дерматиты, которые не поддаются лечению никотиновой кислотой. Источники витамина В6: говядина, рыба, горох, яичный желток, зеленые части растений. 40 Витамин С (аскорбиновая кислота, антискорбутный) – производное углевода Lгулозы, превращенную в L-дикетогулоновую кислоту с последующей ее лактонизацией и восстановлением: СООН │ С=О │ С=О │ -Н2О Н-С-ОН │ НО-С-Н │ СН2ОН L-дикетогулоновая кислота С=О С=О │ │ С=О С-ОН │ ║ С=О + 2Н С-ОН │ │ Н-С Н-С │ │ НО-С-Н НО-С-Н │ │ СН2ОН СН2ОН L-лактон дикетогуло- L-аскорбиновая новая кислота ваяя кислота Аскорбиновая кислота легко отдает и принимает два атома водорода, переходя соответственно дегидроаскорбиновую кислоту, и наоборот. Это важнейшее свойство лежит в основе механизма действия аскорбиновой кислоты в организме: она является участником окислительно-восстановительных систем и обеспечивает нормальное протекание жизненно важных процессов в тканях. При недостаточном поступлении витамина С с пищей развивается специфическое заболевание – цинга, вследствие нарушения синтеза склеивающего межклеточного белка – коллагена, а это вызывает патологические изменения сосудистых стенок и опорных тканей. Источники витамина С: разнообразные продукты растительного превращения (черная смородина, плоды шиповника, лимоны, капуста). Витамин Н (биотин, антисеборрейный) –гетероциклическая монокарбоновая кислота: О- - - - - - -НО ║ │ С С=O НN NH CH2 │ А │ │ HC CH CH2 │ В │ │ H2 C CH-CH2– CH2 S Гетероциклическая часть молекулы состоит из имидазольного (А) и тиофенового (В) циклов, а боковая цепь представлена остатком валериановой кислоты. Между кислородом кетонной группы имидазольного цикла и водородом гидроксильной группы карбоксила боковой цепи замыкается 41 водородная связь, имеющая большое значение для функциональной активности биотина. Необходимость биотина для нормальной жизнедеятельности отражена в его названии (биос-жизнь). При недостатке этого витамина наступает ряд патологических изменений: воспаление кожных покровов, выпадение волос, усиление выделения жира сальными железами кожи (себорея). Механизм действия биотина многообразен, но главная его роль состоит в том, что он входит в состав фермента, ускоряющего реакции карбоксилирования, например, пировиноградной кислоты, связывающее взаимопревращение в организме углеводов и белков: карбоксилирование СН3 –СО-СООН + СО2 НООС-СО-СН2-СООН пировиноградная щавелевоуксусная кислота кислота Участие биотина в реакции карбоксилирования важно и для синтеза жирных кислот. Биотин причастен к биосинтезу белков, пуриновых оснований и ряда других важнейших соединений. Источники биотина: печень крупного рогатого скота, молоко, соя, горох. Витамин В3 (пантотеновая кислота, антидерматитный фактор) – N-(α, γ-диоксиβ, β-диметилбутирил) –β-аланин: СН3 │ НОСН2-С – СН – СО-NH-СН2-СН2-СООН │ │ Н3С ОН Пантотеновая кислота содержится во всех животных, растительныхи микробных объектах. Она малоустойчива, легко окисляется и гидролизуется в присутствии кислот и щелочей по пептидной связи. При недостатке пантотеновой кислоты в организме животных и человека развиваются различные патологические явления: поражение кожных покровов и слизистых оболочек внутренних органов, дегенеративные изменения ряда органов и тканей, потеря волосяного покрова и депигментация волос и др. Это объясняется тем, что пантотеновая кислота входит в состав исключительно важного органического соединения –коэнзима А, который занимает ключевые позиции в синтезе и расщеплении жирных кислот и обеспечивает осуществление реакций, необходимых для взаимопревращения углеводов и жиров: Н2N │ C N C N │ ║ ║ O O HC C CH ║ ║ N N CH-(CHOH)2-CH2-O-P-O-P-O-CH2-C(CH3)2-CH(OH) │ │ │ OH OH │ 42 C=O │ HS-CH2 -CH2 NH-CO-CH2-CH2-NH Коэнзим А играет существенную роль в процессах ацетилирования, в цикле Кребса, при β - окислении жирных кислот, при синтезе многих липоидов. Источники пантотеновой кислоты: дрожжи, печень, зеленые части растений, в небольших количествах она содержится во всех пищевых продуктах. Кроме того, пантотеновая кислота синтезируется микрофлорой кишечника. Контрольные вопросы. 1. Дайте общую характеристику классу витаминов и изложите принципы их классификации и номенклатуры. 2. Определите, к какому классу органических соединений относится каждый из известных вам витаминов. 3.Охарактеризуйте механизм действия пантотеновой кислоты и биотина. 4. Охарактеризовать авитаминозы D, С, РР, А. 5. Каковы природные источники витамина С, А, Е? 6. В каких продуктах содержится много витаминов РР, В6, В2 ? 7. Приведите формулы витамина С, А, РР, Н. 8. Составьте формулу коэнзима А и охарактеризуйте его роль в процессах жизнедеятельности. Лекция № 7 Ферменты. План. 1. Определение и общая характеристика ферментов, свойства. 2. Классификация и номенклатура ферментов. 3. Отдельные представители ферментов, их химическая природа, специфичность, назначение. Ферменты, это катализаторы белковой природы, ускоряющие протекание химических реакций. Первые исследования, посвященные ферментам, осуществил И.П.Павлов. Основные свойства ферментов состоят в следующем: 1.Ферменты термолабильны и легко инактивируются при нагревании; 2. Ферменты имеют температурный оптимум активности; 3. Ферменты имеют оптимум действия при определенном значении рН. 4. Ферменты строго специфичны в своем действии. 5. Ферменты не смещают положение равновесия, а только ускоряют его достижение, т. е. ускоряют прямую и обратную реакцию. 6. Ферменты проявляют свою активность в очень малых количествах. 7. Ферменты нуждаются в присутствии активаторов, под которыми следует понимать: а) специальные белковые вещества – коэнзимы; б) ионы металлов – марганца, магния, кобольта, натрия и др.; в) изменение рН-среды. 8. Ферменты легко инактивируются ферментными ядами. Номенклатура и классификация ферментов. 43 К настоящему времени известно более 800 различных ферментов. По рациональной номенклатуре всем ферментам присвоено окончание «аза». Фермент называют или по субстрату, на который он действует, или по реакции, которую он ускоряет. Например, ферменты, расщепляющие белки называют проте-азы, ферменты, гидролизующие жиры - лип-азы. Многие ферменты называют по принципу катализируемых реакций, например, дегидрогеназы отщепляют водород, гидролазы – ускоряют гидролиз и т. д. Встречаются и исторически сложившиеся названия (пепсин, трипсин, птиалин). Классификация ферментов, принятая в 1961 г. Международным биохимическим союзом делит все ферменты на шесть классов в соответствии с характером ускоряемых реакций: 1. Гидролазы 2.Трансферазы 3. Оксидоредуктазы 4. Лиазы 5.Лигазы 6. Изомеразы. Гидролазы ускоряют реакции расщепления (иногда синтеза) органических соединений при участии воды: R1-R2 + HOH → R1H + R2-OH В зависимости от субстрата гидролазы включают ряд групп: 1. Эстеразы осуществляют гидролиз и синтез сложных эфиров. 2. Гликозидазы ускоряют реакции гидролиза гликозидов, в том числе углеводов. 3. Пептидгидролазы ускоряют реакции гидролиза (иногда синтеза) белков, пептидов и других соединений, содержащих пептидные связи. 4. Гидролазы, действующие на С-N - связи, отличные от пептидных (уреазы, аспарагиназы, глутаминазы и др.). Трансферазы ускоряют реакции переноса атомных групп и молекулярных остатков от одного соединения к другому. В зависимости от характера переносимой группы различают: 1.Фосфотрансферазы 2. Аминотрансферазы 3. Гликозилтрансферазы 4. Ацилтрансферазы. Фосфотрансфераза ускоряет реакции переноса фосфорной кислоты. Перенос фосфатных групп идет на спиртовые, карбоксильные, азотсодержащие, фосфорсодержащие и другие группы. В связи с различностью переносимых групп определены некоторые подгруппы: а) Гексокиназа – фермент, способный переносить остаток фосфорной кислоты от АТФ к глюкозе. б) Аминотрансферазы ускоряют реакции переаминирования и отличаются друг от друга белковой частью. в) Гликозилтрансферазы ускоряют реакции переноса гликозидных остатков от молекул фосфорных эфиров и других соединений к молекулам моноз, диоз и 44 других веществ, т. е. обеспечивают биосинтез олиго- и полисахаридов у животных и растений. г) Ацетилтрансферазы ускоряют процесс переноса ацилов на аминокислоты, амины, спирты и др. соединения под действием ацилкоэнзима А. Оксидоредуктазы ускоряют реакции окисления-восстановления. Окисление протекает как процесс отнятия водорода или электрона от субстрата, а восстановление – как присоединение водорода или электрона к акцептору. Лиазы – это ферменты, ускоряющие негидролитические реакции распада органических соединений по связям С-С, C-N, С-О и др. Некоторые из реакций обратимы, поэтому такие ферменты можно считать как распад и синтез. Известны следующие группы лиаз: а) декарбоксилазы, катализируют реакции карбоновых кислот, кетонокислот, аминокислот: пируватдекарбоксилаза СН3-СО-СООН СО2 + СН3-СН=О оксалатоацетатдекарбоксилаза НООС-СН2-СО-СООН СО2 + СН3-СО-СООН лизиндекарбоксилаза H2N- CH2-(CH2)3-CH(NH2)-COOH CO2+ H2N-(CH2)5-NH2 кадаверин Декарбоксилазы представлены протеидами, а их простетические группы чаще всего растворимые витамины, например, В1 для кетонокислот, В6 для аминокислот. Вторая группа лиаз – гидротазы, ускоряют реакции гидратирования и дегидратирования органических соединений, например, фумаратгидротаза: СООН │ СН-ОН НООС-С-Н │ ║ + Н 2О СН2 Н-С-СООН │ СООН Яблочная кислота Фумаровая кислота Реакция может осуществляться в прямом и обратном направлении. Третья группа – альдолазы, катальзируют реакции расщепления фруктозодифосфата до фосфотриоз. Наряду с реакциями распада, некоторые лиазы, например, цистеинсинтаза, ускоряют реакции синтеза: цистеинсинтаза НО-СН2-СН(NH2)-COOH + H2S HS-CH2-CH(NH2)-COOH + H2O Лигазы (синтетазы) – ускоряют реакции только синтеза, откуда произошло их второе название (синтетазы), но главная особенность лигаз - сопряженность 45 синтеза и распада веществ, способных поставлять энергию для осуществления биохимического процесса. Одним из таких соединений является АТФ. При отрыве от АТФ остатков фосфорной кислоты (1 или 2) выделяется большое количество энергии, используемой для активирования реагирующих веществ. Лигазы, кроме С-N-связей, катализируют C-C –связи (удлинение углеродной цепи), C-O – связи (синтез белков), C-S – связи (синтез ацил-коэнзим – Асинтетазы). Изомеразы – ферменты, ускоряющие процессы внутримолекулярных превращений. Эти превращения могут состоять во внутримолекулярном переносе водорода, фосфатных и ацильных групп, пространственном расположении, перемещении двойных связей и т. п. Например, внутримолекулярный перенос водорода осуществляет триозофосфатизомераза (реакция обратима): СН=О │ триозофосфатизомераза СН-ОН О │ ║ СН2-О – Р – ОН │ ОН 3-фосфатглицериновый альдегтд СН2-ОН │ С=О О │ ║ СН2-О-Р-ОН │ ОН Фосфодиоксиацетон Таким образом, ферменты ускоряют огромное количество химических процессов и играют важнейшую роль в динамической биохимии. Контрольные вопросы. 1. Дать определение понятию «ферменты» 2. Каков механизм действия ферментов? 3. Охарактеризуйте химическую природу ферментов и закономерности в строении их молекул. 4. Принципы классификации и номенклатуры ферментов. 5.Перечислити особенные свойства ферментов. 6. Детально охарактеризуйте каждый класс ферментов: деление на группы, химизм каталитических реакций, свойства отдельных представителей. 46 Лекция № 7-8 Гормоны. План. 1. Определение, номенклатура и классификация гормонов. 2. Отдельные представители гормонов и их функции. 3. Гормоны щитовидной и паращитовидной желез. 4. Гормоны поджелудочной железы, гипофиза и нейрогипофиза, гормон раста. 5. Тиреотропный гормон, АКТГ, прочие гормоны. Гормоны – вещества белковой природы, продуцируемые в железах внутренней секреции. По предложению Е.Н.Старлинга в 1905 г. Такие вещества назвали гормонами от греческого «гармао» - в переводе означающие побуждаю, возбуждаю, поощряю, которые оказывают сильнейшее влияние на процессы обмена веществ и функционирование органов и тканей. Вещества с аналогичной функцией, но образующиеся вне желез внутренней секреции, принято называть гормоноидами. Деятельность желез внутренней секреции, продуцирующих гормоны, находится под контролем ЦНС. Номенклатура и классификация гормонов. К настоящему времени известно несколько десятков гормонов и многие из них имеют известную химическую природу, но химическая номенклатура громоздка и сложна. Поэтому предпочтение отдано тривиальным, исторически сложившимся названиям, отражающим либо функцию, либо происхождение гормона (инсулин, тестостерон и др.). Классификация гормонов имеет двойственное положение. Первая основана на происхождении гормонов и включает следующие группы: 1. Тиреоидные гормоны, образующиеся в щитовидной железе (тироксин, трийодтиронин, дийодтиронин и др.). 2.Паратиреоидный гормон, возникающий в околощитовидных железах. 3. Адренальные гормоны, синтезируемые в надпочечниках (адреналин, кортикостерон, гидрокортизон, альдостерон и др.). 4. Панкреатические гормоны – синтезируются в поджелудочной железе (инсулин, глюкакон). 5. Половые гормоны, куда входят: а) тестикулярные (тестостерон), синтезируются в семенниках; б) овариальные (эстрадиол), синтезируются в яичниках. 6. Гипофизарные гормоны, вырабатываемые в гипофизе (окситоцин, вазопрессин, гормон роста – саматотропин, аденокортикотропин и др.). 7. Гормоны органов пищеварения, синтезируемые слизистой желудка и кишечника (гастрин, секретин и др.). 8. Гормоны зобной железы. Вторая - химическая классификация гормонов включает три главные группы: 1.Стероидные гормоны. Они синтезируются в надпочечниках, семенниках, яичниках, печени, плаценте и т. д. Представители – кортикостерон, гидрокортизон, альдостерон, тестостерон, эстрадиол. 2. Пептидные гормоны – химическая природа их полипептидная. Синтезируются в околощитовидной, поджелудочной железах, гипофизе, слизистых 47 пищеварения. Представители – паратиреоидный гормон, инсулин, глюкагон, окситоцин, вазопрессин, гормон роста и др. 3. Прочие гормоны – все остальные гормоны. Синтезируются в щитовидной железе, надпочечниках и других железах. Представители – тироксин, адреналин и др. Рассмотрению подлежат следующие гормоны: 1. Гормоны щитовидной железы – тиреоглобулин и йодтироксин. Йод в щитовидной железе находится в трех формах: неорганический, органический – гормонально неактивный, органический, связанный с гормонами щитовидной железы При повышенной функции железы доля йода (задействованы все три формы), связанного с гормонами возрастает вдвое от нормы, возникает гипертиреоидизм. При гипофункции в раннем возрасте возникает кретинизм, а у взрослых зоб. Гипер- и гипофункции щитовидной железы зависят в первую очередь от ЦНС, действующей через тиреоидный гормон гипофиса. 2. Гормон паращитовидной железы – паратгормон, полипептид с молекулярной массой 9500. Гипофункция – снижение уровня кальция в крови до 5 – 6 мг %, развивается судорожное состояние. Гиперфункция – повышенное содержание кальция и фосфора в крови, наблюдается отложение кальция и фосфора в жизненно важных органах, ухудшается функция почек, а кости приобретают ломкость. 3. Гормоны поджелудочной железы. Поджелудочная железа обладает двойственной функцией – секреторной и инкреторной. Островки Лангерганса вырабатывают два гормона инсулин и глюкагон. Регулируют углеводный обмен. Инсулин способствует: 1. Снижению гликогенолиза в печени и усилению превращения глюкозы на периферии; 2. Влияет на синтез жирных кислот, при недостатке его их синтез угнетается; 3. Играет важную роль в обмене аминокислот, так как в его присутствии усиливается синтез белков. Основное действие инсулина – снижение сахара в крови. При его недостатке концентрация сахара в крови сильно увеличивается, а содержание гликогена в тканях снижается, что приводит к заболеванию под названием диабет. Глюкагон по своему действию противоположен инсулину, так как способствует повышению концентрации сахара в крови. Гликагон вырабатывается α-клетками островков Лангерганса. Действие гликагона на уровень сахара в крови связано с активированием фосфорилаз. Под их действием усиливается распад гликогена в печени и возрастает содержание глюкозы в крови в виде глюкозо-1-фосфата 4. Гормоны гипофиза – тесно связаны с ЦНС. Играют важную роль в синтезе желез внутренней секреции (эндокринной системы). У человека важны передняя (аденогипофиз) и задняя (нейрогипофиз) доли гипофиза. Аденогипофиз вырабатывает шесть различных гормонов: 48 1. Гормон роста (соматотропный гормон) – стимулирует рост клеток всего тела в юношеском возрасте, особенно рост костей в длину. При кислотном гидролизе гормональные свойства утрачиваются, при ферментативном - частично сохраняются. При гиперфункции гипофиза возникает гигантизм, непропорциональное разрастание костей, увеличение усвоения аминокислот, увеличение веса. При гипофункции гипофиза в молодом возрасте наблюдается карликовость, у взрослых – нарушение липидного обмена, т. е. возникает ожирение. 2. Тиреотропный гормон (стимулирует щитовидную железу) – не получен в чистом виде. У различных животных содержание этого гормона различно. Он циркулирует в крови в связанном виде с β - глобулином плазмы. При его недостатке нарушается деятельность щитовидной железы и утрачивается способность к накоплению йода. 3. Аденокортикотропный гормон (АКТГ) – усиливает скорость синтеза стероидных гормонов коры надпочечников. В химическом отношении АКТГ представляет пептид из 39 аминокислотных остатков. Набор аминокислот АКТГ различных животных одинаков, отличие состоит в первичной структуре,т. е. порядке соединения этих аминокислот. При избытке АКТГ синтез стероидных гормонов коры надпочечников усиливается и наблюдается снижение в крови аскорбиновой кислоты и холестерина, возникает повышенное возбуждение нервной системы, болезнь Кушинга (ожирение, увеличение сахара в крови, нарушение процессов окостенения). 4. Гонадотропный гормон. Атрофия гипофиза сопровождается развитием болезни Симмондса, для которой характерно прекращение функции половых желез. В этом процессе участвуют три гормона гипофиза Один из низ фоликулостимулирующий гормон вызывает у мужчин усиление спермогенеза, а у женщин – образование фолликулов в яичниках. 5. Фолликулостимулирующий гормон. Действие его связано с обменом стероидов. У женщин он ускоряет созревание фолликул и образование желтого тела. 6. Лютеотропный гормон, иначе называют пролактином, который вызывает многообразное действие: а) возбуждает в клетках желтого тела секрецию гормонов; б) вместе с некоторыми половыми гормонами, например, эстрогеном вызывают пролиферацию молочных желез и образование молока. Нейрогипофиз вырабатывает два гормона – окситоцин и вазопрессин. Вазопрессин обладает антидиуретическим действием и способствует повышению кровяного давления. Окситоцин стимулирует сокращение матки и секрецию молочных желез. Химическая природа окситоцина и вазопрессина расшифрована, что позволило синтезировать их аналоги с совпадающей активностью Строение их можно представить в виде входящих в их состав аминокислот: 49 про-лей-гли-NH2 │ цис- асп – NH2 S глю-NH2 │ │ S илей цис тир про-лиз-гли-NH2 │ цис-асп – NH2 S глю-NH2 │ │ S вал цис тир окситоцин вазопрессин Отличие окситоцина и вазопрессина незначительно, в четырех аминокислотах. Активность вазопрессина связана с наличием лизина (основные свойства), способность к повышенному восприятию воды обусловлена наличием дисульфидной связи. Из средней доли гипофиза изолирован гормон интермедин, оказывающий влияние на пигментацию кожи животных. Все гормоны гипофиза – полипептиды, структура большинства расшифрована, что позволяет получать их синтетически. 5. Гормоны надпочечников. Надпочечники – парный орган, левый меньше правого. Морфологически и функционально надпочечники делят на корковый (наружный) и мозговой (внутренний) слои. Мозговой слой секретирует два гормона – адреналин и норадреналин, следы изопропиладреналина. Синтез адреналина и норадреналина контролируется симпатической нервной системой, при ее раздражении синтез этих гормонов увеличивается приблизительно в 5 раз. Действие адреналина проявляется в его влиянии на углеводный обмен, повышается кровяное давление, но не меняется в сосудах мозга и легких. Под влиянием адреналина усиливается сокращение гладкой мускулатуры (матка, сердце), расширяется зрачек, расслабляется мускулатура бронхов и кишечника, деятельность сердца усиливается. По химической природе адреналин, норадреналин и изопропиладреналин являются производными пирокатехина, содержащего в положении 4 остаток – СН(ОН)СН2-NH-CH3 (адреналин), -СН(ОН)-СН2-NH2 (норадреналин) и -СН(ОН)-СН2-NH-CH(CH3)2 (изопропиладреналин). Физиологическая роль адреналина и его аналогов зависит не только от их самих, но и от продуктов их обмена. Например, окислительный процесс под действием пирокатехиноксидазы идет с образованием адреналинхинона черех адренохром до адренолютина. Адренохром – «вещество страха», так как при его взаимодействии с глютаминатдекарбоксилазой мозга развивается психотропный эффект, возникают галлюцинации. Адренолютин, наоборот, снимает чувство страха. Биосинтез адреналина и его гомологов осуществляют из тирозина под действием ферментов. 6.Гормоны половых желез. Половые железы вырабатывают гормоны под влиянием гормонов гипофиза, оказывают влияние на вторичные половые признаки 50 Семенники секретируют андрогенные гормоны, основной из них тестостерон. Его можно получить синтетически из холестерина. Химическая природа стероидная. Гиперфункция тестостерона приводит к увеличению семенников, усилению секреции спермы, форимрованию вторичных половых признаков. Гипофункция тестостерона – атрофия мужских органов. Женские половые гормоны (эстрагены) представлены тремя гормонами - эстрон, эстрадиол, эстриол. Эстрогены вызывают: а) увеличение матки и утолщение ее слизистой оболочки; б) рост грудных желез; в) развитие вторичных половых признаков женщин; г) стимулируют деление клеток и образование костной ткани. Гормоны желтого тела называются гестагены. Их роль состоит в завершении подготовки матки для восприятия оплодотворенного яйца, необходимы для поддержания беременности. К гестагенам относятся прегнандиол и прогестерон. Эти гормоны способствуют выделению из организма эстрогенов. Половые гормоны находятся в стадии детального изучения. 7. Гормоны пищеварительного тракта. Работы И.П.Павлова и его школы показали, что все отделы желудочнокишечного тракта работают согласованно, благодаря рефлекторным связям и эти процессы регулируются нервными импульсами и гормонами. Слизистая тонкого кишечника вырабатывает гормон – секретин, который усиливает функцию поджелудочной железы. Предполагают, что секретин – полипептид, его структура еще выясняется. Слизистая желудка вырабатывает гормон гастрин, который стимулирует секрецию соляной кислоты. Гормон вилликинин, вызывает сокращение кишечных ворсинок. Контрольные вопросы. 1. Дать определение гормонам и гормоноидам. 2. Номенклатура гормонов. 3. Классификация гормонов по происхождению. 4. Химическая классификация гормонов. 5. Гормоны поджелудочной железы: инсулин, гликогон, их действие 6. Аденогипофиз и его гормоны 7. Нейрогипофиз, его гормоны и их химическая природа. 8. АКТГ, химический состав, физиологическое действие, гиперфункция. 9. Составить схематичное строение окситоцина и вазопрессина, их физиологическое действие. 10.Гормоны надпочечников: химическая природа, физиологическое действие, схема окислительного процесса 11.Составить схемы синтеза адреналина и его гомологов. 12. Дать характеристику половым гормонам 51 Лекция № 9 ОБМЕН УГЛЕВОДОВ. План. 1. Роль углеводов в жизнедеятельности организмов. 2. Превращения углеводов в желудочно-кишечном тракте. 3. Превращения углеводов в тканях живого организма. Синтез гликогена. 4. Анаэробный распад углеводов в тканях животных. 5. Аэробная стадия распада углеводов в тканях. Цикл Кребса. Углеводам принадлежит исключительно важная роль в жизнедеятельности как живого, так и растительного организма. Это вещества, несущие большой запас химической энергии, поэтому они используются живыми организмами как источник энергии. В живом организме в процессе дыхания обмен осуществляется суммарной реакцией окисления углеводов: С6Н12О6 + 6О2 → 6СО2 + 6Н2О На один атом углерода приходится 132 калории. В зеленых растениях идет обратный процесс синтеза углеводов: 6Н2О + 6СО2 → С6Н12О6 + 6О2 Синтез требует затраты энергии, которую растения получают от солнца, т. е. используют солнечную энергию (фотосинтез). В количественном отношении – углеводы наиболее значительная группа природных органических веществ. В организме они выполняют четыре вида функций: 1. Источник энергии. 2. Резервные вещества (крахмал растений, гликоген животных). 3. Опорные функции (клетчатка растений, хитин многих беспозвоночных). 4. Специфические функции мукополисахаридов (слизи, камеди, компоненты крови и др.) Все многообразие углеводов делят на три группы: 1. Монозы. 2. Олигосахариды (от двух до десяти). 3. Полисахариды (цепи большогочисла монозвеньев). Наибольшее значение из пентоз имеют рибоза и дезоксирибоза, которые являются составной частью ДНК и РНК. О О НО-СН2 ОН НО-СН2 ОН │ │ │ │ │ │ │ │ Н Н Н Н Н Н Н Н │ │ │ │ ОН ОН ОН Н β,D-рибофураноза 2-дезокси-β,D-рибофераноза Из гексоз наиболее важны глюкоза, фруктоза, галактоза. 52 Из диоз в живом организме найдена лактоза, остальные диозы, попадая в живой организм, распадаются в желудочно-кишечном тракте до моноз. Полисахариды – полимеры моноз. Различают: а) глюканы – крахмал (амилоза, амилопектин); б) гликоген – животный крахмал, главное депо – печень (15%), в других клетках - ≈1%; в) целлюлоза – углевод растений. Превращение углеводов в желудочно-кишечном тракте. Основными углеводами, поступающими с пищей в организм животного, являются полисахариды – крахмал, клетчатка, диозы – сахароза, лактоза, монозы – глюкоза, фруктоза. Остальные углеводы встречаются значительно реже. Начиная с ротовой полости возникают биохимические процессы, подготавливающие углеводы к их дальнейшему усвоению организмом. Слюнные железы вырабатывают фермент амилазу, расщепляющую крахмал (малая часть) до мальтозы. Продукты полураспада крахмала это декстрины, далее распадаются в кишечнике. Под действием мальтазы, сахаразы, лактазы расщепление идет до моноз – глюкозы, фруктозы, галактозы. Простые сахара всасываются стенками кишечника и поступают в кровь. В стенках кишечника глюкоза, фруктоза и галактоза фосфорилируются. Образовавшийся глюкозофосфат переносится к кровяным сосудам, дефосфорилируется и поступает в кровь. Фруктозо – и галактозофосфаты изомеризуются в фосфат глюкозы и свободная глюкоза поступает в кровь. Следовательно, какой бы углевод не поступил в организм, в кровь он поступает в виде глюкозы. Превращение углеводов в тканях живого организма. Синтез гликогена. Кровь живого организма всегда содержит некоторое количество глюкозы, в пределах 0,08 – 0,11%. После принятия пищи, даже очень богатой углеводами, уровень глюкозы увеличивается только в крови воротной вены, оттекающей от кишечника к печени. Пройдя через печень, кровь содержит норму глюкозы, а весь ее избыток остается в печени в виде гликогена. В синтезе гликогена в печени активное участие принимает АТФ. При участии гексокиназы происходит фосфорилирование глюкозы: фосфоглюкоГлюкопираноза + АТФ → АДФ + 6-фосфатглюкопираноза Мутаза 1-фосфатглюкопираноза + [С6Н7(ОН)3]х → Н3РО4 + [C6H7(OH)3]X+1….. В результате этого глюкоза исчезает, а молекула гликогена растет. Если в организме недостаток глюкозы, он пополняется гидролизом гликогена, разносится кровью по всем тканям организма, где она расходуется в процессе тканевого дыхания. Таким образом, в живом организме происходит следующая цепь превращений углеводов: 53 Пища Пищеварительный тракт амилаза крахмал →крахмал амилаза декстрин мальтаза мальтоза Печень гликоген → Кровь Мышцы и другие ткани глюкоза→ глюкоза + О2─ ↑ фосфорилаза ↑ 1-фосфатглюкоза глюкоза ↑ 6-фосфатглюкоза ↑ глюкоза + АТФ через Vena porta ↑ ↓ СО2 + Н2О Использование гликогена или глюкозы, как источников энергии происходит в две стадии. 1. Без присутствия кислорода (анаэробная стадия распада). 2. С участием кислорода (окисление – аэробный распад). Анаэробный распад углеводов в тканях животных. Анаэробный распад углеводов в тканях животных идет в несколько этапов и имеет следующую последовательность: Первый этап- это образование из гликогена 1-фосфатглюкопиранозы: фосфорилаза [С6Н7(ОН)3 ] X + H3PO4 [C6H7(OH)3]X-1 + 1- фосфатглюкопи- фосфоизомераза пираноза глюкомутаза 6-фосфатглюкопираноза Н Н ОН Н Н Н ОН │ │ │ │ │ │ │ СН2 – С – С – С – С – С Н=О ↔ СН2 - С – С – С –С – С Н2 + │ │ │ │ │ │ │ │ │ ║ │ О-Р(ОН)2 ОН ОН Н ОН О-Р(ОН)2ОН ОН Н О ОН ║ ║ О О 6-фосфатглюкоза 6-фосфатфруктоза + АТФ → АДФ + 1,6-дифосфатфруктоза. Аналогично идет превращение, если исходным веществом является глюкоза. Начинается реакция взаимодействием глюкозы с АТФ и образуется АДФ + 1,6-дифосфатфруктозы. 54 Второй этап состоит в распаде 1,6-фифосфатафруктозы с образованием 3фосфатглицеринового альдегида и монофосфатоксиацетона: Н Н ОН │ │ │ СН2 - С – С – С – С – СН2 → СН2 – СН–СН=О + СН2 – С – СН2 │ │ │ │ ║ │ │ │ │ ║ │ ОР(ОН)2 ОН ОН Н О ОР(ОН)2 ОР(ОН)2ОН ОН О ОР(ОН)2 1,6-дифосфатфруктозы 3-фосфатмонофосфатоксиглицериновый альдегид ацетон Монофосфатоксиацетон далее изомеризуется до 3-фосфатглицеринового альдегида: СН2 – С – СН2-О-Р(ОН)2 → О=СН-СН(ОН)-СН2-О-Р(ОН)2 │ ║ ║ ║ ОН О О О Таким образом, на втором этапе образуется 3-фосфатглицериновый альдегид. Третий этап начинается с окисления 3-фосфатглицеринового альдегида до 3фосфатглицериновой кислоты при участии НАД и НS-дегидрогеназы: (ОН)2Р-О-СН2-СН(ОН)-СН=О + НS-дегидрогеназа –НАД → ║ О (ОН)2Р-О-СН2-СН(ОН)-СНОН)- S-дегидрогеназа –НАД → ║ О Далее идет перегруппировка с образованием НАДН2 и вещества с энергетическим запасом в связи: НАДН2 + (ОН)2Р-О-СН2-СН(ОН)-С- S---дегидрогеназа ║ ║ О О Полученный продукт фосфорилируется с высвобождением НS-дегидрогеназы и вступает в реакцию с АДФ с образованием АТФ и фосфата глицениновой кислоты: (ОН)2Р-О-СН2-СН(ОН)-С- S---дегидрогеназа + Н3РО4 → ║ ║ О О → НS-дегидрогеназа + (ОН)2Р-О-СН2-СН(ОН)-С---О-Р(ОН)2 + АДФ→ 55 ║ О ║ О ║ О → АТФ + (ОН)2Р-О-СН2-СН(ОН)-СООН ║ О Таким образом, на третьем этапе образуются АТФ, фосфат глицериновой кислоты и восстановленный никотинамидадениннуклеотида (НАДН2). Четвертый этап заключается в переходе 3-фосфатглицериновой кислоты в 2фосфатглицериновую кислоту, ее дегидратацией, реакцией с АДФ вплоть до пировиноградной кислоты: фосфофируватгидратаза (ОН)2Р-О-СН2-СН(ОН)-СООН ║ О дегидратация СН2 – СН – СООН СН2=С-СООН + АДФ → АТФ + │ │ -Н2О │ ОН ОР(ОН)2 ОР(ОН)2 ║ ║ О О изомеризация СН2=СН(ОН)-СООН СН3-СО-СООН Пировиноградная кислота На пятом этапе осуществляется получение молочной кислоты восстановлением пировиноградной кислоты с помощью НАДН2, полученном в третьем этапе: СН3-СО-СООН + НАДН2 → СН3-СН(ОН)-СООН + НАД. Таким образом, при анаэробном гликогенолизе образуется приблизительно 30 ккал, запасенных в виде богатых энергией фосфатных связей АТФ, которая используется клеткой для ее жизнедеятельности. Распаду может подвергаться не только гликоген, но и свободная глюкоза. В этом случае запасается примерно 20 ккал энергии. Аэробная стадия распада углеводов в тканях. (Цикл Кребса). В клетках дрожжей окислительный распад гликогена идет по тому же пути, как и при анаэробном окислении его в тканях. Различие состоит в том, что с момента образования пировиноградной кислоты эти пути расходятся. 56 После реакции декарбоксилирования пировиноградной кислоты образуется уксусный альдегид, который при участии НАДН2 восстанавливается до этанола: СН3- СО-СООН → СО2 + СН3-СН=О СН3-СН=О + НАДН2 → СН3-СН2-ОН + НАД Поэтому окислительный распад углеводов, происходящий в аэробных условиях, получил название спиртового брожения. При этом распад каждой молекулы глюкозы сопровождается выделением двух моль этанола и двух моль углекислого газа, одновременно фосфорилируются два моль АДФ. Следовательно, общий вид спиртового брожения представляют схемой: С6Н12О6 + 2Н3РО4 + 2АДФ → 2С2Н5ОН + 2СО2 + 2АТФ 50% энергии проявляется в связях АТФ, а 50% рассеивается в виде тепла. Аэробный распад углеводов в тканях можно представить в виде следующих стадий: 1. Присоединение пировиноградной кислоты к ферменту декарбоксилазе, имеющей активный водород с последующим декарбоксилированием: СН3СО-СООН + Н-ФД → СН3-С(ОН)-СООН → СО2 + СН3-СН-ФД │ │ ФД ОН 2. Реакция с липоевой кислотой с высвобождением восстановленной декарбоксилазы и образованием энергетической связи: СН3-СН-ФД + S – ЛК – белок → НФД + СН3-С---S-ЛК-белок │ │ ║ │ ОН S О SH липоевая кислота 3. Реакция с коэнзимом А с образованием восстановленной липоевой кислоты: СН3-С---S – ЛК – белок + НSKoA→ СН3-С---S-KoA + (HS)2-ЛК-белок ║ │ ║ восстановленная О SН О липоевая кислота активный ацетил 4. Образование липоевой кислоты: НАД + НS-ЛК-белок → S - ЛК-белок + НАДН2 │ │ HS S липоевая кислота 57 Образовавшийся активный ацетил-КоА вступает в реакцию с щевелевоуксусной кислотой, образуя лимонную кислоту: СН2-СООН СН2-СООН │ │ СН3-С---S-КоА + С=О + Н2О → Н-S-КоА + НО-С-СООН │ │ СООН СН2-СООН Лимонная кислота изомеризуется в изолимонную кислоту с последующей дегидрируется до щавелевоянтарной кислоты: СН2-СООН СН2-СООН СН2-СООН │ изомеризация │ дегидрирование │ ▪ НО-С-СООН СН-СООН -2Н СН-СООН │ │ │ СН2-СООН НО-СН-СООН СО-СООН лимонная кислота изолимонная кислота щавелевоянтарная кислота За счет декарбоксилирования щавелевоянтарная кислота превращается в кетоглутаровую кислоту, а затем последовательно в янтарную, фумаровую, яблочную и щавелевоуксусную: СН2-СООН │ декарбоксилирование СН-СООН → СО2 + НООС-СН2-СН2-СО-СООН +Н2О │ кетоглутаровая кислота дегидрирование СО-СООН щавелевоянтарная кислота дегидрирование НООС-С-Н ▪ СО2 + 2Н + НООС-СН2-СН2СООН ║ + ▪ . янтарная кислота -2Н Н-С-СООН фумаровая кислота дегидрирование + НО→НООС-СН2-СН-СООН -2Н▪ НООС-СН2-С-СООН │ ║ ОН О яблочная кислота щавелевоуксусная кислота Щавелевоуксусная кислота замыкает цикл превращений вновь являясь акцептором ацетила с коэнзимом А. Приведенный цикл превращений карбоновых кислот носит название «цикл Кребса» (схема). Таким образом, анаэробная стадия образует: 58 Глюкоза → 2СН3-СО-СООН + 4Н▪ + 2АТФ; аэробная стадия: 2СН3-СО-СООН → 6СО2 + 20 Н▪ + 30 АТФ или ∑ глюкоза + 6Н2О → 6СО2 + 24Н▪ + 32АТФ. При этом 57 К выделяется в результате гликолиза в анаэробной стадии и 629 К во время аэробного распада, что в сумме составляет 686 К. Если принять, что при образовании АТФ из АДФ запасается 10 К, то 32 молекулы образовавшихся АТФ будут равны 320 К. 320 х 100% Следовательно, =46,7% всей энергии, выделяющейся при 686 окислительном распаде глюкозы, запасается в виде макроэнергетических соединений АТФ. Контрольные вопросы. 1. Функции углеводов в организме. 2. Составить формулы сахаров, входящие в состав ДНК и РНК. 3. Составить известные формулы моноз, диоз, полиоз, имеющих наибольшее биологическое значение. 4. Составить схему синтеза гликогена в пищеварительном тракте и печени. 5. Составить схемы превращений, имеющих место при анаэробном распаде углеводов в тканях животных. 6. Составить схемы превращений, имеющих место при аэробном распаде углеводов в тканях. Лекция № 10 ОБМЕН ЛИПИДОВ. План 1. Жиры, как источник энергии для живого организма. 2. Превращения жиров в желудочно-кишечном тракте. 3. Обмен жиров в тканях. 4. Синтез высших, жирных кислот. 5. Синтез триглицеридов и обмен стеридов. 6. Распад и биосинтез фосфатидов. Механизм биосинтеза фосфатидов. Нейтральные жиры, как и углеводы, являются важным источником энергии для живого организма. С обменом нейтральных жиров тесно связаны превращения фосфатидов. Обмен стероидных липидов занимает особенное положение, связанное со специфическими функциями этого класса веществ. Различные животные откладывают в качестве запасных веществ определенные нейтральные жиры, ценность которых определяется его калорийностью, легкостью усвоения, наличием непредельных жирных кислот, присутствием жирорастворимых витаминов. По калорийности все жиры эквивалентны (1 г жира образует 9,4 К). Усвоение зависит от легкости эмульгирования. Растительные масла эмульгируются легче, чем животные. По содержанию витаминов лучшим является коровье масло. 59 Превращения жиров в жулудочно-кишечном тракте. Жиры в ротовой полости не изменяются, так как в слюне нет ферментов расщепляющих жир. В желудке большинство жиров плавится, что способствует их дальнейшему эмульгированию. Фермент, ускоряющий годролитический распад жира – липаза, чтобы она действовала эффективно, жир должен быть в тонкодисперсном состоянии. Поэтому эмульгирование занимает основное место в процессе усвоения жира. Существенную роль в эмульгировании играет желчь, вырабатываемая печенью и накапливаемая в желчном пузыре, затем поступающая в двенадцатиперсную кишку и кишечник в виде желчных кислот, таких как холевая и дезоксихолевая: СН(СН3)-СН2-СН2-СООН │ ОН СН3 │ │ │ СН3 НО- -ОН холевая кислота СН(СН3)-СН2-СН2-СООН │ ОН СН3 │ │ │ СН3 НОдезоксихолевая кислота В желчи эти кислоты образуют парные соединения с гликоколом или таурином и присутствуют в виде натриевых солей: 60 СН(СН3)-СН2-СН2-СО-NH-CH2-COONa │ ОН СН3 │ │ │ СН3 НО- -ОН Na –соль гликохолевой кислоты СН(СН3)-СН2-СН2-СО-NH-CH2-CH2-SO3Na │ ОН СН3 │ │ │ СН3 НОNa-соль тауринодезоксихолевой кислоты Натриевые соли желчных кислот создают устойчивую мелкодисперсную эмульсию, на которую далее действуют пищеварительные соки с липазой. Основным источником липазы является поджелудочная железа, а активность липазе придают желчные кислоты. Под влиянием липазы начинается гидролитический распад эмульгированного жира в три ступени: СН2-О-СО-R1 CH2-OH │ липаза │ липаза 2 1 2 CH-O-CO-R + HOH R COOH + CH-O-CO-R + HOH │ │ 3 CH2-O-CO-R CH2-O-CO-R3 CH2-OH CH2-OH │ липаза │ 3 2 2 R COOH + CН-O-CO-R + HOH R COOH + CH-OH │ │ 61 CH2-OH CH2-OH Образовавшийся глицерин легко всасывается кишечными ворсинками, а жирные кислоты дают комплексы с дезоксихолевой кислотой, образуя холевые кислоты, растворимые в воде, что способствует их всасыванию. В кишечнике комплексы распадаются, желчные кислоты переносятся в печень, затем в желчный пузырь, а жирные кислоты используются на построение жиров, присущих данному организму. Всасывание жирных кислот ускоряется при наличии фосфорной кислоты, что связывают с синтезом фосфатидов. Обмен жиров в тканях. Жиры, поступившие в лимфу и большой круг кровообращения, разносятся по всему организму и откладываются в жировом депо – подкожной клетчатке, внутремышечной соединительной ткани, брыжейке, сальнике, печени. Жиры из жирового депо постоянно вовлекаются в дальнейшие реакции обмена. Распад жиров начинается с гидролиза, рассмотренного выше, под действием липазы до глицерина и жирных кислот. Глицерин, далее, фосфорилируется при участии АТФ, затем дегидрируется до 3-фосфатглицеринового альдегида с дальнейшим участием в углеводном обмене: СН2-ОН │ СН –ОН + АТФ → АДФ + │ СН2-ОН СН2-ОН │ СН-ОН │ СН2-О-Ф дегидрирование -2Н▪ СН=О │ СН –ОН │ СН2-О-Ф Жирные кислоты, образовавшиеся в процессе гидролиза, активируются путем соединения с коэнзимом: R-(CH2)3-COOH + H-S-KoA → H2O + R-(CH2)3-CO---S-KoA. Эта активация идет за счет перехода АТФ в АМФ: ОН ОН │ │ АТФ → АМФ + НО-Р – О – Р-ОН ║ ║ О О пирофосфат Водород карбоновой кислоты расположенный в α- и β-положениях под действием кофермента становятся подвижными, а под влиянием флавиновых ферментов (ФАД) наступает их дегидрирование: R-(CH2 )х-CH2-CH2-CO---S-KoA → 2Н▪ + R-(CH2)х-CH=CH-CO---S-KoA далее идет гидратация с последующим дегидрированием: 62 НАД R-(CH2)х-CH=CH-CO---S-KoA+НОН→R-(CH2)х-CH-CH2-CO---S-KoA │ ОН -2Н▪ R-(CH2)х-CO-CH2-CO---S-KoA Этот процесс носит название β-окисления. Под действием КоА-S-H β-окисленный продукт распадается с образованием активного ацила: R-(CH2)х-CO-CH2-CO--S-KoA+КоА-S-H→ R-(CH2)х-CO--S-KoA + CH3-CO---S-KoA. Вследствие этого распада идет укорочение цепочки высшей жирной кислоты на два углерода. Процесс повторяется вплоть до образования активированной масляной кислоты, которая после соответствующего β-окисления в активированную ацетоуксусную кислоту: СН3-СН2-СН2-СО---S-KoA ▪ CH3-CH=CH-CO---S-KoA + HOH → -2H → CH3-CH(OH)-CH2-CO---S-KoA ▪ CH3-CO-СН2-CO---S-KoA. -2H Ацетоуксусная кислота под действием кофактора А дает два активированных ацетила: СН3-СО-СН2-СО---S-KoA + H-S-KoA → 2CH3-CO---S-KoA. Таким образом, вся жирная кислота распадается на n/2 активированных ацетилов, вступающих далее в цикл Кребса. Следовательно, ацетил, активированный кофактором А является вторым звеном, связывающим жировой обмен с углеводным. Если окислительный распад образующегося ацетила заторможен (например, при диабете), и идет интенсивное β-окисление жирных кислот, наступает образование ацетоуксусной кислоты, β-оксимасляной кислоты, ацетона: СН3-СО-СН2-СО---S-KoA + HOH → CH3-CO-CH2-COOH + H-S-KoA ацетоуксусная кислота CH3CO-CH2-COOH + HOH → H2CO3 + CH3-CO-CH3 ацетон ▪ CH3CO-CH2-COOH + 2H → CH3-CH(OH)CH2-COOH β-оксимасляная кислота Присутствие ацетоуксусной кислоты и ацетона в моче (кетонурия) свидетельствует о расстройстве процессов окисления жиров и углеводов. Ацетон при этом находят в крови и выдыхаемом воздухе. Таким образом, окислительный распад жирных кислот начинается в печени, но основная заключенная в жирных кислотах энергия освобождается в тканях при окислении ацетоуксусной кислоты через цикл Кребса. Значительная часть 63 освобождающейся энергии за счет окислительного фосфорилирования запасается в макроэнергетических связях АТФ. Синтез высших жирных кислот. Механизм биосинтеза высших жирных кислот существенно отличается от простого обращения реакций β-окисления. Установлено что: 1. Лишь сырые (неочищенные) препараты ферментов, ответственные за βокисление высших жирных кислот, способны ускорять их синтез из ацетил-КоА. 2. Синтез высших жирных кислот требует присутствия СО2 или малонилКоА. 3. Найдены и изолированы ферменты, ускоряющие отдельные реакции при новообразовании высших жирных кислот. В соответствии с новейшими данными схема синтеза высших жирных кислот в организме может быть представлена следующими схемами превращенй: 1. Синтез малонил-КоА Me2+ ацетил-КоА-кокарбоксилаза СО2 + CH3-CO---S-KoA + ATФ + H2O НООС-СН2-СО---S-KoA малонил-КоА 2. Образование ацетил-малонил-КоА трансацилаза НООС-СН2-СО---S-KoA + СН3-СО---S-KoA малонил-КоА -Н-S-KoA CH3-CO-CH-CO---S-KoA │ COOH ацетил-малонил-КоА 3.Восстановление ацетил-малонил-КоА до этанол-малонил-КоА: CH3-CO-CH-CO---S-KoA + НАДФН2 → НАДФ + СН3-СН – СН-СО-SKoA │ │ │ COOH OH COOH ацетил-малонил-КоА 4. Дегидратация с образованием этилиденилмалонилКоА: дегидратаза СН3-СН(ОН)-СН(СООН)-СО---S-KoA H2O + CH3-CH=C(COOH)-CO---S-KoA этилиденилмалонил-КоА 5. Восстановление с последующим декарбоксилированием до бутирил-КоА: CH3-CH=C-CO--S-KoA+НАДФН2→ НАДФ+СН3-СН2-СН-СО-SKoA │ │ 64 COOH этилиденилмалонил-КоА COOH CH3-CH2-CH-CO--S-KoA → CO2 + СН3-СН2-СН2 - СО-SKoA │ бутирил-КоА COOH Образовавшийся бутирил-КоА взаимодействует со следующей молекулой малонил-КоА и процесс полностью повторяется вплоть до образования СН3-(СН2)4-СО—S-KoA. Таким образом, путем последовательного наращивания ацил-КоА на фрагмент из двух углеродов синтезируются высшие жирные кислоты в виде пальметил- и стеарил-КоА. Синтез триглицеридов. В последние годы безспорно доказано, что биосинтез триглицеридов осуществляется из ацил-КоА и фосфоглицерина, т. е. главный путь новообразования триглицеридов заключается в осуществлении реакций трансацилирования. Исходное вещество 3-фосфатглицерин может возникнуть двумя путями: а) фосфорилированием глицерина АТФ (фермент – глицерокиназа) СН2-ОН СН2-ОН │ глицерокиназа │ СН-ОН + АТФ АДФ + СН-ОН │ │ СН2-ОН СН2-О-Р(ОН)2 ║ О б) восстановление диоксиацетонфосфата СН2-ОН СН2-ОН │ глицерофосфат│ С=О + НАДН2 ГИДРОГЕНАЗА НАД + СН-ОН │ │ СН2-О-Р(ОН)2 СН2-О-Р(ОН)2 ║ ║ О О Ацетил-КоА образуется по ранее приведенной схеме. Затем исходные вещества реагируют с образованием фосфатидных кислот: СН2-ОН СН2-О-СО-С15Н31 │ глицерофосфат- │ 2С15Н31-СО—S-KoA + CH-OH СН-О-СО-С15Н31 + НОН→ │ ацилтрансфераза │ СН2-О-РО3Н СН2-ОРО3Н фосфатидилдипальметат глицерина 65 CH2-O-CO-C15H31 CH2-O-CO-C15H31 │ │ Н3РО4+ СH-О-СО-С15Н31+ С15Н31-СО—S-KoA→ CH-O-CO-C15H31+HSKoA │ │ CH2-OH CH2-O-CO-C15H31 Обмен стеридов Важной группой простых липидов являются стериды, производные циклопентанпергидрофенантрена. При распаде стериды сразу же гидролизуются на жирную кислоту и стерол. Так как стериды по химической природе являются сложными эфирами высших жирных кислот и полициклических спиртов, то реакция гидролиза ускоряется ферментом холестеролэстеразой, что можно представить супрощенной схемой: СН3 │ -СН(СН3)-СН2-СН2-СН2-СН(СН3)2 СН3 │ + НОН холестеролэстераза С17Н35-СООН + О │ СО-С17Н35 стеарохолестерид СН3 │ -СН(СН3)-СН2-СН2-СН2-СН(СН3)2 СН3 │ НО холестерол Высвобождающиеся высшие жирные кислоты подвергаются дальнейшему обмену, т. е. они могут использоваться для ресинтеза липидов или стеридов, или распадаться до ацетил-КоА и в конечном итоге до СО2 и Н2О. Распад и биосинтез фосфатидов Распад фосфатидов исследован вне живого организма. В биологических объектах их превращения исследованы недостаточно. 66 Фосфатиды распадаются на составляющие их структурные единицы, т. е. высшие жирные кислоты, фосфорную кислоту, азотистые основания и глицерин гидролитическим путем. Эфирные связи разрушаются гидролизом и этот процесс ускоряется под действием ферментов фосфолипаз, которые в зависимости от разрушаемых связей обозначают как фосфорилазы А, В, С, Д. Представления о возможных путях распада фосфолипидов можно представить следующими схемами превращений: І. 1. CH2-O-CO-R1 │ фосфолипаза А 2 CH-O-CO-R O + HOH │ ║ CH2 - O - P-O-CH2-CH2-N+(CH3)2 │ OСН2-ОН │ фосфолипаза В СН- ОН О + HOH │ ║ CH2 – O – P -O-CH2-CH2-N+(CH3)2 │ O- R1-COOH + R2COOH + СН2-ОН │ глицерофосфохолинСН- ОН О + HOH НО-СН2-СН2-N+(CH3)2 │ ║ эстераза + CH2 – O – P -O-CH2-CH2-N (CH3)2 │ O- СН2-ОН │ фосфомоноэстераза СН- ОН О + HOH Н3РО4 + │ ║ CH2 – O – P –OH │ СН2-ОН │ СН-ОН │ СН2-ОН 67 OІІ. 1. СН2-О-СО-R1 │ CH-O-CO-R2 O │ ║ CH2 - O - P │ O фосфолипаза С ║ + HOH НО-Р-О-СН2-СН2N+(CH3)2 + │ + - O-CH2-CH2-N (CH3)2 Oфосфохолин OСН2-О-СО-R1 липаза │ 2 CH-O-CO-R │ CH2 -OH + HOH липаза + HOH CH2-OH │ 1 R COOH + CH-CO-R2 + │ CH2OH CH2-OH │ CH-OH + R2-COOH │ CH2-OH ІІІ. 1. СН2-О-СО-R1 фосфолипаза Д CH-O-CO-R O + HOH НО-СН2-СН2N+(CH3)2 + │ ║ холин + CH2 - O - P - O-CH2-CH2-N (CH3)2 │ 2 │ OСН2-О-СО-R1 фосфотидатфосфогидролаза │ 2 CH-O-CO-R O + HOH │ ║ CH2 - O - P - OН Н3РО4 + │ OСН2-О-СО-R1 │ CH-O-CO-R2 │ CH2 -ОН CH2-OH липаза │ 1 + HOH R COOH + CH-O-CO-R2 + HOH→ │ CH2-OH CH2-OH │ CH-OH + R2-COOH 68 │ CH2-OH Следовательно, фосфолипаза А расщепляет первичную сложноэфирную связь; фосфолипаза В – вторичную сложноэфирную связь; фосфолипаза С – глицериноспиртофосфатную связь; фосфолипаза Д –фосфохолиновую связь. Дальнейший распад высших жирных кислот и глицерина идет по ранее рассмотренному механизму. Превращение холина в живом организме, в нервной ткани животных сводится в первую очередь к реакции ацилирования. Источник ацетильных групп ацетилКоА, реакция же ускоряется ферментом холинацетилтрансферазой: холинацетилтрансфераза + СН3-СО—S-KoA + HO-CH2-CH2-N (CH3)2 H-S-KoA + CH3-COO-CH2-CH2-N+(CH3)2 ацетилхолин Ацетилхолин физиологическиактивное вещество, участвующее в передаче нервных импульсов и является непременной составляющей нервной ткани. Другой реакцией превращения холина является реакция окисления холина в бетаин, которая идет в две стадии: холинде+ 1. (СН3)2N -CH2-CH2-OH+ ФАД ФАДН2 + (СН3)2N+-O-CH2CH=O дегидрогеназа бетаинальдегид 2.(СН3)2N -CH2-CH2-OH+ НОН (СН3)2N+-O-CH2C=O + 2Н+ дегидрогеназа │ ОПод действием фермента бетаингемоцистеинметилтрансферазы бетаин вступает в реакцию трансаминирования с гемоцистеином с образованием в конечном итоге метионина: Бетаингемоцистеин+ (CH3)3N -CH2-COO + HS-CH2-CH2-CH(NH2)-COOH -метилтрансфераза + (СН3)2-N-CH2-COOH + CH3-S-CH2-CH2-CH(NH2)-COOH N,N – диметилглицин метионин Далее возможно превращение диметилглицина в глицин, а метионин – важнейший источник метильных групп в обмене белков. Механизм биосинтеза фосфатидов Биосинтез фосфатидов протекает отлично от реакций гидролиза. Первые стадии биосинтеза фосфатидов аналогичны синтезу триглицеридов т. е. а) синтезируется фосфатидная кислота и диглицерид: СН2-ОН │ глицерофосфат2С17Н35-СО-S-КоА + СН-ОН 2HSKoA + 69 │ трансфераза СН2-О-РО3Н2 CH2-O-CO-C17H35 CH2-O-CO-C17H35 │ фосфотидатфосфо- │ CH-O-CO-C17H35 + H2O СН-О-СО-С17Н35 + Н3РО4 │ гидролаза │ СН2-О-РО3Н2 СН2-ОН дистеаратглицерина б) на свободную группу «ОН» дистеаратглицерина присоединяется остаток фосфохолина из цитидинфосфохолина: NН2 │ C N │ O=C N │ │ H CH ║ CH H │ OH OH O+ H │ │ │ CH2-O-P –O – P – O -CH2-CH2N+(CH3)3 OH │ ║ ║ │ O O H O цитидиндифосфохолин СН2-О-СО-С17Н35 │ холинфосфотрансфераза СН-О-СО-С17Н35 │ СН2-ОН СН2-О-СО-С17Н35 │ СН-О-СО-С17Н35 + │ СН2-О-Р-О-СН2-СН2-N+(CH3)3 ∕ \\ O- O дистеаратфосфатидлицитин NН2 │ C N │ O=C N CH ║ CH H H OH │ 70 │ │ H │ OH │ CH2-O-P –OН OH │ ║ │ O H O цитидинмонофосфат Эта реакция ускоряется специфическим ферментом цитидинфосфатхолин-1,2диглицеридхолинфосфотрансферазой. Такой путь биосинтеза вполне обоснован для лицитина и коламина. Синтез цитидиндифосфохолина также расшифрован и состоит в следующем: 1. Холин под действием АТФ (фермент –холинкиназа) переходит в фосфохолин: Охолинкиназа │ НО-СН2-СН2-N(CH3)3 + ATФ АДФ + НО-Р-О-СН2-СН2N(CH3)3 ║ О 2. Взаимодействие ЦТФ (цитидинтрифосфата) с фосфохолином с образованием цитидиндифосфохолина и пирофосфата: NН2 │ C N CH │ ║ O=C CH OH ОН ОН N H H │ │ │ │ │ │ CH2-O-P –O – Р –О –Р –ОН + │ OH OH │ ║ ║ ║ H │ O О О H O OOH OH │ │ │ + + (СН3)3N -CH2-CH2-O-P-OH → HO-P-O-P-OH + ║ ║ ║ O O O NН2 │ C N CH 71 │ O=C N │ │ H ║ CH H │ OH OH ОH │ │ │ CH2-O-P –O – Р –O-CH2-CH2-N+(CH3)3 OH │ ║ ║ │ O О H O Таким образом, цитидинмонофосфат, взаимодействуя с АТФ, переходит в ЦТФ и, соединяясь с фосфохолином опять образует цитидиндифосфохолин. Контрольные вопросы. 1. Дать определение простым и сложным липидам. Привести примеры. 2. Составить общие формулы лицитина, кефалина,серинфосфатида, цериброзида. 3. Составить формулы холестерола, эргостерола. 4. Где осуществляется превращение жиров? Роль желчных кислот. Строение холевой и дезоксихолевой кислот и их парные соединения. 5. Составить схему гидролитического распада эмульгированного жира. Какой фермент при этом необходим? 6. Какие превращения происходят с глицерином, полученным в результате гидролитического распада? Составить схему превращений. 7. Составить схемы превращений высших жирных кислот, освобожденных в результате гидролитического распада жира. 8. Составить схемы образования ацетоуксусной кислоты, β-оксимасляной кислоты, ацетона. Что способствует их образованию? 9. Составить схемы синтеза пальметиновой кислоты, взяв в качестве исходных веществ СО2 , ацетил-S-КоА, АТФ, Н2О. 10.Составить схемы синтеза триглицеридов (трипальметат глицерина). Какие ферменты при этом необходимы? 11. Как происходит распад фосфатидов? Подтвердить схемами превращений 12. Составить схемы биосинтеза фосфатидов (первая и вторая стадии). Какой фермент ускоряет этот процесс? 13. Составить схемы синтеза цитидиндифосфохолина. Лекция № 11 ОБМЕН БЕЛКОВ. План. 1. Значение белкового обмена. 2. Пути распада белков. 3. Превращения аминокислот и конечные продукты распада аминокислот. 4. Новообразование аминокислот. 5. Биосинтез белков. Матричная теория биосинтеза белков. Пептидная теория биосинтеза белков. Распад белков в организме идет посредством: а) гидролиза; 72 б) образование из белковых тел нуклеотидпептидов в присутствии одновременно распадающихся нуклеозидтрифосфатов, в частности АТФ. Гидролиз белков может быть частичным (до пептидов) и полным (до аминокислот). При частичном гидролизе в белковой молекуле распадаются лишь некоторые пептидные связи по строго определенным аминокислотным радикалам, под действием пептидпептидогидролаз. При полном гидролизе пептиды распадаются до аминокислот также под действием пептидогидролаз, что можно представить в виде следующей схемы: Rx O │ ║ → H-[-HN-CH-C-]x-OH → R O │ ║ H-[-NH-CH-C-]n-OH Ry O │ ║ H-[-HN-CH-C-]y-OH пептидпептидо∫ гидролазы белок Rz O │ ║ → H-[-HN-CH-C-]z-OH Rm O │ ║ → H-[-HN-CH-C-]m-OH полипептиды Образовавшиеся полипептиды долее под действием пептидгидролаз распадаются до аминокислот (смесь 19и аминокислот): Rx O │ ║ H-[-HN-CH-C-]x-OH Rx │ → x H2N-CH-COOH 73 Ry O │ ║ H-[-HN-CH-C-]y-OH Ry │ → уH2N-CH-COOH пептидгидролаза Rz O │ ║ H-[-HN-CH-C-]z-OH Rz │ → zH2N-CH-COOH Rm O │ ║ H-[-HN-CH-C-]m-OH Rm │ → mH2N-CH-COOH Второй, недавно обнаруженный путь деструкции белковых тел состоит в распаде белка при участии специфических ферментов до нуклеотидов. Процесс идет только в присутствии нуклеозидтрифосфатов, которые служат источником нуклеотидной группировки, образующегося нуклеотидпептида. Схема распада детально не исследована, предположительно может быть представлена в следующем виде: H2N │ C N C N │ ║ ║ HC C CH N N OH OH OH │ │ │ O HO- P – O –P –O –P –O –CH2 ║ ║ ║ │ O O O │ H ↓ ↓ H + mН2О + АТФ специфический H-[HN-CH-CO-]x-HN-CH-CO-[-HN-CH-CO-]y-OH │ │ │ Rx R Ry фермент H2N │ C 74 N │ HC C ║ C N OH │ O H-[HN-CH-CO]x-NH-CH-CO O –P –O –CH2 ║ │ O │ H ↓ N ║ CH N OH OH │ │ + HO-P-O-P-OH + ║ ║ O O ↓ H пирофосфат + H-[-HN-CH-CO-]y-OH │ Ry Полученный нуклеотидпептид используется далее для ресинтеза белка в качестве готовых пептидных блоков для вновь синтезируемых белковых молекул. Следует отметить, что обмен белков в организме осуществляется весьма интенсивно и экономно. С помощью меченных атомов было установлено, что в течение недели белки печени животных обновляются наполовину. В течение суток в среднем заново создается приблизительно 10% белков плазмы крови и приблизительно 2,5% гемоглобина; соответственное количество этих же белков распадается за тот же период. Следует иметь в виду, что соотношения аминокислот в распадающихся белках и новообразуемых за их счет протеинах, различны. Поэтому аминокислоты и полипептиды должны быть преобразованы в другие аминокислоты или более простые соединения, выводимые из организма. Превращения аминокислот. Превращения аминокислот идут по трем типам реакций: по α-аминогруппе, по карбоксильной группе, по радикалу аминокислоты. Реакции по α-аминогруппе, это реакции дезаминирования и переаминирования. Дезаминирование осуществляется четырьмя путями: а) окислительное дезаминирование R-CH(NH2)-COOH + ½ O2 → R-CO-COOH + NH3 б) восстановительное дезаминированиеR-CH(NH2)-COOH + 2H▪ → R-CH2-COOH + NH3 г) гидролитическое дезаминирование R-CH(NH2)-COOH + HOH → R-CH(OH)-COOH NH3 д) внутримолекулярное дезаминирование 75 R-CH(NH2)-COOH → R-CH=CH-COOH + NH3 Первый вид дезаминирования распространен в живых организмах очень широко, остальные три – лишь у отдельных организмов. Окислительное дезаминирование осуществляется в две стадии: 1. Окисление аминокислоты в иминокислоту с НАД или НАДФ СООН │ (СН2)2 HAД(НАДФ) │ глутаминдегидрогеназа CH-NH2 ← │ НАДН2(НАДФН2) COOH глутаминовая кислота СООН │ (СН2)2 │ C=NH │ COOH иминоглутаровая кислота 2. Гидролиз иминокислоты до кетонокислоты СООН │ (СН2)2 │ С=NH │ COOH + HOH → ← СООН │ (СН2)2 │ + NH3 C=O │ COOH α- кетоглутаровая кислота Кетоглутаровая кислота с L – аминокислотами (под действием очень активной дегидрогеназы L-глутаминовой кислоты ) дезаминируется в организме путем переаминирования (фермент оксоглутараттрансаминаза): СООН СООН │ │ (СН2)2 (СН2)2 │ СООН R │ C=O + │ → │ + CH-NH2 │ H2N-C-H ← C=O │ COOH │ │ COOH R COOH α-кетоглутаровая L-аминокислота кислота Далее идет снова окислительное дезаминирование и вновь синтез с Lаминокислотой. Реакция обратима, что не исключает возможности синтеза из кетонокислот L-аминокислот. Отмечено своеобразное дезаминирование отдельных аминокислот, например, метионина и серина, у которых отщепляется не только аммиак, но и сероводород и метилмеркаптан: 76 H-S-CH2-CH(NH2)-COOH + HOH → H2S + NH3 + CH3-CO-COOH цистеин S-CH3 │ CH2-CH2-CH(NH2)-COOH + HOH → NH3 + CH3-SH + CH3-CH2-CO-COOH метионин Декарбоксилирование активно идет в микроорганизмах и сравнительно легко в живых организмах и растениях. Образуются в основном амины с высокой физиологической активностью. Их называют биогенными аминами. Например, декарбоксилирование гистидина идет с образованием гистамина: N ║ HC C-CH2-CH(NH2)-COOH N ║ гистидиндекарбоксилаза ║ CH HC NH C-CH2-CH2-NH2 ║ CH + CO2 NH гистидин гистамин Гистамин усиливает деятельность желез внутренней секреции и снижает кровяное давление. Тиразин декарбоксилируется до тирамина, а триптофан – до триптамина, окисляющийся до серотонина (5-окситриптамин), который отвечает за болевые ощущения при воспалительных процессах. При декарбоксилировании орнитина образуется путресцин, из которого синтезируется спермидин и спермин: H2N-(CH2)3-CH(NH2)-COOH → CO2 + H2N-(CH2)4-NH2 орнитин путресцин 2HN2-(CH2)4-NH2 → CH3-NH2 + H2N-(CH2)3-NH-(CH2)4-NH2 спермидин 3H2N-(CH2)4-NH2 → 2CH3-NH2 + H2N-(CH2)3-NH-(CH2)4 -NH-(CH2)3-NH2 cпермин Спермидин и спермин принимают участие в биосинтезе белков. Продуктами декарбоксилирования аминокислот являются не только амины, но и аминокислоты с одной аминогруппой: HOOC-CH(NH2)-CH2-CH2-COOH → CO2 + H2N-CH2-CH2-CH2-COOH глутаминовая кислота γ-аминомасляная кислота HOOС-СH(NH2)-СH2-COOH → CO2 + H2N-CH2-CH2-COOH аспарагиновая кислота β-аланин β-аланин принимает участие в синтезе пантотеновой кислоты. 77 По карбоксильной группе идет реакция образования аминоациладенилатов, которые осуществляют первую стадию биосинтеза белка. Превращения аминокислот, связанные с реакциями по радикалу. Важнейшим типом превращения аминокислот, протекающих с видоизменением радикалов, является переход одних аминокислот в другие, что является возможностью для синтеза аминокислот в организме. Например, 1. Синтез тирозина из фенилаланина при действии фермента фенилаланил-4гидроксилаза: С6Н5-СН2-СН(NH2)-COOH +(O) → HO-C6H4-CH2-CH(NH2)-COOH 2. Образованиме аланина из аспарагиновой кислоты при участии фермента аспартат-β-декарбоксилазы: HOOC-CH2-CH(NH2)-COOH → CO2 + CH3-CH(NH2)-COOH 3. Гидролиз аргинина до орнитина (фермент-аргиназа): H2N-C-NH-(CH2)3-CH-COOH + HOH → H2N-C-NH2 + H2N-(CH2)3-CH-COOH ║ │ ║ │ NH NH2 O NH2 аргинин орнитин 4. Превращения орнитина могут идти вплоть до образования глутаминовой кислоты и пролина: H2N-(CH2)3-CH(NH2)-COOH + (O) → NH3 + O=CH-(CH2)2-CH(NH2)-COOH → + (О) → НООС-(СН2)2-CH(NH2)-COOH H2C циклизация→ H2O + │ H2C CH H2C ║ + H2 → │ C-COOH H2C CH2 │ CH-COOH NH NH пролин Окислительно-восстановительные реакции по серусодержащим радикалам идут легко. Цистеин переходит в цистин и обратно под действием НАД и НАДН2 при участии фермента цистеинредуктазы: 2H-S-CH2-CH(NH2)-COOH + HAД↔ HAДH2 + [HOOC-CH(NH2)-CH2-S]2 цистеин цистин При исчерпывающем окислении цистеина образуется таурин, который, в соединении с желчными кислотами, принимает участие во всасывании жиров: декарбокси78 HS-CH2-CH(NH2)-COOH + x(O) → HO3S-CH2-CH(NH2)-COOH лирование СО2 + HO3S-CH2-CH2-NH2 таурин Важна реакция деметилирования метионина, так как она является универсальным поставщиком группы «СН3». Реакция осуществляется через образование «активного метионина» под действием АТФ: H2N │ C N C N │ ║ ║ HC C CH N N OH OH OH │ │ │ O HO- P – O –P –O –P –O –CH2 ║ ║ ║ │ O O O │ H ↓ ↓ H АТФ + CH3 │ S │ (СH2)2 + │ CH-NH2 │ COOH H2N │ C N C N │ ║ ║ HC C CH N N OH OH CH3 │ │ │ O + H2O→ HO-P–O-P–OH + Н3РО4 + ∫ S - CH2 ║ ║ │ │ O O CH2│ │ H ↓ CH2 + НО-(СН2)2N(CH3)2 ↓ H 79 │ CH(NH2)-COOS- аденазил -«активный метионин» → HO-CH2-CH2-N+(CH3)3 холин H2N │ C N C N │ ║ ║ HC C CH N N н+ + ∫ + HOH → O S – CH2 │ │ CH2 │ │ H ↓ ↓ H CH2 │ COOS-аденозилгомоцистеил H2N │ C N C N │ ║ ║ HC C CH N N HS-CH2-CH2-CH(NH2)-COOH + гомоцистеин НО–CH2 │ O 80 │ H ↓ ↓ H аденазин Гомоцистеин переходит в цистеин благодаря реакции с серином: -H2O HS-CH2-CH(NH2)-COOH + HO-CH2-CH(NH2)-COOH ↔ + H2O +Н2О HOOC-CH(NH2)-(CH2)2-S-CH2-CH(NH2)-COOH ↔ цистатионин -Н2О HS-СН2- CH(NH2)-COOH + HO-CH2-CH2-CH(NH2)-COOH цистеин α-амино-γ-оксимасляная кислота По радикалу треонина идет реакция с образованием ацетальдегида и глицина: треоальдоСН3СН(ОН)-СН(NH2)-COOH CH3CH=O + H2N-CH2-COOH треонин лаза глицин Из тирозина через ряд промежуточных соединений образуется гормон адреналин: ОН │ НО-С6Н4-СН2-СН(NH2) + 2(O) → ∫ НО- - CH-CH(NH2)COOH │ OH ОН │ декарбоксилирование СО2 + ∫ НО- - CH-CH-NH2 + СН3J │ OH ОН │ метилирование HJ + ∫ НО- - CH-CH-NH-CH3 │ 81 OH адреналин Таким образом, в процессе превращения аминокислот возникает серия соединений, принимающих участие в регуляции обмена веществ в организме. Конечные продукты распада аминокислот. В результате распада аминокислот образуются аммиак, двуокись углерода, амины, кетонокислоты, а в ряде случаев и более сложные вещества, относящиеся к различным классам органических соединений. Все они, за исключением СО2 и NH3, подвергаются дальнейшей деструкции. Амины превращаются в карбоновые кислоты при участии кислорода и воды (фермент – моноаминооксидаза): R-CH2-NH2 + HOH + O2 → NH3 + H2O2 + ∫ R-CH=O + HOH + НАД → альдегидодегидрогеназа НАДН2 + R-COOH Аналогично окисляются диамины под действием диаминооксидазы. Все другие продукты, включая образующиеся карбоновые кислоты, в конечном итоге образуют Н2О, СО2 и NH3. СО2 беспрепятственно покидает организм. Вода поступает в общий метаболический фонд, и лишь аммиак нуждается в специальном рассмотрении. Аммиак – вредный продукт для большинства растений и живых организмов, и, следовательно, должен переводиться в безвредное азотистое соединение, т. е. переводиться в мочевину, аспарагин, глутамин. Первичное связывание аммиака осуществляется под действием АТФ и ферментов аспарагин- и глутаминсинтетаз: а) АТФ + NH3 + HOOC-CH2-CH(NH2)-COOH → АДФ + H3PO4 + H2N-CO-CH2-CH(NH2)-COOH аспарагин б) АТФ + NH3 + HOOC-CH2-CH2-CH(NH2)-COOH → АДФ + H3PO4 + H2N-CO-CH2-CH2-CH(NH2)-COOH глутамин Амидирование может происходить как со свободными аминокислотами, так и с их остатками в белковой молекуле, т. е. акцепторами аммиака могут быть все три компонента: Н(-HN-CH-CO-)x-HN-CH-CO-(HN-CH-CO-)y-HN-CH-CO-(HN-CH-CO-)zOH+ │ │ │ │ │ R CH2 R1 (CH2)2 R2 │ │ COOH COOH + 2NH3 + 2АТФ → 2АДФ + 2H3PO4 + 82 +Н(-HN-CH-CO-)x-HN-CH-CO-(HN-CH-CO-)y-HN-CH-CO-(HN-CH-CO-)zOH │ │ │ │ │ R CH2 R1 (CH2)2 R2 │ │ CONH2 CONH2 амидированный белок Таким образом, обеспечивается немедленное связывание аммиака в любой точке, где он возникает в результате обмена веществ. Биосинтез мочевины осуществляется в несколько стадий. 1. Синтез карбамилфосфорной кислоты из аммиака, СО2 и АТФ при участии фермента карбаматкиназы: О ║ NH3 + CO2 + АТФ ↔ H2N-COO—P(OH)2 + АДФ 2. А живом организме всегда присутствует орнитин, который образуется при гидролизе аргинина: H2N-C-NH-(CH2)3-CH-COOH + H2O → H2N-C-NH2 + CH2-(CH2)2CH-COOH ║ │ ║ │ │ NH NH2 O NH2 NH2 аргинин орнитин Под действием орнитинкарбамилтрансферазы карбаминовая группировка переходит в орнитин с образованием цитрулина: H2N-(CH2)3-CH(NH2)-COOH + H2N-C-O-P(OH)2 → орнитин ║ ║ O O карбамидфосфорная кислота → H3PO4 + H2N-CO-NH-CH2-CH2-CH2-CH(NH2)-COOH цитрулин 3. Из цитрулина и аспарагиновой кислоты под действием двух ферментов аргиносукцинатсинтетазы и аргиносукцинатлипазы в конечном итоге с АТФ образуются аргинин и фумаровая кислота: H2N-CO-NH-(CH2)3-CH(NH2)-COOH + HOOC-CH(NH2)-CH2-COOH + АТФ↔ H2N COOH │ │ C==N-CH │ │ ↔ АМФ + Н4Р2О7 + HN CH2 │ │ (H2C)3 COOH │ CH-NH2 → H2N-C-NH-(CH2)3-CH-COOH ║ │ NH NH2 аргинин → Н-С-СООН ║ НООС-С-Н 83 │ фумаровая кислота COOH Аргинин далее гидролизуется до орнитина, орнитин вновь вступает в выше приведенный цикл превращений, приводящий к образованию мочевины. Этот процесс получил название «орнитиновый цикл». Новообразование аминокислот. Рассмотренные ранее реакции переаминирования аминокислот с кетонокислотами, реакции в радикале, приводящие к абразованию новой аминокислоты, не следует относить к новообразованию, так как исходными для этого продуктами являются аминокислоты и идет лишь их видоизменение. Первичный синтез аминокислот в природе осуществляется следующими тремя способами: 1.Восстановительное аминирование кетонокислот. 2. Прямое аминирование непредельных кислот. 3. Восстановительное оксимирование кетонокислот. 1.Восстановительное аминирование – главный путь новообразования аминокислот, который осуществляется в два этапа. а) Присоединение к кетонокислотам аммиака с образованием иминокислоты: СН3 СН3 │ │ С=О + NH3 → H2O + C=NH │ │ COOH COOH пировиноградная кислота 2-иминопропановая кислота б) Восстановление иминокислоты в аминокислоту под действием НАДН2: СН3 │ С=NH + НАДН2 → НАД + │ COOH СН3 │ CН-NH2 │ COOH аланин Суммарно процесс восстановительного аминирования можно представить схемой: аланилдегидроСН3-CO-COOH + NH3 + НАДН2 ↔ Н2О + НАД + СН3СНСООН геназа │ NH2 В принципе возможно восстановительное аминирование любой кетонокислоты, но экспериментальные исследования показали, что этот процесс весьма активен лишь для синтеза аланина и глутаминовой кислоты, а для дрегих аминокислот выход целевого продукта оказался ничтожным. 84 2. Прямое аминирование непредельных карбоновых кислот довольно редкая реакция и характерна главным образом для растений и бактерий. Детально изучено аминирование фумаровой кислоты под действием аспартаммиаклипазы: COOH │ НООС-С-Н CH-NH2 ║ + NH3 ↔ │ Н-С-СООН CH2 │ COOH Реакция обратима и служит для дезаминирования аспарагиновой кислоты. Значительные количества аспарагиновой кислоты образуются путем переаминирования щавелевоуксусной кислоты с глутаминовой кислотой: COOH │ C=O │ + CH2 │ COOH щавелевоуксусная кислота COOH COOH COOH │ │ │ CH-NH2 C==N – CH │ → H2O + │ │ ↔ CH2 CH2 CH2 │ │ │ CH2 COOH CH2 │ │ COOH COOH глутаминовая аспаргилглутаровая кислота кислота СOOH COOH COOH COOH │ │ │ │ CH – N==C CH-NH2 C=O │ │ + HOH → │ + │ CH2 CH2 CH2 CH2 │ │ │ │ COOH CH2 COOH CH2 │ │ COOH COOH глутариласпарагиновая аспарагиновая α-кетоглутаровая кислота кислота кислота Процесс восстановительного оксимирования открыт сравнительно недавно и сводится к образованию оксимов кетонокислот при взаимодействии с гидроксиламином с участием фермента оксимаза: R1 R1 │ оксимаза │ C=O + H2N-OH H2O + C==N-OH 85 │ │ COOH COOH Оксимы кетонокислот могут переаминироваться с другими кетонокислотами под действием трансоксимазы: R2 R1 R2 R1 │ │ трансоксимаза │ │ C=O + C==N-OH C==N-OH + C=O │ │ │ │ COOH COOH COOH COOH При ферментативном восстановлении оксима возникает новая аминокислота: R2-C-COOH + 4H▪ → H2O + R2-CH(NH2-COOH ║ N-OH Гидроксиламин – это обязательное промежуточное соединение при восстановлении нитратов и осуществляется по схеме: нитратредуктаза нитритредуктаза гипонитритредуктаза HNO3 HNO2 (HNO2) гидроксиламинредуктаза H2N-OH NH3 Экспериментально установлено, что в природе путем реакций прямого и восстановительного аминирования синтезируются три аминокислоты – аланин, аспарагиновая и глутаминовая кислоты. Остальные аминокислоты создаются в результате реакций переаминирования с кетонокислотами. Поэтому аланин, аспарагиновую и глутаминовую кислоты называют первичными аминокислотами, а все остальные – вторичными аминокислотами. Растительные и животные организмы резко отличаются друг от друга по способности синтезировать аминокислоты. В растениях осуществляется беспрепятственный синтез самых разнообразных аминокислот, включая не только 19 основных, но и большое число редких «экзотических» аминокислот. В растениях на настоящее время обнаружено приблизительно 150 аминокислот и этот список возрастает с каждым годом. В отличие от растений животные синтезируют далеко не все аминокислоты. Из 19 постоянно встречающихся в белках аминокислот в живом организме синтезируется в среднем только половина из них, а остальные 50% не синтезируются. Синтезируемые аминокислоты носят название заменимых, вторые, не синтезируемые, называются незаменимые аминокислоты. К незаменимым аминокислотам относятся: валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан. Недостаток их приводит к нарушению процессов в живом организме. Растительные белки содержат невысокое количество лизина, метионина, триптофана, что влияет на продуктивность сельскохозяйственных животных. 86 Следует незаменимые аминокислоты вводить в корм. Их получаю в основном микробиологическим путем(определенный вид микроорганизмов). Контрольные вопросы. 1. Какое значение имеет белковый обмен? 2. Составить схему распада белков вплоть до аминокислот под действием пептидпептидо- и пептидгидролаз. 3. Составить схему распада белков под действием АТФ и специфического фермента. 4. Привести примеры окислительного, восстановительного, гидролитического и внутримолекулярного дезаминирования аминокислот. 5. Составить схемы окислительного дезаминирования метионина, серина. 6. Составить схемы декарбоксилирования гистидина, орнитина, глутаминовой кислоты. Значение конечных продуктов. 7. Что следует понимать под превращением аминокислот по радикалу. Привести примеры реакций таких превращений. 8. Синтезировать таурин и охарактеризовать его роль в живом организме. 9. Составить схемы превращений, имеющих место при деметилировании вплоть до образования цистеина и α- амино-γ –оксимасляной кислоты. 10. Из тирозина синтезировать адреналин, его роль в живом организме. 11. Конечные продукты распада аминокислот и их дальнейшая судьба. 12. Привести схемы первичного связывания аммиака. 13. Что следует понимать под амидированием белка? Подтвердить схемой превращений 14. Составить схему синтеза цитрулина и на его основе получить аргинин и фумаровую кислоту. 15.Осуществить новообразование аминокислот восстановительным аминированием кетонокислот. 16.Составить схемы прямого аминирования непредельных кислот и восстановительного окмимирования кетонокислот. 17. Приведите формулы первичных аминокислот. Почему их так называют? 18. Приведите несколько формул вторичных аминокислот. Почему их так называют? Лекция № 12 Биосинтез белка. Биосинтез белка представляет собой очень сложный процесс. Сложность заключается в том, что в нем принимают участие многие биологические соединения и надмолекулярные комплексы. Биосинтез белка является завершающим этапом реализации генетической информации закодированной в молекуле дезоксирибонуклеиновой кислоты (ДНК). Посредником в передаче генетической информации является матричная, или информационная, рибонуклеиновая кислота (мРНК). Биосинтез белка невозможен без участия еще двух видов РНК – транспортных (тРНК) и рибосомных (рРНК). Понятие о нуклеиновых кислотах. 87 Нуклеиновые кислоты – биополимеры, мономерами которых служат нуклеотиды, связанные между собой фосфорноэфирными связями. В состав нуклеотидов входят следующие компоненты: углевод ( рибоза в РНК, 2-дезоксирибоза в ДНК), азотистые основания (аденин, гуанин, цитозин и урацил в РНК; аденин, гуанин, цитозин и Тимин в ДНК), фосфорная кислота. Примером трифосфатного нуклеотида может служить АТФ. Транспортные РНК (тРНК) составляют 10% от всех РНК клетки. Основной функцией тРНК является перенос аминоацилов из цитоплазмы на рибосому, где происходит биосинтез белка. Рибосомные РНК (рРНК) составляют основную массу клеточных (80-85%). На доля матричных РНК (мРНК) приходится 3,5% всех клеточных РНК. Матричные мРНК очень разнообразны, в них закодирована информация о различных белках. Все упомянутые РНК взаимодействуют друг с другом в процессе биосинтеза белка. Основной принцип взаимодействия – комплементарность. Комплементарность – это взаимосоответствие азотисных оснований: аденину соответствует урацил, а гуанину – цитозин; пары комплементарных азотистых оснований связаны друг с другом водородными связями. Услорно процесс биосинтеза белка можно разделить на два этапа: первый этап – цитоплазматический, второй – рибосомный. Цитоплазматический этап биосинтеза белка заключается в превращении аминокислоты в аминоацил-тРНК. При этом достигается две цели: а) повышение реакционной способности аминокислоты в реакции образования пептидной связи (активация); б) соединение аминокислоты со специфической тРНК (отбор). Катализируют процесс активации и отбор аминокислот ферменты аминоацилтРНК-синтетазы (АРСазы). Трансляция мРНК в полипептидную цепь происходит на рибосомах. Поэтоме этот процесс получил название рибосомногоэтапа биосинтеза белка. В клетках организма человека большая часть рибосом связана с мембранами эндоплазматического ретикулума. В процессе трансляции можно выделить три этапа: 1) инициация; 2) элонгация (удлинение полипептидной цепи); 3) терминация синтеза. Инициация синтеза белка. Для начала синтеза полипептидной цепи необходимы: рибосома, мРНК, инициирующая N-формил-метионил-тРНКмет, белковые факторы инициации,гуанозинтрифосфорная кислота (ГТФ). Во всех синтезируемых белках первой аминокислотой является N-формилметионин, кодируемый кодоном мРНК –АУГ, названным инициирующим кодоном. Радикал формил защищает аминогруппу (N-конец) метионина растущей полипептидной цепи. Белковые факторы трансляции – семейство белков, не входящих в состав рибосомы постоянно, взаимодействуют с ней на разных этапах трансляции. На каждом этапе синтеза полипептидной цепи принимают участие разные белковые факторы. На этапе инициации принимают участие 88 белковые факторы инициации, отвечающие за присоединение мРНК к рибосоме и за закрепление N-формилметионил-тРНК на кодоне АУГ. тРНКмет закрепляется на кодоне АУГ с помощью комплементарного тринуклеотида УАЦ, который называют антикодоном. В результате согласованного действия всех участников этапа инициации происходит сборка транслирующей рибосомы – комплекса, состоящего из рибосомы,мРНК и N-формилметионил-тРНК. Сборка транслирующей рибосомы является энергозависимым процессом, энергию для которого поставляет гидролиз ГТФ. В транслирующей рибосоме выделяются два центра: пептидный (Р) и аминоацильный (А). На этане инициации N-формилметионил-тРНК присоединяется к мРНК в пептидильном центре, все последующие аминоацилтРНК присоединяются к мРНК в аминоацильном центре. Элонгация полипептидной цепи. Этап элонгации условно можно разбить на три стадии. Первая стадия отвечает за правильное закрепление аминоацил-тРНК на соответствующем кодоне мРНК в аминоацильном центре рибосомы. Этому способствуют белковые факторы элонгации. На второй стадии происходит образование пептидной связи между двумя аминокислотными остатками; катализирует этот процесс пептидилтрансфераза. Сначала происходит разрыв сложно-эфирной связи между N-формилметионилтРНКмет; затем пептидилтрансфераза осуществляет перенос N-формилметионила к аминогруппе аминоацила, закрепленного посредством тРНК в аминоацильном центре рибосомы и образует пептидную связь. В результате действия пептидилтрансферазы в пептидильном центре остается свободная тРНКмет, а в аминоацильном – дипептидил-тРНК. На третьей стадии элонгации происходит три перемещения. Рибосома передвигается вдоль мРНК на расстояние одного кодона. В результате такого перемещения кодон АУГ и тРНКмет оказываются за пределами рибосомы, в пептидильном центре располагается дипептидил-тРНК. Третья стадия элонгации представляет собой пример направленного биологического движения, энергию для которого обеспечивает гидролиз ГТФ, называемого транслокацией. После транслокации рибосома готова к новому этапу элонгации. Элонгация повторяется стоько раз, сколько смысловых кодонов содержитьРНК. Терминация полипептидной цепи. Этап терминации обеспечивают белковые факторы терминации и фермент пептидилэстераза, локализованной в большой субчастице рибосомы. Энергию для осуществления этапа терминации обеспечивает гидролиз ГТФ. В структуре мРНК есть кодоны, не несущие информации ни об одной протеиногенной аминокислоте. Они называются бессмысленными или терминаторными. Таковыми являются кодоны УАА, УАГ, УГА. Эти кодоны (либо один из них) расположены сразу за последним смысловым кодоном мРНК. Ни одна тРНК не способна распознать терминаторные коды, их опознают белковые факторы терминации. Как только рибосома достигает одного из них, факторы терминации присоединяются к терминаторному кодону. В этот момент 89 происходит активирование пептидилэстеразы, которая гидролизует сложноэфирную связь между полипептидом и последней тРНК. Заключительной фазой терминации, а следовательно, и всего процесса трансляции, является диссоциация комплекса, в который входят рибосома, мРНК, тРНК, вновь синтезированный пептид и белковые факторы терминации. Почти всегда мРНК транслируется одновременно множеством рибосом. Образующаяся при этом структура называется полирибосомой или полисомой. Вероятно, преимущество такого процесса заключается в возможности синтеза некоторых копий полипептида, прежде чем мРНК будет расщеплена ферментами деструкции РНК. Размеры полисомных комплексов сильно отличаются, но обычно они определяются размерами молекулы мРНК. Молекулы мРНК, состоящие из нескольких тысяч нуклеотидных остатков, могут образовывать комплексы с 50 – 100 рибосомами. Процессинг белков. Большинство белков синтезируется в виде предшественников, не обладающих нативной структурой. Процесс превращения белкапредшественника в зрелый белок называется созреванием или процессингом. У разных белков процессинг протекает различно, однако можно выделить отдельные этапы процессинга: а) образование дисульфидных связей между боковыми радикалами остатков цистеина, стоящих на разных участках полипептидной цепи; б) расщепление одной или большого числа определенных пептидных связей и превращение полипептида-предшественника в конечный продукт; в) присоединение простетических групп (углеводов, липидов, коферментов и др.), приводящее к образованию сложных белков и ферментов; г) химическая модификация боковых радикалов некоторых аминокислотных остатков в определенных белках (фосфорилирование, метилирование, гидроксилирование, карбоксилирование, йодирование и др.). д) ассоциация субединиц как необходимый этап для белков, обладающих четвертичной структурой. Код белкового синтеза. Передачу генетической информации от ДНК к белку можно выразить схемой: ДНК → мРНК → белок Реализуется эта схема посредством сложных биохимических процессов, протекающих в каждой клетке организма, один из которых – биосинтез белка. Путем сложных и кропотливых экспериментов было доказано соответствие кодонов мРНК и определенных аминокислотных остатков в структуре белка. Известно, что 20 протеиногенных аминокислот кодирует 61 кодон, т. е. многие аминокислоты кодируются несколькими кодонами. Исключение составляют метионин и триптофан. Остальные 18 аминокислот кодируются двумя и большим количеством кодонов. Контрольные вопросы. 1. Расшифровать сокращенные обозначения: рРНК, тРНК, мРНК, их количественные соотношения. 2. Что следует понимать под цитоплазматическим этапом синтеза белка? 90 3. Охарактеризовать рибосомный этап биосинтеза белка. 4. Охарактеризовать этапы элонгации и терминации в синтезе белка. 5. Охарактеризовать этапы, имеющие место в процессинге белков. Лекция № 13 ОБМЕН НУКЛЕОТИДОВ И НУКЛЕИНОВЫХ КИСЛОТ. Нуклеопротеиды – сложные белки. Они вместе с нуклеиновыми кислотами содержатся в наибольшем количестве в клеточных ядрах. Переваривание нуклеопротеидов и нуклеиновых кислот, всасывание продуктов их расщепления происходит в пищеварительном тракте. Первые продукты гидролиза нуклеотидов это белки и нуклеиновые кислоты, или полунуклеотиды. Расщепление осуществляется пепсином и хлороводородной кислотой желудка, а в тонком кишечнике – трипсином. Белок подвергается дальнейшему расщеплению до аминокислот, а полинуклеотиды распадаются в тонком кишечнике до мононуклеотидов. ДНК расщепляются дезоксирибонуклеазой (ДНК-аза), а РНК –рибозонуклеазой (РНКаза), выделяемые поджелужочной железой и тонким кишечником. Часть образовавшихся мононуклеотидов расщепляется фосфотазой кишечника на фосфорную кислоту и нуклеозиды. Следовательно, конечными продуктами превращения нуклеопротеидов и нуклеиновых кислот являются мононуклеотиды и нуклеозиды. Они всасываются кишечником, приносятся кровью в печень и различные ткани, где частично затрачиваются на синтез клеточных нуклеиновых кислот и нуклеопротеидов, а частично расщепляются до конечных продуктов нуклеинового обмена, выводимых мочой. Внутриклеточный нуклеиновый обмен касается изношенных или обновляемых нуклеиновых соединений, а также части всосавшихся ненужных нуклеотидов и нуклеозидов. При этом, в тканях, преимущественно в печени, происходят дальнейшие превращения. Тканевые ДНК-аза и РНК-аза расщепляют нуклеиновые кислоты на мононуклеотиды. Фосфатаза отщепляет от них фосфорную кислоту, вследствие чего образуются нуклеозиды. Тканевая нуклеозидаза расщепляет нуклеозиды на рибозу, пиримидиновые и пуриновые основания. Рибоз после некоторых превращений окисляется до угольного ангидрида и воды, а фосфорная кислота затрачивается на различные надобности организма или выводится с мочой в виде фосфорных солей. Азотистые циклические основания нуклеиновых кислот – пиримидиновые и пуриновые вещества – подвергаются дальнейшим превращениям. К пиримидиновым основаниям относятся цитозин, тимин и урацил. Вероятно, пиримидиновые азотистые основания при окислении и других изменениях образуют конечный продукт обменв – мочевину, что было установлено относительно урацила. Обмен нуклеопротеидов часто медики называют пуриновым обменом.К этим основаниям относятся аденин и гуанин. Они являются производными пурина и содержат аминогруппу, вслелствие чего называются аминопуринами. 91 Строение, превращения и конечный продукт обоих аминопуринов в принципе одинаковы. Поэтому проследим прежде судьбу аденина. Аденин под влиянием аденазы окислительно дезаминируется в окси пурин, или гипоксантин. Последний, присоединяя молекулу воды и отщепляя два атома водорода, окисляется в диоксипурин, или ксантин. Ксантин таким же путем окисляется в триоксипурин, или мочевую кислоту. Оба последние превращения обуславливает ксантиноксидаза. Вероятно, в тканях человека и высших животных дезаминирование аденина происходит еще в составе нуклеозидов. Гуанин, как оксиаминопурин, окислительно дезаминируясь гуаназой, сразу же превращается в диоксипурин, или ксантин, окисляемый затем в мочевую кислоту. Следовательно, судьба гуанина такая же, как и аденина. Таким образом, у человека, а также у птиц, конечным продуктом пуринового обмена является мочевая кислота. Но у большинства млекопитающих мочевая кислота окисляется далее в аллантоин – с разрывом одного кольца. Мочевая кислота очень трудно растворяется в воде (1 : 40000). В тканях, крови и моче она содержится в виде более растворимых мочекислых солей натрия, которые называются уратами, певичными или вторичными, что зависит от содержания одного или двух атомов натрия в молекуле. В таком виде мочевая кислота и выводится с мочой. Подагра, как патология пуринового обмена. Нарушение пуринового обмена вызывает особое заболевание – подагру, название которого происходит от греческих слов: поус – нога, агриос – жестокая. Болезнь представляет собой «привилегию» людей, по – видимому, потерявших в порядке эволюции способность превращать мочевую кислоту в аллантоин, хорошо растворимый в воде, и, потому, не приводящий к подагре. Чаще всего подагрой страдают мужчины, притом пожилого возраста, длительно потреблявшие обильную мясную пищу, особенно печень и почки, богатые пуринами. Заболевание характерно хроническим, периодически обостряющимся воспалением суставов и окружающих тканей, в которых происходит отложение кристаллических мочекислых солей. При этом поражаются суставы, главным образом стопы, особенно часто – большого пальца. Форма суставов обезображивается. Вблизи суставов также образуются очаги воспаления, или подагрические узлы. Время от времени происходят подагрические приступы: обострение процесса с местными жестокими болями. Для лиц, страдающих подагрой, в ряде случаев характерно повышенное содержание мочекислых солей в крови и пониженное выделение уратов с мочой. Перед приступом обычно наблюдается резкое понижение выделения мочекислых солей, а после приступа, наоборот, выведение уратов значительно возростает. 1.1.12. ВЗАИМОСВЯЗЬ МЕЖДУ ОБМЕНОМ УГЛЕВОДОВ, ЖИРОВ И БЕЛКОВ. Изучение биохимического материала, связанного с обменом веществ, рассматривается поэтапно – облен жиров, обмен углеводов, обмен белков. Такое 92 деление процессов является искусственным, но удобным для изучения. В действительности обмен всех трех соединений в организме протекает одновременно и совместно, хотя и в различных объемах. Уже первый этап обмена – пищеварение, представляет собой расщепление углеводов, жиров и белков. Люди биологически приспособились к перевариванию смешанной пищи. Питание человека только одним каким – нибудь видом пищевых веществ, в скором времени вызывает расстройство пищеварения. Суточная потребность человека в энергетических веществах равняется приблизительно2500 калориям. Например, рацион питания, составленный лишь из одного какого – нибудь вещества: 600 г углеводов или 300 г жиров, или 600 г белка –уже в первые дни у человека наступает глюкозурия и расстройство пищеварительного тракта. Еще большая общность обмена различных соединений имеется при внутриклеточном обмене. Одним из промежуточных продуктов расщепления углеводов авляется «активная уксусная кислота», или ацетил-кофермент А. Но и при распаде жиров, и при окислении углеродной цепочки аминокислот появляется то же самое промежуточное вещество. Следовательно, именно в этом пункте, в момент образования одного и того же промежуточного соединения углеводный, жировой и белковый обмен сливаются воедино. И далее этот промежуточный продукт расщепляется в одном и том же цикле трикарбоновых кислот до одних и тех же конечных продуктов, воды и угольного ангидрида. Однако при определенных условиях единство обмена различных веществ может опять дифференцироваться и пойти по разным путям, но уже в других направлениях. На этом основана возможность взаимопревращений углеводов, жиров, аминокислот и переход одного вещества в другое. Например, «активная уксусная кислота», получившаяся при расщеплении углеводов, может синтезироваться в жирные кислоты и жиры. Таким же путем жиры образуются из промежуточного продукта расщепленя углеродной цепочки белков. И наоборот, при сахарном диабете большое количество углеводов возникает из уксусной кислоты, появляюшейся при окислении жиров и белков. И, наконец, многие заменимые аминокислоты могут синтезироваться из промежуточных продуктов расщепления углеводов и жиров путем их аминирования, или присоединения аминогруппы. Так из пировиноградной кислоты может образоваться аланин, из кетоглутаровой и щавелевоуксусной кислот, являющимися промежуточными веществами цикла трикарбоновых кислот, соответствующие аминокислоты – глютаминовая и аспарагиновая. Конечно, возможности синтеза аминокислот из других веществ весьма органичены по сравнению с синтезом жиров и углеводов. Образование новых аминокислот может происходить только при наличии в тканях свободного аммиака, освобождающегося при дезаминировании других аминокислот. Переаминирование или перенос аминогруппы с одной аминокислоты на другую, сумму аминокислот не меняет. 93 Живой организм не может усваивать азот из атмосферы или азотистых минеральных веществ, как это делают растения и некоторые микроорганизмы. Тем более не может быть речи о синтезе в живом организме более сложных незаменимых аминокислот. Они доставляются организму только с пищей. Лекция № 14 ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ. План 1. Общая характеристика обмена веществ и энергии. 2. Сущность окисления. 3. Биохимия дыхания. 4. Основной обмен. 5. Функции крови в процессе дыхания. 6. Механизм транспорта СО2. Обмен веществ и энергии составляет сущность жизнедеятельности любого организма. Явление жизни определяется как «способ существования белковых тел», существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой. Обменом веществ называется непрерывный самосовершенствующийся и саморегулируемый круговорот веществ, протекающий в процессе существования живой материи и сопровождающийся ее постоянным самообновлением. Процесс обмена веществ, который выражается в поглощении, накоплении, усвоении веществ из окружающей среды и синтезе за их счет структурных единиц своего тела носит название анаболизма или ассимиляции; противоположный процесс, включающий разрушение веществ, распад элементов живого тела, выделение продуктов распада называется катаболихмом или диссимичяцией. Обмен веществ представляет сочетание противоположных процессов: а) физиологические процессы (питание – выделение); б) физические процессы (сорбция – десорбция); в) химические процессы (распад – синтез). Химические процессы носят название промежуточного обмена веществ, который изучает динамическая биохимия. Энергия, необходимая для химических процессов, протекающих в организме, доставляется пищевыми веществами. Энергию окисления пищевях веществ обычно учитывают суммарно. При сжигании основных пищевых веществ в калориметрической бомбе получены следующие величины в ккал: 1 г жира – 9,4; 1 г углевода – 4,2; 1 г белка – 5,3. Так как превращение пищи в желудочно-кишечном тракте неполное, то при сгорании 1 г углеводов и белков выделяется 4 ккал, и 1 г жира – 9 ккал. Человек должен компенсировать баланс энергии. Для определения количества 94 выделяемой человеком энергии измеряется объем выделяемой углекислоты в определенный промежуток времени. Отношение выделяемой углекислоты к поглощенному кислороду носит название дыхательного коэффициента (ДК). Его легко определить экспериментально: ДК = СО2/О2 При окислении углеводов суммарный процесс выражается формулой: CnH2nOn + nO2 → nCO2 + nH2O и ДК при этом равен 1; при окислении белков ДК составляет 0,8, так как при их окислении образуется карбамид (H2N-CO-NH2); ДК жиров = 0,7. Среднее значение ДК для человека составляет 0,83 – 0,87 и это значение зависит от функционального состояния конкретного организма. Определение интенсивности обмена веществ с помощью газового анализа широко применяется в медицинской практике и носит название основного обмена. Под этим термином понимают количество тепла, вырабатываемого организмом в состоянии покоя и определяется в течение 15 минут после 12 и-часового голодания. Основной обмен зависит от возраста, веса тела, климатических факторов, пола. Например, основной обмен в ккал∕м2.час в зависимости от возраста и пола имеет следующие значения: Основной обмен, ккал/м2.час Возраст, лет ___________________________________________ Мужчины Женщины 6 52,7 50,7 18 42,9 37,3 40-44 38,3 35,3 75-79 34,2 32,3 _____________________________________________________________________________ На основной обмен влияет величина поверхности. Установлено, что чем меньше животное, тем выше основной обмен. Например, у лошади – 0,45 ккал/час на 1 кг веса, а у мыша – 3,1 ккал/час на 1 кг веса. При расчете на поверхность тела величины почти сравнялись – для лошади 3,8, для мыша 3,9 ккал/час.см2. На основной обмен влияют состояние нервной системы, паталогия щитовидной железы. Отклонения от нормы при этом могут составлять 30 – 50%. В настоящее время установлено, что в организме преобладают реакции с выделением свободной энергии с выделением свободной энергии связанной с одним и тем же процессом – синтезом АТФ и расщеплением АТФ. Следовательно, АТФ представляет собой основное звено механизма, которое связывает энергопроизводящие и энергопоглощающие процессы в организме, т.е. АТФ в клетках обеспечивает энергетический режим. АТФ по современным данным может принимать участие в двух типах реакций, т.е. накопления и использования: NH2 95 │ C N C N HC C CH OH │ H N N OH │ H H OH OH │ │ + X↔ CH2-O-P-O-P-O-P(OH)2 ║ ║ ║ +У↔ H O O O O АТФ ↔ Х-фосфат + АДФ ↔ АМФ-У + Н4Р2О7 пирофосфат Обе реакции обратимы и отражают справа налево аккумуляцию энергии в пирофосфатной связи АТФ, а слева направо – использование этой энергии. В живом организме при нормальных условиях расщепление крайних фосфатных связей составляет 7 – 8 ккал/vjkm. Эту энергию принято называть «содержанием энергии связи». Сущность окисления. Первоначально процесс окисления связывали только с присоединением кислорода к какому-либо веществу. В настоящее время доказано, что процесс окисления связан с процессом восстановления. Эти процессы получили название окислительно-восстановительных и они представляют единое целое. Например, ион О2- реагирует с водой: О2- + НОН → 2ОН-, или СН3-СН2-ОН → Н2 + СН3-СН=О По аналогии с выше рассмотренной реакцией этап биологического окисления состоит в отдаче водорода субстратами и, несмотря на огромное разнообразие органических веществ в живом организме, их можно свести к трем типам: 1. Дегидрирование насыщенных соединений с образованием кратных связей: СООН │ СН2 │ СН2 │ СООН → Н2 + НООС-С-Н ║ Н-С-СООН фумаровая кислота 96 янтарная кислота 2. Дегидрирование спиртов до а) альдегида; б) до кетона: а) СН3-СН2-СН2-ОН → СН3-СН2-СН=О + Н2 б) СН3-СН(ОН)-СН3 → СН3-СО-СН3 + Н2 При этом цепь может вкючать гидратацию и дегидрирование: СООН СООН │ │ НООС-С-Н СН-ОН С=О ▪ ║ + НОН → ∫│ → 2Н + │ Н-С-СООН СН2 СН2 │ │ СООН СООН яблочная кислота щавелевоуксусная кислота 3. Перевод альдегидов в карбоновые кислоты через гидратную форму альдегидов и дегидрирование аминокислот с последующим гидролизом: а) R-CH=O + HOH → R CH(OH)2 → 2H▪ + RCOOH б) COOH │ H-C-NH2 → 2H▪ │ CH3 аланин COOH COOH │ │ + ∫C=NH + HOH → NH3 + C=O │ │ CH3 CH3 имин аланина пировиноградная кислота В биологических системах перенос водорода осуществляется специфическими ферментами и коферментами. Для большинства ферментов, переносящих водород, известны два кофермента: никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотидфосфат (НАДФ) CONH2 │ OH │ C + N - C │ │ H H CH N H2NN OH │ C │ C O H │ ║ CH2 - O -P-OH O │ H O O │ │ N - C H H C-CH2-О -P-OH │ │ │ ║ N C C H O │ │ 97 OH OH НАД О ║ Р(ОН)2 │ CONH2 O │ │ C + N - C │ │ H H O H O CH │ N N - C H │ H2NN C N │ OH OH │ C │ H H │ C │ OH C O │ ║ CH2 - O -P-OH │ O │ C-CH2-О -P-OH │ ║ H O НАДФ Открытие этих нуклеотидов связано с именем Варбурга и послужило началом современных представлений о ступенчатых реакциях дыхательной цепи. Лекция № 15 Биохимия дыхания. Дыхание является основным процессом, снабжающим энергией живые организмы. У животных процесс дыхания можно разбить на следующие стадии: 1. Поглощение кислорода из вдыхаемого в легкие воздуха. 98 2. Связывание кислорода кровью и его перенос (транспорт) во все ткани животного организма. 3. Освобождение кислорода кровью и его диффузия в ткани и клетки организма. 4. Окисление в тканях углеводов, жиров, белков с участием кислорода (тканевое дыхание). Здесь же идет образование конечных продуктов СО2 и Н2О. 5. Диффузия образовавшегося СО2 из тканей в кровь. 6. Связывание СО2 кровью и перенос (транспорт) его к легким. 7. Освобождение СО2 и выделение его с выдыхаемым воздухом. Процесс сложный и многоэтапный. Поэтому детальному рассмотрению подлежат три этапа дыхания: 1. Закономерности, связывающие вдыхаемый кислород с выдыхаемым углекислым газом, т. е. вопросы основного обмена; 2. Функция крови в процессе дыхания; 3. Тканевое дыхание. 1. Основной обмен. Ранее был приведен расчет дыхательного коэффициента, определенного экспериментально для углеводов равный 1. Аналогичный расчет можно провести для жиров, например, для триолеина: СН2-О-СО-С17Н33 │ СН-О-СО-С17Н33 + 80О2 → 57СО2 + 52Н2О │ СН2-О-СО-С17Н33 ДК = 57/80 = 0,71 В случае белков процесс осложняется тем, что побочно выделяется мочевина и другие азотистые вещества. Тем не менее, такие расчеты проведены и определено количество образующейся энергии при полном покое и для человека за сутки это составляет: Белок 75 х 4 = 300 К; Жир 82 х 9 = 738 К; Углеводы 204 х 4 = 816 К, что в сумме составляет 1854 К. Если организм совершает работу, процессы окисления идут энергичнее, веществ распадается больше, следовательно, образуется больше энергии, а значит и питательных веществ в организм должно поступать больше, чем во время покоя. Зная нагрузку в процессе работы, можно рассчитать количество энергии, образующееся в процессе дыхания и необходимое количество белков, жиров и углеводов и количество кислорода для их окисления. Расчеты показали, что потребуется около 1584 л кислорода, в переводе на воздух, где содержание кислорода составляет 15 объемных процентов, потребуется через легкие пропустить 30000 литров воздуха. При этом образуется приблизительно 1275 литров углекислого газа. Такое количество газов (СО2, О2, N2) не может быть перенесено кровью только за счет физической растворимости, которая практически ничтожно по сравнению с приведенными количествами вдыхаемого воздуха и выдыхаемого углекислого газа. Следовательно, кровь для 99 транспорта газов обладает особыми механизмами, играющими существенную роль в процессе дыхания. Функции крови в процессе дыхания. В переносе кислорода принимает участие красное вещество крови – гемоглобин. Это хромопротеид, состоящий из белковой части глобина и простетической группы гема с порфириновой основой: СН3 СН=СН2 │ │ HC CH N H3C ─ CH3 N Fe ↑ N │ ( CH2) │ COOH ─CH=CH2 CH CH N │ │ (CH2)2 CH3 │ COOH гем 100 Содержание железа в гемоглобине составляет 0,33 – 0,34 %. По определению молекулярной массы гемоглобина было установлено, что она составляет 66800 у. е., а это значит, что гемоглобин состоит из четырех остатков гемма, соедененных с глобином: Fe2+ Fe2+ глобин (белок) Fe2+ Fe2+ В норме 100 мл крови содержат 15,9 г гемоглобина (это 100%), часто оно понижено и составляет 80 – 90% от нормы, т. е. 12,72 – 14,37. Содержание гемоглобинеа менее 70% является признаком заболевания «анемия» (11,33 и меньше). Экспериментально доказано, что эритроциты, содержащие гемоглобин, циркулируют в крови 120 дней, затем обновляются с помощью селезенки и костного мозга. В синтезе гемма существенную роль играет гликокол, что доказано реакциями с меченым азотом N15 . Гемоглобин обладает способностью образовывать оксигемоглобин. Это непрочное соединение с молекулярным кислородом (окраска алая), что схематично можно представить: → 2+ 2+ Fe Fe → глобин (белок) + nО2 → Fe2+ Fe2+ Fe2+ ﴾ Fe2+ глобин Fe2+ Fe2+ Fe2+ (белок) ) ▪ О2 Fe2+ Fe2+ ﴾ → Fe2+ глобин (белок) ) ▪ 2О2 Fe2+ Fe2+ 101 ﴾ глобин Fe2+ Fe2+ Fe2+ ﴾ (белок) ) ▪ 3О2 Fe2+ глобин (белок) ) ▪ 4О2 Fe2+ Fe2+ Из приведенной схемы следует, что гемоглобин может присоединять от 1 до 4 моль кислорода, не более. Переход гемоглобина в оксигемоглобин зависит от парциального давления кислорода во вдыхаемом газе. Гемоглобин, соприкасаясь в альвеолах легких с вдыхаемым воздухом (21% содержания кислорода, что соответствует 150 мм парциального давления кислорода) почти весь (99%) переходит в оксигемоглобин. Это значит, что100 мл крови с содержанием 15 г гемоглобина, поглотят приблизительно 20 мл кислорода. В тканях парциальное давление кислорода около 20 – 40 мм. Оксигемоглобин при этом давлении частично распадается и выделяется приблизительно 30% всего поглощенного кислорода, за счет чего и происходит постоянное снабжение тканей молекулярным кислородом. Извесно также, что гемоглобин может соединяться и с другими газами, например с СО (угарный газ) с образованием карбоксигемоглобина. Карбоксигемоглобин – прочное соединение и транспорт кислорода в этом случае прекращается, что приводит к удушью. Под действием других окислителей может образоваться метгемоглобин сFe3+, который не обладает способностью соединяться с молекулярным кислородом и, следовательно, участвовать в его транспорте. В качестве сильных окислителей могут быть яды – анилин, амилнитрит, нитробензол и др. Тогда следует использовать противоядия, например цианиды, аскорбиновую кислоту и другие сильные восстановители, способные ускорять процесс восстановления метгемоглобина в гемоглобин. Механизм транспорта СО2. Механизм транспорта СО2 заключается в том, что в нем принимают участие и эритроциты крови и плазмы крови. Небольшая часть углекислого газа остается в растворенном виде и частично связывается водой и белками плазмы: СО2 + НОН ↔ Н2СО3 H2СО3 ↔ Н+ + НСО3Н+ + НСО3- + Н2N-белок плазмы → Н2О + белок-NH-COOH ↔ ↔ белок-NH-COO- + H+ 102 Основная же часть СО2 дифундирует в эритроциты и быстро реагирует с водой под действием карбоангидразы: карбоангидраза СО2 + Н2О ↔ Н2СО3 В плазме фермента карбогидразы нет, поэтому углекислый газ переходит в эритроциты, где и идет диссоциация: гобин –NH2 + СО2 ↔ глобин –NH-COOH ↔ глобин –NH-COO- + H+ Ионы водорода в эритроцитах связываются буферной системой фосфатов и гемоглобина: Н+ + НРО42- ↔ Н2РО41Н+ + Гм- ↔ НГм далее: НГм + О2 (из оксигемоглобина) → НГмО2 НГмО2 → ГМО2- + Н+ Н+ + НСО3- → Н2СО3 Н2СО3 → Н2О + СО2 Образующийся угольный ангидрид переходит в выдыхаемый воздух. В образовании СО2 принимают участие кислые фосфат-ионы, белки плазмы и гемоглобина: НСО3- + Н2РО4- → НРО42- + ∫ Н2СО3 → СО2 + Н2О Белок-NH2 + Н+ → белок-NH-СООН → СО2 + белок - NH2 Приведенные реакции дают газообразный угольный ангидрид, который и выделяется с выдыхаемым воздухом. Тканевое дыхание. Под тканевым дыханием следует понимать реакции сложных органических веществ тканей с кислородом, приносимым кровью. При этом выделяется энергия, а вещества распадаются до угольного ангидридо и воды. Внешне эта реакция похожа на реакцию горения, например, сахарозы, которую можно рассматривать как окислительно-восстановительную реакцию: С12Н22О11 + хО2 → хСО2 + уН2О. Но для реакции горения необходимо наличие энергии, т. е. нагревание до определенной температуры, чтобы осуществить взаимодействие органического вещества с кислородом. Процессы окисления – восстановления в живом организме идут при низкой температуре (+37 оС) , поэтому нужен особый механизм преодоления энергетического барьера. Это достигается включением в реакцию ряда катализаторов – ферментов, образующих цепь промежуточных продуктов реакции, а чем больше промежуточных реакций, тем меньше величина 103 энергетического барьера. В тканевом дыхании принимают участие три механизма активации: а) активация отнятия водорода; б) активация переброса электрона; в) активация кислорода, как конечного акцептора водород. Реакция окисления сложных органических веществ (субстратов) в процессе дыхания начинается с его дегидрирования (фермент дегидрогеназа), что можно показать схемой: субстрат▪Н2 + Д дегидрогеназа окисленный субстрат + ДН2 восстановленная дегидрогеназа В состав дегидрогеназы входит никотинамид, он и отнимает водород от органического субстрата: CONH2 │ OH │ C + N - C │ │ H H OH │ C │ C O H │ ║ CH2 - O -P-OH O │ H O O ▪ белок + субстратН2 ↔ CH │ │ N N - C H H C-CH2-О -P-OH │ │ │ ║ H2NN C C H O N │ │ OH OH дегидрогеназа CONH2 │ OH │ C N- C │ │ H H CH N H2NN OH │ C │ C O H │ ║ CH2 - O -P-OH O │ H O O ▪ белок + │ │ N - C H H C-CH2-О -P-OH │ │ │ ║ N C C H O │ │ OH OH субстрат 104 Так как дегидрогеназа имеет очень низкий потенциал восстановления, реакция протекает при температуре тела. Дегидрогеназы восстановленные (НАДН2) передают водород флавиновым ферментам, что модно видеть на сокращенной схеме: НАДН2 + ФМН → восстановленная флавиномононуклеотид НАД + окисленная ФМНН2 восстановленный флавин мононуклеотид ОН │ СН2- (СНОН)3-СН2О-Р-О-белок │ ║ CH N N О H3C-C C C C=O │ ║ │ │ + НАДН2 → НАД + H3C-C C C NH CH N C ║ O флавиновый фермент ОН │ СН2- (СНОН)3-СН2О-Р-О-белок │ ║ CH N NН О H3C-C C C C=O + │ ║ ║ │ H3C-C C C NH CH NН C ║ O восстановленный флавиновый фермент Восстановленный флавиновый фермент передает полученные атомы водорода активированному кислоролу. В этой последней стадии важную роль играет цитохромная система, содержащая лябильный атом железа в геминовом кольце. Железо в цитохроме легко отдает свои электроны кислороду, переводя его в 105 ионное состояние. Окисленный цитохром восполняет потерянные электроны от восстановленного флавина. Образующиеся протоны реагируют с ионизированным кислородом, образуя воду: 2Ц▪ Fe2+ → 2Ц▪Fe3+ + 2e _ О2 + 2 е → 2О2ФМНН2 + 2Ц▪Fe3+ → 2Ц▪Fe2+ + ФМН + 2Н+ восстановленный окисленный + 22Н + 2О → Н2О2 2Н2О2 → 2Н2О + О2 Приведенный химизм носит название транспорта электронов, который осуществляется в специальных субклеточных частицах – митахондриях. В них упорядоченно расположены ферменты дыхания, обеспечивающие весь транспорт электронов, при этом выделяется вся энергия, заключенная в субстрате, часть выделяется в виде тепла. Основная энергия тканевого дыхания запасается в АТФ, которая образуется в митахондриях из АДФ и Н3РО4: АДФ + Н3РО4 → Н2О + АТФ Эта реакция называется окислительным фосфорилированием, а образован- ная связь Р---О обладает большим запасом энергии. Окисляемые субстраты (углеводы, жиры, аминокислоты) дают кетонокислоты, которые декарбоксилируются, образуя СО2: R-CO-COOH + HOH → 2H▪ + CO2 + R-COOH Таково происхождение СО2 в процессе тканевого дыхания. Контрольные вопросы. 1. Дать определене понятиям анаболизм, катаболизм. Какие противоположные процессы представляет обмен веществ? 2. Каковы энергетические характеристики для жиров, белков, углеводов? Что такое ДК и как он рассчитывается? 3. Составить схему двух типов реакций для АТФ. Что они отражают? 4. Сущность окисления: привести три типа реакций, обосновать. 5. Составить формулу никотинамидадениндинуклеотид (НАД). В чем заключается отличие НАД от НАДФ? 6. В чем заключается функция крови в процессе дыхания. Привести строение гемма. 7. С помощью химических превращений обосновать механизм транспорта угольного ангидрида. 8. Составить схему реакции окисления субстрата с НАД. Какой фермент при этом участвует и его роль? Лабораторные работы. 1.Липиды. Исследование фосфатидов. 106 Липиды – разнородная по химическому строению группа органических веществ биологического происхождения, практически нерастворимых в воде и легко растворимых в органических неполярных (хлороформ, эфир, бензол, дихлорэтан и др.) и полярных (метанол, этанол, ацетон и др.) жидкостях. Разнообразие химического строения липидов затрудняет их классификацию. Эту группу веществ можно разделить на липидные мономеры (жирные кислоты, высшие алифатические и амино-спирты и др.), простые липиды, куда входят ацилглицерины, воска, диольные липиды; сложные липиды, включающие фосфолипиды и гликолипиды и стероиды, наиболее распространенные из них – холестерин и его эфиры. Биологические функции липидов в живых организмах многообразны. Они содержатся в жидких средах и входят в состав биологических мембран клетки организма. В виду плохой растворимости в воде липиды образуют соединения с гидрофильными молекулами, такими как белки и углеводы. Образование липид – белковых компонентов (липопротеидов) придает липидам растворимость в воде и позволяет транспортироваться с кровью и лимфой в организме. Своеобразие растворимости используется при исследовании липидов, так как позволяет отделить их от других веществ, которые находятся в биологическом материале. Поэтому подбор растворите-лей в ходе извлечения липидов из образцов имеет большое значение при их анализе. Для обнаружения и количественного определения отдельных представителей липидов, экстрагированных из биологического материала, существуют различные физико-химические методы и реакции на функциональные группы. Анализ липидов проводят путем постановки специфических реакций на составные части в целой молекуле или после ее гидролиза. Исследование фосфолипидов Цель работы. 1. Извлечение фосфатидилхолинов из биоматериала (ткани мозга) и их обнаружение в экстрактах; 2. Выявление составных компонентов фосфатидилхолинов. Реактивы. Этиловый спирт, 96%-ный; сульфат кальция (порошок); ацетон; хлорид кадмия, насыщенный раствор в 96%-ном этаноле; гидроксид натрия 10%-ный раствор; хлористоводородная кислота 10%-ный раствор; гидросульфит калия, безводный порошок; реактив молибдата аммония▪; нитрат калия, порошок; карбонат калия, порошок; азотная кислота, 10%-ный раствор; лакмусовая бумага. ●Молибдат аммония в азотной кислоте, приготовление: 7,5 г молибдата аммония растворяют в 100 мл воды и прибавляют 100 мл 32%-ной азотной кислоты. Оборудование. Весы аптечные; ступка с пестиком; стеклянные пластинки (100 х 50 мм); стеклянные палочки; скальпель; глазные пипетки; пипетки вместимостью 2 и 107 5 мл; воронки с бумажными фильтрами; водяная баня; тигли; сушильный шкаф, отрегулированный на 60о С. а) извлечение фосфатидилхолинов из ткани мозга Метод основан на экстракции горячим этанолом фосфатидилхолинов из мозга, осаждении их ацетоном и гидролизе в среде с гидроксидом натрия на составные части (жирные кислоты, глицерин, холин и фосфорная кислота). Ход определения. На технических весах отвешивают 1 г ткани мозга, помещают в ступку и тщательно растирают с 3 г гипса до получения однородной густой кашицы. Кашицу распределяют тонким слоем на стеклянной пластинке при помощи скальпеля и высушивают в сушильном шкафу при 60о С досуха. Сухую массу соскабливают со стекла скальпелем в сухую ступку, растирают и затем переносят в сухую пробирку. Прилив 5 мл этанола, пробирку закрывают пробкой с обратным холодильником (стеклянная трубка длиной 70 – 80 см). Пробирку ставят в водяную баню и нагревают 10 – 15 минут при 70о С (для экстракции). Затем спиртовый экстракт отфильтровывают через бумажный фильтр. Если раствор будет мутным, то фильтрование повторяют через тот же фильтр. Фильтрат используют для анализа. б) обнаружение фосфатидилхолина в экстрактах. Метод основан на нерастворимости фосфатидилхолинов в ацетоне, способности их образовывать эмульсии в воде и давать комплексное соединение с хлоридом кадмия, выпадающее в виде хлопьевидного осадка. Ход определения. В сухую пробирку наливают 2 мл ацетона и по каплям прибавляют спиртовый фильтрат, полученный в предыдущем отыте. Наблюдают за помутнением жидкости и выделением осадка. В пробирку вносят 20 капель дистиллированной воды и постепенно приливают 5 капель спиртового фильтрата мозга. Хорошо встряхивают содержимое и наблюдают за образованием устойчивой белой эмульсии. К 1 мл спиртового фильтрата мозга добавляют 0,5 мл спиртового раствора хлорида кадмия. Отмечают выпадение хлопьевидного осадка. в) Выявление составных компонентов фосфатидилхолинов. Метод основан на гидролизе выделенных фосфатидилхолинов в растворе гидроксида натрия и постановке качественных реакций на составные части их молекул: жирные кислоты, глицерин, холин и фосфорную кислоту. Жирные кислоты обнаруживают добавлением хлороводородной кислоты к гидролизату, в котором содержатся растворимые натриевые соли жирных кислот; в результате образуются нерастворимые свободные жирные кислоты, всплывающие на поверхность. Холин при нагревании превращается в триметиламин, имеющий запах селедочного рассола. Триметиламин также 108 обладает выраженными основными свойствами, поэтому выявляется по посинению красной лакмусовой бумажки. Акролеин обнаруживается по характерному запаху пригоревшего жира. Фосфорную кислоту определяют по образованию желтого осадка фосфомолибдата аммония. Ход определения. 1.Гидролиз фосфатидилхолинов. Спиртовый экстракт, полученный в пункте а) из ткани мозга частично упаривают в пробирке на водяной бане и добавляют 3 мл раствора гидроксида натрия. Кипятят в течение 10 минут: СН2-О-СО-С15Н31 │ СН –О-СО-С15Н31 + 2NaOH + xH2O │ СН2 –О- Р(ОН)-О-СН2-СН2-N(СН3)3]ОН ║ О дипальметатфосфатидилхолин CH2-OH │ CH –OH + 2C15H31COONa + H3PO4 + [ HO-CH2-CH2- N(CH3)3]OH │ CH2-OH C гидролизстом проводят следующие реакции: Открытие холина. В пробирку вносят 20 капель гидролизата и нагревают. При нагревании идет образование триметиламина из холина, который обнаруживают по появлению запаха селедочного рассола: нагревание [HO – CH2- CH2-N(CH3)3] OH НО-СН2-СН2-ОН + N(CH3)3 триметиламин К отверстию пробирки подносят красную лакмусовую бумажку и наблюдают за изменением ее окраски. Делают вывод. Открытие жирных кислот. К оставшемуся гидролизату прибавляют по каплям раствор хлороводородной кислоты до кислой реакции среды, контролируемой лакмусовой бумагой (синий лакмус). На поверхность жидкости всплывают в виде хлопьевидной массы 109 высшие жирные кислоты. Содержимое пробирки фильтруют через складчатый бумажный фильтр, на котором задерживаются жирные кислоты. Фильтрат нейтрализуют (по лакмусовой бумажке), прибавляя по каплям раствор гидроксида натрия и упаривают на водяной бане досуха. Сухой остаток используют для обнаружения глицерина и фосфорной кислоты. [гидролизат (С15Н31СООNa)] + HCl → NaCl + С15Н31СООН Открытие глицерина. Часть сухого остатка переносят в сухую пробирку, добавляют несколько кристаллов гидросульфита калия и осторожно нагревают. Появляется характерный запах акролеина (пригоревший жир): нагревание НО-СН2-СН(ОН)-СН2-ОН СН2=СН-СН=О + 2Н2О глицерин акролеин Открытие фосфорной кислоты. Оставшийся сухой остаток сплавляют в тигле с небольшим количеством (на кончике скальпеля) порошка нитрата калия и карбоната натрия (сплавление проводят в вытяжном шкафу!). После охлаждения тигля к сплаву добавляют раствор азотной кислоты, смесь сливают в пробирку. К 2 мл реактива молибдата аммония приливают небольшими порциями испытуемый раствор. Смесь нагревают до кипения. При стоянии образуется желтый осадок фосфомолибдата аммония: H3PO4+12(NH4)2MoO4+ 21HNO3→ (NH4)3(PO4▪12MoO3)+21NH4NO3+ H2O фосфомолибдат аммония Задание. Оформить работу в виде таблицы и описать признаки, по которым обнаруживается соответствующее вещество: Материал Исследуемый Реакция (проба) Результат компонент реакции Практическая значимость работы. В клинико-биохимических исследованиях качественные реакции на фосфолипиды и их компоненты используются для обнаружения их в экстрактах биологического материала, а в фармацевтической практике – при анализе лекарственных препаратов, содержащих фосфолипиды.При разделении фосфолипидов эти реакции применяются для проявления хроматиграмм, а также для разработки методов количественного определения фосфолипидов. 2. Белки. Качественные (цветные) реакции на функциональные группы белков и аминокислот. Часть 1. 110 Белки Белки – высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных пептидными связями, и имеющие сложную структурную организацию. Белки делятся на две группы: простые, или протеины, и сложные, или протеиды. Протеины состоят только из аминокислот, связанных в полипептидную цепь пептидными связями, а протеиды содержат кроме аминокислот небелковый компонент, или простетическую группу (углевод, липид, нуклеиновую кислоту, кофактор и др.). Белки имеют несколько уровней структурной организации: первичный, вторичный, третичный и в большинстве случаев четвертичный.. 1. Химическая природа простых белков. Присутствие веществ белковой природы в биологическом материале можно обнаружить с помощью качественных реакций на структурные компоненты белка и его функциональные группы. Все известные реакции выявления белков и пептидов можно разделить на три типа. 1.Реакции на пептидную группу, характерную для полипептидной цепи и нетипичную для прочих биологических веществ. Она специфична для белков и пептидов. 2. Реакции на концевые α – амино- или α – карбоксильные группы. Эти реакции дают также свободные α-аминокислоты и некоторые другие соединения. 3. Реакции на отдельные боковые радикалы или группы аминокислот, входящих в полипептиды. Эти реакции специфичны также и для свободных α–аминокислот и других веществ, содержащих соответствующую функциональную группу в молекуле. Качественные (цветные) реакции на функциональные группы белков и аминокислот Цель работы: 1. Изучить цветные реакции на функциональные группы белков и аминокислот. 2. Исследовать белки на способность к денатурации. Реактивы. Биуретовый реактив (17,5 г цитрата натрия и 10 г карбоната натрия растворяют в 30 мл дистиллированной воды на водяной бане. Отдельно в 30 мл воды растворяют 1,73 г сульфата меди. Оба раствора сливают и доводят объем до 500 мл); нингидрин, 0,5%-ный водный раствор; азотная кислота, 111 конц.; гидроксид натрия «0%-ный раствор; реактив Милона (готовят под тягой!!!). В 6 мл концентрированной азотной кислоты растворяют 4 г ртути сначала на холоду, а затем слабо нагревая на водяной бане. Полученный раствор разбавляют двумя объемами воды, дают отстояться и сливают с осадка. Хранят во флаконе из темного стекла); уксусная кислота ледяная;, серная кислота конц.; ацетат свинца, 5%-ный раствор; нитропруссид натрия, 5%-ный раствор. Оборудование. Штатив с простыми пробирками; капельницы; пипетки, вместимостью 1 мл; водяная баня. Материалы для исследования. 1. Раствор яичного белка (белок одного куриного яйца отделяют от желтка, растворяют в 20-кратном объеме дистиллированной воды, фильтруют через несколько слоев марли и хранят в холодильнике). 2. Неразбавленный свежий яичный белок. 3. 1%-ные растворы глицина, глицилглицина, α-аланина, β-аланина. 4. 0,1%-ные растворы фенилаланина, тирозина, цистеина гидрохлорида, метионина. а) биуретовая реакция на пептидную группу (реакция Пиотровского). Метод основан на способности пептидной группы белков и полипептидов образовывать в щелочной среде с ионами Cu2+ комплексное соединение фиолетового цвета с красным или синим оттенком в зависимости от числа пептидных связей в белке. Биуретовая реакция положительна с белками и пептидами, имеющими не менее двух пептидных связей (-C-NH-). ║ О С ди- и трипептидами она неустойчива. В сильнощелочной среде пептидные группы полипептидов переходят в енольную форму, в которой и взаимодействуют с ионами Cu2+, образуя окрашенный биуретовый комплекс. Предполагаемое превращение можно представить схемой: R O │ ║ енолизация 2 -СН – С – NH – CH - C – NH – CH– │ ║ │ 1 R O R2 R O │ ║ 2 - СН – С =N – CH – C –NH – CH- + Cu(OH)2 + 2 NaOH │ │ │ 1 R OH R2 112 R O │ ║ - CH – C = N – CH – C – N – CH │ │ │ 1 R O R2 2Na2+ + 2 H2O Cu R2 O R1 │ ║ │ -CH – C – N – CH - C=N – CH – │ │ R OНа свободные аминокислоты биуретовая реакция обычно отрицательна, исключение составляют некоторые, например, гистидин, серин, треонин, аспарагин. Ход определения. В одну пробирку вносят 5 капель раствора яичного белка, в другую – глицилглицина и в третью – глицина. Добавляют в каждую пробирку по две капли биуретового реактива, слегка взбалтывают и наблюдают за появлением окрашивания. б) нингидриновая реакция на α-аминогруппу. Метод основан на взаимодействии нингидрина с α-аминогруппой аминокислот, пептидов, белков с образованием окрашенного комплекса синего или синефиолетового цвета. При нагревании в присутствии нингидрина происходит окислительное дезаминирование α-аминогрупп аминокислот и пептидов, а молекула нингидрина при этом восстанавливается: О ║ С ОН R-CH(NH2)-COOH + С → СО2 + NH3 + R- CH=O + С ОН ║ О О ║ С ОН 113 С + С ║ О гидринден + NH3 + Н О ║ С ОН С + С ║ О нингидрин ONH4 │ С ОН O ║ C С- N=C С C ║ ║ O O Сине-фиолетовый комплекс Руэмана Пролин и оксипролин дают с нингидрином окрашенный продукт желтого цвета. Нингидриновая реакция может быть положительна с некоторыми аминами, амидами кислот, и некоторыми другими соединениями. Ход определения. В одну пробирку вносят 5 капель раствора яичного белка, в другую – α –аланина и в третью β-аланина. Добавляют в каждую пробирку по 2 капли раствора нингидрина, негревают до кипения и через 1 – 3 минуты наблюдают появление окрашивания. в) ксантопротеиновая реакция на ароматическое кольцо циклических аминокислот. Метод основан на способности аминокислот и аминокислотных остатков полипептидов, содержащих ароматическое кольцо, образовывать при взаимодействии с концентрированной азотной кислотой динитропроизводные соединения желтого цвета. В щелочной среде они переходят в хиноидную структуру, имеющую оранжевое окрашивание. Ксантопротеиновая реакция характерна для фенилаланина, триптофана, тирозина. Например, в случае тирозина образуется динитротирозин; добавление гидроксида натрия приводит к образованию натриевой соли хиноидной структуры: ОН OH │ │ 114 O2N NO2 + 2HONO2 → 2 H2O + │ │ H2C-CH(NH2)-COOH O ║ O2N O ║ O2N + = N-OH + NaOH → H2O + таутомерия │ H2C-CH(NH2)-COOH O ║ O ║ =N-ONa │ H2C-CH(NH2)-COOH Хиноидная форма динитротирозина (желтое окрашивание) │ H2C-CH(NH2)-COOH Натриевая соль хиноидной формы динитротирозина (оранжевое окрашивание) Ксантопротеиновая реакция положительна со многими ароматическими соединениями, например бензолом, фенолами и др. Ход определения. В одну пробирку вносят 5 капель раствора яичного белка, в другую – фенилаланина, в третью – тирозина. В каждую пробирку добавляют по 3 капли концентрированной азотной кислоты, осторожно!!! нагревают до кипения и наблюдают за появлением окрашивания. Содержимое пробирок охлаждают, затем в каждую по каплям добавляют раствор гидроксида натрия, наблюдают переход окраски. г) реакция Миллона на тирозин. Метод основан на способности тирозина (как свободного, так и входящего в состав белка) при нагревании с реактивом Милона образовывать ртутную соль нитротирозина, окрашенную в пурпурно-красный цвет: ОН OH │ │ O2N NO2 + 2HONO2 → 2 H2O + таутомерия │ │ H2C-CH(NH2)-COOH │ H2C-CH(NH2)-COOH 115 O ║ O2N O ║ O2N + = N-OH + HgNO3 → HNO3 + O ║ O ║ =N-OHg │ H2C-CH(NH2)-COOH │ H2C-CH(NH2)-COOН Ртутная соль (пурпурно-красный цвет) Эта реакция положительна также для фенольных соединений. Ход определения. В одну пробирку вносят 5 капель раствора яичного белка, в другую – тирозина и в третью – фенилаланина. В каждую из них добавляют по 3 капли реактива Милона и осторожно нагревают на водяной бане (не выше 50о С), наблюдают за появлением окрашивания. д) реакция Фоля на аминокислоты, содержащие слабосвязанную серу (цистеин, цистин). Метод основан на способности белков, в состав которых входят серусодержащие аминокислоты(цистеин, цистин), в щелочной среде при нагревании образовывать сульфид натрия, который с плюмбитом натрия дает черный или бурый осадок сульфида свинца: СН2-SH │ CH –NH2 │ COOH CH2-OH │ + 2 NaOH → CH –NH2 + Na2S + │ COOH H2O (CH3COO)2Pb + 2NaOH → Pb(OH)2 + 2CH3COONa Pb(OH)2 + 2NaOH → Na2PbO2 + 2H2O Na2S + Na2PbO2 + H2O → PbS + 4NaOH Ход определения, В три пробирки наливают по 10 капель раствора ацетата свинца и по каплям в каждую из них прибавляют раствор гидроксида натрия до растворения первоначально образующегося осадка. В одну пробирку добавляют 5 капель раствора яичного белка, в другую – цистеина, в третью – метионина, смеси кипятят 1 – 2 минуты и наблюдают за изменением их цвета и выпадением осадка. 116 е) нитропрусидная реакция на серусодержащие аминокислоты. Метод основан на способности сульфида натрия, образующегося при щелочном гидролизе серусодержащих аминокислот, давать с нитропрусидом натрия окрашенное комплексное соединение красно-фиолетового цвета: СН2-SH CH2-OH │ │ CH –NH2 + 2 NaOH нагревание CH –NH2 + Na2S + H2O │ │ COOH COOH Na2S + Na2 [Fe(CN)5]NO → Na4 [Fe(CN)5 ]NOS Ход определения. В одну пробирку вносят 5 капель неразбавленного свежего яичного белка, в другую – раствор цистеина, в третью – метионина. Добавляют в каждую пробирку по 10 капель раствора гидроксида натрия, кипятят 3 минуты и затем охлаждают их содержимое. В каждую пробирку прибавляют 2 – 3 капли раствора нитропруссида натрия и наблюдают за появлением окрашивания. Задание. Оформить работу в виде таблицы и обозначить признаки, по которым обнаруживаются функциональные группы в исследуемых объектах. Исследуемый Реакция Результаты Материал химизм, название реакции __________________________________________________________________ Практическое значение работы. Качественные реакции (цветные реакции) используются в клиникобиологических лабораториях, фармацевтической практике и биохимических исследованиях для обнаружения присутствия белка и аминокислот в биологических средах, качественного анализа белковых лекарственных препаратов, препаратов гидролизатов белков и аминокислот, а также для выявления расположения аминокислот, пептидов и белков на хроматограммах и электрофореграммах. Многие качественные реакции положены в основу методов количественного определения белков и аминокислот. Часть 2 Исследование денатурации белков Вещества, нарушающие структурную организацию белковой молекулы(т.е. четвертичную, третичную и даже вторичную структуры), приводит к изменению физико-химических и биологических свойств белка. Это явление называется денатурацией. 117 Денатурирующие факторы делятся на химические, физические и биологические. Наиболее обширны группы химических факторов (кислоты,тяжелые металлы, алкалоиды, поверхностно-активные вещества и т.д.); физические факторы – температура, ионизирующая радиация, ультразвук и т. д. Биологическую денатурацию могут вызывать протеолитические ферменты (например, трипсин), которые разрушают высшие уровни организации молекулы белка перед тем, гидролизовать ее пептидные связи. Денатурация изменяет физико-химические свойства белка, в частности его растворимость. При этом белок становится менее гидрофильным и легко осаждается. Денатурация чаще всего необратима, но в ряде случаев удаление денатурирующих агентов приводит к восстановлению исходной конформации молекулы белка и его природных свойств. Это явление получило название ренатурация. Реактивы. Азотная кислота, концентрированная; сульфат меди, 5%-ный раствор; сульфат свинца, 5%-ный раствор; трихлоруксусная кислота, 10%-ный раствор; хлорная кислота, 10%-ный раствор; раствор нитрата серебра; этиловый спирт, 96%-ный; ацетон, хлороформ. Оборудование. Штатив с простыми пробирками; пипетки; водяная баня. Материал. Раствор яичного белка. а) денатурация белка концентрированными минеральными кислотами. Метод основан на способности минеральных кислот вызывать нейтрализацию зарядов и разрушение пространственной структуры белка, что приводит к его денатурации и осаждению. Ход определения. В пробирку наливают 10 капель концентрированной азотной кислоты и осторожно, держа пробирку под углом 45о, наслаивают на кислоту 5 капель раствора яичного белка. Отмечают изменения на границе двух слоев жидкостей (кольцо денатурированного белка). б) денатурация белка органическими кислотами. Метод основан на способности органических кислот нейтрализовать заряд молекулы белка и разрушать ее пространственную структуру, что приводит к денатурации и осаждению белка. Ход определения. В две пробирки наливают по 10 капель раствора яичного белка. Добавляют в одну из них 2 капли трихлоруксусной кислоты, а в другую – 2 капли хлорной кислоты, отмечают произошедшие изменения. 118 в) денатурация белка солями тяжелых металлов. Метод основан на связывании ионов тяжелых металлов с функциональными группами боковых радикалов аминокислот в молекуле белка, в результате чего разрушается ее пространственная структура и происходит осаждение денатурированного белка. При добавлении избытка солей тяжелых металлов (кроме AgNO3 и HgCl2) происходит растворение первоначально образовавшегося осадка из-за адсорбции ионов металла и приобретении вследствие этого белковой молекулой положительного заряда. Ход определения. В три пробирки вносят по 10 капель раствора яичного белка. В первую из них добавляют 1-2 капли раствора сульфата меди, во вторую – 1 – 2 капли раствора ацетата свинца, а в третью – 1 – 2 капли раствора нитрата серебра. Наблюдают за выпадением осадка белка. Прибавляют в каждую из пробирок по нескольку капель соответствующего осадителя и наблюдают изменения. г) денатурация белка органическими растворителями. Метод основан на способности органических растворителей (спирт, хлороформ, ацетон) нарушать гидрофобные взаимодействия внутри белковой молекулы и вызывать ее денатурацию, что приводит к снижению растворимости и выпадению денатурированного белка. Ход определения. В три пробирки наливают по 10 капель раствора белка и добавляют равные объемы органических растворителей: в первую – этиловый спирт, во вторую – ацетон, в третью – хлороформ. Наблюдают за выпадением белка Задание. Оформить работу. Особенности действия денатурирующих веществ указать в протоколах по каждой реакции осаждения. В выводах отметить причину денатурации белка. Практическое значение работы. Явление денатурации белков используется в клинике, фармации и биохимических исследованиях: а) для осаждения белка в изучаемом биологическом материале с целью дальнейшего определения в нем низкомолекулярных субстратов; б) для выявления присутствия белка в различных биологических экстрактах и жидкостях и количественного его анализа ( в частности, качественное и количественное определение белка в моче основано на реакции денатурации белка азотной кислотой); в) для связывания солей тяжелых металлов белком при лечении отравлений или их профилактике на производстве. г) для обеззараживания отходов в санитарной практике; д) для дезинфекции кожи и слизистых покровов. 119 3. Гидролиз белка ферментами пищеварительного тракта. Превращение белка происходит с участием протеолитических ферментов желудка (пепсин, гастриксин) и кишечника (трипсин, хемотрипсин, карбоксипептидазы А и В, аминопептидазы, эластазы и др.). Каждый из ферментов специфически гидролизует пептидные связи, образованные определенными аминокислотами в полипептидной цепи перевариваемого белка. Оптимум рН действия протеиназ желудка находится в кислой области и равен 1,5 – 2,0 для пепсина и 3,0 – 3,5 для гастриксина, в то время как протеолитическая активность ферментов кишечника максимальна при рН 7,6 – 8,5. Исследование активности протеолитических ферментов проводится путем анализа скорости гидролиза добавленного белка или определения колическва образующихся в ходе реакции пептидов и свободных аминокислот. Реактивы Фибрин; хлороводородная кислота, 0,05 и 0,1 М растворы; гидроксид натрия, 0,4%-ный раствор; карбонат натрия, 0,4%-ный раствор; лакмусовая бумага. Оборудование Штатив с пробирками; пипетки вместимостью 1 и 2 мл; термостат, отрегулированный на 38 оС. Материал Панкреатин, порошок. Перед употреблением готовят 0,1%-ный раствор. Фибрин бычьей крови отмывают от кровяных пигментов в проточной воде в течение нескольких дней до получения белого сгустка. Воду отжимают, а фибрин, залитый глицерином, хранят в плотно укупоренной банке. Перед употреблением фибрин отмывают от глицерина. Демонстрация гидролиза белка под действием панкреатина. Метод основан на визуальном наблюдении скорости гидролиза белка панкреатином, определяемой по растворимости кусочков фибрина. Ход определения. Берут три пробирки и наливают в одну из них 2 мл раствора карбоната натрия, в другую – дистиллированной воды и в третью – раствора хлороводородной кислоты (0,1М). В первую и в третью пробирки добавляют по 1 мл предварительно прокипяченного панкреатина. Перемешивают пробы встряхиванием. В каждую пробирку помещают по одинаковому кусочку фибрина и ставят их в термостат при 38 оС на 10 минут, следя за растворением фибрина. Отмесают изменения, происходящие с фибриновыми волокнами в ходе инкубации. Оформление работы. Результаты опытов оформить в виде таблицы. 120 № Условия опыта Изменения опыта Субстрат рН среды кипячение фибрина __________________________________________________________________ В выводах указать оптимальные условия действия фермента и практическое значение исследоваеия. Практическое значение работы. Переваривание белка в желудочно-кишечном тракте зависит не только от количества образующихся протеолитических ферментов, но и от условий среды, в которой они действуют. При гипохлоргидрии или анацидном гастрите имеются неблагоприятные условия (недостаток хлороводородной кислоты) для гидролиза пищевого белка. Применение щелочных растворов (питьевая сода) при данных патологических состояниях приводит к разрушению выделяемого клетками желудка фермента. Напротив, гиперхлоргидрия обуславливает более медленную нейтрализацию кислого желудочного содержимого, поступающего в кишечник, и как следствие этого, менее эффективную активацию проферментов и переваривающего их действия на белки и пептиды пищи. 121 Методические указания для проведения лабораторных занятий Выполнение лабораторных работ способствует укреплению знаний по биохимии, развивает у студента самостоятельность и прививает навыки проведения эксперимета. Для того, чтобы работа в лаборатории прохадила успешно, необходимо предварительно изучить теоретический материал по учебникам, записям лекций и пособиям по химическим практикумам. К выполнению лабораторной работы допускаются студенты, получившие допуск после проверки теоретических знаний по соответствующей теме. После ваыполнения лабораторной работы студент должен составить отчет, который проверяется преподавателем и подписывается. По окончании работы студент приводит в порядок рабочее место и сдает дежурному. Основное учебное пособие для выполнения лабораторных работ Филиппович Ю.Б. и др. Практикум по общей биохимии, М., Просвещение, 1982 122 План лабораторных занятий № Наименование темы, краткое содержание ЛПЗ 1 Лабораторно-практическое занятие № 1. Характерные реакции органических соединений с различными функциональными группами. Лабораторно-практическое занятие № 2. Качественная реакция на аминокислоты и белки: биуретовая, нингириновая, ксантопротеиновая. Лабораторно-практическое занятие № 3. Качественные реакции на моносахариды: реакция с α-нафтолом, реакция Троммера, реакция Селиванова. Лабораторно-практическое занятие № 4. Качественные реакции на жиры: проба с суданом III, акролеиновая проба 2 Лабораторно-практическое занятие № 5. Общие закономерности обмена веществ в организме человека. 3 Лабораторно-практическое занятие № 6 Общие свойства ферментов. Участие ферментов в обмене веществ. Специфичность действия сукцинатдегидрогеназы. Влияние температуры на активность амилазы слюны. 4 Лабораторно-практическое занятие № 7. Биохимические превращения углеводов в организме человека. Качественные реакции на моносахариды: реакция фелинговой жидкостью, реакция Ниландера, Лабораторно-практическое занятие № 8. Реакция крахмала с иодом, реакция Селиванова. 5 Лабораторно-практическое занятие № 9. Методическое обеспечение Ю.Б.Филиппович и др., Практикум по общей биохимии, М., просвещение, 1982, с.с. 63-64, 217, 219, 221, 258259 Методические рекомендации Ю.Б.Филиппович и др., Практикум по общей биохимии, М., просвещение, 1982, с.с.138-139, 140-141 Ю.Б.Филиппович и др., Практикум по общей биохимии, М., просвещение, 1982, с.с. 220-223 Ю.Б.Филиппович и др., 123 6 7 8 Биохимические превращения липидов в организме человека. Переваривание жиров липазой Лабораторно-практическое занятие № 10. Обзорное занятие по углеводам и липидам Лабораторно-практическое занятие № 11. Биохимические превращения белков в рганизме. Качественные реакции на аминокислоты и белки:Адамкевича, Вуазене, Паули, нитропруссидная реакция. Лабораторно-практическое занятие № 12. Свойства белков: осаждение белков солями щелочных и щелочноземельных металлов (сульфатом аммония, сульфатом магния), денатурация белков при температуре. Лабораторно-практическое занятие № 13. Участие ферментов в обмене веществ. Влияние рН среды на активность ферментов. Определение оптимального значения рН для амилазы слюны. Лабораторно-практическое занятие № 14. Участие ферментов в обмене веществ. Сравнение действия неорганических катализаторов и ферментов. Практикум по общей биохимии, М., просвещение, 1982, с.с. 265-266 Ю.Б.Филиппович и др., Практикум по общей биохимии, М., просвещение, 1982, с.с. 65-66, 38-40, 80-83 Ю.Б.Филиппович и др., Практикум по общей биохимии, М., просвещение, 1982, с.с. 142-143 Ю.Б.Филиппович и др., Практикум по общей биохимии, М., просвещение, 1982, с. 137 Темы для самостоятельной внеаудиторной работы студентов № 1. 2. 3. 4. 5. 6. 7. Наименование темы Белки, углеводы Липиды, витамины Ферменты, гормоны Биохимия дыхания, углеводов Форма контроля Собеседование Собеседование Собеседование обмен Решение индивидуальных заданий Обмен липидов Решение индивидуальных заданий Биосинтез белков и Решение превращения отдельных индивидуальных аминокислот заданий Обмен нуклеотидов Собеседование Сроки исполнения(нед) 2-3 4-5 6-7 8-9 10-11 12 -13 14 124 8. Обмен веществ и энергии. Собеседование Взаимосвязь обмена веществ 15 СПИСОК ЛИТЕРАТУРЫ Основная литература: 1. Филиппович Ю.Б., Основы биохимии, М.:ВШ, 1969 2. Строев Е.А. Биологическая химия, 1986 3. Березов Т.Т. и др. Биологическая химия, М.: Медицина, 1990 4. Филиппович Ю.Д. и др. Практикум по общей биологии. М.: ВШ 5. Шапиро А.Г. Практикум по биологической химии, М., Пр., 1976 6. Филиппович Ю.Б. и др., Упражнения и задачи по биологической химии, М., Пр., 1976 7. Ленинджер К. Биохимия, М.: Мир, 1976 8. Сеитов З.С. Биохимия, Алматы, 2000 Дополнительная литература: 1. Добрынина В.И. Биологическая химия. М.: Медицина, 1976 2. Кретович В.Л. Биохимия растений. М.: ВШ, 1980 3. Биохимия и физиология с/х растений, под ред. Третьякова Н.Н., М.: 2000 4. васильева А.Н. Биологическая химия 5. Сорвачев К.Ф. Биологическая химия. М.: Пр., 1971 6. Биохимия под ред. В.В.Меньшикова, М.: ФКиС, 1986 125 126 127