методы диагностики метастазов рака молочной железы в
advertisement

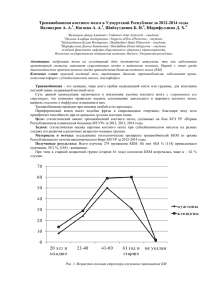
МЕТОДЫ ДИАГНОСТИКИ МЕТАСТАЗОВ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В КОСТНЫЙ МОЗГ Родионов В.В., Богомолова О.А. ФГБОУ ВПО Ульяновский государственный университет, г. Ульяновск, Россия ГУЗ Областной клинический онкологический диспансер, г. Ульяновск, Россия Стадирование рака молочной железы (РМЖ) остается важной задачей, поскольку позволяет оценить прогноз, обсудить варианты лечения, прямые терапевтические стратегии и в целом сделать обзор возможностей лечения. К сожалению, наши способности предсказывать риск рецидива у пациенток с первичным РМЖ далеки от точности. Фактически примерно 40% пациенток с N+-статусом живут 10 и более лет без рецидива, в то время как примерно у 30% пациенток с N0-статусом развивается локорегионарный рецидив или отдаленные метастазы. Это приводит к путанице в отношении тактики лечения и последующего наблюдения как среди врачей, так и среди пациентов [3, 8]. Обнаружение отдельных опухолевых клеток РМЖ в костном мозге приобретает важное значение, т.к. опухолевого субклинические микрометастазы являются индикатором диссеминации процесса и предшественниками отдаленных метастазов. Скрининг микрометастазов в костном мозге способствует более точному стадированию опухолевого процесса, влияет на выбор адьювантной терапии. По данным разных авторов, микрометастазы в костном мозге диагностируются в среднем у 30-35% больных РМЖ [Funke I., Schraut W., 1998], причем после аутопсии умерших от метастатического РМЖ этот показатель увеличивается до 80% Mansi J.L, 1999. Как показали результаты исследования О.В. Крохиной и соавт. (2002), существует вероятность обнаружения метастатических клеток в костном мозге больных РМЖ при различных стадиях заболевания [1]. Причем процент выявления метастазов возрастает от I к IV стадии. Наибольший процент микрометастазов отмечен при IV стадии РМЖ (62,5%). Теми же исследователями доказано, что обнаружение на этапе постановки диагноза микрометастазов в костном мозге влияет на продолжительность безрецидивного промежутка и общую продолжительность жизни больных РМЖ. Для выявления опухолевого поражения костного мозга могут быть использованы следующие методы диагностики метастазов РМЖ в костный мозг. 1. Цитологический и гистологический методы позволяют обнаружить опухолевые клетки (только при их достаточно большом количестве) менее, чем у 4% больных. Единичные же метастатические клетки методом световой микроскопии обнаружить либо сложно, либо невозможно [6]. Повышение чувствительности выявления ИОК достигается при использовании следующих методов исследования. Иммуноцитохимический метод (ИЦХ) основан на выявлении в мазках костного 2. мозга с помощью моноклональных антител антигенов, нехарактерных для гемопоэтической ткани, но экспрессируемых клетками солидных опухолей [2, 4]. Для иммунодетекции ИОК рака молочной железы в костном мозге используют моноклональные антитела к эпителиальному мембранному антигену (ЕМА), цитокератинам (CK), туморассоциированному гликопротеину 12 (TAG 12). Используя методику, основанную на применении моноклональных антител к указанным антигенам, возможно выявление 1-2 клеток рака в 1 млн. нормальных клеток костного мозга. Чувствительность иммуноцитохимического исследования может ограничиваться низким уровнем экспрессии антигенов опухолевыми клетками. В этом случае логичным представляется использование панели АТ для повышения чувствительности метода. Однако такой подход неизбежно приводит к снижению специфичности метода, поскольку известно, что МКА к ЕМА перекрестно реагируют с лимфоидными и ранними миелоидными клетками костного мозга, а CK-8 и CK-18-позитивные клетки встречаются в количестве 2-5 на 1 млн. костном мозге здоровых людей. Поэтому иммуноцитохимический метод может дать ложно-положительный результат у 2-10% здоровых людей. Немаловажен тот факт, что на сегодняшний день в мире используется много коммерческих МКА с разной чувствительностью и специфичностью, что не позволяет стандартизировать метод и затрудняет сравнение результатов, полученных разными группами исследователей. Для увеличения чувствительности иммуноцитохимического метода были разработаны методы обогащения популяции клеток-мишеней. Один из методов обогащения - метод градиентной сепарации Ficoll (Рис. 1). Последний часто сочетается с позитивной или негативной иммуномагнитной клеточной селекцией: антитело-связанные микро-или наноразмерные иммуномагнитные сферы выявляют опухолевые клетки (позитивная селекция) или, что нежелательно, гемопоэтические клетки (негативная селекция) [5, 9, 10]. 3. Полимеразная цепная реакция (ПЦР) предназначена для обнаружения в образце ткани заданной матричной РНК. Данная методика заключается в поиске мРНК некоторых генов (цитокератинов, РЭА), экспрессируемых метастатическими клетками, или поиске мРНК генов, мутации которых специфичны для опухолевых клеток (например, генов ERB B2, p53, и k-ras и др.). По мнению ряда авторов, ПЦР является более чувствительной методикой для выявления микрометастазов рака молочной железы, чем ИЦХ. Вместе с тем, недостатком ПЦР является оценка генетической информации, а не наличия тех или иных живых клеток. В связи с этим при исследовании костного мозга, полученного после проведения курса химиотерапии, нужно быть уверенным, что обнаруженная РНК получена из живой, а не из погибшей опухолевой клетки. Кроме того, РНК не всегда экстрагируются из образцов, фиксированных в формалине и залитых в парафин, что затрудняет ретроспективный анализ. Рис. 1. Стандартизированный метод подготовки препарата костного мозга для выявления диссеминированных опухолевых клеток. 1. Аспирация костного мозга из задне-верхней ости подвздошной кости. 2. Обогащение мононуклеарных клеток, приготовление «цитоспинов» и имммуноцитохимическое исследование. 3. Автоматический скрининг диссеминированных опухолевых клеток и визуальная оценка изображений [7]. 4. Для обнаружения опухолевых клеток в костном мозге методом проточной цитометрии взвесь опухолевых клеток обрабатывают меченными красителем антителами к опухолевым антигенам и пропускают через цитофлюориметр, который автоматически распознает и подсчитывает окрашенные клетки. Метод позволяет обнаружить 1 опухолевую клетку среди 10-100 тыс. нормальных клеток костного мозга. Большим недостатком проточной цитометрии является необходимость выделения из костного мозга значительного числа живых опухолевых клеток, что не всегда возможно. Кроме того, до настоящего времени специфичность метода недостаточно высока. 5. При исследовании костного мозга методом клеточных культур в питательную среду помещают образцы, полученные при аспирационной биопсии. Нормальные клетки костного мозга при отсутствии привычного для них микроокружения пролиферировать не будут. Если же в среде сформируются вторичные колонии, то это будет свидетельствовать о наличии в костном мозге опухолевых клеток, способных к автономному росту. Немаловажным фактором, ограничивающим использование культурального метода, является его техническая сложность и высокая стоимость. Все эти методы исследования костного мозга значительно различаются по своей чувствительности и специфичности, технической сложности и стоимости. В связи с чем, в клинической практике пока не найдено рутинных методов обнаружения скрытой диссеминации (микрометастазов). Следовательно, требуется дополнительная работа в этом направлении. Однако накапливаются данные о том, что важная информация может быть получена в результате анализа костного мозга у пациентов с операбельным раком молочной железы. По мере того, как методы исследования станут более стандартизированными, с приемлемой чувствительностью и специфичностью, они действительно могут стать дополнительным инструментом для более точного стадирования опухолевого процесса. Список литературы: 1. Рак молочной железы. Микрометастазы в костный мозг /О. В. Крохина [и др.] // Вестник Российского онкологического научного центра им. Н.Н. Блохина РАМН. – М., 2002. – Т. 3. – С. 15-20. 2. Brugger, W. Expression of MUC-1 epitopes on normal bone marrow: implications for the detection of micrometastatic tumor cells / W. Brugger, H.J. Bьhring, F. Grьnebach. [et al.] // J. Clin. Oncol.-1999.- Vol.17.- Р.1535-1544. 3. De Vita, VT. Breast cancer therapy: Exercising all our options / VT De Vita // N Eng J Med. -1997. - 337:956–62. 4. Pantel, K. Methodological analysis of immunocytochemical screening for disseminated epithelial tumor cells in bone marrow / K. Pantel, G. Schlimok, M. Angstwurm // J. Hematother. – 1994. – Vol. 3. – P.165-173. 5. Paterlini-Brechot, P. Circulating tumor cells (CTC) detection: clinical impact and future directions / P. Paterlini-Brechot, NL. Benali // Cancer Lett. - 2007. - 253:180–204. 6. Ridell, B. Incidence and histopathology of metastases of mammary carcinoma in biopsies from the posterior iliac creast / B. Ridell, K. Landys // Cancer.-1979. - Vol.44.-Р. 1782-1788. 7. Riethdorf, S. Detection and сharacterization of disseminated tumor cells present in bone marrow of cancer patients / S. Riethdorf, V. M.uller, C. Alix-Panabi`eres [et al.] // Bone and Cancer. – 2009. - Topics in Bone Biology 5. – P.103-117. 8. Rosner, D. Predicting recurrence in axillary-node negative breast cancer patients / D. Rosner, WW. Lane // Breast Cancer Res Treat. - 1993. -V25:127–9. 9. Wong, NS. Prognostic significance of circulating tumour cells enumerated after filtration enrichment in early and metastatic breast cancer patients / NS. Wong, HJ. Kahn, L. Zhang [et al.] // Breast Cancer Res Treat. - 2006- 99:63–69. 10. Zach, O. Tumor cell detection in peripheral blood and bone marrow / O. Zach, D. Lutz // Curr Opin Onco.-2006.- 18:48–56.