ЭКСПЕРИМЕНТАЛЬНЫЙ ТУР
реклама
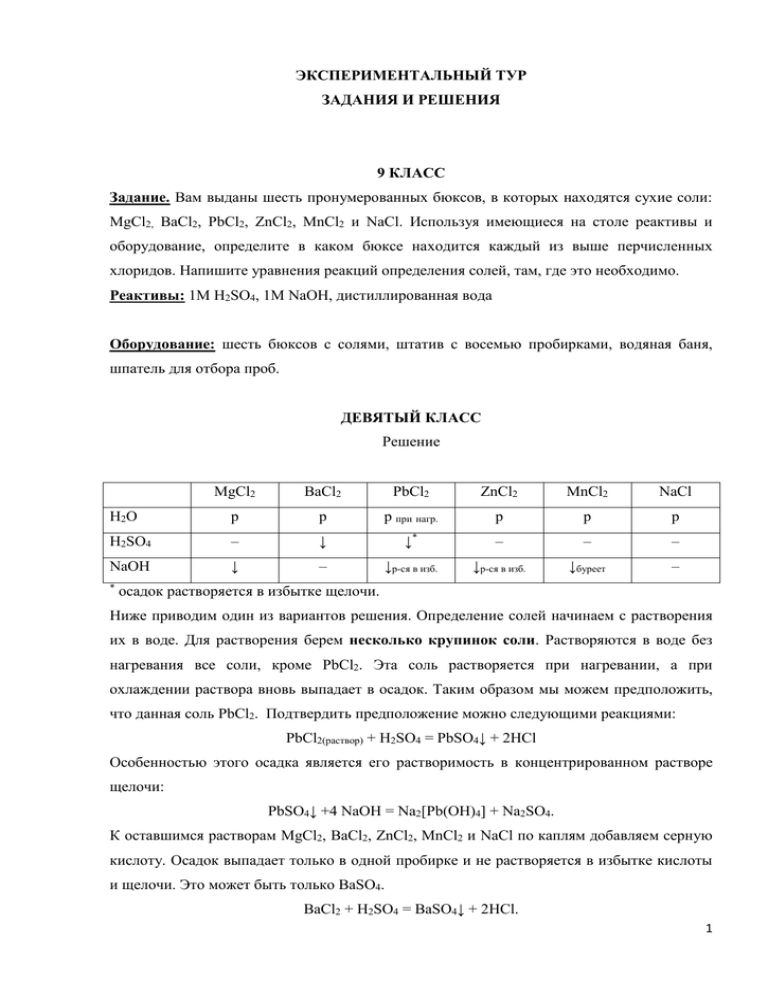
ЭКСПЕРИМЕНТАЛЬНЫЙ ТУР ЗАДАНИЯ И РЕШЕНИЯ 9 КЛАСС Задание. Вам выданы шесть пронумерованных бюксов, в которых находятся сухие соли: MgCl2, BaCl2, PbCl2, ZnCl2, MnCl2 и NaCl. Используя имеющиеся на столе реактивы и оборудование, определите в каком бюксе находится каждый из выше перчисленных хлоридов. Напишите уравнения реакций определения солей, там, где это необходимо. Реактивы: 1M H2SO4, 1M NaOH, дистиллированная вода Оборудование: шесть бюксов с солями, штатив с восемью пробирками, водяная баня, шпатель для отбора проб. ДЕВЯТЫЙ КЛАСС Решение MgCl2 BaCl2 PbCl2 ZnCl2 MnCl2 NaCl H2O р р р при нагр. р р р H2SO4 – ↓ ↓* – – – NaOH ↓ – ↓р-ся в изб. ↓р-ся в изб. ↓буреет – * осадок растворяется в избытке щелочи. Ниже приводим один из вариантов решения. Определение солей начинаем с растворения их в воде. Для растворения берем несколько крупинок соли. Растворяются в воде без нагревания все соли, кроме PbCl2. Эта соль растворяется при нагревании, а при охлаждении раствора вновь выпадает в осадок. Таким образом мы можем предположить, что данная соль PbCl2. Подтвердить предположение можно следующими реакциями: PbCl2(раствор) + H2SO4 = PbSO4↓ + 2HCl Особенностью этого осадка является его растворимость в концентрированном растворе щелочи: PbSO4↓ +4 NaOH = Na2[Pb(OH)4] + Na2SO4. К оставшимся растворам MgCl2, BaCl2, ZnCl2, MnCl2 и NaCl по каплям добавляем серную кислоту. Осадок выпадает только в одной пробирке и не растворяется в избытке кислоты и щелочи. Это может быть только BaSO4. BaCl2 + H2SO4 = BaSO4↓ + 2HCl. 1 Все остальные соли образуют сульфаты, растворимые в воде. К оставшимся в четырех пробирках растворам добавляем по каплям щелочь. При этом наблюдаем следующие эффекты. В пробирке, содержащей раствор MgCl2, выпадает осадок, который не растворяется в избытке реагента: MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl. В пробирке, содержащей раствор ZnCl2, выпадает осадок , который будет растворяться как в избытке реагента, так и в кислоте. Это подтверждает амфотерность ионов цинка. ZnCl2 + 2 NaOH = Zn(OH)2↓ + 2NaCl. Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]. Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O. В пробирке, содержащей раствор MnCl2, выпадает осадок, буреющий на воздухе. MnCl2 + 2NaOH = Mn(OH)2 ↓+ 2NaCl. 2Mn(OH)2 + O2 = 2MnO(OH)2↓ (бурый) или 2Mn(OH)2 + O2 = 2MnO2 + 2H2O. В пробирке, содержащей раствор NaCl, никаких эффектов не наблюдаем. Система оценивания За определение каждой соли с необходимыми уравнениями реакций – 5 баллов 6 = 30 ИТОГО 30 баллов 2 10 КЛАСС Задание. В восьми пронумерованных бюксах находятся индивидуальные соли: Pb(NO3)2, MnCl2, NH4Cl, (NH4)2CO3, ZnCO3, Ca3(PO4)2, MgSO4 и Al2(SO4)3. Используя имеющиеся на столе реактивы и оборудование, определите каждую из выше перечисленных солей. Напишите уравнения реакций определения солей. Реактивы: 1M HCl, 1M NaOH, H2O(дист.) Оборудование: восемь бюксов с солями, штатив с десятью пробирками, водяная баня, шпатель для отбора проб. ДЕСЯТЫЙ КЛАСС Решение Pb(NO3)2 MnCl2 NH4Cl (NH4)2CO3 Ca3(PO4)2 MgSO4 ZnCO3 Al2(SO4)3 H2O р р р Р н р н р HCl ↓ – – ↑CO2 р – р↑CO2 – ↓буреет ↑NH3 ↑NH3 – ↓ – ↓раств. в изб NaOH ↓раств в изб. Приводим один из вариантов решения. Определение солей начинаем с их растворения. Все соли, кроме ZnCO3 и Ca3(PO4)2 растворяются в воде. Не растворившиеся в воде соли растворяем в кислоте, причем при растворении солей в одной из пробирок наблюдаем выделение газа. При этом протекают следующие реакции: Ca3(PO4)2 + 6HCl = 3CaCl2 + 2H3PO4 или Ca3(PO4)2 + 4HCl = Ca(H2PO4)2 + 2CaCl2 ZnCO3 + 2HCl = ZnCl2 + CO2↑ + H2O. Таким образом, мы определили две соли: ZnCO3 и Ca3(PO4)2. К растворам оставшихся шести солей по очереди по каплям прибавляем раствор кислоты. Наблюдаем следующие эффекты. В пробирках, содержащих растворы MgSO4, MnCl2, NH4Cl, Al2(SO4)3 никаких видимых изменений не наблюдаем. В пробирке с раствором (NH4)2CO3 наблюдается выделение газа: (NH4)2CO3 + 2HCl = 2NH4Cl + CO2↑ + H2O. В пробирке, содержащей раствор Pb(NO3)2, наблюдаем выпадение осадка PbCl2. Особенностью этого осадка является его растворение при нагревании и выпадение снова при охлаждении раствора. Таким образом мы определили Pb(NO3)2. Pb(NO3)2 + 2HCl = PbCl2↓ + 2HNO3. 3 В оставшихся пробирках находятся растворы следующих солей: MgSO4, MnCl2, NH4Cl, Al2(SO4)3. Отбираем по несколько капель раствора каждой соли и переносим в чистые пробирки. Затем в каждую пробирку по каплям добавляем щелочь, в недостатке и в избытке. Наблюдаем за эффектами реакций. Пробирки можно нагреть на водяной бане. В пробирке содержащей MgSO4, будет выпадать осадок, не растворяющийся в избытке щелочи: MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4. В пробирке, содержащей MnCl2, будет выпадать осадок, буреющий на воздухе: MnCl2 + 2NaOH = Mn(OH)2 ↓+ 2NaCl. 2Mn(OH)2 + O2 = 2MnO(OH)2↓ (бурый) или 2Mn(OH)2 + O2 = 2MnO2 + 2H2O. В пробирке, содержащей NH4Cl, будет ощущаться запах аммиака, который будет усиливаться при нагревании раствора: NH4Cl + NaOH = NH3↑ + NaCl + H2O В пробирке, содержащей Al2(SO4)3, будет наблюдаться выпадение осадка, который будет растворяться в избытке реактива. Al2(SO4)3 + 6NaOH = 2Al(OH)3↓ +3 Na2SO4 Al(OH)3 + NaOH = Na[Al(OH)4] или Al(OH)3 +3 NaOH = Na3[Al(OH)6] или Al(OH)3 + NaOH + 2H2O = Na[Al(OH)4(H2O)2] Таким образом, мы опредилили каждую из солей, находящихся в восьми бюксах. Система оценивания За определение солей с необходимыми уравнениями Pb(NO3)2, MnCl2, NH4Cl, (NH4)2CO3, ZnCO3, и Al2(SO4)3 по 4 балла, Ca3(PO4)2, MgSO4 по 3 балла. Замечание для членов Жюри: Хлорид марганца и его раствор в воде отличается от других по цвету (розовый). Если идентификация проведена только по этому признаку, без проведения соответствующих реакций, то она оценивается в 1 балл. ИТОГО 30 баллов 4 11 КЛАСС Глубокоуважаемый Юный химик! Вам предстоит работа с едкими и ядовитыми веществами – будьте осторожны и внимательны! Склянки с аммиаком и формалином держите закрытыми, если Вы их не используете. Если Вам что-либо будет непонятно, обращайтесь к члену жюри или лаборанту. Ни в коем случае нельзя определять вкус веществ! Соблюдайте правила техники безопасности! Чтобы не терять время, во время упаривания растворов и охлаждения их до комнатной температуры теоретические вопросы Вы можете (однако помните, отвечать что на нельзя поставленные допускать (стр. 2) перегрева и разбрызгивания реакционной массы). Гексаметилентетрамин (уротропин) – белые кристаллы сладкого вкуса, одно из очень немногих синтетических лекарственных N средств, используемых в настоящее время, с более чем 100-летней историей: его начали применять ещё в 1884 г., и сейчас это вещество можно приобрести в N N N уротропин любой аптеке (например, в смеси с хлоридом кальция под названием «кальцекс»). Другое замечательное свойство уротропина – способность сгорать без образования золы. Таблетки или брикеты «сухого горючего» состоят именно из уротропина с небольшой добавкой парафина. Хотя сухое горючее почти всегда можно купить в хозяйственном магазине или там, где торгуют туристическим снаряжением, в небольшом количестве можно изготовить его и в лаборатории. Впервые синтез уротропина осуществил 150 лет назад (1860 г.) Александр Михайлович Бутлеров. Сегодня Вам предлагается получить уротропин из предложенных реактивов и проделать некоторые характерные для этого вещества реакции. Методика получения уротропина Отмерьте с помощью мерной пипетки 1 мл 25 %-ного водного раствора аммиака, перенесите отмеренный объём в стакан и добавьте 1 каплю фенолфталеина. Отмерьте с помощью мерного цилиндра 12 мл формалина (40 %-ного водного раствора формальдегида), прилейте его к полученному в стакане малиновому раствору и тщательно перемешайте реакционную смесь стеклянной палочкой. Если спустя 1–2 мин. раствор в стакане не обесцветился, добавьте с помощью пипетки ещё 1–2 мл формалина и вновь перемешайте стеклянной палочкой. Осторожно упарьте содержимое стакана до появления первых кристаллов уротропина (нельзя допускать перегрева, поскольку происходит сильное разбрызгивание реакционной 5 массы). Охладите содержимое стакана до комнатной температуры, добавьте 5 мл этилового спирта, отмеренного с помощью мерного цилиндра. Перемешайте содержимое стакана стеклянной палочкой, тщательно смывая остатки уротропина со стенок. Полученный раствор аккуратно перелейте в фарфоровую чашку и упарьте на водяной бане досуха. Охладите чашку с полученными кристаллами уротропина до комнатной температуры. Полученный уротропин аккуратно перенесите (с помощью выданного Вам шпателя) на предварительно взвешенную кальку и определите массу (запишите её!) полученного уротропина. Теоретические вопросы 1. Почему при добавлении фенолфталеина к раствору аммиака появилась малиновая окраска, а при добавлении формалина она исчезла? 2. Напишите уравнение реакции, с помощью которой Вы получили уротропин. 3. К какому типу реакций относится эта реакция (выберите ответ (или ответы))? а) разложения; б) присоединения – отщепления; в) обмена; г) изомеризации; д) конденсации. 4. Приведите все формулы для нахождения выхода полученного уротропина в расчёте на введённое количество аммиака, считая плотность 25 %-ного водного раствора аммиака 0,91 г/см3. Рассчитайте выход продукта реакции. Изучение некоторых свойств уротропина а) С помощью шпателя отберите немного (около 1/3 полученного Вами вещества) уротропина, поместите его на несгораемую подложку и подожгите. Напишите уравнение реакции горения уротропина. б) Небольшое количество уротропина с помощью шпателя поместите в пробирку, добавьте ~1 мл раствора серной кислоты и слегка подогрейте на водяной бане. Понюхайте (осторожно!) выделяющиеся пары. Приведите уравнение реакции гидролиза уротропина в кислой среде. Предложите реактивы, с помощью которых можно было бы идентифицировать образовавшиеся продукты гидролиза. Напишите уравнения соответствующих реакций идентификации и укажите наблюдаемые при этом эффекты. в) Поместите в пробирку немного (3–4 кристаллика) твёрдого гексагидрата хлорида кобальта (CoCl2 · 6H2O) и примерно столько же твёрдого уротропина. Тщательно перетрите содержимое пробирки с помощью сухой стеклянной палочки (следите за тем, чтобы палочка не разбила пробирку). Что наблюдаете? 6 Объясните появление голубой окраски твёрдой смеси в пробирке. Напишите уравнение реакции, поясняющее Ваш ответ. ОДИННАДЦАТЫЙ КЛАСС Ответы на теоретические вопросы 1. В водном растворе аммиак проявляет оснóвные свойства вследствие протекания процесса: NH3 + H2O ⇄ NH4+ + OH. Поэтому при добавлении фенолфталеина к водному раствору аммиака («нашатырному спирту») появляется малиновая окраска. При добавлении формалина к раствору аммиака протекает реакция образования уротропина, в результате чего аммиак полностью расходуется и окраска фенолфталеина исчезает. 2. Уравнение реакции, с помощью которой Вы получили уротропин: N O 6H C + H 4 NH3 N N + 6 H2O N уротропин . 3. Для того, чтобы аргументировано отнести реакцию образования уротропина из формальдегида и аммиака к какому-то из перечисленных типов органических реакций, необходимо иметь некоторые представления о механизме ее протекания. На первой стадии взаимодействия молекулы формальдегида с молекулой аммиака образуется неустойчивый аминоспирт (нуклеофильное присоединение), далее превращающийся в чуть более устойчивый альдимин (при этом отщепляется молекула воды). Альдимин образует циклический тример, который далее конденсируется с тремя молекулами формальдегида и одной молекулой аммиака с образованием гексаметилентетрамина: H H C O + NH3 H NH2 - H2O C OH H H2C HN NH HN CH2 HN CH2 H2C NH CH2 альдимин NH C NH H аминоспирт H CH2 + 3 HCOH + NH3 - 3 H2O N N N N . 7 Таким образом, реакцию образования уротропина из формальдегида и аммиака можно одновременно отнести к реакциям присоединения – отщепления (вариант б) и конденсации (вариант д). 4. Для расчета выхода реакции () необходимо знать массу полученного уротропина (mэксп.) и массу продукта, рассчитанную на введенное количество аммиака: mтеор. mэксп. 100%; mтеор. 1 1 V ( NH3 ) ( NH3 ) ( NH3 ) ( NH3 ) M (C 6 H12 N 4 ) M (C 6 H12 N 4 ); 4 4 M ( NH3 ) mтеор. 1 1 мл 0,91 г / мл 0,25 140 г / моль 0,47 г; 4 17 г / моль mэксп. 100%. 0,47 Изучение некоторых свойств уротропина а) Бесцветные кристаллы уротропина, как и большинство органических соединений, сгорают в кислороде воздуха: C6H12N4 + 9O2 6CO2 + 6H2O + 2N2. б) В подкисленных растворах уротропин неустойчив и гидролизуется согласно уравнению: C6H12N4 + 6H2O + 4H+ 6HCOH + 4NH4+. Продукты гидролиза уротропина можно распознать, проведя характерные реакции на альдегид и соль аммония, например: t HCOH + 4Cu(OH)2 CO2 + 2Cu2O + 5H2O, красный осадок NH4+ + OH NH3 + H2O. характерный запах в) Появление голубой окраски твердой смеси в пробирке обусловлено образованием комплексного соединения кобальта с молекулами уротропина (уротропин выступает в роли комплексообразователя): N 2 N N N + CoCl2 N N N N Co N N N N Cl2 Система оценивания: Проведение синтеза уротропина 8 Техника эксперимента 2 балла; Выход уротропина: 50 % 10 баллов; 49 – 40 % 9 баллов; 39 – 30 % 8 баллов; 29 – 20 % 7 баллов; менее 20 % 6 баллов. Ответы на теоретические вопросы 1. Объяснение появления и исчезновения окраски фенолфталеина 2 балла; 2. Уравнение реакции получения уротропина 2 балла; 3. Тип реакции получения уротропина 0,5 балла 2 = 1 балл; 4. Вывод формул для расчета выхода уротропина 1 балл. Изучение некоторых свойств уротропина a) Уравнение реакции горения уротропина 2 балла; b) Уравнение реакции гидролиза уротропина 2 балла; Реагенты для распознавания продуктов гидролиза (NH4+ и НСОН) 0,5 балла 2 1 балл; Уравнения реакций идентификации продуктов гидролиза 2 балла 2 c) Объяснение появления голубой окраски (комплексообразование) Уравнение реакции комплексообразования Итого за экспериментальный тур (максимальный балл) 4 балла; 1 балл; 2 балла. 30 баллов. 9


