эту ссылку (документ в формате Microsoft Word)
реклама

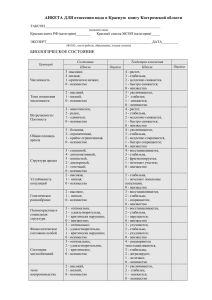
КАРТА РЕГИСТРАЦИИ НЕЖЕЛАТЕЛЬНОГО ЯВЛЕНИЯ – РАСТВОРЫ ДЛЯ ПЕРИТОНЕАЛЬНОГО ДИАЛИЗА ИНФОРМАЦИЯ О ЛИЦЕ, СООБЩИВШЕМ О НЕЖЕЛАТЕЛЬНОМ ЯВЛЕНИИ ФИО лица, сообщившего о нежелательном явлении:_________________________________Дата сообщения: __________ Контактные данные лица, сообщившего о нежелательном явлении:_________________________________________ Работник здравоохранения (указать): Врач Медсестра Фармацевт Другое (указать): ________________________________________________________ ИНФОРМАЦИЯ О ПАЦИЕНТЕ Данные пациента (инициалы):____________Дата рождения/возраст: ________________Пол: Мужской Женский Перенесенные/сопутствующие заболевания: Терминальная стадия почечной недостаточности Сердечная недостаточность Гипертоническая болезнь (высокое артериальное давление) Сердечный приступ (Инфаркт миокарда) Диабет Инсульт Заболевания сердца Пневмония Другое (указать) ИНФОРМАЦИЯ О ПРЕПАРАТЕ/СХЕМА ЛЕЧЕНИЯ НЕОБХОДИМО УКАЗАТЬ НОМЕРА ВСЕХ СЕРИЙ ИСПОЛЬЗОВАННЫХ ПРЕПАРАТОВ Дата начала схемы ПД, указанной ниже:_____________ Раствор для ПД Номер серии Дата начала применения каждой серии Вид: ПАПД Подозреваете ли Вы, что нежелательное явление было вызвано данным препаратом? АПД Неизвестно Были ли случаи прекращения применения растворов вследствие перитонита? Да Нет Да Нет Неизвестно Да Нет Да Нет Неизвестно Да Нет Да Нет Неизвестно Да Нет Да Нет Неизвестно Да Нет Да Нет Неизвестно ИНФОРМАЦИЯ О НЕЖЕЛАТЕЛЬНОМ ЯВЛЕНИИ Дата нежелательного явления: __________ Стерильный перитонит Бактериальный перитонит Грибковый перитонит Мутный экссудат Другое явление (указать): _______________________________________________________________ Описание явления (-й): ________________________________________________________________________ ___________________________________________________________________________________________________________ ___________________________________________________________________________________________________________ Если нежелательным явлением был перитонит: _____________________________________________________________________________Какова была основная причина? Страница 1 из 3 Нарушение мер асептики (указать): Другое (указать): Потребовалась ли пациенту госпитализация в результате возникновения нежелательного явления? При положительном ответе указать: с: ______ по: ______ Да Улучшилось ли состояние пациента при прекращении применения раствора для ПД? Да Нет При положительном ответе указать, какой раствор для ПД был использован _________________ Нет Неизвестно Было ли возобновлено применение раствора для ПД? Да Нет Неизвестно При положительном ответе указать, какой раствор для ПД был использован _________________ При положительном ответе указать, был ли повторный случай перитонита? Да Нет Неизвестно Какова была степень тяжести перитонита? Слабая Умеренная Тяжелая Указать подробности_________________________________________________________________________________ _____________________________________________________________________________________________________ ИСХОД Смерть Выздоровление Дата выздоровления:____________ Выздоровление с последствиями Улучшение состояния Состояние без изменений Состояние ухудшилось Неизвестно РЕЗУЛЬТАТЫ ЛАБОРАТОРНЫХ АНАЛИЗОВ В СЛУЧАЕ ПЕРИТОНИТА Дата отбора проб: дд/мм/гггг Был ли произведен отбор проб перед началом приема антибиотиков Да Число лейкоцитов Нейтрофилы Нет Да Нет Ед. Ед. число клеток/мм3 число клеток/мм3 % % Лимфоцицы эозинофилы Моноциты % % % % Эозинофилы Базофилы % % % % Дата посева: __________________ Результаты посева: Отсутствие роста Рост присутствует, указать микроорганизм______________________ Были ли проведены дальнейшие лабораторные исследования? Да (при положительном ответе прикрепить результаты анализов) Отказ от предоставления результатов анализов Нет Неизвестно ЛЕКАРСТВЕННАЯ ТЕРАПИЯ Получал ли пациент антибиотики? Наименование препарата Доза/единицы действия Да (при положительном ответе, указать какие) Частота Путь введения Дата / время начала терапии Нет Дата / время окончания терапии Неизвестно Показания Страница 2 из 3 Было ли проведено дальнейшее лечение? Да (при положительном ответе прикрепить) Нет Неизвестно Отказ предоставить информацию СОПУТСТВУЮЩЕЕ ЛЕЧЕНИЕ Получал ли пациент сопутствующее лечение? Да (прикрепить) Нет Неизвестно Отказ предоставить информацию Дополнительные сведения: ______________________________________________________________________________________________________________________________________ ______________________________________________________________________________________________________________________________________ ______________________________________________________________________________________________________________________________________ ______________________________________________________________________________________________________________________________________ Заполненную карту направьте, пожалуйста, в отдел фармаконадзора Компании Бакстер по электронной почте: [email protected], или по факсу: +7 (495) 647 68 08. Контактная информация ЗАО «Компания «Бакстер»: 125171, Москва, Ленинградское шоссе, дом 16А, стр.1, тел.: +7 (495) 647 68 07. Отдел по фармаконадзору: Ольга Мишина, тел.: +7(495) 647 68 07, доб. 175, моб.тел.: +7(968) 894 15 71, адрес электронной почты: [email protected]. Страница 3 из 3