Лекция 29 - страница
реклама
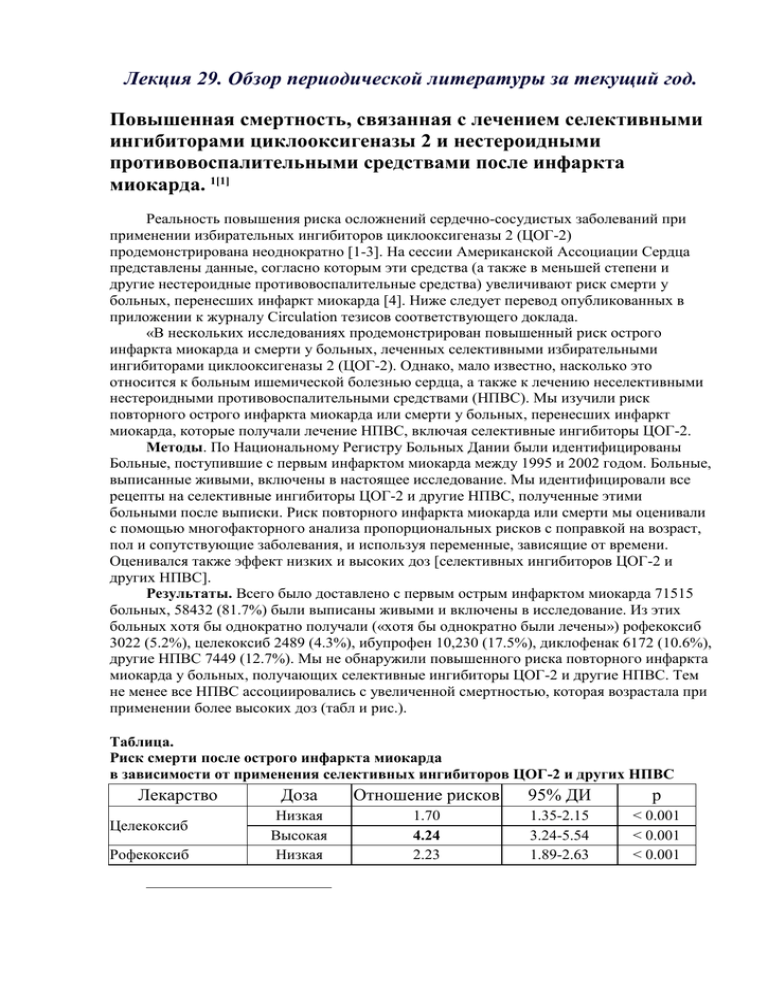
Лекция 29. Обзор периодической литературы за текущий год. Повышенная смертность, связанная с лечением селективными ингибиторами циклооксигеназы 2 и нестероидными противовоспалительными средствами после инфаркта миокарда. 1[1] Реальность повышения риска осложнений сердечно-сосудистых заболеваний при применении избирательных ингибиторов циклооксигеназы 2 (ЦОГ-2) продемонстрирована неоднократно [1-3]. На сессии Американской Ассоциации Сердца представлены данные, согласно которым эти средства (а также в меньшей степени и другие нестероидные противовоспалительные средства) увеличивают риск смерти у больных, перенесших инфаркт миокарда [4]. Ниже следует перевод опубликованных в приложении к журналу Circulation тезисов соответствующего доклада. «В нескольких исследованиях продемонстрирован повышенный риск острого инфаркта миокарда и смерти у больных, леченных селективными избирательными ингибиторами циклооксигеназы 2 (ЦОГ-2). Однако, мало известно, насколько это относится к больным ишемической болезнью сердца, а также к лечению неселективными нестероидными противовоспалительными средствами (НПВС). Мы изучили риск повторного острого инфаркта миокарда или смерти у больных, перенесших инфаркт миокарда, которые получали лечение НПВС, включая селективные ингибиторы ЦОГ-2. Методы. По Национальному Регистру Больных Дании были идентифицированы Больные, поступившие с первым инфарктом миокарда между 1995 и 2002 годом. Больные, выписанные живыми, включены в настоящее исследование. Мы идентифицировали все рецепты на селективные ингибиторы ЦОГ-2 и другие НПВС, полученные этими больными после выписки. Риск повторного инфаркта миокарда или смерти мы оценивали с помощью многофакторного анализа пропорциональных рисков с поправкой на возраст, пол и сопутствующие заболевания, и используя переменные, зависящие от времени. Оценивался также эффект низких и высоких доз [селективных ингибиторов ЦОГ-2 и других НПВС]. Результаты. Всего было доставлено с первым острым инфарктом миокарда 71515 больных, 58432 (81.7%) были выписаны живыми и включены в исследование. Из этих больных хотя бы однократно получали («хотя бы однократно были лечены») рофекоксиб 3022 (5.2%), целекоксиб 2489 (4.3%), ибупрофен 10,230 (17.5%), диклофенак 6172 (10.6%), другие НПВС 7449 (12.7%). Мы не обнаружили повышенного риска повторного инфаркта миокарда у больных, получающих селективные ингибиторы ЦОГ-2 и другие НПВС. Тем не менее все НПВС ассоциировались с увеличенной смертностью, которая возрастала при применении более высоких доз (табл и рис.). Таблица. Риск смерти после острого инфаркта миокарда в зависимости от применения селективных ингибиторов ЦОГ-2 и других НПВС Лекарство Целекоксиб Рофекоксиб Доза Отношение рисков 95% ДИ р Низкая Высокая Низкая 1.70 4.24 2.23 1.35-2.15 3.24-5.54 1.89-2.63 < 0.001 < 0.001 < 0.001 Высокая Низкая Высокая Низкая Высокая Ибупрофен Диклофенак Другие НПВС - 5.03 0.66 1.96 0.74 3.76 1.22 3.73-6.79 0.54-0.81 1.75-2.21 0.55-0.97 3.21-4-39 1.10-1.36 < 0.001 < 0.001 < 0.001 0.047 < 0.001 < 0.001 Рис. 1 Риск смерти в зависимости от применения ингибиторов ЦОГ-2 или других НПВС Препарат Доза Препарат Целекоксиб высокая Целекоксиб низкая Рофекоксиб высокая Рофекоксиб низкая Ибупрофен высокая Ибупрофен низкая Диклофенак высокая Диклофенак низкая Другие НПВС Другие НПВС Отношение рисков 95% доверительный интервал Заключение. Лечение селективными ингибиторами ЦОГ-2 и другими НПВС ассоциируется с повышенной смертностью больных, перенесших острый инфаркт миокарда. Этот эффект зависит от применяемой дозы (дозозависим). Различия в риске между разными НПВС были такими же большими, как и между селективными ингибиторами ЦОГ-2 и другими НПВС. Эти лекарства [селективные ингибиторы ЦОГ-2 и другие НПВС] не оказывали действия на риск повторного инфаркта миокарда. Эти результаты указывают на дозозависимый риск применения всех НПВС у больных ишемической болезнью сердца». Приложение 1. Следующий факт свидетельствует о безусловном признании связанного с применением ингибиторов ЦОГ-2 повышением риска осложнений атеросклеротических заболеваний. К документам, касающимся целекоксиба (в США в настоящее время это единственный разрешенный к применению ингибитор ЦОГ-2), добавлено Предостережение в черной рамке (black box warning). Оно внесено в инструкциювкладыш (prescribing information) к целекоксибу (Целебрексу), в сокращенном виде помещено на страницы сайта Celebrex.com и т.д. (рис. 2). Ниже следует перевод двух из трех абзацев этого предостережения. Рис 2. Предостережение в черной рамке (black box warning) в начале инструкции – вкладыша к целебрексу (prescribing information) [5]. Сердечнососудистый риск «Целебрекс может обусловливать повышенный риск сердечнососудистых тромботических событий, инфаркта миокарда, и инсульта, которые могут привести к смерти (могут быть фатальными). [Применение] всех нестероидных противовоспалительныхсредств может быть связано с таким же риском. Этот риск может возрастать с увеличением продолжительности использования. У больных с сердечно-сосудистыми заболеваниям или факторами риска сердечнососудистых заболеваний риск может быть большим [более выраженным]. … Желудочно-кишечный риск Нестероидные противовоспалительные средства, включая целебрекс, являются причиной повышенного риска серьезных желудочно-кишечных побочных (нежелательных) явлений, включая кровотечение, образование язвы и перфорацию (прободение) желудка или кишечника, которые могут привести к смерти. Эти события могут произойти в любое время на протяжении приема [этих лекарств] и без предостерегающих симптомов. У больных старшего возраста (престарелых больных) риск серьезных желудочно-кишечных событий более высок». Обращает на себя внимание факт, что введено указание не только на риск сердечнососудистых осложнений, но и на повышенный риск желудочно-кишечных явлений. Таким образом, в этом отношении ингибитор ЦОГ-2 целекоксиб теперь приравнен к другим НПВС. Напомним, что основанием для внедрения препаратов класса ингибиторов ЦОГ-2 было как раз отсутствие у них присущего НПВС повреждающего действия на слизистую желудка и кишечника. Приложение 2. Европейское агентство по лекарствам (EMEA) сделало заключение по рассмотрению класса ингибиторов ЦОГ-2 [6]. … « … В заключение обзора Комитет по медицинских продуктам для использования у человека рекомендовал следующие противопоказания к применению этих лекарств и предосторожности при пользовании ими: … ингибиторы ЦОГ-2 не должны использоваться у больных с установленной ишемической болезнью сердца и/или заболеванием мозговых сосудов (инсультом), а также у больных с заболеванием периферических артерий … следует соблюдать осторожность, назначая ингибиторы ЦОГ-2 больным с факторами риска заболеваний сердца, такими как гипертония, гиперлипидемия, диабет и курение … … при применении всех ингибиторов ЦОГ-2 могут развиваться реакции гиперчувствительности и редкие, но серьезные и иногда смертельные кожные реакции. … риск более высок у больных с известной аллергией на лекарственные вещества» Длительная терапия фенофибратом и сердечно-сосудистые события при сахарном диабете 2-го типа (Испытание FIELD). 2[*] Long-term fenofibrate therapy and cardiovascular events in people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial) На недавно завершившейся научной сессии Американской Ассоциации сердца (ААС) 2005 года доложены результаты международного двойного-слепого плацебоконтролируемого исследования FIELD [1]. Оно стало первым в своем роде испытанием, в котором изучалась эффективность фибрата (фенофибрата) в отношении сердечнососудистых конечных точек у типичных пациентов с сахарным диабетом 2-го типа (СД-2), с которыми как правило работают врачи общей практики. Набор больных был начат в 1998 году, завершающие визиты прошли осенью 2005 года. Всего было рандомизировано 9795 человек. Ниже приведен перевод резюме статьи, опубликованной в журнале “Lancet” [1] «Предпосылки. Пациенты со 2-рым типом сахарного диабета имеют повышенный риск развития сердечно-сосудистых заболеваний . Отчасти это связано с дислипидемией, которая может быть устранена терапией фибратами. Для оценки эффекта терапии фенофибратом у этих пациентов на сердечно-сосудистые события было разработано исследование FIELD (Fenofibrate Intervention and Event Lowering in Diabetes) Методы. Мы провели международное рандомизированное контролируемое исследование, включавшее 9795 участников в озрасте 50-75 лет со 2-ым типом сахарного диабета и не принимавших статины на момент включения в испытание. После фазы введения в исследование состоявшей из периода приема плацебо и периода приема фенофибрата, мы рандомизировали пациентов (2131 с сердечнососудистымизаболеваниями в анамнезе и 7664 – без этой патологии) с уровнем общего холестерина 3·0–6·5 ммоль/л и соотношением общего холестерина к Хс ЛВП равным ≥ 4.0 или содержанием триглицеридов в плазме от 1.0 до 5.0 ммоль/л к приему микронизированного фенофибрата (200 мг/д, n=4895) или аналогичного вида плацебо (n=4900). Первичной конечной точкой в нашем исследовании были коронаные события (коронарная смерть и нефатальный инфаркт миокарда). Заранее запланированными конечными точками для анализа по подгруппам были сердечно-сосудистые события в целом (комбинация коронарной смерти, инфаркта миокарда, инсульта и коронарной или каротидной реваскуляризации). Анализ проводился по «намерению лечить». Исследование было проспективно зарегистрировано (регистрационный номер ISRCTN 64783481). 3[†] Результаты. Статус пациентов к концу исследования был установлен для всех больных за исключением 22 человек. За время наблюдения (в среднем 5 лет), прекратили прием препарата примерно равное число пациентов: 10% в группе плацебо и 11% в группе фенофибрата. Достоверно больше пациентов из группы плацебо стали принимать гиполипидемические средства (17%), чем в группе фенофибрата (8 %, p<0·0001). Коронарные события произошли в 5·9% (n=288) случаев в группе плацебо и в 5·2% (n=256) в группе вмешательства, что составило относительное снижение риска на 11%, однако оно не было достоверным (отношение риска 0·89, 95% ДИ 0·75–1·05; p=0·16). Число нефатальных инфарктов достоверно снизилось на 24% в группе вмешательства относительно группы контроля(0·76, 0·62–0·94; p=0·010). Одновременно происходило недостоверное увеличение коронарной смертности в группе фенофибрата (1·19, 0·90– 1·57; p=0·22). Общее число сердечно-сосудистых событий было достоверно меньше в группе фенофибрата, чем в контроле: 12·5% и 13·9% соответственно (0·89, 95% ДИ 0·80–0·99; p=0·035). В том числе на 21% было меньше коронарных реваскуляризаций (0·79, 0·68–0·93; p=0·003). Общая смертность составила 6.6% в группе контроля и 7.3% в группе фенофибрата (p=0·18). Применение фенофибрата ассоциировалось с уменьшением прогрессирования альбуминурии (p=0·002) и числа случаев ретинопатии, потребовавшей лазеротерапии (3·6% против 5·2% в контроле, p=0·0003). Было отмечено небольшое превышение числа панкреатитов у принимавших фенофибрат (0·8% против 0·5% в контроле, p=0·031) и тромбоэмболий легочной артерии (1·1% против 0·7% в контроле, p=0·022). Частота других нежелательных событий в группах значимо не различалась. Заключение. Фенофибрат достоверно не снижал риск развития первичной конечной точки - коронарных событий, но снизил общее число сердечно-сосудистых событий, в основном за счет нефатальных инфарктов миокарда и реваскуляризаций. Более частое назначение статинов пациентам, рандомизированным в группу плацебо, могло маскировать терапевтический эффект». Комментарии. Как известно при СД-2 риск развития сердечно сосудистых осложнений аналогичен риску у лиц с явным атеросклеротическим заболеванием и особенно высок при сочетании с коронарной болезнью сердца (КБС). При этом, по уровню общего холестерина диабетики существенно не отличаются от лиц соответствующего возраста и пола, а уровень холестерина липопротеинов высокой плотности (ХСЛВП) зачастую ниже средних значений и существенно повышен уровень триглицеридов. Холестерин липопротеинов низкой плотности (ХСЛНП) может быть умеренно повышен или в пределах нормы. Очень характерной чертой при диабете является измененный состав этой группы липопротеинов: в них преобладают маленькие и плотные частицы, обладающие максимальной атерогенностью. В этой связи представляется логичным применение фибратов для описываемой клинической ситуации. Тем более, что эти препараты за более чем 20 лет применения в практике хорошо изучены, обладают неплохой переносимостью и имеют небольшое количество побочных эффектов. В зависимости от популяции пациентов, фибраты способны снижать общий холестерин на 15% и более, в основном за счет фракции ЛНП. Триглицериды снижаются под действием фибратов на 30-40%, а ХСЛВП напротив повышается на 10-15% [2]. С другой стороны, для фибратов имеются доказательства эффективности в отношении клинических конечных точек в первичной и вторичной профилактике. Причем, при анализе подгрупп больных с диабетом в исследовании первичной профилактики HHS [3] с гемфиброзилом, эффект был выше, чем в целом в группе вмешательства (хотя и недостоверно из-за малого числа таких пациентов). Похожие данные были получены и в подгруппах c диабетом в испытаниях BIP[4] c безафибратом и VAHIT [5] с гемфиброзилом. В исследовании DAIS с ангиографической конечной точкой применение микронзированного фенофибрата в течение 3-х лет привело к замеделению роста атеросклеротических бляшек [6]. Наконец, к моменту начала FIELD, накоплены теоретические и экспериментальные данные о положительном влиянии агонистов рецепторов ядра, активируемого пролифератором пероксисом (PPAR)-альфа, каковыми являются фибраты, на процессы обмена липидов, воспаления в бляшке и факторы гемостаза.[7,8] Это давало основание полагать, что указанная группа препаратов обладает потенциальным антиатеросклеротическим действием, сходным с действием статинов. Таким образом, к моменту начала набора пациентов, для проведения испытания с фибратом у больных сахарным диабетом были все предпосылки. Исследование FIELD было задумано с целью получения доказательств об эффективности фенофибрата в отношении основных коронарных событий у пациентов с сахарным диабетом 2-го типа. В FIELD включались мужчины и женщины от 50 до 75 лет с сахарным диабетом 2-го типа развившимся после 35 лет вне зависимости от наличия или отсутствия проявлений атеросклероза. Допустимые уровни липидов были следующими: Общий холестерин (ОХС) от 3.0 до 6.5 ммоль/л в сочетании с отношением ОХС/ХсЛВП >4.0 или уровнем ТГ выше 1.0 но ниже 5.0 ммоль/л. Не включались пациенты с нарушенной функцией почек (креатинин > 130 мкмоль/л) и печени (повышение печеночных трансаминаз > 2 раз выше верхней границы нормы); с симптоматической желчекаменной болезнью*.<СНОСКА ВНИЗУ СТРАНИЦЫ: *Стандартно, в информационных листках фибраты не рекомендуется принимать при наличии камней в желчном пузыре не зависимо от наличия симптомов.>.. Не включались пациенты, принимающие в момент рандомизации гиполипидемические препараты, или те, кому они безусловно показаны по мнению лечащего врача. У 78% включенных не было признаков КБС, то есть более ¾ пациентов относились к категории первичной профилактики. План испытания был достаточно сложным. После скрининга пациентам на 4 недели назначалась только диета, затем – на 6 недель вводного периода назначали плацебо фенофибрата для ознакомления и проверки соответствия пациентов критериям включения, а затем еще на 6 недель всем больным в «слепом» порядке назначался фенофибрат. Это было сделано для выявления различий между пациентами с выраженным и умеренным или небольшим краткосрочным эффектом фибрата. И только после этого, при условии отсутствия коронарных событий за это время, проводили рандомизацию и назначали либо микронизированную форму фенофибрата 200 мг или плацебо 1 раз в день с завтраком. В ходе рандомизации пациенты стратифицировались по основным факторам риска, включая протеинурию. Наблюдение продолжалось не менее 5 лет с интервалами между визитами в 4-6 месяцев. Главной конечной точкой на момент начала исследования была коронарная смерть. Однако, в ходе работы частота смертей оказалась небольшой, не обеспечивающей достаточную статистическую мощность. Поэтому было решено в качестве первичной конечной точки использовать комбинацию «коронарная смерть и нефатальный инфаркт миокарда». Вторичными запланированными точками были большие коронарные события, все сердечно-сосудистые события как в комбинации так и по отдельности. В качестве контроля за безопасностью на каждом визите оценивали активность АЛТ и КФК до года, а затем - 1 раз в год. Еще одной отличительной особенностью протокола исследования стало разрешение добавления статинов в ходе наблюдения по усмотрению лечащего врача. Причем возможность учета факта приема статина при статистической обработке материала была заложена в план испытания. В частности, допускалось превышение числа пациентов, которые начали принимать статин в группе плацебо, по сравнению с группой вмешательства на 17% в середине и на 32% - в конце исследования. Таким образом, появилась возможность, хоть и не в рандомизированном порядке, оценить, с одной стороны, безопасность комбинации фибратов и статинов, с другой –дополнительный эффект включения фибрата в стандартную терапию [9]. Результаты В FIELD не было выявлено достоверного преимущества фибрата над плацебо в отношении первичной конечной точки (комбинация случаев коронарной смерти и нефатальных инфарктов миокарда). Недостоверное относительное снижение частоты развития событий главной первичной конечной точки составило 11% (табл.1). Таблица 1. Первичная конечная точка Конечная точка Плацебо Фенофибрат (n=4900), n (%) (n=4895), n (%) Коронарная смерть/нефатальный ИМ Коронарная смерть Нефатальный ИМ ОР (95% CI) p 288 (6) 256 (5) 0.89 (0.75-1.05) 0.16 93 (2) 207 (4) 110 (2) 158 (3) 1.19 (0.90-1.57) 0.22 0.76 (0.62-0.94) 0.010 Превышение коронарных смертей на 19% в группе фенофибрата не было достоверным. При анализе вторичных и третичных конечных точек получено достоверное снижение суммы сердечно-сосудистых событий (в основном за счет уменьшения числа нефатальных ИМ, реваскуляризаций), а также уменьшение числа случаев развития ретинопатии и альбуминурии (табл. 2). Таблица 2. Вторичные конечные точки Конечная точка Плацебо Фенофибрат ОР (95% CI) p (n=4900), n (%) (n=4895), n (%) 683 (14) 612 (13) 0.89 (0.80-0.99) 0.035 Все сердечно-сосудистые события Сердечно-сосудистая смертность Общая смертность Инсульт Коронарная реваскуляризация Все реваскуляризации 127 (3) 323 (7) 175 (4) 364 (7) 471 (10) 140 (3) 356 (7) 158 (3) 290 (6) 380 (8) 1.11 (0.87-1.41) 0.41 1.11 (0.95-1.29) 0.18 0.90 (0.73-1.12) 0.36 0.79 (0.68-0.93) 0.003 0.80 (0.70-0.92) 0.001 В ходе обсуждения на страницах медицинской литературы и в Интернете, мнения исследователей в отношении трактовки результатов FIELD разделились. Главный исследователь FIELD A.Keech (Сиднейский университет) отметил, что хотя результаты испытания оказались не так хороши, как ожидалось, он уверен, что фенофибрат способен оказывать существенный положительный эффект у больных диабетом. Очевидно, не стоит назначать фибраты вместо статина. Однако, в сочетании со статином фенофибрат может оказать дополнительный эффект. Этот эффект Keech связал с характером гиполипидемического действия фибратов: они в отличие от статинов преимущественно снижают уровень триглицеридов, повышают содержание ХСЛВП и увеличивают размер частиц ЛНП. Такое действие теоретически должно быть максимально полезно при сахарном диабете. Он напомнил также, что в крупных исследованиях со статинами по снижению сосудистых событий не было получено данных об эффективности в отношении предупреждения микрососудистых осложнений. В то время как в FIELD фенофибрат уменьшал их число. Д-р Keech считает, что эффект фенофибрата мог быть маскирован достоверно более частым применением статинов в группе плацебо: 17% против 7% в группе фенофибрата. После исключения этого фактора из статистического анализа, первичная конечная точка на 19% (p=0.01) реже регистрировалась в группе фенофибрата. Возможность неоднородности групп по числу пациентов, принимавших статины предусматривалась планом FIELD [9]. Автор комментария к публикации FIELD в «Ланцете» H.Colhoun [10] не считает, что итоги FIELD указывают на целесообразность назначения фенофибрата вместе со статином у пациентов с СД-2. По ее мнению для обоснованной рекомендации комбинированной терапии необходимы более подробные данные, в частности о том, какие именно статины были использованы. Кроме того, она указала на недостоверное повышение на 19% риска сердечной смерти. Согласно заключению H. Colhoun, результаты FIELD не дают основания для широкого назначения фенофибрата пациентам с сахарным диабетом и для назначения фибратов у больных с достигнутым целевым уровнем ХСЛНП. Положительное действие на вторичные и третичные конечные точки, к сожалению, не отразилось на смертности, а даже наоборот. На это указал выступавший с комментарием доклада результатов FIELD на сессии ААС H. Ginsberg. Он является руководителем нового исследования ACCORD, специально спланированного для сравнения комбиниованной терапии статина и фибрата относительно монотерапии статином при СД-2. В него планируется включить 5000 пациентов, результаты ожидаются не ранее 2009 года. Вторичные и третичные конечные точки. Прогрессирование альбуминурии было отмечено в 11% (регресс – в 8%) случаев в группе плацебо и в 9% (регресс – в 8%) - на фоне приема фенофибрата. Таким образом в группе фенофибрата чаще отмечалось замедление прогрессирования или регресс альбуминурии на 2.6%, чем на плацебо (p=0.002). Кроме того, в группе контроля большее число пациентов подверглось лазерной терапии диабетической ретинопатии (5.2% против 3.6% в группе вмешательства, p=0.0003). По словам д-ра А.Keech на пресс-конференции по результатам FIELD, такого драматическоого снижения числа микроангиопатий в исследованиях со статинами не наблюдалось. Изменения липидов. Как и ожидалось, фенофибрат снизил триглицериды на 30%, умеренно снизил ХСЛНП на 12%. Уровень ХСЛВП на начальных этапах испытания достоверно вырос, но к моменту завершения програмы достоверно не отличался от исходного. Надо отметить, что и в исследовании VA-HIT с гемфиброзилом повышение ХСЛВП было минимальным, а эффект на клинические точки – существенным. Все это может указывать на то, что фибраты как и статины, могут обладать нелипидными эффектами, которые обуславливают отчасти клинический эффект и которые могут различаться в зависимости от фибрата. Заключение. Таким образом, результаты FIELD не дают основания считать фибраты (фенофибрат) гиполипидемическим средством первого выбора при сахарном диабете. Соотношение эффективности и безопасности их комбинирования со статинами при этом заболевании так же остается под вопросом, поскольку назначение статинов происходило в нерандомизированном порядке. Но все же результаты этого исследования вероятно нельзя рассматривать как окончательный «провал» фибратов в лечении сахарного диабета. Необходимо ждать результата прямого сравнения комбинированной терапии с монотерапией статином в упоминавшемся выше испытании ACCORD. Новые данные об использовании левосимендана в лечении острой сердечной недостаточности. Результаты испытаний REVIVE II и SURVIVE Подготовил И.С. Явелов Левосимендан – негликозидное кардиотоническое лекарственное средство со свойствами вазодилятатора, одобренное для лечения острой декомпенсации сердечной недостаточности (СН) в 40 странах, включая Российскую Федерацию [1]. Препарат обладает двойным механизмом действия: с одной стороны, он повышает сродство сократительных белков кардиомиоцитов к кальцию, не увеличивая содержания последнего внутри клетки, что лежит в основе положительного инотропного эффекта, с другой – способствует открытию АТФ-зависимых калиевых каналов в гладких мышцах сосудистой стенки и за счет этого вызывает вазодилятацию. Кроме того, левосимендан имеет активный метаболит со сходным механизмом действия и длительным периодом полувыведения, обеспечивающий сохранение эффекта на протяжении нескольких суток после прекращения введения препарата [2]. Результаты клинического изучения в исследованиях II фазы LIDO (203 больных) и RUSSLAN (504 больных) дали основания предполагать, что наряду с благоприятным воздействием на симптомы заболевания и параметры гемодинамики, краткосрочная внутривенная инфузия левосимендана у больных с острой СН и существенно нарушенной сократимостью левого желудочка может иметь преимущество как перед добутамином, так и перед плацебо по влиянию на смертность в ближайшие 6 месяцев [3,4]. Аналогичная закономерность была выявлена в исследовании CASINO (291 больной) [5-7]. Однако количество изученных больных было слишком мало, чтобы с уверенностью судить об этом аспекте воздействия вмешательства. Новые данные об эффективности и безопасности левосимендана при острой декомпенсации СН получены во втором исследовании Рандомизированная оценка левосимендана (Randomized Evaluations of Levosimendan – REVIVE II) [8,9] и исследовании Выживаемость больных с острой сердечной недостаточностью, нуждающихся во внутривенной инотропной поддержке (Survival of Patients With Acute Heart Failure In Need of Intravenous Inotropic Support – SURVIVE) [1,10], результаты которых были доложены на ежегодной сессии Американской ассоциации сердца 14 и 16 ноября 2005 года, соответственно4[1]. 1. Исследование REVIVE II. В рандомизированном проспективном двойном слепом исследовании REVIVE II проводилось сравнение эффективности и безопасности левосимендана и плацебо. Набор больных осуществлялся в 103 центрах США, Австралии и Израиля. Было включено 600 больных старше 18 лет с фракцией выброса левого желудочка (ФВ) 35%, определенной в ближайшие 12 месяцев, госпитализированных в предшествующие 24 ч с декомпенсацией СН. Обязательным условием являлось сохранение одышки в покое после внутривенного введения мочегонных. Критерии невключения представлены в табл.1. Первоначально внутривенно вводилась нагрузочная доза левосимендана 6-12 мкг/кг с последующей инфузией 0,1 мкг/кгмин в течение 1 часа и увеличением дозы до 0,2 мкг/кгмин при хорошей переносимости. Длительность введения левосимендана или плацебо составляла 24 часа. Кроме того, допускалась одновременная инфузия других инотропных препаратов. Средний возраст больных, включенных в исследование, составлял 63 года, 21-29% были афроамериканцами, ишемическая этиология СН отмечена в 57% случаев. ФВ составляла в среднем 22%, ингибиторы АПФ получали 76-78% больных, бетаадреноблокаторы – 69-68%, спиронолактон – 37%, внутривенное введение вазодилататоров или положительных инотропных препаратов осуществлялось у 27-26% (указаны данные для группы плацебо и левосимендана соответственно). Первичной конечной точкой являлось изменение симптомов, смерть или утяжеление СН в первые 5 сут после рандомизации. М. Paker, представлявший результаты, подчеркнул, что в настоящее время это первое двойное слепое рандомизированное плацебо-контролируемое исследование, в котором оценивалось влияние вмешательства на клиническое течение заболевания в целом за период времени, соответствующий продолжительности типичной госпитализации в США. Такой подход представляется более значимым, чем изучение отдельных симптомов в одной временной точке. В группе левосимендана улучшение состояния отмечалось достоверно чаще, а ухудшение – реже, чем в группе плацебо (р=0,015). При этом наличие клинического ухудшения констатировалось при наличии одного из следующих событий: смерть; сохранение или утяжеление СН, несмотря на лечение вазодилататорами, мочегонными или инотропными препаратами; умеренное или выраженное ухудшение общей оценки своего состояния больным через 6 часов, 24 часа и 5 суток. Клиническое состояние не изменилось примерно у равного числа больных в обеих группах. По мнению М. Paker, для врачей, осуществляющих лечение больного, может бить важнее компонент первичной конечной точки, который указывает на оценку изменения общего состояния самим больным. За время наблюдения улучшение происходило у больных обеих групп, но было более выраженным у получавших левосимендан (табл. 2). При этом эффект выявлялся уже через 6 ч после начала введения препарата. Аналогичная закономерность отмечалась при учете выраженности одышки. Имелись также другие свидетельства положительного влияния левосимендана на симптомы заболевания. Так, утяжеление СН, потребовавшее дополнительного внутривенного введения мочегонных, вазодилататоров или инотропных лекарственных средств (в основном усиление одышки, выраженности отека легких и отсутствие ответа на проводимое лечение), в первые 5 суток отмечено у 15% больных, получивших левосимендан, и 26% больных, получивших плацебо. В группе левосимендана была достоверно меньше длительность госпитализации (7,0 против 8,9 суток у получавших плацебо; р=0,006). Кроме того, в первые сутки введения левосимендана существенно уменьшилось содержание мозгового натрийуретического пептида (МНП) в крови. Этот эффект сохранялся как минимум на протяжении первых 5 суток (р<0,001 в сравнении с плацебо) и исчезал к 30-м суткам после начала лечения. Данные о более отдаленном клиническом эффекте левосимендана (к вторичным конечным точкам относились число дней, проведенных не умершими больными вне стационара в первые 14 суток, а также сумма случаев смерти и утяжеления СН за 31 сутки) пока не доступны, хотя есть упоминание о положительном влиянии вмешательства. Смертность на протяжении 90 сут являлась вторичной конечной точкой. За этот срок среди получавших левосимендан умерло 15,1% больных, среди получавших плацебо – 11,6% (разница не достоверна). Число умерших в группе левосимендана оказалось бóльшим также на 5-е, 14-е и 31-е сутки после включения в исследование. Данные о частоте возникновения побочных эффектов представлены в табл. 3. Комментарий. Таким образом, в исследование REVIVE II продемонстрировано положительное воздействие левосимендана на клинические проявления острой СН, которое появляется во время его 24-часовой инфузии и сохраняется как минимум 4 суток после ее окончания. Однако при дальнейшей интерпретации результатов этого исследования необходимо учитывать, что оно не было спланировано (не обладало достаточной мощностью), чтобы оценить влияние вмешательства на смертность. Соответственно, результат, касающийся данного аспекта влияния вмешательства, нельзя считать ни надежным, ни окончательным. Чтобы преодолеть этот недостаток, были объединены результаты плацебо-контролируемых исследований левосимендана при острой СН (CASINO, REVIVE I, REVIVE II и RUSSLAN). По совокупным данным риск смерти на протяжении ближайших 6 месяцев в группах левосимендана и плацебо заметно не различался, а границы 95% доверительного интервала оказались достаточно узкими. С учетом данных о потенциальной опасности других положительных инотропных средств то, что новое вмешательство обладает положительным влиянием на симптомы заболевания и заметно не ухудшает его прогноз – достаточно обнадеживающее сообщение. По мнению M. Packer, основные побочные эффекты левосимендана соответствуют особенностям его фармакологического действия: головная боль и артериальная гипотония сопряжены с вазодилятирующими свойствами, аритмии – с положительным инотропным действием. Поэтому их более частое возникновение в сравнении с использованием плацебо вполне ожидаемо. Вопрос заключается в том, насколько частота встречаемости этих побочных проявлений при применении левосимендана отличается от их частоты на фоне введения других вазодилятаторов и кардиотонических лекарственных средств. 2. Исследование SURVIVE. Рандомизированное проспективное двойное слепое исследование с двойной маскировкой SURVIVE по сравнению эффективности и безопасности левосимендана и добутамина проводилось в 75 центрах 8 стран Европы (Австрия, Великобритания, Германия, Латвия, Польша, Россия, Финляндия, Франция) и Израиля. В него было включено 1327 больных. В настоящее время это крупнейшее клиническое испытание внутривенных инотропных лекарственных средств при острой СН, в котором оценивалось влияние их краткосрочного введения препаратов на выживаемость в отдаленные сроки заболевания. Включались больные с ФВ ≤30%, определенной в ближайшие 12 месяцев, госпитализированные с острой декомпенсацией СН (не обязательно хронической) и недостаточным ответом на внутривенное введение мочегонных и/или вазодилятаторов (хотя бы одно – сохраняющаяся олигурия без гиповолемии, одышка в покое или необходимость в искусственной вентиляции легких, давление заклинивания легочной артерии ≥18 мм рт.ст. и/или сердечный индекс ≤2,2 л/минм2). Критерии невключения представлены в табл.1. Левосимендан вводился на протяжении 24 часов (нагрузочная доза 12 мкг/кг за 10 мин с последующей инфузией 0,1 мкг/кгмин и увеличением через 1 час до 0,2 мкг/кгмин при хорошей переносимости); одновременно использовалось плацебо добутамина. Добутамин вводился в дозе 5-40 мкг/кгмин в течение 24 часов и более (по решению врача при клинической необходимости); одновременно использовалось плацебо левосимендана. Кроме того, при наличии клинической необходимости на протяжении 6-месячного периода наблюдения имелась возможность повторного слепого введения того лекарственного средства, к которому больной был рандомизирован в начале исследования. Средний возраст больных, включенных в исследование, составлял 67-66 лет, хроническая СН отмечалась у 88% больных (в остальных случаях причиной госпитализации являлась впервые возникшая острая СН), этиология СН была ишемической в 76% случаев (указаны данные для группы левосимендана и добутамина соответственно). ФВ составляла в среднем 24%. Длительность введения левосимендана составляла в среднем 23 часа, добутамина – 39 часов (средняя доза 6 мкг/кгмин). Первичной конечной точкой являлась общая смертность на протяжении 6 месяцев. Количество больных в исследовании позволяло с достаточной надежностью продемонстрировать снижение смертности в группе левосимендан в эти сроки на 25% и более в сравнении с получавшими добутамин. Хотя имелась тенденция к преимуществу левосимендана в ранние сроки после начала введения исследуемых препаратов, общая смертность больных ни на одном из этапов исследования в группах левосимендана и добутамина достоверно не различалась (табл. 4). По вторичным точкам, характеризующим клиническую эффективность (число дней, проведенных не умершими больными вне стационара, оценка выраженности одышки и изменение общей оценки своего состояния больным через 24 ч после начала лечения, сердечно-сосудистая смертность через 6 месяцев) группы достоверно не различались. Вместе с тем, содержание МНП вскоре после начала введения левосимендана снизилось примерно наполовину и оставалось таким как минимум 5 суток, в то время как снижение в группе добутамина было менее выраженным и стало заметно меньшим к 3-м суткам после начала лечения (p<0,0001 для различий между группами через 1, 3 и 5 суток). Через 5 суток от начала лечения степень снижения содержания этого маркера тяжести СН составила 46% в группе левосимендана и 13% в группе добутамина. По мнению A. Mebazaa, представлявшего результаты исследования SURVIVE, это “наиболее существенное снижение уровня МНП в клинических испытаниях при острой СН”. По частоте артериальной гипотонии, желудочковых аритмий, побочных проявлений со стороны почек и изменению уровня креатинина группы существенно не различались. В группе левосимендана достоверно чаще возникала мерцательная аритмия (9,1 против 6,1%) и достоверно реже утяжелялась СН (12,3 против 17,0% соответственно). Комментарий. Таким образом, полученные факты свидетельствуют о более выраженном влиянии левосимендана на отдельные проявления заболевания по сравнению добутамином. Единственным отрицательным моментом является более частое возникновение мерцательной аритмии. Не исключено также, что левосимендан обладает некоторым преимуществом и по влиянию на выживаемость в ближайшие 6 месяцев. Однако если оно существует, то заметно меньше ожидаемых 25%. Поэтому получить достоверный результат на изученном количестве больных не представлялось возможным. Чтобы преодолеть этот недостаток, были объединены результаты трех исследований по сравнению левосимендана и добутамина со сходным протоколом введения левосимендана (CASINO, LIDO и SURVIVE). В результате общее количество больных составило 1730, а смертность через 6 месяцев от начала лечения оказалась достоверно ниже у получавших левосимендан (р=0,032). Не исключено также, что преимущество левосимендана перед добутамином по влиянию на выживаемость наиболее выражено в ранние сроки после начала введения препаратов, а в дальнейшем значительно уменьшается или утрачивается (табл. 2). Возможно, что это является следствием раннего неблагоприятного воздействия добутамина. Однако с другой стороны размеры проведенного исследования не позволяет с уверенностью судить о столь раннем влиянии лечения на смертность. Кроме того, в полученных результатах остается много не ясного. Неожиданной находкой явилось несовпадение результатов сравнения левосимендана и добутамина в разных странах: по влиянию на смертность за 6 месяцев левосимендан оказался достоверно лучше в Финляндии (включено 95 больных) и имелось тенденция к его преимуществу в России (включен 461 больной). Противоположная тенденция отмечалась по Франции (включено 183 больных) и Израиле (включено 142 больных). Причина этого несоответствия не понятна: хотя велика вероятность случайности (коэффициент достоверности различий между странами не достигал статистической значимости и составлял 0,06), не исключено, что существенную роль здесь играли несовпадения в контингентах изученных больных, чему способствовали очень широкие критерии включения. Так, комментируя результаты исследования, J.G.F. Cleland подчеркнул, что на результаты сравнения могло повлиять включение некоторого числа больных с систолическим АД около 80 мм рт.ст., что подозрительно в отношении наличия у них кардиогенного шока. Возможно, дальнейший анализ позволит точнее определить подгруппы больных, у которых можно ожидать преимущества левосимендана перед добутамином. Пока представлены данные, что в отличие от больных с впервые возникшей острой СН, при декомпенсации хронической СН в первые 5 суток преимущество левосимендана было более существенным и оказалось близким к статистически значимому (отношение шансов 0,58, 95% доверительный интервал 0,33-1,01). 3. Заключение. Согласно результатам исследований REVIVE II и SURVIVE левосимендан уменьшает симптомы и улучшает клиническое течение острой декомпенсации СН в сравнении с плацебо и обладает преимуществом перед добутамином по влиянию на отдельные проявления заболевания. Вместе с тем при использовании левосимендана можно ожидать более частого возникновения мерцательной аритмии и данный эффект заметен как при сравнении с плацебо, так и в сравнении с добутамином. Насколько это связано со способностью левосимендана несколько снижать уровень калия в крови [2], пока не понятно. Частота возникновения желудочковой тахикардии при использовании левосимендана тоже увеличивается, однако здесь заметных различий по сравнению с добутамином не найдено. Согласно накопленным фактам, по влиянию на смертность левосимендан достоверно не отличается от плацебо и не имеет выраженного преимущества перед добутамином. Однако из-за небольшого количества изученных больных с уверенностью судить об этом аспекте воздействия препарата не представляется возможным. Так, с одной стороны не исключено, что левосимендан способствует некоторому увеличению смертности в сравнении с плацебо, с другой остается надежда, что он может превосходить добутамин, особенно у отдельных групп больных, как минимум в ранние сроки после начала лечения. Возможно, появление более полного изложения результатов проведенных исследований поможет выявить факторы, оказавшие влияние на полученный результат, а также определить перспективные направления дальнейшего изучения левосимендана. Однако пока многие детали не доступны, от определенных выводов разумно воздержаться. Тем не менее, представляется, что наиболее смелые ожидания в отношении левосимендана (возможность существенного снижения смертности при его краткосрочном внутривенном введении больным с острой декомпенсацией СН) не оправдались. Но с другой стороны, новые данные не меняют сложившихся представлений о месте этого лекарственного средства в лечении острой СН: в настоящее время инфузию левосимендана рассматривают как дополнительное вмешательство у больных с низким сердечным выбросом из-за существенно нарушенной сократимости миокарда, не имеющих гиповолемии, выраженной артериальной гипотонии и не отвечающих на стандартные вмешательства (внутривенное введение мочегонных и вазодилататоров в оптимальных дозах) [11]. С появлением левосимендана в распоряжении врачей, ранее в данной клинической ситуации располагавших только добутамином, появился второй эффективный кардиотонический препарат. С учетом накопленных фактов добутамин может быть предпочтительнее при наличии артериальной гипотонии и ряда других противопоказаний к левосимендану (тяжелое нарушение функции печени и почек, гиперчувствительность), в то время как в остальных случаях более выраженного воздействия можно ожидать от левосимендана. Кроме того, в случаях, когда клинической стабилизации при декомпенсированной СН добиться не удается, несмотря на присоединение к лечению более доступного по цене добутамина, надежды, очевидно, стоит возложить левосимендан. Таблица 1. Критерии невключения в исследования SURVIVE и REVIVE-2. SURVIVE REVIVE II возраст ≤18 лет рестриктивная кардиомиопатия, тяжелая обструкция выносящего тракта левого желудочка операция на сердце <30 сут желудочковая тахикардия типа “пируэт” в анемнезе ЧСС в покое >130 уд. в мин. систолическое АД <85 мм рт.ст. содержание калия в крови <3,5 ммоль/л креатинин >450 мкмоль/л, острое кровотечение гемоглобин <80 г/л печеночная недостаточность септицемия, септический шок возраст <18 лет систолическое АД <85 мм рт.ст. ЧСС ≥120 в мин как минимум 5 мин в период отбора больных тяжелая обструкция выносящего тракта левого желудочка (гемодинамически значимый нескорригированный стеноз клапана, рестриктивная или гипертрофическая кардиомиопатия) ожидаемая ангиопластика, операция на сердце или трансплантация сердца в ближайшие 3 мес стенокардия в предшествующие 6 ч инсульт или преходящее нарушение мозгового кровообращения в предшествующие 3 мес желудочковая тахикардия типа “пируэт” в анамнезе назначение амринона или милринона за 24 ч до начала введения левосимендана или плацебо содержания калия в крови <3,5 ммоль/л или >5,4 ммоль/л содержание креатинина в сыворотке крови >450 мкмоль/л или диализ значимое поражение печени (уровень печеночных ферментов как минимум в 5 раз выше верхней границы нормы) острое кровотечение или тяжелая анемия (уровень гемоглобина <100 г/л или переливание крови во время текущей госпитализации) острая декомпенсация из-за активной инфекции тяжелая хроническая обструктивная болезнь легких в анамнезе или бронхиальная астма с задержкой СО2 или парентеральным введением стероидов беременность, кормление грудью Примечания: АД – артериальное давление, ЧСС – частота сердечных сокращений. Таблица 2. Умеренное или выраженное улучшение общей оценки своего состояния больными в исследовании REVIVE-2. Время оценки 24 ч (к концу инфузии) 48 ч 5 суток Левосимендан (n=299) 60% 63% 76% Плацебо (n=301) 46% 58% 65% Таблица 3. Побочные эффекты в исследовании REVIVE-2. Отдельные побочные проявления Артериальная гипотония Головная боль Желудочковая тахикардия Мерцательная аритмия Желудочковые экстрасистолы Левосимендан (n=299) 49,2% 29,4% 24,1% 8,4% 7,4% Плацебо (n=301) 35,5% 14,6% 16,9% 0,2% 0,2% Примечания: данные о статистической значимости различий между группами отсутствуют. Таблица 4. Общая смертность в исследовании SURVIVE. р 0,026 0,053 0,001 Время оценки 180 сут (первичная конечная точка) 31 сутки (вторичная конечная точка) 5 суток (ретроспективн ый анализ) Левосимендан (n=664) Добутамин (n=663) 26,1% 27,9% Относительны й риск (95% доверительный интервал) 0,91 (0,74-1,13) 11,9% 13,7% 0,85 (0,63-1,15) 4,4% 6,0% 0,72 (0,44-1,16) Редколлегия журнала Кардиология в специальном письме по поводу публикации «Ещё раз о безопасности розувастатина" заявила, что дальнейшее обсуждение безопасности статинов «бесплодно и может только вредить». Editorial board of Kardiologia in a special address declared that further discussion of «safety of rosuvastatin (as well as other statins)» «is fruitless and can cause only harm». 5[*] В журнале Кардиология опубликована «подготовленная редколлегией» статья (письмо ?) «… Нужно ли кричать «пожар», в доме, который не горит?»6[†]. Это дискуссионная заметка, достоинство которой в том, что она очередной раз привлекает внимание к проблеме безопасности розувастатина и статинов вообще. Кроме того, из заметки можно почерпнуть, что проблема не придумана неким Грацианским, а к ней имеют отношение и журнал Lancet, причем в лице его главного редактора, и журнал Circulation, и что были обращения к FDA c призывами отозвать розувастатин, и что эта организация была вынуждена специально рассматривать вопрос о безопасности препарата. Надеюсь, что результатом будет обращение читателей к публикации «Еще раз о безопасности розувастатина» (Кардиология 2005, №10, с.69-72). Последняя (во всяком случае с точки человека, ее подготовившего) представляет собой объективное (как теперь кажется, даже слишком объективное) изложение статьи A.A.Alsheikh-Ali с соавт.7[‡] и комментария к ней S.Grundy в журнале Circulation, а также письма FDA о розувастатине. Думаю, что внимательный читатель не найдет в «подготовленном редколлегией материале» новых фактических сведений по сравнению с комментируемым в нем текстом. Основное отличие того, что «подготовила редколлегия» – это заявление о бесплодности и вреде дальнейшего обсуждения безопасности статинов. Оригинален в статье редколлегии и перевод заключения резюме статьи A.A.Alsheikh-Ali и соавт. («настоящий анализ поддерживает суждение об относительной безопасности розувастатина …». На самом деле это заключение переводится противоположно: «настоящий анализ поддерживает сомнения (озабоченность, беспокойство) в относительной безопасности розувастатина…». Именно из этого заключения следует то, что A.A.Alsheikh-Ali и соавт. пишут в конце обсуждения своей статьи: «В настоящее время представляется разумным использовать другие статины как терапию первой линии, начинать лечение с низких доз, предусматривать возможность комбинированной терапии …». Фраза «подготовлено редколлегией» придает обычной, не очень корректной, полемической заметке новое качество, превращая ее в официальный документ (правда с неожиданно залихватским названием). И «Кардиология» становится, очевидно, уникальным из считающих себя серьезными медицинских журналов, редколлегия которого официально подготовила «материал», содержащий своеобразный запрет на обсуждение проблемы безопасности статинов, постулировав, что «дальнейшие рассуждения» на эту тему «бесплодны и могут только вредить». Необычно выглядит в официальном обращении редколлегии ведущего Российского кардиологического журнала и объяснение естественной настороженности по отношению к безопасности нового, высоко активного потенциально массового лекарства только «обычной практикой борьбы между фармацевтическими компаниями». Это также характеризует редколлегию Кардиологии как орган, своеобразно относящийся к обсуждению важнейшей проблемы безопасности «массовых» лекарств. Теперь, скорее всего, следует ожидать «материала, подготовленного редколлегией» Кардиологии с запрещением обсуждения безопасности нестероидных противовоспалительных средств и ингибиторов циклооксигеназы-2. Первый сигнал уже был – главный редактор журнала не разрешил публикацию информации о представленном на очередной сессии Американской Ассоциации Сердца сообщении об увеличении смертности при применении препаратов этих групп и о том, что сердечнососудистые заболевания включены в число противопоказаний к целекоксибу. Что касается розувастатина, то лекарство скорее всего действительно окажется относительно безопасным - при использовании в тех дозах и с теми предосторожностями, которые сейчас содержатся в рекомендациях по его применению. Надо только хорошо понимать, что эти предосторожности и обновленные рекомендации - во многом как раз следствие «суждений на основании имеющихся данных», выступлений и действий Ричарда Хортона, Дэвида Грехэма, Public Citizen, других людей и организаций, своевременно привлекших внимание к потенциальным опасностям, связанным с применением препарата. Эти действия привели к специальному рассмотрению проблемы FDA, снятию дозы 80 мг, к активному распространению знаний о ранних симптомах поражения мышц, к появлению писем Астры-Зенеки к врачам о необходимости осторожности при назначении розувастатина, к ограничению стартовой дозы 10-ю миллиграммами, к тому, что к широкому практическому применению рекомендуется дозы, не превышающие 20 мг и т.д. Дискуссия о безопасности розувастатина безусловно уже дала свои плоды. И в смысле «спор» она действительно может быть прекращена, сменившись констатацией возможности осложнений и беспристрастным накоплением фактических данных из расширяющейся практики с нарастающей продолжительностью использования по обновленным рекомендациям в странах с высокой культурой регистрации нежелательных явлений. Отношение к розувастатину как к средству со все еще недоказанной клинической эффективностью должно определяться, прежде всего, с учетом наличия статинов, соответствующая эффективность которых безоговорочно доказана. Проблема же безопасного применения ингибиторов ГМГ КоА редуктазы и в частности розувастатина в реальной медицинской практике будет существовать всегда8[§]. И не поблагодарят производители и продавцы розувастатина редколлегию Кардиологии, если под влиянием «подготовленных ей материалов» Российские врачи утратят бдительность и забудут о возможности тяжелых осложнений при использовании даже становящихся стандартными малых доз этого препарата. Н.А.Грацианский P.S. Подготавливая текст ответа, я не сомневался, что организаторы акции не поместили в этот номер рекламу Крестора, чтобы «не подставлять» редколлегию, поэтому даже не пролистал журнал. Однако оказалось, что пренебрегли и этим проявлением соблюдения приличий. В результате «подготовленный редколлегией материал» с указанием прекратить обсуждение безопасности розувастатина соседствует с рекламой этого средства. Таким образом, теперь в журнале к оригинальным и передовым статьям, обзорам, лекциям «под рекламу» добавились и редакционные статьи «под рекламу». Очевидно, это наивысшее проявление расположения к торговому представительству соответствующей компании. Очередное указание на неэффективность антибиотиков в профилактике осложнений коронарной болезни сердца. Результаты испытания CLARICOR К теперь уже многочисленным неудачным попыткам предупреждения осложнений коронарной болезни сердца (КБС) с помощью антимикробной терапии, направленной против Chlamydia Pneumonia, добавилась еще одна. В Британском Медицинском Журнале только что опубликовано сообщение о том, что краткосрочное профилактическое применение активного антибиотика-макролида кларитромицина у больных стабильной КБС не только не привело к достижению основной цели, но и сопровождалось увеличением смертности от всех причин [1]. Далее приводится перевод резюме этого сообщения. «Цель. Выснить, влияет ли макролид кларитромицин на смертность и сердечнососудистые осложнения у больных со стабильной коронарной болезнью сердца. План. Многоцентровое испытание с централизованной рандомизацией. Все участвующие стороны (all parties) на всех стадиях были «ослеплены». Анализы выполнялись «по намерению лечить». Места проведения. Пять университетских кардиологических отделений в Копенгагене и координирующий центр. Участники. 13702 больным в возрасте 18-85 лет, у которых диагнозом при выписке в 1993-1999 годах были инфаркт миокарда или стенокардия, и которые были живы в августе 1999 года, были посланы письма-приглашения; 4373 из них были рандомизированы. Вмешательство. Применение в течение 2 недель кларитромицина в дозе 500 мг/сут или плацебо. Основные оценки исхода (результата). Первичный исход: сумма смертности от всех причин, инфарктов миокарда, или нестабильной стенокардии за 3 года наблюдения. Вторичный исход: сумма сердечно-сосудистой смертности, инфарктов миокарда или случаев нестабильной стенокардии. Сведения об исходах были получены из Датских х [национальных]регистров и были вслепую оценены комитетов по событиям. Результаты (табл. 1 и 2). К кларитромицину были рандомизированы 2172, к плацебо – 2201 участников. Мы не обнаружили достоверного влияния кларитромицина на первичный (отношение рисков 1.15, 95% доверительный интервал 0.99-1.34) или вторичный исход 1.17Ж 0.98-1.40). Смертность была достоверно выше в группе кларитромицина (1.27, 1.03-1.54, р=0.03), как следствие достоверно более высокой сердечнососудистой смертности (1.45, 1.09-1.92, р=0.01). Заключение. Кратковременное применение кларитромицина у больных со стабильной коронарной болезнью сердца может обусловливать более высокую сердечнососудистую смертность. Следует изучить длительную безопасность кларитромицина у больных со стабильной ишемической болезнью сердца». Таблица 1. Основные оценки исходов в группах вмешательства согласно рандомизации КларитроОтношение Плацебо* Оценка исходов мицин* рисков P (n=2200) (n=2172) (95% ДИ) Первичная: смерти от всех причин, инфаркты 1.15 344 (15.8) 307 (13.8) 0.08 миокарда/ нестабильная стенокардия (0.99- 1.34) Вторичная: сердечно-сосудистая смертность, 1.17 249 (11.5) 218 (9.9) 0.09 инфаркты миокарда/нестабильная стенокардия (0.98 - 1.40) Третичная: сердечно-сосудистая смертность, инфаркты миокарда/ нестабильная 1.20 351 (16.2) 303 (13.7) 0.03 стенокардия, инсульты, заболевание (1.02 - 1.39) периферических сосудов Примечание. Основано на регрессионной модели Кокса, включающей в качестве обязательных переменных пол, перенесенный инфаркт миокарда, и возраст. * Число больных (%). ДИ – доверительный интервал. Таблица 2. Смертность в соответствии с группой рандомизации Кларитромицин Плацебо Отношение рисков Смертность (n=2172) (n=2200) (95% ДИ) Сердечнососудистая 111 (5.1) 78 (3.5) 1.45 (1.09 to 1.92) Несердечнососудистая 85 (3.9) 84 (3.8) 1.03 (0.76 to 1.41) Не классифицированная 16 (0.7) 10 (0.5) 1.64 (0.75 to 2.11) От всех причин 212 (9.8) 172 (7.8) 1.27 (1.03 to 1.54) Примечание. Основано на регрессионной модели Кокса, включающей в качестве обязательных переменных пол, перенесенный инфаркт миокарда, и возраст. *Число больных (%). ДИ – доверительный интервал. p 0.01 0.82 0.22 0.03 Некоторые другие сведения из публикации. Из общественных регистров были получены сведения о всех исходах, и наблюдение было осуществлено более чем за 99% 99% больных. Потенциальная слабость испытания включает в себя тот факт, что только 32% от соответствовавших критериям включения больныхбыли дествительно рандомизированы. Кроме того, не известно, какими были образ жизни и лечение больных во время наблюдения. Тем не менее, мало вероятно, что эти факторы существенно различались между группами. Среди больных, получавших кларитромицин, было больше курящих, но многофакторный анализ, в котором были учтены как курение, так и другие исходные характеристики, не внес существенного изменения в результаты. Из обсуждения. Почему кларитромицин мог оказать неблагоприятное действие у больных коронарной болезнью сердца, не ясно. Макролиды обладают свойствами блокаторов калиевых каналов, которое может обусловливать удлинение интервала QT, тахикардию типа torsades de pointes и приводить к смерти. Риск увеличивается при одновременном применении макролидов и лекарств, обмен которых осуществляется изоэнзимом 3А цитохрома Р450. Различий в сердечнососудистой смертности во время первого месяца не отмечено. По мнению авторов, взаимодействие лекарств не может объяснить разницы в сердечнососудистой смертности, выявленной при длительном наблюдении. В качестве заключения приводим фразу, завершающую комментарий J.Danesh к результатам той части испытания PROVE-It, в которой оценивалась эффективность антибиотика гатифлоксацина у больных, недавно перенесших острый коронарный синдром [2]. «Данные рандомизированных испытаний показывают, что отсутствуют оправдания использования лечения антихламидийными антибиотиками с целью предупреждения сердечнососудистого заболевания, а накапливающиеся данные из проспективных сероэпидемиологических исследований не поддерживают идеи, согласно которой хроническая инфекция C pneumoniae является важной (основной – major) причиной коронарной болезни сердца». Полученные в CLARICOR результаты делают целесообразным изучение отдаленных последствий применения кларитромицина у больных КБС по любым показаниям. Статины и риск рака. Метаанализ рандомизированных контролированных испытаний статинов показал, что их применение в этих испытаниях не ассоциировалось ни с увеличением, ни с уменьшением риска возникновения злокачественных опухолей и смерти от них. Еще на начальном этапе внедрения статинов в клиническую практику высказывались два противоположных предположения: что эти средства могут способствовать возникновению злокачественных опухолей, и что они обладают противоопухолевым действием [1]. Первое предположение было частично опровергнуто данными крупных рандомизированных испытаний. Частично, потому, что, с одной стороны, в отдельных испытаниях все же было отмечено увеличение частоты возникновения опухолей среди участников, рандомизированных к приему статина 9[*], с другой – длительность испытаний могла оказаться недостаточной для проявления возможного канцерогенного эффекта статинов. Правильность второго предположения находила подтверждение в экспериментальных данных и сведениях, полученных в обсервационных исследованиях. В журнале Американской Медицинской Ассоциации (JAMA) только что опубликованы результаты метаанализа рандомизированных контролированных испытаний статинов, которые продемонстрировали нейтральность этих средств по отношению к развитию злокачественных опухолей [2]. Приводим перевод резюме этой публикации. «Контекст. Статины – снижающие холестерин лекарства, которые, как это было доказано в рандомизированных контролированных испытаниях, предупреждают сердечные события. Недавно выполненные ретроспективные анализы предположили [дали основание предположить], что статины предупреждают также и рак. Цели. Исследовать влияние терапии статинами на частоту возникновения рака и частоту случаев смерти от рака, проанализировать действие статинов на специфические виды рака, а также оценить эффект липофильности статина и его происхождения. Источники данных. Был выполнен систематический поиск литературы с использованием специфических поисковых терминов в MEDLINE, EMBASE, CINAHL, Web of Science, CANCERLIT, и в Кохрановской базе данных систематических обзоров по июль 2005 года. Выполнен также обзор кардиологических и онкологических тезисов и ручной обзор литературных ссылок, [содержащихся в статьях]. Отбор исследований. Двадцать семь из первично идентифицированных 8943 статей (86936 участников) соответствовали критериям включения. Это были сообщения о 26 рандомизированных испытаниях статинов со средней продолжительностью наблюдения не меньше года, в которые было минимально включено 100 больных, и которые содержали данные или о частоте возникновения рака (20 исследований) или случаях смерти от рака (22 исследования). Экстрагирование данных. Все данные были экстрагированы независимо 3 исследователями, использовавшими стандартизованный метод извлечения данных. Взвешенные средние были выражены как отношения рисков (шансов) (ОР) с 95% доверительными интервалами (ДИ). Для этого была использована модель случайных эффектов (методы DerSimonian и Laird). Оценки статистической гетерогенности были получены с помощью Q-статистики. Синтез данных. Согласно мета-анализу, включившему 6662 случая возникновения рака и 2407 смерти от рака, статины не уменьшили ни частоту возникновения рака (OР 1.02; 95%ДИ 0.97-1.07), ни частоту смерти от рака (95%ДИ 1.01; 95% CI, 0.93-1.09). Не было отмечено уменьшения никакого индивидуального типа рака. Этот нулевое влияние на возникновение рака сохранялось, если оценивались только гидрофильные, липофильные статины, статины естественного происхождения или синтетические. Выводы. В рандомизированных контролированных испытаниях действие статинов на риск рака и смерти от рака было нейтральным. Мы установили, что никакой тип рака не был подвержен влиянию применения статинов и никой подтип статина не оказывал влияния на риск рака». Возникновение рака в контролированных рандомизированных испытаниях статинов. Метаанализ. Отношения шансов (95% ДИ) Риск выше на статине Dale RM et al, JAMA 2006; 295: 74-80 Смерти от рака в контролированных рандомизированных испытаниях статинов. Метаанализ. Отношения шансов (95% ДИ) Риск выше на статине Dale RM et al, JAMA 2006; 295: 74-80 Статины и риск различной локализации. N испытаний Группа статина Группа контроля Молочная железа 5 81/16875 64/16901 Простата 3 305/10037 311/10026 6 400/23031 394/23032 4 158/13984 162/13988 7 409/30632 438/30641 5 68/13168 Локализация, тип рака Желудочнокишечный Толстая кишка Дыхательная система Меланома Dale RM et al, JAMA 2006; 295: 74-80 80/13156 Отношение шансов (95% ДИ) 1.33 (0.79-2.26) 0.98 (0.83-1.15) 1.01 (0.82-1.24) 0.95 (0.73-1.25) 0.94 (0.82-1.07) 0.84 (0.57-1.25) P (Q статистика) .047 .94 .14 .24 .53 .30 Статины и рак. Метаанализ Включенные испытания, применявшиеся в них препараты и дозы. n Характеристика Статин Доза Длительность, годы Rрандомизированное DB двойное слепое PC – плацебо контролированное OL – открытое Dale RM et al, JAMA 2006; 295: 74-80 Статины и риск рака, комментарий к метаанализу Метаанализ Dale и соавт. (янв. 2006), продемонстрировавший «нейтральный эффект статинов на риск рака и смерти от рака в рандомизированных контролированных испытаниях» не содержит ни данных из исследований с выраженным снижением (с очень низким достигнутым) ХСЛНП*, ни, тем более, данных о розувастатине. * Известно, что в TNT частота рака в группе рандомизированных к 10 и 80 мг/сут аторвастатина была соответственно 1.5 и 1.7% (отношение рисков 1.13, 95% доверительный интервал 0.83-1.55, р=0.42) Применение клеток костного мозга у больных острым передним инфарктом миокарда, подвергнутых стентированию в остром периоде заболевания, оказалось бесполезным. Результаты испытания ASTAMI. «… результаты действуют отрезвляюще» J.Willerson10[*] На сессии Американской Ассоциации Сердца 2005 года доложены результаты испытания эффективности стволовых клеток у больных передним инфарктом миокарда [1,2]. Испытание проведено в 2 лечебных учреждениях Осло (Норвегия) с сентября 2003 по май 2005 года. Включен 101 больной с первым острым передним инфарктом миокарда и выраженными нарушениями движений стенки левого желудочка по данным эхокардиографии. У всех больных в пределах 2-12 часов после появления симптомов было выполнено стентирование стеноза-«виновника» в проксимальной или средней трети левой передней нисходящей коронарной артерии. К интракоронарному введению аутологичных мононуклеарных клеток костного мозга рандомизированы 52, только к обычному лечению – 49 больных [3, 4]. На 4-7 сутки из гребешка тазовой кости забирали 50 мл костного мозга. Мононуклеарные клетки получали центрифугированием на Lymphoprep. Примерно 10 мл суспензии этих клеток вводили в переднюю нисходящую артерию на 5-8 сутки заболевания [3]. Для оценки функции левого желудочка в исходном состоянии и через 6 месяцев после инфаркта миокарда применены три метода: SPECT (однофотонная эмиссионная компьютерная томография), эхокардиография, и магнитный резонанс (получение изображения с помощью магнитного резонанса). Результаты. Ни один из примененных методов не выявил достоверных различий между группами (таблица). Только по данным магнитного резонанса отмечена тенденция к лучшей фракции выброса, но в контрольной группе [1]. Таблица. Результаты ASTAMI [1] Метод и оценка Стволовые Контроль клетки p Однофотонная эмиссионная компьютерная томография Изменение фракции выброса (%) Изменение конечного диастолического объема (мл) Изменение размера инфаркта (%) 8.1 -11.2 -11.0 7.0 -1.8 -7.8 0.63 0.11 0.14 1.2 -6.9 -0.7 4.3 -2.7 -2.6 0.05 0.50 0.09 3.1 8.9 2.1 10.8 0.54 0.74 Магнитно-резонансная томография Изменение фракции выброса (%) Изменение конечного диастолического объема (мл) Изменение размера инфаркта (%) Эхокардиография Изменение фракции выброса (%) Изменение конечного диастолического объема (мл) На той же сессии Американской Ассоциации Сердца были доложены результаты многоцентрового рандомизированного плацебо контролированного испытания REPAIRAMI, в котором аутологичные клетки костного мозга вводились внутрикоронарно на 3-6 сутки инфаркта миокарда практически таким же образом, как и в ASTAMI [5, 6]. В REPAIR-AMI включались все больные инфарктом миокарда (т=204), независимо от локализации, подвергнутые в остром периоде первичному чрескожному коронарному вмешательству с имплантацией стента. Для оценки результата применялась рентгеноконтрастная вентрикулография. Первичной конечной точкой испытания было абсолютное изменение фракции выброса левого желудочка за 4 месяца. Это изменение оказалось большим (+5.5%) в группе вмешательства, чем в группе плацебо (+3%). При анализе подгрупп оказалось, что увеличение фракции выброса было более выраженным у больных с меньшей фракцией выброса и после процедур, выполненных позже 5-х суток инфаркта (именно в те сроки, когда выполнялось введение клеток костного мозга в ASTAMI) [6]. Контингент больных в ASTAMI был более однородным. Согласно информации интернет-сайта theheart.org вице-президент программного комитета ААС по программе научных сессий G.Tomaselli признал, что оба испытания были хорошо проведены, но в ASTAMI использованы лучшие методы оценки функции левого желудочка [1]. Кроме того, он отметил, что «было трудно понять, какие клетки использованы и были ли они одинаковыми в обоих исследованиях». Но подобное замечание очевидно можно отнести к большинству испытаний так называемой «клеточной терапии». Свидетельство целесообразности срочной ангиопластики при безуспешной тромболитической терапии у больных с острым инфарктом миокарда: результаты исследования REACT Подготовил И.С.Явелов В ряде случаев тромболитическая терапия при остром инфаркте миокарда (ИМ) со стойкими подъемами сегмента ST на ЭКГ не приводит к восстановлению проходимости окклюзированной коронарной артерии. Тактика дальнейшего ведения таких больных еще не определена: в этой ситуации одни врачи предпочитают не предпринимать дальнейших попыток обеспечить реперфузию миокарда, другие верят в эффективность повторного введения фибринолитика, третьи стремятся как можно скорее выполнить “спасающее” (rescue) чрескожное коронарное вмешательство (ЧКВ) [ангиопластику или стентирование]. В пользу последнего, инвазивного подхода свидетельствуют результаты двух исследований, выполненные в середине 1990-х годов на небольшом количестве больных [1,2]. Современные рекомендации указывают на целесообразность ЧКВ в пределах 12 ч после безуспешной тромболитической терапии только при наличии угрожающих жизни осложнений, прежде всего тяжелой сердечной недостаточности (отек легких, кардиогенный шок) [3]. Необходимость срочного инвазивного вмешательства у более широкого круга больных, не имеющих свидетельств реканализации коронарной артерии после тромболитической терапии, остается неустановленной [3,4]. При этом одна из основных нерешенных проблем – отсутствие достаточно надежных неинвазивных способов выявления сохраняющейся окклюзии сосуда. Цель многоцентрового рандомизированного исследования Спасающая Ангиопластика против Консервативного Лечения или Повторного Тромболизиса (Rescue Angioplasty versus Conservative Treatment or Repeat Thrombolysis – REACT) состояла в сравнении трех указанных подходов к реперфузионному лечению острого ИМ со стойкими подъемами сегмента ST на ЭКГ у больных с неэффективной тромболитической терапией [5]. Материал и методы. В исследование включались больные 21-85 лет, получившие аспирин и разрешенный к применению фибринолитик в первые 6 ч после возникновения симптомов ИМ со стойкими подъемами сегмента ST на ЭКГ (более 0,1 мВ по крайней мере в двух смежных отведениях без учета V1). Критерием отсутствия реперфузии служило снижение сегмента ST <50% через 90±15 мин после начала тромболитической терапии в отведении с его максимальным исходным смещением вверх от изоэлектрической линии. Необходимым условием являлась также возможность выполнения “спасающего” ЧКВ в пределах 12 ч после начала болевого приступа. Не включали больных с блокадой левой ножки пучка Гиса, весом менее 65 кг, кардиогенным шоком, получивших низкомолекулярный гепарин в предшествующие 12 ч, а также тяжелым атеросклерозом сосудов нижних конечностей, который мог препятствовать пункции бедренной артерии. Было сформировано три группы больных. В группе повторной тромболитической терапии использовался фибрин-специфичный фибринолитик (алтеплаза или ретеплаза) в сочетании с внутривенной инфузией нефракционированного гепарина на протяжении как минимум 24 ч в дозе, достаточной для удлинения активированного частичного тромбопластинового времени в 1,5-2,5 раза выше контрольного. Для обеспечения сопоставимости, в группе консервативного лечения (без дальнейших попыток реперфузии) в первые 24 ч также вводился нефракционированный гепарин. В группе инвазивного лечения выполнялись коронарная ангиография и при наличии показаний (сниженный кровоток по коронарной артерии [<3 степени по критериям TIMI], остаточный стеноз >50%) ЧКВ. По решению врача могли устанавливаться стенты и вводиться блокаторы гликопротеина IIb/IIIa тромбоцитов. Инвазивное лечение было доступно больным и двух других групп, но только при сохранении боли в грудной клетке, возобновлении болевого синдрома в сочетании с повторными подъемами сегментов ST на ЭКГ, а также развитии кардиогенного шока. Исследование проводилось в 35 центрах Великобритании, в 19-ти из которых имелась условия для выполнения коронарной ангиографии. Набор больных осуществлялся на протяжении 5 лет (с 1999 по 2004 гг.) и был прекращен преждевременно из-за низкой скорости включения. Первичной конечной точкой являлась сумма случаев смерти, повторного ИМ, цереброваскулярных осложнений и тяжелой сердечной недостаточности на протяжении 6 мес. При включении в каждую их групп по 156 больных данное исследование должно было позволить с вероятностью 80% выявить снижение риска совокупности этих событий на 40%. В качестве вторичных конечных точек рассматривали отдельные компоненты первичной конечной точки, в также частоту кровотечений и реваскуляризации миокарда. Решение о наличии учитываемых событий выносили члены независимого комитета, не осведомленные о том, в какую из сравниваемых групп был рандомизирован пациент. Результаты. В группу консервативного лечения был рандомизирован 141 больной, в группу повторной тромболитической терапии 142 больных, в группу “спасающего” ЧКВ 144. По демографическим показателям, данным анамнеза, характеру развившегося ИМ и особенностям его лечения группы достоверно не различались. Средний возраст больных составил 61,1±11,0 лет, 79,2% были мужчинами, передняя локализация ИМ отмечена у 42,5%. Медиана времени от начала симптомов до введения первого фибринолитика составила 140 мин, времени “от двери до иглы” – 27 мин. Стрептокиназа использовалась в 59,5% случаев, ретеплаза в 26,5%, алтеплаза в 11,7%, тенектеплаза в 2,3%. В стационарах, не располагающих возможностью инвазивного лечения, в группу “спасающего” ЧКВ были рандомизированных 88 из 144 больных (61,1%). При этом медиана времени транспортировки в другое лечебное учреждение составляла 85 мин и в 25% случаев длительность транспортировки превышала 2 ч. Коронарная ангиография была выполнена у 128 человек, ЧКВ оказалась технически невыполнимой или безуспешной у 9, не нуждались в реваскуляризации 13. Стентированию подверглись 68,5% больных, блокатор гликопротеина IIb/IIIa тромбоцитов (абциксимаб) вводился у 43,4%. Медиана времени до введения проводника в область поражения коронарной артерии составляла 414 мин, медиана задержки до начала второго этапа реперфузионного лечения в группе “спасающего” ЧКВ в сравнении с группой повторной тромболитической терапии составила 84 мин (при учете времени от начала симптомов 4,6 ч и 3,2 ч соответственно). Частота клинических исходов за 6 мес наблюдения представлена в таблице. Таблица. Клинические исходы в первые 6 мес после включения в исследование REACT. Лечение Повторный тромбо- Консервативное “Спасающее” Р лизис (n=141) лечение (n=141) ЧКВ (n=144) Первичная конечная точка и ее составляющие Смерть (любая причина) 18 (12,7%) 18 (12,8%) 9 (6,2%) 0,12 Смерть (сердечная причина) 15 (10,6%) 14 (9,9%) 8 (5,6%) 0,26 Исход Повторный ИМ 15 (10,6%) 12 (8,5%) Цереброваскулярное 1 (0,7%) 1 (0,7%) осложнение Тяжелая сердечная 10 (7,0%) 11 (7,8%) недостаточность Сумма указанных событий 44 (31,0%) 42 (29,8%) Вторичные конечные точки Крупные кровотечения 7 (5) 5 (3) (в скобках число умерших) Мелкие кровотечения (в скобках в месте установки 10 (3) 8 (0) интродьюссера) Потеря крови без 34 33 выявленного источника Реваскуляризация миокарда 33 (23,2%) 29 (20,6%) Примечание: * р=0,05 при использовании теста log-rank. 3 (2,1) <0,01 3 (2,1%) 0,63 7 (4,9%) 0,58 22 (15,3) 0,003 4 (0) 0,65 33 (28) <0,001 19 0,12 19 (13,2%) 0,08* Совокупность неблагоприятных исходов (первичная конечная точка). При учете других факторов риска относительный риск совокупности неблагоприятных исходов в группе “спасающего” ЧКВ в сравнении с группой консервативного лечения составил 0,47 (95% границы доверительного интервала 0,28-0,79; р=0,004), в сравнении с группой повторной тромболитической терапии 0,43 (95% границы доверительного интервала 0,26-0,72; р=0,001). Заметных различий между больными, вошедшими в группы инвазивного лечения и повторного введения фибринолитика, не было (относительный риск 1,09, 95% границы доверительного интервала 0,71-1,67; р=0,69). В группе “спасающего” ЧКВ не было достоверных различий между больными, которые транспортировались в другое лечебное учреждение, и теми, кому вмешательство выполняли “на месте” (16,4 и 14,6% соответственно; р=0,8). Кроме того, по данным регрессионного анализа не было связи между временем выполнения ЧКВ и исходами заболевания. Несмотря на небольшое число наблюдений, частота неблагоприятных исходов у больных с безуспешным ЧКВ (5 из 9 или 55,6%) была достоверно выше, чем при эффективном вмешательстве (11,3%; р=0,007). Отдельные клинические события. При объединении результатов у больных из групп консервативного лечения и повторной тромболитической терапии, смертность в группе “спасающего” ЧКВ оказалась достоверно ниже (относительный риск 0,48, 95% границы доверительного интервала 0,23-0,99; р<0,05). При учете других факторов риска относительный риск смерти в группе “спасающего” ЧКВ составил 0,42 (95% границы доверительного интервала 0,19-0,94; р<0,04). Вместе в тем, следует учитывать, что данное исследование не предназначалось для оценки влияния лечения на смертность. В группе “спасающего” ЧКВ достоверно реже регистрировались повторные ИМ: относительный риск в сравнении с группой консервативного лечения составлял 0,33 (95% границы доверительного интервала 0,12-0,93; р=0,04), в сравнении с группой повторной тромболитической терапии 0,23 (95% границы доверительного интервала 0,09-0,62; р=0,004). В группе “спасающего” ЧКВ имелась тенденция к более редкому выполнению реваскуляризации миокарда в ближайшие 6 мес. Единственным достоверным различием по частоте кровотечений являлось более частое возникновение мелких геморрагий в месте пункции бедренной артерии в группе ЧКВ. Комментарий. Таким образом, результаты исследования REACT свидетельствуют об отсутствии пользы от повторного введения фибринолитика при безуспешной тромболитической терапии у больных ИМ с подъемами сегмента ST на ЭКГ, оцененной на основании определения степени смещения сегмента ST через 90 мин после начала тромболитической терапии. С другой стороны полученные факты указывают на целесообразность выполнения в этих случаях “спасающего” ЧКВ, по крайней мере, в условиях, когда есть возможность стентирования коронарных артерий и введения блокаторов гликопротеина IIb/IIIa тромбоцитов. При этом практически важно, что для реализации преимущества инвазивного подхода может быть оправдана достаточно длительная (до 2 ч и более) транспортировка больного в стационар с соответствующими возможностями. Однако следует учитывать, что тромболитическая терапия у изученных больных начиналась достаточно рано, а ЧКВ осуществлялось в пределах 12 ч после начала заболевания. Вместе с тем, нельзя не заметить, что показания для ЧКВ в проведенном исследовании были шире, чем устранение сохраняющейся окклюзии сосуда, и включали ангиографические признаки неполноценного кровотока по проходимой коронарной артерии, а также наличие остаточного стеноза. С учетом существенной задержки между выявлением неинвазивного свидетельства безуспешности тромболитической терапии и ЧКВ не исключено, что в этот период времени у части больных проходимость коронарной артерии восстановилась. Соответственно, в целом представляется, что предложенный подход больше соответствует концепции “помогающего” (facilitated) ЧКВ. Однако, как бы то ни было, число больных в исследовании REACT, прерванном досрочно, было небольшим и для определенного суждения о месте “спасающего” ЧКВ в лечении острого ИМ с подъемами сегмента ST на ЭКГ необходимы более крупные клинические испытания. Применение ингибиторов АХАТ не привело к желаемому результату. Испытание ACTIVATE и дальнейшие перспективы направления. 11[*] На протяжении многих лет считается, что потенциальным способом предупреждения атеросклероза является ингибирование образования в клетках эфиров холестерина (внутриклеточной эстерификации холестерина) из свободного холестерина [1, 212[†]]. Катализирует превращение внутриклеточного холестерина в эфиры холестерина фермент ацетил-коэнзим А холестерин ацилтрансфераза - АХАТ (acyl-coenzyme A: cholesterol acyltransferase - ACAT). Существуют две формы этого фермента - ACAT1 и ACAT2. ACAT1 обнаруживается повсеместно. Уровень экспрессии этой изоформы высок в макрофагах, надпочечниках, сальных железах и пенистых клетках из пораженных атеросклерозом участков сосудистой стенки. В противоположность этому экспрессия ACAT2 очевидно ограничена кишечником и печенью. Реакции, катализируемые ACAT, важны для абсорбции холестерина в кишечнике, синтеза и секреции липопротеинов, содержащих аполипопротеин В, и внутриклеточного отложения холестерина (создания внутриклеточных запасов холестерина). Поэтому ингибиторы АСАТ теоретически должны снижать уровень холестерина в плазме, блокируя абсорбцию холестерина, потребляемого с пищей, и уменьшая синтез липопротеинов очень низкой плотности в печени. Кроме того, ингибирование АСАТ может ограничивать накопление эфиров холестерина в цитоплазме макрофагов, уменьшая, таким образом, образование пенистых клеток. Роль изоформ АСАТ в атерогенезе устанавливалась при изучении животных, искусственно лишенных генов АСАТ1 и АСАТ2. Устранение АСАТ2 обычно было атеропротективным, тогда как устранение АСАТ1 давало неоднозначные результаты. В частности у мышей с врожденной гиперхолестеринемией дефицит АСАТ1 приводил к более выраженному атеросклерозу при том же уровне липидов в плазме. Возможным объяснением этому является накопление свободного холестерина в бляшках. В атеросклеротических поражениях (повреждениях), где макрофаги поглощают липопротеины, фрагменты клеток и капли липидов, способность эстерифицировать вновь захваченный холестерин важна для выживания клеток. Поэтому чрезмерное накопление холестерина, обусловленное ингибированием АСАТ1, может привести к нежелательным последствиям, связанным с дестабилизацией функции клеточных мембран, вплоть до гибели клеток. ACAT2 экспрессируется только в гепатоцитах и энтероцитах, где обеспечивает эфиры холестерина для транспорта в липопротеины. Эти два типа клеток имеют дополнительные механизмы удаления холестерина. Поэтому в них торможение ACAT2 не сопровождается нежелательными эффектами. Влияние ингибирования ACAT на прогрессирование коронарного атеросклероза. Препараты, достигшие стадии клинического изучения у человека, очевидно, являются неселективными ингибиторами АСАТ. Опыт проведенных исследований показал, что они не оправдали возлагавшихся на них ожиданий. В частности в ноябре 2005 года на научной сессии Американской Ассоциации Сердца сообщены результаты испытания ACTIVATE, в котором методом внутрисосудистой ультрасонографии изучались изменения выраженность атеросклероза коронарных артерий при применении ингибитора ацил-коэнзим А холестерин трансферазы [3-5]. Далее приводится перевод тезисов этого сообщения [4]. «Предпосылки. Фермент ацил-коэнзимА холестерин трансфераза (AХAT) отсетственнен за эстерификацию холестерина в различных тканях. В некоторых, хотя и не во всех, моделях на животных применение ингибиторов ACAT сопровождалось выраженными анти-атеросклеротическими эффектами. Методы. Мы выполнили внутрисосудистое ультразвуковое исследование у 408 больных с ангиографически документированной (подтвержденной) коронарной болезнью сердца. Все больные получали обычное лечение для вторичной профилактики, включая статины, когда они были показаны. Больные были в случайном порядке распределены к получению ингибитора AХAT пактимайба (100 мг/сут) или соответствующего ему плацебо. Ультрасонография была повторена через 18 месяцев, чтобы оценить (измерить) прогрессирование атеросклероза (рис. 1). Ингибирования ACAT и прогрессирование коронарного атеросклероза у человека Испытание ACTIVATE Внутрисосудистое ультразвуковое исследование. 408 больных. Ангиографически подтвержденная КБС. Обычное лечение для вторичной профилактики, включая статины, когда показаны). Рандомизация к ингибитору ACAT пактимайбу (100 мг/сут) или плацебо. Ультрасонография через 18 месяцев. Nissen SE, for the ACTIVATE Investigators, AHA Sci. Sessions, Nov. 2005 Результаты. Первичный параметр эффективности (изменение в процентном объеме атеромы) оказался одинаковым в группах лечения пактимайбом и плацебо: Скорость прогрессирования была соответственно 0.69% и 0.59% (p=0.77). Однако оба вторичные параметры эффективности продемонстрировали проатерогенный эффект лечения пактимайбом. Измерение нормализованного общего объема атеромы выявило регрессию в группе обычного лечения -5.6 mm3 (p=0.001 по сравнению с исходным) и отсутствие регрессии в группе пактимайба -1.3 mm3 (p=0.39 по сравнению с исходным). Значение р между группами было 0.035. Изменение объема атеромы в наиболее измененном подсегменте длиной 10 мм соответствовало регрессии в группе обычного лечения (-3.2 mm3) и достоверно и существенно меньшей регрессии в группе пактимайма (-1.3 мм3, p = 0.01). Общая частота неблагоприятных сердечнососудистых исходов в группах пактимайба и плацебо была близкой (p = 0.53). Заключение. Лечение ингибитором AХAT больных коронарной болезнью сопровождалось отсутствием благоприятного действия на первичный параметр эффективности (объем атеромы в процентах) и неблагоприятными изменениями двух основных вторичных показателей эффективности. Ингибирование AХAT не является эффективной стратегией для ограничения атеросклероза и может быть проатерогенным» (Рис. 2). Рис.2 Ингибирование ACAT и прогрессирование коронарного атеросклероза у человека Испытание ACTIVATE - результат Изменение параметра эффективности Процентный объем атеромы Общий объем атеромы Объем атеромы в наиболее измененном подсегменте длиной 10 мм Плацебо 0.69% Пактимайб (ингибитор ACAT) 0.59% прогрессирование прогрессирование -5.6 mm3, p=0.001 -1.3 mm3, p=0.39 регрессия -3.2 мм3 регрессия без изменений р 0.77 0.035 -1.3 мм3 меньшая регрессия 0.01 Заключение (приговор ?): «Ингибирование ACAT не является эффективной стратегией для ограничения атеросклероза и может быть проатерогенным». Steven E. Nissen, MD, for the ACTIVATE Investigators, AHA Sci. Sessions, Nov. 2005 Ранее близкие отрицательные результаты были получены в испытании A-PLUS при изучении с помощью внутрисосудистой ультрасонографии влияния на течение коронарного атеросклероза другого ингибитора АХАТ – авазимайба [5]. Причем в этом испытании ингибирование АХАТ сопровождалось повышением уровня холестерина липопротеинов низкой плотности (на 8-11% в зависимости от дозы авзимайба). Перспектива направления - о целесообразности избирательного ингибирования АХАТ2 (по L.L.Rudel и соавт. [2]) Действие изоформ АСАЕ представлено на рис 3 [2]. Рис. 3. Различные роли ACAT1 и ACAT2 в обмене холестерина в печени, энтероците, и макрофагах в артериальной стенке. Типы клеток с ACAT2 – энтероциты и гепатоциты, являющиеся клетками соответственно кишечника и печени, секретирующими липопротеины. Купферовские клетки печени и макрофаги артериальной стенки стенки артерии являются клетками «мусорщиками2, которые активно захватывают многие формы холестерина. Эти клетки экспрессируют ACAT1, функция которого заключается в поддержании уровня свободного холестерина, достаточного для функционирования мембран. Роль AХAT1 и AХAT2 АХАТ (АСАТ) – ацил коэнзим А холестерин ацилтрансфераза. FC – свободный холестерин ЛОНП ЛНП Энтероцит СЕН – холестерин эстер гидролаза (гидролаза эфиров холестерина) Ремнант ЛВП ЛНП и ЛОНП – липопротеины низкой и очень низкой плотности. Хиломикрон Просвет кишки Свободный холестерин FC СЕ – эфиры холестерина (эстерифицированный холестерин) Стенка артерии Макрофаг ЛВП – липопротеины высокой плтности Rudel LL et al, ATVB 2005; 25:1112 Функция ACAT2 заключается в эстерификации холестерина во время его абсобции в энтероцит. Холестерин транспортируется в клетку, где часть его эстерифицируется ACAT2, включается в хиломикроны и транспортируется в виде эфиров в организм человека. Обмен хиломикронов в кровотоке ведет к образованию остатков – ремнантов липопротеинов, которые содержат эфиры холестерина. Эти эфиры холестерина, в конце концов, поступают в гепатоциты в печени. Происходящий здесь гидролиз эфиров холестерина холестерин эстер гидролазой (гидролазой эфиров холестерина) приводит к образованию свободного холестерина. Этот свободный холестерин может подвергнуться реэстерификации под действием ACAT2. Образуемые эфиры холестерина могут включаться в липидные «капли»-запасы в цитоплазме (из которых может образовываться свободный холестерин) или инкорпорироваться в липопротеины вместе с апопротеином В во время образования («сборки») и секреции частиц липопротеинов очень низкой плотности (ЛОНП). Эфиры холестерина, секретированные в ЛОНП, или становятся частью эфиров холестерина в ЛНП (часть эфиров холестерина обеспечивается деятельностью фермента LCAT (ЛХАТ - лецитин холестерин ацил трансфераза), или потенциально могут быть удалены из плазмы возвращением в гепатоциты. Эфиры холестерина в ЛНП могут также переноситься между липопротеинами белком, переносящим (транспортирующим) эфиры холестерина (CEPT) или могут фильтроваться в ткани, такие как интима артерий, где они в конце концов захватываются макрофагами и гидролизируются в свободный холестерин. Свободный холестерин или выводится из клетки, или в ситуациях, когда холестерин присутствует в избытке, как это бывает во время развития атеросклероза, может ресинтезироваться ACAT1 и откладываться в липидных каплях. Процесс синтеза и гидролиза эфиров холестерина динамичен, и когда образовано много таких капель, макрофаги превращаются в то, что известно как пенистые клетки. Таким образом, ACAT1 играет ключевую роль в развитии раннего атеросклеротического повреждения, так как генерирует эфиры холестерина для пенистых клеток в ответ на наличие избытка холестерина внутри клетки. Холестерин, который выводится из клеток, таких как макрофаги, появляется в находящемся в кровотоке ЛВП, где он может быть эстерифицирован ферментом плазмы LCAT для окончательного возвращения эфиров холестерина в гепатоциты печени. Роль ACAT1 – поддерживать необходимый уровень свободного холестерина внутри клеток, предположительно в ответ на потребности функционирования мембран. Присутствие этого фермента представляется особенно важным в клетках «мусорщиках», так как осуществляя свою нормальную функцию эти клетки становятся перегруженными избыточными количествами холестерина. Ограничение роли ACAT1 в этих клетках может способствовать ухудшению их функционирования, приводящему к многим последствиям, не все из которых благоприятны (полезны). Интересно, что два типа клеток, которые обычно (нормально) обеспечивают даже большие потребности в переработке холестерина - энтероциты и гепатоциты экспрессируют другую форму фермента, эстерифицирующего холестерин - ACAT2. Функцией этого фермента является обеспечение эфиров холестерина для секреции в составе липопротеинов, так же как и образование запасов в цитоплазматических липидных каплях Именно селективное ингибирование ACAT2 может обеспечить полезное уменьшение наличия эфиров холестерина в плазме крови. Хорошее состояние здоровья мышей, не имеющих ACAT2 (с «выбитым» ACAT2) позволяет предполагать, что энтероциты и гепатоциты имеют достаточно обходных (других) путей для обмена холестерина, которые компенсируют отсутствие этого фермента. Такого не наблюдается у мышей с «выбитым» ACAT1. Представляется целесообразным идентифицировать селективные ингибиторы ACAT2 для лечения преждевременного коронарного атеросклероза. В отсутствие ACAT2 можно ожидать уменьшения атерогенности липопротеинов плазмы, в то время как большинство типов клеток в организме сохранят нормальное функционирование мембран, благодаря сохранению адекватно функционирующей ACAT1. Сердечно-сосудистые эффекты вторичного табачного дыма (пассивного курения) почти также велики, как и эффекты активного курения. Американская Ассоциация Сердца назвала 10 основных достижений или событий прошедшего года в изучении заболеваний сердца и инсульта [1]. Среди работ, вошедших в эту десятку – анализ исследований действия на сердечно-сосудистую систему вторичного табачного дыма, т.е. так называемого пассивного курения. Последнему в развитых странах придают важное значение, как серьезной угрозе здоровью некурящих. Результаты проведенного анализа опубликованы в журнале Circulation [2]. Приводим перевод резюме этой публикации и некоторые иллюстрации из неё. Предпосылки. Вторичный [табачный] дым увеличивает риск коронарной болезни сердца примерно на 30% (рис. 1 и 2). Этот эффект превосходит тот, который можно было бы ожидать, основываясь на риске, связанном с активным курением и относительными дозами табачного дыма, поступающего к курильщикам и некурящим. Методы и результаты. Мы выполнили обзор исследований, описывающих механистичсические эффекты вторичного [табачного] дыма (пассивного курения) на сердечнососудистую систему, сделав упор на работы, опубликованные после 1995 года. Мы сравнили эффекты вдыхания вторичного дыма и активного курения. Быстро накапливаются данные, что сердечно сосудистая система – тромбоциты, и функция эндотелия, жесткость артерий, атеросклероз, окислительный стресс, воспаление, вариабельность ритма сердца, метаболизм энергии, и увеличение размеров инфаркта – исключительно чувствительна к токсинам, содержащимся во вторичном дыме. Эффекты даже коротких периодов (от минут до часов) пассивного курения часто также велики, как эффекты хронического активного курения (в среднем составляя 80 до 90% от них). Заключение. Эффекты вторичного дыма существенны и быстры, и объясняют относительно высокий риск, который отмечался в эпидемиологических исследованиях. Рис.1 Эпидемиологические исследования связи вторичного [пассивного] курения и КБС Barnoya J, Glantz SA. Circulation 2005;111:2684 Рис.2 Связь вторичного [пассивного] курения и КБС Сердечно-сосудистые эффекты вторичного [пассивного] курения почти также велики как и [активного] курения Вторичное Активное курение (пассивное) курение Метаанализ Barnoya et al. 1.31 1.78 (1.21-1.41) (1.31-2.44 20 лет 1.57 Первые 4 года (1.08-2.28) 3.73 (1.32-10.98) Котинин в начале наблюдения (1.04-2.68) Котинин в начале наблюдения (0.87-12.64) 1.66 3.32 Эффект пассивное/ активное курение 40% 86% 122% Barnoya J, Glantz SA. Circulation 2005;111:2684 Таблица. Сравнение эффектов пассивного и активного курения*. Эффект Экспозиция Эффект Эффект вторичного дыма (курения) † активного курения‡ пассивного курения/Эффект активного курения, % § Риск заболевания сердца (95% ДИI) Данные, суммированные на рис.1 20 лет Первые 4 года Функция тромбоцитов Активирование тромбоцитов (индекс чувствительности к простациклину)# Отношение тромбоцитарных аргрегатов (изменение) Фибриноген, мг/дл (95% ДИ) Фибриноген, мг/дл (SE) Тромбоксан плазмы, пкг/мл Малоновый диальдегид плазмы , нмол/л на 109 тромбоцитов Функция эндотелия и артерий Число клеток эндотелия, среднее число безъядерных клеточных каркасов на камеру объемом 0.9-мкл (изменение) Резерв скорости коронарного кровотока, cm/s Дилатация, обусловленная изменением потока, % Жесткость аорты, мм рт.ст/мм ЛВП, мг/дл Увеличение толщины интимы-медии, мкм/3 года Маркеры воспаления, (95% ДИ) Лейкоциты, 103 на 1 мкл С-реактивный белок, мг/дл Гомоцистеин,мкмоль/л Окисленные ЛНП, мг/дл Антиоксиданты Витамин C, медиана (межквартильный интервал), мкмоль/л Гиповитаминоз (витамин C 23 мкм/л), % Отношение of DHAA к аскорбиновой кислоте Витамин C у детей (средний±SE), ммоль/л Бета-каротин (среднее±SE), мкмоль/л Бета-каротин, мкм/л Фолат эритроцитов, среднее уменьшение, нмоль/л (95% ДИ)†† 1.31 (1.21 - 1.41) 1.57 (1.08 - 2.28)¶ 3.73 (1.32 - 10.98) Хроническая 0.55±0.059 20 мин 0.54±0.069 96 -0.09 20 мин -0.15 60 5.2 (-1.2 - 12) 11.2±4.1 3.30±0.35 1.78 (1.31 - 2.44)║ Котинин при 1.66 включении (1.04 - 2.68) Котинин при 3.32 включении (0.87 - 12.64) Хроническая 6.9 (-0.9 до 14) Хроническая 18.1±6.7 Острая 2.93±0.07 40 86 122 75 62 113 4.2±0.17 Острая 3.9±0.07 108 0.9 20 мин 2.0 45 68.8±22.7 30 мин 67.1±15.0 91 3.1±2.7 ≥3 y 4.4±3.1 134 58 48.26±3.47 4 minutes Хроническая 49 45.59±4.6 110 73 5.9 Хроническая 14.3 41 Хроническая 0.6 (0.5 to 0.7) 100 Хроническая 0.1 (0.08 to 0.2) 80 Хроническая 0.5 (0.1 to 0.9) Хроническая 3.9 (1.4 to 7) 80 85 53 (41 to 79) Хроническая 40 (25 to 58) 57 12 Хроническая 24 50 10.3±7.00 6 мес 11.2±6.9 78 -8.8±1.5** Хроническая -9.0±2.3 98 0.129±0.022 0.15 -50 (-69 до -31) Хроническая Хроническая 0.6 (0.3 to 0.8) 0.08 (0.02 to 0.1) 0.4 (0.2 to 0.6) 3.3 (0.5 to 6) 0.155±0.021 0.17 -86 Хроническая (-101 до -71) 174 128 58 Примечания. * Данные представлены как среднее значение ± стандартное отклонение (если не указано другое). † Изменение показателя, связанное с пассивным курением некурящих (после минус до экспозиции к вторичному табачному дыму). ‡ Разница в показателе между курящими и некурящими (курильщик минус некурильщик) § Разница между эффектом пассивного курения деленная на эффект активного курения, умноженная на 100. ║ Риск смерти в возрасте 65 лет, при выкуривании 20 сигарет в сут. (по Law et al). ¶ Уровень котинина 2.8-14.0 нг/мл. ** Группа с высокой дозой вторичного дыма. †† Высокая экспозиция к вторичному табачному дыму. Необходимо помнить, что пассивное курение оказывает влияние не только на риск возникновения коронарной болезни сердца. Следствия повреждающих здоровье эффектов вторичного или пассивного курения представлены на рис. 3. Рисунок составлен на основании доклада Национального Института Рака США Влияние экспозиции к табачному дыму окружающей среды на здоровье (1999) [3]. Особенно неблагоприятное действие пассивное курение оказывает на детей. Рис. 3. Ежегодные заболеваемость и смертность некурящих в США, связанные с воздействием загрязнения среды табачным дымом (“пассивным курением”) Состояния События Влияние на развитие Низкий вес при рождении Синдром внезапной детской смерти) 9,700 - 18,600 случаев 1,900 - 2,700 смертей Респираторные эффекты у детей Инфекции среднего уха 0.7-1.6 млн посещений врачей Провокация астмы Обострения астмы 8,000 to 26,000 новых случаев 400,000 to 1,000,000 детей Бронхиты и пневмонии в возрасте до 18 месяцев 150,000 to 300,000 случаев 7,500 to 15,000 госпитализаций 136 - 212 смертей Рак легких Сердечно-сосудистые эффекты Ишемическая болезнь сердца 3,000 смертей 35,000 - 62,000 смертей “Health Effects of Exposure to Enviromental Tobacco Smoke” (ETS), Национальный Институт Рака США, 1999 Первое сообщение о том, что по данным наблюдения большой группы населения частота острых цереброваскулярных событий превысила частоту острых коронарных событий. Оксфордское Сосудистое Исследование (Oxford Vascular Study)13[*]. В ноябре 2005 года в журнале Ланцет опубликованы промежуточные результаты проводимого в настоящее время Оксфордского Сосудистого Исследования (Oxford Vascular Study) - Исследования частоты возникновения всех сосудистых событий во всех артериальных территориях и смертности при них [1]. Ниже приводится перевод резюме этой публикации. «Предпосылки. В основе острых коронарных, цереброваскулярных, и периферичеких сосудистых событий лежат общие патологические изменения артерий и факторы риска, их превентивное лечение одинаково, но они редко изучаются одновременно. В Оксфордском Сосудистом Исследовании мы определили сравнительную эпидемиологию различных острых сосудистых синдромов, распространенность этих синдромов в настоящем, и потенциальный эффект старения населения на их частоту в будущем. Методы. Мы выполнили проспективную оценку всех людей, у которых произошло острое сосудистое событие любого типа в любой артериальной территории независимо от возраста, в группе населения из 91106 человек в Оксфордшире, Соединенное Королевство, в 2002-2005 гг. Результаты. Острые сосудистые события (n=1657) произошли у 1657 человек: 918 (45%) цереброваскулярных (618 инсультов, 300 преходящих ишемических атак [ПИА]); 856 (42%) коронарных (159 инфарктов миокарда с подъемами ST, 316 инфарктов миокарда без подъемов ST, 218 случаев нестабильной стенокардии, 163 случая внезапной сердечной смерти); 188 (9%) периферических (43 аортальных, 53 случая эмболической ишемии внутренних органов или конечностей, 92 - критической ишемии конечностей); и 62 не классифицированные смерти. Относительные частоты возникновения цереброваскулярных событий в сравнении с коронарными были 1·19 (95% CI 1.06–1.33) для всех событий; 1.40 (1.23–1.59) для событий, не закончившихся смертью (нефатальных); и 1.21 (1.04–1.41) после исключения еще и ПИА и нестабильной стенокардии. Число событий и частоты их возникновения круто возрастали с возрастом во всех артериальных территориях. У 12 886 (14%) человек в возрасте 65 лет или старше возникло 735 (80%) цереброваскулярных, 623 (73%) коронарных, и 147 (78%) периферических сосудистых событий. У 5919 (6%) человек в возрасте 75 лет или старше возникло соответственно 503 (54%), 402 (47%), и 105 (56%), событий. Хотя с увеличением возраста частоты смерти при возникших событиях (case-fatality rates) увеличивались, 736 (47%) of 1561 нефатальных событий произошли в возрасте 75 лет и старше» Рис. 1. Все события Первые события 5 4 3,36 3,13 3 2,27 2 Периферические Коронарные 0,52 Цереброваскулярные Периферические Коронарные 0 1,91 0,69 1 Цереброваскулярные Частота сосудистых событий на 1000 чел в год Частоты острых сосудистых событий в OXVASC Rothwell PM et al, for the Oxford Vascular Study. Lancet 2005; 366: 1773 Рис. 2. OXVASC. Частоты сосудистых событий и возраст Инсульты ИМ+внезапная смерть Острые периферические сосудистые события Частоты на 1000 населения в год Все события Мужчины Первые события Женщины Возраст Годы Rothwell PM et al, for the Oxford Vascular Study. Lancet 2005; 366: 1773 Интерпретация. Высокие частоты острых сосудистых событий вне коронарной сосудистой территории и крутой подъем частоты событий с возрастом во всех территориях должны учитываться в стратегиях профилактики, в планах клинических исследований, и при направлении средств на обеспечение помощью и поддержку исследований». Очередное указание на неэффективность антибиотиков в профилактике осложнений коронарной болезни сердца. Результаты испытания CLARICOR К теперь уже многочисленным неудачным попыткам предупреждения осложнений коронарной болезни сердца (КБС) с помощью антимикробной терапии, направленной против Chlamydia Pneumonia, добавилась еще одна. В Британском Медицинском Журнале только что опубликовано сообщение о том, что краткосрочное профилактическое применение активного антибиотика-макролида кларитромицина у больных стабильной КБС не только не привело к достижению основной цели, но и сопровождалось увеличением смертности от всех причин [1]. Далее приводится перевод резюме этого сообщения. «Цель. Выснить, влияет ли макролид кларитромицин на смертность и сердечнососудистые осложнения у больных со стабильной коронарной болезнью сердца. План. Многоцентровое испытание с централизованной рандомизацией. Все участвующие стороны (all parties) на всех стадиях были «ослеплены». Анализы выполнялись «по намерению лечить». Места проведения. Пять университетских кардиологических отделений в Копенгагене и координирующий центр. Участники. 13702 больным в возрасте 18-85 лет, у которых диагнозом при выписке в 1993-1999 годах были инфаркт миокарда или стенокардия, и которые были живы в августе 1999 года, были посланы письма-приглашения; 4373 из них были рандомизированы. Вмешательство. Применение в течение 2 недель кларитромицина в дозе 500 мг/сут или плацебо. Основные оценки исхода (результата). Первичный исход: сумма смертности от всех причин, инфарктов миокарда, или нестабильной стенокардии за 3 года наблюдения. Вторичный исход: сумма сердечно-сосудистой смертности, инфарктов миокарда или случаев нестабильной стенокардии. Сведения об исходах были получены из Датских х [национальных]регистров и были вслепую оценены комитетов по событиям. Результаты (табл. 1 и 2). К кларитромицину были рандомизированы 2172, к плацебо – 2201 участников. Мы не обнаружили достоверного влияния кларитромицина на первичный (отношение рисков 1.15, 95% доверительный интервал 0.99-1.34) или вторичный исход 1.17Ж 0.98-1.40). Смертность была достоверно выше в группе кларитромицина (1.27, 1.03-1.54, р=0.03), как следствие достоверно более высокой сердечнососудистой смертности (1.45, 1.09-1.92, р=0.01). Заключение. Кратковременное применение кларитромицина у больных со стабильной коронарной болезнью сердца может обусловливать более высокую сердечнососудистую смертность. Следует изучить длительную безопасность кларитромицина у больных со стабильной ишемической болезнью сердца». Таблица 1. Основные оценки исходов в группах вмешательства согласно рандомизации КларитроОтношение Плацебо* Оценка исходов мицин* рисков P (n=2200) (n=2172) (95% ДИ) Первичная: смерти от всех причин, инфаркты 1.15 344 (15.8) 307 (13.8) 0.08 миокарда/ нестабильная стенокардия (0.99- 1.34) Вторичная: сердечно-сосудистая смертность, 1.17 249 (11.5) 218 (9.9) 0.09 инфаркты миокарда/нестабильная стенокардия (0.98 - 1.40) Третичная: сердечно-сосудистая смертность, инфаркты миокарда/ нестабильная 1.20 351 (16.2) 303 (13.7) 0.03 стенокардия, инсульты, заболевание (1.02 - 1.39) периферических сосудов Примечание. Основано на регрессионной модели Кокса, включающей в качестве обязательных переменных пол, перенесенный инфаркт миокарда, и возраст. * Число больных (%). ДИ – доверительный интервал. Таблица 2. Смертность в соответствии с группой рандомизации Кларитромицин Плацебо Отношение рисков Смертность (n=2172) (n=2200) (95% ДИ) Сердечнососудистая 111 (5.1) 78 (3.5) 1.45 (1.09 to 1.92) Несердечнососудистая 85 (3.9) 84 (3.8) 1.03 (0.76 to 1.41) Не классифицированная 16 (0.7) 10 (0.5) 1.64 (0.75 to 2.11) От всех причин 212 (9.8) 172 (7.8) 1.27 (1.03 to 1.54) Примечание. Основано на регрессионной модели Кокса, включающей в качестве обязательных переменных пол, перенесенный инфаркт миокарда, и возраст. *Число больных (%). ДИ – доверительный интервал. p 0.01 0.82 0.22 0.03 Некоторые другие сведения из публикации. Из общественных регистров были получены сведения о всех исходах, и наблюдение было осуществлено более чем за 99% 99% больных. Потенциальная слабость испытания включает в себя тот факт, что только 32% от соответствовавших критериям включения больныхбыли дествительно рандомизированы. Кроме того, не известно, какими были образ жизни и лечение больных во время наблюдения. Тем не менее, мало вероятно, что эти факторы существенно различались между группами. Среди больных, получавших кларитромицин, было больше курящих, но многофакторный анализ, в котором были учтены как курение, так и другие исходные характеристики, не внес существенного изменения в результаты. Из обсуждения. Почему кларитромицин мог оказать неблагоприятное действие у больных коронарной болезнью сердца, не ясно. Макролиды обладают свойствами блокаторов калиевых каналов, которое может обусловливать удлинение интервала QT, тахикардию типа torsades de pointes и приводить к смерти. Риск увеличивается при одновременном применении макролидов и лекарств, обмен которых осуществляется изоэнзимом 3А цитохрома Р450. Различий в сердечнососудистой смертности во время первого месяца не отмечено. По мнению авторов, взаимодействие лекарств не может объяснить разницы в сердечнососудистой смертности, выявленной при длительном наблюдении. В качестве заключения приводим фразу, завершающую комментарий J.Danesh к результатам той части испытания PROVE-It, в которой оценивалась эффективность антибиотика гатифлоксацина у больных, недавно перенесших острый коронарный синдром [2]. «Данные рандомизированных испытаний показывают, что отсутствуют оправдания использования лечения антихламидийными антибиотиками с целью предупреждения сердечнососудистого заболевания, а накапливающиеся данные из проспективных сероэпидемиологических исследований не поддерживают идеи, согласно которой хроническая инфекция C pneumoniae является важной (основной – major) причиной коронарной болезни сердца». Полученные в CLARICOR результаты делают целесообразным изучение отдаленных последствий применения кларитромицина у больных КБС по любым показаниям. Применение клеток костного мозга у больных острым передним инфарктом миокарда, подвергнутых стентированию в остром периоде заболевания, оказалось бесполезным. Результаты испытания ASTAMI. «… результаты действуют отрезвляюще» J.Willerson14[*] На сессии Американской Ассоциации Сердца 2005 года доложены результаты испытания эффективности стволовых клеток у больных передним инфарктом миокарда [1,2]. Испытание проведено в 2 лечебных учреждениях Осло (Норвегия) с сентября 2003 по май 2005 года. Включен 101 больной с первым острым передним инфарктом миокарда и выраженными нарушениями движений стенки левого желудочка по данным эхокардиографии. У всех больных в пределах 2-12 часов после появления симптомов было выполнено стентирование стеноза-«виновника» в проксимальной или средней трети левой передней нисходящей коронарной артерии. К интракоронарному введению аутологичных мононуклеарных клеток костного мозга рандомизированы 52, только к обычному лечению – 49 больных [3, 4]. На 4-7 сутки из гребешка тазовой кости забирали 50 мл костного мозга. Мононуклеарные клетки получали центрифугированием на Lymphoprep. Примерно 10 мл суспензии этих клеток вводили в переднюю нисходящую артерию на 5-8 сутки заболевания [3]. Для оценки функции левого желудочка в исходном состоянии и через 6 месяцев после инфаркта миокарда применены три метода: SPECT (однофотонная эмиссионная компьютерная томография), эхокардиография, и магнитный резонанс (получение изображения с помощью магнитного резонанса). Результаты. Ни один из примененных методов не выявил достоверных различий между группами (таблица). Только по данным магнитного резонанса отмечена тенденция к лучшей фракции выброса, но в контрольной группе [1]. Таблица. Результаты ASTAMI [1] Метод и оценка Стволовые Контроль клетки p Однофотонная эмиссионная компьютерная томография Изменение фракции выброса (%) Изменение конечного диастолического объема (мл) Изменение размера инфаркта (%) 8.1 -11.2 -11.0 7.0 -1.8 -7.8 0.63 0.11 0.14 1.2 -6.9 -0.7 4.3 -2.7 -2.6 0.05 0.50 0.09 3.1 8.9 2.1 10.8 0.54 0.74 Магнитно-резонансная томография Изменение фракции выброса (%) Изменение конечного диастолического объема (мл) Изменение размера инфаркта (%) Эхокардиография Изменение фракции выброса (%) Изменение конечного диастолического объема (мл) На той же сессии Американской Ассоциации Сердца были доложены результаты многоцентрового рандомизированного плацебо контролированного испытания REPAIRAMI, в котором аутологичные клетки костного мозга вводились внутрикоронарно на 3-6 сутки инфаркта миокарда практически таким же образом, как и в ASTAMI [5, 6]. В REPAIR-AMI включались все больные инфарктом миокарда (т=204), независимо от локализации, подвергнутые в остром периоде первичному чрескожному коронарному вмешательству с имплантацией стента. Для оценки результата применялась рентгеноконтрастная вентрикулография. Первичной конечной точкой испытания было абсолютное изменение фракции выброса левого желудочка за 4 месяца. Это изменение оказалось большим (+5.5%) в группе вмешательства, чем в группе плацебо (+3%). При анализе подгрупп оказалось, что увеличение фракции выброса было более выраженным у больных с меньшей фракцией выброса и после процедур, выполненных позже 5-х суток инфаркта (именно в те сроки, когда выполнялось введение клеток костного мозга в ASTAMI) [6]. Контингент больных в ASTAMI был более однородным. Согласно информации интернет-сайта theheart.org вице-президент программного комитета ААС по программе научных сессий G.Tomaselli признал, что оба испытания были хорошо проведены, но в ASTAMI использованы лучшие методы оценки функции левого желудочка [1]. Кроме того, он отметил, что «было трудно понять, какие клетки использованы и были ли они одинаковыми в обоих исследованиях». Но подобное замечание очевидно можно отнести к большинству испытаний так называемой «клеточной терапии». Свидетельство целесообразности срочной ангиопластики при безуспешной тромболитической терапии у больных с острым инфарктом миокарда: результаты исследования REACT Подготовил И.С.Явелов В ряде случаев тромболитическая терапия при остром инфаркте миокарда (ИМ) со стойкими подъемами сегмента ST на ЭКГ не приводит к восстановлению проходимости окклюзированной коронарной артерии. Тактика дальнейшего ведения таких больных еще не определена: в этой ситуации одни врачи предпочитают не предпринимать дальнейших попыток обеспечить реперфузию миокарда, другие верят в эффективность повторного введения фибринолитика, третьи стремятся как можно скорее выполнить “спасающее” (rescue) чрескожное коронарное вмешательство (ЧКВ) [ангиопластику или стентирование]. В пользу последнего, инвазивного подхода свидетельствуют результаты двух исследований, выполненные в середине 1990-х годов на небольшом количестве больных [1,2]. Современные рекомендации указывают на целесообразность ЧКВ в пределах 12 ч после безуспешной тромболитической терапии только при наличии угрожающих жизни осложнений, прежде всего тяжелой сердечной недостаточности (отек легких, кардиогенный шок) [3]. Необходимость срочного инвазивного вмешательства у более широкого круга больных, не имеющих свидетельств реканализации коронарной артерии после тромболитической терапии, остается неустановленной [3,4]. При этом одна из основных нерешенных проблем – отсутствие достаточно надежных неинвазивных способов выявления сохраняющейся окклюзии сосуда. Цель многоцентрового рандомизированного исследования Спасающая Ангиопластика против Консервативного Лечения или Повторного Тромболизиса (Rescue Angioplasty versus Conservative Treatment or Repeat Thrombolysis – REACT) состояла в сравнении трех указанных подходов к реперфузионному лечению острого ИМ со стойкими подъемами сегмента ST на ЭКГ у больных с неэффективной тромболитической терапией [5]. Материал и методы. В исследование включались больные 21-85 лет, получившие аспирин и разрешенный к применению фибринолитик в первые 6 ч после возникновения симптомов ИМ со стойкими подъемами сегмента ST на ЭКГ (более 0,1 мВ по крайней мере в двух смежных отведениях без учета V1). Критерием отсутствия реперфузии служило снижение сегмента ST <50% через 90±15 мин после начала тромболитической терапии в отведении с его максимальным исходным смещением вверх от изоэлектрической линии. Необходимым условием являлась также возможность выполнения “спасающего” ЧКВ в пределах 12 ч после начала болевого приступа. Не включали больных с блокадой левой ножки пучка Гиса, весом менее 65 кг, кардиогенным шоком, получивших низкомолекулярный гепарин в предшествующие 12 ч, а также тяжелым атеросклерозом сосудов нижних конечностей, который мог препятствовать пункции бедренной артерии. Было сформировано три группы больных. В группе повторной тромболитической терапии использовался фибрин-специфичный фибринолитик (алтеплаза или ретеплаза) в сочетании с внутривенной инфузией нефракционированного гепарина на протяжении как минимум 24 ч в дозе, достаточной для удлинения активированного частичного тромбопластинового времени в 1,5-2,5 раза выше контрольного. Для обеспечения сопоставимости, в группе консервативного лечения (без дальнейших попыток реперфузии) в первые 24 ч также вводился нефракционированный гепарин. В группе инвазивного лечения выполнялись коронарная ангиография и при наличии показаний (сниженный кровоток по коронарной артерии [<3 степени по критериям TIMI], остаточный стеноз >50%) ЧКВ. По решению врача могли устанавливаться стенты и вводиться блокаторы гликопротеина IIb/IIIa тромбоцитов. Инвазивное лечение было доступно больным и двух других групп, но только при сохранении боли в грудной клетке, возобновлении болевого синдрома в сочетании с повторными подъемами сегментов ST на ЭКГ, а также развитии кардиогенного шока. Исследование проводилось в 35 центрах Великобритании, в 19-ти из которых имелась условия для выполнения коронарной ангиографии. Набор больных осуществлялся на протяжении 5 лет (с 1999 по 2004 гг.) и был прекращен преждевременно из-за низкой скорости включения. Первичной конечной точкой являлась сумма случаев смерти, повторного ИМ, цереброваскулярных осложнений и тяжелой сердечной недостаточности на протяжении 6 мес. При включении в каждую их групп по 156 больных данное исследование должно было позволить с вероятностью 80% выявить снижение риска совокупности этих событий на 40%. В качестве вторичных конечных точек рассматривали отдельные компоненты первичной конечной точки, в также частоту кровотечений и реваскуляризации миокарда. Решение о наличии учитываемых событий выносили члены независимого комитета, не осведомленные о том, в какую из сравниваемых групп был рандомизирован пациент. Результаты. В группу консервативного лечения был рандомизирован 141 больной, в группу повторной тромболитической терапии 142 больных, в группу “спасающего” ЧКВ 144. По демографическим показателям, данным анамнеза, характеру развившегося ИМ и особенностям его лечения группы достоверно не различались. Средний возраст больных составил 61,1±11,0 лет, 79,2% были мужчинами, передняя локализация ИМ отмечена у 42,5%. Медиана времени от начала симптомов до введения первого фибринолитика составила 140 мин, времени “от двери до иглы” – 27 мин. Стрептокиназа использовалась в 59,5% случаев, ретеплаза в 26,5%, алтеплаза в 11,7%, тенектеплаза в 2,3%. В стационарах, не располагающих возможностью инвазивного лечения, в группу “спасающего” ЧКВ были рандомизированных 88 из 144 больных (61,1%). При этом медиана времени транспортировки в другое лечебное учреждение составляла 85 мин и в 25% случаев длительность транспортировки превышала 2 ч. Коронарная ангиография была выполнена у 128 человек, ЧКВ оказалась технически невыполнимой или безуспешной у 9, не нуждались в реваскуляризации 13. Стентированию подверглись 68,5% больных, блокатор гликопротеина IIb/IIIa тромбоцитов (абциксимаб) вводился у 43,4%. Медиана времени до введения проводника в область поражения коронарной артерии составляла 414 мин, медиана задержки до начала второго этапа реперфузионного лечения в группе “спасающего” ЧКВ в сравнении с группой повторной тромболитической терапии составила 84 мин (при учете времени от начала симптомов 4,6 ч и 3,2 ч соответственно). Частота клинических исходов за 6 мес наблюдения представлена в таблице. Таблица. Клинические исходы в первые 6 мес после включения в исследование REACT. Лечение Исход Повторный тромбо- Консервативное “Спасающее” лизис (n=141) лечение (n=141) ЧКВ (n=144) Первичная конечная точка и ее составляющие Смерть (любая причина) 18 (12,7%) 18 (12,8%) 9 (6,2%) Смерть (сердечная причина) 15 (10,6%) 14 (9,9%) 8 (5,6%) Повторный ИМ 15 (10,6%) 12 (8,5%) 3 (2,1) Цереброваскулярное 1 (0,7%) 1 (0,7%) 3 (2,1%) осложнение Тяжелая сердечная 10 (7,0%) 11 (7,8%) 7 (4,9%) недостаточность Сумма указанных событий 44 (31,0%) 42 (29,8%) 22 (15,3) Вторичные конечные точки Крупные кровотечения 7 (5) 5 (3) 4 (0) (в скобках число умерших) Мелкие кровотечения (в скобках в месте установки 10 (3) 8 (0) 33 (28) интродьюссера) Потеря крови без 34 33 19 выявленного источника Реваскуляризация миокарда 33 (23,2%) 29 (20,6%) 19 (13,2%) Примечание: * р=0,05 при использовании теста log-rank. Р 0,12 0,26 <0,01 0,63 0,58 0,003 0,65 <0,001 0,12 0,08* Совокупность неблагоприятных исходов (первичная конечная точка). При учете других факторов риска относительный риск совокупности неблагоприятных исходов в группе “спасающего” ЧКВ в сравнении с группой консервативного лечения составил 0,47 (95% границы доверительного интервала 0,28-0,79; р=0,004), в сравнении с группой повторной тромболитической терапии 0,43 (95% границы доверительного интервала 0,26-0,72; р=0,001). Заметных различий между больными, вошедшими в группы инвазивного лечения и повторного введения фибринолитика, не было (относительный риск 1,09, 95% границы доверительного интервала 0,71-1,67; р=0,69). В группе “спасающего” ЧКВ не было достоверных различий между больными, которые транспортировались в другое лечебное учреждение, и теми, кому вмешательство выполняли “на месте” (16,4 и 14,6% соответственно; р=0,8). Кроме того, по данным регрессионного анализа не было связи между временем выполнения ЧКВ и исходами заболевания. Несмотря на небольшое число наблюдений, частота неблагоприятных исходов у больных с безуспешным ЧКВ (5 из 9 или 55,6%) была достоверно выше, чем при эффективном вмешательстве (11,3%; р=0,007). Отдельные клинические события. При объединении результатов у больных из групп консервативного лечения и повторной тромболитической терапии, смертность в группе “спасающего” ЧКВ оказалась достоверно ниже (относительный риск 0,48, 95% границы доверительного интервала 0,23-0,99; р<0,05). При учете других факторов риска относительный риск смерти в группе “спасающего” ЧКВ составил 0,42 (95% границы доверительного интервала 0,19-0,94; р<0,04). Вместе в тем, следует учитывать, что данное исследование не предназначалось для оценки влияния лечения на смертность. В группе “спасающего” ЧКВ достоверно реже регистрировались повторные ИМ: относительный риск в сравнении с группой консервативного лечения составлял 0,33 (95% границы доверительного интервала 0,12-0,93; р=0,04), в сравнении с группой повторной тромболитической терапии 0,23 (95% границы доверительного интервала 0,09-0,62; р=0,004). В группе “спасающего” ЧКВ имелась тенденция к более редкому выполнению реваскуляризации миокарда в ближайшие 6 мес. Единственным достоверным различием по частоте кровотечений являлось более частое возникновение мелких геморрагий в месте пункции бедренной артерии в группе ЧКВ. Комментарий. Таким образом, результаты исследования REACT свидетельствуют об отсутствии пользы от повторного введения фибринолитика при безуспешной тромболитической терапии у больных ИМ с подъемами сегмента ST на ЭКГ, оцененной на основании определения степени смещения сегмента ST через 90 мин после начала тромболитической терапии. С другой стороны полученные факты указывают на целесообразность выполнения в этих случаях “спасающего” ЧКВ, по крайней мере, в условиях, когда есть возможность стентирования коронарных артерий и введения блокаторов гликопротеина IIb/IIIa тромбоцитов. При этом практически важно, что для реализации преимущества инвазивного подхода может быть оправдана достаточно длительная (до 2 ч и более) транспортировка больного в стационар с соответствующими возможностями. Однако следует учитывать, что тромболитическая терапия у изученных больных начиналась достаточно рано, а ЧКВ осуществлялось в пределах 12 ч после начала заболевания. Вместе с тем, нельзя не заметить, что показания для ЧКВ в проведенном исследовании были шире, чем устранение сохраняющейся окклюзии сосуда, и включали ангиографические признаки неполноценного кровотока по проходимой коронарной артерии, а также наличие остаточного стеноза. С учетом существенной задержки между выявлением неинвазивного свидетельства безуспешности тромболитической терапии и ЧКВ не исключено, что в этот период времени у части больных проходимость коронарной артерии восстановилась. Соответственно, в целом представляется, что предложенный подход больше соответствует концепции “помогающего” (facilitated) ЧКВ. Однако, как бы то ни было, число больных в исследовании REACT, прерванном досрочно, было небольшим и для определенного суждения о месте “спасающего” ЧКВ в лечении острого ИМ с подъемами сегмента ST на ЭКГ необходимы более крупные клинические испытания. Статины и риск рака. Метаанализ рандомизированных контролированных испытаний статинов показал, что их применение в этих испытаниях не ассоциировалось ни с увеличением, ни с уменьшением риска возникновения злокачественных опухолей и смерти от них. Еще на начальном этапе внедрения статинов в клиническую практику высказывались два противоположных предположения: что эти средства могут способствовать возникновению злокачественных опухолей, и что они обладают противоопухолевым действием [1]. Первое предположение было частично опровергнуто данными крупных рандомизированных испытаний. Частично, потому, что, с одной стороны, в отдельных испытаниях все же было отмечено увеличение частоты возникновения опухолей среди участников, рандомизированных к приему статина15[*], с другой – длительность испытаний могла оказаться недостаточной для проявления возможного канцерогенного эффекта статинов. Правильность второго предположения находила подтверждение в экспериментальных данных и сведениях, полученных в обсервационных исследованиях. В журнале Американской Медицинской Ассоциации (JAMA) только что опубликованы результаты метаанализа рандомизированных контролированных испытаний статинов, которые продемонстрировали нейтральность этих средств по отношению к развитию злокачественных опухолей [2]. Приводим перевод резюме этой публикации. «Контекст. Статины – снижающие холестерин лекарства, которые, как это было доказано в рандомизированных контролированных испытаниях, предупреждают сердечные события. Недавно выполненные ретроспективные анализы предположили [дали основание предположить], что статины предупреждают также и рак. Цели. Исследовать влияние терапии статинами на частоту возникновения рака и частоту случаев смерти от рака, проанализировать действие статинов на специфические виды рака, а также оценить эффект липофильности статина и его происхождения. Источники данных. Был выполнен систематический поиск литературы с использованием специфических поисковых терминов в MEDLINE, EMBASE, CINAHL, Web of Science, CANCERLIT, и в Кохрановской базе данных систематических обзоров по июль 2005 года. Выполнен также обзор кардиологических и онкологических тезисов и ручной обзор литературных ссылок, [содержащихся в статьях]. Отбор исследований. Двадцать семь из первично идентифицированных 8943 статей (86936 участников) соответствовали критериям включения. Это были сообщения о 26 рандомизированных испытаниях статинов со средней продолжительностью наблюдения не меньше года, в которые было минимально включено 100 больных, и которые содержали данные или о частоте возникновения рака (20 исследований) или случаях смерти от рака (22 исследования). Экстрагирование данных. Все данные были экстрагированы независимо 3 исследователями, использовавшими стандартизованный метод извлечения данных. Взвешенные средние были выражены как отношения рисков (шансов) (ОР) с 95% доверительными интервалами (ДИ). Для этого была использована модель случайных эффектов (методы DerSimonian и Laird). Оценки статистической гетерогенности были получены с помощью Q-статистики. Синтез данных. Согласно мета-анализу, включившему 6662 случая возникновения рака и 2407 смерти от рака, статины не уменьшили ни частоту возникновения рака (OР 1.02; 95%ДИ 0.97-1.07), ни частоту смерти от рака (95%ДИ 1.01; 95% CI, 0.93-1.09). Не было отмечено уменьшения никакого индивидуального типа рака. Этот нулевое влияние на возникновение рака сохранялось, если оценивались только гидрофильные, липофильные статины, статины естественного происхождения или синтетические. Выводы. В рандомизированных контролированных испытаниях действие статинов на риск рака и смерти от рака было нейтральным. Мы установили, что никакой тип рака не был подвержен влиянию применения статинов и никой подтип статина не оказывал влияния на риск рака». Возникновение рака в контролированных рандомизированных испытаниях статинов. Метаанализ. Отношения шансов (95% ДИ) Риск выше на статине Dale RM et al, JAMA 2006; 295: 74-80 Смерти от рака в контролированных рандомизированных испытаниях статинов. Метаанализ. Отношения шансов (95% ДИ) Риск выше на статине Dale RM et al, JAMA 2006; 295: 74-80 Статины и риск различной локализации. N испытаний Группа статина Группа контроля Молочная железа 5 81/16875 64/16901 Простата 3 305/10037 311/10026 6 400/23031 394/23032 4 158/13984 162/13988 7 409/30632 438/30641 5 68/13168 Локализация, тип рака Желудочнокишечный Толстая кишка Дыхательная система Меланома Dale RM et al, JAMA 2006; 295: 74-80 80/13156 Отношение шансов (95% ДИ) 1.33 (0.79-2.26) 0.98 (0.83-1.15) 1.01 (0.82-1.24) 0.95 (0.73-1.25) 0.94 (0.82-1.07) 0.84 (0.57-1.25) P (Q статистика) .047 .94 .14 .24 .53 .30 Статины и рак. Метаанализ Включенные испытания, применявшиеся в них препараты и дозы. n Характеристика Статин Доза Длительность, годы Rрандомизированное DB двойное слепое PC – плацебо контролированное OL – открытое Dale RM et al, JAMA 2006; 295: 74-80 Статины и риск рака, комментарий к метаанализу Метаанализ Dale и соавт. (янв. 2006), продемонстрировавший «нейтральный эффект статинов на риск рака и смерти от рака в рандомизированных контролированных испытаниях» не содержит ни данных из исследований с выраженным снижением (с очень низким достигнутым) ХСЛНП*, ни, тем более, данных о розувастатине. * Известно, что в TNT частота рака в группе рандомизированных к 10 и 80 мг/сут аторвастатина была соответственно 1.5 и 1.7% (отношение рисков 1.13, 95% доверительный интервал 0.83-1.55, р=0.42) Аспирин в первичной профилактике сердечно-сосудистых событий у женщин и мужчин (мета-анализ рандомизированных контролируемых исследований) Aspirin in primary prevention of cardiovascular events in women and men (a metaanalysis of randomized controlled trials). Подготовил И.С. Явелов Эффективность аспирина в профилактике инфаркта миокарда, инсульта и сосудистой смерти у мужчин и женщин с сердечно-сосудистыми заболеваниями хорошо установлена [1-3]. Целесообразность его использования в первичной профилактике сердечно-сосудистых осложнений не столь очевидна: при мета-анализе 5 рандомизированных исследований, выполненных до 2003 года, оказалось, что использование аспирина сопровождается достоверным уменьшением риска возникновения ИМ, но не влияет на частоту инсультов и сосудистую смертность [4]. При этом число женщин, участвовавших в клинических испытаниях, было слишком мало, чтобы оценить влияние пола на профилактическую эффективность вмешательства. С целью восполнить недостающую информацию после накопления новых фактов был проведен повторный мета-анализ [5]. Цель изучения. Определить, какую роль играет пол в эффективности и безопасности аспирина, применяемого для первичной профилактики сердечно-сосудистых осложнений. Методы. Из публикаций с 1966 по 2005 гг. для последующего анализа было отобрано 6 проспективных рандомизированных контролируемых исследований, включавших в совокупности 95456 больных. При последующем мета-анализе у женщин и мужчин сопоставлялся риск суммы случаев сердечно-сосудистой смерти, не смертельного ИМ и не смертельного инсульта, а также каждого из этих событий в отдельности. Анализировалась также частота крупных кровотечений. Результаты. Средняя длительность наблюдения составляла 6,4 года. Применение аспирина у 51342 женщин сопровождалось достоверным уменьшением риска суммы сердечно-сосудистых событий на 12% (отношение шансов [ОШ] 0,88, 95% границы доверительного интервала [ДИ] 0,79-0,99; р=0,03), инсульта на 17% (ОШ 0,83, 95% ДИ 0,70-0,97; р=0,02) за счет меньшей частоты ишемических инсультов (ОШ 0,76, 95% ДИ 0,63-0,93; р=0,008) при отсутствии существенного влияния на частоту геморрагических инсультов. Частота ИМ, сердечно-сосудистая и общая смертность у получавших аспирин существенно не отличались от групп сравнения. Применение аспирина у 44114 мужчин сопровождалось достоверным уменьшением риска суммы сердечно-сосудистых событий на 14% (ОШ 0,86, 95% ДИ 0,78-0,94; р=0,01), ИМ на 32% (ОШ 0,68, 95% ДИ 0,54-0,86; р=0,001). При этом риск ишемического инсульта у получавших аспирин был выше на 69% (ОШ 1,69, 95% ДИ 1,04-2,73; р=0,03). Сердечнососудистая и общая смертность в группах аспирина существенно не отличались от групп сравнения. Использование аспирина сопровождалось достоверным увеличением риска крупных кровотечений как у женщин (ОШ 1,68, 95% ДИ 1,13-2,52; р=0,01), так и у мужчин (ОШ 1,72, 95% ДИ 1,35-2,20; р<0,001). Абсолютное снижение риска совокупности серьезных сердечно-сосудистых осложнений на фоне применения аспирина составило 0,3% у женщин и 0,37% у мужчин. Соответственно, за 6,4 года удалось предотвратить 3 события на каждые 1000 женщин и 4 на каждые 1000 мужчин (для предотвращения одного события было необходимо лечить 333 женщины и 270 мужчин). При использовании аспирина удавалось предотвратить примерно 2 ишемических инсульта на каждую 1000 женщин и примерно 8 ИМ на каждую 1000 мужчин. Абсолютное увеличение частоты крупных кровотечений на фоне применения аспирина составило 0,25% у женщин и 0,33% у мужчин. Соответственно, для возникновения одного крупного кровотечения было необходимо лечить 400 женщины и 303 мужчины на протяжении 6,4 лет. Выводы. Полученные результаты свидетельствуют, что аспирин уменьшает риск серьезных сердечно-сосудистых осложнений за счет влияния на частоту ишемического инсульта у женщин и ИМ у мужчин. При этом независимо от пола увеличивается частота крупных кровотечений. Авторы публикации подчеркивают, что до назначения аспирина с целью первичной профилактики у лиц обоего пола врач должен взвесить ожидаемую пользу, возможный риск и обсудить это с больным. Вместе с тем представленные факты получены при мета-анализе и при их оценке следует учитывать все недостатки этого метода. Кроме того, в проведенных исследованиях изучались больные низкого риска, что не позволяет достаточно надежно оценить влияние вмешательства на отдельные события, входящие в состав комбинированной конечной точки. В частности, число ИМ у женщин и инсультов у мужчин было сравнительно невелико. Поэтому для окончательного суждения о различном воздействии аспирина на отдельные сердечно-сосудистые события у женщин и мужчин необходимо дальнейшее изучение. Уменьшают ли статины смертность больных с кардиомиопатией? Непредвиденные результаты SCD-HeFT. Does Statin Therapy Decrease Mortality in Patients with Cardiomyopathy? Unanticipated Observations from SCD-HeFT. Ретроспективный анализ данных крупного исследования, выполненного на больных сердечной недостаточностью, еще раз показал, что ответ на вопрос о целесообразности включения статинов в комплексную терапию больных сердечной недостаточностью с низкой фракцией выброса сможет быть дан только после окончания специально спланированных рандомизированных испытаний. Результаты этого анализа были сообщены на научной сессии Американской Ассоциации Сердца 2005 года. Далее представлен перевод тезисов соответствующего доклада [1]. Предпосылки. Согласно некоторым ретроспективным данным применение статинов ассоциируется со сниженной смертностью больных с кардиомиопатей. Мы изучили связь исходов и использования статинов в «Испытании Внезапная Сердечная Смерть При Сердечной Недостаточности» (SCD-HeFT). Это испытание выполнено на 2521 больном с сердечной недостаточностью II и III класса, фракцией выброса левого желудочка < 35%, как с ишемической, так и с неишемической кардиомиопатией. Больные были рандомизированы к имплантации дефибриллятора, амиодарону, или плацебо. Методы. Оценены взаимоотношения между применением статинов, группой, в которую были рандомизированы больные (группой рандомизации), категорией и функциональным классом заболевания, а также смертностью от всех причин. Результаты. Сведения об использовании [или неиспользовании] статинов на протяжении испытания получены от 2500 из 2521 участников, 38% из них сообщили, что применяли статин в исходном состоянии [т.е. при включении], 47% - при последнем, связанным с испытанием контакте (at last follow-up). В целом ассоциации между общей смертностью и применением статинов не было (отношение рисков HR 0.90, 0.73, 1.09, p=0.28). В подгруппе с ишемической кардиомиопатией при однофакторном (унивариантном) анализе общая смертность представлялась меньшей у больных, сообщивших, что они использовали статины («больные на статинах»), но после поправки на возраст, пол, расу, вес, фракцию выброса, функциональный класс, диабет, гипертонию, фибрилляцию предсердий, применение бета-блокаторов и аспирина различий в смертности не было ни в ишемической (HR 0.88, 0.7 - 1.11, p=0.29), ни в какой-либо другой подгруппе. Больные на статинах имели несколько достоверных отличий от больных не на статинах в исходном состоянии. В ишемической подгруппе у больных, получавших статины, была реже частота сердечных сокращений в покое, реже отмечалась мерцательная аритмия, они были моложе, и у них чаще отмечалась гиперлипидемия (все p<0.003). Среди «больных на статинах» у меньшего числа пациентов был III функциональный класс сердечной недостаточности и отмечалась тенденция к меньшей частоте гипертонии и диабета. Использование статинов ассоциировалось с применением бета-блокаторов (83% vs 74%, p=0.001) и аспирина (67% vs 47%, p=0.001). Не было связи между использованием статинов и группой, в которую были рандомизированы больные, и с применением не было связано никакого дополнительного положительного эффекта ни в одной из групп рандомизации. Заключение. В этом ретроспективном (post-hoc) анализе больных из SCD-HeFT не было возможным продемонстрировать уменьшение смертности в связи с применением статинов. Принимающие статины представляли собой особую (отличающуюся) популяцию больных с менее тяжелым заболеванием и большей частотой использования другой благоприятно действующей терапии. Эти результаты противоречат предшествующим исследованиям и демонстрируют потребность в проспективном рандомизированном испытании терапии статинами при сердечной недостаточности. Опасное лекарство Астры-Зенеки отозвано - уже после начала рекламирования в России, но к счастью до начала активных продаж. Фармацевтическая компания Астра-Зенека 14 февраля этого года выпустила обращение, известившее об отзыве антикоагулянта Эксанта (мелагатран/ксимелагатран) и о прекращении работ по его развитию [1] . Остановлены и проводимые в настоящее время крупные испытания препарата. Согласно этому обращению «ни у одного нового больного нельзя начинать лечение Эксантой. У больных, которые уже принимают Эксанту, врачи должны рассмотреть переход на альтернативный антикоагулянт». Непосредственным основанием к такому действию явилось сообщение о серьезном повреждении печени у больного, принимающего участие в клиническом испытании эффективности относительно длительного применения Эксанты (до 35 дней) в профилактике возникновения тромбозов в связи с ортопедическми операциями. Это новое сообщение рассмотрено в контексте данных о действии на печень, ранее полученных во время клинических испытаний хронического использования препарата. Сообщение указывает на потенциальный риск тяжелого повреждения печени. Так как о возможности неблагоприятного действия Эксанты на печень уже было хорошо известно, в испытании предпринимались определенные предосторожности. И наиболее важным для окончательного решения оказалось то, что эти предосторожности не предупредили развития серьезного осложнения. То, что препарат способен вызывать повышение активности печеночных ферментов выявилось и в сравнительных испытаниях ксимелагатрана и варфарина при мерцательной аритмии. Астра-Зенека отозвала заявку в Европейское Агенство по Лекарственным средствам (EMEA) на разрешение применения Эксанты для предупреждения тромбоэмболических осложнений, связанных с мерцательной аритмией [2]. Симптоматично, что острожное Управление по лекарствам и пищевым продуктам (FDA) США в 2004 году отклонило ксимелагатран как ввиду опасности осложнений, так и отсутствия доказательств превосходства над другими антитромботическими средствами. Нельзя не отметить, что в сообщениях сотрудника лаборатории клинической кардиологии НИИ ФХМ И.Р.Трифонова о результатах изучения действия ксимелагатрана при мерцательной аритмии (SPORTIF-III) и после перенесенного острого коронарного синдрома (ESTEEM) подробно представлены данные о большей частоте случаев повышения активности печеночных ферментов среди принимавших ксимелогатран по сравнению с больными, принимавшими препараты сравнения [3,4]. Так отмечено, что в SPORTIF-III частота случаев повышения содержания печеночных ферментов в крови более чем в 3 раза по сравнению с верхней границей нормы (ВГН) среди получавших ксимелогатран была в 9 раз большей, чем среди получавших варфарин (соответственно 6.5 и 0.7%, р=0.007) [4]. В ESTEEM более чем трехкратное превышение ВГН по активности АЛТ зарегистрировано у 147 больных. Шестеро из этих больных умерли (правда, согласно имевшимся на то время данным, эти смерти не были расценены испытателями, как связанные с приемом препарата) [4]. В России препарат зарегистрировать успели и уже была начата активная рекламная кампания в «глянцевой печати» [5]. При самоконтроле международного нормализованного отношения результаты длительного лечения непрямыми антикоагулянтами лучше, чем при стандартном контроле. Результаты нового метаанализа. Подготовил И.С. Явелов Непрямые антикоагулянты (НА) пока не имеют альтернативы в случаях, когда необходима длительная профилактика тромбоэмболических осложнений, и обладают хорошо документированным эффектом при сохраняющейся мерцательной аритмии, наличии механических искусственных клапанов сердца, венозном тромбозе и тромбоэмболии легочной артерии. Их применение предполагает строгий контроль достигнутого уровня антикоагуляции, который осуществляется с помощью международного нормализованного отношения (МНО) [1]. Доля больных, у которых МНО находится в границах терапевтического диапазона, зависит от частоты определения показателя с коррекцией дозы препарата, если это необходимо: отмечено, что если данные мероприятия осуществляются ежемесячно, желаемое МНО поддерживается примерно в 50% случаев, в то время как при еженедельных определениях достичь желаемого можно у 85% больных [2,3]. Одним из способов улучшить качество лечения НА является самоконтроль МНО в домашних условиях с помощью устройств, позволяющих определять значения показателя в цельной крови [4]. Однако крупных исследований по сопоставлению эффективности и безопасности самоконтроля МНО и коррекции дозы НА (самостоятельно на основании заранее разработанных алгоритмов или после звонка в медицинское учреждение) со стандартным подходом к ведению больных (повторные визиты в клинику) проведено не было. Три мета-анализа небольших клинических испытаний не позволяли с уверенностью судить о преимуществе какого-либо из этих подходов [5-7]. Недавно появились результаты еще одного мета-анализа, включавшего наибольшее количество рандомизированных клинических исследований [8]. Цель изучения. Проанализировать накопленные факты об эффективности самоконтроля МНО и самостоятельной коррекции дозы препаратов у больных, получающих НА. Методы. В электронных базах данных был проведен поиск результатов опубликованных и неопубликованных рандомизированных контролируемых исследований, выполненных с 1966 по 2005 гг. у взрослых и детей, в которых проводилось сравнение частоты тромбоэмболических осложнений и крупных кровотечений при самоконтроле МНО, самостоятельном подборе дозы НА (самоконтроль МНО и самостоятельное изменение дозы препаратов), контроле МНО и дозировании НА личным врачом, в специализированной клинике или в другом соответствующем подразделении (стандартное использование НА). Показания к применению НА значения не имели. Для анализа было отобрано 14 исследований, включавших в совокупности 3049 больных. Длительность наблюдения составляла от 2 до 24 месяцев. Результаты. По совокупным данным при самоконтроле МНО общая смертность (отношение шансов [ОШ] 0,61; 95% доверительный интервал [ДИ] 0,38-0,98), частота тромбоэмболических осложнений (ОШ 0,45; 95% ДИ 0,30-0,68) и крупных кровотечений (ОШ 0,65; 95% ДИ 0,42-0,99) были достоверно ниже, чем при стандартном использовании НА. Наиболее выраженным оказалось преимущество сочетания самоконтроля МНО и самостоятельного изменения дозы НА: ОШ общей смертности составило 0,37 (95% ДИ 0,16-0,85), частоты тромбоэмболических осложнений – 0,27 (95% ДИ 0,12-0,59). При этом частота крупных кровотечений существенно не отличалась от стандартного подхода к использованию НА (ОШ 0,93; 95% ДИ 0,42-2,05). Данные о доле больных со средними значениями МНО в пределах терапевтического диапазона имелись в 11 исследованиях. Во всех отмечено преимущество самоконтроля МНО. Имеющиеся факты не позволили сопоставить стойкость поддержания терапевтических значений МНО. Среди больных, подходящих для включения в 8 из проанализированных исследований, 62% были исключены или приняли решение не участвовать. Среди больных, включенных в группы самоконтроля МНО, с задачей не смогли справиться 22% (от 9 до 43% в различных исследованиях). В основном это происходило из-за проблем с прибором, физических ограничений, проблем с посещением занятий, а также неудовлетворительными результатами обучения. Выводы. По данным проведенного мета-анализа самоконтроль МНО улучшает качество лечения НА и по сравнению со стандартным подходом обеспечивает достоверное уменьшение риска тромбоэмболических осложнений, общей смертности и частоты крупных кровотечений. Самостоятельное изменение дозы НА приводит к более выраженному снижению риска тромбоэмболических осложнений и смерти ценой меньшего влияния на частоту крупных кровотечений. Вместе с тем очевидно, что самостоятельное мониторирование МНО у всех больных получающих НА, невыполнимо, и требует выявления и специального обучения потенциальных кандидатов, способных практиковать подобный подход. В настоящее время существуют рекомендации по самоконтролю действия НА и их самостоятельному дозированию [9]. Очередной раз об опасности возникновения сердечнососудистых осложнений при применении ингибиторов циклооксигеназы-2. Риск сердечно-сосудистых событий и целекоксиб: систематический обзор и метаанализ. Подготовлено Н.А.Грацианским. Ссылка по теме. Как известно, использование представителей класса ингибиторов циклооксигеназы-2 рофекоксиба, вальдекоксиба и парекоксиба оказалось связанным с повышенным риском сердечно-сосудистых событий, и клиническое применение этих средств прекращено [1,2]. Информация о риске сердечнососудистых событий при использовании еще одного представителя той же группы - целекоксиба – противоречива [1]. Поэтому Управление по пищевым продуктам и лекарствам (FDA) США ограничилось требованием добавить к официальным документам, касающимся целекоксиба, предостережение в черной рамке (black box warning) о потенциальной опасности «сердечнососудистых тромботических событий, инфаркта миокарда, и инсульта» [2, 3] 16[1]. Только что опубликованы результаты метаанализа рандомизированных испытаний целекоксиба, не только подтвердившего безусловную правильность этого предупреждения [4], но и поставившего под сомнение «исключительность» целекоксиба. Кроме того, эти результаты предоставили дополнительные аргументы в пользу представлений о повышении риска сердечнососудистых осложнений, в частности инфаркта миокарда, как эффекте класса специфических ингибиторов ЦОГ-2. Приводим некоторые выдержки из соответствующей публикации и перевод ее резюме [4]. «Предметом серьезного обсуждения является вопрос о том, до какой степени повышенный риск, связанный с применением специфического ингибитора циклооксигеназы-2 (ЦОГ-2) рофекоксиба, распространяется на целекоксиб. Программа исследований целекоксиба первично предназначалась для определения его эффективности и сопутствующегориска желудочно кишечных нежелательных явлений, и клинические испытания не имели достаточной мощности для для оценки риска сердечно сосудистых событий. Существует явное расхождение между данными разных испытаний, предоставивших информацию о сердечно-сосудистых событиях. Например, согласно сообщениям о результатах CLASS (Исследование безопасности длительного применения целекоксиба при артрите), в нем не было увеличения основных сердечнососудистых тромбоэмболических событий, включая инфаркт миокарда. В недавнем же Colorectal Adenoma Prevention Trial (Исследование по предупреждению аденомы толстой и прямой кишок) выявлено повышение риска сердечно сосудистых событий в 2.3 и 3.4 раза при использовании соответственно доз 400 и 800 мг. Авторы выполнили систематический обзор и метаанализ двойных слепых рандомизированных контролированных испытаний целекоксиба, предоставивших сведения о серьезных сердечнососудистых событиях. Первичный анализ включал испытания, в которых сопоставлялись целекоксиб и плацебо [5-8], при вторичном анализе плацебо контролированные испытания были объединены с испытаниями, где в качестве вмешательств сравнения использовались нестероидные противовоспалительные средства или парацетамол [9-10]». Резюме. «Цель. Выяснить, является ли повышенный риск сердечно-сосудистых событий при применении рофекоксиба отражением эффекта класса специфических ингибиторов циклооксигеназы-2 (ЦОГ-2). План. Систематический обзор и метаанализ рандомизированных двойных слепых клинических испытаний целекоксиба продолжительностью по крайней мере 6 недель и представивших сведения о серьезных сердечнососудистых тромбоэмболических событиях. Источники информации включали 6 библиографических баз данных, имеющие отношение к проблеме файлы Управления по лекарствам и пищевым продуктам США, и Интернет сайты фармацевтических компаний. Основные критерии (оценки, характеристики) исходов. Суммарные фиксированные оценки отношений шансов для риска сердечнососудистых событий при применении целекоксиба в сравнении с сопоставляемым лечением. Эти оценки были рассчитаны с использованием метода обратного взвешенного дисперсионного анализа (inverse variance weight method). Основным показателем, характеризующим исходы, было развитие инфаркта миокарда. Результаты. Четыре плацебо-контролированных испытания на 4422 больных были включены в первичный мета-анализ сравнения целекоксиба и плацебо. Отношение шансов возникновения инфаркта миокарда при применении целекоксиба по сравнению с плацебо было 2.26 (95% доверительный интервал 1.0-5.1). Для суммы сердечнососудистых событий (отношение шансов 1.38 95%ДИ 0.91-2.10)], случаев сердечнососудистой смерти [ОШ 1.06 (95% ДИ 0.38-2.95)] и инсульта [ОШ 1.0 (95% ДИ 0.51 1.84)] достоверного увеличения, связанного с целекоксибом, не отмечено. Вторичный метаанализ, в который было включено 6 испытаний на 12780 больных (с плацебо, диклофенаком, ибупрофеном, и парацетамолом как вмешательствами сравнения) дал близкий результат с достоверно увеличенным риском инфаркта миокарда при применении целекоксиба [ОШ 1.88 (95% ДИ 1.15 - 3.08)]. Увеличения риска других исходов не было. Заключение. Имеющиеся данные свидетельствуют об увеличении риска инфаркта миокарда при терапии целекоксибом, соответствующем эффекту класса специфических ингибиторов ЦОГ-2». Некоторые дополнительные сведения из публикации. Всего авторы нашли 48 двойных слепых рандомизированных испытаний. Исключены 42 так как их длительность не достигала 6 недель или так как в сообщениях о них отсутствовали сведения об основных сердечнососудистых событиях (инфаркт миокарда, церебральнососудистое событие или сердечнососудистая смерть). Отобранные испытания выполнены на больных с различными состояниями (ревматоидный артрит, остеоартрит, болезнь Альцгеймера, и высокий риск аденом толстой и прямой кишок), в них использовались дозы целекоксиба 200, 400 и 800 мг/сут [5-10]. Длительность колебалась от 6 до 161 недель. Ни одно из испытаний не было предназначено для определения риска сердечнососудистых тромбоэмболических событий, связанных с применением целекоксиба, и не имело необходимой для этого статистической мощности. Сообщения об испытаниях не содержали указаний на проведение систематического наблюдения для выявления сердечнососудистых событий (например, регистрации ЭКГ в исходном состоянии и на лечении). Только в одном были приведены критерии для диагноза сердечнососудистого осложнения. Некоторые другие факты также характеризуют недостаточно корректную регистрацию сердечнососудистых событий в испытаниях целекоксиба. В частности, отмечены существенные расхождения данных о числе событий между сообщениями результатов одного испытания. В качестве примера приводится CLASS: в первичной публикации не было указаний на сердечнососудистые смерти, в докладе FDA упомянуты 13 случаев смерти от сердечнососудистых заболеваний, в публикации White и соавт – 20 (в мета-анализе использованы данные из этой публикации). Другой пример – несовпадения числа церебральнососудистых событий в разных документах, содержащих данные испытания при болезни Алцгеймера [6, 11]. Кроме того, в части испытаний не были уточнены причины сердечнососудистой смерти и оказалось невозможным определить число фатальных инфарктов миокарда и цреброваскулярных событий. Результаты первичного анализа. Инфаркт миокарда. Данные содержались в сообщениях о 3 испытаниях. Было 29 случаев среди 2574 больных (1.13%) на целекоксибе и 6 – среди 1447 больных (0.41%) на плацебо. Отношение рисков 2.26 (95%ДИ 1.0-5.1). Цереброваскулярные события. Было 24 события среди 2775 больных (0.86%) на целекоксибе и 13 – среди 1647 (0.79%) на плацебо. Сердечно-сосудистые смерти. Данные содержались в сообщениях о 3 испытаниях. Было 16 случаев смерти на 2574 больных (0.62%) на целекоксибе и 7 среди 1447 больных (0.48%) на плацебо. Все сердечнососудистые события. Было 79 событий среди 2775 больных (2.85%) на целекоксибе и 30 – среди 1647 (1.82%) на вмешательствах сравнения. Отношение рисков 1.38 (95%ДИ 0.91-2.10). Результаты вторичного анализа. Инфаркт миокарда. Данные содержались в сообщениях о 5 испытаниях. Было 55 случаев среди 6658 больных (0.83%) на целекоксибе и 21 – среди 5522 больных (0.38%) на вмешательствах сравнения. Отношение рисков 1.88 (95%ДИ 1.15-3.08). Цереброваскулярные события. Было 28 событий среди 6859 больных (0.41%) на целекоксибе и 27 – среди 5921 (0.46%) на вмешательствах сравнения. Сердечно-сосудистые смерти. Данные содержались в сообщениях о 5 испытаниях. Было 26 случаев смерти на 6561 больных (0.40%) на целекоксибе и 17 среди 5428 больных (0.31%) на вмешательствах сравнения. Все сердечнососудистые события. Было 134 события среди 6859 больных (1.95%) на целекоксибе и 81 – среди 5921 (1.37%) на вмешательствах сравнения. Отношение рисков 1.22 (95%ДИ 0.92-1.62). Из заключения публикации. Эти результаты предполагают, что предпочтительная оценка FDA отношения риск/польза целекосиба (по сравнению с другими ингибиторами ЦОГ-2) возможно не поддерживается имеющимися в настоящее время фактическими данными. Комментарий. Существует уже достаточно указаний на возможное повышение различных неблагоприятных событий при применении целекоксиба. Достаточно для того, чтобы практическому врачу было ясно, что до получения окончательного заключения о сердечнососудистой безопасности этого средства, его применение должно быть минимизировано с учетом содержания «черного ящика» (см. приложение ниже [12]). В тех случаях, когда врач считает, что избежать назначения целекоксиба нельзя, необходимо следовать рекомендации FDA «использовать в соответствии с целями лечения конкретного больного наименьшую эффективную дозу и наименьшую продолжительность применения». Эту рекомендацию следует, очевидно, соблюдать пока не станут известны результаты специально спланированного исследования PRECISION (Проспективное рандомизированное оценка интегральной безопасности целекоксиба в сравнении с ибупрофеном или напроксеном), которое предполагается осуществить примерно на 20000 больных [13]. В PRECISION будут включаться пациенты с сочетанием артрита и сердечнососудистого заболевания (например инфаркта миокарда, инсульта) или заболевания периферических сосудов или диабета. Т.е. это будут больные, нуждающиеся в активной вторичной профилактике. Соответственно все они будут получать аспирин. Кроме того, для защиты желудочно-кишечного тракта, а также ослепления лечения, у всех больных будет использоваться ингибитор протонного насоса (омепразол). А пока испытания целекоксиба, предназначенные для других целей, продолжают поставлять свидетельства повышения риска кардиоваскулярных событий. В частности любопытный результат был получен в только что опубликованном относительно краткосрочном (12 недель) сравнительном испытании эффективности и желудочно-кишечной безопасности целекоксиба, напроксена и диклофенака SUCCESS-I у больных с остеоартритом [14]. В SUCCESS-I было включено 13274 больных. Целекоксиб использовался в дозах 200 и 400 мг/сут. Исследование не имело достаточной мощности для выявления различий в частоте сердечнососудистых событий и число этих событий за такой короткий срок было малым во всех группах. Тем не менее, среди рандомизированных к неспецифическим нестероидным противовоспалительным средствам за 4 месяца развился 1 инфаркт миокарда, а среди рандомизированных к целекоксибу за это время возникло 10 инфарктов миокарда (!). Опубликованы данные наблюдения в течение 18 месяцев в рандомизированном контролированном испытании BOOST (Перенос костного мозга для улучшения регенерации инфаркта миокарда с подъемами ST). Ссылки по теме Резюме публикации «Внутрикоронарное введение аутологичных клеток костного мозга (ККМ) может способствовать восстановлению функции левого желудочка у больных, перенесших острый инфаркт миокарда. Однако клинические исследования, посвященные эффектам ККМ после инфаркта миокарда охватывали только ограниченный период времени от 3 до 6 месяцев. Критический вопрос о том, может ли перенос ККМ оказать длительное действие на функцию левого желудочка, остается без ответа. Методы и результаты. После чрескожного коронарного вмешательства с имплантацией стентов в ответственную за инфаркт артерию 60 больных были рандомизированы в отношении 1:1 или в контрольную группу с оптимальной после инфарктной терапией, или в группу переноса аутологичных ККМ, в которой больные получили еще и внутрикоронарную инфузию костногомозговых клеток через 4.8±1.3 дней после ЧКВ. Магнитно-резонансная визуализаиция (томография) была выполнена через 3.5±1.5 дней, 6±1 месяцев, и 18±6 месяцев после ЧКВ. Перенос ККМ не ассоциировался с нежелательными клиническими событиями. В контрольной группе средняя глобальная фракция выброса левого желудочка увеличилась на 0.7 и 3.1 процентную единицу соответственно через 6 и 18 месяцев. В группе переноса костномозговых клеток фракция выброса левого желудочка увеличилась на 6.7 и 5.9 процентных единиц соответственно через 6 и 18 месяцев. Разница в улучшении ФВЛЖ между группами была достоверной через 6 месяцев, и недостоверной - через 18 месяцев (р=0.27). Скорость восстановления фракции выброса левого желудочка на протяжении 18 месяцев была достоверно более высокой в группе переноса ККМ (р=0.001). Заключение. В этом исследовании однократная доза внутрикоронарных ККМ не обеспечила длительной пользы для систолической функции левого желудочка после инфаркта миокарда по сравнению с рандомизированной контрольной группой. Тем не менее, исследование предполагает ускорение восстановления фракции выброса левого желудочка после инфаркта миокарда терапией клетками костного мозга». Некоторые дополнения из публикации. Результаты можно трактовать двояко. (1) ККМ оказывает только преходящее действие на сократительность миокарда без структурного заживления. (2) ККМ несколько ускоряют регенеративные процессы, которые и так происходят у больных инфарктом миокарда, получающих современную терапию. BOOST не было предназначено для изучения механизмов возможного влияния ККМ на функцию левого желудочка. Однако по данным магнитно-резонансного исследования существенного образования новой миокардиальной ткани у больных не произошло. Перенос ККМ не оказал достоверного действия на конечный диастолический объем левого желудочка. Это предполагает, что ККМ оказывают очень ограниченное действие на ремоделирование левого желудочка после инфаркта миокарда. Если ККМ действительно оказывают только кратковременное положительное действие на функцию левого желудочка, существенное влияние их переноса на клинические конечные точки (например, возникновение сердечной недостаточности или выживаемость в отдаленном периоде) становится маловероятным. Авторы ссылаются на собственную работу, в которой показано, что только 5% от введенных ККМ действительно задерживаются в инфаркцированном миокарде человека. Они считают, что для дальнейшего прогресса необходимо найти фармакологические или генетические стратегии, увеличивающие включение ККМ в миокард. Применение антидепрессантов при коронарной болезни сердца ассоциируется с повышенной смертностью17[1]. На ежегодном съезде Американского Психосоматического Общества доложены результаты исследования, заставляющие серьезно пересмотреть отношение к применению антидепрессантов у больных коронарной болезнью сердца. Ниже приводится перевод тезисов этого доклада [1]. «На протяжении последних 10 лет появились публикации, документирующие повышенный риск смертности ассоциируемый с депрессией у больных коронарной болезнью сердца (КБС) и общетерапевтических госпитализированных больных. Одним из следствий этого является увеличивающееся внедрение быстрого использования антидепрессивных лекарств в медицинскую практику. Антидепрессанты, особенно более новая генерация селективных ингибиторов обратного захвата серотонина, считаются относительно свободными от побочных эффектов. Однако имеется мало информации, описывающей действие этих средств на смертность больных КБС Исследование VAGUS - проспективное исследование, предназначенное для оценки влияния тревоги и депрессии на больных КБС. В качестве части этого исследования мониторировались симптомы депрессии и использование антидепрессивных лекарств во время госпитализации больных для диагностической катетеризации сердца. Цель настоящего анализа – выяснить, предсказывает ли общее потребление антидепрессантов больными КБС, подвергаемыми коронарной ангиографии, повышенный риск смертности. Двадцать процентов (n=189) больных принимали антидепрессанты. Из представителей разных классов антидепрессантов наиболее часто прописывались ингибиторы обратного захвата серотонина (66%), затем следовали антидепрессанты со смешанным эффектом ингибиторов обратного захвата норадреналина и серотонина (21.5%), лекарства со слабым тормозящим действием на обратный захват как ноадреналина, так и допамина, такие как бупропион (9%), и средства, которые в основном действуют, ингибируя обратный захват норэпинефрина (4%). В целом использование антидепрессантов независимо ассоциировалось с повышенным риском смерти. Этот риск уменьшался, но все же присутствовал после поправки на тяжесть (выраженность) депрессии (определялась по шкала депрессии Бека), сопутствующие заболевания, возраст, фракцию выброса левого желудочка, пол, принадлежность к национальным меньшинствам, и курение (отношение рисков 1.62, р=0.029). Эти предварительные данные предполагают, что у больных КБС обычно используемые антидепрессанты могут способствовать повышенному риску смерти». Дополнительная информация из других источников. Информация о содержании доклада L.Watkins и соавт. на различных Интернет сайтах содержит некоторые уточнения по сравнению с опубликованными тезисами [2-4]. Всего был включен 921 больной КБС в возрасте 29-90 лет. Антидепрессанты использовали 19.4% из них. На протяжении 3 лет наблюдения (средняя продолжительность) умерло 21.4% среди принимавших, и 12.5% - среди не принимавших антидепрессанты. Таблица. Характеристика больных в исследовании L.Waters и соавт. и его основной результат [2] Без Использование Фактор p антидепрессанов антидепрессантов Баллы по шкале депрессии Бека 7 11 <0.001 Число сосудов со значимыми стенозами (n) 2.1 1.8 <0.05 Фракция выброса (%) 54 56 <0.05 Сопутствующие терапевтические заболевания (%) 23 32 <0.01 Смерти за период наблюдения (%) 12.5 21.4 <0.01 Комментарий. Работа имела ограничения, присущие исследованиям такого рода. Нельзя исключить действие неизвестных обстоятельств, обусловивших назначение антидепрессантов одним больным, и неназначение – другим. Статистическая поправка на наиболее очевидные прогностические факторы полностью положение не исправляет. Соответственно исследование L.Watkins и соавт. – не только основание к осторожному отношению к антидепрессантам, но прежде всего стимул для серьезных рандомизированных испытаний. Одно из таких испытаний предполагается выполнить в том же учреждении, из которого вышла работа и L.Watkins соавт. – ( университет Duke). В нем планируется сравнить сердечнососудистые эффекты ингибиторов обратного захвата серотонина и физических тренировок (расширения физической активности) [2]. Всегда было ясно, что ведущаяся в России рекламная компания о благоприятных эффектах антидепрессантов при КБС не основана на убедительных данных. После появления результатов L.Watkins очевидно, что широкий поиск признаков депрессии и либеральное назначение антидепрессантов больным КБС до завершения соответствующих рандомизированных исследований не оправданы. Результаты сравнения стентов с различным антипролиферативным покрытием и без него при первичном чрескожном коронарном вмешательстве у больных инфарктом миокарда не совпали. Предварительные итоги испытаний TYPHOON и PASSION. Подготовил И.С. Явелов На ежегодной сессии Американской коллегии кардиологов 12 марта 2006 г. были представлены результаты двух исследований по сравнению эффективности стентов с антипролиферативным покрытием и без него: Исследование по оценке использования стента Cypher [выделяющего сиролимус] при остром инфаркте миокарда, леченного с помощью баллонной ангиопластики (Trial to Assess the Use of the Cypher Stent in Acute Myocardial Infarction Treated with Balloon Angioplasty – TYPHOON) и Стент, выделяющий паклитаксел, против обычного стента при инфаркте миокарда с подъемами сегмента ST (Paclitaxel-Eluting Stent versus Conventional Stent for STEMI – PASSION) [1]. Исследование TYPHOON. В исследовании участвовало 48 лечебных учреждений Европы, Австралии и Израиля, в которых было рандомизировано 712 больных с острым инфарктом миокарда (ИМ). У части из них было проведено первичное чрескожное коронарное вмешательство с установкой стента, выделяющего сиролимус (Cypher), у других был имплантирован металлический стент без покрытия (мог применяться любой из стентов этого типа). Наблюдение осуществлялось на протяжении 1 года. Результаты представлены в табл. 1. Таблица 1. Клинические и ангиографические результаты исследования TYPHOON. Конечная точка Сердечная смерть, ИМ или повторное инвазивное вмешательство на том же сосуде Серьезные острые коронарные осложнения Повторное инвазивное вмешательство на том же сосуде Повторное инвазивное вмешательство на том же участке сосуда Бинарный рестеноз* Позднее уменьшение минимального диаметра просвета сосуда в месте вмешательства* Выраженность стенозирования в месте вмешательства* Cypher Металлический стент без покрытия р 7,3% 14,3% <0,0036 5,9% 14,6% <0,001 5,6% 13,6% <0,001 3,7% 12,6% <0,0001 3,5% 20,3% <0,001 0,13 мм 0,83 мм <0,0001 16,4% 37,1% <0,0001 Примечание: * ангиографические результаты оценивались через 8 месяцев в подгруппе из 210 больных. Частота клинически значимых неблагоприятных событий при использовании металлического стента без покрытия оказалась в два раза выше, чем при имплантации стента, выделяющего сиролимус. Такое различие было достигнуто в основном за счет более высокой частоты повторных инвазивных вмешательств на том же сосуде в области установки стента. Это соотносилось с меньшей частотой рестенозирования и менее выраженной уменьшение минимального диаметра просвета сосуда при повторном ангиографическом обследовании через 8 месяцев. Согласно данным, представленным на сайте www.theHeart.org, С. Spaulding, докладывавший результаты исследования, отметил, что “стенты, выделяющие сиролимус, еще больше увеличивают отдаленные клинические преимущества первичной ангиопластики, которая, как было показано, является наиболее эффективным способом лечения острого ИМ с подъемами сегмента ST на ЭКГ, если выполняется опытной командой специалистов”. Исследование PASSION. Было рандомизировано 619 больных, часть из которых во время первичного чрескожного коронарного вмешательства подверглись имплантации стента, выделяющего паклитаксел (Taxus Express). У других был имплантирован металлический стент без покрытия (Express). Через 1 год статистически значимых различий между группами по частоте клинически значимых неблагоприятных событий не было (табл. 2). Таблица 2. Клинические и ангиографические результаты исследования PASSION. Конечная точка Серьезные острые коронарные осложнения Смерть или ИМ Повторное инвазивное вмешательство на том же участке сосуда Taxus Металлический стент без покрытия р 8,7% 12,6% 0,12 4,8% 6,5% 0,39 6,2% 7,4% 0,23 Комментарий. В интервью с представителями информационного интенет-сайта Heartwire С. Spaulding отметил, что контингенты больных, включенные в эти два исследования, а также особенности их проведения существенно различались. Так, согласно информации, приведенной на сайте www.theHeart.org, в исследовании PASSION не предусматривалось повторного ангиографического исследования. Соответственно, целесообразность нового инвазивного вмешательства в месте имплантации стента определялось преимущественно клиническими показаниями, а не реакцией на выявленную при плановом обследовании ангиографическую картину. M. Dirksen, представлявший результаты исследования PASSION, в интервью Heartwire привлек внимание к большей частоте серьезных острых коронарных осложнений в группе маталлических стентов без покрытия в исследовании TYPHOON. По его мнению, это может быть во многом связано с несовпадением типов таких стентов, применявшихся в данных исследованиях (любые в исследовании TYPHOON, только Express в исследовании PASSION). Кроме того, в исследование PASSION в отличие от исследования TYPHOON могли включаться больные со стенозом ствола левой коронарной артерии, бифуркационными стенозами, крупными тромбами. Наконец, время о начала симптомов ИМ до раздувания баллона в коронарной артерии в исследовании TYPHOON было немного большим. Не совпадали и определения некоторых конечных точек. Таким образом, очевидно, что до появления более подробной информации об особенностях проведенных исследований, анализировать причины несовпадения их результатов и клиническое значение новых фактов не представляется возможным. Однако уже сейчас очевидно, что для сопоставления эффективности стентов с различным покрытием необходимо их прямое сравнение в рамках одного специально спланированного рандомизированного клинического испытания (на одном контингенте больных, по одному протоколу). Ультрафильтрация с забором крови из периферической вены при декомпенсации сердечной недостаточности. Результаты исследования UNLOAD. Подготовил И.С. Явелов Применение мочегонных для устранения задержки жидкости лежит в основе лечения декомпенсации хронической сердечной недостаточности (ХСН). Вместе с тем у тяжелых больных часто требуется вводить высокие дозы мочегонных, что может быть сопряжено с повышенным риском смерти, включая внезапную. Кроме того, во многих случаях диуретики оказываются недостаточно эффективными. Так, по данным Национального регистра острой декомпенсации сердечной недостаточности (Acute Decompensated Heart Failure National Registry – ADHERE) по крайней мере, один из пяти больных, госпитализированных с таким диагнозом, выписывается из стационара без снижения веса [1]. Альтернативным способом быстрого удаления из организма избытка жидкости является ультрафильтрация. В настоящее время она обычно используется у больных с почечной недостаточностью или при рефрактерности к диуретикам [2]. Данные двух небольших исследований, появившиеся в 2005 году, указывают на способность ультрафильтрации удалять большее количество жидкости из организма по сравнению с внутривенным введением мочегонных, также обеспечить достаточно быструю и стойкую стабилизацию состояния декомпенсированных больных с устойчивастью к диуретикам. Кроме того, в несравнительном исследовании оказалось, что при применении ультрафильтрации достигается уменьшение выраженности нейрогормональной активации (снижение уровня ренина, норадреналина и адьдостерона в крови). При этом уровень креатинина и электролитов существенно не менялся, а случаев артериальной гипотонии отмечено не было [1, 3-5]. Результаты первого достаточно крупного многоцентрового рандомизированного клинического испытания по сопоставлению эффективности ультрафильтрации с забором крови из периферической вены и стандартного подхода с внутривенным введением мочегонных у больных с острой декомпенсацией ХСН Ультрафильтрация против внутривенных диуретиков для больных, госпитализированных с острой декомпенсацией ХСН (Ultrafiltration vs IV Diuretics for Patients Hospitalized for Acute Decompensated CHF – UNLOAD) были доложены на ежегодной сессии Американской коллегии кардиологов 13 марта 2006 г. [6]. В исследовании участвовали 28 лечебных учреждений, в которых было включено 200 больных. Оценивались события за 48 часов и 90 суток. Первичной конечной точкой являлось уменьшение веса через 48 часов. Основные результаты исследования представлены в таблице. Таблица. Результаты исследования UNLOAD. Конечная точка 48 часов Снижение веса (в среднем, кг) Индекс одышки (в среднем) Ультрафильтрация Диуретики р 5,0 (n=83) 6,4 (n=80) 3,1 (n=84) 6,1 (n=83) 0,001 0,35 Потеря жидкости (в среднем, л) К <3,5 ммоль/л (%) Необходимость в вазоактивных препаратах (%) 90 суток Повторные госпитализации (%) Длительность повторной госпитализации (в среднем, сут) Внеплановые посещения врача (%) 4,6 1 3 3,3 12 13 0,001 0,018 0,015 18 1,4 32 3,8 0,022 0,022 21 44 0,009 В группе больных, лечившихся с применением ультрафильтрации, по сравнению со стандартным использованием диуретиков в первые 48 ч достигалось выведение большего количества жидкости, что сочеталось с более редкой потребностью в использовании вазоактивных препаратов и не приводило к гипокалиемии или достоверным изменения уровня креатинина в крови. Через 3 месяца больные в группе ультрафильтрации реже госпитализировались повторно. Кроме того, как отмечается в изложении предварительных результатов исследования [6], после выписки у этих больных требовались меньшие дозы мочегонных для поддержания больных в состоянии компенсации. Вместе с тем, заметного различия в тяжести одышки через 48 часов не обнаружено. В сообщении, опубликованном на сайте theHeart.org, указано, что M. Costanzo, представлявшая результаты исследования UNLOAD, подчеркнула способность этого несоответствие изменить существующую практику использовать оценку выраженности симптомов в качестве критерия эффективности лечения острой декомпенсации сердечной недостаточности и высказала предположение о необходимости других целей терапии. В частности, не исключено, что в качестве последних стоит рассматривать степень выведения жидкости и уменьшения веса, которые согласно проведенному изучению достоверно коррелировали с частотой повторных госпитализаций. Для проведения ультрафильтрации использовалась коммерчески доступная установка Aquadex FlexFlow. При этом во время процедуры из периферической вены забирается и депонируется примерно 33 мл крови, что существенно меньше, чем при использовании систем предыдущего поколения, когда требовалась катетеризация центральной вены. Полагают, что такой поход не требует обязательного присутствия медицинской сестры, обученной в отделении гемодиализа, а также участия специалистанефролога [1]. Стоимость аппарата составляет 19000 долларов США, стоимость фильтра для одной процедуры – 900 долларов США. M. Costanzo отметила, что за один 8-часовой сеанс прибор способен удалить из организма до 4 литров жидкости, а для успешного устранения ее избытка у больных с острой декомпенсацией ХСН обычно требуется до двух процедур. Комментарий. Таким образом, эффективное лечение острой декомпенсации ХСН у больных с задержкой жидкости из преимущественно терапевтической проблемы начинает смещаться в область высоких технологий, т.е. становится более инвазивным, дорогостоящим и потому малодоступным. Вместе с тем важно учитывать, что результаты представленного исследования еще не опубликованы и многие детали, важные для понимания выявленных закономерностей, неизвестны (в частности, не охарактеризован контингент больных, у которых проводилось изучение, отсутствует описание методики ультрафильтрации, нет сведений о препаратах мочегонных, использовавшихся в группе стандартного лечения, их дозах). Кроме того, медикаментозное лечение декомпенсации ХСН постоянно совершенствуется, поэтому вопрос о соотношении инвазивного и консервативного подходов к ведению подобных больных при появлении более эффективных лекарственных средств придется переоценивать. Очевидно также, что в дальнейшем изучении нуждается как безопасность предложенного подхода (в частности, риск тромбоэмболических осложнений), так и соотношение эффективности и стоимости вмешательства. Частый длительный прием нестероидных противовоспалительных средств ассоциируется с повышенным риском сердечнососудистых событий. Развитие темы «Падение рофекоксиба…» В Исследовании Здоровья Медицинских Сестер (Nurses’ Health Study – NHS или ИЗМС) США была проведена оценка связи применения нестероидных противовоспалительных средств (НПВС) и риска сердечнососудистых заболеваний. ИЗМС начато в 1976 году, когда 121701 медицинской сестре (женщине) в возрасте от 30 до 55 лет заполнив вопросники, представили информацию о различных факторах риска. Затем вопросники посылались этим женщинам каждые 2 года, чтобы оценить статус факторов риска и выявить вновь диагностированные сердечнососудистые события и другие исходы. В 1990 году были добавлены вопросы о применении НПВС и ацетомифена. Данные о соотношении потребления этих средств и возникновения сердечнососудистых событий на протяжении 12 лет наблюдения опубликованы в журнале Circulation (пока только в электронном виде) [1]. Далее приводится перевод резюме этой публикации. «Предпосылки. Хотя в рандомизированных испытаниях ингибиторов циклооксигеназы-2 (ЦОГ-2) было выявлено увеличение сердечно-сосудистого риска, исследования неселективных нестероидных противовоспалительных средств (НПВС) и ацетомифена дали разноречивые результаты. Методы и результаты. Мы изучили влияние НПВС и ацетомифена на риск основных сердечно-сосудистых событий (нефатальный инфаркт миокарда, фатальная коронарная болезнь сердца, нефатальный и фатаьный инсульт) в проспективно наблюдаемой группе (когорте) из 70971 женщин в возрасте 44 - 69 лет к началу исследования, без известного сердечнососудистого заболевания или рака [при исходном обследовании], предоставлявших данные об используемых лекарствах каждые 2 года, начиная с 1990 года В течение 12 лет наблюдения было 2041 подтвержденное основное сердечнососудистое событие. У женщин, сообщивших о нерегулярном (нечастом - от 1 до 21 дней на протяжении месяца) использовании НПВС или ацетомифена не было достоверного увеличения риска сердечно-сосудистых событий. После поправки на сердечнососудистые факторы риска у женщин, которые использовали НПВС часто (≥22 дней/мес), относительный риск (ОР) сердечнососудистого события составил 1.44 (95% ДИ 1.27 до 1.65) по отношению к не использовавшим НПВС. У женщин, которые часто употребляли ацетомифен, ОР был равен 1.35 (95% ДИ, 1.14 до 1.59). Повышение риска, ассоциировавшееся с частым использованием НПВС, было особенно явным у курящих (ОР=1.82; 95% CI, 1.38 - 2.42) и отсутствовало среди никогда не куривших (Pвзаимодействия=0.02). Более того, мы наблюдали достоверную связь реакции (увеличение риска сердечнососудистых событий) и дозы: в сравнении с теми, кто не пользовался НПВС, отношения рисков сердечнососудистых событий среди женщин, принимавших ≥15 таблеток в неделю, составили 1.86 (95% ДИ, 1.27 - 2.73) для НПВС и 1.68 (95% ДИ, 1.10 2.58) - для ацетомифена. Выводы. Использование НПВС или ацетомифена с высокой частотой или в высоких дозах ассоциировалось с достоверно увеличенным риском основных сердечнососудистых событий, хотя более умеренное использование не обусловливало существенного риска». Некоторые дополнительные факты из публикации. В анализ не включались данные женщин, которые не предоставили ответы на вопросы о применяемых лекарствах, сообщили о наличии рака (кроме рака кожи – не меланомы), перенесенных инфаркте миокарда, инсульте, операции коронарного шунтирования или чрескожном коронарном вмшательстве, а также о наличии стенокардии. При анализе в качестве конечных точек не использовались сообщения об операциях коронарного шунтирования, чрескожных коронарных вмешательствах или возникновении стенокардии. В подвыборке из 200 женщин, которые в 1990 году сообщили об использовании аспирина выяснялись причины приема аспирина (ответ – 91%). Основными причинами у женщин, принимавших от одной до 6 и ≥7 таблеток в неделю, были головная боль (соответственно 32% и 18%), артрит или другая мышечно-скелетная боль (30% и 50%), сочетание головной и мышечно-скелетной боли (16% и 15%). Предупреждение сердечнососудистых заболеваний не относилось к наиболее частым причинам (9% и 8%). Таблица 1. Число женщин в группах Частота Не принимали использования, (никакие) дней в месяц НПВС n=44843 Ацетаминофен n=40438 1–4 5–14 15–21 ≥22 n=12989 n=19827 n=5481 n=6178 n=1705 n=1809 n≥5953 n=2719 Таблица. Результаты. Относительный риск сердечнососудистых событий в зависимости от использования аналгетиков, 1990-2002. Частота Не использования, принимали 1–4 5–14 15–21 ≥22 p дней в месяц (никакие) НПВС Человеко-годы 544 472 79 634 52 544 21 079 67 356 Число событий 1467 139 104 43 288 ОР с поправкой на 0.96 1.01 0.98 1.67 1.0 0.0001 возраст (95% ДИ) (0.80–1.14) (0.82–1.23) (0.72–1.32) (1.46–1.89) ОР с поправкой на 0.95 1.01 0.92 1.51 факторы риска † 1.0 0.0001 (0.80–1.14) (0.82–1.24) (0.68–1.25) (1.33–1.73) (95% ДИ) † ОР с поправкой на 0.95 1.00 0.91 1.44 факторы риска ‡ 1.0 0.0001 (0.79–1.14) (0.81–1.22) (0.67–1.23) (1.27–1.65) (95% ДИ) Ацетомифен Человеко-годы 546 800 108 179 54 166 20 596 35 344 Число событий 1441 221 143 68 168 ОР с поправкой на 1.00 1.19 1.36 1.72 1.0 0.0001 возраст (95% ДИ) (0.87–1.17) (1.00–1.42) (1.07–1.74) (1.47–2.03) ОР с поправкой на 0.99 1.12 1.25 1.41 факторы риска † 1.0 0.001 0.85–1.15) 0.94–1.33) 0.98–1.60) 1.19–1.66) (95% ДИ) ОР с поправкой на 0.98 1.09 1.22 1.35 факторы риска ‡ 1.0 0.0001 0.84–1.14) 0.91–1.30) 0.95–1.56) 1.14–1.59) (95% ДИ) Аспирин Человеко-годы 477 859 94 691 53 716 31 794 107 025 Число событий 1298 168 111 85 379 ОР с поправкой на 0.72 0.77 0.92 1.11 1.0 0.11 возраст (95% ДИ) 0.61–0.85) 0.64–0.94) 0.74–1.15) 0.99–1.26) ОР с поправкой на 0.80 0.86 1.03 1.13 факторы риска † 1.0 0.05 0.68–0.94) 0.70–1.05) 0.82–1.29) 1.00–1.27) (95% ДИ) ОР с поправкой на 0.80 0.85 1.00 1.07 факторы риска ‡ 1.0 0.25 0.68–0.95) 0.70–1.04) 0.80–1.26) 0.95–1.20) (95% ДИ) Примечания. *Сердечнососудистые события включали нефатальный инфаркт миокарда, нефатальный инсульт, смерти от коронарной болезни сердца, смерти от инсульта. ОР для женщин в каждой категории частоты применения по отношению к категории «не принимали (никакие)». †Многовариантный относительный рик (ОР) поправка на возраст, наличие инфаркта миокарда у родителей в возрасте до 60 лет (да или нет), наличие диабета (да или нет), гиперхолестеринемии (да или нет), курения (никогда, в прошлом, в настоящее время), индекс массы тела (22, 22–24.9, 25–26.9, 27–29.9, ≥30), регулярная умеренная или высокая физическая активность r (1.7, 1.7– 4.5, 4.6 –10.5, 10.6 –22.1, and ≥22.1 метаболических эквивалентов в неделю metabolic equivalent task score per week), использование гормонов в постменопаузе postmenopausal hormone use (пременопауза, никогда, в прошлом, в настоящее время), прием мультивитаминов в настоящее время (да или нет), стандартизованные по энергии квинтили потребления фолата (с питанием и как добавка), омега-3 жирных кислот, насыщенного жира, потребления алкоголя (0, 0.1– 4.9, 5.0 –14.9, ≥15 g/d), и аналгетиковдругих категорий. ‡ Многовариантный относительный рик (ОР) с поправкой на перечисленные выше факторы плюс наличие гипертонии (да или нет). Применение высокой нагрузочной дозы клопидогреля до коронарного стентирования в ранние сроки острого инфаркта миокарда без стойких подъемов сегмента ST на ЭКГ. Результаты исследования ISAR-REACT 2. Подготовил И.С. Явелов. В ряде клинических испытаний, выполненных объединением исследователей Внутрикоронарное стентирование и антитромботический режим (Intracoronary Stenting and Antithrombotic Regimen – ISAR), было показано, что блокатор гликопротеинов (БГП) IIb/IIIа тромбоцитов абциксимаб не приносит дополнительной пользы при применении высокой нагрузочной дозы клопидогреля (600 мг) как минимум за 2 часа до планового чрескожного коронарного вмешательства (преимущественно стентирования) у больных с низким и умеренным риском тромботических осложнений, наличием сахарного диабета, а также при вмешательстве на сосудах малого диаметра (≤2,5 мм) [1-4]. Вместе с тем, в эти исследования не включались больные с обострениями коронарной болезни сердца, у которых можно ожидать максимальной пользы от введения БГП IIb/IIIa. Цель многоцентрового рандомизированного двойного слепого плацебоконтролируемого исследования Внутрикоронарное стентирование и антитромботический режим: быстрое раннее воздействие при коронарном лечении 2 (Intracoronary Stenting and Antithrombotic Regimen: Rapid Early Action for Coronary Treatment 2 – ISAR-REACT 2) заключалась в оценке целесообразности применения БГП IIb/IIIa абциксимаба при стентировании в ранние сроки острого коронарного синдрома без стойких подъемов сегмента ST на ЭКГ (ОКСБПST) у больных высокого риска, получивших перед вмешательством высокую нагрузочную дозу клопидогреля [5]. Материал и методы. В исследование включались больные с затяжным (>20 минут) или возобновляющимися приступами стенокардии в покое или при минимальной физической нагрузке в предшествующие 48 часов в сочетании с повышенным уровнем сердечного тропонина Т (>0,03 мкг/л) или/и появившимися депрессиями сегмента ST на ЭКГ или/и преходящими (<20 минут) подъемами сегмента ST на ЭКГ или/и блокадой ножки пучка Гиса. Необходимым условием являлось также наличие стенозов в коронарных артериях или венозных шунтах, при которых требуется чрескожное коронарное вмешательство. К основным критериям невключения относили повышенный риск кровотечений (инсульт в предшествующие 3 месяца, продолжающееся кровотечение, геморрагический диатез, травма или крупная операция в ближайший месяц, подозрение на расслоение аорты), не снижающееся систолическое АД 180 мм рт.ст., гемоглобин <100 г/л или гематокрит <34%, содержание тромбоцитов в крови <100 или >600103 в 1 мкл. Коронарное стентирование рекомендовалось выполнять в пределах 6 часов после постановки диагноза. Как минимум за 2 часа до вмешательства больные должны были получить 500 мг аспирина (внутрь или внутривенно) и 600 мг клопидогреля внутрь. Данных об особенностях использования гепарина в эти сроки заболевания нет. После коронарной ангиографии и принятия решения о необходимости стентирования, но до введения проводника в область стеноза больные рандомизировались к введению БГП IIb/IIIa абциксимаба или плацебо. Такой подход с одной стороны способствовал отбору больных достаточно высокого риска, которые наверняка подвергнутся инвазивному вмешательству, с другой мог сказаться на эффективности БГП IIb/IIIa, поскольку промежуток времени между началом их использования и процедурой был сравнительно небольшим. Абциксимаб вводился внутривенно болюсом 0,25 мг/кг с последующей инфузией 0,125 мкг/кг/мин (максимально 10 мкг/мин) на протяжении 12 часов в сочетании с внутривенным болюсом нефракционированного гепарина 70 ЕД/кг. В группе плацебо размер болюса нефракционированного гепарина составлял 140 ЕД/кг. При этом контроля активированного времени свертывания крови не проводилось и введения дополнительных болюсов нефракционированного гепарина не предусматривалось. В последующем все больные получали аспирин в дозе 200 мг/сут неопределенно долго в сочетании с клопидогрелем 75 мг 2 раза/сут до выписки, но не дольше 3-х суток, затем 75 мг/сут на протяжении как минимум 6 месяцев. Первичной конечной точкой являлась сумма случаев смерти, инфаркта миокарда (ИМ) и повторного инвазивного вмешательства на том же сосуде из-за возобновившейся ишемии миокарда в течение 30 суток. ИМ после процедуры диагностировали на основании появления новых патологических зубцов Q на ЭКГ, а также изменений активности МВ фракции креатинфосфокиназы в крови (при ее недоступности разрешалось использовать общую креатинфосфокиназу). Для постановки диагноза было необходимо выявить повышение активности этого фермента 3 раз выше верхней границы нормы после чрескожного коронарного вмешательства или 50% от максимального значения до рандомизации в случаях, когда уровень фермента в крови до рандомизации оставался повышенным. В качестве вторичных конечных точек рассматривали частоту крупных и мелких кровотечений во время госпитализации. Результаты. Рандомизировано 2022 больных (средний возраст 66 лет, уровень сердечного тропонина Т повышен у 52%, среднее время от приема нагрузочной дозы клопидогреля до вмешательства - 6,1 часа). Почти у всех больных было выполнено коронарное стентирование (97%; у остальных баллонная ангиопластика), в половине случаев (49%) использовались стенты, выделяющие антипролиферативные вещества. При выписке статины получали 92% больных, бета-адреноблокаторы 94%, ингибиторы ангиотензинпревращающего фермента 88%. Сумма случаев смерти, ИМ и повторного инвазивного вмешательства на том же сосуде из-за возобновившейся ишемии миокарда в ближайшие 30 суток в группе абциксимаба составляла 8,9%, в группе плацебо - 11,9% (относительный риск [ОР] 0,75; 95% границы 95% доверительного интервала [ДИ] 0,58-0,97; р=0,03). Снижение риска этих событий произошло преимущественно за счет более редкого возникновения смерти или ИМ у получавших абциксимаб (8,6 против 11,5%; ОР 0,75; 95% ДИ 0,57-0,97). Различие было достигнуто за счет подгруппы больных с повышенным уровнем сердечного тропонина Т до вмешательства, в которой частоты суммы указанных событий составляли 13,1% у получавших абциксимаб и 18,3% у получавших плацебо (ОР 0,71; 95% ДИ 0,54-0,95; р=0,02). У больных без исходного повышения тропонина Т частоты неблагоприятных исходов у получавших абциксимаб и плацебо были одинаковыми (4,6%). Существенных различий в эффективности вмешательства у больных с сахарным диабетом и без него, а также при приеме клопидогреля менее и более чем за 3 часа до процедуры, не было. Достоверных различий по частоте кровотечений и необходимости в переливании крови между группами не было. Тяжелая тромбоцитопения (<20103 в 1 мкл) отмечена только в группе абциксимаба (8 случаев; в сравнении с плацебо р=0,008). Выводы. Применение абциксимаба в дополнение к аспирину и введению нефракционированного гепарина во время процедуры обеспечивает уменьшение частоты серьезных осложнений после раннего выполнения коронарного стентирования у больных высокого риска с острым коронарным синдромом без стойких подъемов сегмента ST на ЭКГ, получивших 600 мг клопидогреля как минимум за 2 часа до инвазивного вмешательства. При этом положительное воздействие абциксимаба распространяется только на больных ИМ без стойких подъемов сегмента ST на ЭКГ, выявленных на основании повышения уровня сердечного тропонина Т в крови. Эффективность комбинации клопидогрель и аспирин в предупреждении атеротромботических событий у стабильных больных. Результаты испытания CHARISMA. Добавление клопидогреля к аспирину увеличивает эффективность антитромбоцитарной терапии при обострении коронарной болезни сердца (КБС) или при остром повреждении стенки артерии во время внутрисосудистых вмешательств. Однако неизвестно, превосходит ли комбинация клопидогрель аспирин эффективность одного аспирина у больных со стабильным течением КБС и у людей с множественными факторами риска, которым показана «агрессивная» первичная (в отношении симптоматического заболевания) профилактика. На сессии Американской Коллегии Кардиологов 2006 г. доложены результаты крупного международного испытания CHARISMA, которое было специально спланировано для того, чтобы дать ответ на этот вопрос. Одновременно результаты испытания были опубликованы в Медицинском Журнале Новой Англии. Далее приводится перевод резюме этой публикации. «Предпосылки. Двойная антитромбоцитарная терапия клопидогрелем в сочетании с низкой дозой аспирина не изучалась на больших группах людей (пациентов) с высоким риском атеротромботических событий. Методы. Мы в случайном порядке распредилили 15603 пациентов или с клинически явным сердечно-сосудистым заболеванием или с множественными факторами риска [табл. 1, 2] к получению клопидогреля (75 мг в сут) плюс низкая доза аспирина (75 до 162 мг в день) или плацебо плюс низкая доза аспирина и наблюдали за ними на протяжении 28 месяцев (медиана продолжительности наблюдения). Первичной конечной точкой для оценки эффективности было наступление следующих событий: инфаркта миокарда, инсульта, или смерти от сердечно-сосудистых причин. Результаты [табл. 3 и рис.]. Частота возникновения первичной конечной точки была 6.8% при применении клопидогреля в сочетании с аспирином и 7.3% при применении плацебо в сочетании с аспирином (относительный риск 0.93; 95% доверительный интервал 0.83-1.05; р = 0.22). Соответствующие частоты основной вторичной конечной точки, которая включала еще и госпитализации из-за ишемических событий, были 16.7% и 17.9% (относительный риск 0.92; 95% доверительный интервал 0.86 до 0.995; р = 0.04). Частоты тяжелых кровотечений составили 1.7% и 1.3% (относительный риск 1.25; 95% доверительный интервал от 0.97 до 1.61%; р = 0.09). Частоты первичной конечной точки среди пациентов с множественными факторами риска были 6.6% на клопидогреле и 5.5% на плацебо (относительный риск, 1.2; 95% доверительный интервал, 0.91 до 1.59; р = 0.20). Частота случаев смерти от сердечно-сосудистых причин также была большей на клопидогреле (3.9% vs. 2.2%, р = 0.01). В подгруппе с клинически явным атеротромбозом частоты [возникновения первичной конечной точки] были 6.9% на клопидогреле и 7.9% на плацебо (относительный риск, 0.88; 95% доверительный интервал, 0.77 to 0.998; р = 0.046). Заключение. В этом испытании получено указание на пользу лечения клопидогрелем у больных с симптоматическим атеротромбозом и вред - у пациентов с множественными факторами риска. В целом клопидогрель в сочетании с аспирином не был достоверно более эффективным, чем один аспирин в отношении уменьшения частоты возникновения инфаркта миокарда, инсульта, или смерти от сердечнососудистых заболеваний». Таблица 1. Характеристика включенных пациентов Плацебо плюс аспирин Число больных (%) Клопидогрель плюс аспирин Больные с множественными факторами риска атеростромбоза Основные факторы риска Диабет типа 1 или 2 (на терапии лекарствами) Диабетическая нефропатия Индекс лодыжка-плечо <0.9 Бессимптомный стеноз сонной артерии ≥70% диаметра просвета ≥1 бляшки в сонной артерии по данным измерения толщины интимы-медии Прочие факторы риска Систолическое артериальное давление ≥150 мм рт ст, несмотря на терапию не менее 3 мес Первичная гиперхолестеринемия 1659 1625 1535 (92.5) 1360 (82.0) 716 (43.2) 94 (5.7) 1490 (91.7) 1295 (79.7) 687 (42.3) 92 (5.7) 123 (7.4) 132 (8.1) 198 (11.9) 213 (13.1) 1474 (88.8) 1454 (89.5) 809 (48.8) 744 (45.8) 993 (59.9) 1030 (63.4) Курение в настоящем >15 сигарет/сут Возраст ≥65 лет у мужчин, ≥70 лет у женщин Больные с установленным сердечно-сосудистым заболеванием Документированная коронарная болезнь Стенокардия с документированной многососудистой коронарной болезнью Перенесенные многососудистые чрескожные коронарные вмешательства Перенесенные многососудистые операции шунтирования коронарных артерий Инфаркт миокарда в предшествующие 5 лет Документированное заболевание мозговых сосудов Преходящая ишемическая атака в предшествующие 5 лет Ишемический инсульт в предшествующие 5 лет Документированное симптоматическое заболевание периферических артерий Перемежающаяся хромота в настоящее время и индекс лодыжка-плечо ≤0.85 Перемежающаяся хромота в прошлом и перенесенное вмешательство (такое как ампутация, периферическое шунтирование, или ангиопластика) 284 (17.1) 841 (50.7) 271 (16.7) 853 (52.5) 6062 6091 2892 (47.7) 2943 (48.3) 888 (14.6) 885 (14.5) 398 (6.6) 434 (7.1) 736 (12.1) 733 (12.0) 1903 (31.4) 2157 (35.6) 617 (10.2) 1634 (27.0) 1943 (31.9) 2163 (35.5) 616 (10.1) 1611 (26.4) 1418 (23.4) 1420 (23.3) 885 (14.6) 892 (14.6) 835 (13.8) 801 (13.2) Таблица 2. Сопутствующее лечение (с сокращениями) Клопидогрель Плацебо плюс аспирин плюс аспирин (n=7802) (n=7801) Число больных (%) Лечение Аспирин 7775 (99.7) 7777 (99.7) Испытуемое лекарство 7775 (99.7) 7777 (99.7) Диуретики 3757 (48.2) 3671 (47.1) Нитраты 1812 (23.2) 1877 (24.1) Антагонисты кальция 2866 (36.7) 2879 (36.9) Бета-блокаторы 4292 (55.0) 4344 (55.7) Блокаторы рецепторов к ангиотензину II 1990 (25.5) 2020 (25.9) Рамиприл 1387 (17.8) 1424 (18.3) Другие ингибиторы ангиотензин 3607 (46.2) 3612 (46.3) превращающего фермента Другие антигипертензивные средства 966 (12.4) 968 (12.4) Статины 5991 (76.8) 6001 (76.9) Другие липид-снижающие средства 1114 (14.3) 1094 (14.0) Антидиабетические лекарства 3259 (41.8) 3237 (41.5) Инсулин 1360 (17.4) 1334 (17.1) Рис. CHARISMA. Частота возникновения первичной и вторичной конечной точки Первичная конечная точка инфаркт миокарда, инсульт, смерть от сердечно-сосудистых причин (%) Плацебо Клопидогрель Месяцы Вторичная конечная точка инфаркт миокарда, инсульт, смерть от сердечно-сосудистых причин, госпитализации из-за ишемических событий (%) Плацебо Клопидогрель Месяцы Bhatt DL et al. NEJM 2006; 354. www.nejm.org Таблица 3. Результаты (составные и индивидуальные первичные и вторичные конечные точки) Конечная точка Конечные точки оценки эффективности Первичная конечная точка при оценке эффективности Смерть от любой причины Смерть от сердечнососудистых причин Инфаркт миокарда (нефатальный) Ишемический инсульт (нефатальный) Инсульт (нефатальный) Вторичная конечная точка при оценке эффективности Госпитализации из-за нестабильной стенокардии, преходящие ишемические атаки, или процедуры реваскуляризации Конечные точки оценки безопасности Клопидогрель Плацебо Относительный плюс аспирин плюс аспирин риск (95% ДИ) (n = 7802) (n = 7801) Число больных (%) р 534 (6.8) 573 (7.3) 0.93 (0.83–1.05) 0.22 371 (4.8) 374 (4.8) 0.99 (0.86–1.14) 0.90 238 (3.1) 229 (2.9) 1.04 (0.87–1.25) 0.68 147 (1.9) 159 (2.0) 0.92 (0.74–1.16) 0.48 132 (1.7) 160 (2.1) 0.82 (0.66–1.04) 0.10 149 (1.9) 185 (2.4) 0.80 (0.65–0.997) 0.05 1301 (16.7) 1395 (17.9) 0.92 (0.86–0.995) 0.04 866 (11.1) 957 (12.3) 0.90 (0.82–0.98) 0.02 Тяжелые кровотечения Кровотечения, приведшие к смерти Первичные внутричерепные кровоизлияния Умеренные кровотечения 130 (1.7) 104 (1.3) 1.25 (0.97–1.61) 0.09 26 (0.3) 17 (0.2) 1.53 (0.83–2.82) 0.17 26 (0.3) 27 (0.3) 0.96 (0.56–1.65) 0.89 164 (2.1) 101 (1.3) 1.62 (1.27–2.10) <0.001 Некоторые дополнительные сведения. «Симптоматическими» были названы больные, включенные из-за наличия документированного сердечнососудистого заболевания. Термином «бессимптомные» обозначены пациенты без документированного сердечнососудистого заболевания, включенные в связи с наличием множественных «атеротромботических факторов риска». Однако среди последних были больные, сообщившие о перенесенных сердечнососудистых событиях: инфарктах миокарда (10.4%), инсультах (5.8%), преходящих нарушениях мозгового кровообращения - преходящих ишемических атаках (5.2%), чрезкожных коронарных вмешательствах (7.7%), операциях коронарного шунтирования (9.8%). Это делает выделение подгрупп с «симптоматическим» и «асимптомным» атеротромбозом достаточно условным. Из комментария к публикации результатов CHARISMA. Комментарий написан M.A.Pfeffer и J.A.Jarcho [2]. Его авторы заключают, что испытание не выявило достоверной пользы от длительной терапии клопидогрелем в дополнение к аспирину. «Отсутствие же такой пользы в отношении клинических исходов, в сочетании с повышенной частотой кровотечений (также как и с экономическими соображениями, связанными с длительным использованием клопидогреля), дает ясный ответ на центральный вопрос испытания и является доводом против использования двойной антитромбоцитарной терапии в этой популяции больных» (т.е. «больных с установленным заболеванием коронарных, церебральных, или периферических артерий или с множественными факторами риска атеротромбоза») [2]. Авторы комментария считают методически неправильными попытки выделить на основании анализа отдельных подгрупп в CHARISMA состояния, при которых применение клопидогреля может оказаться целесообразным. По их мнению, чтобы определить такие состояния потребуется найти какие то «генотипические или фенотипические (патофизиологические) характеристики» для выявления гомогенных групп больных, у которых можно ожидать эффекта от конкретной антитромбоцитарной терапии, и уже на них осуществить «персонализованные» испытания этой терапии. Но пока следует «не поддаваться харизме вытягивания благоприятных значений Р из подгрупп и избегать двойной антитромбоцитарной терапии у пациентов со стабильным заболеванием» [2]. Результаты CHARISMA не распространяются на состояния, при которых целесообразность применения клопидогреля была доказана ранее. В связи с тем, что результаты CHARISMA могут быть восприняты многими как предлог для немедленного отказа от дорогостоящего лечения, крупнейшие кардиологические организации - Американская Ассоциация Сердца, Американская Коллегия Кардиологов, Европейское Кардиологическое Общество – выпустили специальные краткие заявления [3-4]. Суть их заключается в том, что полученные в CHARISMA данные не являются основанием для прекращения больными КБС применения комбинации клопидогрель-аспирин по ранее установленным показаниям – после имплантации стентов и после перенесенного острого коронарного синдрома без подъемов сегмента ST. Результаты испытания ASTEROID. Pronounced Lowering of Low Density Cholesterol Combined With Elevation of High Density Cholesterol Was Associated With Reduction of Coronary Atheroma. Results of ASTEROID Trial. «Для определения влияния наблюдавшихся изменений на клинические исходы требуются дальнейшие исследования» (Further studies are needed to determine the effect of the observed changes on clinical outcome). S.E.Nissen и савт. [1] На очередной сессии Американской Коллегии Кардиологов доложены результаты испытания ASTEROID. Одновременно они были опубликованы в Журнале Американской Ассоциации Сердца [1]. Это испытание, выполненное на больных коронарной болезнью сердца, подтвердило результаты REVERSAL о благоприятном действии агрессивного режима гиполипидемической терапии на атеросклеротический процесс в коронарной артерии [2]. Кроме того, в нем с помощью внутрисосудистого ультразвукового исследования получены данные, согласно которым выраженное снижение холестерина липопротеинов низкой плотности (ХСЛНП) на срок, превышающий длительность REVERSAL на ¼, в сочетании с существенным повышением холестерина липопротеинов высокой плотности (ХСЛВП) может привести к уменьшению выраженности атеромы в коронарной артерии. Однако испытание не было контролированным. Ниже приводится перевод резюме публикации результатов ASTEROID. «Контекст. Предшествующие внутрисосудистые ультразвуковые испытания продемонстрировали замедление или прекращение прогрессирования атеросклероза при применении терапии статинами, но не предоставили убедительных свидетельств регрессии при использовании процентного объема атеромы (ПОА) - наиболее строгой характеристики прогрессирования или регрессирования заболевания, получаемой при с помощью внутрисосудистого ультразвука (ВСУЗ). Цель. Оценить, способна ли очень интенсивная терапия статином вызвать регрессию коронарного атеросклероза по данным визуализации с помощью ВСУЗ. План и проведение исследования. Проспективное открытое ослепленное в отношении конечных точек испытание (Исследование для Оценки Эффекта Розувастатина на Определенную Внутрисосудистым Ультразвуком общую Нагрузку Атеромой) выполнено в 53 коммунальных и третичных медицинских центрах в США, Канаде, Европе и Австралии. Моторизованное извлечение ВСУЗ было использовано для оценки «нагрузки» атеромой в исходном состоянии и через 24 месяца лечения. Каждая пара исходных и полученных в конце наблюдения оценок была проанализирована вслепую. Больные [рис.]. Между ноябрем 2002 года и октябрем 2003 года 507 больных были подвергнуты исходному ВСУЗ обследованию и они получили, по крайней мере, 1 дозу исследуемого лекарства. Через 24 месяца у 349 больных получены поддающиеся измерению (оценке) серийные ВСУЗ изображения. ASTEROID – больные скринированные, получавшие розувастатин, двукратно обследованные, и действительно включенные в анализ Скринированы 1183 больных 676 – не включены (не отвечали критериям включения/соответствовали критериям исключения). 507 получили хотя бы одну дозу исследуемого лекарства 125 вышли из исследования во время лечения 14 потеряны для наблюдения 2 выведены исследователями 63 нежелательных явления 32 отозвали согласие 3 нарушения протокола 11 прочие причины 382 закончили фазу лечения 33 заключительное ВСУЗ исследование не выполнено или не поддавалось оценке 13 не подвергнуты заключительному обследованию 20 результаты заключительного обследования не поддавались оценке. 349 получены данные парных ВСУЗ исследований 349 парных исследований включено в анализ нормализованного объема атеромы 319 парных исследований включено в анализ 10 мм сегментов с наибольшей выраженностью заболевания 30 исключены (отсутствовали 8 поддающихся оценке последовательных сечений) S.E.Nissen et al, JAMA 2006; 295: jama.ama-assn.org Рис. Больные скринированные, получившие розувастатин, двукратно обследованные, и действительно включенные в анализ. Объектом анализа стали данные 69% (сопоставление ПОА) и 63% (сопоставление подсегментов с наибольшей выраженностью заболевания) начавших лечение больных. Вмешательство. Все больные получали интенсивную терапию розувастатином, 40 мг/сут. Основной параметр оценки исходов (результатов). Два первичных параметра эффективности были определены заранее: изменения ПОА и изменения номинального объема атеромы в подсегментах артерии длиной 10 мм с наибольшей выраженностью заболевания при исходном обследовании. Также заранее была определена и вторичная переменная эффективности - изменение нормализованного общего объема атеромы для всей артерии. Результаты. Средний (стандартное отклонение - СО) исходный уровень холестерина липопротеинов низкой плотности (ЛНП-ХС) 130.4 (34.3) мг/дл снизился до 60.8 (20.0) мг/дл, среднее уменьшение - 53.2% (p<0.001). Средний исходный уровень холестерина липопротеинов высокой плотности (ЛВП-ХС) 43.1 (11.1) мг/дл возрос до 49.0 (12.6) мг/дл, увеличение на 14.7% (p<0.001) [табл.1]. Среднее изменение ПОА для всего сосуда было −0.98% (3.15%) с медианой −0.79% (97.5% ДИ −1.21% до −0.53%) (p<0.001 по отношению к исходному). Среднее (СО) изменение объема атеромы в 10 миллиметровых подсегментах с наибольшей выраженностью заболевания было −6.1 (10.1) мм3 с медианой −5.6 мм3 (97.5% ДИ −6.8 до −4.0 мм3) (p<0.001 по отношению к исходному) [табл. 2]. Изменение общего объема атеромы отразило уменьшение на 6.8% (медиана) со средним (СО) уменьшением −14.7 (25.7) мм3 и медианой уменьшения −12.5 мм3 (95% ДИ −15.1 до −10.5 мм3) (p<0 .001 по отношению к исходному). Нежелательные явления (события) были нечастыми и близкими к наблюдавшимся в других испытаниях статинов [табл. 3,4]. Заключение. При терапии статином очень высокой интенсивности с использованием розувастатина в дозе 40 мг/сут достигнуты средний ЛНП-ХС 60.8 мг/дл и увеличение ЛВП-ХС на 14%. Это привело к достоверной регрессии атеросклероза по всем трем заранее определенным ВСУЗ оценкам выраженности заболевания. Лечение до уровней ЛНП-ХС ниже установленных принятыми в настоящее время рекомендациями, если оно сопровождается существенным увеличением ЛВП-ХС, может привести к регрессии атеросклероза у больных коронарной болезнью. Для определения влияния наблюдавшихся изменений на клинические исходы требуются дальнейшие исследования». Таблица 1. Средние уровни ХС ЛНП и ЛВП - исходные и в конце испытания. ХС ЛНП ХС ЛНП во время исходный, лечения, мг/дл мг/дл (ммоль/л) (ммоль/л) Розувастатин 40 мг (n=346*) 130.4 3.38 60.8 (1.57) p <0.001 ХС ЛВП ХС ЛВП во время исходный, лечения, мг/дл мг/дл (ммоль/л) (ммоль/л) 43.1 (1.1) 49.0 (1.27) p <0.001 Среднее изменение в %, метод наименьших -53.2 +14.7 квадратов Примечание. * У 3 из закончивших испытание больных не было исходных лабораторных данных. Таблица 2. Результаты ВСУЗ исследования – исходные и в конце испытания Исходное обследование Через 24 месяца Средний процентный объем атеромы (n=349) 39.6 38.6 -0.98 - Средний объем атеромы в наиболее пораженном подсегменте длиной 10 мм3 (n=319) 65.1 59.0 -6.1 -8.5 Средний нормализованный общий объем атеромы, мм3 (n=349) 212.2 197.5 -14.7 -6.7 Параметр ВСУЗ Абсолютное Относительное изменение изменение (%) Таблица 3. Событие Смерть Инфаркт миокарда Инсульт Основные нежелательные явления Число больных (%)* 4 (0.8) 10 (2.0) 3 (0.6) Примечание: % рассчитан на 507 больных, хотя бы 1 раз получивших розувастатин. Таблица 4. Прекратившие прием лекарства из-за нежелательных событий, связанных с лечением Число больных (%)* Скелетно-мышечные жалобы (боль или слабость) Желудочно-кишечные жалобы (больль в животе или тошнота) Новообразования Повышение креатинкиназы Повышение АЛТ или билирубина Сердечно-сосудистые расстройства (стенокардия, застойная сердечная недостаточность, аритмии и другие типы ишемических событий) 19 (3.7) 2 (0.4) 2 (0.4) 2 (0.4) 2 (0.4) 22 (12.2) Примечание: % рассчитан на 507 больных, хотя бы 1 раз получивших розувастатин. Дополнительные факты. Включались только «статин-наивные» больные (согласно критерию «наивности» больные не должны были принимать статины по крайней мере в течение 3 месяцев на протяжении последнего года). Если больные получали какое-либо липид-снижающее лекарство на протяжении предшествующих 4 недель, то до включения они проходили 4-х недельный период отмывки. По первичному параметру эффективности ПОА регрессия наблюдалась у 63.6%, прогрессирование – у 34.4% больных. Доля нежелательных явлений рассчитывалась на 507 больных, хотя бы раз получивших розувастатин, а не на закончивших фазу лечения. Из обсуждения публикации. У 22 больных, которые были выведены из испытания в связи с ишемическими событиями, могло происходить прогрессирование стенозирования (они «могли представлять прогрессоров»), и это является потенциальным источником ошибки (source of bias). Несмотря на полезность ВСУЗ, продемонстрированную в нескольких испытаниях по оценке эффективности, степень, в которой документированная ВСУЗ регрессия будет транслироваться в уменьшение выраженности болезни и смертности, остается спекулятивной (предположительной) Из редакционного комментария к публикации. Публикация результатов ASTEROID сопровождена комментарием Blumenthal R.S. и Kapur N.K [2]. Они отметили следующие ограничения испытания: отсутствие контрольной группы с несколько менее интенсивным режимом снижения холестерина липопротеинов низкой плотности; отсутствие парных ультразвуковых исследований в менее измененных заболеванием коронарных сегментах для демонстрации воспроизводимости измерений объема атеромы; исключение больных с коронарными стенозами, превышающими 50% в целевом сегменте. Кроме того, по мнению комментаторов, план исследования порождает вопрос о том, не зависит ли выраженность изменений атеромы от того, получал ли больной ранее статины (т.к. в ASTEROID включались «статин-наивные» больные). Это признается особенно важным при сравнении результатов ASTEROID и REVERSAL, в котором больные могли получать липид-снижающую терапию до момента включения [2]. Дополнение. Наиболее ярко возможность регрессии стенозов коронарных артерий под влиянием комбинированной гиполипидемической терапии была продемонстрирована с помощью количественной коронарной ангиографии довольно давно [4]. Причем регрессия стенозов коррелировала не только со снижением ХСЛНП и аполипопротеина В, но и со степенью повышения ХСЛВП. В этом исследовании, которое продолжалось немногим больше ASTEROID, был отмечен и явный клинический эффект гиполипидемической терапии [4]. Недавно признаки регрессии атеросклеротических изменений в коронарных артериях больных ишемической болезнью сердца с гиперхолестеринемией уже после 12 месяцев применения симвастатина в дозе 40 мг/сут были продемонстрированы с помощью ВСУЗ L.O.Jensen с соавт., но также в неконтролированном испытании [5]. Уровень ХСЛНП в этом испытании был снижен на 42.6% (с 4.0±0.8 до 2.2±0.6 ммоль/л, P0.001). Полученные данные указывают на терапевтические возможности менее интенсивного снижения уровня липидов и, соответственно, на слабость аргумента о неэтичности контролированных испытаний статинов, которым авторы ASTEROID обосновывали отказ от группы сравнения. Именно симвастатин в дозе 40 мг/сут считали бы целесообразным использовать как вмешательство сравнения по отношению к розувастатину авторы комментария публикации ASTEROID R.S.Blumenthal и N.K.Kapur [3]. Доводы в пользу такого предложения следующие – клиническая эффективность симвастатина в дозе 40 мг/сут доказана в Исследовании Защита Сердца (HPS), после появления генериков он повсеместно становится самым распространенным лекарством группы статинов. Сравнительное испытание с розувастатином позволило бы сопоставить действие на развитие атеромы наиболее активного гиполипидемического вмешательства с вмешательством c доказанным клиническим эффектом, которое скорее всего в ближайшее время будет наиболее широко использоваться в практической медицине. Результаты отдаленного наблюдения за больными в испытании BASKET (BASKET-LATE). Подготовил И.С. Явелов. В 2005 г. были опубликованы результаты рандомизированного Базельского исследования по соотношению стоимости и эффективности стентов (Basel stent costeffectiveness trial – BASKET), выполненного на 826 последовательно поступивших больных, которым выполнялась коронарная ангиопластика со стентированием вновь возникших стенозов [1]. Показания к процедуре не имели значения для отбора больных, которые были рандомизированы в три группы: стента, выделяющего сиролимус (Cypher, n=264); стента, выделяющего паклитаксел (Taxus, n=281); металлического стента без покрытия на основе кобальта-хрома (Vision, n=281). В качестве антитромботического лечения больные получали аспирин (100 мг/сут) и клопидогрел (первоначально 300 мг, затем 75 мг/сут). Период наблюдения составлял 6 месяцев. За этот срок сумма случаев смерти, инфаркта миокарда (ИМ) и повторного инвазивного вмешательства на стентированном сосуде была достоверно меньше в группе стентов с антипролиферативным покрытием (7,2% против 12,1%, р=0,02). Существенных различий в частоте выявления совокупности этих событий между стентами, покрытыми сиролимусом и паклитакселем, не было. На ежегодной сессии Американской Коллегии Кардиологов 14 марта 2006 года были доложены результаты отдаленного наблюдения за 746 больными, вошедшими в исследование BASKET, у которых на протяжении 6-месячного наблюдения не произошло серьезных острых коронарных осложнений (исследование BASKET-LATE) [2]. У этих больных после полугодового применения клопидогрел был отменен. При анализе все больные с имплантированным стентом с антипролиферативным покрытием были объединены в одну группу. Под поздним тромбозом стента понимали тромботические осложнения, возникшие через 6 месяцев после чрескожного коронарного вмешательства. Под термином “осложнения, связанные с тромбозом” понимали тромбоз стента, подтвержденный ангиографически, внезапную сердечную смерть или инфаркт миокарда (ИМ) в области кровоснабжения стентированного сосуда. Результаты исследования BASKET-LATE представлены в таблице. Таблица. Серьезные сердечные осложнения, возникшие между 7-м и 18-м месяцами после имплантации стента. Событие Сердечная смерть Не смертельный ИМ Сердечная смерть или Не смертельный ИМ Повторное инвазивное вмешательство на стентированном сосуде в связи с рестенозом Серьезные острые коронарные осложнения Металлический стент без покрытия 0 1,3% Стент с антипролиферативным покрытием 1,2% 4,1% 0,09 0,04 1,3% 4,9% 0,01 6,7% 4,5% 0,21 7,9% 9,3% 0,53 р Проведенное изучение показало, что на протяжении года после отмены клопидогрела частота не смертельного ИМ и суммы случаев смерти и ИМ была достоверно выше у больных со стентами с антипролиферативным покрытием, чем с металлическими стентами без покрытия. При этом в группе стентов с покрытием имелась тенденция к меньшей потребности в повторных инвазивных вмешательствах в связи с рестенозом, что соответствует современным представлениям. Кривые накопления случаев повторного вмешательства на стентированном сосуде начали расходиться примерно через 4 месяца после стентирования, что также соответствует данным, полученным в других исследованиях. Однако кривые накопления суммы случаев сердечной смерти и ИМ начали расходиться примерно через 9 месяцев, когда число событий у больных со стентами без покрытия перестало увеличиваться, а в группе стентов с покрытием продолжало нарастать. “Тромботические осложнения” оказались равномерно распределены на протяжении 12 месяцев после прекращения приема клопидогрела. Согласно информации, содержащейся на сайте www.theHeart.org, M. Pfisterer, представлявший результаты исследования, отметил, что при многофакторном анализе применение стентов с антипролиферативным покрытием являлось одним из “наиболее важных” предикторов смерти или ИМ в отдаленные сроки после вмешательства. В соответствии с полученными данными применение стентов с антипролиферативным покрытием способствует меньшей частоте повторных вмешательств по поводу рестеноза ценой увеличения частоты суммы случаев смерти и ИМ в поздние сроки заболевания. Было подсчитано, что применение стентов этого типа у 100 больных сможет предотвратить примерно 5 случаев повторного вмешательства в связи с рестенозом ценой 3,3 поздних смертей или ИМ. Однако M. Pfisterer подчеркнул, что в этой части исследования наблюдались больные высокого риска, 60% которых исходно имели нестабильную стенокардию или ИМ с подъемами сегмента ST на ЭКГ. Кроме того, общее число изученных больных было слишком мало, чтобы обеспечить достаточную надежность полученного результата. Комментарий. До появления более подробного отчета о проведенном изучении судить о выявленных закономерностях и их возможных причинах не представляется возможным. Пока можно предположить, что если полученные результаты не являются случайностью и не связаны с какими-то особенностями проведенного изучения, они свидетельствуют в пользу более длительного, чем 6-ти месячное, применения клопидогрела после установки стентов, выделяющих антипролиферативные вещества. Возможно, в особой степени это относится к больным высокого риска (после перенесенного обострения коронарной болезни сердца). Результаты EXTRACT. Эффективность низкомолекулярного гепарина эноксапарина активно изучается практически при всех состояниях, при которых целесообразно использование антитромбина и считается эффективным нефракционированный гепарин (НФГ). Не стал исключением и острый коронарный синдром с подъемами сегмента ST (ОКСПST). При нем «все еще» применяется введение фибринолитиков, и их введение (во всяком случае с более фибрин-специфичными агентами – альтеплазой, ретеплазой и тенектеплазой) принято сопровождать антитромбином – пока нефракционированным гепарином. На Конгрессе Американской Коллегии Кардиологов в апреле2006 г. были доложены и одновременно опубликованы в Медицинском Журнале Новой Англии результаты испытания EXTRACT, в котором у больных ОКСПST сравнивались эноксапарин и НФГ как средства, сопровождающие фибринолитики. Ниже представлены перевод резюме и изложение публикации EXTRACT, подготовленные А.Д.Эрлихом и Н.Н.Славиной. Резюме [1]i[1]. «Предпосылки. У больных с инфарктом миокарда (ИМ) с подъемам сегмента ST на ЭКГ (П ST) в дополнение к фибринолитической терапии часто используется нефракционированный гепарин. Мы сравнили [результаты применения] с этой целью низкомолекулярного гепарина (эноксапарина) и нефракционированного гепарина. Методы. Мы случайным образом распределили 20506 больных с ИМ П ST, которым была назначена фибринолитическая терапия, к приему эноксапарина на весь период госпитализации или нефракционированного гепарина как минимум на 48 часов в дозе, зависящей от массы тела больного,. Первичной конечной точкой [при оценке] эффективности были смерть или нефатальный поторный инфаркт миокарда в течение 30 дней. composite Результаты. Первичная конечная точка имела место у 12,0% больных в группе нефракционированного гепарина и у 9,9% в группе эноксапарина (уменьшение относительного риска на 17%, р<0,001); умерли 7,5% больных, получавших нефракционированный гепарин и 6,9% получавших эноксапарин (р=0,11). Объединенные события (смерть, нефатальный реинфаркт или экстренная реваскуляризация) произошли у 14,5% больных, получавших нефракционированный гепарин и 11,7% у тех, кто получал эноксапарин (р<0,001); соответственно серьезные кровотечения произошли у 1,4% и 2,1% больных (р<0,001). Объединенные события – смерть, нефатальный реинфаркт, или нефатальное внутричерепное кровоизлияние (подсчет общего клинического преимущества) произошли у 12,2% больных, получавших н ефракционированный гепарин и у 10,1% из тех, кто получал эноксапарин (р<0,001). Заключение. У больных с ИМ П ST, получавших фибринолитическую терапию, лечение эноксапарином во время госпитализации предпочтительнее, чем лечение гепарином в течение 48 часов, но связано с повышением числа случаев серьезных кровотечений. Эти находки должны рассматриваться с учетом общей клинической пользы». Изложение статьи. Фибринолизис является наиболее распространенным методом достижения реперфузии в артерии у пациентов с инфарктом миокарда с подъемами сегмента ST ЭКГ. Согласно рекомендациям, тромболитики должны применяться совместно с аспирином и нефракционированным гепарином (НФГ) [ii[2], iii[3]]. Попытки увеличить время внутривенной инфузии нефракционированного гепарина более 48 часов после фибринолизиса не привели к снижению количества повторных реокклюзий инфарктсвязанной артерии. Кроме этого применение НФГ не совсем удобно из-за необходимости частого контроля активированного частичного тромбопластинового времени (АЧТВ) с целью поддержания степени антикоагуляции на терапевтическом уровне. Низкомолекулярные гепарины (НМГ), в частности энксапарин, являются потенциальной заменой нефракционированному гепарину. В отличие от НФГ, эноксапарин обеспечивает стабильный уровень антикоагуляции без необходимости мониторирования АЧТВ. Дополнительным преимуществом эноксапарина является возможность вводить его подкожно, и, в связи с этим, в течение более длительного времени. Исследование ExTRACT TIMI 25 (The Enoxaparin and Thrombolysis Reperfusion for Acute Myocardial Infarction Treatment) было спланировано для сравнения эффективности и безопасности эноксапарина и НФГ в качестве дополнения к применению фибринолитика у больных с инфарктом миокарда с подъемами сегмента ST на ЭКГ (ИМ П ST) [1]. МЕТОДЫ. Популяция пациентов. В период с 24 октября 2002 года по 1 октября 2005 года происходила рандомизация пациентов в 674 центрах в 48 странах. В исследование включались пациенты с ИМ П ST в первые 6 часов от начала симптомов. Протокол исследования. Все включенные пациенты получили по решению лечащего врача стрептокиназу, тенектеплазу, алтеплазу или ретеплазу. Так же они получили внутрь 150-325 мг не кишечнорастворимой формы аспирина или 500 мг аспирина внутривенно (за исключением тех, кто получил не менее 325 мг аспирина в предшествующие 24 часа). Начиная со вторых суток назначалась поддерживающая терапия аспирином 75-325 мг в день как минимум в течение 30 дней. При непереносимости аспирина, или по решению лечащего врача могли назначаться альтернативные антитромбоцитарные препараты, в частности клопидогрель. Пациенты рандомизировались к получению эноксапарина или нефракционированного гепарина в соотношении 1:1. Исследуемый препарат назначался не ранее, чем за 15 минут до и не позднее, чем через 30 минут после начала фибринолизиса, а так же не позднее, чем через 30 минут после рандомизации. Лечение было двойным слепым с применением плацебо. Введение НФГ (или его плацебо) состояло из внутривенного болюса из расчета 60 Ед на 1 кг массы тела ( но не более 4000 Ед) и последующей инфузии со скоростью 12 Ед на 1 кг массы тела (начальная скорость не более 1000 Ед/кг). Внутривенный болюс не вводился пациентам, которые «открыто» получили 4000 или более Ед НФГ в пределах 3 часов до рандомизации. Во время инфузии скорость введения НФГ менялась с целью поддержания терапевтического уровня антикоагуляции (АЧТВ на уровне в 1.5-2 раза выше нормы). Внутривенная инфузия НФГ назначалась на 48 часов, но лечение могло быть продлено по решению лечащего врача. Доза эноксапарина выбиралась в зависимости от возраста и функционального состояния почек пациента. Для больных моложе 75 лет доза эноксапарина (или его плацебо) была фиксированной. После введения внутривенного болюса (30 мг) назначались подкожные инъекции (первая в течение первых 15 минут после болюса) из расчета 1 мг на 1 кг массы тела каждые 12 часов. Внутривенный болюс не вводился пациентам старше 75 лет и пациентам, получившим «открыто» 4000 или более Ед НФГ в ближайшие 3 часа к рандомизации. У больных старше 75 лет лечение ограничивалось подкожным введением эноксапарина в сниженной дозе (0.75 мг на 1 кг массы тела) каждые 12 часов. Больные, у которых клиренс креатинина составлял менее 30 мл/мин., получали эноксапарин в дозе 1 мг на 1 кг массы тела каждые 24 часа [11]. Двойное слепое лечение эноксапарином (или его плацебо) продолжалось в течение 8 суток или до выписки из стационара («что наступит раньше»). Протокол исследования рекомендовал отложить элективные (т.е. не экстренные) процедуры чрескожных вмешательств на коронарных артериях (ЧКВ) как минимум на 48 часов после рандомизации. Наблюдение за больными с регистрацией конечных точек продолжалось в течение 30 дней. Конечные точки. Основная конечная точка была определена как сумма случаев смерти от любой причины и нефатальных инфарктов миокарда в течение 30 дней после рандомизации. Вторичная конечная точка включала в себя вышеперечисленные события и повторную ишемию миокарда, потребовавшую неотложной реваскуляризации. Были выделены так же три конечные точки, отражающие «общую клиническую эффективность». Первая - сумма случаев смерти, нефатальных инфарктов миокарда и нефатальных крупных кровотечений, вторая - сумма случаев смерти, нефатальных инфарктов миокарда и нефатальных внутричерепных кровотечений, третья - сумма смертей, нефатальных инфарктов миокарда и нефатальных инсультов. РЕЗУЛЬТАТЫ. Рандомизировано 20506 больных, из которых 20479 были действительно подвергнуты лечению. Исходные характеристики у групп не отличались. 99.7% больных получили фибринолитик (79.5% - фибрин-специфичный препарат, 20.2% - стрептокиназу). Медиана времени от начала симптомов до начала введения фибринолитика составила 3.2 часа. Открытое введение НФГ в течение 3 ч, предшествующих рандомизации, получили 15,8% больных; 0,5% получили НМГ в предшествующие рандомизации 7 дней. Медиана введения эноксапарина составила 7 дней, а введение НФГ – 2 дня. Медиана длительности госпитализации – 10 дней (7-17 дней). 74,3% больных для лечения ИМ получали только медикаментозную терапию, а 20,2% - ЧКВ. Первичная конечная точка произошла у 12,0% больных, получавших НФГ и у 9,9% больных, получавших эноксапарин - уменьшение относительного риска (ОР) на 17%; р<0,001. Было получено значительное преимущество эноксапарина в подгруппе больных, получивших инвазивное лечение (снижение ОР на 23%) и у больных, лечившихся медикаментозно (снижение ОР на 16%) за 30 дней (р=0.33 для различий между группами консервативного и инвазивного лечения). Преимущество лечения эноксапарином проявилось уже в первые 48 часов наблюдения: за это время снижение относительного риска нефатального ИМ составило 33% (р=0.002). Кроме этого, в группе эноксапарина было достоверно меньше эпизодов повторной ишемии, потребовавшей экстренной ЧКВ ( 2,8% и 2,1% в группах НФГ и эноксапарина соответственно, р<0.001). При анализе подгруппы больных, получивших тромболитическую терапию стрептокиназой, достоверной разницы между группами эноксапарина и НФГ в отношении первичной конечной точки за 30 дней выявлено не было (рис.). Первичная конечная точка в разных подгруппах Подгруппа Пол Муж. Жен. Возраст 75 лет ≥75 лет Локализация инфаркта Передняя Прочая Диабет Есть Нет Перенесенный ИМ Есть Нет Число больных Относительный риск Конечные точки ЭноксаНФГ парин % % Уменьшение риска Фибрино- Стрептокиназа Фибрин-спелитик цифический Время до лечения медианы ≥ медианы Эноксапарин лучше НФГ лучше Antman EM, Morrow DA, McGabe C. et al. NEJM 2006; 354, www.nejm.org Безопасность. Частота серьезных кровотечений за 30 дней в группе эноксапарина была 2.1%, а в группе НФГ - 1.4% (абсолютное повышение риска на 0.7%; повышение ОР - 53%; р<0.001). Частота внутричерепных кровотечений составила 0.8% в группе эноксапарина и 0.7% в группе НФГ (р=0.14). Общая Клиническая Эффективность. Частота всех трех конечных точек, определяющих клиническую эффективность к 30 дню была достоверно меньшей в группе эноксапарина. ОБСУЖДЕНИЕ. Результаты исследования ExTRACT-TIMI-25 показывают, что у больных с ИМ П ST, подвергнутых тромболизису, лечение эноксапарином в течение 7 дней превосходит рекомендованную в настоящее время лечебную стратегию – инфузию НФГ в течение 48 часов. Длительное применение эноксапарина вместо кратковременного введения НФГ у 1000 больных с ИМ П ST может предотвратить 15 нефатальных ИМ, 7 случаев экстренной реваскуляризации, 6 смертей, но добавить 4 дополнительных нефатальных серьезных кровотечения (без увеличения числа нефатальных внутричерепных кровотечений). Важно отметить, что эффект эноксапарина проявляется довольно рано – частота вторичных конечных точек была меньшей у больных, получавших эноксапарин уже в первые 48 часов. ЗАКЛЮЧЕНИЕ ПУБЛИКАЦИИ. У больных с ИМ П ST, получавших фибринолитическую терапию, лечение эноксапарином за время госпитализации предпочтительнее, чем лечение гепарином в течение 48 часов, но связано с повышением числа случаев серьезных кровотечений. Эти находки должны рассматриваться с учетом общего клинического преимущества. Комментарий. Значение общего результата ExTRACT-TIMI-25 для стран в с низкой частотой использования фибрин-специфичных агентов (например, для России) очевидно невелико, учитывая отсутствие преимуществ эноксапарина в подгруппе больных EXTRACT, леченных стрептокиназой. Тем более, что в настоящее время вообще нет убедительных доказательств необходимости применения антитромбинов в дополнение к стрептокиназе – единственному более или менее широко доступному фибринолитику в России. Соотношения риска и эффективности омега-3 жиров на смертность, сердечно-сосудистые заболевания и рак: систематический обзор. Подготовлено Н.А. Ваулиным Новый метаанализ, появившийся в конце апреля на страницах British Medical Journal, посвящен роли омега-3 жирных кислот в риске развития осложнений атеросклероза и оценке потенциальных негативных эффектов этого пищевого компонента. В отличие от ряда предыдущих работ с обнадеживающими результатами (по крайней мере для ЖК с длинными цепочками), в настоящем анализе не получено отчетливых доказательств эффективности этих веществ. Это в очередной раз показывает, что первоначальное оптимистичное мнение о безусловной пользе от добавления в пищу омега-3 ЖК еще требует серьезных доказательств. Цель работы: Систематический обзор доказательств эффективности длинно- и короткоцепочечных омега-3 жирных кислот (ЖК) на смертность и частоту сосудистых заболеваний и рака.. Источники данных: Поиск по электронным базам данных до 2002 года. Контакты с авторами работ и поиск в библиографических ссылках в публикациях многоцентровых испытаний. Методы: Обзор многоцентровых работ по применению омега-3 ЖК у взрослых на протяжении 6 и более месяцев (независимо от наличия или отсутствия факторов риска). Эпидемиологические исследования с примерно известным потреблением омега-з ЖК и использование клинических конечных точек так же включались в анализ. Проверка критериев включения, занесение данных и оценка качества собранной информации осуществлялась независимо в дубликатах. Результаты: Изучено 15 159 названий работ и абстрактов. Из них отобрано и изучено 48 контролируемых исследований (общее число участников - 36 913) и 41 эпидемиологическая работа. Результаты оказались неубедительными. Оценка совокупности данных не показала какого либо значимого снижения риска общей смертности (относительный риск 0,87 при 95%ДИ[0,73 - 1,03] ) или комбинированного риска развития сердечнососудистого заболевания (относительный риск 0,95 при 95%ДИ[0,82 - 1,12) на фоне активного употребления омега-3 ЖК. В нескольких рандомизированных испытаниях с большей степенью объективности не выявлено эффекта ЖК на общую смертность (относительный риск 0,98 при 95%ДИ от 0,70 до 1,36) и на сердечно-сосудистые события в целом (относительный риск 1,09 при 95%ДИ [0,87 - 1,37]). В метаанализе, при выделении подгруппы работ с применением длинноцепочечных омега-3 ЖК, вновь не было отмечено снижения ни общей смертности, ни сердечно-сосудистых событий (ОР 0.86 при ДИ [0.70 - 1.04], 138 событий и ОР 0.93 при ДИ [0.79 - 1.11]) соответственно)). Риск развития рака так же не увеличивался ни в рандомизированных (ОР-1.07 при ДИ[0.88 - 1.30]), ни в эпидемиологических исследованиях ( ОР-1.02, при ДИ[0.87 - 1.19]). Тем не менее клинически важные побочные эффекты полностью исключить нельзя. Заключение: Омега-3 ЖК с длинными и короткими цепочками не оказывают явного эффекта на общую смертность, на комбинацию основных сердечно-сосудистых событий и заболеваемость раком, Использование селективных к циклооксигеназе-2 нестероидных противовоспалительных средств первого и второго поколения и риск острого инфаркта миокарда. В журнале Circulation опубликована статья, содержащая очередное указание на то, что повышение риска возникновения инфаркта миокарда является свойством класса ингибиторов циклооксигеназы 2 [1]. Ниже приводятся переводы резюме этой статьи и раздела «Клиническая перспектива», обычно сопровождающего публикации оригинальных исследований в Circulation. «Предпосылки. Сердечнососудистая безопасность избирательных по отношению к циклооксигеназе-2 (ЦОГ-2) нестероидных противовоспалительных средств (НПВС) привлекла пристальное внимание после отзыва рофекоксиба и прекращения испытания Предупреждение Аденомы Целекоксибом. Увеличивают ли сердечно-сосудистый риск более новые ингибиторы ЦОГ-2 второго поколения (эторикоксиб, вальдекоксиб) неизвестно. Методы и результаты. Мы предприняли исследование случай-контроль в когорте из 486378 человек, зарегистрированных в Исследовательской базе данных общей практики Соединенного Королевства, которым был выписан по крайней мере 1 рецепт на НПВС между 1 июня 2000 года и 31 октября 2004 года. Всего 3643 случая острого инфаркта миокарда (ОИМ) были сопоставлены с 13918 контрольными пациентами, подобранными к «случаям» по возрасту, полу, году регистрации в когорте (году ввода в нее) и [принадлежности к конкретной] общей практике. Были рассчитаны отношения частот возникновения острого инфаркта миокарда, ассоциированного с использованием селективных ЦОГ-2 и неселективных НПВС. Текущее использование [т.е. продолжающийся прием после применения на протяжении предшествовавшего года] эторикоксиба ассоциировалось с увеличением в 2.09 раза (95% доверительный интервал – ДИ - 1.10-3.97) риска ОИМ по сравнению с отсутствием применения НПВС на протяжении предшествовавшего года. Текущее применение рофекоксиба (относительный риск - ОР = 1.29, 95%ДИ 1.02 - 1.63), целекоксиба (ОР=1.56; 95% ДИ, 1.22 - 2.00), и диклофенака (ОР=1.37; 95% ДИ, 1.17 - 1.59) также достоверно увеличивали риск острого инфаркта миокарда. Для использования в настоящее время вальдекоксиба ОР был 4.60 (95% ДИ, 0.61 - 34.51). Величины относительного риска возрастали при применении более высоких доз ингибиторов ЦОГ-2. Причем они были повышенными и у пациентов без основных сердечнососудистых факторов риска.. Заключение. Результаты нашего исследования поддерживают гипотезу, что повышенный риск ОИМ является эффектом класса ингибиторов ЦОГ-2. Увеличение риска представляется зависящим от дозы, но для подтверждения этой гипотезы необходимо дальнейшее накопление данных». Клиническая перспектива. «ЦОГ-2-селективные нестероидные противовоспалительные средства были созданы для того, чтобы свести до минимума частоту возникновения нежелательных желудочнокишечных событий. Данные, недавно полученные в плацебо контролированных исследованиях по предупреждению аденом толстой и прямой кишок колоректальных аденом вызвали озабоченность сердечнососудистой безопасностью ингибиторов ЦОГ-2. В этих исследованиях было показано, что рофекоксиб и целекоксиб увеличивают риск сердечнососудистых событий. Сведения о сердечнососудистой безопасности еще более избирательных ингибиторах ЦОГ-2, так называемых ингибиторах ЦОГ-2 второго поколения, немногочисленны. Основная цель этого исследования случай-контроль - изучить риск острого инфаркта миокарда, сопровождающий применение ингибиторов ЦОГ-2 первого и второго поколения. Использование ингибитора ЦОГ-2 второго поколения эторикоксиба ассоциировалось с двукратно повышенным риском острого инфаркта миокарда. Увеличенный риск наблюдался также и при использовании ингибиторов ЦОГ-2 рофекоксиба и целекоксиба. Это соответствует гипотезе, что повышенный риск ОИМ является эффектом класса ингибиторов ЦОГ-2. Риск был повышен (увеличен) и у пациентов, не имевших основных сердечнососудистых факторов риска (коронарной болезни сердца, гипертонии, диабета). Риск от селективных к ЦОГ-2 нестероидных противовоспалительных средств возрастал при более высоких суточных дозах, поддерживая рекомендацию использовать ингибиторы ЦОГ-2 в наименьшей требующейся дозе (Circulation 2005;111:1713–1716). Диклофенак, похожий на целекоксиб в отношении селективности к ЦОГ-2, также сопровождался увеличенным риском ОИМ. тогда как при применении неселективных нестероидных противовоспалительных средств напроксена и ибупрофена увеличения риска не наблюдалось. Это предполагает, что у более старых НПВС действие на сердечнососудистый риск зависит от относительной степени селективности к ЦОГ-2. Дальнейшие данные требуются для подтверждения этого наблюдения». Дополнительные сведения из статьи. Для каждого «случая» подбирали до 4 контролей из членов когорты, которые продолжали наблюдаться и не переносили инфаркт миокарда. Контроли к каждому случаю подбирались по возрасту (±2 года), полу, принадлежности к определенной практике, и году вступления в когорту. Для каждого случая и контроля идентифицировали все НПВС, прописанные за 1 год до «индексной» даты. Индексная дата для случаев определялась как наиболее ранняя дата зарегистрированного ОИМ, появления симптомов (таких как острая боль в грудной клетке), дата госпитализации из-за ОИМ, или дата смерть. определяли «индексную дату». Индексная дата для контролей, подобранных к конкретному случаю, определялась путем подсчета такой же длительности наблюдения, как и у соответствующего случая. Таблица Риск острого инфаркта миокарда в зависимости от используемой суточной дозы НПВС Случаи, n=3643 (%) Не использование НПВС† ЦОГ-2 селективные НПВС первого поколения Рофекоксиб 25 мг/сут ≥25 мг/сут Целекоксиб 200 мг/сут 200 мг/сут ЦОГ-2 селективные НПВС второго поколения Эторикоксиб 60 мг/сут 60 мг/сут Вальдекоксиб 10 мг/сут 10 мг/сут Неселективные НПВС Диклофенак 100 мг/сут 100 мг/сут Ибупрофен 1200 мг/сут 1200 мг/сут 795 (21.8) Контрольные пациенты, n=13 918 (%)) 3265 (23.5) Многофакторный относительный риск* (95% ДИ) 1 55 (1.5) 65 (1.8) 222 (1.6) 175 (1.3) 1.01 (0.74–1.40) 1.58 (1.16–2.15) 96 (2.6) 15 (0.4) 281 (2.0) 25 (0.2) 1.44 (1.12–1.87) 2.46 (1.26–4.81) 7 (0.2) 9 (0.3) 19 (0.1) 15 (0.1) 1.51 (0.61–3.76) 2.80 (1.15–6.81) 1 (0.0) 1 (0.0) 1 (0.0) 1 (0.0) НП НП 148 (4.1) 245 (6.7) 504 (3.6) 788 (5.7) 1.31 (1.06–1.62) 1.35 (1.13–1.61) 173 (4.8) 28 (0.8) 767 (5.5) 108 (0.8) 0.99 (0.81–1.21) 1.14 (0.74–1.77) Напроксен 750 мг/сут 750 мг/сут 33 (0.9) 26 (0.7) 121 (0.9) 103 (0.7) 1.19 (0.79–1.80) 1.05 (0.66–1.66) * - С поправкой на применение других НПВС, наличие коронарной болезни сердца, заболевания мозговых сосудов, гиперлипидемии, гипертонии, диабета, ревматоидного артрита, курения, и с учтом индекса массы тела. † - Не принимавшие никаких НПВС на протяжении года до индексной даты. Потребление кофе и коронарная болезнь сердца у мужчин и женщин. Проспективное когортное исследование. В журнале Circulation опубликованы результаты оценки связи между длительным потреблением кофе и риском развития коронарной болезни сердца . Эта оценка выполнена на материале двух крупнейших проспективных эпидемиологических исследований в США «Длительное наблюдение работников здравоохранения - Health Professionals Followup Study (HPFS)» и «Здоровье Медицинских Сестер – Nurses Health Study (NHS)». Результаты касаются огромного числа людей, так как кофе относится к самым распространенным напиткам в мире. Далее приводится перевод резюме этой публикации. «Мы исследовали ассоциацию между длительным привычным потреблением кофе и риском коронарной болезни сердца. Методы и результаты. Мы предприняли проспективное когортное исследование на 44005 мужчинах и 84488 женщинах без истории сердечнососудистого заболевания или рака [без их признаков при исходном обследовании]. Потребление кофе было впервые оценено [с помощью вопросноков] в 1986 году у мужчин и в 1980 – у женщин. Затем эта оценка повторялась каждые 2-4 года и наблюдение продолжалось до конца 2000 года. Мы документировали 2173 случая возникновения коронарной болезни сердца (1449 нефатальных инфаркта миокарда и 724 фатальных случая КБС) среди мужчин и 2254 случая (1561 нефатальный инфаркт миокарда и 693 фатальных случая КБС) среди женщин). Среди мужчин после поправки на возраст, курение и другие факторы риска КБС относительные риски КБС в зависимости от категории общего потребления кофе (<1 чашки/мес, 1 чашка/мес до 4 чашки/нед, 5 - 7 чашек/нед, 2 - 3 чашки/сут, 4 - 5 чашек/сут, и 6 чашек/сут) были следующими: 1.0, 1.04 (95% доверительный интервал 0.9 -1.17), 1.02 (0.91-1.15), 0.97 (0.86-1.11), 1.07 (0.88-1.31), и 0.72 (0.49-1.07; р для тенденции [тренда] =0.41). Среди женщин, относительные риски были следующими: 1.0, 0.97 (0.83-1.14), 1.02 (0.90-1.17), 0.84 (0.74-0.97), 0.99 (0.83-1.17), и 0.87 (0.68-1.11; р для тенденции =0.08) (табл. 1). Стратификация по статусу курения, потреблению алкоголя, наличию диабета 2 типа, и индексу массы тела дала близкие результаты. Мы не обнаружили эффекта и когда учитывали только наиболее недавнее потребление кофе (потребление кофе за более короткий предшествующий период времени). Относительные риски для квинтилей потребления кофеина колебались от 0.97 (0.84-1.10) во второй квинтиле до 0.97 (0.84-1.11) в высшей квинтиле (р для тенденции = 0.82) у мужчин, и от 1.02 (0.90-1.16) до 0.97 (0.851.11; р для тенденции=0.37) у женщин. Заключение. Эти данные не предоставляют никаких свидетельств того, что потребление кофе увеличивает риск коронарной болезни сердца». Некоторые другие сведения из публикации. Частое потребление кофе было тесно ассоциировано с курением: 30% мужчин и более половины женщин, выпивавших 6 и более чашек кофе в сутки курили сигареты. Кроме того, люди, потреблявшие большие количества кофе, с большей вероятностью принимали алкоголь, с меньшей – пили чай и использовали добавки мультивитаминов и витамина Е. При анализе с учетом возраста не было обнаружено достоверной ассоциации между длительным потреблением кофе и риском КБС у мужчин, но отмечена положительная ассоциация у женщин. Однако после учета курения (введения кроме поправки на возраст еще и поправки на статус курения) эта положительная ассоциация у женщин исчезла. Не было выявлено достоверных ассоциаций между потреблением кофе и уровнями липидов в крови. Ассоциация между потреблением кофе и риском КБС отсутствовала как у некурящих, так и у курящих (рис.). Большинство участников исследования пили фильтрованный кофе18[2]. Не было ассоциаций между потреблением фильтрованного кофе, содержащего кофеин, или фильтрованного декафеинированного кофе с уровнями холестерина (общего, липопротеинов низкой или высокой плотности) (табл. 2). Среди тех, кто сообщал о потреблении не фильтрованного через бумагу кофе, повышенного риска КБС обнаружено не было. Тем не менее, авторы считают, что результаты их исследования не исключают возможности наличия связи между высоким потреблением нефильтрованного кофе и риском КБС. Среди участников HPFS и NHS было сравнительно немного людей, потреблявших большие количества нефильтрованного кофе (табл. 2), и среди лиц с наиболее высоким потреблением оно в абсолютном выражении было невелико (≥2 чашек в сутки). Сведения же о неблагоприятном эффекте нефильтрованного «вареного» (boiling) кофе были получены у потреблявших 4-6 чашек в сутки [2]. Комментарий. То, что данные проведенного анализа относятся преимущественно к потреблению фильтрованного кофе, уменьшает значимость результата для России, где такой способ приготовления напитка относительно мало распространен. Таблица 1. Потребление кофе и относительные риски КБС у мужчин и женщин* Потребление кофе(чашек) <1 /мес <1/мес -4/нед 5–7 /нед 2-3/сут 4-5/сут ≥6/сут 1.04 1.02 0.97 1.07 0.72 Р для тенденции Мужчины Вся КБС 1.0 (0.91–1.17) (0.91–1.15) (0.86–1.11) (0.88–1.31) (0.49–1.07) Фатальная КБС 1.04 1.04 1.04 1.08 0.60 1.0 (0.84–1.29) (0.85–1.28) (0.84–1.30) (0.76–1.54) (0.26–1.36) (смерти от КБС) Нефатальный 1.02 1.01 0.94 1.06 0.81 1.0 (0.88–1.19) (0.87–1.17) (0.80–1.10) (0.84–1.34) (0.52–1.26) ИМ Женщины Вся КБС 1.0 0.97 1.02 0.84 0.99 0.87 0.41 0.82 0.49 0.08 (0.83–1.14) (0.90–1.17) (0.74–0.97) (0.83–1.17) (0.68–1.11) Фатальная КБС 1.09 1.01 0.81 0.97 0.61 1.0 (0.83–1.42) (0.80–1.27) (0.64–1.03) (0.72–1.31) (0.37–1.02) (смерти от КБС) Нефатальный 0.93 1.04 0.86 0.99 0.99 1.0 (0.77–1.13) (0.89–1.22) (0.73–1.02) (0.80–1.22) (0.75–1.31) ИМ 0.03 0.47 * Относительные риски с поправками: на возраст (5-ти летние категории); статус курения (никогда, в прошлом, в настоящем 1-14, 15-24, ≥25 сигарет/сут); индекс массы тела (23, 23-24.9, 25-27.9, 28-29.9, и ≥30 кг/м2); физическую активность (квинтили MET час/нед для мужчин и 1, 1-1.9, 2-3.9, 4-6.9 и ≥7 час/нед для женщин); потребление алкоголя (никогда, 0.1-4.9, 5.0-9.9, 1014.9, 15-29.9 и ≥30 г/сут); ИМ у родителей в возрасте до 60 лет; статус менопаузы и использование гормональной терапии у женщин (женщина в пременопаузе, постменопауза без гормональной терапии, постменопауза с гормональной терапией в прошлом, постменопауза с гормональной терапией в настоящем); использование аспирина; использование мултивитаминов; использование добавок с витамином Е; гипертонию; гиперхолестеринемию; диабет при включении в исследование (в исходном состоянии). Рис. Относительный риск Потребление кофе, курение и относительные риски КБС Мужчины (n=44005) Женщины (n=84488) 1986-2000 1986-2000 <1 /мес 1/мес -4/нед 5– 7/нед 2– 3/сут ≥4 /сут <1 /мес 1/мес -4/нед 5– 7/нед 2– 3/сут ≥4 /сут Потребление кофе (чашек) Никогда не курившие и курившие в прошлом Курящие Lopez-Garcia E., et al. Circulation 2006; 113: 2045 Таблица 2. Декафеинированный кофе, чай, не фильтрованный через бумагу кофе и относительный риск (95% доверительный интервал) КБС* 1/мес Мужчины Декафеинированный кофе Чай 1.0 1.0 1/месяц 5– 2–3/сутки 4/неделю 7/неделю 0.95 1.07 1.05 ≥4/сутки 1.08 (0.86–1.06) (0.96–1.20) (0.90–1.22) (0.81–1.45) 1.01 1.07 1.08 1.17 (0.92–1.11) (0.94–1.21) (0.89–1.32) (0.76–1.78) P для тенденции 0.19 0.19 Не фильтрованный через бумагу кофе † Женщины Декафеинированный кофе ‡ 1.0 1.0 Чай 1.0 Не фильтрованный через бумагу кофе † 1.0 1.04 1.19 1.11 0.49 (0.58–1.86) (0.81–1.74) (0.72–1.70) 1.01 0.94 1.10 0.96 (0.90–1.14) (0.83–1.07) (0.92–1.33) (0.62–1.48) 0.88 0.95 0.86 0.80 (0.79–0.99) (0.85–1.07) (0.72–1.02) (0.58–1.12) 0.70 0.89 0.77 (0.29–1.70) (0.58–1.35) (0.51–1.15) 0.80 0.26 0.20 * Поправки те же, что и на таблице 1. † - наблюдение с 1990 г. ‡ - наблюдение с 1984 г. Рано начатая терапия статинами у больных острыми коронарными синдромами. Метаанализ рандомизированных контролированных испытаний. В Журнале Американской Медицинской Ассоциации в начале мая опубликованы данные метаанализа контролированных плацебо испытаний статинов, в которых их применение начиналось в первые дни после развития острого коронарного синдрома [1]. В метаанализ в частности были включены такие испытания как PACT, MIRACL и A to Z. Приводим перевод резюме этой публикации с некоторыми дополнениями. «Контекст. Кратковременные эффекты раннего лечения статинами у больных после начала острых коронарных синдромов на такие исходы как смерть, инфаркт миокарда и инсульт, неясны. Цель. Оценить исходы больных из рандомизированных контролированных испытаний, сравнивающих раннюю терапию статинами с плацебо или обычным лечением, через 1 и 4 месяца после острого коронарного синдрома. Источники данных и выбор исследований. Выполнен систематический поиск в электронных базах данных (MEDLINE, EMBASE, PASCAL, Центральный регистр Cochrane) от их начала до августа 2005 г, дополненный контактами с экспертами в этой области. Два обозревателя независимо определяли подходящие рандомизированные контролированные испытание, в которых сравнивалось лечение статинами с контролем, которые были начаты в пределах 14 дней после возникновения ОКС, и и в которых минимальный длительность наблюдения была 30 дней. Испытания церивастатина были включены в анализ чувствительности. Экстрагирование извлечение данных. Информация об исходных характеристиках включенных испытаний и больных, о качестве методологичеком, уровнях липидов и клинических исходах была независимо извлечена двумя исследователями. При необходимости исследователи из каждого включенного испытания предоставляли дополнительные данные. Синтез данных. В мета-анализ включены 12 испытаний, в которые было вовлечено 13024 больных. Отношения рисков комбинированной конечной точки смерть, инфаркт миокарда и инсульт для больных, рано леченных статинами в сравнении с контрольной терапией были 0.93 (95% доверительный интервал [ДИ], 0.80-1.09; р = 0.39) через 1 месяц и 0.93 (95%ДИ, 0.81-1.07; р = 0.30) через 4 месяца после ОКС (таблица). Применение статинов не сопровождалось статистически достоверным уменьшением риска смерти (общей смертности), инфарктов миокарда, инсультов, сердечнососудистой смерти, отдельно фатальных или нефатальных инфартов миокарда, или процедур реваскуляризации (чрескожные коронарные вмешательства или операции шунтирования коронарных артерий). Анализы чувствительности - ограниченный испытаниями высокого качества или с дополнительными данными из крупного испытания, в котором использовался церивастатин, - дали суммарные отношения рисков, даже еще более близкие к 0. Заключение. Согласно имеющимся данным начало терапии статинами в пределах 14 дней после возникновения ОКС не уменьшает [частоту таких событий как] смерть инфаркты миокарда и инсульты на протяжении первых 4-х месяцев. Таблица. Результаты метаанализа [5] События, терапия статинами (%) События, контроль (%) Относительный риск (95% ДИ) Смерть/нефатальный ИМ/нефатальный инсульт за 1 мес 4.7 5.0 0.93 (0.80-1.09) Смерть/нефатальный ИМ/нефатальный инсульт за 4 мес 7.5 8.1 0.93 (0.81-1.07) Нестабильная стенокардия за 1 мес 4.3 4.8 0.90 (0.76-1.06) Нестабильная стенокардия за 4 мес 4.8 6.0 0.80 (0.64-1.00) Конечная точка Согласно информации Интернет сайта theheartorg по мнению одного из авторов представленного метаанализа др. J. de Lemos его ограничением является то, что в нем не рассматривается интенсивная терапия статинами, а объединены испытания статинов различной интенсивности в сравнении с плацебо [5]. Др. J. de Lemos считает, что для оценки кратковременных эффектов интенсивной липидснижающей др. J. de Lemos терапии у больных ОКС потребуются отдельные анализы [5]. Комментарии Н.А. Грацианского к внезапно возникшему интересу к зофеноприлу. Перелистывая Российские периодические медицинские издания (глянцевые журналы мне присылают, как и многим другим людям, которые, по мнению оплачивающих эту рассылку, или сами часто назначают лекарства или могут повлиять на их назначение другими), я обратил внимание на признаки явного оживления в последние месяцы интереса к проблеме применения ингибиторов ангиотензин превращающего фермента (АПФ) у больных инфарктом миокарда. Потом получил повестку Московского городского общества кардиологов - ближайшее заседание «Новые возможности в лечении острого инфаркта миокарда ...» с докладом о «и-АПФ в остром периоде инфаркта миокарда». Посмотрел на сайте cardioweb программу предстоящей в начале июня конференции РКНПК – название единственного (очевидно пока) сателлитного симпозиума "Лечение острого инфаркта миокарда: место иАПФ". Что случилось? Или я пропустил что-то важное и недавно закончилось какое-то крупное испытание, результаты которого вдруг заставили эксперта за экспертом компилировать, а журнал за журналом помещать статьи о применении ингибиторов ангиотензинпревращающего фермента при инфаркте миокарда? Я-то считал, что все касающееся этой проблемы давно вошло в учебники, а на страницах Российских журналов о ней вспоминают только во время рекламных кампаний очередных генериков известных препаратов. Очевидно это что-то похожее. Действительно, просмотрев статьи и программы, я заметил, что их объединяет большое место, уделенное зофеноприлу – представителю группы ингибиторов АПФ, о котором я (к своему стыду, конечно) раньше ничего и не знал. Наверное, этот препарат только появился, или, может быть, при его изучении только что были получены какие-то важные результаты, породившие такое обилие специальных публикаций и устных выступлений? Я набрал в Медлaйн «zofenopril», отметил «human», англоязычные статьи с abstracts, относящиеся к типам «клиническое испытание», «рандомизированное контролированное испытание», «метаанализ», «практическая рекомендация», и выполнил поиск за последние 3 года. Ниже представлены его результаты. 1. Napoli C, Sica V, de Nigris F, et al. Sulfhydryl angiotensin-converting enzyme inhibition induces sustained reduction of systemic oxidative stress and improves the nitric oxide pathway in patients with essential hypertension. Am Heart J. 2004 Jul;148(1):e5. Matarrese M, Salimbeni A, Turolla EA, et al. 11C-Radiosynthesis and preliminary human evaluation of the disposition of the ACE inhibitor [11C]zofenoprilat. Bioorg Med Chem. 2004 Feb 1;12(3):603-11. 3. Borghi C, Bacchelli S, Esposti DD, Ambrosioni E; SMILE Study. Effects of the early ACE inhibition in diabetic nonthrombolyzed patients with anterior acute myocardial infarction. Diabetes Care. 2003 Jun;26(6): 1862-1868. Из трех работ только последняя (трехлетней давности) - клиническая. В ней представлен результат анализа подгруппы больных из испытания SMILE, общие результаты которого опубликованы еще в 1995 году [1]. Ничего особенно благоприятного для зофеноприла статья не содержит, так как оказалось, что у больных диабетом с острым передним инфарктом миокарда, не подвергнутых тромболизису, применение зофеноприла не оказало достоверного влияния на смертность ни за 6 недель, ни в течение 1 года [2]. Это контрастирует, например, с данными GISSI-3, в котором применение лизиноприла[†] у больных диабетом сопровождалось достоверным уменьшением частоты случаев смерти в первые 6 недель на 32% [3]. SMILE. Зофеноприл появился довольно давно. Во всяком случаев 1985 году он уже находился «на ранней стадии клинического изучения» [4]. А 10 лет назад стали известны результаты SMILE – довольно крупного рандомизированного контролированного испытания, выполненного на уже упомянутом строго определенном контингенте пациентов (не подвергнутые тромболитической терапии больные с передним инфарктом миокарда) [1]. В SMILE применение зофеноприла не привело к достоверному снижению смертности через 6 недель. Правда, через один год в группе рандомизированных к зофеноприлу доля умерших стала достоверно меньшей, чем в группе рандомизированных к плацебо. Через 6 же недель была отмечена достоверно меньшая, чем в группе плацебо, частота возникновения суммарной конечной точки, включавшей смерть и «тяжелую застойную сердечную недостаточность» [1]. Для определения состояний, на которые могут быть экстраполированы результаты SMILE, крайне важно понимание особенностей «материала» этого испытания. В него включались больные с ЭКГ признаками переднего инфаркта миокарда, «если они не подходили (were not eligible) для тромболитической терапии из-за позднего поступления, или если у них были противопоказания для системного фибринолизиса» [1]. Т.е. результаты испытания не распространяются на частую в отечественных лечебных учреждениях ситуацию, когда больные, госпитализированные достаточно рано, не получают фибринолитическую терапию из-за отсутствия соответствующего препарата. В 1998 году появился «систематический обзор индивидуальных данных от 100000 больных, включенных в рандомизированные исследования» раннего применения ингибиторов ангиотензинпревращающего фермента при остром инфаркте миокарда [5]. Он как бы завершил период изучения эффективности вмешательства и позволил окончательно сформулировать показания к использованию препаратов этой группы. Согласно названию этот обзор основывался на «индивидуальных данных больных» из клинических испытаний. Отбирались испытания, в которых участвовало более 1000 пациентов. К тому времени было выполнено 5 испытаний, соответствовавших этому критерию: CONSENSUS-II, GISSI-3, ISIS-4, CCS-1, SMILE. Однако в обзоре использовались только индивидуальные данные из первых четырех испытаний, так как из SMILE они получены не были [5][‡]. SMILE примечательно еще и тем, что в нем (также как и в SMILE-2 – см. ниже) длительность применения зофеноприла (6 недель) очевидно была наибольшей, во всяком случае у больных, перенесших инфаркт миокарда. Похоже, что эффекты более длительного применения препарата у человека в крупных сравнительных рандомизированных двойных слепых исследованиях не изучались. Другие сведения о зофеноприле. Нечто относительно новое о зофеноприле в 2003 году все же действительно появилось. Только публикация относится к январю и поэтому не попала в пределы «последних трех лет». Публикация эта посвящена результатам сравнения зофеноприла и лизиноприла с суррогатной конечной точкой (снижение систолического АД менее 90 мм рт ст) у больных острым инфарктом миокарда в испытании SMILE-2 [6]. SMILE-2 - двойное слепое рандомизированное испытание с параллельными группами на 1024 больных инфарктом миокарда. Применение зофеноприла или лизиноприла соответственно в дозах 30-60 и 5-10 мг/сут начиналось в пределах 12 часов после завершения тромболитической терапии и продолжалось 42 дня. Общая частота случаев гипотензии достоверно не различалась, но частота тех из них, которые можно было рассматривать как следствие применения ингибитора АПФ, была меньшей на зофеноприле (соответственно 6.7 и 9.8%, при пограничном р=0.048). О том, что это означает для практики, можно судить по заключению авторов. Привожу его (заключение резюме публикации) дословно: «Испытание SMILE-2 демонстрирует, что как зофеноприл, так и лизиноприл безопасны и ассоциируются с довольно низкой частотой тяжелой гипотензии, когда применяются по схеме с титрованием дозы у подвергнутых тромболизу больных с острым инфарктом миокарда» [6]. Напомню, что применение лизиноприла в GISSI-3 в отличие от зофеноприла в SMILE сопровождалось достоверным уменьшением смертности за 6 недель [7][§]. В одной из Российских публикаций по зофеноприлу упоминается «рандомизированное, двойное слепое исследование SMILE-3, целью которого было изучение антиишемических эффектов зофеноприла у больных, перенесших ОИМ» [8]. Согласно тезисам постерного сообщения на Конгрессе Американской Коллегии Кардиологов (март 2004 года) эффекты эти были впечатляющими [9]. Применение зофеноприла в течение 6 месяцев по сравнению с плацебо сопровождалось: по данным 48ми часовой ЭКГ - более чем двукратным уменьшением числа больных с депрессиями ST, более чем трехкратным уменьшением средней продолжительности депрессии ST; по данным велоэргометрического теста - более чем трехкратным уменьшением доли больных с приступом боли, почти двукратным уменьшением доли больных со «значимой (significant)» (?) депрессией ST во время велоэргометричекого теста, и почти трехкратным уменьшением доли больных, у которых во время теста возникли аритмии (!). Автор российской публикации пишет, что «предварительные результаты свидетельствуют о достоверно меньшей частоте ишемических событий в группе зофеноприла (20.3%), чем у больных, получавших плацебо (35.9%) (р=0.001)» [8]. В доступном мне варианте тезисов таких цифр не оказалось, а содержалась фраза «Основные сердечнососудистые события были равномерно распределены между популяциями исследования (?)» (Major cardiovascular events were evenly distributed between study populations) [9]. Протокол этого исследования по имеющимся тезисам понять трудно. Обычно в таких случаях пишут – окончательное заключение сможет быть дано на основании полной публикации. Однако сейчас, более чем через 2 года, следов полной публикации найти не удалось (в Медлайн я искал публикации и на итальянском языке). Следовательно, и обсуждать пока нечего. Зофеноприл в современных руководствах и рекомендациях. Чтобы окончательно прояснить для себя место зофеноприла в лечении больных инфарктом миокарда, я обратился к руководствам и документам авторитетных обществ – может быть, по мнению экспертов, данные SMILE-2 все же что-то добавили к характеристике препарата, что и стало основанием для настоятельных попыток привлечь внимание Российских врачей к этому ингибитору АПФ именно в последнее время. В классическом руководстве, обычно называемом просто «Браунвальд» – «Braunwald’s Heart Disease. A Textbook of Cardiovascular Medicine» слова зофеноприл в тексте нет (ни в издании 6, ни в постоянно обновляемой Интернет-версии последнего 7-го издания) [10]. Упоминание о нем есть только в списке литературы (публикация SMILE 1995 года). В Европейских рекомендациях по острому коронарному синдрому с подъемами сегмента ST 2002 года (опубликованы в 2003 г) слово зофеноприл есть в одной из таблиц, а публикация испытания SMILE – в списке литературы [11]. В Executive summary рекомендаций Американских Ассоциации Сердца и Коллегии Кардиологов 2004 года упоминания зофеноприла нет вообще [12]. В тексте же полного документа слово зофеноприл можно найти в 2-х местах [13]. Причем в одном из них он упоминается даже наравне с рамиприлом, эналаприлом, и квинаприлом, правда только для констатации, что применение всех этих средств следует начинать с низкой дозы, а затем увеличивать ее таким же образом, как это делалось в испытаниях каптоприла и лизиноприла. В другом месте подчеркиваются ограничения SMILE, в котором действие зофеноприла сравнивалось с плацебо только у не подвергнутых тромболитической терапии больных и только с передним инфарктом миокарда. Тем не менее, констатировано, что «раннее использование ингибитора АПФ в этом испытании предположило тенденцию к большему числу спасенных жизней в первые 6 недель» [13]. Кроме того, публикация SMILE упоминается в списке литературы. Общее впечатление. Удивляет скудность информации о лекарстве, появившемся более 20 лет назад. При запросе публикаций клинических исследований у человека на английском и итальянском языках, имеющих резюме (abstract), Медлайн выдает 34 работы с 1985 года. Не совсем понятно, на каком основании рекомендуется применять препарат при гипертонии, так как ничего, кроме данных нескольких испытаний с суррогатными конечными точками, найти не удалось. Нет обоснования и в документах Европейского агентства по медицинским продуктам (EMEA) [14]. Не ясна длительность применения зофеноприла в клинических исследованиях. В одной из Российских публикаций отмечено, что в испытании SMILE-pilot зофеноприл использовали в течение года [8], но в доступном мне резюме этой публикации длительность применения после первых 6 недель не указана [15]. Заключение. Таким образом, никакого «научного» толчка для неожиданного массового интереса к зофеноприлу обнаружить не удалось. Очевидно происходящее – обычная «раскрутка» ненового препарата на Российском рынке. Конечно, всегда лучше знать характеристики появившегося в продаже лекарства. Так что хорошо, что те, кто направил это лекарство в аптеки, хотят информировать о нем медицинскую общественность и организуют соответствующую кампанию. Некоторая (мягко говоря) предвзятость представления информации во время нее уже стала рутиной и надеюсь, врачи научились ее учитывать. Однако только благодаря этой кампании (в основном тому, что в нее вовлекли и сотрудника моей лаборатории [16] - см. Disclaimer) я и заинтересовался зофеноприлом. Результатом этой заинтересованности стал основной вывод, что я немногое терял, не зная о его существовании. Думаю, что немногое теряли и другие врачи, которые подобно мне не знали об этом средстве, но применяли как у больных инфарктом миокарда, так и в других случаях наличия соответствующих показаний, какой-либо из «доказанных» ингибиторов АПФ (оригинальный или генерик). Рекомендации ААС и АКК по вторичной профилактике у пациентов с коронарной и другими атеросклеротическими болезнями сосудов. Обновление 2006 года. Документ утвержден Национальным Институтом Сердца, Легких и Крови. Подготовил Н.А.Ваулин Со времени публикации обновления совместного документа Американской Коллегии Кардиологов (АКК) и Американской Ассоциации Сердца (ААС) по вторичной профилактике в 2001 году были получены новые важные доказательства того, что более агрессивная терапия у более широкого круга лиц может принести дополнительную пользу у пациентов с КБС или другой локализацией атеросклеротического процесса. Непрерывно пополняемая доказательная база указывает на возможность снижения смертности, уменьшения числа повторных сердечно-сосудистых событий и числа больных, кому необходимы инвазивные вмешательства. Наконец, отмечено улучшение качества жизни у таких больных. Сопоставление данных недавних клинических исследований и пересмотренных клинических рекомендаций дало основание для появления настоящего обновления (табл.1). В документе применена стандартная шкала степени обоснованности и доказанности, используемая АКК и ААС (табл. 2). . В этом документе существующие на тот момент целевые уровни ХСЛНП были снижены для пациентов с КБС и повышенным уровнем риска, включая больных с ОКС. Соответственно, были расширены показания для назначения гиполипидемических препаратов. Уже после выхода новой редакции ATP III 2004 года, были опубликованы результаты двух многоцентровых исследований [8,9]. На основании указанных работ к существующему понятию о целевом уровне ХС ЛНП ниже 100 мг/дл (2.6 ммоль/л) у всех больных с КБС и с любым другим проявлением атеросклероза, появилось указание на обоснованность снижения этого показателя у больных ниже 1.8 ммоль/л. В случае, если в качестве терапевтической цели выбран уровень ХСЛНП менее 1.8 ммоль/л, считается целесообразным постепенное увеличение дозы статина для оценки ее гиполипидемического действия и переносимости. В случае, если на фоне максимальной гиполипидемической терапии не удается достичь целевого уровня (из-за очень высокого исходного уровня ХС ЛНП), в общем считается достаточным снижение уровня ХС ЛНП более чем на 50% от начального. Рекомендации касаются изменений во вторичной профилактике и не затрагивают положения обновленного руководства НОПХ 2004 года для пациентов без атеросклеротических поражений, но с высоким риском осложнений КБС (>20% за 10 лет), включая сахарный диабет и сочетание нескольких факторов риска. Для этой категории сохраняется целевой уровень ХС ЛНП < 2.6 ммоль/л. Тем более новый целевой уровень не относится к пациентам без КБС и с невысоким уровнем риска. Помимо изменений в подходе к гиполипидемической терапии, в настоящем обновлении отражены результаты исследований по вторичной профилактике с применением других средств. В частности, добавлены рекомендации по применению клопидогреля после острого коронарного синдрома и после стентирования коронарных артерий. Остается актуальным постоянный прием низких доз аспирина. Результаты последних клинических испытаний еще раз подтвердили эффект антагонистов альдостерона у больных с нарушенной функцией левого желудочка. Наконец, в тексте современных рекомендаций нашли отражение результаты недавно завершившегося исследования по эффективному применению ингибитора АПФ у пациентов относительно низкого риска <в рамках вторичной профилактики> с нормальной функцией левого желудочка. [26] В тексте рекомендаций впервые появилась рекомендация о противогриппозной вакцинации. Согласно данным Центров по Контролю за Заболеваниями и Профилактики США, вакцинация против вируса гриппа рекомендована всем пациентам с хроническим ими заболеваниями сердечно-сосудистой системы, поскольку эта категория лиц находится в группе риска осложнений гриппа [38]. Группа авторов рекомендаций подчеркивает, что основой при их создании были доказательства, полученные в ходе клинических испытаний, что должно повысить их практическую значимость. Вместе с тем, авторы признают, что национальные меньшинства, женщины и пожилые люди в меньшей степени были представлены в клинических исследованиях. В связи с чем авторы призывают врачей активнее включать в будущие клинические испытания пациентов указанных групп. Таблица 1. Рекомендации ААС и АКК по вторичной профилактике у пациентов с коронарной болезнью и прочими заболеваниями сосудов1. Обновление 2006 года. Цель вмешательства Рекомендуемые вмешательства с указанием класса эффективности и доказанности КУРЕНИЕ Цель: Полное прекращение. Избегать «пассивного» курения. · Опрос о курении на каждом визите к врачу. I (B) · Рекомендовать отказаться от курения всем курящим. I (B) · Оценить мотивацию пациента бросить курить. I (B) · Помочь пациенту в разработке плана по отказу от курения. I (B) · Организовать регулярное наблюдение, направить для участия в соответствующих программах или назначить фармакотерапию (включая заместительную терапию и бупропион <bupropion>). I (B) · Рекомендовать воздерживаться от «пассивного курения» на работе и дома. I (B) АРТЕРИАЛЬНОЕ ДАВЛЕНИЕ Цель: <140/90 мм рт.ст. или <130/80 мм рт ст при сахарном диабете и хроническом заболевании почек Для всех пациентов: · Начать /продолжить меры по изменению образа жизни: контроль за массой тела, увеличение физической активности, контроль за употреблением алкоголя, ограничение потребления натрия. Увеличить употребление свежих фруктов, овощей, молочных продуктов с низким содержанием жира. I (B) Для пациентов с артериальным давлением выше целевого: · Добавить по переносимости гипотензивные средства, начиная с бета-блокаторов и/или ингибиторов АПФ, добавляя при необходимости другие препараты, например тиазидные диуретики для достижения целевых уровней АД. I (A) УРОВЕНЬ ЛИПИДОВ Цель: ХС ЛНП < 2.6 ммоль/л Если триглицериды > 2.26 ммоль/л – не-ЛВП2 холестерин должен быть < 3. ммоль/л Для всех пациентов: · Назначить диетотерапию. Снизить потребление насыщенных жиров (<7% от общей калорийности пищи), транс-жирных кислот и холестерина (< 200 мг/д). I (B) · Добавление растительных станолов/стеролов (2г в день), клетчатки (>10 г/день) дополнительно снижает уровень ХС ЛНП. · Обеспечить ежедневную физическую активность и контроль за массой тела. I (B) · Предложить пациенту увеличить потребление омега-3 жирных кислот в виде блюд из рыбы3 или капсул (1 г/день) с целью снижения риска. При лечении гипертриглицеридемии требуются более высокие дозы. IIa (B) Гиполипидемическая терапия: Определить липидный профиль натощак у всех пациентов. При остром коронарном или другом сосудистом событии липиды надо определить в первые 24 часа госпитализации. Для госпитализированных пациентов гиполипидемическая терапия назначается до выписки из стационара. Ниже представлены основные положения: · ХС ЛНП должен быть ниже 2.6 ммоль/л, кроме того · Есть основание для большего снижения уровня ХСЛНП ниже 1.8 ммоль/л IIa (A) · Если исходный уровень ХС ЛНП >2.6 ммоль/л – сразу же назначается гиполипидемическая терапия.4 I (A) · Если на фоне гиполипидемической терапии ХСЛНП > 2.6 ммоль/л – необходимо интенсифицировать терапию (возможно добавление второго препарата 5). I (A) · Если исходный уровень ХС ЛНП >2.6 ммоль/л и > 1.8 ммоль/л, возможно назначение терапии для снижения этого показателя ниже 1.8 ммоль/л. Iia (B) · Если уровень триглицеридов в пределах от 2.26 до 5.6 ммоль/л, уровень не-ЛВП холестерина должен быть ниже 3.4 ммоль/л I (B) и тогда: · желательно снижение не-ЛВП холестерина ниже 2,6 ммоль/л IIa (B) с помощью следующих терапевтических вмешательств: Ø интенсификация ЛНП-снижающей терапии I (B) или Ø добавление никотиновой кислоты6 (после ЛНП-снижающей терапии) IIa (B) или Ø терапия фибратами7 (после ЛНП-снижающей терапии) IIa (B) · Если уровень триглицеридов > 5.65 ммоль/л7, средство первого выбора для предотвращения острого панкреатита – фибрат или никотиновая кислота до назначения ЛНП-снижающего препарата; последний назначается только после снижения триглицеридов. По возможности рекомендуется достичь целевого уровня не-ЛВП холестерина ниже 3.4 ммоль/л. I (C) ФИЗИЧЕСКАЯ АКТИВНОСТЬ Цель: 30 мин в день, 7 дней в неделю (минимум 5 дней в неделю) · Для всех пациентов – оценить переносимость физических нагрузок по анамнезу и/или по результатам пробы с физической нагрузкой для выработки приемлемых рекомендаций. I (B) · Всем пациентам рекомендовать умеренные аэробные физические нагрузки, например быструю ходьбу по 30-60 мин в день, желательно ежедневно. Советовать увеличить физическую активность в повседневной жизни (например – ходьба во время перерыва на работе, работа в саду, домашние дела). I (B) · Рекомендовать физические упражнения с утяжелением 2 раза в неделю. IIb (C) · Для пациентов с высоким уровнем риска – после ОКС, реваскуляризации, при сердечной недостаточности – советовать проведение тренировок по программе под контролем врач. I (B) МАССА ТЕЛА Цель: Индекс массы тела в пределах 18.5 – 2.9 кг/м2 Окружность талии: для женщин - < 89 см (35 дюймов) для мужчин -102см (40 дюймов) · Оценить индекс массы тела и/или окружность талии на каждом визите к врачу. Регулярно напоминать пациенту о необходимости поддержания массы тела на должном уровне путем комплекса мер - физической активности, ограничения калорийности пищи. При необходимости - участие в специализированных программах. I (B) · Если окружность талии, измеренная на уровне гребней подвздошных костей > 89 см у женщин и 102см у мужчин, необходимо инициировать терапевтические изменения образа жизни по поводу метаболического синдрома. При наличии показаний – начать терапевтические вмешательства. I (B) · Первичная цель терапии, направленной на снижение веса – уменьшение массы на 10% от исходного уровня. После этого можно попытаться добиться большего снижения массы, если не достигнут целевой уровень при повторных осмотрах. I (B) САХАРНЫЙ ДИАБЕТ Цель: уровень HbA1C< 7% · Начать изменения образа жизни и фармакотерапию для достижения близкого к целевому уровню HbA1C. I (B) · Начать активное воздействие на другие факторы риска (физическая активность, коррекция веса, контроль АД и уровня холестерина, как было указано выше). I (B) · Координировать лечение диабета с врачом общей практики или с эндокринологом, которые наблюдают за данным больным. I (C) АНТИТРОМБОЦИТАРНЫЕ СРЕДСТВА И АНТИКОАГУЛЯНТЫ · Назначить аспирин в дозе 75-162 мг/день на неопределенно долгое время всем пациентам, если нет противопоказаний. I (A) Ø Больным после операции коронарного шунтирования аспирин должен быть назначен в пределах 48 часов для предотвращения тромбоза шунтов. В этом случае вероятно эффективны дозы от 100 до 300 мг/день. Применение дозы выше 162 мг/день в этом случае оправдано на протяжении до 1 года. I (B) · Назначить/продолжить прием 75 мг/день клопидогреля в комбинации с аспирином до 12 месяцев после острого коронарного синдрома или после чрезкожного вмешательства со стентированием (>1 мес для непокрытого стента, >3 мес для стентов с сиролимусом и > 6мес для стентов с паклитакселем). I (B) Ø Пациентам после стентирования коронарных артерий первоначально следует назначать более высокие дозы аспирина - 325 мг/день (на >1 мес. для простого стента, на >3 мес. для стентов с сиролимусом и на >6мес для стентов с паклитакселем). I (B) · У пациентов с показаниями к варфарину – пароксизмальной или постоянной мерцательной аритмией, трепетанием предсердий, при постинфарктном тромбе в желудочке сердца – необходимо поддерживать МНО на уровне от 2.0 до 3.0. I (A) · Использование варфарина одновременно с аспирином и клопидогрелем связано с риском кровотечений и требует особого контроля. I (B) БЛОКАТОРЫ РЕНИН-АНГИОТЕНЗИН АЛЬДОСТЕРОНОВОЙ СИСТЕМЫ Ингибиторы АПФ: · Назначить на неопределенно долгий срок всем пациентам с фракцией выброса ЛЖ <40%, при артериальной гипертензии, сахарном диабете или хроническом заболевании почек, если нет противопоказаний. I (A) · Рассмотреть возможность хронической терапии у всех больных I (B) · В качестве возможного дополнительного вмешательства иАПФ могут быть рассмотрены у пациентов низким риском: с нормальной функцией ЛЖ, с хорошо контролируемыми факторами риска и после процедуры реваскуляризации. Iia (B) Антагонисты рецепторов ангиотензина: · Пациентам с симптомами сердечной недостаточности или после инфаркта миокарда со сниженной фракцией выброса ЛЖ <40%, которые не переносят ингибиторы АПФ. I (A) · Рассмотреть возможность назначения у других групп больных с непереносимостью ингибиторов АПФ. I (B) · Рассмотреть возможность назначения в комбинации с ингибиторами АПФ у пациентов с систолической сердечной недостаточностью. IIb (B) Антагонисты альдостерона: · У пациентов после инфаркта миокарда со сниженной фракцией выброса ЛЖ <40%, без значимого нарушения почечной функции8 и/или гиперкалиемии9, которые уже получают терапевтические дозы ингибиторов АПФ и бета-блокаторы, и имеют либо сахарный диабет, либо клинику сердечной недостаточности. I (A) БЕТА-АДРЕНОБЛОКАТОРЫ · Назначить на неопределенно долгий срок всем пациентам перенесшим инфаркт миокарда, острый коронарный синдром или при нарушенной функции левого желудочка независимо от наличия клиники сердечной недостаточности, если нет противопоказаний. I (A) Рассмотреть возможность хронической терапии у всех больных с проявлениями атеросклеротического поражения сосудов или с сахарным диабетом, если нет противопоказаний. IIa (C) ВАКЦИНАЦИЯ ПРОТИВ ВИРУСА ГРИППА · Пациенты с сердечно-сосудистыми заболеваниями должны быть вакцинированы против гриппа. I (B) Примечания: 1. Представленные рекомендации относятся к больным с установленной КБС и другим атеросклеротическим поражениями, включая атеросклероз периферических артерий, аорты, сонных артерий. Лечение пациентов исключительно с сахарным диабетом будет рассмотрено в отдельном документе ААС и АКК. 2. не-ЛВП холестерин = общий холестерин – холестерин ЛВП 3. Беременные и кормящие женщины должны ограничивать употребление рыбы, чтобы избежать возможного воздействия метил-ртути. 4. При использовании ЛНП-снижающих препаратов, желательно по меньшей мере достижение 30-40% снижения ХС ЛНП. Если за целевой уровень принято значение <1.8 ммоль/л, целесообразно постепенное повышение дозы статина для минимизации побочных эффектов и стоимости терапии. Если целевой уровень < 1.8 ммоль/л не удается достичь адекватной терапией из-за очень высокого исходного значения липидов, считается приемлемым снижение ХС ЛНП на 50% с помощью монотерапии статинами или в комбинации с другим гиполипидемическим агентом. 5. Стандартная доза статина с эзетемибом, секвестрантом желчных кискот, никотиновой кислотой. 6. Комбинирование высокой дозы статина с фибратом может увеличить риск тяжелой миопатии, в связи с чем в такой комбинации статин применяется в относительно небольшой дозировке. Применение никотиновой кислоты в составе витаминных добавок в качестве гиполипидемического средства не оправдано. 7. Больным с очень высоким уровнем триглицеридов следует воздерживаться от употребления алкоголя. Использование секвестрантов жирных кислот относительно противопоказано при концентрации триглицеридов > 2.26 ммоль/л. 8. Креатинин должен быть ниже 2.5 мг/дл для мужчин и ниже 2.0 ммоль/л для женщин 9. Содержание калия в крови ниже 5 ммоль/л. Таблица 2. Классификация положений рекомендаций с учетом весомости и доказанности. Степень обоснованности применения вмешательства: Класс I. Существуют доказательства и/или общее соглашение, что процедура или метод лечения полезны и эффективны. Класс II. Имеются противоречивые данные и/или мнения экспертов о полезности/ эффективности вмешательства Класс IIа. Больше доказательств или мнений в пользу вмешательства. Класс IIb. Целесообразность вмешательства менее очевидна. Класс III. Существуют доказательства и/или общее соглашение, что процедура или метод лечения не полезны, не эффективны и в некоторых случаях могут быть опасными. Степень надежности доказательств, лежащих в основе рекомендаций: Уровень доказанности А (наивысший) – данные получены во многих рандомизированных клинических исследованиях. Уровень доказанности В (промежуточный) – данные получены в ограниченном количестве рандомизированных исследований, нерандомизированных исследованиях или регистрах, предназначенных для наблюдения. Уровень доказанности С (низкий) – рекомендации основываются в преимущественно на соглашении экспертов. Ранняя реваскуляризация миокарда обеспечивает длительное улучшение выживаемости больных острым инфарктом миокарда, осложненным кардиогенным шоком: результаты отдаленного наблюдения в исследовании SHOCK. Early revascularization provide a long-term survival benefit in patients with cardiogenic shock complicating acute myocardial infarction: follow up results in SHOCK trial. Подготовил И.С. Явелов Цель изучения. В международном рандомизированном исследования Должны ли мы немедленно осуществлять реваскуляризацию окклюзированных коронарных артерий при кардиогенном шоке (Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock – SHOCK), проводившемся с 1993 по 1998 гг., было доказано преимущество быстрой реваскуляризации миокарда при кардиогенном шоке в ранние сроки инфаркта миокарда (ИМ) [1,2]. Его результаты стали основой современных рекомендаций по ведению подобных больных [3,4]. Вместе с тем до недавнего времени имелись результаты относительно короткого (годичного) наблюдения за больными, рандомизированными в это клиническое испытание [2]. Недавно были опубликованы данные об исходах на протяжении более длительного периода времени (вплоть до 2005 г.). Методы. В 29 лечебных учреждениях было рандомизировано 302 больных с подъемами сегмента ST на ЭКГ или патологическими зубцами Q, задним ИМ, остро возникшей или предположительно остро возникшей блокадой левой ножки пучка Гиса в пределах 36 часов после начала симптомов и 12 часов после выявления кардиогенного шока. Наличие последнего устанавливали при наличии признаков гипоперфузии в сочетании с систолическим АД ниже 90 мм рт.ст. на протяжении как минимум 30 минут (или необходимости в инотропной поддержке для поддержания систолического АД выше 90 мм рт. ст.), сердечного индекса не выше 2,2 л/мин/м2 и давления заклинивания легочной артерии как минимум 15 мм рт. ст. У 152 больных, рандомизированных в группу ранней реваскуляризации, коронарную ангиопластику или операцию коронарного шунтирования (КШ) рекомендовалось выполнить как можно быстрее, в пределах 6 часов после рандомизации. Эти процедуры были выполнены в 55 и 38% случаев соответственно. 150 больных, вошедших в группу первоначального медикаментозного лечения, могли получать тромболитическую терапию (была проведена в 63% случаев) притом, что коронарную ангиопластику или КШ разрешалось осуществлять не ранее, чем через 54 часа после рандомизации (были выполнены у 25% больных). Показаниями для КШ служили стеноз ствола левой коронарной артерии и тяжелое трехсосудистое поражение. В обеих группах у существенного числа больных (86%) проводилась внутриаортальная баллонная контрапульсация. Транспортировка в другое лечебное учреждение для инвазивного лечения потребовалась в 55% случаев. Длительность наблюдения за выписавшимися больными достигала 11 лет (медиана 5,9 лет). Результаты. Преимущество ранней реваскуляризации миокарда, отмеченное через 1 год (снижение риска смерти на 36%; 95% доверительный интервал [ДИ] 5-46%; р<0,03; абсолютное различие в выживаемости 13,2%), сохранялось через 6 лет (снижение риска смерти на 24%; 95% ДИ 3-43%; р=0,03; абсолютное различие в выживаемости 13,2%). Через 6 лет выживаемость в группе ранней реваскуляризации составила 32,8%, в группе первоначальной медикаментозной стабилизации 19,6%. При этом в группе первоначального медикаментозного лечения наиболее часто больные умирали на протяжении первого года (26,4 смертей на 100 человеко-лет против 9,5 смертей на 100 человеко-лет в группе раннего инвазивного лечения). В последующем ежегодная смертность составляла 10,7 и 8,0 на 100 человеко-лет, соответственно. Среди 143 больных, выписавшихся из стационара, снижение риска смерти через 6 лет составило 41% (95% ДИ 5-64%; р=0,03). При этом в группе ранней реваскуляризации выжило 62,4% больных, в группе первоначальной медикаментозной стабилизации 44,4%. Иначе говоря, почти две трети больных ИМ с подъемами сегмента ST и кардиогенным шоком, подвергшихся ранней реваскуляризации миокарда и выписавшихся из стационара, были живы на протяжении ближайших 6 лет. Не было выявлено зависимости эффективности лечения от различных показателей тяжести заболевания и особенностей его лечения (включая возраст <75 лет и 75 лет, наличие шока при госпитализации или его развитие в последующем, факт перевода в другой стационар для инвазивного лечения, возможность быстро устранить гипоперфузию с помощью внутриаортальной баллонной контрапульсации, вводившийся фибринолитический агент). Выводы. У больных ИМ с подъемами сегмента ST на ЭКГ, осложнившимся истинным кардиогенным шоком, ранний инвазивный подход преимуществом по влиянию на выживаемость на протяжении длительного времени по сравнению с тактикой, предусматривающей попытки первоначальной медикаментозной стабилизации. Полученные данные являются дополнительным свидетельством важности транспортировки подобных больных в специализированные лечебные учреждения, в которых возможно квалифицированное выполнение реваскуляризации миокарда. Дыхание под постоянным положительным давлением способствует снижению летальности при кардиогенном отеке легких: мета-анализ рандомизированных контролируемых исследований. Ventilatory support with continuous positive airway pressure possesses decrease mortality in patients with acute cardiogenic pulmonary oedema: meta-analysis of randomized controlled trials. Подготовил И.С. Явелов Цель изучения. Результаты ряда исследований свидетельствуют о достоверном уменьшении потребности в инвазивной искусственной вентиляции легких (ИВЛ), требующей интубации трахеи, у больных с острым кардиогенным отеком легких при применении дыхательной поддержки, включающей дыхание через маску под постоянным положительным давлением (ППД) и двухуровневую неинвазивную ИВЛ (ДНИВЛ) [1,2]. В 1998 г. при совокупном анализе трех из них оказалось, что при дыхании под ППД имеется тенденция к уменьшению летальности в период госпитализации [2]. Однако с другой стороны, в одном из клинических испытаний ДНИВЛ была сопряжена с более высокой частотой возникновения инфаркта миокарда в сравнении дыханием под ППД [3]. Чтобы выяснить влияние данных способов дыхательной поддержки на клинически значимые исходы заболевания был проведен мета-анализ результатов сравнительных испытаний, выполненных с 1966 г. по май 2005 г. [4]. Методы. После поиска в электронных базах данных для анализа были отобраны 23 рандомизированных контролируемых клинических исследования, содержащие информацию о летальности в стационаре и потребности в инвазивной ИВЛ, в которых у больных с острым кардиогенным отеком легких сопоставлялись дыхание под ППД и стандартное лечение заболевания, включающее дыхание кислородом через маску, ДНИВЛ и стандартное лечение, а также дыхание под ППД и ДНИВЛ. Результаты. По данным 11-ти исследований, включавших в совокупности 532 больных, дыхание под ППД в сравнении со стандартным лечением сопровождалось достоверным уменьшением риска смерти во время госпитализации на 41% (95% границы доверительного интервала [ДИ] 10-62%; р=0,015), что соответствовало предотвращению 101 летального исхода на каждую 1000 леченных (т.е. для спасения одного больного необходимо было лечить 10 человек). Хотя аналогичная тенденция отмечалась и 7-ми исследованиях ДНИВЛ, включавших в совокупности 345 больных, различие с группами стандартного лечения не достигало статистической значимости. Оба вмешательства способствовали уменьшению необходимости в инвазивной ИВЛ: для дыхания под ППД снижение риска составило 54% (95% ДИ 34-71%; р=0,0003), что соответствовало 161 предотвращенной процедуре на каждую 1000 леченных (для исключения одной инвазивной ИВЛ необходимо было лечить 6 человек); для дыхание ДНИВЛ снижение риска составило 50% (95% ДИ 10-73%; р=0,02), что соответствовало 136 предотвращенным процедурам на каждую 1000 леченных (для исключения одной инвазивной ИВЛ необходимо было лечить 7 человек). Статистически значимых различий влияния дыхания под ППД и ДНИВЛ на этот показатель эффективности лечения отмечено не было. Длительность госпитализации при использовании изученных неинвазивных способов дыхательной поддержки не уменьшилась, продолжительность дыхания под ППД и ДНИВЛ существенно не различалась. Достоверного неблагоприятного воздействия изучавшихся способов дыхательной поддержки на частоту инфарктов миокарда отмечено не было, однако при сопоставлении ДНИВЛ с дыханием под ППД (8 исследований, 344 больных) отмечалась тенденция к более частому возникновению этого осложнения при использовании ДНИВЛ (отношение шансов 1,49; 95% ДИ 0,92-2,42; р=0,11). Выводы. По данным проведенного мета-анализа у больных с острым кардиогенным отеком легких дыхание под ППД и ДНИВЛ позволяют уменьшить потребность в инвазивной ИВЛ, возникающую в связи с недостаточной эффективностью стандартного лечения, включающего дыхание кислородом через маску. При этом дыхание под ППД способствует снижению летальности в период госпитализации. Отсутствие достоверного влияния ДНИВЛ на этот показатель наряду с меньшей эффективностью вмешательства могло быть обусловлено недостаточным количеством изученных больных, увеличением числа случаев инфаркта миокарда, а также большей тяжестью заболевания у лиц, отобранных для проведения ДНИВЛ. Вместе с тем, в проведенные клинические исследования включалась только часть больных, госпитализированных с острым кардиогенным отеком легких, и их общее число было небольшим. Все это ограничивает возможность распространения полученных результатов на все случаи госпитализации с указанным проявлением острой сердечной недостаточности. Кроме того, величина положительного давления в дыхательных путях в конце выдоха в начале дыхания под ППД (10 см водного столба в 6-ти из 8-ми исследований), как правило, была выше, чем при ДНИВЛ (≤5 см водного столба в 7-ми из 8-ми исследований). Установить значение этого фактора, а также оценить роль ДНИВЛ у больных с гиперкапнией предстоит при дальнейшем изучении. Сравнение сочетания клопидогреля с аспирином и принимаемых внутрь антикоагулянтов для предупреждения сосудистых осложнений у больных с мерцательной аритмией: результаты рандомизированного контролируемого испытания ACTIVE W iii[*] «Варфарин остается стандартом антитромботического лечения для всех подходящихiii[†] больных с фибрилляцией предсердий». Verheught F.W.A. [8] Применение антикоагулянтов для приема внутрь (АПНiii[‡]) является стандартным компонентом лечения больных мерцательной аритмией (МА). Однако связанные с ним опасность кровотечений и необходимость контроля заставляют искать альтернативные пути профилактики возможных при МА тромбоэмболических осложнений. Одним из таких путей является использование активной комбинированной антитромбоцитарной терапии, в частности комбинации аспирин-клопидогрель. Эффективность и безопасность сочетания аспирин-клопидогрель были сравнены в испытании ACTIVE W, результаты которого были недавно опубликованы в журнале Ланцет [1]. Ниже представлено краткое изложение этой публикации. Обоснование и цель исследования. Мерцательная аритмия (МА) является наиболее распространенной аритмией, особенно у людей старшего возраста. Ее наличие повышает риск различных сердечно-сосудистых осложнений 2,3. В сравнении с аспирином использование АПН у больных с МА позволяет уменьшить риск развития инсульта на 45%, других сердечно-сосудистых осложнений на 29%, однако при этом на 70% увеличивается риск крупных кровотечений 4. Тем не менее, АПН считаются средством выбора у больных с МА и высоким риском сосудистых осложнений 5. Однако на практике из-за необходимости регулярного мониторирования уровня антикоагуляции АПН получают не более половины нуждающихся в них больных 6. Поэтому поиск эффективной и безопасной альтернативы этим лекарственным средствам имеет большое клиническое значение. Ранее была установлена польза добавления к аспирину производных тиенопиридина у больных с острым коронарным синдромом, а также после коронарного стентирования 7. Ожидалось, что сочетание аспирина с клопидогрелем окажется не менее эффективным средством предупреждения сосудистых осложнений у больных с МА и высоким риском инсульта, чем АПН. Методы. Программа Испытание клопидогреля и ирбесартана при фибрилляции предсердий для предупреждения сосудистых событий (Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events – ACTIVE) включала в себя три отдельных взаимосвязанных исследования. Больные, подходившие для использования АПН и желавшие получать такое лечение, были включены в открытое испытание ACTIVE W, в котором сочетание аспирина с клопидогрелем сравнивалось с АПН. Больные с противопоказаниями для применения АПН или не желавшие получать подобное лечение, были включены в двойное слепое испытание ACTIVE A, в котором клопидогрель сравнивался с плацебо у больных, получавших аспирин. В плацебо-контролируемое испытание ирбесартана ACTIVE I рандомизировались больные, включенные в ACTIVE W или в ACTIVE A (рис.1). Рис.1 Включение больных в ACTIVE Доказательство мерцание предсердий и высокого риска сердечно-сосудистых осложнений Факторы выбора ACTIVE A ACTIVE W Аспирин + клопидогрель* в сравнении с непрямыми антикогулянтами N=6500 *Аспирин 75-100 мг/сут., клопидогрель 75 мг/сут., ОАК (МНО 2-3), ирбесартан 150 мг/сут (через 2 нед.- 300 мг/сут.) ACTIVE A Аспирин + клопидогрель* в сравнении с аспирином N=7500 ACTIVE I *Ирбесартан в сравнении с плацебо Среднее время наблюдения 3 года В этом сообщении представлены представлены результаты исследования ACTIVE W; исследования ACTIVE A и ACTIVE I продолжаются [1]. В исследование ACTIVE W включались больные с МА (пароксизмальной, персистирующей или постоянной), подтвержденной ЭКГ, имевшие хотя бы один из факторов риска сосудистых осложнений: возраст 75 лет и старше; лечение артериальной гипертензии; наличие в анамнезе инсульта, преходящего нарушения мозгового кровообращения или артериальные эмболии не в сосуды центральной нервной системы (ЦНС); фракция выброса левого желудочка <45%; периферический атеросклероз; возраст 55-74 лет с наличием сахарного диабета, требующего лечения, или коронарной болезни сердца. Не включались больные с противопоказаниями к клопидогрелю или АПН, документированной язвенной болезнью в предшествущие 6 месяцев, геморрагическими инсультами в анамнезе, тромбоцитопенией (тромбоциты< 50×109 /л) или митральным стенозом. Больные, рандомизированные к открытому приему АПН, получали доступный в их стране препарат с ежемесячным контролем международного нормализованного отношения (МНО) для его поддержания на уровне 2-3. Другая группа больных получала сочетание клопидогреля в дозе 75 мг 1 раз/сут и аспирина в дозе 75-100 мг 1 раз/сут. Первичной конечной точкой являлось первое возникновение инсульта, или артериальных (системных) эмболий не в сосуды ЦНС, или инфаркта миокарда (ИМ), или сердечно-сосудистой смерти. Результаты. В группу сочетания клопидогреля с аспирином было рандомизировано 3335 больных, в группу непрямых антикоагулянтов – 3371. Большинство больных (68%) страдали постоянной формой МА, аритмия продолжалась >2-х лет в 59% случаев. Синусовый ритм на исходной ЭКГ был отмечен у 13% больных. Инсульт или преходящее нарушение мозгового кровообращения перенесли 15% больных, ИМ в анамнезе имели 17%, доказательства наличия коронарной болезни сердца 28%. Большинство (77%) при включении в исследование принимали АПН. За время изучения в группе получавших АПН терапевтический уровень МНО (2-3) поддерживался у 63,8% больных, был ниже 2 у 20,8% и выше 3 у 15,4%. ACTIVE W было преждевременно остановлено 25 августа 2005 г. из-за очевидного преимущества АПН перед сочетанием клопидогреля с аспирином. Медиана длительности наблюдения составила 1,28 года. За время наблюдения в группе больных, получавших непрямые антикоагулянты, события, входившие в состав комбинированной конечной точки, отмечены в 164 случаях (годовая частота 3,9%). У больных, получавших сочетание клопидогреля с аспирином, зарегистрировано 234 события (годовая частота 5,6%). Относительный риск (ОР) возникновения этих неблагоприятных событий при применении клопидогреля с аспирином в сравнении с АПН составил 1,44; 95% доверительный интервал (95% ДИ) 1,18-1,76; p=0,0003. При рассмотрении отдельных компонентов комбинированной конечной точки оказалось, что АПН достоверно лучше снижали риск развития инсульта (ОР 1.72; 95% ДИ 1.24-2.37; р=0.001) и риск артериальных эмболий не в сосуды ЦНС (ОР 4.66; 95% ДИ 1.58-13.8; р=0.005). Частота ИМ в сравниваемых группах достоверно не отличалась и составляла менее 1% в год. Риск сердечно-сосудистой смерти, не сердечнососудистой и смерти от всех причин в группах больных, принимавших сочетание клопидогреля с аспирином и АПН статистически значимо не отличался (соответственно ОР 1.14; р=0.34; ОР 0.76; р=0,20 и ОР 1.01; р=0.91). Риск кровотечений у больных, получавших сочетание клопидогреля с аспирином, оказался достоверно выше, чем у принимавших АПН (ОР 1.21; 95% ДИ 1.08-1.35; р=0.001). При этом по частоте крупных кровотечений, включая тяжелые и смертельные, группы достоверно не различалась (ОР 1.1; р=0.53), а риск развития небольших кровотечений у больных, получавших АПН, был существенно ниже (ОР 1.23; 95% ДИ 1.09-1.39; р=0.0009). Рис.2. Сердечно-сосудистые события (первичные исходы) и крупные кровотечения АнтиКлопидогрель коагулянты ОтносительКонечные точки для приема ный риск +аспирин внутрь р Инсульт/эмболия не в ЦНС / инфаркт миокарда / сосудистая смерть (%/год) 5.60 3.93 1.44 0.0003 Крупные кровотечения (%/год) 2.42 2.21 1.10 0.53 The ACTIVE Writing Group on behalf of the ACTIVE Investigators. Lancet 2006; 367: 1903 Кумулятивный риск возникновения первичного исхода Клопидогрель +аспирин Антикоагулянты Относительный риск 1.44 р=0.0003 Годы The ACTIVE Writing Group on behalf of the ACTIVE Investigators. Lancet 2006; 367: 1903 Большинство больных, включенных в исследование (77%), принимали АПН до рандомизации. По сравнению с лицами, ранее не получавшими АПН, в этой подгруппе на протяжении исследования лучше контролировались артериальная гипертензия, МНО чаще находилось в границах терапевтического диапазона (62.4 против 57.2% в течение 3 месяцев; р< 0.0001) и была отмечена достоверно меньшая частота преждевременного прекращения лечения (8.7 против 15.3% на протяжении года; р=0,008). У больных, получавших АПН до рандомизации, риск возникновения событий, входивших в состав комбинированной конечной точки, среди рандомизированных к применению АПН был достоверно ниже, чем при использование сочетания клопидогреля с аспирином (ОР 1.5; р=0.0005). У больных, не принимавших АПН до рандомизации, различие не было достоверным (ОР 1.27; р=0.24). В ходе исследования у больных, не принимавших АПН до рандомизации, частота крупных кровотечений при использовании АПН была выше, чем в группе сочетания клопидогрела с аспирином. С другой стороны, у больных, принимавших АПН до рандомизации, частота крупных кровотечений была больше в группе сочетания клопидогреля с аспирином (р для взаимодействия 0,028). Комментируя эти результаты, авторы работы отмечают, что больные, принимавшие АПН до рандомизации и продолжавшие получать их во время исследования, по-видимому, обладали лучшей приверженностью к такому лечению и исходно лучше переносили АПН. У больных неклапанной МА с высоким риском сосудистых осложнений профилактическая эффективность АПН в дозах, необходимых для поддержания МНО на уровне 2-3, была заметно выше, чем при применении сочетания клопидогреля в дозе 75 мг/сут и аспирина в дозе 75-100 мг/сут. При этом риск возникновения серьезных кровотечений при использовании этих двух подходов к профилактике артериальных тромбоэмболий существенно не различался. Выводы резюме публикации. Терапия антикоагулянтами для приема внутрь превосходит комбинацию клопидогрель плюс аспирин в отношении предупреждения сосудистых событий у больных с мерцанием предсердий с высоким риском инсульта, особенно у тех из них, кто уже получает терапию антикоагулянтами для приема внутрь. Заключение. Таким образом, согласно результатам ACTIVE-W в профилактике тромбоэмболических осложнений у больных с мерцательной аритмией и высоким риском сосудистых осложнений антикоагулянты для приема внутрь остаются средствами выбора. Данные же полученные при анализе подгруппы больных, которые при включении в испытание впервые начали антитромботическое лечение, могут явиться только основанием для специально спланированного клинического исследования Сравнение реперфузионной терапии тенектеплазой и прямого чрескожного коронарного вмешательства у рано госпитализированных больных с острым крупноочаговым инфарктом миокарда. Результаты испытания WEST. Подготовил Трифонов И.Р. До настоящего времени в среде кардиологов нет однозначного мнения об оптимальной реперфузионной стратегии при остром коронарном синдроме с подъемами сегмента ST. Возможность использовать фибринолитик догоспитально, относительная дешевизна фибринолитической терапии (ФЛТ) в сравнении с чрескожными коронарными вмешательствами (ЧКВ), короткий период от первого контакта с медицинским персоналом до начала такого лечения, делают ФЛТ весьма привлекательной, особенно в первые часы заболевания. Однако ФЛТ не всегда достигает своей цели и обеспечивает удовлетворительную реканализацию (степень кровотока 3 по шкале TIMI) ответственной за возникновение инфаркта миокарда – («инфаркт-связанной») - артерии лишь в 29 -54% случаев. ЧКВ обеспечивает такое восстановление кровотока в 90% случаев [1,2]. Именно с ФЛТ связано такое опасное, как правило фатальное, осложнение, как внутричерепное кровоизлияние (ВК). ФЛТ имеет ряд абсолютных противопоказаний (любое ВК в прошлом, структурные сосудистые аномалии или опухоли головного мозга, ишемическое нарушение мозгового кровообращения или травмы черепа в последние 3 месяца, активные кровотечения или коагулопатии, подозрение на расслаивающую аневризму аорты), и довольно много относительных противопоказаний [3]. В большинстве ситуаций, когда ФЛТ невозможна, ЧКВ может быть выполнено. Кроме того, способность фибринолитика лизировать тромб в коронарном сосуде сильно снижается с течением времени [4]. Результаты испытания PRAGUE 2 показали, что если в первые 3 часа эффективность ФЛТ сопоставима с эффективностью ЧКВ, то у больных с продолжительностью боли более 3 часов она существенно уступает эффективности ЧКВ. Смерть, повторный инфаркт миокарда, инсульт в последующие 30 дней отмечались у 15,2% леченых ФЛТ и у 8,4% подвергнутых ЧКВ (p<0,003) [5]. Согласно данным испытания CAPTIM догоспитальная ФЛТ у больных, рандомизированных в первые 6 часов после начала боли, по способности предотвращать смерти от всех причин в последующие 30 дней сопоставима с ЧКВ, выполненным после госпитализации [6]. Текущие рекомендации Американской Коллегии Кардиологов и Американской Ассоциации Сердца пока признают равноценность этих двух стратегий в течение первых 3 часа с начала развития симптомов [3]. Чтобы прояснить эффективность и безопасность ФЛТ и ЧКВ именно в ранние сроки заболевания было запланировано исследование WEST (Which Early ST-elevation myocardial infarction Therapy) [7]. Материалы и методы. Испытание WEST , выполнявшееся в 4-х городах Канады, было открытым и рандомизированным. В пределах 6 часов от начала симптомов включены 304 больных с ИМ с подъемами ST, превышавшими 4 мм, на ЭКГ. Все больные получали аспирин (100-325 мг), эноксапарин (1 мг на кг веса подкожно при рандомизации и далее с интервалом в 12 часов минимум 72 часа) и были рандомизированы в три группы: A (n=100) леченые тенектеплазой (ТНК) и другими обычными в практике способами; B (n=104) леченые ТНК с обязательным в последующие 24 часа ЧКВ (включая ангиопластику «спасения» (rescue) при безуспешной ФЛТ: то есть при гемодинамической нестабильности или при отсутствии снижения подъемов сегмента ST на ЭКГ≥ на 50% от исходного уровня через 90 минут лечения), С (n=100) леченые первичным ЧКВ и получившие кроме стандартного лечения 100 мг клопидогреля. Применение клопидогреля в группах А и В осуществлялось согласно действующим рекомендациям. Абциксимаб получали все больные в группе С в связи с ЧКВ, а так же все больные других групп, подвергнутые спасительной ангиопластике, но не ранее чем через 3 часа после начала ФЛТ. При оценке эффективности в течение 30 дней в качестве первичной конечной точки учитывалась сумма случаев смерти от всех причин, повторных ИМ, рефрактерной ишемии, появления признаков недостаточности кровообращения, случаи кардиогенного шока и “больших” желудочковых аритмий. Перечисленные компоненты изучались так же изолировано. Вторичными конечными точками были: снижение сегмента ST до изолинии через 90 и 180 минут после начала лечение (оценивали методом Шрëдера [8]), и размеры инфаркта миокарда оцененные с помощью QRS-индекса Сильвестра и пикового значения креатинфосфокиназы [9]. Лабораторная часть исследования включала измерение сывороточного NT-фрагмента пронатрийуретического пептида. Ангиографическое исследование проводилось всем больным групп С и В, и отдельным – в группе А. При оценке безопасности учитывались случаи внутричерепных кровоизлияний (ВЧК), инвалидизирующих инсультов и больших системных кровотечений. При статистическом анализе авторы использовали метод “по намерению лечить”. При оценке данных использовался x2-тест, точный тест Фишера и ряд других методов непараметрической статистики. При анализе времени наступления событий использовался анализ кривых Каплана-Майера. При анализе выживаемости за 30-дней использовалась однофакторная регрессия Кокса с 90% доверительным интервалом. Результаты. При сравнении трех групп по основным характеристикам истории заболевания, данных обследования и сопутствующего лечения единственным значимым отличием было большее число случаев артериальной гипертензии в прошлом в группе В в сравнении с двумя другими группами (p=0,006). Медианы времени с момента начала симптомов до начала ФЛТ составили 113 и 130 минут в группах А и В (различие недостоверно). Время с момента начала симптомов и начала ЧКВ составило 425 минут в группе В и 176 минут в группе С (различие обусловлено протоколом). Следует отметить, что около трети включенных (31 из 100) в группу А за время наблюдения был подвергнут ЧКВ: в 25 случаях это было «ЧКВ спасения», в 6 – ЧКВ по другим показаниям. В большинстве случаев (97%) во время ЧКВ во всех группах выполнялась имплантация стента(ов). Важно, что по результатам ангиографии, выполненной перед ЧКВ в первые сутки заболевания, у больных группы В только в 30%-х случаев была выявлен кровоток, достигающий по шкале TIMI 2-3 степени. Аанализ эффективности показал, что частота возникновения первичной конечной точки в группах А, В и С была близкой: соответственно 25.0, 24.6 и 22,4%. Из 6 умерших За 30 дней умерли 6 человек – 4 в группе А (ФЛТ), и по одному в группах В (ФЛТ и ЧКВ в течение суток) и С (первичное ЧКВ). Число умерших не позволило провести статистический анализ смертности. Однако, при анализе отдельных компонентов первичной конечной точки выявлено, что у больных в группе С (первичное ЧКВ) в сравнении с группой А (ФЛТ) в последующие 30 дней реже возникало такое событие как смерть или повторный ИМ (относительный риск – 0.29; 90%-й доверительный интервал 0.11-1.74; p=0.021) [Рис.1]. При сравнении результатов у больных, включенных до 2-х часов после начала симптомов, и включенных позже, оказалось, что число первичных конечных точек у таких больных группы А достоверно не различалось. В группе С частота первичных конечных точек была вдвое большей у рандомизированных после 2-х часов от начала боли (соответственно 16.4% и 34.4%; p=0.0052). Это единственный факт, указывающий на возможные преимущества ФЛТ перед ЧКВ в очень ранние сроки заболевания. Безопасность. При использовании трех лечебных тактик число геморрагических осложнений было столь низким (1-2 в группе), что результат не поддавался никакой статистической обработке. Дополнительно было показано, что быстрое снижение ST несколько чаще отмечалось в группе С, а максимальные пики общей КФК были следующими: 1199(548– 2351), 1590 (771–2624), и 1833 (852–3649) для групп A, B, и C, соответственно (p=0.0045). При серийном определении сывороточного NT-пронатрийуретического пептида отмечалось его достоверное повышение через 72 часа после начала боли по отношению к уровню при поступлении с постепенным снижением к 30-му дню наблюдения. В целом уровень этого вещества был достоверно выше в группе С, чем в группе А, на всех этапах определения (72-96 часов с начала боли – p=0.003; 30-й день наблюдения – p=0,0007). Заключение. Результаты этого небольшого исследования хорошо иллюстрируют проблему выбора лечебной реперфузионной тактикиiii[1]. C одной стороны получено еще одно свидетельство превосходства ЧКВ над ФЛТ , что совпадает с результатами многих небольших исследований и данными недавно опубликованного крупного объединяющего статистического анализа Е.Boersma et al [4]. C другой стороны анализ подгруппы очень рано рандомизированных (в первые 2 часа) указывает на возможные преимущества ФЛТ в эти сроки. Однако, даже результаты более крупного исследования CAPTIM, в котором эффективности ранней догоспитальной ФЛТ и ЧКВ были сопоставимыми, многими экспертами признаются неубедительными, так как состояние более трети больных в группе ФЛТ потребовало в дальнейшем ЧКВ [6]. С другой стороны неожиданно высокая внутрибольничная смертность среди больных, подвергнутых ЧКВ после догоспитальной ФЛТ (facilitated – т.е. «усиленному» или вспомогательному ЧКВ), в сравнении со смертностью леченных догоспитально только ФЛТ, выявленная в ходе исследования ASSENT-IV [10], характеризуют «усиленное ЧКВ для всех» как сомнительную тактику. Видимо, до завершения продолжающихся крупных исследований «вспомогательного» (facilitated) ЧКВ, следует придерживаться избирательной тактики лечения – использовать догоспитальную ФЛТ, если быстрая доставка больного для первичного ЧКВ невозможна, а в дальнейшем выполнять ЧКВ «спасения» гемодинамически нестабильным больным и больным без признаков успешной реперфузии миокарда.