Каф.ПП №2, юлиш Харьков
реклама

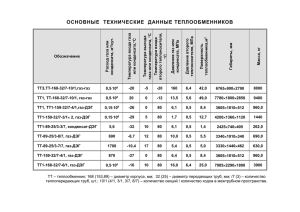
УДК 616-053.2:612.233]-073.175 Клименко В.А., Криворотько Д.Н. Кафедра пропедевтики педиатрии № 2, Харьковский национальный медицинский университет, г. Харьков Анализ выдыхаемого воздуха как маркер биохимических процессов в организме Резюме. В обзоре литературы отображены основные исторические этапы развития исследований выдыхаемого воздуха и современные представления о биомаркерах конденсата выдыхаемого воздуха у человека. Ключевые слова: диагностика, выдыхаемый воздух, биомаркеры, конденсат. В здоровом теле – здоровый выдох! В.А. Скрупский Одним из важных направлений современной медицины является неинвазивная диагностика. Актуальность проблемы обусловлена щадящими методическими приемами забора материала для анализа, когда пациенту не приходится испытывать боль, физический и эмоциональный дискомфорт; безопасностью исследований ввиду невозможности заражения инфекциями, передающимися через кровь или инструментарий. Неинвазивные методы диагностики могут применяться, с одной стороны, в амбулаторных условиях, что обеспечивает их широкое распространение; с другой стороны, у пациентов в реанимационном отделении, т.к. тяжесть состоянии больного не является противопоказанием для их выполнения. В последнее время в мире возрос интерес к исследованию выдыхаемого воздуха (ВВ), как к неинвазивному методу диагностики бронхолегочных, сердечно-сосудистых, желудочно-кишечных и других заболеваний. Известно, что функциями легких, помимо респираторной, являются метаболическая и выделительная. Именно в легких подвергаются ферментативной трансформации такие вещества, как серотонин, ацетилхолин и, в меньшей степени, — норадреналин. Легкие обладают самой мощной ферментной системой, разрушающей брадикинин (80 % брадикинина, введенного в легочный кровоток, инактивируются при однократном прохождении крови через легкие). В эндотелии легочных сосудов синтезируются тромбоксан В2 и простагландины, а 90—95 % простагландинов группы Е и Fа инактивируются также в легких. На внутренней поверхности легочных капилляров локализуется большое количество ангиотензин-конвертирующего фермента, который катализирует превращение ангиотензина I в ангиотензин II. Легкие играют важную роль в регуляции агрегатного состояния крови благодаря своей способности синтезировать факторы свертывающей и противосвертывающей систем (тромбопластин, факторы VII, VIII, гепарин). Через легкие выделяются летучие химические соединения, образующиеся в ходе реакций обмена, происходящих как в легочной ткани, так и во всем организме человека. Так, например, ацетон выделяется в реакциях окисления жиров, аммиак и сероводород – при обмене аминокислот, предельные углеводороды – в ходе перекисного окисления ненасыщенных жирных кислот. По изменению количества и соотношения выделяемых при дыхании веществ можно делать выводы об изменениях обмена веществ и наличии болезни. С древних времен для диагностики заболеваний учитывался состав ароматических летучих веществ, выделяемых больным при дыхании и через кожу (т.е. «запахи», исходящие от пациента). Продолжая традиции античной медицины, известный клиницист начала ХХ века М.Я. Мудров писал: «Обоняние твое да будет чувствительным не к масти благовоний для влас твоих, не к ароматам, из одежды твоей испаряемым, а к запертому и зловонному воздуху, окружающему больного, к заразительному его дыханию, поту и ко всем его извержениям» [1]. Анализ выделяемых человеком ароматических химических веществ имеет для диагностики столь важное значение, что многие запахи описаны как патогномоничные симптомы заболеваний: например, сладковатый «печеночный» запах (выделение метилмеркаптана – метаболита метионина) при печеночной коме, запах ацетона у больного в кетоацидотической коме или запах аммиака при уремии. Длительный период анализ ВВ носил субъективный и описательный характер, но с 1784 года его изучение наступило в новый этап – назовем его условно «параклинический» или «лабораторный». В этом году французский естествоиспытатель Антуан Лоран Лавуазье вместе с известным физиком и математиком Симоном Лапласом провели первое лабораторное исследование выдыхаемого воздуха у морских свинок. Они установили, что выдыхаемый воздух состоит из «удушливой части», дающей угольную кислоту, и инертной части, которая выходит из легких без изменений. Эти части позже назвали углекислым газом и азотом [2, 3]. «Из всех явлений жизни нет более поразительного и заслуживающего внимание, чем дыхание» пророчески писал А.Л. Лавуазье. Долгое время (ХVIII-ый и весь ХIХ-ый века) анализ ВВ проводился химическими методами. Концентрации веществ в ВВ низкие, поэтому для их выявления требовалось пропускание больших объемов воздуха через поглотители и растворы. В середине XIX века немецкий врач А. Небельтау впервые использовал исследование ВВ для диагностики заболевания – в частности, нарушения обмена углеводов. Он разработал способ определения малых концентраций ацетона в ВВ. Больному предлагалось выдыхать в трубку, опущенную в раствор йодата натрия. Ацетон, содержащийся в воздухе, восстанавливал йод, при этом изменялся цвет раствора, по которому А. Небельтау довольно точно определял концентрацию ацетона [4]. В конце ХІХ - начале ХХ века количество исследований по изучению состава ВВ резко возросло, что было связано, прежде всего, с потребностями военно-промышленного комплекса. В 1914 году в Германии была спущена на воду первая подводная лодка «Лолиго», что стимулировало поиск новых способов получения «искусственного воздуха» для дыхания под водой. Фриц Хабер, разрабатывая химическое оружие (первые отравляющие газы) с осени 1914 г., параллельно разрабатывал защитную маску с фильтром. Первая газовая атака на фронтах Первой мировой войны 22 апреля 1915 года привела к изобретению в том же году противогаза. Развитие авиации и артиллерии сопровождалось строительством бомбоубежищ с принудительной вентиляцией. В дальнейшем изобретение ядерного оружия стимулировало проектировку бункеров для длительного пребывания в условиях "ядерной зимы", а развитие космической науки требовало создания новых поколений систем жизнеобеспечения с искусственной атмосферой. Все эти задачи по разработке технических устройств, обеспечивающих нормальное дыхание в замкнутых пространствах, могли быть решены только при условии изучения состава вдыхаемого и выдыхаемого воздуха. Это та ситуация, когда «не было бы счастья, да несчастье помогло». Помимо углекислого газа, кислорода и азота, в ВВ были обнаружены пары воды, ацетон, этан, аммиак, сероводород, окись углерода и некоторые другие вещества. Anstie в 1874 г. выделил этанол в ВВ – этот метод и сегодня используется в дыхательном тесте на алкоголь [5]. Но «качественный» прорыв в изучении состава ВВ был сделан только в начале ХХ века, когда начали применяться масс-спектрография (Томпсон, 1912) и хроматография. Эти аналитические методы позволяли определять вещества, находящиеся в низких концентрациях и не требовали больших объемов воздуха для выполнения анализа. Хроматография была впервые применена русским учёным-ботаником Михаилом Семеновичем Цветом в 1900 году, но метод был незаслуженно забыт и практически не развивался до 30-х годов. Возрождение хроматографии связано с именами английских ученых Арчера Мартина и Ричарда Синга, которые в 1941 г. разработали метод распределительной хроматографии, за что им в 1952 году была присуждена Нобелевская премия в области химии [6]. И с середины XX века до наших дней хроматография и масс-спектрография являются одними из наиболее широко применяемых аналитических методов для изучения ВВ. Этими методами в ВВ было определено около 400 летучих метаболитов, многие из которых используются как маркеры воспаления, определены их специфичность и чувствительность для диагностики многих заболеваний. Описание веществ, выявленных в ВВ при различных нозологических формах, в данной статье нецелесообразно, т.к. даже их простое перечисление займет многие страницы. Применительно к анализу летучих веществ ВВ необходимо сделать акцент на трех моментах. Во-первых, анализ летучих веществ ВВ уже «вышел» из лабораторий и сегодня имеет не только научный и теоретический интерес, но сугубо практическое значение. Примером являются капнографы (приборы, регистрирующие уровень углекислого газа). С 1943 г. (когда Luft создал первый прибор для регистрации СО2) капнограф – обязательный компонент аппаратов ИВЛ и анестезиологической аппаратуры. Другой пример – определение оксида азота (NO). Впервые его содержание в ВВ было измерено в 1991 г. L. Gustafsson и соавт. у кроликов, морских свинок и людей [7]. В последующем потребовалась одна пятилетка, чтобы значение этого вещества как маркера воспаления было доказано. В 1996 г. группой ведущих исследователей созданы единые рекомендации по стандартизации измерений и оценки выдыхаемого NO - "Exhaled and nasal nitric oxide measurements: recommendations" [8]. А в 2003 г. получено разрешение FDA и начато промышленное производство детекторов NO [9]. В развитых странах определение оксида азота в ВВ широко применяется в рутинной практике пульмонологами, аллергологами как маркер воспаления дыхательных путей у стероид-наивных пациентов и для оценки эффективности противовоспалительной топической терапии у больных с хроническими обструктивными заболеваниями легких [10, 11, 12]. Во-вторых, наибольшая диагностическая значимость анализа ВВ отмечена при заболеваниях органов дыхания – описаны достоверные изменения состава ВВ при бронхиальной астме, ОРВИ, бронхоэктатической болезни, фиброзирующем альвеолите, туберкулезе, реакции отторжения легочного трансплантата, саркоидозе, хроническом бронхите, поражении легких при системной красной волчанке, аллергическом рините и др. [13]. В-третьих, при некоторых нозологических формах анализ ВВ позволяет выявить патологию на той стадии развития, когда другие методы диагностики малочувствительны, неспецифичны и неинформативны. Например, обнаружение алканов и монометилированных алканов в ВВ позволяется диагностировать рак легких на ранних стадиях (Gordon et al., 1985) [14], в то время как стандартные скрининг - исследования при опухоли легких (рентгенография и цитология мокроты) еще не информативны [15]. Исследование данной проблемы было продолжено Phillips et al., 1999 г. - ими определено в ВВ 22 летучих органических вещества (преимущественно алканы и производных бензола), содержание которых было достоверно выше у больных с опухолью легких [16]. Ученые из Италии (Diana Poli et al., 2005) показали возможность использования стиролов (с молекулярной массой 10-12 M) и изопренов (10-9 M) в ВВ как биомаркеров опухолевого процесса диагноз был корректно установлен у 80 % больных [17]. Таким образом, исследование ВВ продолжается достаточно активно по многим направлениям, и изучение литературы по данной проблеме вселяет в нас уверенность, что в будущем анализ ВВ для диагностики заболеваний станет столь же рутинным методом, как контроль уровня алкоголя в ВВ у водителя транспортного средства работником ГАИ. Новый этап изучения свойств ВВ начался в конце 70-х годов прошлого века - Нобелевский лауреат Linus Pauling (Лайнус Полинг) предложил анализировать конденсат ВВ (КВВ). Используя методы газовой и жидкостной хроматографии, ему удалось идентифицировать до 250 веществ [18], а современные методики позволяют определить до 1000(!) субстанций в КВВ [19]. С физической точки зрения ВВ представляет собой аэрозоль, состоящий из газообразной среды и взвешенных в ней жидких частиц. ВВ насыщен водяными парами, количество которых составляет примерно 7 мл/кг массы тела в сутки. Взрослый человек выделяет через легкие около 400 мл воды в сутки, но суммарный объем экспиратов зависит от многих «внешних» (влажность, давление окружающей среды) и «внутренних» (состояния организма) факторов. Так, при обструктивных заболеваниях легких (бронхиальная астма, хронический обструктивный бронхит) объем экспиратов уменьшается, а при остром бронхите, пневмонии – увеличивается; гидробалластная функция легких уменьшается с возрастом - на 20% каждые 10 лет, зависит от физической нагрузки и т.д. [20, 21]. Увлажнение ВВ также определяется бронхиальным кровообращением [22]. Водяные пары служат переносчиками многих летучих и нелетучих соединений посредством растворения молекул (согласно коэффициентам растворения) и образования новых химических веществ внутри аэрозольной частицы [23]. Известны два основных метода формирования аэрозольных частиц: 1. конденсационный – «от малого к большому» - образование капель жидкости из молекул перенасыщенного пара; 2. диспергационный – «от большого к малому» - измельчение бронхоальвеолярной жидкости, выстилающей респираторный тракт, при турбулентном потоке воздуха в дыхательных путях [24, 25]. Средний диаметр аэрозольных частиц в норме при нормальном дыхании у взрослого человека составляет 0,3 мкм, а количество – 0,1 – 4 частицы в 1 см2 [26]. При охлаждении воздуха водяные пары и содержащиеся в них вещества конденсируются, что делает возможным их количественный анализ. Таким образом, диагностические возможности исследования КВВ базируются на гипотезе, что изменения концентрации химических веществ в КВВ, сыворотке крови, легочной ткани и бронхоальвеолярной лаважной жидкости одинонаправлены [19, 27]. Для получения КВВ используют приборы как серийного (EcoScreen® - Jaeger Tonnies Hoechberg, Германия; R Tube® - Respiratory Research, Inc., США), так и кустарного производства. Принцип действия всех устройств единый: пациент совершает форсированные выдохи в емкость (сосуд, колбу, трубку), в которой водяные пары, содержащиеся в воздухе, конденсируется при охлаждении. Охлаждение осуществляется жидким или сухим льдом, реже – жидким азотом. Для улучшения конденсации водяных паров в емкости для сбора КВВ создается турбулентный поток воздуха (изогнутая трубка, изменение диаметров сосуда). Подобные устройства позволяют собрать у детей старшего возраста и взрослых до 5 мл конденсата за 10-15 мин дыхания. На кафедре пропедевтики педиатрии № 2 ХНМУ (В.А. Клименко, Д.Н. Криворотько, 2009) кустарным способом создано устройство для получения КВВ у детей раннего возраста. Устройство состоит из стеклянной изогнутой трубки, помещенной в сосуд с жидким льдом, системы клапанов (вдоха/выдоха) и маски для дыхания. Для сбора конденсата не требуется активного сознательного участия пациента, что делает возможным применение методики с периода новорожденности. За 45 мин спокойного дыхания у новорожденных с пневмонией удается получить 0,1-0,3 мл конденсата. Большинство биологически-активных веществ могут быть исследованы в конденсате, собранном при помощи самодельных приборов. Исключение составляют лейкотриены – учитывая их быстрый метаболизм и нестабильность, они могут быть определены только в замороженных образцах, полученных приборами серийного производства. Например, в устройстве EcoScreen создается температура до -10°С, что обеспечивает быструю заморозку конденсата. На состав КВВ может влиять материал, из которого изготовлен контейнер – так, при исследовании производных липидов прибор должен быть изготовлен из полипропилена и рекомендуется избегать контакта КВВ с полистиреном, который может абсорбировать липиды, влияя на точность измерений [29, 30]. Какие биомаркеры сегодня определены в КВВ? Наиболее полный ответ на этот вопрос содержится в обзоре, выполненном Montuschi Paolo (отделение фармакологии медицинского факультета Католического Университета Святого Сердца, Рим, Италия). Обзор опубликован в 2007 году в журнале «Therapeutic Advances in Respiratory Disease» [31] - данные представлены в таблице 1. Таблица №1. Биомаркеры в конденсате выдыхаемого воздуха (Montuschi Paolo, 2007) Биомолекулы Методы определения Кто исследовал первым, год 8-изопростан Газовая хроматография (ГХ) / Carpenter et al., 1998 масс-спектрография (МС) Радиоиммунный анализ (РИА) Montuschi et al., 2003 Иммуноферментный анализ (ИФА) Montuschi et al., 1999 Жидкостная хроматография (ЖХ) / МС Montuschi et al., 2004 ГХ / МС Cap et al., 2004 ИФА Montuschi and Barnes, 2002 LTD4 ГХ / МС Cap et al., 2004 LTE4 ГХ / МС Cap et al., 2004 ИФА Mondino et al., 2004 ИФА Antczak et al., 2001 Простагландин ГХ / МС Carpenter et al., 1998 (PG) E2 РИА Montuschi et al., 2003 ИФА Montuschi and Barnes, 2002 ИФА Montuschi and Barnes, 2002 Лейкотриены (LT) LTB4 Цистеиновые Простаноиды (C4, D4, E4) PGF2α PGD2 ИФА Тромбоксан В2 РИА Montuschi and Barnes, 2002 Vass et al., 2003 ИФА Montuschi and Barnes, 2002 Ионы водорода pH-метрия Hunt et al., 2000 Перекись водорода Спектрофотометрия (СФМ) Dekhuijzen et al., 1996 Флюорометрический анализ (ФМА) Jobsis et al., 1997 Хемилюминисцентный метод Zappacosta et al., 2001 CФМ Cunningham et al., 2000 Флюорометрия Balint et al., 2001 Нитраты Флюорометрия Balint et al., 2001 S-Нитрозотиол CФМ Corradi et al., 2001 Флюорометрия Kharitonov et al., 2002 ГХ / МС Larstad et al., 2005 ЖХ / МС Goen et al., 2005 Высокоэффективная ЖХ Celio et al., 2006 ИФА Hanazawa et al., 2000 Аденозин Высокоэффективная ЖХ Vass et al., 2003 Глутатион Высокоэффективная ЖХ Corradi et al., 2003 Альдегиды ЖХ / МС Corradi et al., 2003 Высокоэффективная ЖХ Larstad et al., 2002 TBARS1 Спектрофлуорометрия Nowak et al., 1999 ДНК Полимеразная цепная реакция (ПЦР) Gessner et al., 2004 (TxB2) NO Нитриты Производные 3-Нитротирозин Электролиты (натрий, Ионно-селективные электроды Effros et al., 2002 калий, кальций, Ионная хроматография Effros et al., 2003 ELISA2 Jackson et al., 2007 ИФА Scheideler et al., 1993 Мультиплексный иммуноанализ3 Sack et al., 2006 IL-2 Поточная цитометрия Robroeks et al., 2006 IL-4 Протеиновая матрица4 Matsunaga et al., 2006 Поточная цитометрия Robroeks et al., 2006 ELISA Shahid et al., 2002 IL-5 ELISA Profita et al., 2006 IL-6 Мультиплексный иммуноанализ Sack et al., 2006 магний, хлориды) Кератин Цитокины IL-1β ИФА Bucchioni et al., 2003 ELISA Rozy et al., 2006 Протеиновая матрица Protein array Matsunaga et al., 2006 Мультиплексный иммуноанализ Sack et al., 2006 ELISA Cunningham et al., 2000 Поточная цитометрия Robroeks et al., 2006 Мультиплексный иммуноанализ Sack et al., 2006 IL-12p70 Мультиплексный иммуноанализ Sack et al., 2006 IL-17 Протеиновая матрица Matsunaga et al., 2006 Интерферон-γ ИФА Shahid et al., 2002 Поточная цитометрия Robroeks et al., 2006 IGF-1 ELISA Rozy et al., 2006 Интерферон-γ индуцируемый протеин 10 MIP-1α, MIP-1β5 Протеиновая матрица Matsunaga et al., 2006 Протеиновая матрица Matsunaga et al., 2006 PAI-1 6 ELISA Rozy et al., 2006 RANTES Протеиновая матрица Matsunaga et al., 2006 TGF-β7 Протеиновая матрица Matsunaga et al., 2006 TNF-α8 РИА Scheideler et al., 1993 Протеиновая матрица Matsunaga et al., 2006 ELISA Rozy et al., 2006 Мультиплексный иммуноанализ Sack et al., 2006 IL-8 IL-10 1 - TBARS - thiobarbituric acid reactive substances - активные субстанции тиобарбитуровой кислоты 2 - ELISA - enzyme-linked immunosorbent assay - Энзим-связанный иммуносорбентный анализ 3 - Мультиплексный иммуноанализ - Multiplex bead array 4 - Протеиновая матрица - Protein array 5 - MIP - macrophage inflammatory protein- макрофагальный воспалительный протеин 6 - PAI-1 - plasminogen activator inhibitor-1 – ингибитор активатора плазминогена-1 7- TGF-β - transforming growth factor-β – трансформирующий фактор роста β 9 - TNF-α - tumor necrosis factor-α – фактор некроза опцхоли-α. Таким образом, конденсат выдыхаемого воздуха является биологической средой, по изменению состава которой можно судить о морфо-функциональном состоянии, прежде всего респираторного тракта, а также других систем организма. Сбор и исследование конденсата представляет собой новое перспективное направление современных научных исследований. Список литературы. 1. Чем пахнут болезни // Feldcher. Информационный сайт скорой помощи; http://www.feldsher.ru/news-view-1258.html. 2. Открытие газов // Аllchem. Мы знаем о химии все; http://allchem.ru/pages/history/97. 3.Лавуазье Антуан Лоран. Раздел Наука и техника: Химия / Кругосвет. Энциклопедия online; http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/LAVUAZE_ANTUAN_LORAN.html. 4. Hubbard R. S. Determination of acetone in expired air // J. Biol. Chem. 1920. – № 43. - Р. 57–65. 5. Baldwin A. D. Anstie's alcohol limit: Francis Edmund Anstie 1833–1874 // Am. J. Public Health. 1977. –№ 67. – Р. 679–681. 6. Хроматография / Википедия; http://ru.wikipedia.org/wiki. 7. Gustafsson L. E., Leone A. M., Persson M. G., Wiklund N. P. and Moncada S. Endogenous nitric oxide is present in the exhaled air of rabbits, guinea pigs and humans // Biochem. Biophys. Res. Commun. – 1991. - № 181. – Р. 852–857. 8. Kharitonov S.A., Alving K., Barnes P.J. Exhaled and nasal nitric oxide measurements: recommendations // Eur Resp J. - 1997. - № 10. – Р. l683- 1693. 9. Gill M., Graff G. R., Adler A. J. and Dweik R. A. Validation study of fractional exhaled nitric oxide measurements using a handheld monitoring device // J. Asthma. – 2006. – № 43. – Р.731–734. 10. Franklin P.J., Turner S.W., Mutch R.C. Measuring exhaled NO in infants during tidal breathing; methodological issues // Pediat Pulmol. – 2004. – № 37 (1). – Р. 24-30. 11. Strunk R.S. Relationship of exhaled nitric oxide to clinical and inflammatory markers of persistent asthma in children // J Allergy Clin Immunol.- 2003.- № 112.- Р. 883-892. 12. Цыпленкова С. Э. Оксид азота в выдыхаемом воздухе: клинико-функциональные паралели при бронхиальной астме у детей // Аллергология : научно-практический журнал. - 2006. - № 2 . - С. 48-53. 13. Hunt J. Exhaled breath condensate: an evolving tool for non-invasive evaluation of lung disease // J Allergy Clin Immunol. – 2002. – Vol. 110. – P. 28–34. 14. Gordon S.M., Szidon J.P., Krotoszynski B.K., Gibbons R.D., O'Neill H.J. Volatile organic compounds in exhaled air from patients with lung cancer // Clin Chem. – 1985. – № 31. – Р. 12781282. 15. Humphrey LL, Teutsch S, Johnson M, U.S. Preventive Services Task Force: Lung cancer screening with sputum cytologic examination, chest radiography, and computed tomography: an update for the U.S. Preventive Services Task Force // Ann Intern. Med. – 2004. – № 140. – Р. 740753. 16. Phillips M., Gleeson K., Hughes J.M., Greenberg J., Cataneo R.N., Baker L., Mc.Vay W.P. Volatile organic compounds in breath as markers of lung cancer: a cross-sectional study // Lancet. – 1999. – № 353. – Р. 1930-1933. 17. Diana Poli, Paolo Carbognani, Massimo Corradi, Matteo Goldoni, Olga Acampa, Bruno Balbi, Luca Bianchi, Michele Rusca and Antonio Mutti. Exhaled volatile organic compounds in patients with non-small cell lung cancer: cross sectional and nested short-term follow-up study // J. Respiratory Research. - 2005. – № 6 (71). – Р. 1186-1465; http://respiratory- research.com/content/6/1/71. 18. Pauling L., Robinson A. B., Teranishi R. and Cary P. Quantitative analysis of urine vapor and breath by gas–liquid partition chromatography // Proc. Natl Acad. Sci. USA. – 1971. – № 68. – Р. 2374–2376. 19. Raed A. Dweik, Anton Amann. Exhaled breath analysis: the new frontier in medical testing // J. Breath Res. – 2008. - № 2. // doi: 10.1088/1752-7163/2/3/030301. 20. Mc.Cafferty J.B., Bradshow T.A., Tate S. et al. Effects of breathing pattern and inspired air condition onbreath condensate volume, pH, nitrite and protin concentration // Torax. – 2004. – № 59. – P. 694-698. 21. Яковлева О.А., Баяк Н.Ю., Зорин С.М. Патогенетическое значение конденсата выдыхаемого воздуха в патологии органов дыхания. Нереспираторные функции легких.Ленинград, Сборник научных трудов ВНИИ Пульмонологии. – 1988. - С. 67-70. 22. Mc.Fadden E.R. Respiratory heat and water exchange: physiologycal and clinical implications // J. Appl. Physiol. - 1983. – № 54 – P. 326-331. 23. Климанов И.А. Механизмы формирования конденсата выдыхаемого воздуха и маркеры оксидативного стресса при патологиях респираторного тракта // Пульмонология. — 2009. — N 2. — С. 113-119. 24. Климанов И.А., Соодаева С.К., Лисица А.В., Кудрявцев В.Б., Чучалин А.Г. Стандартизация преаналитического этапа исследования конденсата выдыхаемого воздуха // Пульмонология. – 2006. - № 2. – С. 53-55. 25. Райст, П. Аэрозоли. Введение в теорию; ред. Б. Ф. Садовский. - М., Мир. - 1987. - с. 278. 26. Fairchild C.D., Stempfer J.E. Particle concentration in exhaled breath // Am.Industr.Hyg.Assoc. J. – 1987. – № 48. – P. 948-949. 27. Щербакова Н.В., Начаров П.В., Янов Ю.К. Анализ газового состава выдыхаемого воздуха в диагностике заболеваний // Российская отоларингология. – 2005. - № 4 (17). – С. 126-132; http://scholar.google.com/scholar_host?q=info:178WcfHgA20J. 28. Патент № 13276 МГЖ7 G 01 N 33/497. Украина. Лабораторний прилад для отримання конденсату повітря, що видихають. Одинець Ю.В.,.Наконечна М.О, Наконечна Ю.О.; заявник та патентовласник Харьківський державний медичний університет. - № 200509876; заявл. 20.10.05; опубл. 15.03.06, Бюл. № 3. 29. Анаев Э.Х., Чучалин А.Г. Исследование конденсата выдыхаемого воздуха в пульмоногии (обзор зарубежной литературы) // Пульмонология. – 2002. – № 2. – С. 57-65. 30. Rosias P.P. et al. Breath condenser coatings affect measurement of biomarkers in exhaled breath condensate // Eur. Respir. J. – 2006. – № 28. – Р. 1036–1041. 31. Montuschi Paolo. Analysis of exhaled breath condensate in respiratory medicine: methodological aspects and potential clinical applications // Therapeutic Advances in Respiratory Disease. – 2007. – Vol. 1(1). – P.5–23. DOI: 10.1177/1753465807082373. Клименко В.А., Криворотько Д.М. ЗНАЧЕННЯ АНАЛІЗУ ПОВІТРЯ, ЩО ВИДИХАЮТЬ, У ДІАГНОСТИЦІ ХВОРОБ Кафедра пропедевтики педіатрії №2, Харківський національний медичний університет, м. Харків Резюме. В огляді літератури відображені основні історичні етапи розвитку досліджень повітря, що видихають та сучасні уявлення про біомаркери конденсату повітря, що видихає людина. Ключові слова: діагностика, повітря, що видихають, біомаркери, конденсат. Klymenko V.A., Kryvorotko D.N. THE VALUE OF EXHALED-BREATH ANALYSIS FOR DIAGNOSTICS. Department of Introduction to Pediatrics № 2, Kharkiv National Medical University, Kharkiv Summary. The historic stages of exhaled-breath investigations are represented in the literature review. The modern notions about exhaled-breath condensate biomarkers are described. Key words: diagnostic, exhaled-breath, biomarkers, condensate. Виктория Анатольевна Клименко, д.м.н. доцент, кафедра пропедевтики педиатрии №2 ХНМУ. Тел. +38 (057) 338 20 69; +38 (067) 94 92 246. Дмитрий Николаевич Криворотько, аспирант, кафедра пропедевтики педиатрии №2 ХНМУ. Тел.8(057)338 20 69.