Исследовательская работа «Снег – индикатор чистоты воздуха
advertisement

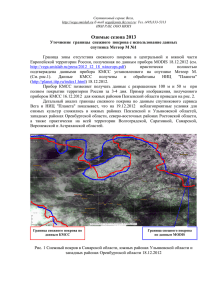
Исследовательская работа «Снег – индикатор чистоты воздуха» Ученик 10 класса - Дмитрий Теплов Учитель биологии – Людмила Витальевна Огаркова Учитель химии – Людмила Петровна Конькова МОУ «Дороховская средняя общеобразовательная школа» Поселок Дорохово Бежецкий район Бежецк 2009 Содержание: 1. Введение. 3 2. Цель и задачи исследовательской работы. 4 3. Гипотеза. 4 4. Этапы исследовательской работы. 4 5. Методика выполнения работы. 5 6. Оборудование и материалы. 9 7. Статистическая обработка данных. 9 8. Наглядное представление опытных данных 10 9. Обсуждение результатов. 11 10.Выводы. 12 11.Литература. 12 2 Введение Снежный покров накапливает в своем составе практически все вещества, поступающие в атмосферу. В связи с этим он обладает рядом свойств, делающих его удобным индикатором загрязнения не только самих атмосферных осадков, но и атмосферного воздуха, а также последующего загрязнения почвы и воды. При образовании снежного покрова из-за процессов сухого и влажного выпадения примесей концентрация загрязняющих веществ в снегу оказывается на 2-3 порядка выше, чем в атмосферном воздухе. Поэтому измерения их содержания могут производиться более простыми методами с высокой степенью надёжности. Средняя продолжительность снежного покрова в Бежецком районе составляет более 4 месяцев. Он появляется преимущественно в начале декабря, а начинает разрушаться в середине марта. Актуальность Исследование снежного покрова позволит выявить загрязнение местности (сульфатами, нитратами и др. соединениями) за зимний сезон и позволит оценить степень безопасности нашего района для проживания людей, произрастания растений, жизнедеятельности животных. В зависимости от источника загрязнения изменяется состав снежного покрова. Загрязнение снежного покрова нитратами и сульфатами представляет особый интерес в связи с тем, что эти компоненты могут быть причиной “кислотных выпадений”, что является одной из экологических проблем. Ежегодно в атмосферу Земли выбрасывается около 200 млн. т твердых частиц (пыль, сажа и др.), сернистого газа (SO2), 700 млн. т оксида углерода (II), 150 млн. т оксидов азота, что в сумме составляет более 1 млрд. т вредных веществ. В зависимости от источника загрязнения изменяется состав снежного покрова. Так вблизи котельных, работающих на угле, железных дорог, сетей, обслуживаемых тепловозами на мазутном топливе, большого потока автотранспорта, работающего на 3 дизельном серосодержащем топливе, а также ряда специфичных промышленных предприятий следует ожидать повышенное содержание источники содержания соединений азота - серы. Антропогенные автотранспорт, теплоэнергетика, промышленные предприятия. Информативным является показатель величины pH снеговых вод. В обычном (незагрязненном) состоянии он изменяется от 5.5 до 5.8. Вблизи металлургических заводов около ТЭЦ, котельных, как правило, pH снега имеет более высокие значения, то есть означает слабощелочную или щелочную среду, что связано, по-видимому, с выпадением зольных частиц, содержащих соединения гидрокарбонатов калия, кальция, магния, повышающих pH снеговой воды. Вдоль автомобильных трасс, в местах выбросов промышленными предприятиями продуктов сгорания с преобладанием оксидов серы, азота, углерода, наблюдается повышенное содержание хлорид ионов, за счет посыпания улиц смесью (песок + хлорид натрия). Цель: проведение химического анализа снегового покрова поселка Дорохово и районов города Бежецка. Объект и изучаемое свойство (предмет): пробы снега точек отбора с антропогенной нагрузкой и природных ландшафтов, их химический анализ. Задачи: 1) определение кислотности снеговой воды; 2) определение прозрачности снеговой воды; 3) определение общего содержания и наличия нерастворимых веществ; 4) проведение анализа на следующие компоненты: соединение азота, сульфатов, хлоридов, железа, некоторых тяжелых металлы. Гипотеза: химический анализ снегового покрова – показатель уровня загрязненности окружающей среды поселка Дорохово и города Бежецка. Этапы исследовательской работы: 1. Изучение литературы об антропогенном воздействии на атмосферу и об индикаторе загрязненности – снеге, в том числе и в нашем районе. 4 2. Подбор методик для проведения химического анализа снегового покрова и оборудования. 3. Определение точек забора проб снегового покрова с антропогенной нагрузкой и природных ландшафтов, взятие проб. 4. Проведение лабораторного исследования. 5. Статистическая обработка данных. 6. Обсуждение результатов 7. Наглядное представление опытных данных. 8. Выводы. Методика исследования: 1. Снег для проб нужно брать по всей глубине его отложения в стеклянные банки (трехлитровые, пятилитровые). 2. Средняя глубина снежного покрова измеряется снеговой рейкой с сантиметровыми делениями в разных точках жилых кварталов, на пустырях, стадионах, парках и скверах, то есть там, где она не искажена искусственно: при сгребании снега или при его уплотнении. При небольшой толщине можно использовать длинную школьную линейку. 3. Сразу после таяния пробы снега, когда температура талой воды сравняется с комнатной, проводят ее анализ. Необходимые условия для анализа следующие: проба снега должна быть отобрана на всю глубину снежного покрова; пробы должны быть достаточно большой - до 1 л талой воды, что при объемном весе снега около 0,2 г/м2 составит примерно 5 литров снега; проба должна быть отобрана на некотором удалении (5-10 м) от дорог и тротуаров, т.е. те места, где обычно не ходят люди и животные; в пробе перед фильтрацией не должно оставаться сухих листьев, семян, хвоинок; посуда, в которой тает проба снега, должна быть чистой и не реагировать с талой водой; подойдет эмалированная, стеклянная пластиковая. 5 4. Определение прозрачности талой воды. Прозрачность снеговой воды зависит от количества взвешенных частиц и содержания химических веществ. Мерой прозрачности служила высота столба воды (в см), при которой можно различить на белой бумаге стандартный шрифт с высотой букв 3,5 мм. Для опыта нужен прозрачный плоскодонный стеклянный цилиндр диаметром 2-2,5 см, высотой 30-35 см. Можно использовать мерный цилиндр на 250 мл без пластмассовой подставки. Цилиндр установили на печатный текст и вливали исследуемую воду, следя за тем, чтобы можно было читать через воду текст. Отметили на какой высоте шрифта не видно, измерили высоту столба воды линейкой. 5.Определение кислотности талой воды. Водородным показателем pH=-lg[H+] Например, если [H+]=10-3 моль/л, то pH=3, среда раствора кислотная; если [H+]=10-12 моль/л, то pH=12, среда раствора щелочная; если [H+]=10-7 моль/л, то pH=7, среда нейтральная. Чем pH меньше 7, тем больше кислотность раствора. Чем pH больше 7, тем больше щелочность раствора. Качественный тип среды и pH талой воды определили с помощью бумажных индикаторов - универсальный. Использовали эталонную шкалу pH . 6. Проведение лабораторного анализа талой воды. 6.1. Обнаружение сульфат-ионов. Реагенты: хлорид бария (10 г BaCl2 · 2H2O растворить в 90 г H2O): соляную кислоту (16 мл HCl (р=1,19) растворить в воде и довести объем до 100 мл). Условия проведения реакции: 1. pH< 7,0 (кислая среда). 2. Температура комнатная. 3. Осадок нерастворим в азотной и соляной кислотах. Выполнение анализа К 10 мл пробы прибавляют 2-3 капли соляной кислоты и приливают 0,5 раствора хлорида бария. При концентрации сульфат-ионов более 10 мг/л выпадает осадок: SO42- + Ba2+ = BaSO4↓ (белый) 6 Если наблюдается опалесценция, то концентрация сульфат-ионов более 1 мг/л. 6.2. Обнаружение нитрит-ионов. Качественное определение с приближенной количественной оценкой. Приблизительную количественную оценку содержания нитритов можно дать визуально по качественной реакции. Для этого в пробирку наливают 10 мл исследуемой воды, прибавляют несколько кристалликов сухого или 1 мл 10 % реактива Грисса и нагревают до 70-800С на водяной бане. Через 10 минут появившуюся окраску сравнивают со шкалой визуального определения. (табл. 1) Таблица 1. Ориентировочное содержание нитритов Окрашивание при рассмотрении сбоку сверху нет нет нет Чрезвычайно слабое розовое Едва заметное Очень слоборозовое розовое Очень слабоСлабо-розовое розовое Слабо-розовое Светло-розовое Светло-розовое розовое Розовое Сильно-розовое Сильно-розовое Красное Красное Ярко-красное Нитриты мг N/л < 0,001 0,001 мг NO2-/л <0,003 0,003 0,002 0,007 0,004 0,013 0,015 0,030 0,060 0,150 0,300 0,05 0,10 0,20 0,50 1,00 Приготовление раствора Грисса: 10 г сухого реактива Грисса растворяем в 100 см3 12% уксусной кислоте. 6.3. Обнаружение хлорид-ионов. Реагенты: нитрат серебра (5 г AgNO3 растворить в 95 мл воды); азотная кислота (1:4). Условия проведения реакции: 1. pH< 7,0 (кислая среда). 2. Температура комнатная. Выполнение анализа 7 К 10 мл пробы воды прибавляют 3-4 капли азотной кислоты и приливают 0,5 мл раствора нитрата серебра. Белый осадок выпадает при концентрации хлорид-ионов более 100мг/л. Cl- + Ag+ = AgCl↓ белый Помутнение раствора наблюдается, если концентрация хлорид-ионов более 10 мг/л, опалесценция – более мг/л. 6.4. Обнаружение катионов железа (III) Реагенты: тиоцианат аммония (20 г NH4CNS) растворить в дистиллированной воде и довести до 100 мл; азотная кислота (конц.); перекись водорода (w(%)=5%)). Условия проведения реакции: 1. pH< 3,0 (кислая среда). 2. Температура комнатная. Действием пероксида водорода ионы Fe(II) окисляются до ионов Fe (III). Выполнение анализа К 10 мл пробы воды прибавляют 1 каплю азотной кислоты, затем 2-3 капли пероксида водорода и вводят 0,5 мл тиоцианата аммония. При концентрации ионов железа более 2,0 мг/л появляется розовое окрашивание, при концентрации более 10 мг/л окрашивание становится красным: Fe3+ + 3 CNS- = Fe(CNS)3 красный 6.5. Обнаружение сульфид-ионов. К 10 мл пробы добавить нитрат серебра. Если есть сульфид ионы, то появиться слабое помутнение. S2- + 2Ag+ = Ag 2S↓ 6.6. Обнаружение катионов свинца. Реагент: хромат калия (10 г K2 CrO4 растворить в 90 мл H2O). Условия проведения реакции: 1. pH = 7,0 (нейтральная среда). 2. Температура комнатная. Выполнение анализа В пробирку помещают 10 мл пробы воды, прибавляют 1 мл раствора реагента. Если выпадает желтый осадок, то содержание катионов свинца более 100 мг/л: Pb2+ + CrO42- = Pb CrO4 (желтый) 8 Если наблюдается помутнение раствора, то концентрация катионов свинца более 20 мг/л, а при опалесценции – 0,1 мг/л. Оборудование и материалы. 1. Трехлитровые стеклянные банки. 2. Длинная школьная линейка. 3. Реагенты для проведения лабораторного исследования талой воды. 4. Бумажные индикаторы для определения pH среды талой воды. 5. Компьютер. Статистическая обработка данных Данные исследования занесли в сводную таблицу (таб.2) Таблица 2. «Результаты анализа проб снега» Место отбора pН Глубина снегового покрова 1. Луг у реки Маклайки Прозрач ность Сульфатионы Нитритионы Хлорид-ионы Катионы железа (+2) Катионы железа (+3) Суль фидионы Катионы свинца Появилась - - - - - - - - мг/л 5,5 44 - - легкая светлосерая муть - (29см) опалесценция 2. Берег реки Мологи 5 29 - - легкая светлосерая муть (27 см) 3. Поле у гаражей и поселковой дороги Появилась 5,5 25 - - Пробу мутнеет интенсивнее - - - - 5,5 25 - 0,013 Пробу мутнеет интенсивнее - - - - 5,5 30 - 0,007 Появилась светло-серая муть - - - - 4,5 24 - 0,20 Пробу мутнеет - - - Помутнение (25 см) 4. Газовая котельная (24 см) 5. Лес в районе эскадрилии (28 см) 6. 9 Федеральная трасса интенсивнее (опалесцен ция) (24 см) 7. Завод АСО 5 24 - 0,20 Пробу мутнеет интенсивнее - - - - 5,5 24 - 0,013 Пробу мутнеет интенсивнее - - - - 5,5 24 - О,50 Пробу мутнеет интенсивнее - - - Помутнение Появилась - (24 см) 8. Железная дорога города Бежецка в районе поселка Сельмаш (25 см) 9. Автопарк (24 см) 10. Детская площадка 6 28 - О,20 (20 см) легкая светлосерая муть Наглядное представление опытных данных. Диаграмма №1. «pH талой воды». Диаграмма №2. «Прозрачность талой воды». 10 (опалесценция) - - - Диаграмма №3. «Содержание нитрит-ионов (max значения) в природных ландшафтах – 1, районах с антропогенной нагрузкой –2» Обсуждение результатов Как видно из таблицы, на всех исследованных участках характерны незначительные изменения. Увеличение нитрит–ионов от 0,20 до 0,50 мг/л при фоне около 3,5 мг/л, во всех пробах обнаружились хлорид-ионы, Большая их концентрация обнаружилась у поле, расположенного возле гаражей, газовой котельной, федеральной трассы, завода АСО, железной дороги, автопарка. Катионы свинца обнаружены были у федеральной трассы, автопарка. Сульфат и сульфид-ионы, катионы железа не обнаружены. Прозрачность воды дала интересные результаты: прозрачность у выше перечисленных объектов оказалась в среднем от 24 до 27, а на объектах менее загрязненных хлорид-ионами, нитрит-ионами по данным исследования выше. Информативным является показатель величины рН снеговых вод. Все значения находятся ниже 6, что свидетельствует о кислотной среде (самые высокие показатели наблюдались у федеральной трассы, она проходит через центр города. Снег на детской площадки имеет рН=6. На основании данных таблицы видно, что максимальное загрязнение снежного покрова наблюдается в трех районах: федеральная трасса, по которой движется транзитный грузовой транспорт, район автопарка, железная дорога, что связано с выхлопными газами машин и завод АСО расположен вдоль центральной дороги города. Особое внимание необходимо уделить лабораторным исследованиям на детской площадке, поскольку это излюбленное место отдыха детей нашего поселка Дорохово, рядом с площадкой находится стоянка автомобильного транспорта, машины здесь останавливаются временно. Для более точных результатов необходимо провести лабораторный анализ талой воды в конце зимы. В дальнейших исследованиях техногенной нагрузки на окружающую среду в зимний период представляется перспективным проведение регулярного мониторинга загрязнения снежного покрова выбросами отдельных источников промышленных площадок и транспорта. 11 Выводы: 1. В результате обследований мы выделили три района наиболее подвергающихся техногенезу. 2. Для выявления новых зон экологически неблагополучных необходимы дальнейшие обследования снежного покрова города Бежецка и его районов. 3. Необходимо создание обводных магистралей, чтобы исключить прохождение грузового транспорта через город. 4. Химический анализ снегового покрова поселка Дорохово и города Бежецка показал, что условия окружающей среды благоприятные для проживания. Литература: 1. Волынова Л.Г., Сейдалиева Л.К., Кузнецова Н.П., Мейснер Е.В. Химия. Предметная неделя в школе: планы конспекты мероприятий. Волгоград: Учитель, 2007. 2. Габриелян О.С.. Химия. 8 класс: Учебн. для общеобразовательных учреждений. М.: Дрофа, 2002. 3. Габриелян О.С.. Химия 11 класс: Учебн. для общеобразовательных учреждений. М.: Дрофа, 2002. 4. Я иду на урок биологии: Экология: Книга для учителя. М.: Издательство «Первое сентября», 2002. 5. Охрана природы. Пособие для учащихся. А.В. Михеев, К.В. Пашканг, Н.Н. Родзевич, М.П. Соловьева. М.: Просвещение, 1983. 12