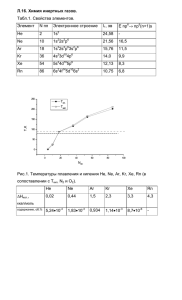
методика замораживания сердца животного или человека
реклама

МИНИАТЮРНАЯ КРИО-БАРОКАМЕРА ДЛЯ ЭКСПЕРИМЕНТАЛЬНОЙ КЛАТРАТНОЙ КРИОКОНСЕРВАЦИИ С тех пор как нам впервые удалось обнаружить в природе наличие совершенно нового вида анабиоза [1] и тем самым инициировать по всему миру исследования этого неизвестного ранее проявления жизнеспособности (так называемый «клатратный анабиоз» [2]) прошёл достаточно продолжительный срок. Выдвинутый тогда амбициозный проект «Альтернативная криобиология» к настоящему времени, казалось бы, уже должен был получить свою практическую реализацию. К сожалению данные работы хотя и ни свёрнуты полностью, но ведутся ни так активно как того хотелось бы. По всей видимости, причина инерционности связана, прежде всего, с необходимостью проведения обязательных декомпрессионных мероприятий на завершающем этапе любого из этих сложных в инструментальном смысле экспериментов [10]. Именно отсутствие соответствующей приборной базы и с нею связанной надёжной методики является серьёзным препятствием на пути масштабного осуществления таких операций. Наличие доступного и самого простого газового оснащения (мы бы даже сказали — элементарной «газовой крио-лаборатории») смогло бы стимулировать исследовательский интерес к этой области. Несмотря всё-таки на значительную повторяемость опытов по так называемой «клатратной криоконсервации» [2], сведения об устройствах, необходимых для её проведения, завуалированы самими их авторами [5, 6, 7, 9]. Исключение составляют только отдельные источники, где полностью раскрывается принцип работы исследовательского агрегата и приводится конкретная его схема [3, 4]. Но всё равно, сложные в технологическом исполнении и неудобные при эксплуатации они не могут найти массового отклика среди криобиологов. В связи с объективными инструментальными потребностями предлагается оригинальная конструкция простого лабораторного прибора, в основе которого лежит аналог аппарата, относящийся ещё к самым первым нашим наработкам [1]. Причём предлагаемая оригинальная крио-барокамера состоит из готовых узлов, имеющихся в розничной торговле, и может быть легко собрана в условиях любой даже мало-оснащённой лаборатории самими заинтересованными исследователями. При этом мы намеренно (!) не рассматриваем здесь хорошо отработанный (в тот период наших активных исследований) — достаточно эффективный способ насыщения инертными газами органов лабораторного животного путём принудительной ингаляции во время проведения ИВЛ [1]. — Ведь разрабатываемая сейчас камера должна стать прототипом будущего крио-бара-контейнера, как можно более простого в конструкционном плане, именно для выделенных органов человека — для их надёжного хранения и последующей транспортировки. Таким образом, поставленная на сегодня задача — изготовление универсального миниатюрного металлического сосуда для работы с биологическими объектами (клетки, ткани, органы) в условиях низких и криогенных температур, а также повышенных давлений инертных газов («микро-крио-барокамера»), — легко решаема. — Наши самые первые поверочные исследования по клатратной криоконсервации биообъектов, в том числе и небольших размеров, проведённые ещё в 1980-е годы [1], с использованием миниатюрного криобароконтейнера собственной конструкции, могут лечь в основу при разработке такого инструментария, что станет необходим уже для сегодняшних масштабных исследований по данной тематике. Использоваться будущий сосуд давления должен будет сразу на 2-х этапах экспериментов. Сначала, на 1-ом этапе — для клеточного материала. В дальнейшем, на 2-ом этапе — для выделенного сердца крысы. Итак. Уже для проведения экспериментов на клетках (на 1-м этапе) необходима малая барокамера-капсула. — Это должен быть миниатюрный сосуд среднего давления с габаритными размерами, выбранными специально под горловину стандартного сосуда Дьюара, например, 24-литрового. Но в тоже время, исследовательская крио-капсула должна быть универсальной и позволять вести дальнейшие экспериментирования с органами мелких лабораторных животных (на 2-м этапе). Необходимые условия : — Микроагрегат мог бы помещаться в различные хладагенты, в зависимости от желания самих экспериментаторов : обычный лёд, холодный воздух морозильной камеры холодильника, «сухой лёд», пары жидкого азота, сам жидкий азот и др. — Данная исследовательская микро-барокамера должна быть рассчитана на максимальное рабочее давление в 10 атм, что позволяло бы, наряду с выбором определённой рабочей температуры, варьировать так же и этим параметром (в сторону уменьшения от указанной величины). — Согревать барокамеру-капсулу можно было бы или медленно (естественным путём при комнатной температуре), или же быстро (горячим воздухом или жидкостью). — В крио-барокамере можно было бы замораживать или животные клетки, или органы (сердце крысы). В связи с такими широкими запросами, естественно, на первый план выходят требования чисто экономического характера. И самое главное из них — это необходимость создания «Крио-биологической газовой лаборатории», основанной на едином протоколе клатратной криоконсервации, так как она должна быть обязательно общей для двух этапов. Что значительно удешевит весь процесс уникальных исследований. 1. Замораживание биообъекта, находящегося в миниатюрной крио-барокамере. — По конструкционному исполнению наша будущая крио-барокамера явится аналогом миниатюрного биологического (или же химического) реактора заводского исполнения и будет выглядеть почти также как и сам такой реактор : По сути, стоит абсолютно такая же как и раньше (в 1980-е годы) задача — осуществление «замораживания-согревания» всего данного устройства-системы (с биообъектом внутри — в среде инертных газов), нагруженного давлением — путём полного погружения всего изделия в некий жидкий хладагент. 2. Погружные морозильные аппараты — Одним из традиционных способов замораживания является — иммерсионный (погружением). — При этом способе хладагент контактирует непосредственно со всей поверхностью объекта, и соответственно создаются лучшие условия для теплообмена между поверхностью объекта и хладагентом. — Эта особенность обусловила ряд преимуществ данного способа по сравнению с воздушным холодильным оборудованием. — Иммерсионный способ обеспечивает более высокую скорость замораживания и меньший уровень потерь в процессе замораживания и последующего оттаивания. — Погружные морозильные аппараты предназначены для замораживания объектов, погруженных в охлаждающую, не изменяющую свое фазовое состояние жидкость (водный раствор соли или гликоля). 3. Чиллеры Чиллер — это специальное охлаждающее устройство, известное тем, что наиболее часто применяется в системах кондиционирования воздуха центрального типа. В общем случае чиллером называют холодильную предназначенную для охлаждения жидких теплоносителей. машину, Итак, чиллер — это холодильная машина, предназначенная для охлаждения холодоносителя (воды, гликолевого раствора и т.п.). Хотя основная сфера эксплуатации чиллеров — это системы кондиционирования воздуха, но чиллеры применяются и в других областях : — В специальном медицинском оборудовании и в фармацевтической сфере; — В сфере лазерных технологий. 4. Чиллеры погружного типа Чиллер погружного типа сконструирован таким образом, чтобы пользователь мог поместить его в какой-нибудь уже существующий резервуар с охлаждающей жидкостью — испаритель чиллера помещается внутрь самого резервуара. ВОЗМОЖНЫЕ СПОСОБЫ ЗАМОРАЖИВАНИЯ ДЛЯ КОНКРЕТНОГО НАШЕГО СЛУЧАЯ I Захолаживание только одним чиллером (неуправляемое охлаждение; вообще нет согревания) 5. Лабораторные чиллеры погружного типа Погружные охладители — недорогая альтернатива так называемым «охлаждающим термостатам» ! Достигается : — Отказ от применения «сухого льда» или жидкого азота. — Диапазон температур до -50 °C. — Быстрое охлаждение рабочих жидкостей до низких температур. II Пара «лабораторный чиллер — низкотемпературный термостат» (недостаточно-управляемое охлаждение; относительно-управляемое согревание) 6. Лабораторный чиллер погружного типа может работать в паре с низкотемпературным термостатом (криотермостатом) — Компенсирующее охлаждение циркуляционными термостатами. жидкостей в сочетании с — К типичным областям применения таких охладителей относятся: контрохлаждение нагревающих термостатов, использование охладителей в качестве замены сухого льда. 7. Низкотемпературные чиллеры — Низкотемпературные чиллеры, как правило, работают в областях ниже –20°С и часто требуют особых низкотемпературных теплоносителей или повышенной концентрации гликоля, поскольку чем выше концентрация вещества в водном растворе, тем ниже температура замерзания. — В этих случаях хладоносителем является как правило этиленгликоль. Данную жидкость можно охлаждать до −25 С и при этом она не кристаллизуется. 8. Теплоносители (хладоносители) на основе гликолей — Теплоносители (хладоносители) являются промежуточным телом, с помощью которого осуществляется перенос тепла от охлаждаемого объекта к холодильному агенту. — Хладоносителем может служить вода, водные растворы солей или жидкости с низкой температурой замерзания — антифризы и т. д. — При температурах теплоносителя ниже точки замерзания воды, также в целях предотвращения замерзания теплоносителя трубопроводах при низких температурах окружающей среды, качестве теплоносителей используют различные растворы и смеси низкой температурой замерзания. а в в с — Распространенными хладоносителями являются хлористый натрий (NaCl), соли хлористого кальция (CaCl2), водные растворы гликолей. — В связи с высокой коррозионной активностью солевых растворов, расходы на ремонт оборудования могут многократно превысить прямые затраты, поэтому в последнее время все более широкое применение находят растворы многоатомных спиртов, в том числе пропиленгликоля (ПГ), этиленгликоля, глицерина. Гликоли — бесцветные сладковатые и высоковязкие жидкости с точкой замерзания ниже -50 С. Различают два главных типа гликолей : Пропиленгликоль — С3Н6 (ОH)2, благодаря нетоксичности находит также применение в пищевой промышленности (в качестве пищевых добавок). Этиленгликоль — C2H4(ОН)2, в основном, используется там, где его утечка не будет опасной для людей, животных и продовольственных товаров. Он значительно дешевле пропиленгликоля и потери на трение — намного ниже при низких температурах, чем для пропиленгликоля. 9. Имеющийся в розничной продаже теплоноситель для систем нагрева и охлаждения — Antifrogen N / Антифроген Н — Данный антифриз представляет собой смесь воды, основного компонента (в данном случае, моноэтиленгликоля) и целевых добавок. Для снижения коррозионной активности антифризов используются ингибиторы коррозии. Ингибиторы коррозии, вещества, снижающие скорость коррозии; применяются для антикоррозионной защиты материалов, главным образом металлов. Также в состав теплоносителя вводят ингибиторы накипеобразования, набухания и растворения резиновых уплотнителей систем отопления, пенообразования и мн. др. II Захолаживание «охлаждающим–нагревающим» лабораторным термостатом (хорошо управляемые — и охлаждение, и согревание) 10. Альтернативой относительно дешёвой и недостаточно управляемой паре «чиллер–криотермостат» могут быть — более дорогие, но хорошо управляемые «охлаждающие–нагревающие» лабораторные термостаты : — Классические охлаждающие термостаты с открытой ванной предназначены для выполнения типичных лабораторных задач по нагреву и охлаждению. — Работают в диапазоне от -90°C до +200°C, с различной мощностью охлаждения и нагрева, с воздушным или водяным охлаждением системы рефрижерации. — Эти приборы обладают высокой нагревательной и охлаждающей способностью для короткого времени нагрева и охлаждения. САМИ ЭКСПЕРИМЕНТЫ Для проведения биологических экспериментов необходимо — Исследования могли бы быть проведены в 2-а этапа : 1-й этап — на клетках млекопитающего. 2-й этап — на органах мелкого лабораторного животного (на сердце крысы). 2-й этап будет разбит на 2-е серии экспериментов : 1-я серия — охлаждение в морозильной камере до -20 С. 2-я серия — охлаждение в жидком азоте до -196 С. Для 2-го этапа (органные исследования — сердце крысы) каждая из 2х серий будет разбита ещё на 2-а подхода (2-ве группы) : 1-я группа — интактный эксперимент. 2-я группа — под защитой ксенона. ЭКСПЕРИМЕНТЫ С ОРГАНАМИ ЖИВОТНЫХ ЭТАП 2 : «ОПТИМИЗАЦИЯ ПРОЦЕССА КРИОКОНСЕРВАЦИИ СЕРДЦА КРЫСЫ» СОДЕРЖАНИЕ РАБОТ НА ВТОРОМ ЭТАПЕ — Оптимизация режимов физического воздействия на биологический объект для обратимого криосохранения органов мелких лабораторных животных (сердце крысы) в атмосфере ксенона ПРОДОЛЖИТЕЛЬНОСТЬ РАБОТ НА ВТОРОМ ЭТАПЕ — 12 месяцев. РАБОТА СО СТОРОННИМИ ОРГАНИЗАЦИЯМИ НА ВТОРОМ ЭТАПЕ — Изготовление стенда (или же его покупка) для перфузии сердца. Известно, что пересадка органов у мелких лабораторных животных — наиболее адекватный метод оценки жизнеспособности аллотрансплантанта в эксперименте (демонстрационный и вообще не нуждающийся в биохимическом обеспечении). А гетеротопическая пересадка сердца у крыс на магистральные сосуды брюшной полости по Abbott — наиболее удобная для таких целей хирургическая манипуляция. Но всё же, менее затратной и не столь трудоёмкой методикой является стендовая перфузия сердца (в плане отсутствия в таком случае необходимости приобретения и содержания кроме доноров ещё и дополнительных животных-реципиентов). 1. На сегодняшний день уже существует готовая установка IH-SR промышленного изготовления, специально предназначенная для перфузии изолированного сердца мелких грызунов : 2. Есть и более дешёвый аналог вышеприведённой установки — «Установка перфузии изолированного сердца по Лангендорфу»: ЦЕЛЬ ИССЛЕДОВАНИЯ 2-ГО ЭТАПА — Целью настоящего исследования (на 2-ом этапе) является введение в клатратный анабиоз сердца крысы с последующим выведением из этого состояния и восстановлением его функциональной активности. МЕТОДИКА ИССЛЕДОВАНИЯ 2-ГО ЭТАПА — Начнём рассмотрение с того, что будем считать, как бы уже проведено 2-е серии экспериментов : 1. В 1-й серии была отработана методика при охлаждении органа животного (крысиного сердца) до -20 С. 2. Во 2-й — до -196 С. 3. Эксперименты 1-й серии и 2-й серии проводились на одной и той же — универсальной установке : Для проведения лабораторной практической проверки и исследования эффективности предложенного способа клатратной криоконсервации каждая серия была поделена ещё на 2-ве группы : 1-я группа — интактный эксперимент. 2-я группа — под защитой ксенона. ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ 1. Введение животного в наркоз. 2. Иммобилизация животного. 3. Забор сердца. 4. Размещение органа в крио-бара-контейнере. 5. Для обработки сердца ксеноном, загерметизированную микробарокамеру, с помещённым в неё тут же выделенным органом, медленно нагружали давлением Хе до 10 атм и пролонгировали в таком состоянии в течение 60 минут — при комнатной температуре. 6. Затем постепенно снижали температуру всей испытательной системы (состоит из сосуда давления и сердца внутри него) до 0°С, помещая данное устройство в шугу (ледяную крошку), при этом не снижая самого давления Хе. 7. После чего крио-капсулу с сердцем внутри неё, находящимся всё под тем же давлением Хе в 10 атм, помещали в хладагент низкотемпературного криостата с подготовленной заранее температурой рабочей жидкости в 0°С и охлаждали в этом криостате до -20°С (1-я серия). 8. По достижении данной температуры (-20°С), давление в криососуде полностью сбрасывали и приступали — или к согреванию исследовательской системы до 0°С, или же ко 2-й серии эксперимента. 9. Во 2-й серии крио-капсулу с сердцем внутри (как было сказано выше, в этот период сосуд уже не нагружен давлением Хе !) вынимали из криостата и помещали в пары жидкого азота (экспозиция 60 минут), а затем медленно окунали данный криобароконтейнер с сердцем — в сам жидкий азот, добиваясь постепенного охлаждения всей системы до -196 С и выдерживали в течение 60 минут. [ Необходимо ещё раз напомнить, что следует обязательно сбрасывать давление Хе полностью — перед температурным значением, соответствующим началу вымораживания газа ксенона (111,85 °C) ] 10. Размораживание образцов всех серий (1-й и 2-й) проводили путем согревания до 0 С всего устройства, не нагруженного давлением Хе — в хладагенте того же низкотемпературного криостата. 11. После чего сердце вынимали из крио-капсулы и приступали — или к его перфузии аппаратным методом, или же осуществляли гетеротопическую пересадку расконсервированного биообъекта. Литература: 1. Щербаков П. В., Тельпухов В. И. Бессмертие под газом // Химия и жизнь. – 2006. – № 8. – С. 34-39. 2. Тельпухов В.И., Щербаков П.В. Клатратная криоконсервация // Вопросы реконструктивной и пластической хирургии. 2012. – Т. 15. – № 3(42). – С. 77-80. 3. Пульвер А.Ю., Целиковский А.В., Пульвер Н.А., Артюхов И.В., Перегудов А.Г. Криоконсервация Saccharomyces cerevisiae с использованием ксенона // Материалы Международной заочной научно-практической конференции «Теоретические и практические аспекты современной криобиологии». Сыктывкар, 2014. С. 220-226. 4. Худяков А.Н., Полежаева Т.В., Зайцева О.О., Соломина О.Н. Устройство для криоконсервирования клеточных взвесей в атмосфере газовых протекторов // Материалы Международной конференции «Криоконсервация генетических ресурсов. Современное состояние, проблемы и перспективы». Биофизика живой клетки. Том 10. 2014 год. Стр. 209 – 211. 5. Sheleg Sergey, Hixon Hugh, Cohen Bruce et. al. Cardiac Mitochondrial Membrane Stability after Deep Hypothermia using a Xenon Clathrate Cryostasis Protocol — an Electron Microscopy Study // Int. J. Clin. Exp. Pathol. 2008. 1 (5), P. 440—447. 6. Пономарев А. И., Макеев О. Г., Зверева А. И., Коротков А. В. Исследование консервирующих свойств клатратов инертного газа ксенона на модели краткосрочного хранения кожных лоскутков // Материалы III Межрегиональной научно-практической конференции «Клеточные технологии — практическому здравоохранению». Екатеринбург. 2014 г. Стр. 78 – 83. 7. Способ криоконсервации мезенхимальных стромальных клеток кожи. Патент РФ № 2433173. мультипотентных 8. Макеев О. Г., Пономарев А. И., Коротков А. В. Применение клатратобразующего газа для криоконсервации мезенхимальных мультипотентных стромальных клеток // Вестник уральской медицинской академической науки. – 2010. - №1. – С. 180 – 183. 9. Сведенцов Е.П., Лаптев Д.С., Полежаева Т.В., Зайцева О.О., Худяков А.Н., Шерстнёв Ф.С., Князев М.Г. Оценка криопротекторных свойств аргона // Международный журнал прикладных и фундаментальных исследований — 2012. — №4. — С. 55. 10. Смолин В.В., Соколов Г.М., Павлов Б.Н. Водолазные спуски до 60 метров и их медицинское обеспечение. – Москва: Фирма «Слово», 2003. – 626 с. П Р И Л О Ж Е Н И Е (некоторые характеристики гидратов тяжёлых инертных газов и метана) Для получения при 0оС гидрата ксенона достаточно приложить всего 1,5 атм, но для гидрата криптона уже — 14,5 атм, а для гидрата аргона все — 105 атм. При 0°С гидрат метана стабилен под давлением порядка 25 бар (250 метров). При -3,4оС для кристаллогидрата ксенона, при -27,8оС для кристаллогидрата криптона, при -42,8оС для кристаллогидрата аргона — давление диссоциации соответствует нормальному атмосферному давлению. При нормальном атмосферном давлении, гидрат метана сохраняет устойчивость при соответствующей температуре — около -80°С. При нормальном давлении температура перехода двуокиси углерода (СО2) из твёрдого состояния в газообразное равна -78,5°С. Видимая разница в вышеприведённых значениях, во-первых, температуры, необходимой для стабилизации гидрата метана (-80°С), во-вторых, реальной температуры замёрзшего углекислого газа (78,5°С), указывает на то, что гидраты метана, в конце концов, окажутся в метастабильном состоянии. Но температурные возмущения при этом будут столь ничтожны, что известный эффект само-консервации гидратов (в данном случае, безусловно, положительный) обеспечит, с запасом, сохранение их стабильности.