Начинаем обучение с тех заданий, которые не вызовут затруднения
реклама
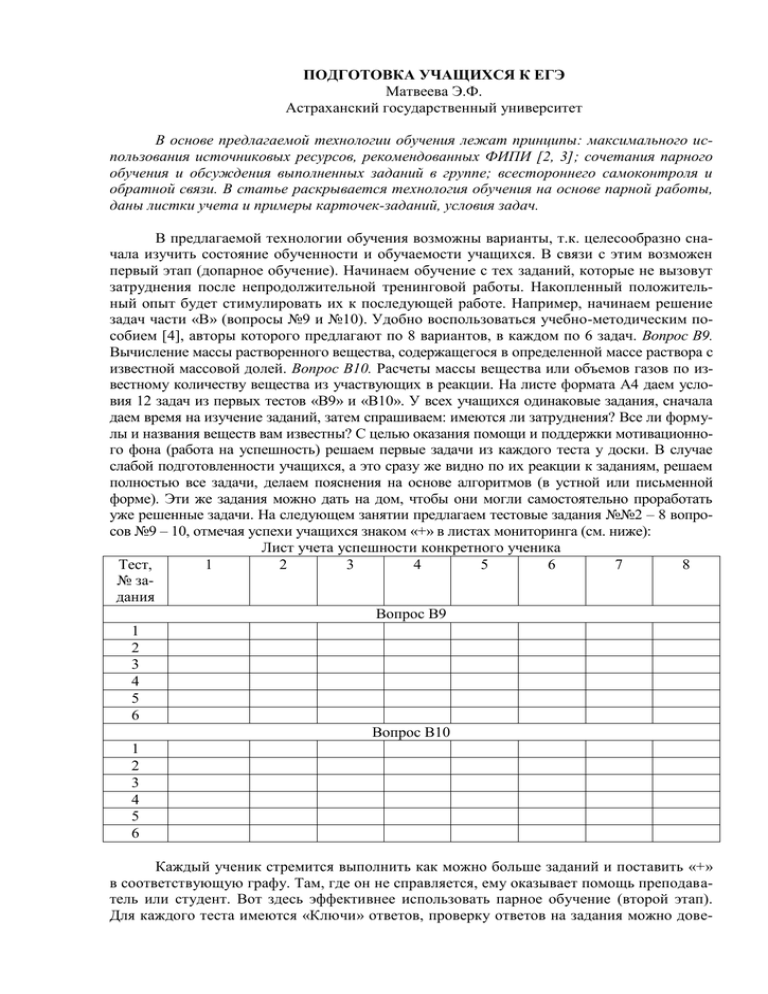
ПОДГОТОВКА УЧАЩИХСЯ К ЕГЭ Матвеева Э.Ф. Астраханский государственный университет В основе предлагаемой технологии обучения лежат принципы: максимального использования источниковых ресурсов, рекомендованных ФИПИ [2, 3]; сочетания парного обучения и обсуждения выполненных заданий в группе; всестороннего самоконтроля и обратной связи. В статье раскрывается технология обучения на основе парной работы, даны листки учета и примеры карточек-заданий, условия задач. В предлагаемой технологии обучения возможны варианты, т.к. целесообразно сначала изучить состояние обученности и обучаемости учащихся. В связи с этим возможен первый этап (допарное обучение). Начинаем обучение с тех заданий, которые не вызовут затруднения после непродолжительной тренинговой работы. Накопленный положительный опыт будет стимулировать их к последующей работе. Например, начинаем решение задач части «В» (вопросы №9 и №10). Удобно воспользоваться учебно-методическим пособием [4], авторы которого предлагают по 8 вариантов, в каждом по 6 задач. Вопрос В9. Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей. Вопрос В10. Расчеты массы вещества или объемов газов по известному количеству вещества из участвующих в реакции. На листе формата А4 даем условия 12 задач из первых тестов «В9» и «В10». У всех учащихся одинаковые задания, сначала даем время на изучение заданий, затем спрашиваем: имеются ли затруднения? Все ли формулы и названия веществ вам известны? С целью оказания помощи и поддержки мотивационного фона (работа на успешность) решаем первые задачи из каждого теста у доски. В случае слабой подготовленности учащихся, а это сразу же видно по их реакции к заданиям, решаем полностью все задачи, делаем пояснения на основе алгоритмов (в устной или письменной форме). Эти же задания можно дать на дом, чтобы они могли самостоятельно проработать уже решенные задачи. На следующем занятии предлагаем тестовые задания №№2 – 8 вопросов №9 – 10, отмечая успехи учащихся знаком «+» в листах мониторинга (см. ниже): Лист учета успешности конкретного ученика Тест, 1 2 3 4 5 6 7 8 № задания Вопрос В9 1 2 3 4 5 6 Вопрос В10 1 2 3 4 5 6 Каждый ученик стремится выполнить как можно больше заданий и поставить «+» в соответствующую графу. Там, где он не справляется, ему оказывает помощь преподаватель или студент. Вот здесь эффективнее использовать парное обучение (второй этап). Для каждого теста имеются «Ключи» ответов, проверку ответов на задания можно дове- рить учащимся. Далее механизм тот же: выполнение, само- и взаимопроверка, поиск доказательства правильного ответа. Так происходит детальная проработка предметных знаний и оперативное исправление ошибок. Работа в парах проходит по определенному алгоритму [1]: 1) Ученики берут карточки и прорабатывают их сами. 2) Выбирают партнёра и садятся в пары. 3) Закончив работу в паре, отмечают результат в листке учёта. 4) Меняют партнёра в паре. Условия заданий В9-1-1. Массовая доля азотной кислоты в растворе, полученном после добавления 20 г воды к 160 г ее 5% раствора, равна______% (Запишите число с точностью до десятых). В10-1-1. 12,5 г железа растворили в избытке разбавленной хлороводородной кислоты. Рассчитайте объем (н.у.) выделившегося в результате этой реакции газа. Ответ: … л. (Запишите число с точностью до целых). В9-1-2. Какую массу нитрата натрия необходимо растворить в 200 г воды для получения раствора с массовой долей 20%? Ответ: ___ ___________ г. (Запишите число с точностью до целых). Примеры заданий: Образец – подсказка m(в ва) 160 0,05 100% → 160 m(воды) m( р ра) 8 100% 4,4% 180 12,5 г хл Fe + 2HCl = FeCl2 + H2 1 моль 1 моль 56 г/моль 22,4 л/моль 56 г 22,4 л Найдите «Х». Ответ: 5 л. Принимаем за «Х» г массу нитрата натрия, тогда получается выражение: m(в ва) 100% m( р ра) Х 0,2 Х 200 Ответ: 50 г → Х (в ва) → Х m(воды) В10-1-2. Масса кислорода, необходимого для сжигания 67,2 л Хг 67,2 л (н.у.) сероводорода до 2H2S + 3O2 → 2SO2 + 2H2O S02, равна___ г. (Запишите 2 моль 3 моль число с точностью до целых). 22,4 л/моль 32 г/моль 44,8 л 96 г Ответ: 144 г. В работе с учащимися могут быть разные подходы, например, в отдельной карточке задания даются в последовательности: 1) Для ввода: разбор примера В9-1-1; 2) для само- и взаимоконтроля: задания В9-1-2. Так для каждого ученика составляется карточка движения по тренингу. Ученик самостоятельно подбирает себе партнера по работе. Можно использовать подход на основе работы в парах переменного состава. Например: каждый ученик из микрогруппы (4 – 6 человек) получает карточку с первой задачей, решение которой имеется на карточке, далее ему предлагается условие следующей задачи для самостоятельного решения (ответ можно будет посмотреть в «Ключе»). Завершение обучения можно провести в форме обсуждения результатов, общего обзора выполненной работы (показать результат на экран и обсудить) или остановиться только на сложных моментах заданий и помочь исправить ошибки (помощь оказывает не только учитель, но и сами учащиеся). Желающим можно предложить варианты заданий на дом. На столах учащихся карточки-задания, листы учета само- и взаимоконтроля. Документация процесса (заполняется всеми учащимися) № Выполнение задания Самоконтроль взаимоконтроль ученика 1 2 3 4 5 … 1 2 3 4 5 … 1 2 3 4 5 … 1 2 3 …. Пояснение: В графе «Выполнение задания»: а) ученик сначала ставит точку – это означает, что он приступил к заданию 1; б) затем «плюс», – это означает, что работа завершена и можно выполнять задание 2 и т.д. В графе «самоконтроль» ученик может оценить свою работу, в графе «взаимоконтроль» ставится оценка партнером по работе. Предложенная технология обучения формирует многие качества личности учащегося, – это компетентность в приобретаемых знаниях и умениях, настойчивость и ответственность за выполнение заданий теста, стремление к успешной учебной деятельности и сотрудничеству. Подготовка студентов (учителя) к занятиям, в основе которых лежит парное обучение, требует внимания и грамотного отношения к подбору заданий, отслеживания получаемых результатов, обсуждения их с учащимися. От того, насколько осознанно ученик подходит к процедуре подготовки к ЕГЭ зависит и эффективность технологии обучения. Общий настрой на успешность помогает достичь хороших результатов. Библиографический список 1. Громыко Г.О. Парное обучение парному обучению – на расстоянии // Актуальные проблемы естественнонаучной подготовки педагогов. Сборник материалов Межрегиональной научно-практической конференции 2 – 3 ноября 2010 г. / Под ред. Э.Ф. Матвеевой. – Астрахань: Изд-во АИПКП, 2010. – С.20 – 23 2. Медведев, Ю.Н. ЕГЭ. Химия. Практикум по выполнению типовых тестовых заданий ЕГЭ: учебно-методическое пособие / Ю.Н. Медведев. – М.: Издательство «Экзамен», 2010. – 125 с. 3. Самое полное издание типовых вариантов заданий ЕГЭ: 2011: Химия / авт.-сост. А.А. Каверина, Д.Ю. Добротин, А.С. Корощенко, М.Г. Снастина. – М.: АСТ: Астрель, 2011. – 139, [5] с. – (Федеральный институт педагогических измерений). 4. Химия. ЕГЭ – 2009. Тематические тесты. Базовый и повышенный уровни (А1 – А30; В1 – В10) / В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева. – Ростов н/Д: Легион, 2008. – 411 с. Приложение к статье [4]: Вопрос В9. Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей. Тест1 1. Массовая доля азотной кислоты в растворе, полученном после добавления 20 г воды к 160 г ее 5% раствора, равна______% (Запишите число с точностью до десятых.) 2. Какую массу нитрата натрия необходимо растворить в 200 г воды для получения раствора с массовой долей 20%? Ответ: г. (Запишите число с точностью до целых.) 3. 12,5 г хлорида натрия растворили в 375 г раствора поваренной соли с массовой долей 0,1. Массовая доля NaCl в полученном растворе равна_____%. (Запишите число с точностью до десятых.) 4. Смешали 400 г 10%-ного и 100 г 70%-ного растворов серной кислоты. Концентрация кислоты в полученном растворе равна_____. (Ответ приведите в долях единицы с точностью до сотых.) 5. Сколько граммов воды необходимо добавить к 400 г 50%-ного раствора серной кислоты для того, чтобы получить 10%-ный раствор? Ответ:_____ г. (Ответ приведите с точностью до целых.) 6. Масса серной кислоты, содержащейся в 400 г ее 12%-ного раствора, равна____г. (Запишите число с точностью до целых.) Вопрос В10. Расчеты массы вещества или объемов газов по известному количеству вещества из участвующих в реакции. Тест1 1. 12,5 г железа растворили в избытке разбавленной хлороводородной кислоты. Рассчитайте объем (н.у.) выделившегося в результате этой реакции газа. Ответ: … л. (Запишите число с точностью до целых.) 2. Масса кислорода, необходимого для сжигания 67,2 л (н.у.) сероводорода до S02, равна ________________________ г. (Запишите число с точностью до целых.) 3. Масса технической негашеной извести, содержащей 80% основного вещества, необходимая для получения 640 г карбида кальция, равна … г. (Запишите число с точностью до целых). 4. Сколько литров воздуха (н.у.) требуется для сжигания 89,6 л водорода? (Принять содержание кислорода в воздухе равным 20% объемным.) (Запишите число с точностью до десятых). 5. При взаимодействии 21,75 г минерала доломита, содержащего 80% основного вещества, хлороводородной кислотой можно получить (выход 90%) газ массой … г. (Запишите число с точностью до целых). 6. Масса газа, выделившегося при обработке избытком хлороводородной кислоты 3 моль сульфида натрия, равна … г. (Запишите число с точностью до целых).