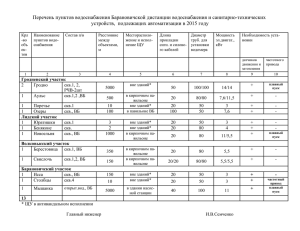
Sakibaev_Spontannaya i antigenzavisimaya b
реклама

ЦЕНТР ПОСЛЕДИПЛОМНОГО МЕДИЦИНСКОГО ОБРАЗОВАНИЯ г. ОШ На правах рукописи УДК: 616.5-002.525.2-092-079.4+576.8.077.3 САКИБАЕВ Кыязбек Шерикбаевич СПОНТАННАЯ И АНТИГЕНЗАВИСИМАЯ В - КЛЕТОЧНАЯ АКТИВАЦИЯ ПРИ РАЗЛИЧНЫХ КЛИНИЧЕСКИХ ВАРИАНТАХ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ (14.00.05. - внутренние болезни) ДИССЕРТАЦИЯ на соискание ученой степени кандидата медицинских наук Научный руководитель: доктор медицинских наук, профессор А.Т. Мамасаидов Ош - 2007 2 ОГЛАВЛЕНИЕ ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ……………………………............4 ВВЕДЕНИЕ…………………………………………………………………..........6 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ……………………………………………...12 1.1. Спонтанная В - клеточная активация при различных клинических вариантах системной красной волчанки………………………………...12 1.2. Антигензависимая В - клеточная активация при различных клинических вариантах системной красной волчанки…………………26 ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ……………………..…………………34 2.1. Клиническая характеристика обследованных лиц………………..............34 2.1.1. Клиническая характеристика больных СКВ……………………….........34 2.1.2. Клиническая характеристика больных РА……………………………....37 2.1.3. Клиническая характеристика больных ОА……………………………...39 2.2. Методы исследования………………………………………………………41 2.2.1. Клинические методы исследования……………………………………...42 2.2.2. Лабораторные методы исследования……………………………............42 2.2.3. Инструментальные методы исследования……………………………....43 2.2.4. Определение спонтанной В – клеточной активации……………………43 2.2.4.1. Определение спонтанной пролиферативной активности В лимфоцитов……………………………………………………………………....43 2.2.4.2. Определение спонтанной иммуноглобулинсинтезирующей активности В - лимфоцитов……………………………………………………..46 2.2.5. Определение антигензависимой В - клеточной активации…………….48 2.2.6. Статистический анализ результатов……………………………………..49 ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ………………………………...50 3.1. Клинико-лабораторные особенности течения различных клинических вариантов СКВ…………………………………………………………………...50 3.1.1. Клинико-лабораторные особенности острого, подострого и хронического течения СКВ……………………………………………..............50 3 3.1.2. Клинические особенности течения СКВ с АФС………………………..54 3.2. Спонтанная В - клеточная активация при СКВ……………………….......58 3.2.1. Спонтанная пролиферативная активность В - лимфоцитов в обследованных группах........................................................................................58 3.2.1.1. Спонтанная пролиферативная активность В - лимфоцитов при различных клинических вариантах СКВ…………………………………….....60 3.2.2. Спонтанная иммуноглобулинсинтезирующая активность В лимфоцитов в обследованных группах ………………………………………..65 3.2.2.1. Спонтанная иммуноглобулинсинтезирующая активность В лимфоцитов при различных клинических вариантах СКВ……………..........66 3.3. Антигензависимая В - клеточная активация при СКВ…………………...71 3.3.1. Кардиолипинзависимая активация В - лимфоцитов в обследованных группах …………………………………………………………………………..71 3.3.2. Кардиолипинзависимая активация В - лимфоцитов при различных клинических вариантах СКВ……………………………………………………72 ЗАКЛЮЧЕНИЕ………………………………………………………………….80 ВЫВОДЫ…………………………………………………………………...........89 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ…………………………………...........91 СПИСОК ИСПЛЬЗОВАННЫХ ИСТОЧНИКОВ……………………………...92 4 ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ АД – артериальное давление АГ – антиген аутоАГ - аутоантиген аКЛ – антитела к кардиолипину АНА – антинуклеарные антитела АНФ – антинуклеарный фактор АО – акридиновый оранжевый АРА – американская ревматологическая ассоциация АСК – антистрептокиназа АСЛ - антистрептолизин АТ – антитела АТДНК – антитела к нативной ДНК аутоАТ - аутоантитела АФЛ – антитела к фосфолипидам АФС – антифосфолипидный синдром БОК – бляшкообразующие клетки ВА – волчаночный антикоагулянт ДНК – дезоксирибонуклеиновая кислота ИЛ – интерлейкин КЗАЛ – кардиолипинзависимая активация В-лимфоцитов КЛ – кардиолипин КЦФ – количественная цитофлюриметрия ЛПРВ – ложноположительная реакция Вассермана ЛПС – липополисахарид МЛ – митоген лаконоса ОА - остеоартроз ОНМК – острое нарушение мозгового кровообращения ППС – полная питательная среда ПТИ – протромбиновый индекс 5 РА – ревматоидный артрит РНК – рибонуклеиновая кислота СПАЛ – спонтанная пролиферативная активность В–лимфоцитов СИАЛ – спонтанная иммуноглобулинсинтезирующая лимфоцитов СКВ – системная красная волчанка СОЭ – скорость оседания эритроцитов СРБ – С-реактивный белок УЗИ – ультразвуковое исследование Усл.ед. – условные единицы ФИ - фосфатидилинозитол ФИТЦ – флюресцеинизотиоционат ФНО – фактор некроза опухоли ФНС – функциональная недостаточность суставов ФС - фосфатидилсерин ФХ – фосфатидилхолин ФЭ - фосфатидилэтаноламин ЦИК – циркулирующие иммунные комплексы ЦНС – центральная нервная система ЦП – цветной показатель ЧД – частота дыхания ЧСС – частота сердечных сокращений ЭКГ - электрокардиограмма Ig – иммуноглобулин LE –Lupus erythematosus RW – реакция Вассермана активность В- 6 ВВЕДЕНИЕ Актуальность темы. Системная красная волчанка (СКВ) предстала как проблема ревматологии во второй половине ХХ века. Заболеваемость СКВ по различным данным варьирует от 1:10 000 до 1:1000 населения. Ежегодно регистрируется до 7 случаев СКВ на 10 000 населения. СКВ является классической одновременно, моделью моделью аутоиммунного ускоренного воспаления развития (В.А.Насонова, 1972; 1999; 2003; В.А.Насонова, и, атеросклероза Н.В.Бунчук 1997; M.B.Urowitz, D.D.Gladman, 1999; P.H.Shur, 2002; B.H.Hahn, 2003). На сегодняшний иммунопатогенеза проявляющаяся, циркулирующих день СКВ в известно, является частности, в что ведущим поликлональная накоплении иммунокомплексов при (ЦИК), звеном В-активация, этой болезни сывороточных иммуноглобулинов (Ig), антинуклеарного фактора (АНФ) и антител к нативной ДНК (АТнДНК). В свою очередь особое место в оценке Вактивации при СКВ занимают методы изучения пролиферативной и иммуноглобулинсинтезирующей функции периферических лимфоцитов, позволившие установить высокую пролиферативную и иммуноглобулинсинтезирующую активность В-лимфоцитов при этой болезни (А.Т.Мамасаидов, 1997; 1998; А.Т.Мамасаидов, Г.О.Баймырзаева, Г.А.Кулчинова, 2003; А.Т.Мамасаидов, Ф.А.Юсупов, А.М.Мурзалиев, С.А.Грошев, 2004; M.Zhang, K.J.Tracey, 1998). В последние годы внимание исследователей привлечено к изучению роли антител к фосфолипидам (АФЛ) в развитии тромботических нарушений и сосудистой патологии при СКВ (З.С.Алекберова , Т.М.Решетняк, С.Г.Раденска Лоповок, 1995; З.С.Алекберова ., Е.С.Мач, Е.В.Герасимова и др., 2003; Е.Л.Насонов, 2002; 2004; M.Samarcos, R.A.Asherson, S.Loizou, 2001; C.Neville J.Rauch, J.Kassis et all., 2003). Убедительно показано, что продукция АФЛ ассоциируется с развитием 7 достаточно очерченного симптомокомплекса, получившего название «антифосфолипидный синдром» (АФС) (Е.Л.Насонов, З.С.Алекберова, Л.А.Калашникова и др., 1998; Е.Л.Насонов, 2002; 2004; G.R.V.Hughes, 1993; E.N.Harris, S.S.Pirangeli, 2000), и формирует особый субтип болезни СКВ с АФС (З.А.Абдукадырова, Р.И.Руденко, А.Р.Вильданова, 2003). В научной и клинической практике при исследовании больных АФС в основном имеет место определение антител к кардиолипину (аКЛ) (Е.Н.Александрова, А.А.Новиков, Т.М.Решетняк и др., 2003; S.W.Reddel, S.A.Krilis, 1999; M.Samarkos K.A.Davles, C.Gordon et all., 2001). Определение аКЛ имеет место в основном при СКВ с развитием АФС. При этом АФС проявляется наличием в сыворотке крови аКЛ, а также тромбоцитопенией и триадой клинических признаков - повторными венозными и артериальными тромбозами, акушерской патологией в виде спонтанных абортов (привычных выкидышей) и поражением ЦНС (рецидивирующий ишемический инсульт у молодых, мигрень, хорея, эпилептиформные припадки) (Е.Л.Насонов, З.С.Алекберова, Ю.А.Карпов и др., 1999; М.М.Иванова, 2001; Е.Л.Насонов, 2002; 2004; Л.А.Калашникова, 2003; B.T.Oshiro, R.M.Silver, J.R. Scott et all., 1996; G.J.T.Peltola, A.Haapala, J.T.Jsojarvi et all., 2000; G.Sanna, M.L.Bertolaccini, M.J.Cuadrado et all., 2003). В клинической иммунологии кардиолипинзависимого В-иммунного ответа при СКВ, особенно субтипа СКВ с АФС, наименее изучен клеточный субстрат. Между тем его изучение создаст известную полноту в исследовании В-системы иммунитета, позволит уточнить природу активации этого важного эффекторного механизма В-иммунного ответа при СКВ с АФС (А.Т.Мамасаидов, 1997; А.Т.Мамасаидов , Ф.А.Юсупов, 2003; А.Т.Мамасаидов , Ф.А.Юсупов, С.А.Грошев, 2003). Исследование В-клеточного иммунного ответа к кардиолипину имеет большое значение для клинической практики, так как позволит провести более глубокий анализ степени иммунных сдвигов у больных СКВ с АФС, разработать на основании полученных данных вспомогательные методы 8 диагностики СКВ с АФС, прогнозирования характера течения патологического процесса и контроля иммунотропной терапии болезни. Цель настоящего исследования: изучить спонтанную и антигензависимую В-клеточную активацию при различных клинических вариантах СКВ. Задачи исследования: 1. Изучить клинико–лабораторные особенности течения различных клинических вариантов системной красной волчанки. 2. Оценить спонтанную пролиферативную активность В–лимфоцитов у больных системной красной волчанкой в сопоставлении с клиническими особенностями болезни. 3. Исследовать спонтанную иммуноглобулинсинтезирующую активность В-лимфоцитов у больных системной красной волчанкой в сопоставлении с контрольной группой и группами сравнения. 4. Изучить антигензависимую В–клеточную активацию при системной красной волчанке в зависимости от клинических особенностей болезни. Научная новизна: Осуществлено комплексное клинико-иммунологическое обследование больных СКВ с различными клиническими вариантами. У 28,1% больных СКВ обнаружены клинико-лабораторные признаки АФС в виде рецидивирующего тромбоза сосудов, акушерской патологии, поражения центральной нервной системы и обнаружения аКЛ в сыворотке крови. Характерной особенностью больных СКВ с АФС было то, что у значительного количества больных отмечалось благоприятное течение болезни. Впервые при СКВ изучены показатели спонтанной В–клеточной активации (по уровням пролиферативной и иммуноглобулинсинтезирующей функции периферических лимфоцитов 9 (СПАЛ и СИАЛ)) в зависимости от клинических вариантов течения болезни. Выявлено то, что у больных СКВ уровни СПАЛ и СИАЛ достоверно выше, чем у здоровых лиц, больных остеоартрозом (ОА) и ревматоидным артритом (РА). Обнаружено, что при СКВ показатели СПАЛ и СИАЛ возрастали с повышением активности патологического процесса и увеличением тяжести течения болезни. Установлен максимальный уровень кардиолипинзависимой активации В–лимфоцитов (КЗАЛ) у больных СКВ и нехарактерность КЗАЛ для здоровых лиц, больных ОА и РА. Значения КЗАЛ при СКВ с АФС были гораздо выше, чем при СКВ без АФС. Впервые обнаружено избирательное повышение иммуноглобулинсинтезирующей активности В-лимфоцитов в присутствии кардиолипина у больных СКВ с АФС. Выявлено, что КЗАЛ является специфическим иммунологическим признаком СКВ с АФС. На основе изучения антигензависимой В–клеточной активации разработан новый способ иммунологической диагностики АФС при СКВ. Практическая значимость полученных результатов: Установлена, достаточная информативность показателей СПАЛ и СИАЛ для определения минимальных проявлений активности патологического процесса при СКВ, что имеет существенное значение в клинической практике для диагностики, дифференциальной диагностики и назначения своевременной адекватной терапии. Выявленные особенности показателей В-клеточной активации у больных СКВ в комплексе с клиническими данными способствуют дифференциальной диагностике различных клинических вариантов СКВ. Определение КЗАЛ может быть использовано в качестве иммунологического метода диагностики АФС у больных СКВ. Кроме того, определение КЗАЛ у больных СКВ может быть использовано для проведения дифференциальной диагностики между СКВ с наличием и без наличия АФС. 10 Экономическая значимость полученных результатов: Включает возможность улучшения клинико-лабораторной, а также иммунологической диагностики в лечебно-профилактических учреждениях от внедрения результатов нашего исследования. Основные положения, выносимые на защиту: 1. У больных СКВ отмечается гиперактивность В-клеточного ответа, в частности, проявляющаяся в виде повышенных уровней СПАЛ, СИАЛ и КЗАЛ. 2. Высокие уровни СПАЛ и СИАЛ при СКВ ассоциируются с выраженностью активности патологического процесса, острым течением, наличием и высоким титром АНФ в сыворотке крови и не зависят от присутствия клинико-лабораторных проявлений АФС. 3. Определение КЗАЛ в комплексе с клинико-лабораторными данными способствуют улучшению диагностики и дифференциальной диагностики АФС при СКВ. 4. Обнаружение признаков АФС при СКВ сочетается с более благоприятным течением болезни, т.е. с хроническим течением, отсутствием тяжелых висцеритов и минимальной степенью активности патологического процесса. Личный вклад соискателя: Аналитическая проработка литературных источников, весь комплекс клинико-лабораторных методов исследований, результаты которых вошли в диссертационную работу проведены аспирантом самостоятельно. Внедрение в практику: Результаты исследования внедрены в работу иммунологической лаборатории, отделения ревматологии Ошской областной клинической больницы и в учебный процесс кафедры внутренних болезней медицинского института Ошского государственного университета, а также 11 используются в преподавании на циклах последипломной подготовки врачей-ревматологов, иммунологов и общей практики. Апробация работы. Материалы диссертационной работы доложены и обсуждены на Международной научной конференции «Актуальные проблемы современной медицины», посвященной 2200-летию Кыргызской Государственности и 10-летию медицинского факультета Ошского Государственного Университета (г. Ош, 2003), на X Международной конференции молодых ученых и специалистов, посвященной 65-летию Кыргызской Государственной Медицинской Академии (г. Бишкек, 2004), на ежегодных научных сессиях Ошского Государственного Университета (г. Ош, 2004; 2005), на Международной конференции «Актуальные проблемы медицины и высшего образования» (г. Жалалабат, 2005), на научно- практической конференции молодых ученых КГМА (г. Бишкек, 2006). Апробация диссертационной работы состоялась 26 января 2007 года на заседании межотделенческой конференции НЦКТ имени академика Мирсаида Миррахимова при МЗ КР в г. Бишкек. Публикации: По материалам диссертации опубликовано 9 работ, получены удостоверения на 2 рационализаторских предложения и оформлена 1 заявка на изобретение. Структура диссертации: Диссертационная работа общим объемом 116 страниц литературы, компьютерного набора состоит из введения, обзора главы о материалах и методах результатов собственных исследований, практических рекомендаций и списка исследования, обсуждения, использованной главы выводов, литературы. Содержит 9 таблиц и 3 рисунка. Указатель источников литературы включает 240 источника, в том числе 91 русскоязычных и 149 иностранных авторов. Приведено 7 выписок из истории болезни. 12 Глава 1 ОБЗОР ЛИТЕРАТУРЫ 1.1. Спонтанная В-клеточная активация при различных клинических вариантах СКВ Системная красная волчанка (СКВ) - это хроническое полисиндромное заболевание преимущественно молодых женщин и девушек, развивающаяся на фоне генетически обусловленного несовершенства иммунорегуляторных процессов, приводящего к неконтролируемой продукции антител к собственным клеткам и их компонентам, с развитием аутоиммунного и иммунокомплексного воспаления (В.А.Насонова, М.Г.Астапенко, 1989; В.А.Насонова, 1995; 1999; В.А.Насонова, Е.Л.Насонов, 2003; J.W.Morrow, L.Nelson, R.Watts et all., 1999; G.S.Dean, J.Tyrrei-Price, E.Grawley et all., 2000). Заболеваемость СКВ по различным данным варирует от 1:10 000 до 1:1000 населения. Ежегодно регистрируется до 7 случаев СКВ на 10 000 населения (M.B.Urowitz, D.D.Gladman, 1999). В последние два десятилетия отмечено существенное повышение количества больных СКВ. В 40-60-х годах ХХ столетия СКВ рассматривалась как фатальное заболевание, часто заканчивающееся летальным исходом в течение нескольких месяцев или лет, и при этом 5-летняя выживаемость больных СКВ в эти годы не превышала 50% (K.M.Uramoto, C.J.Michet, J.Thomboo, W.M.O’Fallon, 1999). По результатам ретроспективного изучения летальности больных СКВ 90-годов 10-летняя выживаемость составляла 75-85%, а 2-летняя выживаемость – около 90%. По данным крупных проспективных исследований (Европейского, включавшего 1000 человек, и Канадского с охватом 644 человек), 5-летняя выживаемость составила соответственно 95-93%. Не столь оптимистичны сведения о продолжительности жизни больных СКВ в развивающихся странах (R.Cervera, M.A.Khamashta, G.M.Kammer, N.Mishra, 2000; K.Е.Sullivan, 2000). J.Font, 1999; 13 В патогенезе СКВ важное место отводится иммунным механизмам, многие аспекты которых, несмотря на интенсивное изучение, остаются невыясненными. СКВ – заболевание, предъявляющее серьезный вызов клинической и теоретической иммунологии. СКВ характеризуется «обескураживающей пестротой» иммунологических феноменов (J.S.Cameron, 1997; E.G.Neilson, W.G.Couser, 1997; D.J.Wallace, B.N.Hahn, 1997). СКВ ассоциировано клеточными с многообразными иммунологическими нарушениями. При активном течении заболевания выявляют увеличение пролиферации стволовых клеток, преждевременную инволюцию вилочковой железы, нарушение продукции тимических гормонов (А.И.Дядык, 1995; W.Kelley, 1997). Особое место среди иммунных нарушений занимают Тклеточные деффекты. Часто определяют снижение количества циркулирующих Т-лимфоцитов, изменение уровней и функциональной активности их субпопуляций. Многие исследователи полагают, что дефекты Т-клеточных субпопуляций с нарушением иммунорегуляции могут играть основную роль в патогенезе СКВ (В.А.Насонова, Я.А.Сигидин, 1985; В.А.Насонова, 1999; 2003; C.Surh, J.Sprent, 2000). Установлено, что блокирование CD4+-Т-клеток предупреждает начало заболевания (В.А.Насонова, 1995; 1999; 2003; D.J.Wallace, 1999). Отмечаемый при СКВ дефицит супрессорной функции приводит к увеличению синтеза антител (АТ) и, возможно, к продукции аутоантител (ауто-АТ). Нарушение продукции цитокинов (в частности, интерлейкинов -2 и -10) в результате изменения функции CD4+-Т-клеток выявляют у больных СКВ. Наряду с измененным ответом этих иммуноцитов на воздействие цитокинов это нарушение может определять патологию активирующих регуляторных воздействий (G.Kammer, I.Khan, C. Malemud, 1994; E.G.Neilson, W.G. Couser, 1997). Одной из гипотез является то, что при СКВ происходит первичное нарушение Т-клеточного звена иммунной системы, в основе которого лежит нарушение баланса цитокинов, продуцируемых Т-клетками вследствие преимущественной активации Т-хелперов II -класса (Th2) (G.M.Kammer, 14 R.L.Stein, 1990). Th2 вырабатывают интерлейкины (ИЛ), обуславливающие развитие гуморального ответа. Одним из следствий этого дисбаланса являются поликлональная активация В-клеток, нерегулируемая продукция естественных АТ и патологических ауто-АТ (K.Okudaira, R.Searles, J.Ceuppens et all., 1982; M.Lincer-Israeli, A.Bakke, R.Kitridou et all., 1983; D.A.Fox, J.A.Millard, J.Treisman et all., 1991; A.M.Blasini, I.L.Stekman, F.Conzalez et all., 1994; А.К.Dayal, G.M.Kammer, 1996). На сегодняшний день известно, что ведущим звеном иммунопатогенеза СКВ является поликлональная В-активация, проявляющаяся, в частности, в накоплении при этой болезни циркулирующих иммунокомплексов (ЦИК), сывороточных иммуноглобулинов (Ig), антинуклеарного фактора (АНФ), антител к нативной ДНК (АТнДНК). В свою очередь, особое место в оценке В-активации при СКВ занимают методы изучения пролиферативной и Igсинтезирующей функции периферических лимфоцитов, позволившие установить высокую пролиферативную и Ig-синтезирующую активность Влимфоцитов при этой болезни (А.Т.Мамасаидов, 1997; 1998; А.Т.Мамасаидов, Г.О.Мурзабаева, Г.А.Кулчинова, 2003; А.Т.Мамасаидов, Г.М.Мамасаидова, Ф.Р.Таджибаева и др., 2006; M.Zhang, K.J.Tracey, 1998). При этом избыточная активация В-клеток приводит к синтезу ими иммуноглобулинов, реактивных к различным аутоантигенам (ауто-АГ), включая молекулы клеточных мембран, цитоплазматические протеины и ядерные детерминанты (V.Strand, 1999). У больных СКВ часто определяют увеличение Ig-синтезирующих В-лимфоцитов периферической крови по сравнению со здоровыми лицами. Эти лимфоциты продуцируют аутореактивные АТ с широким спектром аутоспецифичности, которые индуцируют как тканевые волчаночные повреждения (гемолитическая анемия, гломерулонефрит, васкулит и т.д.), так и изменения в регуляции функционировании различных элементов иммунной системы (например, аутоантитела, влияющие на функции Т-супрессоров). К важнейшим факторам патогенеза СКВ относят изменения процессов, обеспечивающих 15 развитие толерантности к ауто-АГ, закономерным следствием чего является ненормальная продукция широкого спектра ауто-АТ (K.Е.Sullivan, 2000). Важное значение в развитии иммунопатологических процессов при СКВ имеют снижение абсолютного или относительного количества естественных клеток-киллеров и нарушение их функциональной способности. При этом развиваются нарушения как цитотоксической, так и иммунорегуляторной функции естественных клеток-киллеров. СКВ характеризуется гетерогенным поликлональным ответом ауто-АТ. Среди ауто-АТ наиболее специфичными для СКВ являются антинуклеарные АТ, направленные против различных ядерных компонентов, включая ДНК, РНК, гистоны и нуклеопротеиновые комплексы. Наряду с АТ к нуклеарным структурам, при СКВ могут определяться АТ к мембранным и цитоплазматическим детерминантам различных клеток, растворимым протеинам и другим компонентам. Считают, что в индукции образования ауто-АТ задействованы как специфические, так и антигенспецифические иммунорегуляторные нарушения (G.Ruiz-Irastorza, M.A.Khamashta, G.Castellino, G.R.V.Hughes, 2001). Активация В-лимфоцитов - процесс многостадийный, включающий такие условно разделенные стадии, как индукция (распознавание), требующая наличия специфического антигена, активация, пролиферация, дифференцировка с созреванием в Ig-синтезирующие, затем Ig- секретирующие клетки. Инициирующим экзогенным сигналом активации Влимфоцитов могут быть неспецифические поликлональные В-клеточные митогены, а в условиях in vivo – специфические антигены. При этом Вклетки одновременно получают активирующий сигнал от Т-лимфоцитов, распознающих этот специфический антиген (В.А.Лященко, В.А.Дроженников, И.М.Молотковская, 1988; Ю.А.Осеюнин, Р.М.Балабанова, 1996; M. Rosenthal, 1976; H.P.McNeil, C.N.Chesterman, S.A.Krilis, 1991). К Вклеточным митогенам относятся митоген лаконоса (МЛ), липопосахариды (ЛПС) грамотрицательных бактерий, белок А стафилококка, туберкулопротеин (ТП) и другие. Воздействие этих веществ выражается, 16 главным образом, в индукции митозов и развитии клеток с известной активностью. Часто степень активизации оценивается по усилению пролиферации лимфоцитов, которая определяется по включению в клетки меченного тимидина. Однако считается, что таким методом нельзя точно определить, какая именно субпопуляция клеток активирована используемым митогеном и каков будет конечный (функциональный) результат активации (G.C.Mudde, D.Van Dan, G.C.de Gast, 1986; E.S.Hansen, K.Fogn, V.E.Hjortdal et all., 1990). Конечный эффект активации В-лимфоцитов – синтез и секреция Ig, оценка которых более показательна в изучении В-клеточной активации (Е.В.Бененсон, Е.Цай, О.В.Лобанченко, В.Г.Панов, 1990; А.Т.Мамасаидов, 1997; 1998; 2002; А.Т.Мамасаидов, Ф.А.Юсупов, 2001; 2003; H.Zola, 1985). В настоящее время процесс активации В-лимфоцитов человека рассматривается в связи с клеточным циклом (Е.В.Бененсон, Е.Г.Цай, 1990; J.H.Kehrl, J.l.Muragushi, R.J.M.Falkoff et all., 1984; G.M.Kallenberg, F.Van Bissel-Emiliani, M.G. Muitema et all., 1988). Процесс активизации В-клеток, то есть переход покоящихся клеток из фазы G0 в следующую G1-фазу клеточного цикла, сопровождается метаболическими, ферментативными изменениями в лимфоците и является обязательным для развития иммунного ответа с формированием специфических клонов В-эффектов. Для каждой фазы клеточного цикла В-лимфоцитов характерны свои регуляторные факторы. Переход В-клеток из фазы покоя (G0) в фазу G1 происходит под влиянием фактора, стимулирующего В-клетки (BSF-1), вырабатываемого Тклетками. Для этого антиген презентируется Т-лимфоцитами макрофагам. После чего макрофаги, вырабатывая ИЛ-1, активируют Т-клетки (Y.Kageyama, Y.Koide, S.Miyamoto et all., 1994). Активированные Тлимфоциты выделяют различные лимфокины, в том числе и BSF-1, и активируют В-клетки. Дальнейший переход В-клеток в S-фазу регулируется фактором роста В-клеток (BCGF) Т-клеточного происхождения, рецепторы к которому имеются на покоящихся клетках, но после активации их количество возрастает (У.Н.Петрова, Т.В.Радыгина, Г.Л.Лыскина, 17 А.П.Продеус, 2002; M.R.Kehry, L.C.Yamashita, R.D.Hodobin, 1990). В S-фазу действуют другие ростовые факторы (BCGF-11), интерферон, ИЛ-2 (C.Denzlinger, A.Guhlmann, P.H.Scheuber et all., 1996). Сам антиген или антиIg сыворотки действуют сразу после митоза, то есть каждый новый пролиферативный цикл начинается с антигенного стимула. Для максимальной В-клеточной активации и пролиферации необходимо прямое взаимодействие Т-хелперов и В-клеток. В отсутствие антигенной стимуляции Т-хелперы не способны стимулировать покоящиеся В-клетки. При этом рецепторы В-лимфоцитов обладают способностью связывать антиген. После воздействия антигена на клеточную мембрану происходит трансформация Вклеток в эффективные антигенпредставляющие клетки, способные к их активации (А.Бейум, 1980; А.Лященко, В.А.Дроженников, И.М.Молотковская, 1988; О.Б.Ярменко, 2004). В патологическом пути Вактивации начальный сигнал исходит из взаимодействия со специфическим иммноглобулиновым рецептором на поверхности В-клеток, приводящего к освобождению вторичных мессенджеров. Это ведет к эффективному взаимодействию В-лимфоцитов с Т-хелперами с последующей активацией последних и секрецией ими BCGF и лимфокинов. После чего происходит активация (пролиферация) и дифференцировка В-клеток в плазмоциты, Igпродуценты после серий клеточных делений, а также под воздействием вырабатываемого Т-клетками фактора дифференцировки В-клеток (BCDF) (C.Milanese, A.Bensussan, E.Reinhers et all., 1985; P.Gresswell, 1987; B.Christophe, H.Maureen, 2000) и лимфоцитов, в частности, ИЛ-2, ИЛ-4, ИЛ5, ИЛ-6 (L.Mayer, 1985; M.H.A.Julius, 1990; C.Luc, H.Kiyon, J.McGhee et all., 1991). Строгая этапность этих двух взаимосвязанных процессов (пролиферации и дифференцировки) подтверждается супрессирующим влиянием на синтез Ig ингибиторов пролиферации. Для выхода Влимфоцитов из стадии покоя G0 достаточно даже неспецифического воздействия, например, повышения уровня внутриклеточного кальция, однако вход в фазу G1 и дальнейшее продвижение по циклу требуют 18 дополнительного воздействия. Установлено, что для дифференцировки Вклеток необходимы 3 сигнала: 1) стимуляция пролиферации G0-G1; 2) индукция чувствительности клеток к дифференцировочным факторам; 3) дифференцировочный сигнал, причем роль такого сигнала могут выполнять активаторы В-клеток (L.L.Stunz, T.L.Felbuch, 1986; H.Enzmann, J.Mollenhauer, K.Brune, 1990; J.G.Johnson, R.Jemmerson, 1991). Известна точка зрения, что В-лимфоциты играют активную роль и через свои Ig-ые рецепторы способны выступать в ряде случаев как стимуляторы или супрессоры иммунных реакций. J.G.Johnson и R.Jemmerson [151] установили, что большая часть В-лимфоцитов активируется с помощью механизма активации, при котором В-клетки поглощают большое количество неспецифического (не соответствующего специфичности их Ig-рецепторов) антигена. После процессинга антиген распознается специфичными к нему Тлимфоцитами, запускающими продукцию В-клетками антител. Делают вывод, что Ig-рецепторы подают на В-клетку сигнал активации (A.Ройт, 1991; B.Combe, 1989). По мнению некоторых исследователей происходит прямая внутриклеточная дифференцировка В-клеток памяти в плазматические клетки (А.Каплас, А.Альварес, 1977; A.Benegtsson, G.Holmlund, E.Kihlstrm, B.Linablom, 1985; Roojen van N, 1990). Это идет таким образом: часть ИК, образующихся при контакте иммунной системы с антигеном, захватывается дендритными клетками фолликулов лимфоидных органов. При контакте этих клеток с В-лимфоцитами последние превращаются в клетки памяти. При повторном контакте с антигеном покоящиеся клетки памяти непосредственно превращаются в антителообразующие клетки (B.C.Смирнов, А.Н.Малков, Л.Б.Булатов, 1990; G.Sieber, H.J.Breyer, F.Hermann et all., 1985). Известно, что гиперактивция В-клеток может быть оценена в двух стадиях: 1) индукции и пролиферации; 2) экспрессии эффекторной функции. При ее оценке следует применять РБТ-тест с В-митогенами, определять 19 уровень Ig в культурных супернантах, число клеток с цитоплазматическими Ig и число клеток, секретирующих Ig. Способность В-лимфоцитов периферической крови к синтезу и секреции основных эффекторных молекул иммунной системы – Ig – открывает широкие возможности для исследования этой важнейшей функции иммунного ответа in vitro (А.П.Мешков, 1999; Е.М.Davidson, S.A.Ral, M.J.Smith, 1983). Определение Ig-синтезирующей активности В-клеток по появлению Ig в культурной среде стало возможным благодаря развитию нефелометрического, радиоиммунного и иммуноферментного анализов, обладающих высокой разрешающей способностью. В основе этих методов лежит краткосрочное культивирование иммунокомпентных клеток в присутствии поликлональных митогенов с последующим определением в надостаточной жидкости «валовой» продукции Ig (P.Tan, G.Paud, J.D.Wilson, 1981). Применяя эти методы, удалось установить роль митогенов в Вклеточной дифференцировке, определить культуральные условия и их влияние на синтез Ig (I.Jokinen, K.Poikonen, T.Mottenen et all., 1990) и роль других популяций в осуществлении эффективной функции В-клеток (T.Kunori, O.Rinkden, 1980). В результате этих исследований удалось выяснить, что ряд митогенов (МЛ, ЛПС, продукты золотистого стафилококка) способны стимулировать В-клетки как к пролиферации, так и к дифференцировке в продуценты Ig in vitro. Другие активаторы (антитела против Ig, декстросульфат, антирецепторные многоклональные антитела) выводят В-лимфоциты в пролиферативный цикл без дальнейшей дифференцировки. Также было установлено, что в отсутствие стимулятора происходит незначительное повышение количества Ig в культурной среде (спонтанный синтез и секреция), тогда как в стимулированных лимфоцитах вырабатывается в 5-10 раз больше Ig. Исследования Ig-синтезирующей функции in vitro в клинической практике, выполненные вышеуказанным методом, дали чрезвычайно вариабельные результаты. Так, например, по данным S.Jahn et all (157) у 84 20 здоровых лиц уровень синтезированных Ig в стимулированной МЛ культуре сильно колебался. Результаты аналогичных исследований при различных патологиях также отличаются разнородностью, особенно при аутоиммунных заболеваниях, иммунитета в основе которых (K.T.Nouri-Aria, лежит J.E.Hegarty, гиперактивность G.J.Alexander et В-системы all., 1985; A.Sigfusson, J.M.Bubbage, R.L.Souhami, 1985). Так, при СКВ показано повышение спонтанного (Е.В.Бененсон, и В.Г.Панов, снижение стимулированного А.Ш.Сейсенбаев, синтеза Б.Б.Сагандыков, Ig 1982; A.J.Levinson, A.Oziarski, T.Penius et all., 1981; G.M.Kallenberg, F.Van BisselEmiliani, M.G.Muitema et all., 1988; B.K.Pelton, M.Specmaier, W.Hylton et all., 1991; T.Yoshiva, S.Eumihico, O.Tushiyuci et all., 1998). Анализируя данные о возможности определения Ig-синтезирующей функции В-лимфоцитов по их содержанию в культурном супернанте и оставляя в стороне чисто технические сложности радиоиммунного и иммуноферментного анализов, нельзя не отметить следующие важные факторы, влияющие на результаты и их интерпретацию. Культуре лимфоцитов для определения продукции ими Ig in vitro присуще множество факторов нестабильности. Отметим лишь некоторые из них: 1. Недостатки длительного культивирования клеток. За эти сроки в культуре лимфоцитов значительно (почти до 50%) падает выживаемость клеток, причем жизнеспособность клеток в культурах без стимулятора значительно ниже, чем в присутствии стимулятора (И.Р.Линг, 1971). Также известно, что в условиях in vitro в течении 20 часов гибнет субпопуляция неспецифических супрессорных клеток, играющая огромную роль в регуляции пролиферации лимфоцитов in vivo (D.N.IIfela, M.K.Cathcart, P.S. Krakauer et all., 1981). Кроме того, гибель и разрушение клеток в течение 7 суток приводит к пассивному выходу Ig в культуральную среду, что искажает представление об истинном уровне синтеза и, особенно, секреции Ig клетками. 21 2. Определение Ig в супернанте характеризует, прежде всего, уровень секреции Ig В-клетками, т.е. отражает количество и функциональную активность зрелых Ig-продуцентов (J.Jokinen, K.Poikonen, H.Arvilomni, 1985). Интенсивность синтеза Ig В-лимфоцитами находится в прямой зависимости от степени их зрелости. При нормальном развитии иммунного ответа популяция Ig-содержащих клеток состоит в основном из малых лимфоцитов, играющих центральную роль в образовании антител (А.Ройт, 1991). Также известно, что совокупность В-лимфоцитов in vivo является гетерогенной по функциональному состоянию клеточной популяции (A.S.Fauci, 1983), т.е. в каждый данный момент времени клетки популяции находятся на разных ступенях активации. Интенсивность Ig-образования в клетке нарастает с момента активации и достигает максимума в зрелых плазмоцитах (A.Nisonoff, 1982). Учитывая гетерогенность и несинхронность по циклу развития определение Ig-продукции в культуральном супернанте позволяет судить лишь о конечной стадии развития В-клетки со всеми элементами нестабильности, присущими длительному культивированию лимфоцитов in vitro. Гиперактивность В-системы в патологических условиях характеризируется появлением в популяции повышенного числа незрелых, активированных лимфоцитов (Т.Д.Буланова, А.Ле Го, З.С.Алекберова и др., 1980; Е.В.Бененсон, С.К.Сагандыкова, Б.Б.Сагандыков, 1981), которые являются Ig-синтезирующими, но еще не секретирующими формами лимфобластов (Е.В.Бененсон, Е.Г.Цай, О.В.Лобанченко, В.Г.Панов, 1990). Имеются данные о нарушении способности В-клеток к нормальному прохождению клеточного цикла и созреванию у больных с аутоиммунными феноментами, в результате чего активированные клетки могут «застревать» на определенной стадии развития (G.B.Klaus, M.B.Bijsterboch, I.Holman, 1985; C.H.Jurgensen, J.L.Ambrus, A.S.Fauci, 1986). В этом случае при низкой секреции Ig незрелыми В-клетками обнаруживаемые в супернанте Ig имеют трудноинтерпретируемое происхождение, они могут быть как частично 22 секретированными, так и в большей степени пассивно вышедшими из погибших во время культивирования лимфоцитов, и количественный результат теста будет в основном определяться не функциональной активностью, а техническими и культуральными условиями опыта. Таким образом, определение Ig-синтезирующей функции в 5-7- суточном супернанте односторонне, поскольку учитывает лишь функцию зрелых секретирующих клеток, со всеми факторами нестабильности, присущими длительной культуре лимфоцитов. Другим методом изучения Ig-продукции лимфоцитами in vitro является определение количества Ig-секретирующих клеток по числу образуемых в кровяном агаре зон локального гемолиза («бляшек»). К настоящему моменту метод имеет много модификаций, ряд которых несет чисто технические усовершенствования. Отметим лишь те, которые позволят расширить круг приложения метода. В первоначальном варианте метод определения бляшкообразующих определения числа клеток клеток образующих (БОК) предназначался антитела против для бараньих эритроцитов и сыграл значительную роль в изучении механизмов развития иммунного ответа на вводимый эксперментальным животным антиген. Позже для применения метода в клинических целях было предложено изучать число БОК к другим антителам. Для определения неспецифического синтеза Ig было предложено использовать способность белка А золотистого стафилококка связыватся с Fs-фрагментом IgG. Вырабатываемые клетками Ig связывались с белками А, присоединенным к эритроцитам. После обработки анти-Ig сывороткой и комплементом эритроциты, к которым присоединился секретированный L.Hammerston, Ig лизировались, C.I.Smith Многочисленные et all., исследования, образуя 1981; зоны G.F.Burns, выполненные этим БОК (A.C.Bird, B.L.Pike, способом, 1981). дали результаты, в основном совпадающие по направленности с данными, полученными радиоиммунным и иммуноферментным методами (J.Jokinen, K.Poikonen, H.Arvilomni, 1985). Однако была отмечена слабая корреляция 23 БОК теста с иммуноферментным и больший запрос данных в БОК теста (J.Ludeman, B.Utecht, W.L.Gross, 1985). Нестабильность БОК-метода также отмечена в работах A.Wangel et all [236], не нашедших разницы в числе БОК между здоровыми и больными СКВ в неактивной фазе, в то время как G.Sieber et all [221] установили повышение числа БОК при данном заболевании. Другими авторами установлена выраженная зависимость результатов БОК-метода от технических условий постановки. Так, обнаружено, что обычный БОК-тест проявляет не все Ig-секретирующие клетки, а добавление ПЭГ–600 в два раза увеличивает число БОК, а использование белка А в БОК методе оказывает сильное неконтролируемое влияние на результат, поскольку данный реагент является одновременно и сильным митогеном для В-клеток (А.Ройт, 1991; G.F.Burns, B.L.Pike, 1981; J.Ludeman, B.Utecht, W.L. Gross, 1985). Таким образом, исследования пролиферативной и Ig-синтезирующей функции лимфоцитов отличаются противоречивостью, фрагментарностью и сложностью интерпретации целостному организму полученных (Е.В.Бененсон, данных применительно В.Г.Панов, к А.Ш.Сейсенбаев, Б.Б.Сагандыков, 1982; Е.В.Бененсон, Е.Г.Цай, О.В.Лобаченко, В.Г.Панов, 1990; K.Poikonen, M.Oka, T.Mottonen et all., 1982). Эти особенности проводимых исследований имеют методическую основу, поскольку методы in vitro связаны с длительным (до 5-7 суток) сроком культивирования клеток в системе моно- или смешанных культур. При этом не учитываются исходные, складывающиеся в организме соотношения предактивированных и зрелых клеток, изменения их количественного состава в процессе культивирования. Все эти факторы устраняются при использовании количественной флюороресцентной микроскопии и проточных флюороресцентных анализаторов, позволяющих буквально в первый час после взятия крови изучать с высокой скоростью и максимальной приближенностью к процессам in situ основные параметры функциональной активности лимфоцитов. 24 Со времени разработки Coons A. et all [117] метода определения внутриклеточных антигенов иммунофлюоресцентным способом проведено немалое количество исследований, что позволило выделить специальную область (иммуногистология) в рамках иммунологии. Основное преимущество метода в том, что определение интересующих исследователя веществ производится непосредственно в клетке, что позволяет исключить ряд факторов нестабильности и недостоверности, присущие другим, более косвенным методам определения. Преимущества иммунофлюоресцентного метода, особенно для клинициста, заключается в возможности анализа количества, а в ряде случаев и функции Ig-содержащих клеток максимально близкого к положению in situ, поскольку для иммунофлюоресцентного анализа (ИФА) не требуется предварительного культивирования Чувствительность ИФА очень высока удовлетворительной воспроизводимости. (в пределах клеток. нг/мл) при При проведении ИФА в твердой фазе (что характерно для определения Ig-синтезирующих клеток в рамках традиционной флюоресцентной микроскопии) продукты реакции отделяют друг от друга, что резко повышает специфичность и чувствительность, т.к. устраняются фоновые помехи. Большинство исследований, посвященных ИФА Ig-синтезирующих клеток, выполнено путем подсчета флюоресцирующих клеток. Недостатки подобного анализа налицо: 1) субъективность при выборе объекта счета; 2) малая точность, поскольку учитываются клетки, обладающие достаточно яркой флюоресценцией. Трудоемкость и значительное время, затрачиваемое на визуальный поиск объекта и его флюориметривание, не позволило методу количественного ИФА получить широкое распространение в рамках традиционной флюоресцентной микроскопии. Появления высокоскоростных и чувствительных проточных анализаторов резко повысило интерес исследователей к количественному ИФА. Удалось с высокой точностью изучить стадии активации В-клеток по перераспределению Ig в клетке (M.A.Cuchens, T.M.Buttke, 1984), уточнить 25 количественные (В.С.Смирнов, соотношения А.Н.Малков, В-популяций К.Б.Булатов, в периферической 1990; J.Gebhard, крови F.David, A.Millelman et all., 1986) и тканях, изменения Ig-синтезирующей функции под влиянием митогенов (G.C.Mudde, D.VanDan, G.C.de Gast, 1986), влияние интерлейкинов на созревание В-клеток (L.Bich-Thuy, A.S.Fauci, 1986). Проточный метод также не лишен определенных недостатков (В.А.Насонова, А.Я.Сигидин, 1985; R.D.Gitmann, R.S.Poulsen, 1983), которые впрочем относятся к разделу технических особенностей анализа. Однако метод дорогостоящий, приборное обеспечение его технически сложно, поскольку современный проточный анализатор представляет из себя комплекс, состоящий гидродинамической и из лазерного фотометрической устройства, чувствительной техники компьютерного и анализатора. По этим причинам проточная цитофлюорометрия еще не получила широкого распространения в мировой клинико-иммунологической практике, оставляя в настоящее время широкое поле для применения традиционной цитофлюорометрии. К настоящему времени методом по включению Н3-тимидина обнаружена более высокая пролиферативная активность периферических В-лимфоцитов больных СКВ по сравнению со здоровыми донорами. Наиболее информативным и практически удобным для определения Вклеточной активации является способ количественной цитофлюориметрии (КЦФ) (Е.В.Бененсон, Е.Г.Цай, 1990). КЦФ позволяет совместить достоинства проточной цитофлюориметрии и доступность традиционной флюоресцентной микроскопии, регистрировать в едином методическом ключе в режиме экспресс-анализа выраженность, характер и взаимосвязи основных функций лимфоцитов (пролифиративной, супрессорной и Igсинтезирующей) с учетом фазы клеточного цикла, открывает большие перспективы в изучении Ig-синтезирующей функции В-клеток. При исследовании путем КЦФ обнаружена значительно более выраженная активность В-лимфоцитов периферической крови больных СКВ по 26 сравнению со здоровыми лицами (Е.В.Бененсон, Е.Г.Цай, 1987; 1990; А.Т.Мамасаидов, 1997; 1998; А.Т.Мамасаидов, Ф.А.Юсупов, 2003; А.Т.Мамасаидов, Г.М.Мамасаидова, Ф.Р.Таджибаева и др., 2006). Известны данные о более высокой способности лимфоцитов периферической крови больных СКВ, по сравнению со здоровыми, к более интенсивному спонтанному синтезу неспецифических Ig in vitro (А.Н.Чередеев, Л.В.Ковальчук, 1991; P.Tan, G.Paud, J.D.Wilson, 1981), что изучено в тесте бляшкообразования по наличию антителообразуюших клеток нефелометрическим, радиометрическим, иммуноферментным и КЦФ методами (И.Т.Карнаухов, 1970; B.K.Pelton, M.Spekmaier, W.Hylton et all., 1991). При этом обнаружено, что чем выше активность СКВ, тем значительнее возрастает спонтанная продукция Ig (T.Takeuchi, 1985; А.Т.Мамасаидов, 1997; 1998). Установлено, что больные СКВ с высоким уровнем Ig-синтезирующей активности В-клеток страдают преимущественно серопозитивной формой болезни, характеризующейся более тяжелым течением и неблагоприятным прогнозом заболевания. Аналогично, у больных СКВ с высоким уровнем В-активации отмечается более тяжелое течение. Эти особенности функциональной и метаболической активности периферических лимфоцитов больных СКВ, по-видимому, лежат в основе спонтанной продукции in vitro В-клетками специфических Ig, в частности, продукции АНФ при СКВ (R.Gorld, P.Airo, F.Franceschini et all., 1990), антител к ДНК при СКВ (D.Ora, M.R.Salaman, M.N.Seifert et all., 1988), аКЛ при СКВ с АФС (P.E.Love, S.A.Santoro, 1990). 1.2. Антигензависимая В–клеточная активация при различных клинических вариантах системной красной волчанки В последние годы внимание исследователей привлечено к изучению роли антител к фосфолипидам (АФЛ) в развитии тромботических нарушений и сосудистой патологии при СКВ (Е.Л.Насонов, А.А.Баранов, Н.П.Шилкина, 27 З.С.Алекберова, 1999; Е.Л.Насонов, 2002; 2004; Т.А.Лисицына, Т.Л.Тихонова, И.Е.Широкова и др.. 2004; E.L.Nasonov, V.Yu.Kovalev, Z.S.Alekberova, S.K.Soloviev, 1992; E.Cucurul, A.E.Gharavi, E.Diri et all., 1999). АФЛ рассматриваются как гетерогенная группа антител, реагирующих с кардиолипином и другими отрицательно заряженными фосфолипидами, обладающими активностью волчаночного антикоагулянта или обуславливаюшими развитие ложноположительной реакции Вассермана (ЛПРВ) (Т.М.Решетняк., З.С.Алекберова., Г.П.Котельникова, 2003; R.A.Asherson, D.Mercey, G.Phillips et all., 1987; D.W.Branch, R.Anders, K.D.Digre, 1989; T.Kavakamei, N.Kuruta, M.Tucuda et all., 1991). Убедительно показано, что продукция АФЛ ассоциируется с развитием достаточно очерченного симптомокомплекса, получившего название «АФС» (Е.Л.Насонов, Алекберова З.С, 1999; Е.Л.Насонов, 2002; 2004; G.R.V.Hughes, 1993; E.N.Harris, S.S.Pirangeli, A.E.Gharavi, 1998; R.Cervera, J.C.Piette, J.Font, et all., 2002) и формирует особый субтип болезни - СКВ с АФС (З.А.Абдукадырова, Р.И.Руденко, А.Р.Вильданова, 2003; А.Е.Дорохов, 2003; L.Carreras, J.Maclouf, G.Tobelen, 1992). АФС-синдром, в основе которого лежит развитие аутоиммунной реакции на широко распространенные фосфолипидные детерминанты, присутствующие на мембранах тромбоцитов, клеток эндотелия сосудов, клеток нервной ткани. Существует несколько классов мембранных фосфолипидов, различающихся по структуре и иммуногенности. Наиболее распространены в организме «нейтральные» фосфолипиды: фосфатидилэтаноламин (ФЭ) и фосфатидилхолин (ФХ). «Отрицательно заряженные» (анионные) фосфолипиды: фосфатидилсерин (ФС) и фосфатидилинозитол (ФИ) локализуются на внутренней поверхности биомембран и экспонируются в процессе клеточной активации. Кардиолипин (КЛ) является «двойным фосфолипидом» (дифосфатидилглицерол) и присутствует, главным образом, на внутренней мембране митохондрий. 28 В научной и клинической практике при исследовании больных АФС в основном имеет место определение антител к кардиолипину (аКЛ) (Л.З.Прудникова, 1990; З.С.Баркаган, А.Е.Доронов, Т.В.Сердюк, 1993; И.В.Травкина, М.М.Иванова, Е.Н.Александрова, Е.Л.Насонов, Е.Б.Вавилов, Е.Л.Насонов, В.Ю.Ковалёв и др., 1995; 1993; A.Arita, F.G.Loper-Longo, F.C.Moreno et all., 1993; A.Selva-O´Callaghan, J.Оrdi-Ros, F.Monegal-Ferran et all., 1998; A.Ticani, G.Balestrieri, F.Allergi et all., 2000). В сыворотке здоровых людей уровень аКЛ низкий, при этом биологические мембраны защищены от воздействия последних. При заболеваниях, связанных с активацией В-лимфоцитов, резко увеличивается концентрация аКЛ. Наиболее часто и в высоком титре аКЛ обнаруживаются в сыворотке крови больных СКВ, реже - при других ревматических заболеваниях (Б.С.Джузенова, Е.Л.Насонов, В.Ю.Ковалев и др., 1992; Е.Л.Насонов, 2004; Z.B.Hrneir, V.Chycova 1990; R.Caporall, A.Ravelli, F.Defennaro et all., 1991; F.Juliane, S.Werner, G.I.Erika, 1991; M.AbyShakra, D.Gladman, M.B.Urowitz, V.Farewell, 1995; A.Escalante, R.L.Brey, B.D.Mitchel et all., 1995; G.D.Sebastiani, M.Galeazzi, A.Tinicani et all., 1999; L.Gomez-Pacheco, A.R.Villa, C.Drencard et all., 1999). Избыточное образование аКЛ выявлено также у больных со злокачественными новообразованиями, сифилисом, аутоиммунной тромбоцитопенической пурпурой, на фоне острых и хронических вирусных и бактериальных инфекций, при ряде заболеваний ЦНС, некоторых формах акушерской патологии, приеме препаратов, вызывающих развитие волчаночноподобного синдрома. Но все же клиническое значение определение аКЛ имеет место только при СКВ с развитием АФС. При этом АФС проявляется наличием в сыворотке крови аКЛ, а также тромбоцитопенией и триадой клинических признаков- повторными венозными и артериальными тромбозами, акушерской патологией в виде спонтанных абортов (привычных выкидышей) и поражением ЦНС (рецидивирующий ишемический инсульт у молодых, мигрень, хорея, эпилептиформные припадки) (О.И.Близнюк, 1990; 29 А.А.Баранов, Е.Л.Насонов, Н.П.Шилкина и др., 1995; Н.Ю.Карпов, А.А.Баранов, Н.П.Шилкина и др., 1999; Е.Н.Понамарева, П.А.Синевич, В.В.Понамарев, А.И.Антоненко, 2002; Б.М.Доронин, И.А.Грибачева, Т.Ф.Попова, 2003; M.A.Khamashta, T.Wallington, 1991; K.R.McCrae, 1996; S.R.Levine, L.Salowich-Palm, K.L.Sawaya et all., 1997). Следует отметить, что в основе акушерской патологии и поражения ЦНС при АФС так же лежит тромбоз сосудов плаценты и мозга. АФС впервые был описан в рамках СКВ. У больных СКВ обнаружен в крови «волчаночный антикоагулянт» (ВА) - популяция антител, относящихся к различным изотипам иммуноглобулинов, специфически реагирующих с фосфолипидным компонентом протромбиназы активаторного комплекса. ВА является антифосфолипидным антителом класса IgM или IgG. In vitro, он мешает образованию активатора протромбина. Известно, что при СКВ может обнаруживаться ЛПРВ (А.Ройт, 1991; Е.Л.Насонов, 2002; 2004). Это обусловлено продукцией антител к фосфолипидам, в первую очередь к кардиолипину (Е.Л.Насонов, 2004; E.N.Harris, 1990; H.P.McNeil, C.N.Chesterman, S.A.Krilis, 1991), являющему основным антигеном реакции Вассермана и входящему в состав комплекса прокоагулянтных фосфолипидов. Данный, относительно новый, иммунологический феномен - появление в крови аКЛ - имеет существенное патогенетическое значение для СКВ, определяя особую специфического форму, особый субтип клинико-иммунологического болезни с развитием симптомокомплекса (З.С.Алекберова, Е.Л.Насонов, Л.З.Стаенович, 1992; J.C.Piette, B.Wechsler, R.Larari et all., 1991; M.Samarkos, K.A.Davles, C.Gordon et all., 2001). При этом при СКВ частота обнаружения аКЛ меньше 50% (Е.Н.Александрова, А.А.Новиков, Т.М.Решетняк и др., 2003; H.J.Out, Ph.G.Groot, P.Hasselaar et all., 1989; K-L.Wong, H-W.Liu, K.Ho et all., 1991), а при СКВ с АФС гораздо чаще- до 90% и выше (Е.Л.Насонов, З.С.Алекберова, Л.А.Калашникова и др., 1998; J.C.Piette, B.Wechsler, R.Larari et all., 1991). 30 Существование кардиолипинзависимой В-активации с появлением аКЛ в сыворотке крови больных СКВ подтверждается сопоставлением следующих данных. Так, обнаружена достоверная связь между развитием тромбоза сосудов и увеличением уровня аКЛ (Я.Забек, И.Войцеховска, Е.Биернака и др., 2004; K.C.Kalinian, V.B.Peter, H.R.Middlekauf et all., 1988; L.R.Samaritano, S.Ng,R.Sobel et all., 1997; P.R.Ames, A.Maargarita, J.Delgado Alves et all., 2002). Установлено, что риск тромбоза значительно возрастал при появлении аКЛ (И.Е.Широкова, Т.А.Лисицына, Л.В.Кондратьева и др., 2004; H.P.McNeil, C.N.Chesterman, S.A.Krilis, 1991) и это не было связано с АНФ, антителами к ДНК (P.Schulze, D.Sima, H.Ziegler et all., 1991; D.Alarcon-Segovia, A.Perez-Ruiz, A.R.Vila, 2000). В некоторых работах не выявлено связи между аКЛ и наличием тромбозов при СКВ (R.H.Derksen, F.Hasselaan, L.Blokzije et all., 1988). Но все же в подавляющем большинстве отечественных и зарубежных работ установлена коррелятивная связь между аКЛ и развитием тромбоза периферических сосудов (А.Е.Ильина, Н.Г.Клюквина, Е.Н.Александрова и др., 2006; C.Neville, J.Rauch, J.Kassis, et all., 2003). Причина связи тромбоза и гиперпродукции аКЛ в настоящее время до конца не ясна, но аКЛ имеют патогенетическое значение, которое может реализоваться на разных уровнях: прямое повреждение эндотелия, антителозависимая эндогенных активация антикоагулянтов тромбоцитов, подавление (тромбомодулин, активности антитромбин III, прекалликреин, простациклин) (C.Mackworth-Yong, 1990). Второй основной клинический признак АФС - акушерская патология, в виде внутриутробной гибели плода, рецидивирующих спонтанных абортов и привычных выкидышей, так же тесно связана с наличием в сыворотке крови аКЛ (С.Н.Байданов, Н.Н.Нутрихина, Л.Г.Ефимова и др., 1993; М.Х.Султанова, Т.С.Солиев, 2003; Ю.В.Ершова, А.А.Баранов, Н.Е.Абайтова и др., 2004; R.M.Lee, W.Emlen, J.R.Scott et all., 1999; M.D.Hornstein, O.K.Davis, J.B.Massey et all., 2000; D.W.Branch, T.F.Porter, L.Rittenhouse et all., 2001). Установлено, что высокие титры аКЛ являются прогностическим 31 признаком высокого риска внутриутробной гибели плода в середине беременности у женщин больных СКВ (T.Oamar, R.A.Levy, L.Sammaritano et all., 1990). M.A.Unander и соавт. [231] исследовали наличие аКЛ у 337 женщин, имевших в анамнезе 3 и более спонтанных аборта: у 33% из них обнаружены аКЛ, что гораздо выше частоты встречаемости аКЛ у здоровых беременных - 8%. Наличие аКЛ в сыворотке крови больных СКВ тесно коррелировало с патологией ЦНС - третьим большим признаком АФС (Л.А.Калашникова, Е.Л.Насонов, А.Е.Кушекбаева и др., 1988; Л.А.Калашникова, Л.А.Добрынина, В.В.Гнездицкий и др., 1999; А.Э.Чориев, О.М.Лесняк, 2003; A.Khaliti, R.C.Cooper, 1991; R.L.Brey, S.R.Levine, 2002). При этом высокие титры аКЛ коррелировали с тяжелым поражением ЦНС (И.В.Травкина. М.М.Иванова, Е.Л.Насонов, Е.Б.Вавилов, 1993; R.A.Asherson, 1988; R.A.Fields, W.L.Sibbit, H.Toubbeh, A.D.Bunkhurst, 1990). M.Magaron и соавт. [183] у 40,7% больных нашли неврологические нарушения, при этом у 77,7% из этой группы больных СКВ обнаружили аКЛ в сыворотке крови иммуноферментным методом. В работе P.E.Love и S.F.Santoro [179], полученной на основании ретроспективного анализа 315 больных СКВ, включенных в исследования различных авторов, имеется достоверная ассоциация между выявлением как ВА, так и аКЛ, и поражением ЦНС при СКВ. Перечень анализируемых неврологических нарушений включал ОНМК (16%), судорожный синдром (17%), психоз (2%), тромбоз артерий сетчатки (1%), преходящую потерю зрения (3%), у 61% больных проявления церебральной симптоматики были неспецифическими. По данным результатов работы Ф.А.Юсупова [89, 90], так же отмечен высокий уровень аКЛ у больных СКВ с поражением нервной системы. Таким образом, аКЛ, являясь лабораторным признаком АФС при СКВ, ассоциировались с тремя главными клиническими признаками АФС. Кроме того, наличие аКЛ сочеталось и другими (малыми) признаками АФС. Так, аКЛ при СКВ сочетались с поражением сосудов кожи по типу сетчатого 32 ливедо (C.Frances, B.Tribout, S.Boisnic et all., 1989; R.A.Asherson, S.C.Mavou, P.Merry et all., 1989; E.Gromnica Ihle , W.Schopler, J.Franz, 1991; D.M.Aronoff, J.P.Callen, 1997), сосудов сетчатки глаз, нередко приводящем к слепоте (Г.А.Максимов, Н.В.Пизова, Н.П.Шилкина, Д.А.Прилепский, 2003; D.Gold, O.A.Morris, P.Henkind, 1972; R.C.Kleiner, I.V.Najarian, S.Schatten et all., 1989; J.Carbone, S.Sanchez-Ramon, R.Cobo-Soriano et all., 2001). Установлено, что эндокардит и поражение клапанов при СКВ встречались чаще у больных с аКЛ, чем у больных без аКЛ (Т.М.Решетняк, Г.П.Котельникова, О.А.Фомичева и др., 2002; P.Nihoyannopoulos, P.M.Gemez, J.Joshi et all., 1990; G.Nesher, J.Ilany, D.Rosenmann, A.S.Abraham, 1997; D.Erkan, M.J.Roman, F.Tenedios, M.D.Lockshin, 2004). А эндокардит с поражением клапанов считается одним из признаков АФС (А.А.Чиркин, А.Н.Окороков, И.И.Гончарик, 1993; E.K.Chartash, D.M.Lans, S.A.Paget et all., 1989; W.H.Leung, K.L.Wong, C.P.Lau et all., 1990; M.A.Khamashta, R.Cervera, R.A.Asherson et all., 1990; M.Hojnik, J.George, L.Ziporen, Y.Shoenfeld, 1996). Своеобразие клинико-иммунологических проявлений болезни у больных СКВ с аКЛ и с развитием АФС позволило выделить эту форму болезни как особый субтип СКВ (О.Б.Несмеянова, Е.А.Сальникова, И.Н.Данилюк и др., 2003; Е.Л.Насонов и др., 2001; 2002; 2004; J.C.Piette, B.Wechsler, R.Larari et all., 1991; E.Gromnica Ihle , M.Schossler, 2000). Так, установлено, что у больных СКВ с АФС реже отмечалось острое течение, более высокая продолжительность болезни, чаще поражение ЦНС и тромбозы периферических сосудов, реже поражение кожи, чаще тромбоцитопения, реже поражения почек, чаще спонтанные аборты у женщин, реже АНФ, реже антитела к ДНК (J.Ishii, K.Magasama, I.Mayumi et all., 1990). Особо подчеркивается то, что наличие АФС ассоциируется с более благоприятным течением болезни, невысокой активностью патологического процесса, невыраженными признаками люпус-нефрита и отсутствием АНФ в крови (Е.Е.Калинина, О.М.Лесняк, 2001; Е.Е.Калинина, И.Е.Валамина, О.М.Лесняк, 2003; Н.Л.Козловская. М.Ю.Швецов, Л.В.Козловская и др., 33 2005; M.E.Peres-Vasguez, J.Cabiedes, A.R.Cabral, D.Alarcon-Segovia, 1992; D.Nochy, E.Daugas, D.Droz et all., 1999). В клинической иммунологии кардиолипинзависимого В-иммунного ответа при СКВ с АФС наименее изучен клеточный субстрат. Между тем его изучение создаст известную полноту в исследовании В-системы иммунитета, позволит уточнить природу активации этого важного эффекторного механизма В-иммунного ответа при СКВ с АФС. Целесообразность изучения клеточной основы кардиолипинзависимой В-активации вытекает из исследований, в которых показаны ДНК - чувствительные рецепторы на Вклетках, а также способность В-лимфоцитов при кратковременном культивировании спонтанно секретировать АНФ, антитела к ДНК и кардиолипину у экспериментальных мышей, предрасположенных к волчаночноподобному синдрому (K.Twai, T.Tsubata, Y.Katsura, 1983). Исследование СПАЛ, СИАЛ и В-клеточного иммунного ответа к кардиолипину имеет большое значение для клинической практики, так как позволит провести более глубокий анализ степени иммунных сдвигов у больных СКВ, разработать на основании полученных данных дополнительные методы диагностики АФС при СКВ, прогнозирования развития тромбозов, оценки активности патологического процесса, тяжести течения и контроля иммунотропной терапии болезни. 34 ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ 2.1. Клиническая характеристика обследованных лиц Нами были обследованы 108 больных. Из них 64 больных СКВ составляли опытную группу, а сравнительную группу обследованных лиц 26 больных РА и 18 больных ОА. В качестве контрольной группы были обследованы 30 практически здоровых лиц. Больные СКВ ревматологическом находились отделении на Ошской стационарном областной лечении в объединенной клинической больницы и были обследованы в первые дни госпитализации до начала терапии. Больные ОА и РА также были обследованы в стационарных условиях, но обследование проводилось однократно. В группу здоровых лиц вошли студенты 4 курса медицинского факультета Ошского Государственного Университета в возрасте 20-25 лет и клинические ординаторы Центра последипломного образования г. Ош, не страдающие хроническими заболеваниями и не получавшие никаких вакцинаций в течение 6 месяцев. 2.1.1. Клиническая характеристика больных СКВ Диагностика СКВ проводилось на основании диагностических критериев Американской ревматологической ассоциации (АРА), а степень активности, особенности развития и характер течения определяли в соответствии с классификацией СКВ, предложенной В.А.Насоновой [64]. Диагноз АФС устанавливали на основании критериев диагностики АФС, предложенных C.R.V. Hughes и соавторами [148]. Общая клиническая характеристика больных СКВ представлена в таблице 2.1. 35 Таблица 2.1. Клиническая характеристика больных СКВ Общее число больных n=64 абс. % Женщины 62 96,9 Мужчины 2 3,1 15-20 14 21,9 21-25 20 31,2 26-30 16 25,0 31-35 9 14,1 36-40 и выше 5 7,8 0-1 18 28,1 1,1-2 10 15,6 2,1-3 12 18,7 3,1-5 7 10,9 5,1-10 и выше 17 26,6 17 26,6 26 40,6 21 32,8 Пол: Возраст, годы: Длительность болезни, годы: Степень активности заболевания: I II III Течение болезни: Острое 20 31,3 Подострое 26 40,6 Хроническое 18 28,1 36 Продолжение табл. 2.1. Серологические данные АНФ + 57 89,1 АНФ - 7 10,9 АФС + 18 28,1 АФС - 46 71,9 аКЛ + 30 46,9 аКЛ - 34 53,1 Наличие АФС Наличие аКЛ Как видно из таблицы 2.1, основную часть больных СКВ составляли женщины – 62 человек (96,9%), а мужчины составляли всего лишь – 3,1% (2 человека). По возрастным особенностям, большинство больных были в возрасте от 15-35 лет (92,2%) т.е. преимущественно девушки и молодые женщины (15-25 лет – 53,1%, 26-35 лет – 39,1%). Больных от 36-40 лет и выше было 5 человек (7,8%). Из таблицы видно, что больные по продолжительности болезни распределялись следующим образом: у 18 больных (28,1%) продолжительность болезни составляла до 1 года, у 22 больных (34,4%) – 1,1 – 3 года, лишь у 7 больных (10,9%) – 3,1 – 5 лет, у 17 больных (26,6%) стаж болезни – 5,1-10 лет и выше. Также из приведенных данных таблицы видно, что у 21 (32,8%) больного СКВ была отмечена высокая (III) степень активности патологического процесса; у 26 (40,6%) умеренная (II) степень активности болезни, а минимальная (I) степень активности выявлена лишь у 17 (26,6 %) больных. По характеру течения патологического процесса острое течение болезни отмечено у 20 (31,3%) больных, подострое у 26 (40,6%), а хроническое течение болезни отмечено у 18 (28,1%) больных. Из 64 обследованных больных СКВ у 57 (89,1%) больных в крови определялся АНФ. При этом титр АНФ у этой же группы больных составил 1:176,8±19,2. В то же время он у 7 (10,9%) больных СКВ 37 отсутствовал. 18 (28,1%) больных СКВ находились под особым контролем, у них были отмечены симптомы АФС. Остальные 46 больных СКВ не имели клинико-лабораторных признаков АФС. У 30 (46,9%) больных СКВ обнаружены аКЛ в сыворотке крови, а у 34 (53,1%) – эти антитела отсутствовали. Таким образом, данные таблицы 2.1 свидетельствуют о том, что основную массу больных СКВ составляли женщины в возрасте 15-35 лет, т.е. девушки и молодые женщины наиболее трудоспособного и детородного возраста. У большинства больных были отмечены умеренная (II) и высокая (III) степени активности болезни, острое и подострое течения болезни, серопозитивная форма болезни и отсутствовали клинико-лабораторные признаки АФС. 2.1.2. Клиническая характеристика больных РА Под нашим наблюдением находились 26 больных РА, в том числе 21 женщин (80,8%) и 5 мужчин (19,2%) в возрасте от 20-45 лет. Для установления диагноза РА мы пользовались диагностическими критериями, предложенными АРА в 1987г. (В.А.Насонова, М.Г. Астапенко, 1989). Общая клиническая характеристика больных РА представлена в таблице 2.2. Таблица.2.2. Клиническая характеристика больных РА Характеристика n=26 абс. % Женщины 21 80,8 Мужчины 5 19,2 Пол: 38 Продолжение табл. 2.2. Возраст, годы: 20-30 8 30,8 30,1-40 15 57,7 40,1-50 и выше 3 11,5 0-2 5 19,2 2,1-5 12 46,2 5,1-10 и выше 9 34,6 Серопозитивная форма 22 84,6 Серонегативня форма 4 15,4 I (минимальная) 5 19,2 II (умеренная) 13 50,0 III (высокая) 8 30,8 МПТ 21 80,8 БПТ 5 19,2 I стадия 8 30,8 II стадия 11 42,3 III стадия 6 23,1 IV стадия 11 3,8 0-I 12 46,2 II 13 50,0 III 1 3,8 Длительность болезни, годы: Клинико-иммунологическая форма: Степень активности заболевания: Характер течения болезни: R0 стадия по Штайн-Брокеру: Степень ФНС: 39 Как видно из таблицы 2.2., что большой процент больных составили женщины - 80,8% (21 человек), мужчины же составили 19,2 % (5 человек). Возраст большинства обследованных больных РА составил 20-40 лет (20,1-30 лет - 30,8%; 30,1-40 лет – 57,7%) – т.е. наиболее трудоспособный возраст. У подавляющего большинства обследованных больных РА длительность болезни составила от 2,1–5 до 10 лет (46,2 и 34,6% соответственно) и лишь у 5 (19,2%) больных – до 2 лет. При определении ревматоидного фактора с помощью метода Ваалера-Роузе, у 22 (84,6%) больных выявлен серопозитивный, а у 4 (15,4%) серонегативный тип РА. Большинство обследованных нами больных имели умеренную (II) и высокую (III) степень активности (13 и 8 человек соответственно; 50,0 и 30,8% соответственно) и лишь у 5 (19,2%) больных наблюдалось минимальная (I) степень активности патологического процесса. Значительное число больных имели медленно прогрессирующее течение болезни – 21 человек (80,8%), а у 5 (19,2%) больных наблюдалось быстропрогрессирующее течение болезни. По изменениям суставов на рентгенологических снимках выявлена следующая картина распределения больных по рентгенологическим стадиям: I стадия – у 8 (30,8%) больных, II стадия- у 11 (42,3%) больных, III стадия – у 6 (23,1%) больных, а IV стадия - лишь у 1 (3,8%) больного. У 12 (46,2%) обследованных лиц определена I степень функциональной недостаточности суставов (ФНС), II степень ФНС выявлена у 13 (50,0%), и только у 1 больного (3,8%) определена III степень ФНС. 2.1.3. Клиническая характеристика больных ОА Нами было обследовано 18 больных ОА, из них женщин было 10 (55,6%) и 8 (44,4%) мужчин. Общая клиническая характеристика больных ОА представлена в таблице 2.3. 40 Таблица 2.3. Клиническая характеристика больных ОА Характеристика n=18 абс. % Женщины 10 55,6 Мужчины 8 44,4 До 30 0 0 30,1-40 1 5,6 40,1-50 4 22,2 50,1- 60 6 33,3 60,1 – 70 и выше 7 38,9 0-5 3 16,7 5,1-10 7 38,9 10,1- 20 и выше 8 44,4 Моноартроз 2 11,1 Олигоартроз 5 27,8 Полиостеоартроз 11 61,1 МПТ 15 83,3 БПТ 3 16,7 I стадия 5 27,8 II стадия 10 55,5 III стадия 3 16,7 Пол: Возраст, годы: Длительность болезни, годы: Клиническая форма: Характер течения болезни: R0 стадия по Келлгрену: 41 Продолжение табл. 2.2. Степень ФНС: 0-I 7 38,9 II 9 50,0 III 2 11,1 Из таблицы 2.3., видно, что у большинства больных ОА средняя продолжительность болезни равнялась от 5 – 10 и выше лет. Наблюдаемые нами больные ОА были в возрасте: до 30 лет – ни одного случая, 30-40 лишь у 1 (5,6%) больного 40-50 лет – у 4 (22,2%) больных, 50-60 – у 6 (33,3%) больных и 60-70 лет и выше – у 7 (38,9%) больных. Значительное число больных ОА имели картину полиостеоартроза – у 11 (61,1%) больных, и всего лишь у 2 (11,1%) больных определялась клиническая картина моноартроза в виде коксо - или гонартроза. Среди наблюдавшихся лиц у большинства больных - 15 (83,3%) болезнь протекала в виде медленно прогрессирующего характера течения, а у 3 (16,7%) больных отмечалось быстро прогрессирующее течение, которое привело в конечном итоге к полной утрате функции суставов. У всех обследованных больных обнаружены по рентгенологическим снимкам характерные изменения в суставах, причем у 72,2 % больных эти изменения были далеко зашедшими: 10 (55,5%) больных имели II и 3 (16,7%) – III рентгенологическую стадию болезни. Также в свою очередь - из всех обследованных лиц у 7 (38,9%) больных наблюдалась I степень ФНС, у 9 (50,0%) – II степень ФНС, и только 2 (11,1%) больных имели тяжелую (III) степень ФНС. 2.2. Методы исследования Для обследования опытной, сравнительной и контрольной групп мы использовали клинические, лабораторные, иммунологические методы исследования. инструментальные и 42 2.2.1. Клинические методы обследования Клиническое обследование больных состояло из сбора жалоб, анамнестических данных, также объективного осмотра с определением антропометрических показателей (рост, вес, ИМТ). 2.2.2. Лабораторные методы исследования Лабораторные тесты включали в себя общий (развернутый) анализ крови и мочи, определения СОЭ, общего белка и белковых фракций, Среактивного белка (трансаминазы) (СРБ), фибриногена, сыворотки, серомукоидов, протромбинового ферментов индекса, времени свертываемости крови, креатинина, мочевины, остаточного азота, подсчет LE-клеток, реакции Вассермана, а также определения АНФ, иммуноглобулинов А, М, G и циркулирющих иммунных комплексов в сыворотке крови (ЦИК). Общее клиническое исследование крови включало в себя: определение числа эритроцитов и содержания в них гемоглобина, определение общего числа лейкоцитов и соотношение отдельных форм среди них, определение числа тромбоцитов. Определение СОЭ проводилось по методу Панченкова. Методом электрофореза определяли общий белок и белковые фракции сыворотки крови. СРБ определен методом кольцепреципитации в капиллярах. Содержание фибриногена определяли методом Бидвелла. Биуретовым методом определяли по белковому компоненту общее содержание серомукоидов. Определение прямого и непрямого билирубина проводили по методу Ендряссика-Грофа. Трансаминазы сыворотки крови (АлАт, АсАт) определяли методом Райтмана-Френкеля. Методом иммунофлюоресценции определяли АНФ. Антитела к кардиолипину (аКЛ) определяли иммуноферментным методом в клинико-диагностической лаборатории Юни- 43 Т-Реактив-Фарма г. Ош. Ig классов А, М, G, определяли методом радиальной иммунодиффузии в геле по Манчини. ЦИК определяли методом преципитации полиэтиленгликолем по V.Haskova в модификации Ю.А. Гриневич, А.Н. Альферова. 2.2.3. Инструментальные методы исследования Для подтверждения проводились следующие заключительного клинического инструментальные методы диагноза исследования: рентгенологические исследование суставов и органов грудной клетки, электро-, эхо- и фонокардиографические исследования сердца, а также ультразвуковое исследование внутренних органов, проводимое на базе УЗИ аппарата «Volison - 550» фирмы Philips SD-100 LG. 2.2.4. Определение спонтанной В–клеточной активации Спонтанную В–клеточную активацию оценивали по уровням спонтанной пролиферативной и спонтанной иммуноглобулинсинтезирующей активности В–лимфоцитов. 2.2.4.1. Определение спонтанной пролиферативной активности Влимфоцитов Лимфоциты выделяли из периферической венозной крови, стабилизированной антикоагулянтом, на градиенте плотности 1,007 г/см3 верографин-фиколл. Градиент готовили следующим образом: одну часть 76% раствора верографина смешивали с четырмя частями раствора фиколла. После тщательного перемешивания смесь была готова к употреблению (для длительного хранения смесь верографин-фиколл помещают в холодильник при 40С). В бактериологическую пробирку наливали 2,5 мл смеси 44 верографин-фиколл (высота столба смеси 2-2,5 см). Пробирку оставляли на столе до тех пор, пока смесь не примет комнатную температуру. Из локтевой вены брали 5 мл крови. Для предотвращения свертывания в кровь при взятии добавляли антикоагулянты: гепарин (20 единиц на 1,0 мл крови) или 0,1 мл 5%-ного раствора этилендиаминтетраацетата натрия (ЭДТА) на 1,0 мл крови. С помощью пастеровской пипетки аккуратно наслаивали цельную стабилизированную антикоагулянтами кровь в объеме 4 мл на градиент, избегая смешивания градиента и крови. Затем центрифугировали при 1500 об/мин в течение 30 минут. При этом эритроциты и гранулоциты оседают на дно пробирки, а на границе раздела градиента и крови находятся мононуклеарные клетки. По всей площади сечения пробирки на границе раздела фаз отсасывали пастеровской пипеткой слой мононуклеаров (плотное облачко над смесью). Клетки, прилипшие к стенке пробирки, собирали кончиком пипетки. Лимфоциты переносили в чистую центрифужную пробирку. Выделенные клетки дважды отмывали от плазмы средой 199 центрифугированием при 1000 об/мин в течение 5 минут. Надосадок отбрасывали, а лимфоциты ресуспендировали раствором питательной среды. Выделенные лимфоциты отмывали еще 1 раз средой 199, путем центрифугирования при 1000 об/мин в течение 5 минут, затем ресуспендировали в 3-4 каплях среды 199, доводя концентрацию клеток до 45х106/мл. Исследование пролиферативной функции лимфоцитов проводили по методике, описанной Е.Г. Цай [84]. Данное исследование проводили в монослойных культурах, созданных на предметных стеклах по способу А.Н. Красюка и др. [39]. Каплю густой свежевыделенной суспензии лимфоцитов наносили на 2 чистых обезжиренных предметных стекла (контроль и опыт), инкубировали во влажной камере при комнатной температуре 3-5 мин. После чего, неприлипшие клетки смывали средой 199. В результате на стекле оставалось четко сформированное пятно клеточного монослоя жизнеспособных клеток. Затем стекла со сформированным монослоем 45 лимфоцитов, не допуская высыхания, сразу же помещали в камеры для культивирования с полной питательной средой (ППС), состоящей из среды 199 с добавлением 10% сыворотки крупного рогатого скота, L-глютамина (300 мг/мл) и гентамицина (0,08 мг/мл). Затем в обе культуры лимфоцитов (контроль и опыт) добавляли В-клеточный митоген - ЛПС 5 мпд/мл производства НИИЭМ им. Н.Ф. Гамалея. После чего камеру с контрольной культурой лимфоцитов немедленно помещали в холодильник при °t 4°C, a камеру с опытной культурой - в термостат при °t 37°C с влажной камерой. Камеры инкубировали 2 часа. Затем стекла вынимали, ополаскивали в среде 199, фиксировали 15 мин 70% раствором этанола. Затем мазки окрашивали 0,001% акридиновым оранжевым (АО) по R.Rigler [209], исключая этап ацетилирования белков. Рабочий раствор АО готовили в день опыта из маточного раствора АО концентрации 1:1000, разводя его цитратным буфером до концентрации 1:100000. Затем препарат промывали 10 минут в чистом цитратном буфере, подсушивали и флюориметрировали методом КЦФ. КЦФ проводили оригинальным методом на базе микроскопа ЛЮМАМ-ИЗ, используя фотометрическую приставку ФМЭЛ-1. Источником возбуждения служила лампа ДРК-120, дающая стабильный разряд, источник устанавливали по варианту освещения сверху, возбуждающий фильтр СС-154, запирающий фильтр ЖС-9. Световыделительная система устанавливалась по темнопольному варианту с темнопольным ОПАК-объективом малой скрещенности увеличения 9x0,20. Для обеспечения максимальной регистрации интенсивности, люминесценция осуществлялась на ФЭУ-39А с базовым напряжением усилительного комплекса 1000-1500 вольт с выдачей результатов на цифровой вольтметр в регистре 2-20 вольт. Цитофлюориметрию лимфоидных клеток, окрашенных АО, осуществляли следующим образом. На произвольный участок препарата при невозбуждающем освещении фокусировали объектив фотометра, в котором был предварительно убран один из микрозондов с целью обеспечения измерения со всей площади объектива. После фокусирования объектива 46 устанавливали положение, соответствующее убранному микрозонду, заменяли светофильтр на возбуждающий и замеряли интенсивность флюоресценции в области 640 нм, выделяя эту область интерференционным светофильтром, встроенным в фотометр. После регистрации результата поворотом диска заменяли интерференционный фильтр на другой и замеряли флюоресценцию в области 530 нм. Вся процедура непосредственных измерений занимает 20-30 секунд, что практически устраняет эффект фотодеструкции АО. Полученные результаты выражали отношением флюоресценции (Ф) комплекса АО с РНК (640 нм) к комплексу АО с ДНК (530 нм). Данное соотношение (Ф640/Ф530) известно как параметр А, отражающий степень активности ядерного хроматина клеток. Таким образом, определяли соотношение РНК/ДНК ядерного хроматина, которое закономерно изменяется в ходе активизации лимфоцитов. Сравнивая уровень параметра А в контроле и опыте, выводили показатель спонтанной пролиферативной активности В-лимфоцитов (СПАЛ) по формуле: СПАЛ=(А опыт : А контроль) х 100 усл. ед. 2.2.4.2. Определение спонтанной иммуноглобулинсинтезирующей активности В-лимфоцитов Определение спонтанной иммуноглобулинсинтезирующей активности В-лимфоцитов (СИАЛ) проводили следующим образом. Периферические лимфоциты выделяли, как описано выше (раздел 2.2.4.1). Собранные с интерфазы лимфоциты 1 раз отмывали средой 199, путем центрифугирования при 1000 об/мин в течение 5 минут. Надосадок отбрасывали, а мононуклеары ресуспендировали 1,0 мл среды 199. По 0,5 мл суспензии лимфоцитов вносили в 2 (две) центрифужные пробирки (контроль и опыт) с ППС, состав которой описан выше. Контроль немедленно помещали в холодильник при °t 4°C, a опыт - в термостат при °t 37°C с влажной камерой. Пробы 47 инкубировали 18 часов в герметически закупоренных центрифужных пробирках. После инкубации пробы центрифугировали при 1000 об/мин в течение 5 минут, надосадок отбрасывали, а лимфоциты ресуспендировали 2 каплями среды 199. После чего получали монослой лимфоцитов по методу А.И. Красюка [39], как описано выше. Сразу после получения монослоя его фиксировали 4% раствором формальдегида в течение 10 минут. После фиксации препарат промывали средой 199, подсушивали и окрашивали люминесцирующей конъюгированной сывороткой с против глобулинов флюоресцеинизотиоционатом человека, (ФИТЦ-сыворотка) производства НИИЭМ им. Н.Ф. Гамалея. После окрашивания и тщательного отмывания от несвязавшихся белков и ФИТЦ стекла подсушивали и проводили КЦФ по способу Е.В. Бененсона, Е.Г. Цай [13] на базе микроскопа ЛЮМАМ-ИЗ, используя фотометрическую приставку ФМЭЛ-1. Источником возбуждающего излучения служила лампа ДРК-120, дающая стабильный разряд. Источник устанавливали по варианту освещения сверху. Световыделительная система устанавливалась по темнопольному варианту с темнопольным ОПАК-объективом малого увеличения 9×0,20 для обеспечения максимальной «скрещенности». Регистрация интенсивности люминесценции осуществлялась на ФЭУ-39А с базовым напряжением усилительного комплекса 1000-1500 вольт с выдачей результата на цифровой вольтметр в регистре 2-20 вольт. Линейность зависимости фототока от интенсивности люминесценции в данном диапазоне измерений и стабильности разряда источника излучения контролировались измерениями флюоресценции эталонных урановых стекол с толщиной 2,3 мм, при этом величина отношения интенсивности флюоресценции этих эталонов в области 530 нм оставалась постоянной изо дня в день. Измерение иммуноглобулинсинтезирующей функции лимфоцитов проводили в области 530 нм с площади участка препарата. Помимо суммарной флюоресценции на том же участке препарата измеряли суммарное светорассеивание, используя для этого комбинацию не 48 возбуждающих флюоресценцию светофильтров МС-1 и НС-10. Светорассеивание при выбранных условиях измерений линейно отражает клеточную плотность монослоя, поэтому отношение суммарной флюоресценции к светорассеиванию есть средняя флюоресценция на плоскости монослоя, или величина, отражающая уровень иммуноглобулинов на одну клетку в изучаемой лимфоидной популяции. Учитывая, что сила разряда лампы источника не является строго постоянной величиной и, следовательно, интенсивность флюоресценции может меняться от серии опытов к серии, вводили поправку к величине суммарной флюоресценции, измеряя в каждой серии определений флюоресценции эталонного уранового стекла толщиной 2,3 мм - Фэ. Отсюда среднюю флюоресценцию (Ф) плотности монослоя вычисляли по соотношению: Ф=Ф : С×Фэ. Данное соотношение отражает среднее количество внутриклеточных иммуноглобулинов, связанных с лимфоидной клеткой. Затем, сравнивая уровни иммуноглобулинов в опыте и контроле, выводили показатель СИАЛ по формуле: СИАЛ= (Фопыт : Фконтроль)×100 усл. ед. 2.2.5. Определение антигензависимой В-клеточной активации При определении антигензависимой В-клеточной активации (по уровню кардиолипинзависимой активации В-лимфоцитов) выделение лимфоцитов проводили, как описано выше (раздел 2.2.4.). Затем по 0,5 мл суспензии лимфоцитов вносили в две центрифужные пробирки (контроль и опыт) со средами следующего состава: • Опыт - ППС с добавлением 0,1 мл антигена. В качестве антигена мы использовали кардиолипин кардиолипиновый Харьковского для (из реакции предприятия по комплекта диагностикума микропреципитации» выпуску Кардиолипин использовали в разведении 1:50. бактерийных «Антиген производства препаратов). 49 • Контроль - ППС с добавлением 0,1 мл физиологического раствора. Обе пробы (контроль и опыт) немедленно помещали в термостат при °t 37°C с влажной камерой. Пробы инкубировали 18 часов в герметически закупоренных центрифужных пробирках. После чего с помощью метода КЦФ проводили определение иммуноглобулинсинтезирующей активности Влимфоцитов, как описано в разделе 2.2.4.2. Затем, сравнивая уровень иммуноглобулинсинтезирующей активности В-лимфоцитов в опыте и контроле, выводили показатель кардиолипинзависимой активации В– лимфоцитов (КЗАЛ) по формуле: КЗАЛ = (Фопыт : Фконтроль)×100 усл.ед. 2. 6. Статистический анализ результатов Статистическая обработка полученных результатов проводилась на персональном компьютере по специальным программам с вычислением средней арифметической (М), среднеквадратического отклонения (δ), средней ошибки средней арифметической (m), коэффициента достоверности (t), показателя вероятности (Р), коэффициента корреляции (r). 50 ГЛАВА 3 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Клинико-лабораторные особенности течения различных клинических вариантов СКВ В ходе исследования нами уделено особое внимание выявлению клинических особенностей СКВ, а также острого, подострого и хронического течения СКВ. Кроме того, еще изучены клинические особенности течения СКВ с АФС. 3.1.1. Клинико-лабораторные особенности острого, подострого и хронического течения СКВ В таблице 3.1 приведены основные клинические и лабораторные признаки больных СКВ с острым, подострым и хроническим течениями болезни. Таблица 3.1. Основные клинико-лабораторные показатели у больных СКВ Показатели Острое Подострое Хроническ. Общая течение течение течение группа n=20 n=26 n=18 n=64 абс % абс % абс % абс % «Бабочка» 20 100,0 23 88,6 7 38,9 50 78,1 Полиартрит 18 90,0 24 92,3 17 94,4 59 92,2 Лихорадка 20 100,0 22 84,6 7 38,9 49 76,6 Алопеция 19 95,0 16 61,5 5 27,8 40 62,5 Похудание 19 95,0 14 53,8 4 22,2 37 57,8 Полисерозит 17 85,0 7 26,9 0 0 24 37,5 51 Продолжение табл. 3.1. 5,6 8 12,5 Фотосенсибилизация 5 25,0 2 7,7 1 Афтозный стоматит 5 25,0 3 11,5 1 5,6 9 14,1 Лимфоаденопатия 16 80,0 17 65,1 1 5,6 34 53,1 Люпус-нефрит 20 100,0 11 42,3 1 5,6 32 50,0 Люпус-кардит 9 45,0 7 26,9 - - 16 25,0 Пневмонит 7 35,0 6 23,1 1 5,6 14 21,9 Нейролюпус 6 30,0 7 26,9 6 33,3 19 29,7 Анемия 17 85,0 19 73,1 7 38,9 43 67,2 Лейкопения 12 60,0 10 38,5 2 11,1 24 37,5 LE- клетки 17 85,0 18 69,2 3 16,7 38 59,4 АНФ 20 100,0 24 92,3 13 72,2 57 89,1 АФС - - 3 11,5 15 83,3 18 28,1 аКЛ 1 5,0 14 53,8 15 83,3 30 46,9 Из обследованных 64 больных СКВ у 50 (78,1%) больных обнаружен симптом «бабочка» (табл. 3.1). При этом этот симптом встречался у всех 20 (100,0%) больных СКВ с острым, у 23 (88,6%) больных СКВ с подострым и лишь у 7 (38,9%) больных СКВ с хроническим течениями болезни. Полиартрит диагностирован у 59 (92,2%) больных СКВ. В это же время он обнаружен у 18 (90,0%) больных с острым, у 24 (92,3%) больных с подострым и у 17 (94,4%) больных с хроническим течениями СКВ. Лихорадка отмечена у 49 (76,6%) больных СКВ. При этом она отмечена у всех 20 (100,0%) больных СКВ с острым, у 22 (84,6%) больных СКВ с подострым и лишь у 7 (38,9%) больных СКВ с хроническим течениями болезни. Алопеция выявлена у 40 (62,5%) больных СКВ. При этом она выявлена у 19 (95,0%) больных СКВ с острым, у 16 (61,5%) больных СКВ с подострым и лишь у 5 (27,8%) больных СКВ с хроническим течениями болезни. Похудание было характерно для 37 (57,8%) больных СКВ. При этом оно обнаружено у 19 (95,0%) больных СКВ с острым, у 14 (53,8%) больных 52 СКВ с подострым и лишь у 4 (22,2%) больных СКВ с хроническим течениями болезни. Полисерозит был диагностирован у 24 (37,5%) больных СКВ. При этом он диагностирован у 17 (85,0%) больных СКВ с острым, лишь у 7 (26,9%) больных СКВ с подострым течениями болезни и он отсутствовал у больных СКВ с хроническим течением. Фотосенсибилизация выявлена лишь у 8 (12,5%) больных СКВ. При этом она выявлена у 5 (25,0%) больных СКВ с острым, у 2 (7,7%) больных СКВ с подострым и всего лишь у 1 (5,6%) больного СКВ с хроническим течениями патологического процесса. Афтозный стоматит также определен лишь у 9 (14,1%) больных СКВ. Он встречался у 5 (25,0%) больных СКВ с острым, лишь у 3 (11,5%) больных СКВ с подострым и всего лишь у 1 (5,6%) больного СКВ с хроническим течениями болезни. Лимфоаденопатия была обнаружена у 34 (53,1%) больных СКВ. При этом она обнаружена у 16 (80,0%) больных СКВ с острым, у 17 (65,1%) больных СКВ с подострым и лишь у 1 (5,6%) больного СКВ с хроническим течениями болезни. Люпус-нефрит был диагностирован у 32 (50,0%) больных СКВ. При этом данный симптом обнаружен у всех 20 (100,0%) больных СКВ с острым, у 11 (42,3%) больных СКВ с подострым и всего лишь у 1 (5,6%) больного СКВ с хроническим течениями болезни. Люпус-кардит диагностирован у 16 (25,0%) больных СКВ. При этом он диагностирован у 9 (45,0%) больных СКВ с острым, лишь у 7 (26,9%) больных СКВ с подострым течениями болезни, но он не определялся среди больных СКВ с хроническим течением. Пневмонит был обнаружен у 14 (21,9%) больных СКВ. При этом он встречался только у 7 (35,0%) больных СКВ с острым, лишь у 6 (23,1%) больных СКВ с подострым и всего лишь у 1 (5,6%) больного СКВ с хроническим течениями болезни. Нейролюпус выявлен лишь у 19 (29,7%) больных СКВ. При этом он выявлен у 6 (30,0%) больных СКВ с острым, у 7 (26,9%) больных СКВ с подострым и у 6 (33,3%) больных СКВ с хроническим течениями болезни. Анемия была диагностирована у 43 (67,2%) больных СКВ. При этом она диагностирована у 17 (85,0%) больных СКВ с острым, у 7 (73,1%) больных СКВ с подострым и 53 всего лишь у 7 (38,9%) больных СКВ с хроническим течениями болезни. Лейкопения обнаружена у 38 (59,4%) больных СКВ. При этом она обнаружена у 12 (60,0%) больных СКВ с острым, у 10 (38,5%) больных СКВ с подострым и всего лишь у 2 (11,1%) больных СКВ с хроническим течениями болезни. LE–клетки выявлены у 38 (59,4%) больных СКВ. При этом данный лабораторный феномен выявлен у 17 (85,0%) больных СКВ с острым, у 18 (69,2%) больных СКВ с подострым и лишь у 3 (16,7%) больных СКВ с хроническим течениями болезни. АНФ был обнаружен у 57 (89,1%) больных СКВ. В то же время этот феномен определен у всех 20 (100,0%) больных СКВ с острым, у 24 (92,3%) больных СКВ с подострым и лишь у 13 (72,2%) больных СКВ с хроническим течениями болезни. Такой клиниколабораторный синдром как АФС обнаружен лишь у 18 (28,1%) больных СКВ. В то же время данный синдром отсутствовал у всех больных СКВ с острым, а встречался лишь у 3 (11,5%) больных СКВ с подострым и у 15 (83,3%) больных СКВ с хроническим течениями болезни. Лабораторный феномен - аКЛ был обнаружен у 30 (46,9%) больных СКВ. При этом данный феномен обнаружен у 15 (83,3%) больных СКВ с хроническим, у 14 (53,8%) больных СКВ с подострым и всего лишь у 1 (5,0%) больного СКВ с острым течениями патологического процесса. Как следует из таблицы 3.1, у больных СКВ находившихся под нашим наблюдением, наиболее часто отмечены следующие клинико-лабораторные признаки: полиартрит в 92,2%, «бабочка» в 78,1%, лихорадка в 76,6%, алопеция в 62,5%, анемия в 67,2% и АНФ в 89,1% случаях. Острое течение обследованных больных СКВ клинически проявлялось лихорадкой гектического типа, эритематозным высыпанием на лице по типу «бабочки», острым полиартритом, полисерозитом экссудативного характера и развитием тяжелых висцеральных поражений в виде люпус-нефрита, кардита и нейролюпуса. Подострое течение обследованных больных клинически проявлялось лихорадкой фебрильного типа, появлением на коже неспецифической 54 эритемы, рецидивирующим артритом, полисерозитом по типу сухого плеврита и перикардита, висцеральными поражениями в виде миокардита, пневмонита, гломерулонефрита и нейролюпусом в виде энцефалита. Хроническое течение обследованных больных СКВ клинически характеризовалось симптомом дискоидной волчанки, субфебрилитетом в течении длительного времени, полиартралгией, синдромом Рейно, постепенным развитием в течении долгих лет висцеральных поражений, но редким развитием тяжелых нарушений со стороны сердца, почек и центральной нервной системы. Кроме этого определено то, что у большинства больных СКВ с хроническими течением обнаружены клиниколабораторные признаки АФС. 3.1.2. Клинические особенности течения СКВ с АФС В таблице 3.2 приведены общая характеристика больных СКВ с АФС в сравнении с СКВ без АФС. Таблица 3.2. Общая характеристика больных СКВ с АФС и СКВ без АФС. Общее число СКВ с АФС СКВ без АФС n = 18 n = 46 абс. % абс. % Женщины 18 100,0 44 95,7 Мужчины 0 0 2 4,3 15- 25 0 0 21 45,6 26- 35 6 33,3 19 41,3 36- 40 и выше 10 55,6 6 13,1 Свыше 40 лет 2 11,1 - - Пол: Возраст, годы: 55 Продолжение табл. 3.2. Активность болезни: I ст. активности 15 83,3 II ст. активности 3 16,7 III ст. активности 0 0 Хроническое 15 83,3 3 6,5 Подострое 3 16,7 23 50,0 Острое - - 20 43,5 Есть - - 32 69,6 Нет 18 100,0 12 30,4 Есть 10 55,6 9 19,6 Нет 8 44,4 37 80,4 Есть 1 5,6 15 32,6 Нет 17 94,4 31 67,4 АНФ + 6 33,3 44 95,7 АНФ - 12 66,7 2 4,3 аКЛ + 15 83,3 15 32,6 аКЛ - 3 16,7 31 67,4 2 23 21 4,3 50,0 45,7 Течение болезни: Люпус- нефрит: Поражение ЦНС: Люпус-кардит: Как видно из таблицы 3.2, весь контингент больных СКВ с АФС составляли женщины - 18 (100,0%) человек. Ни один случай заболевания среди мужчин не обнаруживался. По сравнению с группой больных СКВ без АФС, больные СКВ с АФС были, в основном, в возрасте старше 26-36 лет и не было больных до 25 лет. Из таблицы 3.2 видно, что 15 (83,3%) больных СКВ с АФС имели I степень, 3 (16,7%) больных – II степень активности патологического 56 процесса. У больных с III степенью активности не обнаруживались признаки АФС. У значительного числа наблюдавшихся больных СКВ с АФС, а именно у 15 (83,3%) больных отмечено хроническое течение. В то же время клиниколабораторные проявления АФС обнаружены лишь у 3 (16,7%) больных СКВ с подострым течением болезни и ни в одном случае у больных СКВ с острым течением. Клиническая картина люпус-нефрита не встречалась ни в одном случае у больных СКВ с АФС. Поражение ЦНС отмечалось у 10 (55,6%) больных, а признаки люпус-кардита обнаруживались лишь у 1 (5,6%) больного. Такой иммунологический феномен, как - АНФ определялся у 6 (33,3%) больных СКВ с АФС. Особо следует отметить то, что аКЛ в сыворотке крови обнаружены у 15 (83,3%) больных СКВ с АФС, а этот лабораторный феномен отсутствовал у 3 (16,7%) больных СКВ с АФС. Как видно из таблицы 3.2, больные СКВ без АФС по возрастным категориям, в отличие от больных СКВ с АФС, были в основном в возрасте от 15 до 30 лет (65,2%). Из таблицы 3.2 видно, что противоположно больным СКВ с АФС у большинства больных СКВ без АФС, а именно у 21 (45,7%) больного отмечалась III степень активности болезни. В то же время у 23 (50,0%) больных отмечена II степень и лишь у 2 (4,7%) больных - I степень активности патологического процесса. Также следует отметить то, что значительное количество больных СКВ без АФС, а именно 20 (43,5%) больных имели острое, 23 (50,0%) больных – подострое и лишь 3 (6,5%) больных - хроническое течение болезни. Из наблюдавшихся 46 больных СКВ без АФС, у 32 (69,6%) больных обнаруживались признаки люпус-нефрита. Поражение ЦНС отмечалось лишь у 9 (19,6%) больных, а признаки люпускардита обнаруживались у 15 (32,6) больных СКВ без АФС. АНФ был определен у 44 (95,7%) больных и отсутствовал лишь у 2 (4,3%) больных СКВ без АФС. В свою очередь аКЛ в крови обнаружены лишь у 15 (32,6%) больных СКВ без АФС, в то же время аКЛ отсутствовали у 31 (67,4%) больных СКВ без АФС. 57 Основные клинико-лабораторные признаки АФС у больных СКВ с АФС представлены в таблице 3.3. Таблица 3.3. Основные клинико-лабораторные показатели АФС у больных СКВ с АФС Больные СКВ с АФС Показатели АФС n=18 абс. % 12 66,7 - глубокие вены нижних конечностей 7 38,9 - подкожные вены 3 16,7 - вены сетчатки глаз 1 5,6 - печеночные вены (синдром Бадда-Киари) 1 5,6 3 16,7 - мозговые артерии 2 11,1 - коронарные артерии 1 5,6 3) Сетчатое ливедо: 5 27,8 4) Акушерская патология: 6 33,3 - Спонтанные аборты 5 27,8 - Преэклампсия 2 5,6 5) Поражение ЦНС: 5 27,8 - ОНМК (ишемические инсульты) 4 22,2 - Менингоэнцефалопатия 1 5,6 6) Тромбоцитопения 6 33,3 7) Антитела к кардиолипину 15 83,3 1) Венозные тромбозы: 2) Артериальные тромбозы: Из таблицы 3.3 видно, что основные клинико-лабораторные проявления АФС у больных СКВ с АФС распределялись следующим образом. Венозные тромбозы обнаружены у 12 (66,7%) больных, при этом у 7 (38,9%) больных СКВ с АФС обнаружены тромбозы глубоких вен нижних конечностей, у 3 (16,7%) больных тромбозы подкожных вен и всего лишь по 58 1 (5,6%) больному имели признаки тромбоза венозных сосудов сетчатки глаз и печени. Артериальный тромбоз встречался у 3 (16,7%) больных СКВ с АФС. При этом у 2 (11,1%) больных обнаруживался тромбоз мозговых, а у 1 (5,6%) больного - коронарных артерий. Сетчатое ливедо диагностировано у 5 (27,8%) больных СКВ с АФС. У 6 (33,3%) больных СКВ с АФС обнаружена акушерская патология. Она встречалась у 5 (27,8%) больных в виде спонтанных абортов, а лишь у 1 (5,6%) больного в виде преэклампсии. Поражение ЦНС обнаружилось у 5 (27,8%) больных. При этом оно протекало у 4 (22,2%) больных в виде ишемических инсультов, а лишь у 1 (5,6%) больного в виде менингоэнцефалопатии. Тромбоцитопения определена у 6 (33,3%) больных СКВ с АФС. Особо следует отметить то, что у большинства больных СКВ с АФС, т.е. у 15 (83,3%) больных в сыворотке крови определены антитела к кардиолипину. 3.2. Спонтанная В-клеточная активация при СКВ Спонтанную В-клеточную активацию определяли по уровням СПАЛ и СИАЛ с помощью метода КЦФ. СПАЛ оценивали путем количественного изучения степени активности ядерного хроматина лимфоидных клеток. СИАЛ оценивали по уровню иммуноглобулинсинтезирующей функции Влимфоцитов. 3.2.1. Спонтанная пролиферативная активность В-лимфоцитов в обследованных группах Нами было впервые проведено исследование СПАЛ, для этого, в первую очередь, мы изучали уровень СПАЛ у здоровых лиц. Установив среднее значение СПАЛ в группе здоровых лиц, мы вычисляли нормальные показатели СПАЛ. Для чего находили максимальное значение доверительного интервала (d max) по формуле: d max=M±δ, где δ – средняя 59 арифметическая ошибка. В результате этого за положительный результат принимали значение СПАЛ, равное 125 усл. ед. и более. Уровень СПАЛ у здоровых лиц, больных ОА, РА и СКВ приведены в рисунке 3.1. M 170 158,2 150 Больные СКВ -90,6% Здоровые лица -10% 136,3 130 115,6 118,4 Больные ОА -27,7% 110 Здоровые лица Больные ОА Больные РА Больные СКВ Больные РА -80,8% Рис. 3.1. Уровни и частота положительных результатов СПАЛ в обследованных группах. У находившихся под нашим наблюдением больных ОА, РА и СКВ уровень СПАЛ был значительно выше, чем у здоровых лиц. Как видно из рисунка 3.1, показатель СПАЛ у здоровых лиц и у больных ОА ниже, чем у больных РА и СКВ. При этом минимальное значение СПАЛ найдено у здоровых лиц и у больных ОА, среднее значение выявлено у больных РА, а максимальное значение вышеуказанного показателя наблюдалось у больных СКВ. Из приведенных данных рисунка 3.1 видно, что уровень СПАЛ у больных СКВ был достоверно выше, чем у здоровых лиц (t=13,7; p<0,001), больных ОА (t1=11,33; р1<0,001) и больных РА (t2=6,1; р2 <0,001). При этом в группе больных РА данный показатель также достоверно превышал (t=6,8; p<0,001) нормативный показатель, а у больных ОА показатель СПАЛ статистически не достоверно превышал норму (t=0,9; p>0,05). В итоге частота положительных результатов СПАЛ составила у 90,6% больных СКВ, 80,8% - РА, лишь 27,7% - ОА, и всего лишь 10% здоровых лиц. Таким наблюдением, образом, уровень у больных СПАЛ был СКВ, находившихся, достоверно выше, под нашим чем у лиц 60 сравнительной группы. Отсюда следует отметить то, что обнаружение максимального уровня СПАЛ у больных СКВ лишний раз свидетельствовало о высокой степени активности иммунного ответа при этой болезни. 3.2.1.1. Спонтанная пролиферативная активность В-лимфоцитов при различных клинических вариантах СКВ У больных СКВ с I (минимальной) степенью активности показатель СПАЛ достоверно превышал нормальные показатели (t=6,02; р<0,001), а также значение СПАЛ у больных ОА (t=4,77; р<0,01) и больных РА (t=0,27; р>0,05), но последнее не достоверно (табл. 3.4). При этом у 76,5% больных СКВ с I степенью активности уровень СПАЛ был выше нормы, т.е. даже при минимальной активности СКВ положительный результат определялся у подавляющего большинства больных. У больных СКВ со II (умеренной) степенью активности уровень СПАЛ был также достоверно выше, чем у здоровых лиц (t=11,11; р<0,001) и больных СКВ с I степенью активности (t3=4,65; р3<0,05). Уровень СПАЛ выше нормы был обнаружен у 26 (92,3%) больных со II степенью активности патологического процесса, что гораздо выше, чем у больных с I степенью активности (76,5%). Уровень СПАЛ у больных с III ( максимальной ) степенью активности СКВ был достоверно выше не только по сравнению со здоровыми лицами (t=13,93; р<0,001), но и в сравнении с больными I степенью активности болезни (t5=7,19; р5<0,001). Аналогичные результаты отмечены и по частоте обнаружения положительного результата. У больных с III степенью активности значение СПАЛ выше нормы обнаружено у 100% против 76,5 % у больных с I степенью активности. Следует также отметить то, что показатель СПАЛ у больных с III степенью активности был достоверно выше, чем у больных со II степенью активности (t4=2,50; р4<0,01). При этом та же тенденция обнаружена по количеству повышенного результата: 100% у 61 больных СКВ с III степенью активности, против 92,3% больных СКВ со II степенью активности патологического процесса. Таблица 3.4. Уровень и частота обнаружения СПАЛ при различных клинических вариантах СКВ. Обследованные подгруппы больных n М±m в усл. ед Здоровые лица I ст. активности II ст. активности III ст. активности Острое течение Подост. течение Хрон. течение АНФ + АНФ – АФС + АФС – 30 17 26 21 20 26 18 57 7 18 46 115,6±1,73 137,4±3,19*** 159,7±3,58*** 172,6±3,71*** 174,3±3,46*** 160,4±3,34*** 136,5±3,16*** 161,8±2,49*** 129,3±4,58** 136,5±3,16*** 166,4±2,52*** СПАЛ Частота положительных результатов абс. % 3 10,0 13 76,5 24 92,3 21 100,0 20 100,0 25 96,1 13 72,2 54 94,7 4 57,1 13 72,2 45 97,8 t, p t3=4,65; p3<0,001 t4=2,50; р4<0,01 t5=7,19; p5<0,001 t6=2,89; p6<0,01 t7=5,2; p7<0,001 t8=8,07; p8<0,001 t9=6,23; р9<0,001 t10=7,4; р10<0,001 Примечания: -* - достоверно, по сравнению со здоровыми (*- р<0,05; ** - р<0,01; *** - р<0,001 ); -t3 и р3 - разница между показателями при I и II ст. активности у больных СКВ; -t4 и р4 - разница между показателями при II и III ст. активности у больных СКВ; -t5 и р5 - разница между показателями при I и III ст. активности у больных СКВ; -t6 и р6 – разница между показателями острого и подострого течения у больных СКВ; -t7 и р7 – разница между показателями острого и хронического течения у больных СКВ; -t8 и р8 – разница между показателями подострого и хронического течения у больных СКВ; -t9 и р9 – разница между показателями АНФ (+) и АНФ (-) у больных СКВ; -t10 и р10 - разница между показателями АНФ (+) и АНФ (-) у больных СКВ Из приведенных данных из таблицы 3.4 видно, что у больных СКВ с острым течением уровень СПАЛ значительно превосходил показатели не только здоровых лиц (t=15,20; р<0,001), но и больных СКВ с подострым и хроническим течениями болезни (t6=2,89; р6<0,001 и t8=8,07; р8<0,001). При этом повышенный уровень СПАЛ обнаружен у всех 20 (100%) больных СКВ с острым течением. Значение исследуемого показателя у больных СКВ с 62 подострым течением также было достоверно выше по сравнению со здоровыми лицами (t=11,91; р<0,001), как и с больными с хроническим течением (t7=5,2; р7<0,001). Процент больных СКВ с подострым течением составил 96,1%. В свою очередь у больных СКВ с хроническим течением уровень СПАЛ был достоверно выше, чем у здоровых доноров (t=5,8; р<0,001). По частоте обнаружения положительного результата больные СКВ с хроническим течением составляли 72,2%. У 57 больных СКВ с серопозитивной формой уровень СПАЛ был гораздо выше, чем у здоровых лиц (t=15,24; р<0,001), но и чем у 7 больных с серонегативной формой СКВ (t9=6,23; р9<0,001). При этом процент больных с повышенным уровнем СПАЛ составил 94,7%. Также отмечалось повышение уровня СПАЛ у больных СКВ с серонегативной формой болезни по сравнению со здоровыми лицами (t=2,80; р<0,01). При этом повышенный уровень СПАЛ обнаружен у 57,1 % больных. Из 18 находившихся под нашим наблюдением больных СКВ с клинико-лабораторными признаками АФС 13 (72,2%) имели повышенный уровень СПАЛ. Причем уровень СПАЛ был достоверно выше, чем у здоровых доноров (t=5,8; р<0,001). В свою очередь, показатель СПАЛ у больных СКВ без АФС был достоверно выше не только по сравнению со здоровыми лицами (t=16,65; р<0,001), но и с больными СКВ с клинико-лабораторными проявлениями АФС (t10=7,4; р10<0,001). При этом процент больных с повышенным уровнем СПАЛ составил 97,8%. Для подтверждения клинического значения СПАЛ при СКВ приводим следующие клинические примеры: Клинический пример 1. Больная З., 21 лет, история болезни №1012. Клинический диагноз: СКВ, острое течение, III степени активности. Дерматит («бабочка»). Полиартрит. Синдром Рейно. Пневмонит. Миокардит. Полисерозит (плеврит, перикардит). Люпус-нефрит с нефротическим синдромом и артериальной 63 гипертензией. Гепатоспленомегалия. Анемия. Лимфоаденопатия. Алопеция. Афтозный стоматит. Лихорадка. Жалобы на эритематозные высыпания на лице по типу «бабочки», лихорадку до 39,2ºС, боли во всех суставах, посинение и похолодание пальцев кистей рук и стоп, сильные головные боли, отеки на лице и на нижних конечностях, нарастающую слабость, одышку и сердцебиение при малейшей физической нагрузке, боли в грудной клетке, чувство тяжести в обоих подреберьях, выпадение волос, утомляемость, сухость во рту с появлением болезненных язвочек, похудание на 6 кг. Из анамнеза: болеет в течение 2-х лет. Дебют болезни связывает с переохлаждением организма (перенесла тяжелую форму вирусной инфекции). Появилась эритема на лице («бабочка»), боли и припухлости мелких суставов кистей рук, постоянная лихорадка до 38ºС. Постепенно присоединились боли в грудной клетке, одышка и сердцебиение, кашлевой синдром, трофические расстройства. Был выставлен диагноз СКВ. С момента постановки диагноза принимает поддерживающие дозы преднизолона в дозе 10-15 мг/сутки, но без особых признаков ремиссии. Неоднократно получала стационарное лечение в условиях ревматологического отделения НЦКиТ в г. Бишкек. Последнее время присоединились отеки на лице, синдром артериальной гипертензии. Объективно: общее состояние тяжелое, бледность кожи и видимых слизистых. Отеки лица и ног. Подмышечные, подчелюстные и паховые лимфоузлы увеличены. Припухлость в области мелких суставов кистей рук и стоп. В легких дыхание ослаблено в нижних отделах, единичные хрипы, ЧД 33 в мин. Сердечные тоны глухие, ритмичные. Границы сердца расширены. ЧСС -108 в мин. АД -160/100 мм.рт.ст. Печень и селезенка увеличены. Лабораторно-инструментально: Развернутый анализ крови: 12 гемоглобин-79г/л, эритроциты-2,94х10 /л, ЦП-0,6, лейкоциты-3,8х109/л, тромбоциты-193,1х109/л, СОЭ-65 мм/ч; общий белок-54 г/л, альбумины-35%, глобулины-65%: ά1ά2-18%, β-14%, γ-33%; Ревмотесты: Ваалера-Роузе-1:64, АСК-1:150, АСЛ-О-1:250, СРБ+++, серомукоид-0,45 ед, гаптоглобин - 2,4 г/л, РФ-(+), LE-клетки-15:1000, АНФ-1:256; Анализ мочи: удельный вес-1012, белок-7,2 г/л, эритроциты-15-18 в поле зрения, цилиндры - 5-6 в поле зрения. ЭКГ - синусовая тахикардия, диффузные изменения миокарда, отклонение ЭОС влево; доплерография сосудов нижних конечностей: значительные снижения интенсивности периферического кровообращения; рентгенограмма легких: наличие жидкости в плевральной полости; ЭхоКГ: увеличение полостей сердца, снижение фракции выброса, наличие жидкости в полости перикарда; УЗИ органов брюшной полости: увеличение размеров печени и селезенки; СПАЛ-183 усл.ед. На данном клиническом примере можно утверждать, что высокий уровень СПАЛ характерен для острого течения и высокой клиниколабораторной активности СКВ. 64 Клинический пример 2. Больная Н., 36 лет, история болезни №245. Клинический диагноз: СКВ, хроническое течение, I ст. акт. Дерматит («бабочка»). Полиартрит. Пневмонит. Нефрит (мочевой синдром). Лимфоаденопатия. Анемия. Алопеция. Жалобы на эритематозные высыпания на лице, «бабочка», усиливающиеся во время пребывания на солнце, боли в мелких суставах кистей и в грудной клетке, сухой кашель, тяжесть в проекции почек, слабость и утомляемость, похудание, выпадение волос. Из анамнеза: болеет в течение 11 лет. Дебют болезни связывает с переохлаждением организма, когда после перенесенного тяжелого ОРЗ, появились эритематозные высыпания на коже лица, туловища. Они рецидивировали в течение 5 лет. Неоднократно обращалась за помощью дерматологам. В динамике появились боли в суставах, увеличение подмышечных, затем паховых лимфоузлов, трофические расстройства, в крови обнаружены LE-клетки. Был выставлен диагноз: СКВ, хроническое течение. Объективно: общее состояние относительно удовлетворительное. На лице эритематозные высыпания, напоминающиеся форму «бабочки». Суставы кисти припухшие, болезненные. Прощупываются болезненные подмышечные лимфатические узлы. Бледность кожных покровов и видимых слизистых оболочек. В легких дыхание жестковатое, хрипов нет, ЧД-22 в мин. Сердечные тоны ясные, ритмичные. ЧСС-92 в мин, АД-110/70 мм.рт.ст. Живот мягкий, безболезненный. Печень и селезенка не увеличены. Лабораторно-инструментально: Анализ крови: гемоглобин-95 г/л, эритроциты-3,3х1012/л, ЦП-0,8, лейкоциты-3,4х109/л, тромбоциты9 165,1х10 /л, СОЭ-19; общий белок-60,5 г/л, альбумины-46%, глобулины-54%: ά1ά2-17%, β-10%, γ-27%, Ваалера-Роузе-1:32, АСК-1:150, АСЛ-О-1:250, СРБ+,серомукоид-0,28 ед., гаптоглобин-1,6 г/л, РФ-+, LE-клетки-8:1000, АНФ-1:32; Анализ мочи: удельный вес-1018, белок-0,36 г/л, лейкоциты-7-8 в поле зрения, эритроциты-3-4 в поле зрения, цилиндры - 5-6 в поле зрения. Рентгенограмма кистей рук: сужение суставной щели без деструктивных изменений; СПАЛ-135 усл. ед. На примере данной истории болезни видно, что невысокая активность, хроническое течение и отсутствие тяжелых висцеральных поражений при СКВ, характеризуются низким уровнем СПАЛ. 65 3.2.2. Спонтанная иммуноглобулинсинтезирующая активность Влимфоцитов в обследованных группах Нами впервые проведено исследование СИАЛ, для этого мы в первую очередь изучали уровень СИАЛ у здоровых лиц. Установив среднее значение СИАЛ в группе здоровых лиц, мы вычисляли нормальные показатели СИАЛ. Для чего находили максимальное значение доверительного интервала (d max) по формуле: d max=M±δ, где δ – средняя арифметическая ошибка. В результате этого за положительный результат принимали значение СИАЛ, равное 135 условных единиц и более. Уровень СИАЛ у здоровых лиц, больных ОА, РА и СКВ приведен в рисунке 3.2. 175 M Здоровые лица -10% 166,9 Больные СКВ 93,7% 160 143,2 Больные ОА -33,3% 145 128,1 130 124,2 Больные РА -84,6% 115 Здоровые лица Больные ОА Больные РА Больные СКВ Рис. 3.2. Уровни и частота положительных результатов СИАЛ в обследованных группах. Как следует из рисунка 3.2, уровень СИАЛ у больных СКВ был достоверно выше, чем у здоровых лиц (t=12,55; p<0,001), больных ОА (t1=11,27; p1<0,001), и больных РА (t2=6,79; p2<0,001), т.е. максимальный уровень СИАЛ обнаружен у больных СКВ. При этом частота положительных результатов обнаружена у 60 (93,7%) больных СКВ, у 22 (84,6%) больных РА, лишь у 6 (33,3 %) больных ОА и всего лишь у 3 (10%) здоровых лиц. Таким образом, у больных СКВ, находившихся, под нашим наблюдением уровень СИАЛ был достоверно выше, чем у лиц сравнительной 66 группы. Отсюда следует отметить то, что обнаружение максимального уровня СИАЛ у больных СКВ лишний раз свидетельствовало о высокой степени активности иммунного ответа при этой болезни. 3.2.2.1. Спонтанная иммуноглобулинсинтезирующая активность Влимфоцитов при различных клинических вариантах СКВ Уровень СИАЛ при различных клинических вариантах СКВ приведен в таблице 3.5. Таблица 3.5. Уровень и частота обнаружения СИАЛ при различных клинических вариантах СКВ СИАЛ Обследованные Частота подгруппы n М ± m в усл. положительных больных результатов ед t, р абс. % Здоровые лица 30 124,2±1,92 3 10,0 I ст. активности 17 144,3±3,2*** 14 82,3 t3=5,11; р3<0,001 t4=2,66; р4<0,01 II ст. активности 26 169,3±3,7*** 25 96,1 t =8,51; р5<0,001 III ст. активности 21 182,1±3,08*** 21 100,0 5 t =2,91; р6<0,01 Острое течение 20 183,3±3,02*** 20 100,0 6 t7=5,15; р7<0,001 Подост. течение 26 169,5±3,68*** 25 96,1 t8=8,97; р8<0,001 Хрон. течение 18 144,8±3,07*** 15 83,3 t9=7,07; р9<0,001 АНФ + 57 170,6±2,54*** 56 98,2 t =8,28; 10 АНФ – 7 136,7±4,07** 4 57,1 р <0,001 10 АФС + 18 143,2±3,21*** 14 77,7 АФС 46 176,1±2,35*** 46 100,0 Примечания: -* - достоверно, по сравнению со здоровыми (*- р<0,05; ** - р<0,01; *** - р<0,001 ); -t3 и р3 - разница между показателями при I и II ст. активности у больных СКВ; -t4 и р4 - разница между показателями при II и III ст. активности у больных СКВ; -t5 и р5 - разница между показателями при I и III ст. активности у больных СКВ; -t6 и р6 – разница между показателями острого и подострого течения у больных СКВ; -t7 и р7 – разница между показателями острого и хронического течения у больных СКВ; -t8 и р8 – разница между показателями подострого и хронического течения у больных СКВ; -t9 и р9 – разница между показателями АНФ (+) и АНФ (-) у больных СКВ; - t10 и р10 - разница между показателями АФС (+) и АФС (-) у больных СКВ 67 Как видно из таблицы 3.5, у больных СКВ I (минимальной) степенью активности показатель СИАЛ достоверно превышал нормальные показатели (t=5,38; р<0,001), а также значение СИАЛ у больных ОА (t=4,3; р<0,001) и больных РА (t=0,28; р>0,05), но последнее не достоверно. При этом у 82,3% больных СКВ с I степенью активности уровень СИАЛ был выше нормы, т.е. даже при минимальной активности СКВ положительный результат определялся у подавляющего большинства больных. У больных СКВ со II (умеренной) степенью активности уровень СИАЛ был также достоверно выше, чем у здоровых лиц (t=10,84; р<0,001) и больных СКВ с I степенью активности. (t3=5,11; р3<0,001). Уровень СИАЛ выше нормы обнаружен у 25 (96,1%) больных со II степенью активности патологического процесса, что гораздо выше, чем у больных с I степенью активности (82,3%). Уровень СИАЛ у больных СКВ с III (максимальной) степенью активности был достоверно выше не только по сравнению со здоровыми лицами (t=15,99; р<0,001), но и в сравнении с больными I степенью активности болезни (t5=8,51; р5<0,001). Аналогичные результаты отмечены и по частоте обнаружения положительного результата: у больных с III степенью активности значение СИАЛ выше нормы обнаружен у 100 % против 82,3 % у больных с I степенью активности. Следует также отметить то, что показатель СИАЛ у больных с III степенью активности был достоверно выше, чем у больных со II степенью активности (t4=2,66; р4<0,01). При этом та же тенденция обнаружена по количеству повышенного результата: 100% у больных СКВ с III степенью активности, против 96,1% больных СКВ со II степенью активности патологического процесса. Из приведенных данных таблицы 3.5 видно, что у больных СКВ с острым течением уровень СИАЛ значительно превосходил показатели не только здоровых лиц (t=16,6; р<0,001), но и больных СКВ с подострым и хроническим течениями болезни (t6=2,91; р6<0,01 и t8=8,97; р8<0,001). При этом повышенный уровень СИАЛ обнаружен у всех 20 (100%) больных СКВ 68 с острым течением. Значение исследуемого показателя у больных СКВ с подострым течением также было достоверно выше по сравнению со здоровыми лицами (t=10,91; р<0,001), как и с больными с хроническим течением (t7=5,15; р7<0,001). В свою очередь у больных СКВ с хроническим течением уровень СИАЛ был достоверно выше, чем у здоровых доноров (t=5,69; р<0,001). У больных СКВ с серопозитивной формой уровень СИАЛ был гораздо выше, чем у здоровых лиц (t=14,59; р<0,001), и больных с серонегативной формой СКВ (t9=7,07; р9<0,001). При этом процент больных с повышенным уровнем СИАЛ составил 98,2%. Также отмечалось повышение уровня СИАЛ у больных СКВ с серонегативной формой болезни по сравнению со здоровыми лицами (t=2,78; р<0,01). При этом повышенный уровень СИАЛ обнаружен у 57,1 % больных. Из 18 находившихся под нашим наблюдением больных СКВ с клинико-лабораторными признаками АФС 14 (77,7%) имели повышенный уровень СИАЛ. При этом уровень СИАЛ был достоверно выше, чем у здоровых доноров (t=5,09; р<0,001). В свою очередь показатель СИАЛ у больных СКВ без АФС был достоверно выше не только по сравнению со здоровыми лицами (t=17,12; р<0,001), но и с больными СКВ с клинико-лабораторными проявлениями АФС (t10=8,28; р10<0,001). При этом процент больных с повышенным уровнем СИАЛ составил 100%. Для подтверждения клинического значения СИАЛ при СКВ приводим следующие клинические примеры: Клинический пример 3. Больная М., 26 лет, история болезни № 956. Клинический диагноз: СКВ, острое течение, III степени активности. Дерматит («бабочка»). Полиартрит. Полисерозит (Экссудативный плеврит, перикардит). Пневмонит, ЛН II ст. Люпус-кардит. Люпус-нефрит (нефротический синдром). Нейролюпус (менингоэнцефалополирадикулонейропатия). Анемия. Лимфоаденопатия. Алопеция. Лихорадка. Жалобы на эритематозные высыпания на лице по типу «васкулитной бабочки», боли в суставах кистей рук и стоп, в области сердца и в грудной 69 клетке, одышку и сердцебиение при малейшей физической нагрузке, лихорадку до 38,8ºС, боли в проекции почек, головные боли, головокружение, выраженную общую слабость, чувство онемение на нижних конечностях, выпадение волос, похудание на 7 кг. Из анамнеза: болеет в течение 1,5 года. Начало острое, появилась эритема на лице («бабочка»), постоянная лихорадка до 38,5ºС, боли и припухлость мелких суставов кистей рук. Через некоторые промежутки появились боли в грудной клетке и в области сердца, одышка и сердцебиение в покое, выпадение волос, увеличение подмышечных, поднижнечелюстных и паховых лимфатических узлов. Объективно: общее состояние тяжелое, обусловленное полиорганной недостаточностью. Бледность кожи и видимых слизистых. Отеки лица и ног. Болезненные увеличенные лимфоузлы (подмышечные и паховые). Припухшие суставы кистей. Эритематозные высыпание на лице, напоминающиеся форму бабочки. В легких дыхание ослаблено в нижних отделах, сухие и влажные хрипы, ЧД-26 в мин. Шум трения перикарда. Сердечные тоны приглушены, экстрасистолия, ЧСС-124 в мин, АД-135/80 мм.рт.ст. Живот мягкий, безболезненный. Печень и селезенка не увеличены. Лабораторно-инструментально: Анализ крови: гемоглобин-69г/л, эритроциты-2,9х1012/л, ЦП-0,7, лейкоциты-3,4х109/л, тромбоциты9 160,5х10 /л, СОЭ-68 мм/ч; общий белок-52 г/л, альбумины -38%, глобулины 62%: ά1ά2-20%, β-10%, γ-32%, β-ЛП-0,65, холестерин-8,2 ммол/л; Ревмотесты: Ваалера-Роузе-1:32, АСК-1:150, АСЛ-О-1:250, СРБ+++, серомукоид-0,35 ед, гаптоглобин-2,4 г/л, РФ-отр, LE-клетки-16:1000, АНФ-1:128; Анализ мочи: удельный вес-1015, белок-6,6 г/л, лейкоциты - 5-6 в поле зрения, эритроциты5-6 в поле зрения, плоский эпителий - много; Суточная протеинурия-400 мг/сутки. ЭКГ - синусовая тахикардия, нарушение процессов реполяризации, единичные желудочковые экстрасистолии. Рентгенограмма легких - наличие жидкости в плевральной полости, усиление бронхолегочного рисунка; УЗИ данные: наличие жидкости в полости перикарда; СПАЛ - 174 усл.ед. СИАЛ 198 усл.ед. Таким образом, у данной больной с классической СКВ с острым течением и максимальной степенью активности показатели СПАЛ и СИАЛ были высокими. Клинический пример 4. Больная С., 32 года, история болезни №1345. Клинический диагноз: СКВ, хроническое течение, I степени активности. Дерматит. Фотосенсибилизация. Полиартрит. Лимфоаденопатия. Серозит (адгезивный плеврит). Нефрит (мочевой синдром). Алопеция. Сетчатое ливедо. Жалобы на появление высыпаний эритематозного характера на лице и открытых частях тела, усиливающиеся при нахождении на солнце, боли в суставах, сухой кашель, боли в грудной клетке и в проекции почек, выпадение волос, слабость. 70 Из анамнеза: считает себя больной в течение 8 лет. В начале около 3-4х лет беспокоил болевой синдром в суставах. В последние годы при нахождении длительное время на солнце появились эритематозные высыпания на лице и открытых частях тела, трофические расстройства в виде алопеции, отмечались боли в грудной клетке и в проекции почек. Выставлен диагноз: СКВ, минимальная степень активности, хроническое течение. Объективно: общее состояние удовлетворительное. На лице и открытых частях тела имеются эритематозные высыпания. Слегка припухшие суставы кистей рук. Болезненные, увеличенные подмышечные лимфоузлы. В легких дыхание везикулярное, хрипов нет. Шум трения плевры, ЧД-20 в мин. Сердечные тоны приглушены, ритмичные, ЧСС-86 в мин., АД-120/80 мм.рт.ст. Лабораторно-инструментально: Анализ крови: гемоглобин-115 г/л, 12 эритроциты-5,3х10 /л, ЦП-0,85, лейкоциты-5,5х109/л, тромбоциты9 182,5х10 /л, СОЭ-21 мм/час; общий белок-59 г/л, альбумины-42%, глобулины-58%: ά1ά2-18%, β-11%, γ-29%; Ревмотесты: Ваалера-Роузе-1:32, АСК-1:150, АСЛ-О-1:250, СРБ+, серомукоид-0,24 ед, гаптоглобин-1,45 г/л, РФ-отр, LE-клетки-6:1000, АНФ-1:32. Анализ мочи: удельный вес-1015, белок-0,28 г/л, лейкоциты-8-9 в поле зрения, эритроциты-3-5 в поле зрения, плоский эпителий – мало; СПАЛ – 130 усл.ед. СИАЛ – 137 усл.ед. Таким образом, у данной больной низкий уровень СИАЛ ассоциируется с невысокой активностью, хроническим течением и отсутствием тяжелых висцеральных поражений при СКВ. Подводя итоги подглавы 3.2, следует отметить то, что показатели СПАЛ и СИАЛ отражают наличие и степень воспалительных изменений при СКВ. Отмечено что показатели СПАЛ и СИАЛ (158,2±2,58 и 166,9±2,81) у больных СКВ достоверно превышали эти показатели у больных РА (136,3±2,49 и 143,2±2,08) и ОА (118,4±2,39 и 128,1±1,99). Частота повышенного уровня СПАЛ и СИАЛ выявлена у 90,6% и 93,7% больных СКВ соответственно, что значительно выше, чем у больных РА (80,8% и 84,6%) и ОА (27,7% и 33,3%). Следовательно, полученные нами данные в виде высоких уровней СПАЛ и СИАЛ при СКВ по сравнению с больными РА, ОА и со здоровыми лицами указывают на важное патогенетическое значение показателей СПАЛ и СИАЛ, заключающиеся в соответствии степени спонтанной иммуноглобулинсинтезирующей активности В-клеток выраженности иммунного ответа при аутоиммунных воспалительных заболеваниях, в частности, при СКВ. 71 Таким образом, все вышеизложенное позволяет говорить о том, что показатели СПАЛ и СИАЛ у больных СКВ зависят от активности болезни (чем выше активность патологического процесса, тем выше значения СПАЛ и СИАЛ), варианта течения процесса (при остром и подостром течениях больше, чем при хроническом течении), от присутствия АНФ в сыворотке крови (при серопозитивном типе выше, чем при серонегативном), а также от наличия АФС (у больных СКВ без признаков АФС больше, чем у больных с признаками АФС). 3.3. Антигензависимая В-клеточная активация при СКВ Антигензависимую В-клеточную активацию оценивали, как описано в подглаве 2.2.5., по уровню кардиолипинзависимой активации В–лимфоцитов (КЗАЛ). 3.3.1. Кардиолипинзависимая активация В-лимфоцитов в обследованных группах Нами впервые проведено исследование КЗАЛ, для этого мы в первую очередь изучали его значения у здоровых лиц. Установив среднее значение КЗАЛ в группе здоровых, вычисляли границы нормы этого показателя. Для чего находили максимальное значение доверительного интервала (d max) по формуле: d max= М±2δ (где δ - среднее квадратическое отклонение). При этом по этой формуле нормальные значения КЗАЛ были в пределах 101,0199,8 усл.ед. Исходя из этого, за положительный результат мы считали значение КЗАЛ, равное 200 усл.ед. и более. При исследовании уровня КЗАЛ из приведенных результатов рисунка 3.3 видно, что уровень КЗАЛ у больных СКВ был выше, чем у здоровых лиц (t=6,07, р<0,001), больных ОА (t1=4,35, р1<0,001) и РА (t2=3,78, р2<0,001). При этом высокий показатель КЗАЛ обнаружен у 36 (56,2%) больных СКВ, у 72 7 (26,9%) больных РА, лишь у 3 (16,7 %) больных ОА и ни в одном случае у здоровых лиц. Особо следует отметить то, что встречаемость при СКВ положительного результата КЗАЛ (56,2%) была выше, чем обнаружение аКЛ в сыворотке крови (46,9%). 190 186,2 M 180 170 160 Здоровые Больные ОА - лица -0% 16,7% 160,3 150,4 156,7 150 140 Больные РА Больные СКВ - Здоровые лица Больные ОА Больные РА Больные СКВ Рис. 3.3. Уровни и частота обследованных группах. 3.3.2. 26,9% 56,2% положительных Кардиолипинзависимая активация результатов КЗАЛ В-лимфоцитов в при различных клинических вариантах СКВ У больных СКВ с I степенью активности уровень КЗАЛ был достоверно выше, чем у здоровых лиц (t=11,46; р<0,001) и больных СКВ со II и III степенями активности (t3=4,7; р3<0,001 и t5=5,74, р5<0,001) (табл. 6.6). Также частота положительных результатов были выше при I степени активности патологического процесса (82,3%), чем при II (50,0%) и III (42,8%) степенях активности. В свою очередь у больных СКВ со II степенью активности уровень КЗАЛ достоверно превышал нормальные показатели (t=5,09; р<0,001). У больных СКВ с III степенью активности патологического процесса уровень КЗАЛ также превышал нормальные показатели (t=1,9; р>0,05), но статистически недостоверно. Также по данным таблицы 3.6 обнаружено то, что у больных СКВ с хроническим течением показатель КЗАЛ был достоверно выше, чем у здоровых доноров (t=12,31; р<0,001) и больных СКВ с острым (t8=6,12; р8<0,001) и подострым (t7=5,4; р7<0,001) течениями болезни. В свою очередь 73 у больных СКВ с подострым течением показатель КЗАЛ был выше, чем при остром течении болезни (t6=2,09; р6 <0,05). Полученные данные из таблицы 3.6 свидетельствовуют, что при АНФнегативной форме СКВ уровень КЗАЛ был достоверно выше, чем у здоровых лиц (t=11,91; р<0,001) и больных СКВ с АНФ-позитивной формой болезни (t9=6,16; р9<0,001). При этом частота положительного результата в группе больных СКВ с серонегативной формой болезни была равна 100%. Таблица 3.6. Уровень и частота обнаружения КЗАЛ при различных клинических вариантах СКВ КЗАЛ Обследованные Частота подгруппы n положительных t, р М±m больных результатов в усл. ед. абс. % Здоровые лица 30 150,4±4,51 0 0 t3=4,7; р3<0,001 I ст. активности 17 212,2±2,96*** 14 82,3 t4=2,02; р4<0,05 II ст. активности 26 184,8±5,03*** 13 50,0 t5=5,74; р5<0,001 III ст. активности 21 166,8± 7,38 9 42,8 t6=2,09; р6<0,05 Острое течение 20 165,1± 7,48 8 40,0 t7=5,4; р7<0,001 Подост. течение 26 183,8±4,89*** 12 46,1 t8=6,12; р8<0,001 Хрон. течение 18 213,2±2.4*** 16 88,9 t9=6,16; р9<0,001 АНФ + 57 182,9±4,05*** 29 50,9 t10=8,96; АНФ – 7 212,6±2,63*** 7 100,0 р10<0,001 АФС + 18 215,3±1,77*** 18 100,0 t11=10,19; АФС – 46 174,8 ± 4,17*** 18 39,1 p11<0,001 аКЛ + 30 211,1±1,45*** 30 100,0 аКЛ – 34 164,2±4,37 6 17,6 Примечания: -* - достоверно, по сравнению со здоровыми (*- р<0,05; ** - р<0,01; *** - р<0,001 ); -t3 и р3 - разница между показателями при I и II ст. активности у больных СКВ; -t4 и р4 - разница между показателями при II и III ст. активности у больных СКВ; -t5 и р5 - разница между показателями при I и III ст. активности у больных СКВ; -t6 и р6 – разница между показателями острого и подострого течения у больных СКВ; -t7 и р7 – разница между показателями острого и хронического течения у больных СКВ; -t8 и р8 – разница между показателями подострого и хронического течения у больных СКВ; -t9 и р9 – разница между показателями АНФ (+) и АНФ (-) у больных СКВ; -t10 и р10 - разница между показателями АФС (+) и АФС (-) у больных СКВ; -t11и р11 - разница между показателями аКЛ (+) и аКЛ (-) у больных СКВ 74 Особо следует отметить то, что у всех больных СКВ с клиниколабораторными признаками АФС (100%) определялся высокий уровень КЗАЛ и это подтверждалось достоверно высоким уровнем КЗАЛ не только по сравнению со здоровыми лицами (t=11,40; р<0,001), но и по сравнению с больными СКВ без признаков АФС (t10=8,96; р10<0,001). У больных СКВ с наличием в сыворотке крови аКЛ уровень КЗАЛ был достоверно (t11=10,19; р11<0,001) выше, чем у больных без наличия аКЛ. Особый интерес заслуживает то, что у всех больных СКВ с повышенным уровнем КЗАЛ в сыворотке крови обнаружены аКЛ. В то же время у 3 больных с повышенным уровнем КЗАЛ в крови отсутствует аКЛ. свидетельствует о том, что КЗАЛ отражает более Последнее ранние этапы антигенспецифической В–активации и говорит о возможности использования метода определения КЗАЛ для более ранней диагностики АФС (табл. 3.6). Отмечена высокая корреляция между уровнем КЗАЛ и значениями аКЛ (r=0,97) и тромбозами сосудов (r=0,93). А корреляционная связь была слабее между уровнями КЗАЛ и СПАЛ (r=0,10), а также между КЗАЛ и СИАЛ (r=0,21). Для подтверждения клинического значения КЗАЛ при СКВ приводим следующие клинические примеры: Клинический пример 5. Больная М., 23 года, история болезни № 356. Клинический диагноз: СКВ, острое течение, III степени активности. Эритема («бабочка»). Полиартрит. Миозит. Люпус-нефрит (нефротический синдром). Полисерозит (плеврит, перикардит). Люпус-кардит. Гепатоспленомегалия. Анемия. Лимфоаденопатия. Алопеция. Тромбоцитопения. Жалобы на повышение температуры тела до высоких цифр постоянного характера, высыпания эритематозного характера на лице по типу «бабочки», усиливаюшиеся при нахождении на солнце, выраженные боли в суставах кистей рук, в мышцах конечностей, боли в области сердца и в грудной клетке, сухой кашель, одышку и сердцебиение при физической нагрузке, боли при глубоком вдохе в грудной клетке, в проекции печени и почек, появление отеков на лице и конечностях, выраженную общую слабость, выпадение волос. Считает себя больной в течение 2,5 года. Дебют болезни связывает с переохлаждением организма. В начале появилась эритематозные высыпания 75 на лице, боли в суставах, в мышцах, повышение температуры тела до 38,5ºС. В течение 4 месяцев присоединились боли в грудной клетке и в области сердца, отеки на лице и нижних конечностях, похудание, увеличение печени и селезенки, изменения в анализах мочи (протеинурия). Выставлен диагноз: СКВ, острое течение. Объективно: состояние тяжелое. Бледность кожных покровов и видимых слизистых. Отеки лица и ног. Высыпание на лице, напоминающие форму бабочки. Увеличенные и болезненные поднижнечелюстные, подмышечные и паховые лимфоузлы. Припухлость и болезненность суставов кистей. В легких дыхание везикулярное, но ослаблено в нижних отделах обоих легких, влажные хрипы. ЧД-24 в мин. Границы сердца расширены. Тоны сердца глухие, ритмичные. ЧСС-122 в мин. АД-120/80 мм.рт.ст. Живот мягкий, болезненный в проекции печени и селезенки. Печень и селезенка увеличены. Лабораторно-инструментально: Анализ крови: гемоглобин-68 г/л, 12 эритроциты-2,94х10 /л, ЦП-0,7, лейкоциты-3,2х109/л, тромбоциты-105х109/л, СОЭ-70 мм/час; общий белок-53 г/л, альбумины-37%, глобулины-65%: ά1ά218%, β-9%, γ-36%; Ревмотесты: Валера-Роузе-1:32, АСК-1:150, АСЛ-О-1:250, СРБ+++, серомукоид-0,55 ед., гаптоглобин-3,4 г/л, РФ-(+), LE-клетки22:1000, АНФ-1:128; Анализ мочи: удельный вес-1018, белок-5,7 г/л, эритроциты - 10-12 в поле зрения, лейкоциты - 7-8 в поле зрения, цилиндры 5-6 в поле зрения. ЭКГ-синусовая тахикардия, диффузные нарушения процессов реполяризации. УЗИ сердца: незначительная гипертрофия миокарда обоих желудочков и увеличение полостей сердца. УЗИ органов брюшной полости: увеличение размеров печени и селезенки; СПАЛ - 185 усл.ед. СИАЛ - 195 усл.ед. КЗАЛ - 172 усл.ед. По результатам вышеуказанных данных подтверждено, что у больной СКВ с острым течением и максимальной степенью активности, показатель КЗАЛ был отрицательным. Кроме того, у этой больной уровни СПАЛ и СИАЛ наоборот были высокими. Клинический пример 6. Больная К., 35 лет, история болезни № 647. Клинический диагноз: СКВ, хроническое течение, I степени активности. Дерматит («бабочка»). Полиартрит. Миалгия. Лимфоаденопатия. Сетчатое ливедо. Нефрит (мочевой синдром). АФС (Тромбозы глубоких вен голени; Спонтанный аборт; Преходящее нарушение мозгового кровообращения; Тромбоцитопения). Алопеция. Жалобы на появления на лице эритематозных высыпаний, боли в суставах, мышцах, онемение и тяжесть на нижних конечностях, болевые ощущения в проекции почек, лихорадку до 37,5ºС, похудание, постоянные головные боли и головокружение. Из анамнеза: считает себя больной в течение 7 лет. Начало болезни связывает с носоглоточной инфекцией (часто обострился явления 76 хронического тонзиллита). Первые симптомы: эритематозные высыпания на лице, часто рецидивирующаяся в течение 4-х лет. Через 2 года стала отмечать боли в суставах, в мышцах, появление сосудистого рисунка на конечностях. Затем в течение года беспокоили боли в проекции почек, увеличение лимфоузлов, в крови были обнаружены LE-клетки. Был выставлен диагноз: СКВ, хроническое течение. В анамнезе последние годы беременности 2 раза завершились выкидышами (спонтанными абортами). Год тому назад перенесла преходящее нарушение мозгового кровообращения. Объективно: общее состояние средней тяжести. На коже туловища и лица эритематозные высыпания, сетчатый рисунок кожи конечностей. Суставы кисти припухшие, болезненные. В легких дыхание везикулярное, хрипов нет, ЧД-18 в мин. Тоны сердца ясные, ритмичные, ЧСС-80 в мин. АД110/70 мм.рт.ст. Живот мягкий, безболезненный. Печень и селезенка не увеличены. Подмышечные, паховые лимфоузлы увеличены и болезненные. Лабораторно-инструментально: Анализ крови: гемоглобин-105 г/л , эритроциты-4,5х1012/л, ЦП-0,9, лейкоциты-3,9х109/л, тромбоциты9 120,5х10 /л, СОЭ-18 мм/час; общий белок-62 г/л, альбумины-48%, глобулины-52%: ά1ά2-14%, β-12%, γ-26%; Ревмотесты: Валера-Роузе-1:24, АСК-1:150, АСЛ-О-1:250, СРБ +, серомукоид-0,26 ед, гаптоглобин-1,52 г/л, РФ-отр, LE-клетки - не обнаружены, АНФ-1:16, аКЛ обнаружены в высоком титре. Анализ мочи: удельный вес-1018, белок-0,35 г/л, лейкоциты - 4-5 в поле зрения, эритроциты - 2-4 в поле зрения, плоский эпителий – мало; КЗАЛ - 231 усл.ед. СПАЛ - 128 усл.ед. СИАЛ - 138 усл.ед. На примере данной истории болезни видно, что у больной СКВ с явными клиническими проявлениями АФС в крови обнаружены антитела к кардиолипину в высоком титре и высокий уровень синтеза иммуноглобулинов В-клетками в присутствии кардиолипина. При этом высокий уровень КЗАЛ у этой больной ассоциировался с хроническим течением болезни, с невысокой клинико-иммунологигической активностью процесса, минимальными продолжительностью жизни признаками больной, люпус-нефрита со спонтанными с высокой абортами и поражением ЦНС на фоне тромбоза сосудов. Клинический пример 7. Больная Г., 31 лет, история болезни № 1345; Клинический диагноз: СКВ, хроническое течение, II степени активности. Дерматит. Фотосенсибилизация. Миозит. Полиартрит. Лимфоаденопатия. Нефрит (гломерулонефрит). Люпус-кардит (эндомиокардит). Алопеция. Анемия. Жалобы при поступлении: появление на лице и верхней части туловища эритематозных высыпаний, усиливаюшееся при длительном 77 пребывании на солнце, боли в суставах, мышцах, тяжесть в области почек, появление отеков лица и ног, похудание. Одышка и сердцебиение при физической нагрузке, выпадение волос. Утомляемость и общую слабость. Из анамнеза: в течение 5-6 лет состоит на «Д» - учете по поводу СКВ. Получает ежегодно 2 раза стационарное лечение. Постоянно принимает преднизалон в поддерживающих дозах и антиагреганты (курантил, тиклид и др.). Объективно: Обшее состояние средней тяжести. На коже лица и верхней части туловища имеются эритематозные высыпания. Припухлость и болезненность в области мелких суставов кистей. Отеки на нижних конечностях. Подчелюстные, подмышечные лимфоузлы увеличены и болезненные. В легких дыхание везикулярное, хрипов нет, ЧД-20 в мин; Тоны сердца приглушены, ритмичные, систолический шум на верхушке, ЧСС-102 в мин; АД-110/80 мм.рт.ст. Живот мягкий, безболезнен. Печень и селезенка не увеличены. Симптом Пастернацкого отрицательный с обеих сторон. Лабораторно-инструментально: Анализ крови: гемоглобин-99 г/л, эритроциты-3,95х1012/л, ЦП-0,8, лейкоциты-3,2х109/л, тромбоциты9 165,5х10 /л, СОЭ-28 мм/час; общий белок-60 г/л, альбумины-42%, глобулины-58%: ά1ά2-14%, β-14%, γ-30%; Ревмотесты: Валера-Роузе-1:32, АСК-1:150, АСЛ–О-1:100, СРБ ++, серомукоид-0,28 ед., гаптоглобин- 1,62 г/л, РФ-отр, LE-клетки - обнаружены, АНФ-1:32, аКЛ обнаружены в высоком титре. Анализ мочи: удельный вес-1016, белок-0,45 г/л, лейкоциты - 5-6 в поле зрения, эритроциты - 3-4 в поле зрения, плоский эпителий – много; КЗАЛ - 225 усл.ед. СПАЛ - 132 усл.ед. СИАЛ - 143 усл.ед. Как видно из этого примера, у больной с достоверной СКВ, страдающей в течение 5-6 лет этой болезнью, отмечалось хроническое течение и умеренная степень активности патологического процесса. При этом значения СПАЛ и СИАЛ также были низкими, что совпадало с характером течения болезни у данной больной. Но особо обращало на себя внимание обнаружение у этой больной высокого уровня КЗАЛ (значительно превышающего верхнюю границу нормы). Данная больная была взята нами на особый учет. В дальнейшем у этой больной через 2 месяца при текущем «Д»-осмотре обнаружены признаки сетчатого ливедо, осложнившегося развитием тромбофлебита глубоких вен голени. А через 5 месяцев у больной развились признаки ОНМК. Больная была госпитализирована, и в ходе стационарного обследования выявлено лабораторно: тромбоцитопения, антитела к фосфолипидам, антитела к кардиолипину, гиперкоагуляция. 78 Таким образом, у больной с высоким уровнем КЗАЛ через 5 месяцев появились достоверные клинико-лабораторные признаки АФС. На основе данного клинического примера можно говорить о том, что показатель КЗАЛ можно использовать для диагностики АФС на ранних стадиях СКВ и даже как прогностический признак развития АФС при хроническом течении СКВ. Заключая подглаву 3.3, можно утверждать то, что предложенное нами исследование антигензависимой В-клеточной активации позволяет выявить при СКВ с АФС избирательное повышение иммуноглобулинсинтезирующей активности В-лимфоцитов в присутствии такого антигена как кардиолипин. Результаты исследования антигензависимой В-клеточной активации у обследованных показали, что наиболее высокий уровень синтеза иммуноглобулинов В-лимфоцитами в присутствии кардиолипина отмечено при СКВ. При исследовании КЗАЛ установлено, что кардиолипин избирательно и в большей степени (по выраженности и по частоте - 100%) повышал внутриклеточный синтез иммуноглобулинов В-лимфоцитами у больных СКВ с АФС. Для здоровых, больных ОА и РА этот показатель был не характерен, и его значения в этих группах не отличались от нормальных величин. При этом повышение иммуноглобулинсинтезируюшей активности В-клеток в присутствии кардиолипина выявлено лишь у 7 (26,9%) больных РА, у 3 (16,7%) больных ОА и ни в одном случае у здоровых лиц. Особо следует отметить то, что показатель КЗАЛ у больных СКВ был достоверно выше, чем не только у здоровых лиц (t=6,07; р <0,001), но и чем у больных ОА и РА (t1=4,35; p<0,001 и t2=3,78; p<0,001 соответственно). Исследование показателя КЗАЛ при различных клинических вариантах СКВ выявило снижение его значения с увеличением активности патологического процесса, то есть максимальное значение КЗАЛ обнаружено у больных СКВ с I степенью активности, а минимальное – с III степенью активности. 79 Аналогичные результаты выявлены у больных СКВ с острым, подострым и хроническим течениями болезни, т.е. у больных СКВ с хроническим течением уровень КЗАЛ был максимальным, а у больных с острым течением – минимальным. Исследование показателя КЗАЛ у больных СКВ с наличием АНФ показало то, что уровень КЗАЛ при серонегативной форме СКВ был выше, чем у больных СКВ с серопозитивной формой болезни. Особое значение имело то, что показатель КЗАЛ у больных СКВ с клинико-лабораторными признаками АФС достоверно выше, чем у больных СКВ без признаков АФС. При этом следует отметить то, что высокий уровень КЗАЛ у больных СКВ ассоцировался с высоким уровнем аКЛ в сыворотке крови и выраженными клиническими проявлениями АФС. Опираясь на эти данные, можно говорить о наличии у больных СКВ с АФС В-лимфоцитов, сенсибилизированных in vivo кардиолипином. По-видимому, эти кардиолипинзависимые В-лимфоциты по мере развития аутоиммунного процесса продуцируют аКЛ и другие антифосфолипидные антитела с развитием клинико-лабораторных симптомов АФС. Таким образом, определение КЗАЛ может быть использовано в диагностике СКВ с АФС, а также в дифференциальной диагностике СКВ с АФС и СКВ без АФС. 80 ЗАКЛЮЧЕНИЕ В настоящей работе проведено изучение спонтанной и антигензависимой В-клеточной активации при различных клинических вариантах СКВ с выявлением клинико-патогенетического значения этих иммунологических феноменов. В основу работы положено клинико-иммунологическое изучение 64 больных СКВ, которые составляли опытную группу. А сравнительную группу обследованных лиц составляли 18 больных ОА и 26 больных РА. В качестве контрольной группы были обследованы 30 практически здоровых лиц. В последнюю группу вошли студенты IV курса медицинского факультета Ош ГУ в возрасте 20-25 лет и клинические ординаторы Центра последипломного медицинского образования города Ош, не страдающие хроническими заболеваниями и не получавшие никаких вакцинаций в течение 6 месяцев. Больные СКВ ревматологическом находились отделении и на были стационарном обследованы в лечении первые в дни госпитализации до начала терапии. А больные сравнительной группы прошли обследования в амбулаторно-диагностическом отделении Ошской областной объединенной клинической больницы. Нами были обследованы 64 больных СКВ в возрасте 15-46 лет. Основную часть больных СКВ составляли женщины - 62 человека (96,9%), а мужчины составляли всего лишь 3,1% (2 человека). По возрастным особенностям большую часть больных составляли девушки и молодые женщины в возрасте 15-35 лет (92,2%). Из обследованных больных СКВ у 21 (32,8%) была отмечена высокая (III) степень активности патологического процесса; у 26 (40,6%) - умеренная (II) степень, а минимальная (I) степень активности болезни выявлена у 17 (26,6%) больных. По характеру течения патологического процесса острое течение болезни отмечено у 20 (31,3%) больных, подострое у 26 (40,6%), а хроническое течение болезни отмечено у 81 18 (28,1%) больных. АНФ был обнаружен у 57 (89,1%) больных СКВ (серопозитивная форма), а у 7 (10,9%) отсутствовал (серонегативная форма). У 30 (46,9%) больных СКВ обнаружены аКЛ в сыворотке крови, а у 34 (53,1%) – эти антитела отсутствовали. Из 64 обследованных больных СКВ у 18 (28,1%) больных были отмечены клинико-лабораторные проявления АФС. Из 18 больных СКВ с АФС 15 (83,3%) больных имели I степень, 3 (16,7%) - II степень активности патологического процесса и ни в одном случае у них не отмечена III степень активности болезни. У значительного числа наблюдавшихся больных СКВ с АФС, а именно у 15 (83,3%) больных отмечено хроническое течение и лишь у 3 (16,7%) – подострое течение болезни. При этом ни у одного больного СКВ с АФС не отмечены острое течение болезни и клинические проявления люпус–нефрита. Поражение ЦНС отмечалось у 10 (55,6%) больных, а признаки люпус-кардита обнаруживались лишь у 1 (5,6%) больного. Венозные тромбозы обнаружены у 12 (66,7%) больных, артериальные тромбозы – у 3 (16,7%) больных, сетчатое ливедо – у 5 (27,8%) больных, акушерская патология - у 6 (33,3%) больных, тромбоцитопения - у 3 (16,7%) больных СКВ с АФС. При этом особо следует отметить то, что у большинства больных СКВ с АФС, т.е. у 15 (83,3%) больных в сыворотке крови определены аКЛ, а у 3 (16,7%) – эти антитела отсутствовали. Такой иммунологический феномен, как - АНФ определялся у 6 (33,3%) больных СКВ с АФС. Нами проведено пролиферативной комплексное активности изучение В-лимфоцитов при СКВ (СПАЛ), иммуноглобулинсинтезирующей активности антигензависимой, кардиолипинзависимой а именно спонтанной спонтанной В-лимфоцитов (СИАЛ) активации и В- лимфоцитов (КЗАЛ). Перед определением показателей СПАЛ, СИАЛ и КЗАЛ у больных СКВ их уровень был изучен у 30 здоровых лиц. На основании проведенных иммунологических исследований установлены гораздо более высокие (по частоте и выраженности) уровни СПАЛ и СИАЛ у больных СКВ по сравнению со здоровыми лицами (t=13,7; 82 p<0,001 и t=12,55; p<0,001 соответственно) и больными ОА (t=11,33; р<0,001 и t= 11,27; p1<0,001 соответственно) и РА (t=6,1; р<0,001 и t=6,79; p<0,001 соответсвенно). При этом положительные результаты СПАЛ и СИАЛ обнаружены соответственно у 90,6% и 93,7% больных СКВ, у 80,8% и 84,6% больных РА, лишь у 27,7% и 33,3 % больных ОА и всего лишь у 10% здоровых лиц. Эти полученные нами данные подтверждают соответствие количественных значений В-клеточной активации наличию и степени выраженности воспалительного процесса (В.А.Насонова, 1972; 1995; В.А.Насонова, М.Г.Астапенко, 1989; Е.Л.Насонов, М.М.Иванова, З.С. Алекберова и др.. 1995; А.Т.Мамасаидов и др., 1997; 1998; А.Т.Мамасаидов, Г.О.Мурзабаева, Г.А.Кулчинова, 2003; А.Т.Мамасаидов, Г.М.Мамасаидова, Ф.Р.Таджибаева и др., 2006). Более высокие уровни СПАЛ и СИАЛ при СКВ, чем при РА, свидетельствуют о более высокой выраженности воспалительных иммунных сдвигов у больных СКВ по сравнению с РА (Е.В.Бененсон, В.Г.Панов, А.Т.Мамасаидов, 1997; А.Ш.Сейсенбаев, 1998; Б.Б.Сагандыков, А.Т.Мамасаидов, Ф.А.Юсупов, 1982; 2001; G.M.Kallenberg, F.Van Bissel-Emiliani, M.G.Muitema, 1988; B.K.Pelton, M.Spekmaier, W.Hylton et all., 1991). Полученные нами результаты соответствуют данным литературы о том, что высокая пролиферативная и иммуноглобулинсинтезирующая активность В-лимфоцитов свойственна аутоиммунным воспалительным ревматическим заболеваниям, в частности СКВ, а их патологического уровни коррелируют воспалительного с максимальной процесса активностью (В.А.Насонова, 1972; В.А.Насонова, М.Г.Астапенко, 1989; А.Г.Бородин, А.А.Баранов, Е.Л.Насонов и др., 2002; M.Zhang, K.J.Tracey, 1998). Эти данные подтверждают факт соответствия степени активности В-лимфоцитов выраженности аутоиммунных сдвигов при ревматических заболеваниях (В.А.Насонова, 1995; 1999; А.Т.Мамасаидов, 1997; 1998; А.Т.Мамасаидов, Г.М.Мамасаидова, Ф.Р.Таджибаева и др., 2006). Обнаруженные нами максимальные уровни СПАЛ и СИАЛ у больных СКВ лишний раз доказывают наличие 83 гиперактивности иммунного ответа при этой болезни (В.А.Насонова, 1972; 1995; В.А.Насонова, М.Г.Астапенко, 1989; А.Т.Мамасаидов, 1997; 1998). Изучение значения СПАЛ и СИАЛ при различных клинических вариантах СКВ выявило его нарастание при переходе от одной степени активности к другой. При этом у больных СКВ с III (высокой) степенью активности патологического процесса значения этих иммунологических показателей было достоверно выше, чем у больных с I (минимальной) степенью активности (t=7,19; р<0,001 и t=8,51; р<0,001 соответственно) и II (умеренной) степенью активности (t=2,50; р<0,01 и t=2,66; р<0,01 соответственно). В свою очередь у больных СКВ с II (умеренной) активностью болезни эти показатели достоверно (t=4,65; р<0,001 и t=5,11; р<0,001 соответственно) выше, чем у больных с I (минимальной) степенью активности патологического процесса. По мере повышения активности болезни увеличивалась и доля больных, у которых выявлен повышенные уровени СПАЛ и СИАЛ (76,5% и 82,3% при I, 92,3% и 96,1% при II, 100,0% при III степени активности патологического процесса). Следовательно, показатели СПАЛ и СИАЛ зависели от активности болезни, достоверно возрастая от минимальной активности до максимальной. Более высокие показатели СПАЛ и СИАЛ при III и II степенях активности по сравнению с I степенью отражали наличие выраженных иммунологических сдвигов у больных с высокой и умеренной активностями СКВ, что, по-видимому, обусловлено более высоким содержанием лимфоцитов с повышенной метаболической активностью при этих формах болезни. При анализе уровней изученных иммунологических феноменов у больных СКВ с I (минимальной) степенью активности патологического процесса показатели СПАЛ и СИАЛ превышали аналогичные показатели здоровых лиц (t=6,02; р<0,001 и t=5,38; р<0,001 соответственно). Следует также отметить то, что у больных СКВ с минимальной (I) степенью активности показатели СПАЛ и СИАЛ выше нормы обнаружены в 76,5% и 82,3% случаев соответственно, т.е. эти иммунологические феномены 84 достоверно показывали наличие активности болезни, хотя большинство общепринятых клинических и лабораторных признаков выявления активности болезни были в пределах нормы. Изучение показателей СПАЛ и СИАЛ при различных вариантах течения СКВ выявило нарастание их значений с увеличением тяжести течения болезни: при остром и подостром течениях болезни эти показатели были достоверно (t=8,07; р<0,001 и t=8,97; р<0,001 соответственно и t=5,2; р<0,001 и t=5,15; р<0,001 соответственно) выше, чем у больных с хроническим течением. Обнаруженные нами более высокие уровни этих показателей при остром и подостром течениях, чем при хроническом течении лишний раз свидетельствуют о гиперактивности аутоиммунного воспаления и неблагоприятности течения подострого и особенно острого течения СКВ (В.А.Насонова, 1972; 1995; 1999). При этом принципиально важным представляется наличие большой частоты обнаружения повышенных уровней СПАЛ и СИАЛ при хроническом течении болезни (соответственно у 72,2% и 83,3% больных с хроническим течением отмечены повышенные результаты изучаемых показателей), так как клиническая картина и лабораторная характеристика подострого и особенно острого течения СКВ проявляется столь ярко и определенно, что это не оставляет сомнений в необходимости назначения иммунодепрессивного лечения при этих течениях болезни. Затруднение обычно возникают при хроническом течении СКВ, когда клинические проявления не выражены и рутинные лабораторные показатели мало изменены. И в этом случае определение показателей СПАЛ и СИАЛ может быть полезным для решения при этой форме болезни вопроса в пользу проведения иммунодепрессивного лечения. Также нами обнаружено то, что уровни СПАЛ и СИАЛ у больных СКВ, наряду с классическими клинико-лабораторно-инструментальными методами, были более выражены при серопозитивной форме заболевания, чем при серонегативной. При этом у больных СКВ высокие уровни СПАЛ и 85 СИАЛ, как и высокие титры АНФ, характеризовали более тяжелое течение и неблагоприятный прогноз болезни (В.А.Насонова, М.Г.Астапенко, 1989; В.А.Насонова, 1995; 1999). Изучение уровней СПАЛ и СИАЛ в группе больных СКВ с наличием и без АФС выявило, что показатели СПАЛ и СИАЛ у больных СКВ с АФС были значительно ниже, чем у больных СКВ без АФС. При этом у больных СКВ с АФС низкие уровни СПАЛ и СИАЛ сочетались с наличием аКЛ в сывортке крови, с более доброкачественным течением болезни (низкие титры АНФ, отсутствие проявлений люпус-нефрита, минимальная активность патологического процесса, хроническое течение, большая продолжительность жизни больных), но с высоким риском развития тромбоза сосудов, спонтанных абортов и поражения ЦНС. Таким образом, показатели СПАЛ и СИАЛ у больных СКВ зависят от активности болезни (чем выше активность, тем больше значения СПАЛ и СИАЛ), варианта течения патологического процесса (при остром и подостром течениях больше, чем при хроническом течении), от наличия АНФ в сыворотке крови (при серопозитивном типе выше, чем при серонегативном), а также от присутствия АФС-феномена (у больных СКВ без АФС значения СПАЛ и СИАЛ больше, чем у больных СКВ с АФС). Изучение антигензависимой иммуноглобулинсинтезирующей активности В-лимфоцитов у обследуемых лиц показало, что наиболее высокий уровень синтеза иммуноглобулинов В-лимфоцитами в присутствии кардиолипина отмечено при СКВ. Показатель кардиолипинзависимой активации В-лимфоцитов (КЗАЛ) при СКВ был достоверно выше, чем у здоровых доноров (t=6,07; р<0,001) больных ОА (t=4,35;р<0,001) и РА (t=3,78; р<0,001). При этом положительные результаты КЗАЛ обнаружены у 56,2% больных СКВ, у 26,9% больных РА, лишь у 16,7% больных ОА и ни в одном случае у здоровых лиц. При исследовании КЗАЛ при различных клинических вариантах СКВ выявлено следующее: значительно более высокий уровень этого феномена у 86 больных СКВ с минимальной активностью, чем с умеренной и высокой активностями (t=4,7; р<0,001 и t=5,74, р<0,001); достоверно более высокое значение КЗАЛ при хроническом течении болезни по сравнению с острым и подострым течениями (t=6,12; р<0,001 и t=5,4; р<0,001 соответственно); гораздо высокий уровень этого показателя у больных СКВ с отсутствием АНФ в сыворотке крови, чем у АНФ-позитивных больных (t=6,16; р<0,001). Следовательно, данный феномен был характерен для более доброкачественного (по активности, течению и наличию АНФ) течения СКВ. Особо следует отметить то, что показатель КЗАЛ был значительно выше у больных СКВ с признаками АФС, чем без АФС (t=8,96; р<0,001). При этом частота положительного результата КЗАЛ в группе больных СКВ с АФС была равна 100%, а частота обнаружения аКЛ – 83,3%. Высокий уровень КЗАЛ при СКВ с АФС коррелировал с невысокой клиникоиммунологической активностью болезни, с относительно доброкачественной формой СКВ (минимальная активность, хроническое течение, отсутствие нефрита и тяжелых висцеритов). Другое важное значение КЗАЛ при СКВ определялось тем, что данный феномен ассоциировался с наличием в сыворотке крови высокого титра аКЛ. Вышеприведенные данные в виде избирательного повышения синтеза иммуноглобулинов В-лимфоцитами в присутствии кардиолипина у больных СКВ, могут свидетельствовать о наличии антигензависимого иммунного ответа у этих больных. Об этом свидетельствует способность периферических В-лимфоцитов спонтанно секретировать АНФ, антитела к ДНК и кардиолипину при СКВ (D.Ora, M.R.Salaman, M.N.Seifert et all., 1988; R.Gorld, P.Airo, F.Franceschini et all., 1990), а также наличие В-клеток, продуцирующих антитела к ДНК и кардиолипину у экспериментальных мышей, предрасположенных к волчаноподобному синдрому (K.Twai, T.Tsubata, Y.Katsura, 1983). Установленный иммуноглобулинов нами при СКВ периферическими высокий лимфоцитами уровень в синтеза присутствии 87 кардиолипина указывает на наличие при этой болезни В-клеток, сенсибилизированных к кардиолипину. В основе повышенного уровня КЗАЛ при СКВ, по-видимому, лежат иммунорегуляторные нарушения и, прежде всего, снижение Т-супрессорной функции лимфоцитов (A.C.Bird, L.Hammerston, C.I.Smith et all., 1981) с последующей гиперактивацией Вклеток на различные аутоантигены, в том числе и на кардиолипин (M.R.Kehry, L.C.Yamashita , R.D.Hodobin, 1990). Появление В-лимфоцитов с цитопатической супрессорной активностью функции к кардиолипину Т-лимфоцитов, на фоне по-видимому, дефицита приводит к неконтролируемому синтезу В-клетками антител к кардиолипину (аКЛ). Появление последних обуславливает при СКВ развитие таких основных клинических проявлений АФС, как тромбоз сосудов, акушерская патология и поражение ЦНС (Е.Л.Насонов, 1998; 2002; 2004; Е.Л.Насонов, З.С.Алекберова, 1999; Т.М.Решетняк, З.С.Алекберова, А.Н.Александрова и др., 2003; З.А.Абдукадырова, Р.И.Руденко, А.Р.Вильданова, 2003; А.Е.Дорохов, 2003; G.R.V.Hughes, 1993; E.N.Harris et all., 1998; E.Gromnica Ihle, M.Schossler, 2000; R.Cervera, J.C.Piette, J.Font, et all., 2002). Важное клиническое значение КЗАЛ состоит в том, что наличие Вклеток чувствительных к кардиолипину, свидетельствует о сравнительно доброкачественной форме СКВ, но с опасностью развития сосудистых тромбозов. Присутствие В-лимфоцитов чувствительных к кардиолипину, при СКВ может быть прогностическим признаком развития сосудистых тромбозов. Особое клиническое значение КЗАЛ при СКВ заключается в том, что данный иммунологический феномен ассоциируется с более благоприятным течением болезни - СКВ с АФС, характеризующимся невысокой активностью болезни, АНФ-негативным вариантом, отсутствием тяжелых висцеритов, отсутствием признаков люпус-нефрита, более высокой продолжительностью жизни, но при этом с высоким риском развития сосудистых тромбозов и спонтанных абортов у женщин. Об этом 88 свидетельствует (В.Ю.Ковалев, полученные нами З.С.Алекберова, данные и С.К.Соловьев, данные 1992; литературы С.Н.Байданов, Н.Н.Нутрихина, Л.Г.Ефимова и др., 1993; Н.Ю.Карпов, А.А.Баранов, Н.П.Шилкина и др.. 1999; Л.К.Козлова, В.В.Багирова, 2003; М.Х.Султанова, Т.С.Солиев, 2003; Н.М.Кошелева, С.И.Хузмиева, Р.А.Фролова, 2004; З.С.Алекберова, Е.С.Мач, Е.В.Герасимова и др., 2004; Ю.В.Ершова, А.А.Баранов, Н.Е.Абайтова и др., 2004; Е.Л.Насонов, 2002; 2004). Таким образом, определение КЗАЛ может быть использовано для диагностики АФС и для прогноза развития сосудистых тромбозов у больных СКВ, а регистрация показателей СПАЛ и СИАЛ может быть использована для уточнения степени активности патологического процесса, диагностики минимальных проявлений активности патологического процесса и решения вопроса целесообразности проведения иммуноактивной терапии при СКВ. 89 ВЫВОДЫ 1. У 28,1% больных системной красной волчанкой выявлены клиниколабораторные признаки антифосфолипидного синдрома. Наличие у больных системной антифосфолипидного благоприятным красной синдрома течением волчанкой признаков ассоциировалось болезни с (невысокая более активность патологического процесса, хроническое течение, отсутствие тяжелых висцеритов), но с высоким риском развития сосудистых тромбозов. 2. Уровень спонтанной В-клеточной активации (по уровням спонтанной пролиферативной активации В-лимфоцитов и спонтанной иммуноглобулинсинтезирующей активации В-лимфоцитов) у больных системной красной волчанкой гораздо выше, чем у здоровых лиц и больных остеоартрозом и ревматоидным артритом. Уровни спонтанной пролиферативной активации иммуноглобулинсинтезирующей В-лимфоцитов активации и спонтанной В-лимфоцитов при системной красной волчанке зависят от степени активности, характера течения и наличия антинуклеарного фактора в сыворотке крови: при III степени активности, остром и подостром течениях и серопозитивном (по наличию антинуклеарного фактора) варианте болезни значения этих показателей достоверно выше, чем при I степени активности, хроническом течении и серонегативном варианте болезни. 3. Уровень антигензависимой В-клеточной активации (по уровню кардиолипинзависимой активации В-лимфоцитов) значительно выше у больных системной красной волчанкой, чем у здоровых лиц, больных остеоартрозом и ревматоидным артритом. Положительный результат кардиолипинзависимой активации В-лимфоцитов обнаружен у 100% больных системной красной волчанкой с антифосфолипидным синдромом. Определение показателя кардиолипинзависимой активации В-лимфоцитов при системной красной волчанке может быть 90 использовано в качестве иммунологического метода диагностики такого особого субтипа болезни как системная красная волчанка с антифосфолипидным синдромом. 4. Исследования показателей спонтанной пролиферативной активации Влимфоцитов, спонтанной иммуноглобулинсинтезирующей активации В-лимфоцитов и кардиолипинзависимой активации В-лимфоцитов в комплексе с клинико-лабораторными иммунологическими данными способствуют и общепринятыми дифференциальной диагностике различных клинических вариантов систомной красной волчанки. 91 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. Обнаружение признаков антифосфолипидного синдрома при системной красной волчанке с одной стороны свидетельствует о благоприятном течении болезни, но с другой стороны является прогностическим признаком высокого риска сосудистых тромбозов. 2. У больных системной красной волчанкой показатели спонтанной пролиферативной активности В–лимфоцитов и спонтанной иммуноглобулинсинтезирующей активности В–лимфоцитов выше 125 усл. ед. и 135 усл. ед. соответственно свидетельствуют о наличии активности патологического процесса. 3. Для диагностики минимальной активности патологического процесса у больных системной красной волчанкой следует определять показатели спонтанной пролиферативной активности В–лимфоцитов и спонтанной иммуноглобулинсинтезирующей активности В-лимфоцитов. При этом в этой группе больных системной красной волчанкой показатели спонтанной пролиферативной активности В–лимфоцитов наблюдаются в пределах 137,4±3,19 усл. иммуноглобулинсинтезирующей ед., а показатель активности спонтанной В–лимфоцитов – в пределах 144,3±3,2 усл. ед. 4. В качестве лабораторного метода диагностики антифосфолипидного синдрома при системной красной волчанке рекомендуется определять показатели кардиолипинзависимой активности В–лимфоцитов и при его значении 200 усл. ед антифосфолипидный синдром. и более можно диагностировать 92 СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ 1. Абдукадырова З.А., Руденко Р.И., Вильданова А.Р. Антифосфолипидный синдром при системной красной волчанке. // Центрально-Азиатский медицинский журнал. - 2003. - том IX. - №6. - С. 344-346. 2. Алекберова З.С., Мач Е.С., Герасимова Е.В. и др. Состояние периферических артерий у больных СКВ и АФС. // Тезисы конгресса ревматологов России. - Саратов. - 2003. - С. 5. 3. Алекберова З.С., Насонов Е.Л., Стаенович Л.З. Гетерогенность системной красной волчанки, обусловленная антифосфолипидным синдромом. // Тер. Архив. - 1992. - №5. - С. 77-79. 4. Алекберова З.С., Решетняк Т.М., Раденска Лоповок С.Г. Васкулопатия у больных системной красной волчанкой с антифосфолипидным синдромом. // Тер. Архив. - 1995. - №5. - С. 41-44. 5. Александрова Е.Н., Насонов Е.Л., Ковалёв В.Ю. Количественный иммуноферментный метод определения антител к кардиолипину в сыворотке крови. // Клиническая ревматология. - 1995. - №4. - С. 35-39. 6. Александрова Е.Н., Новиков А.А., Решетняк Т.М. и др. Антитела к b2гликопротеину- 1 и антитела к кардиолипину при антифосфолипидном синдроме: анализ чувтсвительности и специфичности. // Клин. Медицина. - 2003. -№ 9. - С. 25-31. 7. Байданов С.Н., Н.Н.Нутрихина, Ефимова Л.Г. и др. Возможность клинической диагностики системной красной волчанки при использовании критериев антифосфолипидного синдрома. // Тезис докладов I съезда ревматологов России. - Оренбург. - 1993. - С. 77-78. 8. Баранов А.А., Насонов Е.Л., Шилкина Н.П. и др. Сосудистая патология при антифосфолипидном синдроме. – В кн.: Насонов Е.Л., Баранов А.А., Шилкина Н.П., Алекберова З.С. Патология сосудов при 93 антифосфолипидном синдроме (клиника, диагностика, лечение). - М. 1995. - С. 36-49. 9. Баркаган З.С., Доронов А.Е., Сердюк Т.В. Антифосфолипидная болезнь. // Тезис докладов I съезда ревматологов России. - Оренбург. - 1993. - С. 80-81. 10. Бейум А. Лимфоциты: выделение, фракционирование, характеристика. М. - 1980. – С. 68 . 11. Бененсон Е.В., Панов В.Г., Сейсенбаев А.Ш., Сагандыков Б.Б. Количественная оценка иммуноглобулинсинтезирующей функции периферических лимфоцитов при ревматоидном артрите, сисемной красной волчанке и ревматизме. // Тер. Архив. - 1982. - №6. - С. 37-40. 12. Бененсон Е.В., Сагандыкова С.К., Сагандыков Б.Б. Синтез секреция АНФ лимфоидными клетками перефирической крови человека. // Иммунология. - 1981. - №6. - С. 47-49. 13. Бененсон Е.В., Цай Е.Г. Цитофлюрометрические экспресс показатели функциональной активности лимфоцитов при ревматоидном артрите и системной красной волчанке. // Тер. Архив. - 1990. - №5. - С. 22-27. 14. Бененсон Е.В., Цай Е.Г. Способ определения специфической флюоресценции лимфоидных клеток крови. // Откр. Изобр. - 1987. Бюлл. №29. - А.С.СССР № 1328757. 15. Бененсон Е.В., Цай Е.Г., Лобанченко О.В., Панов В.Г. Синтез и секреция иммуноглобулинов в краткосрочных культурах периферических лимфоцитов при ревматоидном артрите. // Иммунология. - 1990. - №2. С. 55-57. 16. Близнюк О.И. Диагностика и клиническая характеристика поражения центральной нервной системы при системной красной волчанке по данным длительного наблюдения и обследования с помощью компютерной томографии и других методов исследования. Дисс. …канд. мед. наук. - 1990. – С. 145. 94 17. Бородин А.Г., Баранов А.А., Насонов Е.Л. и др. Клинико– патогенетическое значение фактора некроза опухоли-альфа при СКВ. // Тер. Архив. - 2002. - № 5. - С. 32–35. 18. Буланова Т.Д., Ле Го А., Алекбарова З.С. и др. Изучение циркулирующих иммунобластов в периферической крови больных системной красной волчанкой и другими ревматическими заболеваниями. // Тер. Архив. - 1980. - С. 64-67. 19. Джузенова Б.С., Насонов Е.Л., Ковалев В.Ю. и др. Антитела к кардиолипину при острой ревматической лихорадке. // Клин. Медицина. - 1992. - № 2. - С. 66-71. 20. Доронин Б.М., Грибачева И.А., Попова Т.Ф. Ишемический инсульт как проявления катастрофического антифосфолипидного синдрома. // Журнал неврол. и психиатр. - 2003. - № 9. - С. 122. 21. Дорохов А.Е. Опыт лечения антифосфолипидного синдрома. // Научнопрактическая ревматология. - Приложение к №2. - Тезисы конгресса ревматологов России. - Саратов. - 2003. - С. 114. 22. Дядык А.И. // Волчаночный гломерулонефрит. - Донецк. Донеччина. 1995. - С. 196. 23. Ершова Ю.В., Баранов А.А., Абайтова Н.Е. Антитела к кардиолипину и b2- глткопротеину I в группе женщин с невынашиванием беременности в анамнезе. // Тезисы научно-практической конференции «Проблема тромбозов в ревматологии». - Москва. - 2004. - С. 30. 24. Забек Я., Войцеховска И., Биернака Е. Разновидности антифосфолипидных антител у больных системной красной волчанкой и первичным антифосфолипидном синдроме. // Тезисы научно- практической конференции «Проблема тромбозов в ревматологии». – Москва. - 2004. - С. 30. 25. Иванова М.М. ЦНС-Люпус: проблемы и достижения (результаты 10летнего клинико-инструментального исследования) (лекция). // Тер. Архив. - 2001. - № 5. - С. 25-28. 95 26. Ильина А.Е., Клюквина Н.Г., Александрова Е.Н. Атеросклеротическое поражение сосудов при системной красной волчанке и антифосфолипидном синдроме у мужчин. // Клин. Медицина. - 2006. том 84. - № 4. - С. 23-28. 27. Калашникова Л.А. Ишемия мозга и антитела к фосфолипидам. // Журнал неврол. и психиатр. - 2003. - № 9. - С. 131. 28. Калашникова Л.А. Неврология антифосфолипидного синдрома. // Москва «Медицина». - 2003. - С. 256. 29. Калашникова Л.А., Добрынина Л.А., Гнездицкий В.В. и др. Эпилептические припадки при антифосфолипидном синдроме. // Неврологический журнал. - 1999. - № 5. - С. 12-17. 30. Калашникова Л.А., Насонов Е.Л., Кушекбаева А.Е. и др. Синдром Снеддона (связь с антителами к кардиолипину). // Клин. Медицина. 1988. - № 10. - С. 32-37. 31. Калинина Е.Е., Валамина И.Е., Лесняк О.М. Роль нефробиопсии в диагностике патологии почек при антифосфолипидном синдроме. //Научно-практическая ревматология. - Приложение к №2. - Тезисы конгресса ревматологов России. - Саратов. - 2003. - С. 209. 32. Калинина Е.Е., Лесняк О.М. Клинико-морфологические особенности патологии почек при антифосфолипидном синдроме. // Тер. Архив. 2001. - №12. - С. 88-91. 33. Каплас А., Альварес А. Молекулы и клетки: перевод с англ. - М.: Медицина, 1977. - Вып. 6. - С. 287-303. 34. Карнаухов И.Т. // Люминесцетный спектральный анализ клетки. - М.: Медицина, 1978. - С. 218. 35. Карпов Н.Ю., Баранов А.А., Шилкина Н.П. и др. Антитела к кардиолипину при беременности высокого риска. // Клин. Медицина. 1999. - № 4. - С. 19-22. 36. Козлова Л.К., Багирова В.В. Микроциркуляторные нарушения при системной красной волчанке. // Тер. Архив. - 2003. - №5. - С. 41-46. 96 37. Козловская Н.Л., Швецов М.Ю., Козловская Л.В. и др. Поражение почек у больных системной красной волчанкой с антифосфолипидным синдромом и первичным антифосфолипидным синдромом. // Центрально-Азиатский медицинский журнал. - 2005. - Том X. Приложение 5. - С. 33-38. 38. Кошелева Н.М., Хузмиева С.И., Фролова Р.А., Алекберова З.С. Исходы беременности у пациенток с вторичным антифосфолипидным синдромом при системной красной волчанке. // Научно-практическая ревматология. - Приложение к №4. - Тезисы научно-практической конференции «Проблема тромбозов в ревматологии». - Москва. - 2004. С. 14. 39. Красюк А.Н., Панченко Н.А., Дедорович В.И. Способ определения клеточного иммунитета. // Откр. Изобр. 1985. - Бюлл. №31. - А.С.СССР № 1174033. 40. Линг И.Р. // Стимуляция лимфоцитов. - М.: Медицина, 1971. - С. 106. 41. Лисицына Т.А., Тихонова Т.Л., Широкова И.Е. Влияние активности системной красной волчанки на частоту тромбозов. // Научнопрактическая ревматология. - Приложение к № 4. - Тезисы научнопрактической конференции «Проблема тромбозов в ревматологии». Москва. - 2004. - С. 16. 42. Лященко В. А., Дроженников В.А., Молотковская И.М. // Механизмы активации иммунокомпетентных клеток. - М.: Медицина, 1988. - С. 118. 43. Максимов Г.А., Пизова Н.В., Шилкина Н.П., Прилепский Д.А. Состояние сосудов глазного дна у молодых больных системной красной волчанкой. // Научно-практическая ревматология. - Приложение к №2. Тезисы конгресса ревматологов России. - Саратов. - 2003. - С. 264. 44. Мамасаидов А.Т. В-клеточная активация при ревматических заболеваниях. // Дисс. …док. мед. наук. - 14.00.39. - Волгоград. - 1997. 97 45. Мамасаидов А.Т. Гиперактивность Т- и В-лимфоцитов при воспалительных ревматических заболеваниях. // Медицинский вестник. 1998. - № 2. - С. 25-28. 46. Мамасаидов А.Т. Современные методы иммунодиагностики нейролюпуса. // Вестник Ошского Государственного Университета. 2002. - № 5. – С. 32-34. 47. Мамасаидов А.Т., Баймырзаева Г.О, Кулчинова Г.А. Спонтанная Вклеточная активация при люпус-нефрите. // Научно-практическая ревматология. - 2003. - № 2. - С. 248. 48. Мамасаидов А.Т., Мамасаидова Г.М., Таджибаева Ф.Р. и др. Спонтанная пролиферативная активность В- лимфоцитов при ревматоидном артрите, системной красной волчанке и неспецифическом язвенном колите. // Медицинская иммунология. - 2006. –Том 8. - № 4. - С. 557-561. 49. Мамасаидов А.Т., Мурзабаева Г.О., Кульчинова Г.А. Клиническое значение показателя спонтанной пролиферативной активности Влимфоцитов при воспалительных ревматических заболеваниях. // Научно-практическая ревматология. - 2003. - № 2. - С. 249. 50. Мамасаидов А.Т., Юсупов Ф.А., Мурзалиев А.М., Грошев С.А. Клинико-иммунологическое пролиферативной активности значение показателя спонтанной В-лимфоцитов у больных СКВ с поражением нервной системы. // Медицинская иммунология. - 2004. - № 6. - С. 567-572. 51. Мамасаидов А.Т., Юсупов Ф.А. Взаимосвязь показателей В - клеточной активации и клинических проявлений неврологических осложнений при ревматоидном артрите. // Наука и новые технологии. - 2001. - № 3. - С. 21-22. 52. Мамасаидов А.Т., Юсупов Ф.А. Клинико-иммунологические взаимосвязи у больных СКВ. // Вестник ОшГУ. - 2003. - № 4. - С. 115117. 98 53. Мамасаидов А.Т., Юсупов Ф.А., Грошев С.А. Сочетание кардиолипинзависимой В - клеточной активности и поражения центральной нервной системы у больных системной красной волчанкой с антифосфолипидным синдромом. // Южно-Российский медицинский журнал. - 2003. - № 5-6. - С. 76-78. 54. Мешков А.П. Диагностика и лечение болезней суставов. - Н. Новгород: Издательство НГМА, 1999. – С. 78. 55. Насонов Е.Л. Современные подходы к профилактике и лечению антифосфолипидного синдрома. // Тер. Архив. - 2001. - № 5. - С. 82-89. 56. Насонов Е.Л., Алекберова З.С., Калашникова Л.А. и др. Антифосфолипидный синдром (синдром Hughes): 10 лет изучения в России. // Клин. Медицина. - 1998. - № 2. - С. 411. 57. Насонов Е.Л., Алекберова З.С., Карпов Ю.А. и др. Поражение сосудов при ревматических заболеваниях: связь с атеросклерозом. В кн.: Насонов Е.Л., Баранов А.А., Шилкина Н.П. Васкулиты и васкулопатии. Ярославль. - 1999. - С. 574-593. 58. Насонов Е.Л., Алекберова З.С. Антифосфолипидный синдром. // М.: «Наука». - 1999. - 32. - С. 7-11. 59. Насонов Е.Л., Баранов А.А., Шилкина Н.П., Алекберова З.С. Патология сосудов при антифосфолипидном синдроме. // Научно-практическая ревматология. - 1999. - № 2. - С. 10-14. 60. Насонов Е.Л., Иванова М.М., Алекберова З.С. и др. Современные подходы к оценке активности СКВ. // Клиническая ревматология. - 1995. - № 1. - С. 41-48. 61. Насонов Е.Л., Ковалев В.Ю., Алекберова З.С., Соловьев С.К. Прогнозирования развития тромбоза у больных системной красной волчанкой: роль антитела к кардиолипину. // Тер. Архив. - 1992. - № 5. С. 25-30. 62. Насонов. Е.Л. Антифосфолипидный синдром: клиника, диагностика, лечение. // РМЖ. - 2002. - № 10. – С. 22. 99 63. Насонов. Е.Л. Антифосфолипидный синдром. // М. «Литтерра». - 2004.С. 434. 64. Насонова В.А. Клиническая ревматология. // М. «Медицина». - 1999. - С. 412. 65. Насонова В.А. Ревматология: взгляд в XXI век. // Вестник РАМН. - 2003. - № 7. - С. 3-6. 66. Насонова В.А. Справочник по ревматологии. // М. «Медицина». -1995. С. 270. 67. Насонова В.А. Системная красная волчанка. // М. «Медицина». -1972. С. 246. 68. Насонова В.А., Астапенко М.Г. // Клиническая ревматология. - М. «Медицина». - 1989. – С. 320. 69. Насонова В.А., Бунчук Н.В. Ревматические болезни: (Руководство). - М. «Медицина». - 1997. 70. Насонова В.А., Насонов Е.Л. Рациональная фармакотерапия ревматических заболеваний. // М. «Литтера». - 2003. - Том 3. - С. 506. 71. Насонова В.А., Сигидин Я.А. // Патогенетические основы терапии ревматических заболеваний. - М. «Медицина». - 1985. – С. 287. 72. Несмеянова О.Б., Сальникова Е.А., Данилюк И.Н. и др. Особенности клинической картины у больных системной красной волчанкой с вторичным антифосфолипидным синдромом. // Научно-практическая ревматология. - Приложение к №2. - Тезисы конгресса ревматологов России. - Саратов. - 2003. - С. 295. 73. Осеюнин Ю.А, Балабанова Р.М.Комбинированная иммуномодулирующая терапия ревматоидного артрита. // Тер. Архив. 1996. - №5. - С. 13-16. 74. Петрова У.Н., Радыгина Т.В., Лыскина Г.Л., Продеус А.П. // Вопросы гематологии, онкологии и иммунологии в педиатрии. - 2002. - Том. - №1. - С. 90-92. 100 75. Пономарева Е.Н., Синевич П.А., Понамарев В.В., Антоненко А.И. Неврологические нарушения при антифосфолипидном синдроме. // Неврологический журнал. - 2002. - № 2. - С. 22-25. 76. Прудникова Л.З. Клиническое значение волчаночного антикоагулянта и антител к кардиолипину у больных системной красной волчанкой. // Дисс. …канд. мед. наук. - 1990. - С. 103. 77. Решетняк Т.М, Котельникова Г.П, Фомичева О.А. и соавт. Кардиологические аспекты антифосфолипидного синдрома. Часть I. Клапанные поражения сердца при первичном и вторичном антифосфолипидном синдроме и системной красной волчанке. // Кардиология. - 2002. - Том. 7. - С. 38-43. 78. Решетняк Т.М., Алекберова З.С., Александрова А.Н. и др. Клиникоиммунологические аспекты антифосфолипидного синдрома. // Научнопрактическая ревматология. - Приложение к №2. - Тезисы конгресса ревматологов России. - Саратов. - 2003. - С. 341. 79. Решетняк Т.М., Алекберова З.С., Котельникова Г.П. и др. Выживаемость и прогностические факторы риска смерти при антифосфолипидном синдроме: результаты 8-летнего наблюдения. // Тер. Архив. - 2003. - №5. - С. 46-51. 80. Ройт А. // Основы иммунологии. - М. «Мир». - 1991. – С. 376. 81. Смирнов B.C., Малков А.Н., Булатов Л.Б. Метод определения суьпопуляции В-лимфоцитов на проточном цитомере. // Лабораторное дело. - 1990. - № 7. - С. 60-63. 82. Султанова М.Х., Солиев Т.С. Клинические проявления антифосфолипидного синдрома больных системной красной волчанкой. // Научно-практическая ревматология. - Приложение к №2. - Тезисы конгресса ревматологов России. - Саратов. - 2003. - С. 360. 83. Травкина И.В., Иванова М.М., Насонов Е.Л., Вавилов Е.Б. Клиническое значение антител к кардиолипину и ЯМР-томографии при системной 101 красной волчанке с нейропсихическими расстройствами. // Тезисы докладов I съезда ревматологов России. - 1993. - С. 142-143. 84. Цай Е.Г. Определение Функциональной активности лимфоцитов периферической крови при ревматоидном артрите. // Дисс. …канд. мед. наук. - 14.00.36. - Фрунзе. - 1988. – С. 132. 85. Чориев А.Э., Лесняк О.М. Поражение головного мозга при антифосфолипидном синдроме. // Научно-практическая ревматология. Приложение к №2. - Тезисы конгресса ревматологов России. - Саратов. 2003. - С. 405. 86. Чередеев А.Н., Ковальчук Л.В. Интерпретация лабораторных показателей при оценке иммунного статуса человека. // Лабораторное дело. - 1991. - № 2. - С.6-14. 87. Чиркин А.А., Окороков А.Н., Гончарик И.И. // Диагностический справочник терапевта. - Минск. - «Беларусь». - 1993. - С. 688. 88. Широкова И.Е., Лисицына Т.А., Кондратьева Л.В. и др. Факторы риска сосудистых осложнений при системной красной волчанке с и без интифосфолипиидного синдрома (СКВ с/без АФС). // Научно- практическая ревматология. - Приложение к № 4. - Тезисы научнопрактической конференции «Проблема тромбозов в ревматологии». Москва. - 2004. - С. 113. 89. Юсупов Ф.А. В - клеточная активация при системной красной волчанке и ревматоидном артрите с поражением нервной системы. // Дисс. …докт. мед. наук. - 14.00.13. - Алматы. - 2005. 90. Юсупов Ф.А., Мамасаидов А.Т. Кардиолипинзависимая В - клеточная активация при нейролюпусе. // Центрально-Азиатский медицинский журнал. - 2003. - Том IX. - № 1. - С. 37-41. 91. Ярменко О.Б. Современный алгоритм диагностики ревматоидного артирита. // Клиническая иммунология. Аллергология. Инфектология. Киев. - 2004. - № 5. - С. 32-34. 102 92. Aby-Shakra M., Gladman D., Urowitz M.B. Farewell V. Anticardiolipin antibodies in SLE: Clinical and laboratory corvelations. // Am. J. Med. 1995. - vol. 99. - P. 624. 93. Alarcon-Segovia D., Perez-Ruiz A., Vila A.R. Long-term prognosis of antiphospholipid syndrome in patients with systemic lupus erythematosus. // J.Autoimmunity. - 2000. - №. -15. - P. 157-163. 94. Ames P.R., Maargarita A., Delgado Alves J. et all. Anticardiolipin antibody titer and plasma homocysteine level independently predict intima media thickness of carotid arteries I n subjects with idiopathic antiphospholipid antibodies. // Lupus. - 2002. - № 11. - P. 208-214. 95. Arita A., Loper-Longo F.G., Moreno F.C. et all. Association of anti–BB-Sm antibodies with anticardiolipin antibodies and trombosis in patients with systemic lupus erythematosus. // Abstracts of XVIII ILAR Congress of Rheumatology, Barselona, Spain. - 1993 - Abstr. 36. - P. 16. 96. Aronoff D.M, Callen J.P. Necrosing livedo reticularis in a patient with recurrent pulmonary haemorrhage. // J. Am. Acad. Dermatol. - 1997. - Vol. 37. - P. 300-302. 97. Asherson R.A., Mavou S.C., Merrv P. et all. The spectrum of livedo reticularis and anticardiolipin antibodies. // Brit. J. Dermatol. - 1989. - V. 120. - № 2. - P. 215-221. 98. Asherson R.A., Mercey D., Phillips G. et all. Reccurent stroke and multiinfarct dementia in systemic lupus erythematosus: association with antiphospholipid antibodies. // Ann. Of the Rheum. Dis. - 1987. - V. - 46. - P. 605-615. 99. Asherson R.A., The primary antiphospholipid syndrome. // J. Rheumatology. - 1988. - Vol. - 15. - P. 1742-1746. 103 100. Benegtsson A., Holmlund G., Kihlstrm E., Linablom B. Lymphocyte stimulations in Reiter’s syndrome. // Scand. J. Rheum. - 1985. - Vol. 14. - № 4. - P. 381-385. 101. Bich-Thuy L., Fauci A.S. Recombinant interleukin and gamma interferon act synergistically on distinet steps of in vitro terminal human B cell maturation. // J. Clin.Invest. - 1986. - V. 77. - P. 1173-1176. 102. Bird A.C., Hammerston L., Smith C.I. et all. Polyclonal humant T lymphocytes activation results in the secondary functional activation the human B lymphocytes. // Clin. And Exp Immunol. 1981. - V. 53, N1. - P. 165-169. 103. Blasini A.M., Stekman I.L.., Conzalez F et all. // Clin.Immunopatol 1994. – V. 70. – P. 66-72. 104. Branch D.W, Porter T.F, Rittenhouse L et all. Antihospholipid antibodies in women at risk for preeclampsia. // Am. J. Obstet. Gynecol. - 2001. - Vol. 184. - P. 825. 105. Branch D.W., Anders R., Digre K.D. The association of antiphospholipid antibodies with severe preeclampsia. // Obstet. and Gynec. - 1989. - Vol. 73. P. 541-545. 106. Brey R.L., Levine S.R. APL and the breine: treatment. // Lupus. - 2002. - 11 (9). - 559 (abstr.). 107. Burns G.F., Pike B.L. Spontaneous reverse haemolytie plaque formation 1. Technical aspects of the protein A assay. // J. Immunol. Meth. - V. 41, N3. P. 269-274. 108. Cameron J.S. Systemic lupus erythematosus. In: E.G. Neilson, W.G. Couser Immunologic renal diseases. // Philadelphia. W.B.Saunders. - 1997. - P. 10551098. 109. Caporall R., Ravelli A., Defennaro F., et all. Prevalence of anticardiolipin antibodies in juvenile chronic arthritis. // Ann. Rheum Dis. - 1991. -Vol. 50. № 9. - P. 599-601. 104 110. Carbone J, Sanchez-Ramon Cobo-Soriano S. et all. Antiphospholipid antibodies: A risk factor for occlusive retinal vascular disorders. Comparison with ocular inflammatory diseases. // J. Rheumatol. - 2001. - Vol. 28. - P. 2437. 111. Carreras L., Maclouf J., Tobelen G. Physiopathologie du syndrome des antiphospholipides. // STV. Sanol. Trombes, vaisseaux. - 1992. - Vol. 4. - № 3. - P. 855-859. 112. Cervera R., Khamashta M.A., Font J. Morbidity and mortality in systemic lupus erythematosus during a 5-year period: a multicenter prospective study of 1,000 patients. European working party on systemic lupus erythematosus. // Medicine Baltimore. - 1999. - Vol. - 78. - P. 167-175. 113. Cervera R., Piette J.C., Font J. et all. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of diseaseexpression in a cohort of 1,000 patients. // Arthritis Rheum. - 2002. - Vol. 46. - P. 1019. 114. Chartash E.K, Lans D.M, Paget S.A. et all. Aortic insufficiency and mitral regurgitation in patient with systemic lupus erythematosus and the antiphospholipid syndrome. // Am. J. Med. - 1989. - Vol. 86. - P. 407-412. 115. Christophe B., Maureen H. Autoimmunity Curr. // Opt. Immunol. - 2000. Vol. 12. - P. 661-663. 116. Combe B. Immunologe de sa polyarthrite rheumatoide. Influence des treitements de fond. // Rev. Rheumatol. - 1989. - Vol. 56. - № 5. - P. 30-33. 117. Coons A.H., Kaplan M.H. Lokalizations of antigen in tissue cells II. Impovements in a method for the detection of antigen by means of fluorescent antibody. // L. Exp. Med. - 1950. - V. 91. - P. 1-13. 118. Cuchens M.A., Buttke T.M. A kinetic study of membrane immunoglobulin capping by flow cytometry. // Cytometry. - 1984. - V5, N6. - P. 601-604. 119. Cucurul E, Gharavi A.E, Diri E. et all. IgA anticardiolipin and anti-B2glycoprotein-I are the most prevalent isotypes in African American patients with systemic lupus erythemathosus. // Am. J. Med. Sci. - 1999. - Vol. 418. P. 55-60. 105 120. Davidson Е.М., Ral S.A., Smith M.J. // Ann. Rheum. Dis. - 1983. - Vol. 43. - P. 677-679. 121. Dayal А.К., Kammer G.M. // Arthr. Rheum. - 1996. - № 39. - P. 23-33. 122. Dean G.S., Tyrrei-Price J., Grawley E. et all. Cytokines and systemic lupus erythematosus. // Ann. Rheum. Dis. - 2000. - Vol. 59. - P. 243-251. 123. Denzlinger C., Guhlmann A., Scheuber P.H. et all. Metabolism and analysis of cysteiny leukotrienes in the monkey. // J. Biol. Chem. - 1996. - № 261. - P. 124. Derksen R.H., Hasselaan F., Blokzije L. et all. Cjfgulation serene is more speciphic than a CL ELISA in defining a thrombotic subet of lupus patients. // Ann. Rheum. Dis. - 1988. - Vol. 47. - P. 364-371. 125. Enzmann H., Mollenhauer J., Brune K. Humoral autoimmunity to cartilage in rheumatoid arthritis. // Agents and Action. - 1990. - Vol. 29. - № 1-2. - P. 114-116. 126. Erkan D, Roman M.J, Tenedios F, Lockshin M.D. Cardiac involvement in the antiphospholipid syndrome. // In. The Heart in Systemic Autoimmune Disease. Ed. A. Doria, P. Pauletto. Elseiver, Amsterdam, Boston, Heidelberg. - 2004. - P. 213-225. 127. Escalante A, Brey R.L, Mitchel B.D et all. Accuracy of antocardiolipin antibodies in identifying a history of thrombosis among patients with systemic lupus erythematosus. // Am. J. Med. - 1995. -Vol. 98. - P. 559-565. 128. Fauci A.S. // Progress in clinical immunology. The Role of chemical Mediators and celleular interactions-Basel. - 1983. - P. 96-105. 129. Fields R.A., Sibbit W.L., Toubbeh H., Bunkhurst A.D. Neuropsychiatric lupus erithematosus, cerebral infarction and anticardiolipin antibodies. // Ann. Rheum. Dis. - 1990. - Vol. 49. - P. 114-117. 130. Fox D.A., Millard J.A. Treisman J. et.all. Ibid. - 1991. - Vol. 34. - P. 561571. 131. Frances C., Tribout B., Boisnic S. et all. Cutaneous necrosis associated with the lupus anticoagulant. // Dermatologica. - 1989. - Vol. 178. - P. 194-201. 106 132. Gebhard J., David F., Millelman A. et all. Comparative analysis of surface membrane immunoglobuline delermination by flow cytometry and fluoresccenc microscopy. // J. Histochem and Cytochem. - 1986. - V. 34, N4. - P. 475-479. 133. Gitmann R.D., Poulsen R.S. Fluorescence activated cell sorter analisis of lympocyte after renal transplantation. // Transplant. Bros. - 1983. - V. 18, N1. - P. 1160. 134. Gold D., Morris O.A., Henkind P. Ocular findings in systemic lupus erythematosus. // British J. of Ophthalmol. - 1972. - Vol. 56. - P. 800-804. 135. Gomez-Pacheco L., Villa A.R., Drencard C et all. Serum anti-β-glycoprotein I and anticardiolipin antibodies during trombosis in systemic lupus erytematosus patients. // Am. J. Med. - 1999. - Vol. 106. - P. 417-423. 136. Gorld R., Airo P., Franceschini F. et all. Decreases number of peripheral blood CD 4+, CD 29+ lymphocytes and increased in vitro spontaneous production of anti-DNA antibodies in patients with active systemic lupus erythematosus. // J. Rheumatol. - 1990. - Vol.17. - P. 1048-1053. 137. Gresswell P. Antigen recognition by T-lymphocytes. // Immunology Today. - 1987. - V. 8. - P. 67. 138. Gromnica Ihle E., Schopler W., Franz J. Clinical significance of antiphospholipid antibodies in patients with rheumatic disease. // Hung. Rheum. - 1991. - Suppl. - P. 115. 139. Gromnica Ihle E., Schossler M. Antiphospholipid syndrome. // Int. Arch. Allergy Immunol. - 2000. - Vol. 123. - P. 67. 140. Hahn B.H. Systemic lupus erythematosus and accelerated atherosclerosis. // New Engl. J. Med. - 2003. - Vol. 349. - P. 2379-2380. 141. Hansen E.S., Fogn K., Hjortdal V.E. et all. Synovitis reduces by ingibition of leukotriene B4. Carrageenan-inductt gonartritis studies in dogs. // Acta. Orthop. Scand. - 1990. - Vol. 61 (3). - P. 207-212. 142. Harris E.N. Antiphospholipid antibodies. // Brit. J. Haemat. - 1990. - Vol. 74. - P. 1-9. 107 143. Harris E.N., Pierahgeli S.S. “Equivocal” antiphospholipid syndrome. // J. Autoimmmihity. - 2000. - Vol. 15. - P. 81-85. 144. Harris E.N., Pirangeli S.S., Gharavi A.E. Diagnosis of the antiphospholipid syndrome a for use of Laboratory tesis. // Lupus. - 1998. Vol. 7 (Suppl). - P. 144-148. 145. Hojnik M., George J., Ziporen L., Shoenfeld Y. Heart valve involvement (Libman-Sacks Endocarditis) in the antiphospholipid syndrome. // Circulation. - 1996. - Vol. 93. - P. 1579. 146. Hornstein M.D., Davis O.K., Massey J.B. et all. Antihospholipid antibodies and in vitro fertilization success: a meta-analysis. // Fertil Steril. - 2000. -Vol. 73. - P. 330. 147. Hrneir Z.B., Chycova V. Anticardiolipinove protelatky u difuznich nemoci pojiva. // Vnitr. Lek. - 1990. - Vol. 36. - № 1. - P. 1041-1049. 148. Hughes G.R.V. Antiphospholipid syndrome. // Lancet. - 1993. - Vol. 15. - P. 81-85. 149. IIfela D.N., Cathcart M.K., Krakauer P.S. et all. Human splenik and perifpheral blood lymphocyte response to lypopoly saccaride. // Cell Immunol. - 1981. Vol. 57, N2. - P. 400-402. 150. Ishii J., Magasama K., Mayumi I. et all. Clinical importance of anticardiolipin antibodies in systemic lupus erythematosus. // Ann. Rheum. Dis. - 1990. - Vol. 49. - № 6. - P. 387-390. 151. Johnson J.G., Jemmerson R. Relative frequencies of secondary B-cells activated by cognate vs. other mechanism. // Eur. J. Immunol. - 1991. - Vol. 21. - № 4. - P. 951-958. 152. Jokinen I., Poikenen K., Mottenen T. et all. Analysis of impaired in vitro immunoglobulin synthesis in rheumatoid arthritis. // Ann. Rheum. Dis. 1990. - Vol. 49. - P. 507-601. 153. Jokinen J., Poikonen K., Arvilomni H. Synthesis of human immunoglobilins in vitro. Comparison of two assays of secrated immunoglobilins. // J. Immunoassay. - 1985. - Vol. N1-2. - P. 1-7. 108 154. Juliane F., Werner S., Erika G.-I. Auffan eines Enzimimmunoassays zum Nachweis von Anti-Cardiolipin Antikorpern. // L. Klin. Med. - 1991. - Bd. 46. - № 4. - P. 255-258. 155. Julius M.H.A. Postulated role for the induction of bustlander resting B- cell differentiation. // Res. Immunol. - 1990. - Vol. 141. - P. 443-446. 156. Jurgensen C.H., Ambrus J.L., Fauci A.S. Production of B-cell grwth factor by normal B-cell. // J. Immunol. - 1986. - Vol. 136, N12. - P. 4542-4547. 157. Jаhn S., Kiessing S.T., Lucowsky A. et all. Pokeweed-mitiogen induced sythests of human IgM in vinto Tehnical aspects and the role of odherent cells aspects and the role of odherent cells. // Biomed.Biochem acta. - 1986. - N4. P. 467-471. 158. Kageyama Y., Koide Y., Miyamoto S. et all. Leukotrien B 4-indused interleukin-1 beta in synovial cells from pacients with rheumatoid arthritis. // Scand. J. Rheumatol. - 1994. - Vol. 23 (3). - P. 148-150. 159. Kalinian K.C., Peter V.B., Middlekauf H.R. et all. Clinical significanct of a single test for aCL in patients with SLE. // Amer. J. Med. - 1988. - Vol. 85. P. 602-607. 160. Kallenberg G.M., Van Bissel-Emiliani F., Muitema M.G. et all. B-cell proliferation and differentation in systemic lupus eritematosus and mixed connective tissue disease. // J. Clin. and Lab. Immunol. - 1988. - Vol. 26, N2. - P. 55-61. 161. Kammer G., Khan I., Malemud C. Mechanisms of autoimmune disease induction. The role of immune response to microbial pathogens. // J. Clin. Invest. - 1994. - Vol. 94. - P. 422-430. 162. Kammer G.M., Mishra N. Systemic lupus erythematosus in the elderly. // Rheum. Dis. Clin. North. Am. - 2000. - Vol. 26. - P. 475-492. 163. Kammer G.M., Stein R.L. J. // Lab. Clin. Med. - 1990. -Vol. 115. - P. 273282. 164. Kavakamei T., Kuruta N., Tucuda M. et all. Heterogeneity of anticardiolipin antibody. // Ryumachi. - 1991. - Vol. 31. - № 2. - P. 157-158. 109 165. Kehrl J.H., Muragushi J.l., M.Falkoff R.J. et all. Human B-cell activation, proliferation and differentiation // Immunol. Reviews. - 1984. - V.78. - P. 7596. 166. Kehry M.R., Yamashita L.C., Hodobin R.D. B-cell proliferation and differentiation mediated by T-cell membranct and lymphokines. // Res. Immunol. - 1990. - P. 421-423. 167. Kelley W. Textbook of rheumatology. // Lippincott Williams &Wilikins, London. - 1997. - P. 1028-1039. 168. Khaliti., Cooper R.C. A stady of immune resporenses to myelin cardiolipin in patients with systemic lupus eritematosus (SLE). // Clin. and Exp. Immunol. - 1991. - Vol. 85. № 3. - P. 365-372. 169. Khamashta M.A., Wallington T. Management of the antiphospholipid syndrome. // Ann. Rheum. Dis. - 1991. - Vol. 50. - № 12. - P. 959-962. 170. Klamashta M.A., Cervera R., Asherson R.A. et all. Association of antibodies against phospholipids with heart valve disease in systemic lupus eritematosus. // Lancet. - 1990. - № 8705. - P. 1541-1544. 171. Klaus G.B., Bijsterboch M.B., Holman I. Signals for activation and proleferation of murine B-cell. Lonophors aclium ave nonmitogen polyclonal activators for B-cells. // Immunology. - 1985. - Vol. 56, N2. - P. 191-194. 172. Kleiner R.C., Najarian I.V., Schatten S. et all. Vaso-occlusive retinopathy associated with antihospholipid antibodies (lupus anticoagulant retinopathy). // Ophthalmology. - 1989. - Vol. 96. - P. 896-904. 173. Kunori T., Rinkden O. Antibody secretion and DNA synthesis indused by lypopolysacharide in enriched human lymphocyte subpopulation. // Scand. J. Immunol. - 1980. - Vol. 11. - № 2. - P. 137-141. 174. Lee R.M., Emlen W., Scott J.R. et all. Antibeta2-glycoprotein I antibodies in women with recurrent spontaneous aborton, unexplained fetal death, and antihospholipid syndrome. // Am. J. Obstet. Gynecol. - 1999. - Vol. 181. - P. 642. 110 175. Leung W.H., Wong K.L., Lau C.P. et all. Association between antiphospholipid antibodies and cardiac abnormalities in patient with systemic lupus erythematosus. // Am. J. Med. - 1990. - Vol. 89. - P. 411-419. 176. Levine S.R., Salowich-Palm L., Sawaya K.L. et all. IgG anticandiolipin antibody titer >40 GPL and the risk of subsequent thorombo-ocdusive events and death. // A prospective cobort study. Storke. - 1997. - Vol. 28. - P.1660. 177. Levinson A.J., Oziarski A., Penius T. et all. Heterogeneity of pokyclonal Bcell activity in SLE. // J. Clin. Lab. Immunol. - 1981. - Vol. 5, N1. - P17-22. 178. Lincer-Israeli M., Bakke A., Kitridou R. et.al. // Immunol. - 1983. - Vol. 30. - P. 2651-2656. 179. Love P.E., Santoro S.A. Antiphospholipides: anticardiolipin and the lupus anticoagulant in systemic lupus eritematosus (SLE) and non-SLE disorders. // Ann. Inter. Med. - 1990. - Vol. 112. - P. 682-698. 180. Luc C., Kiyon H., McGhee J. et all. Recombinant human interleukin 6 (rhil6) promotes the terminal differentiation of in vivo activated human B-cells into antibody-secretind cells. // Cell. Immunol. - 1991. - Vol. 192. - P. 423432. 181. Ludeman J., Utecht B., Gross W.L. Protein A-plaquer test und ELISA: Vergbeich zweier methoden zur B zell function analyse. // Immun. and Infek. - 1985. - Vol. 13, N4. - P. 139-143. 182. Mackworth-Yong C. Antiphospholipid antibodies: more than just a disease marker. // Immunol. Today. - 1990. - Vol. - 11. - P. 60-69. 183. Magaro M., Mirone L., Altomoute L. et all. Lack of correlation between antibodies and peripheral autonomic nerve involvement in systemic lupus erythematosus. // Clinical Rheumatology. - 1992. - Vol. 11. - № 2. - P. 231234. 184. Mayer L. Thompson synergy between B- cell differentiation factors and interleukin-2 using a monoclonal system. // J. Immunol. - 1985. - Vol. 13. - № 3. - P. 3272-3276. 111 185. McCrae K.R. Antiphospholipid antibody associated thrombosis: a consensus for treatment. // Lupus. - 1996. - Vol.5. - P. 560. 186. McNeil H.P., Chesterman C.N., Krilis S.A. Immunology and clinical importence of antipholipid antibodies // Advanc.Immunol. - 1991. - Vol.49. P.100-160. 187. Milanese C., Bensussan A., Reinhers E. et al. Clonal analysis at B-cell growth and differentiation activities induced T-lymphocytes upon triggering of T 3-, T 1- and T 2-pathways. // J. Immunol. - 1985. - Vol. 135. - № 3. - P. 1884-1886. 188. Morrow J.W., Nelson L., Watts R. et all. Autoimmine rheumatic disease. - 2 nd ed. - Oxford: Oxford University Press. – 1999. – P. 236. 189. Mudde G.C., Van Dan D., de Gast G.C. Human Peripheral blood B-cell subpopulations: surface IgD cells respons to pokeweed mitogen with plasma cell differentiation // Clin. and Exp. Immunol. - 1986. - Vol. 64, N1. - P. 150153. 190. Nasonov E.L., Kovalev V.Yu., Alekberova Z.S., Soloviev S.K. Prediction of thrombosis in patients with systemic lupus erythemathosus: the role of antibodies to cardiolipin. // Sov. Arch. Intern. Med. - 1992. - Vol 64. - P. 348353. 191. Neilson E.G., Couser W.G. Immunologic renal diseases. // Philadelphia. W.B.Saunders. - 1997. - P. 1055-1098. 192. Nesher G., Ilany J., Rosenmann D., Abraham A.S. Valvular dysfunction in antiphospholipid syndrome: prevalence, clinical features, and treatment. // Semin. Arthritis Rheum. - 1997. - Vol. 27. - P. 27-35. 193. Neville C., Rauch J., Kassis J. et all. Thrombotic risk in patients with high titre anticardiolipin and multiple antibodies. // Thromb Haemost. - 2003. Vol. 90. - P. 108. 194. Nihoyannopoulos P., Gemez P.M., Joshi J. et all. Cardiac abnormalities in systemic lupus erythematosus. Association with raised anticardiolipin antibodies. // Circulation. - 1990. - Vol. 82. - P. 369-375. 112 195. Nisonoff A. Introductioh of Molecular immunology. // Sinauer Assoc. Mass. USA. - 1982. - P. 98. 196. Nochy D., Daugas E., Droz D. et all. The intrarenal vascular lesions associated with primary antiphospholipid syndrome. // J. Am. Soc. Nephrol. 1999. - Vol. 10. - P. 507-518. 197. Nouri-Aria K.T., Hegarty J.E., Alexander G.J. et all. IgG production in autoimmune chronic active hepatitis. Effect of prednisolone on T- and BLymphocyte Function. // Clin. and Exp. Immonol. - 1985. - Vol. 61. - P. 290. 198. Oamar T., Levy R.A., Sammaritano L. et all. Characteristics of high-titer IgG antiphospholipid antibody in systemic lupus erythematosus patients with and fetal death. // Arthr. Rheum. - 1990. - Vol. 33. - № 4. - P. 501-504. 199. Okudaira K., Searles R., Ceuppens J. et.al. // J. Clin. Invest. - 1982. -Vol. 69. - P. 17-24. 200. Ora D., Salaman M.R., Seifert M.N., Isenberg D.A. B-lymphocyte activation in systemic lupus erythematosus: Spontaneous production of IgG antibodies to DNA and environmental antigens in cultures of blood mononuclear cells. // Clin. and Exp. Immunol. - 1988. - Vol. 73. - № 3. - P. 430-435. 201. Oshiro B.T., Silver R.M., Scott J.R. et all Antiphospholipinid antibodies and fetal death. // Obstet. Gynecol. - 1996. - Vol. 87. - P. 489. 202. Out H.J., De Groot Ph.G., Hasselaar P. et all. Fluctuations of anticardiolipin antibody levels in patients with systemic lupus erythematosus. // Ann. Rheum. Dis. - 1989. - Vol. 48. - № 12. - P. 1023-1028. 203. Peltola J.T., Haapala A., Jsojarvi J.T. et all Antiphospholipid and antinuclear antibodies in patients with epilepsy or new-onset seizure disorders. // Amer. J. Med. - 2000. - Vol. 109. - P. 712-717. 204. Pelton B.K., Spekmaier M., Hylton W. et all. Cytokine-independent progression of immunoglobulin production in vitro by B-lymphocytes from patients with systemic lupus erythematosus. // Clin. and Exp. Immunol. 1991. - Vol. 83. - №3. - P. 274-279. 113 205. Peres-Vasguez M.E., Cabiedes J., Cabral A.R., Alareon-Segovia D. Decrease in serum antiphospholipid antibody levels upon development of nephritic syndrome in patients with systemic lupus erythematosus: Relationship to urinary loss of IgG and other factors. // Amer. J. Med. - 1992. - Vol. 92. - №4. - P. 357-362. 206. Piette J.C., Wechsler B., Larari R. et all. Un nouveau venu: le syndrome des antiphospholipides. // Semin. Hop. Paris. - 1991. - Vol. 67. - № 40-41. - P. 1845-1847. 207. Poikonen K., Oka M.,Mottonen T. et all. Synthesis of IgM, IgG and IgA in rheumatoid arthritis. // J. Rheum. - 1982. - Vol, N6. - P. 607-611. 208. Reddel S.W., Krilis S.A. Testing for and clinical sighificance of anticardiolipin antibodies. // Clin. Diagn. Lab. Immunol. - 1999. - Vol. C. - P. 775-782. 209. Rigler R. Microfluoremetric characterization an interacellular nucleis acids and nucleoproteins by acridine orange. // Actaphysiol. Seand. - 1966. - Vol. 67, Suppl. - P. 267-268. 210. Rooijen van N. Direct intrafollicular differentiation of memori B-cells into plasma cells. // Immunol. Today. - 1990. - Vol. 11. - № 5. - P. 154-156. 211. Rosenthal M. Cellular immune mechanism in the patogenesis of rheumatoid arthritis. // Symp.Med.Hoechst. - 1976. - Vol. 11. - P.67-78. 212. Ruiz-Irastorza G., Khamashta M.A., Castellino G., Hughes G.R.V. Systemic lupus erythematosus. // Lancet. - 2001. - Vol. 357. - P. 1027-1032. 213. Samarcos M., Asherson R.A., Loizou S. The clinical significance of IgA antiphospholipid antibodies. // J. Rheumatol. - 2001. - Vol. 28. - P. 694-697. 214. Samaritano L.R., Ng S., Sobel R. et all. Anticardiolipin IgG subclass. Assosiation of IgG2 with arterial and/or venous thrombosis. // Arthritis Rheum. - 1997. - Vol. 40. - P. 1998-2006. 215. Samarkos M., Davles K.A., Gordon C. et all. JgG subclass distribution of antibodies against B2-GPT and cardiolipin in patient with systemic lupus 114 erythematosus and primany antiphospholipid syndrome and their clinical associations. // Rheumatiology. - 2001. - Vol. 40. - P. 1026-1032. 216. Sanna G., Bertolaccini M.L., Cuadrado M.J. et all. Neuropsichiatric manifestations systemic lupus ery thematosus: prevalence and association with antiphospholipidantibadies. // Rheumatilogy. - 2003. – Vol. 30. - P. 985992. 217. Schulze P., Sima D., Ziegler H. et all. Uber das Vorkommen und die Bedeutung von Anti-phospholipid-Antikorpern bei Autoimmunerkrankungen. // Dermatol. Monatssehr. - 1991. - Bd. 177. - № 6. - P. 325-332. 218. Shur P.H. Epidemiology and pathogenesis of systemic lupus erythematosus. // Up Today. - 2002. – P. 1-2. 219. Sebastiani G.D., Galeazzi M., Tinicani A. et all Anticandiolipin and antibeta 2 GPI antibodies in a large sevies of European patents with SLE. Prevalence and clinical associations. European Concerted Action on the Immunogenetics of SLE. // Scand J. Rheuwatil. - 1999. - Vol. 28. - P. 344. 220. Selva-O´Callaghan A., ordi-Ros J., Monegal-Ferran F. et all. IgA anticandiolipin antibodies-relation with other antiphospolipid antibodies and clinical significance. // Throwb Haemost. - 1998. - Vol. 79. - P. 282-285. 221. Sieber G., Breyer H.G., Hermann F. et all. Abnormalities of B-cell acnivation and immunoregulation in splenoctomized patients. // Immunobiology. - 1985. -Vol. 169, N3. - P. 263-267. 222. Sigfusson A., Bubbage J.M., Souhami R.L. Defective in vitro antibody production in peponse to pokeweed mitogen and influenza antigen in patients with Hodgkin ,s diseases. // Clin. and Exp.Immunol. - 1985. - Vol. 60, N2. - P. 396-403. 223. Strand V. Вiologic agents and innovative interventional approaches in the management of systemic lupus erythematosus. // Curr.Opin. Rheum. - 1999. Vol. 11. - P. 330-349. 115 224. Stunz L.L., Felbuch T.L. Polyclonal activation of rat B-cells. A single mitogenic signal can stimulate proliferation, but three signals are recuired for differentiation. // J. Immunol. - 1986. - Vol. 136. - №11. - P. 4006-4011. 225. Sullivan K.Е. Genetics of systemic lupus erythematosus. Clinical implications. // Rheum. Dis. Clin. North Am. - 2000. - Vol. 26. - P. 229- 256. 226. Surh C., Sprent J. Howeostatic T-cell proliferation. How far can T-cells be actvated to self-ligands? // J.Exp.Med. - 2000. - Vol. 192; P. 8-14. 227. Takeuchi T. Spontaneous production of antibodies deoxyribonucleic acids in patients with systemic lupus erythematosus. // Clin. Immunol. Immunopath. 1985. - Vol. 35. - № 1. - P. 47-56. 228. Tan P., Paud G., Wilson J.D. Immunoglobulin production in vitro by peripheral blood lymphocytes in systemic lupus erythematosus: helper T-cell defect and B-cell hyperactivity. // Clin. and Exp. Immunol. - 1981. - Vol. 45. № 3. - P. 548-553. 229. Ticani A., Balestrieri G., Allergi F. et all. Overview on anticardiolipin Elisa standrtixation. // J. Autoimmunity. - 2000. - Vol. - P. 195-197. 230. Twai K., Tsubata T., Katsura Y. Qualitative difference of anti-DNA antibody cell precursors in the pre-immume B-cell repertoire between normal and lupus pron mice. // Clin. and Exp. Immunol. - 1983. - Vol. 85. - № 1. - P. 106-111. 231. Unander M.A., Norberg R.-A.L., Enskog A. et all. Opinions on treatment of women with habitual abortion based on investigations for blocking antibody and autoantibodies. // AJKT: Amer. V. Reprod. - 1991. - Vol. 26. - № 1. - P. 32-37. 232. Uramoto K.M., Michet C.J., Thomboo J., O’Fallon W.M. Trends in the incidence and mortality of systemic lupus erythematosus. // Arthritis Rheum. - 1999. - Vol. 42. - P. 46-50. 233. Urowitz M.B., Gladman D.D. Evolving spectrum of mortality and morbidity in systemic lupus erythematosus (SLE). // Lupus. - 1999. - Vol. 8. - P. 253255. 116 234. Wallace D.J. Aphaeresis for lupus erythematosus. // Lupus. - 1999. - Vol. 8. - P. 174-180. 235. Wallace D.J., Hahn B.N. Dubois lupus erythematosus. Lippincott-Raven Pblishers, Baltimore, 5-th edition. 1997. 236. Wangel A.G., Milton A., Egan B. Spontaneous plague forming cells in the peripheral blod of patients with systenic lupus erythematosus. // Immunology. - 1981. - Vol. 159, N1. - P.157-163. 237. Wong K-L., Liu H-W., Ho K. et all. Anticardiolipin antibodies and lupus anticoagulant in Chinese patients with systemic lupus erythematosus. // J.Rheumatol. - 1991. - Vol. 18. - № 8. - P. 1187-1192. 238. Yoshiva T., Eumihico S., Tushiyuci O. et all. Mechamism of spontaneous of activation of B-cells in B in potens with systemic lupus erythermatosus. Analysis with (systemic lupus) anti-class II antibody. // J. Immunol. - 1998. Vol. 14, N3. - P. 761-767. 239. Zhang M., Tracey K. J. Tumor necrosis factor. In: Thomson A. W., ed. // The cytokine handbook, 3rd ed, New York Academic Press. - 1998. - P. 515548. 240. Zola H. Regulation of B-cell diffentiation // Patology. - 1985. - Vol. 17. - P. 365-381.