Уравнение состояния
реклама
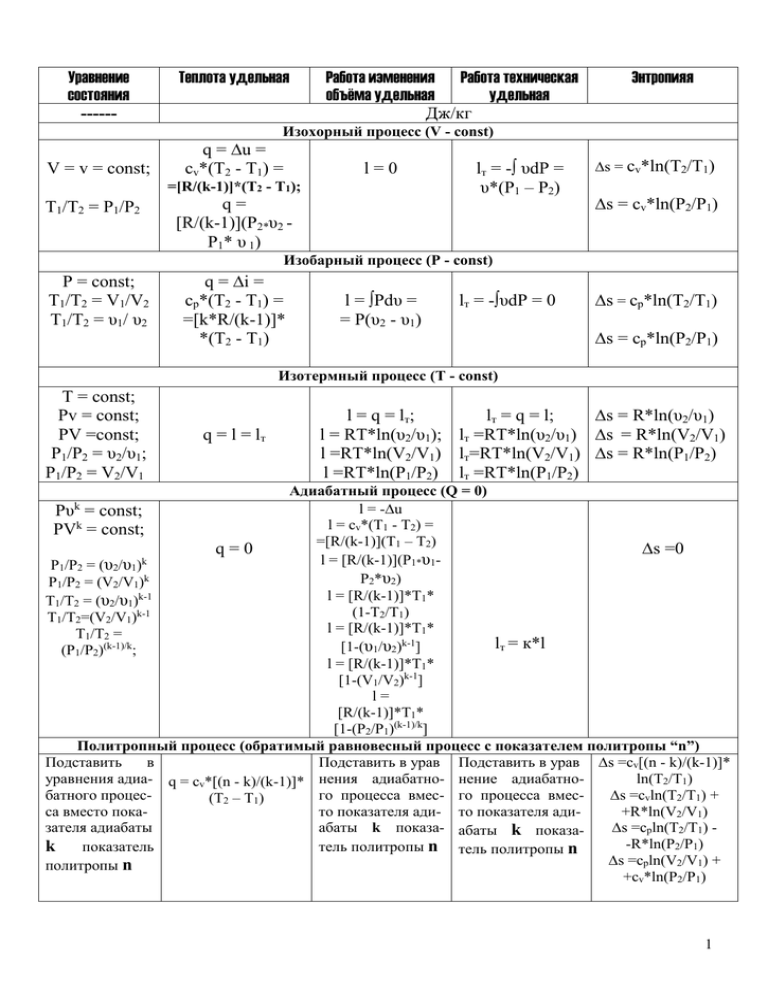
Уравнение состояния ------ Теплота удельная Работа изменения Работа техническая объёма удельная удельная Дж/кг Энтропияя Изохорный процесс (V - const) V = v = const; q = ∆u = cv*(T2 - T1) = l=0 =[R/(k-1)]*(T2 - T1); T1/T2 = P1/P2 lт = -∫ υdP = υ*(P1 – P2) q= [R/(k-1)](P2*υ2 P1* υ 1) ∆s = cv*ln(T2/T1) ∆s = cv*ln(P2/P1) Изобарный процесс (P - const) P = const; T1/T2 = V1/V2 T1/T2 = υ1/ υ2 q = ∆i = cp*(T2 - T1) = =[k*R/(k-1)]* *(T2 - T1) l = ∫Pdυ = = P(υ2 - υ1) lт = -∫υdP = 0 ∆s = cp*ln(T2/T1) ∆s = cp*ln(P2/P1) Изотермный процесс (T - const) T = const; Pv = const; PV =const; P1/P2 = υ2/υ1; P1/P2 = V2/V1 q = l = lт l = q = l т; lт = q = l; ∆s = R*ln(υ2/υ1) l = RT*ln(υ2/υ1); lт =RT*ln(υ2/υ1) ∆s = R*ln(V2/V1) l =RT*ln(V2/V1) lт=RT*ln(V2/V1) ∆s = R*ln(P1/P2) l =RT*ln(P1/P2) lт =RT*ln(P1/P2) Адиабатный процесс (Q = 0) l = -∆u Pυ = const; k l = cv*(T1 - T2) = PV = const; =[R/(k-1)](T1 – T2) q=0 ∆s =0 l = [R/(k-1)](P1*υ1P1/P2 = (υ2/υ1)k P2*υ2) P1/P2 = (V2/V1)k l = [R/(k-1)]*T1* T1/T2 = (υ2/υ1)k-1 (1-T2/T1) k-1 T1/T2=(V2/V1) l = [R/(k-1)]*T1* T1/T2 = lт = к*l (k-1)/k [1-(υ1/υ2)k-1] (P1/P2) ; l = [R/(k-1)]*T1* [1-(V1/V2)k-1] l= [R/(k-1)]*T1* [1-(P2/P1)(k-1)/k] Политропный процесс (обратимый равновесный процесс с показателем политропы “n”) Подставить в Подставить в урав Подставить в урав ∆s =cv[(n - k)/(k-1)]* уравнения адиа- q = cv*[(n - k)/(k-1)]* нения адиабатно- нение адиабатноln(T2/T1) батного процесго процесса вмес- го процесса вмес∆s =cvln(T2/T1) + (T2 – T1) са вместо покато показателя ади- то показателя ади+R*ln(V2/V1) зателя адиабаты абаты k показа- абаты k показа∆s =cpln(T2/T1) -R*ln(P2/P1) k показатель тель политропы n тель политропы n ∆s =cpln(V2/V1) + политропы n +cv*ln(P2/P1) k 1 Удельная внутренняя энергия и удельная энтальпия рабочего тела (вне зависимости от термодинамического процесса): ∆u = cv*(T2 – T1); ∆i = cp*(T2 – T1). Уравнение состояния: * * PV = (M/μ)R T; R = 8314 Дж/(кмоль*градус) – универсальная газовая постоянная; Pυ = (R*/μ)T; Pυ =RT; R = R*/μ - газовая постоянная; μ – молекулярный масса (кг/кмоль); υ = V/M; υ – удельный объём (м3/кг), V – объём (м3), М - масса (кг); ρ = М/V – плотность (кг/м3); ρ = 1/υ; υ = 1/ρ. Соотношения между удельными параметрами и полными: Сx = cx*M – полная и удельная теплоёмкости рабочего тела (Сx = cx) в каком – либо термодинамическом процессе “x”; Удельная массовая теплоёмкость измеряется в Дж/(кг*градус) Теплоёмкости являются функциями термодинамического процесса; L = l*M – полная и удельная работы изменения объёма; Lт = lт*M – полная и удельная технические работы; Q = q*M - полное и удельное тепло в каком – либо термодинамическом процессе. I = i*М - полная и удельная энтальпия в каком – либо термодинамическом процессе. U = u*M - полная и удельная внутренняя энергия рабочего тела; Тепло и работа – функции состояния термодинамического процесса. Правила знаков: Тепло в процессе больше нуля, если оно подводится к рабочему телу, и тепло в процессе отрицательно, если оно отводится от рабочего тела; Работа в процессе больше нуля, если она совершается рабочим телом, и работа в процессе отрицательна, если она совершается над рабочим телом. Внутренняя энергия, энтальпия и энтропия являются только-лишь функциями состояния рабочего тела (зависят только от параметров рабочего тела). Уравнение Майера ср – сv = R; k – показатель адиабаты; k = ср/сv ; сv = R/(k - 1); ср = k*R/(k - 1) Первый закон термодинамики. Аналитическое выражение закона через внутреннюю энергию и работу изменения объёма рабочего тела dq = du +Pdυ; dq = du +dl; Pdυ – удельная работа изменения объёма рабочего тела, Дж/кг Аналитическое выражение закона через энтальпию и техническую работу рабочего тела dq = di – υdP; dq = di + dlт; i = u + Pυ υdP – удельная техническая работа рабочего тела, Дж/кг Термодинамические коэффициенты полезного действия различных циклов. Цикл Карно ηt = 1 – T2/T1 Цикл со сгоранием при V = const ηt = 1 – 1/εk-1 Цикл со сгоранием при P = const ηt = 1 – (ρk – 1)/[kεk-1(ρ-1)] Цикл со смешанным подводом тепла ηt = 1 – (λρk – 1)/[εk-1(λ – 1 + kλ(ρ-1)] 2




