upload/images/files/Химия 8 кл (36 часов)
реклама
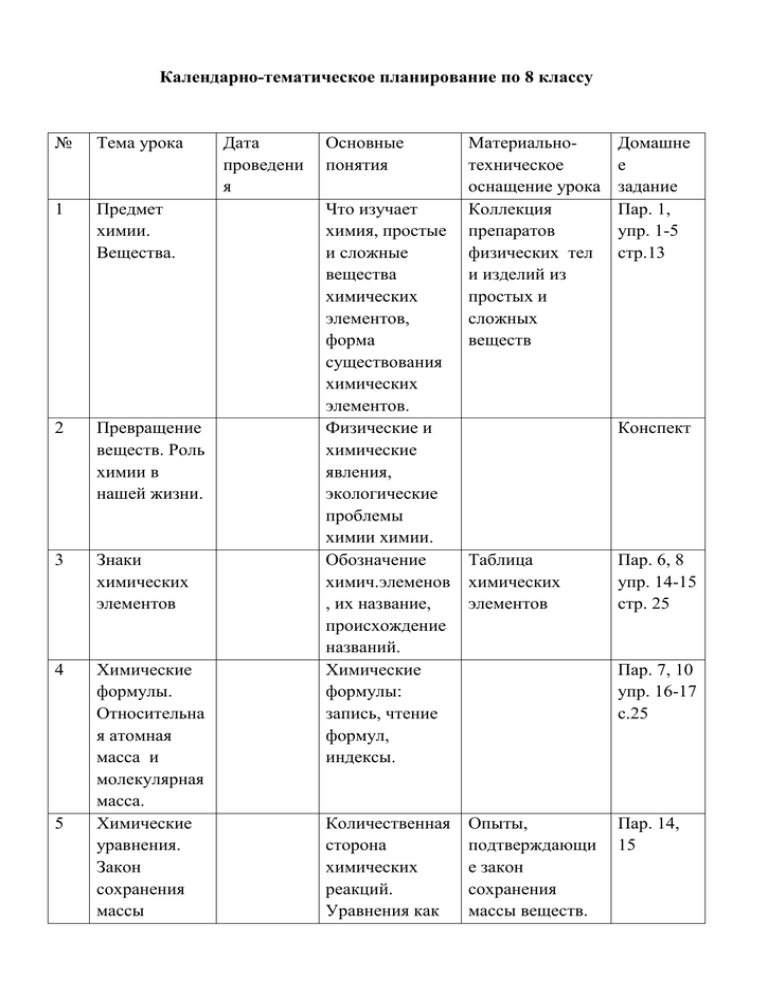
Календарно-тематическое планирование по 8 классу № Тема урока 1 Предмет химии. Вещества. 2 Превращение веществ. Роль химии в нашей жизни. 3 Знаки химических элементов 4 Химические формулы. Относительна я атомная масса и молекулярная масса. Химические уравнения. Закон сохранения массы 5 Дата проведени я Основные понятия Материальнотехническое оснащение урока Коллекция препаратов физических тел и изделий из простых и сложных веществ Что изучает химия, простые и сложные вещества химических элементов, форма существования химических элементов. Физические и химические явления, экологические проблемы химии химии. Обозначение Таблица химич.элеменов химических , их название, элементов происхождение названий. Химические формулы: запись, чтение формул, индексы. Количественная сторона химических реакций. Уравнения как Опыты, подтверждающи е закон сохранения массы веществ. Домашне е задание Пар. 1, упр. 1-5 стр.13 Конспект Пар. 6, 8 упр. 14-15 стр. 25 Пар. 7, 10 упр. 16-17 с.25 Пар. 14, 15 веществ. 6 7 Типы химических реакций. Реакции разложения и соединения. Реакции замещения и обмена. 8 Количество вещества. 9 Молярная масса вещества. 10 Вычисление по химическим уравнениям 11 Молярный объем газообразных условная запись химических реакций. Составление уравнений реакций на тип соединение и разложение Примеры реакций замещения, условия течения реакций обмена до конца. Количество вещества и его еденицы – моль,моль, кмоль. Разложение веществ Cu (НО)2, KMnO4 Пар. 16 упр. 5-7 стр. 47-48 Реакции взаимодействия цинка с соляной кислотой, хлорида бария с серной кислотой. .Некоторые простые и сложные вещества количеством 1 моль. Решение задач с использованием числа Авагардо, количества вещества, массы, молярной массы Пар. 16 Постоянная Авагардо. Расчет молярных масс по химическим формулам. Нахождение количества вещества, массы продукта реакции по количеству вещества и массе исходного вещества Понятие о Модель молярном молярного объеме газов. объема газа. Пар. 17 упр. 7 – 10 с.47 Пар.17 №1-2, стр.48 Пар. 44,45 №1,4 стр. 156 12 13 14 15 16 17 веществ. Урок упражнение Обобщение и систематизац ия знаний по пройденной теме Контрольная работа №1 Важнейшие классы неорганическ их соединений. Оксиды Свойства оксидов Основания Решение задач и упражнений с использованием понятий количество вещества, массы, олярный объем газов и объем газов. Решение задач и выполнение упражнений, подготовка к к/р Проверка и оценка знаний учащихся Составление формул, из названия, характеристика Солеобразующи еи несолеобразую щие оксиды. Состав, названия, классификация, индикторы конспект №1-4 стр.47 Образцы оксидов Пар.30, P2O5> SiO2> №1-7 CaO стр.92-93 Изучение свойств основных и кислотных оксидов на примереCaO и CO2 Образцы щелочей ТВ. И р-ры, нерастворимые основания, изменение цвета индикаторов. Пар. 30, №1-2, с.93 Пар. 31, № 1-4, стр.99 18 Химические свойства оснований 19 Кислоты: классификаци я, названия. 20 Свойства кислот. 21 Соли 22 Свойства солей Диссоциация раств.оснований ,. Взаимодейтсвие с кислотами, кислотными оксидами, солями. Разложение нерастворимых оснований. Состав, названия, классификация. Расчеты по формулам кислот. Диссоциация кислот, взаимодействие кислот с металлами, оксидами, основаниями, солями. Состав, названия солей, их клссификация, характерные представители солей Электрохиическ ий ряд напряжения металлов, взаимодействие с металлами, Реакции, характерные для щелочей и нерастворимых оснований. Пар. 31, упр. 1-4, стр.99 Образцы кислот, правило разбавления серной кислоты в воде, изменение цвета индикатора в кислой среде. Реакции, характерные для кислот, на примере соляной и серной кислот. Пар. 32, упр. 1-9, стр. 104105 Образцы солей Пар. 33, упр.1-5 стр.112 Изучение химических свойст Пар.33 № 1,2 стр.112 Пар. 32, №1,2 стр. 105 23 24 25 26 27 28 Генетическая связь междуклассам и неорганическ их веществ Обобщение и систематизац ия знаний по теме «Классы неорганическ их веществ» Практическая работа №1 по теме «Важнейшие классы неорганическ их веществ» Контрольная работа №2 по теме «Классы неорганическ их веществ» Периодическа я система химических элементов Д.И. Менделеева Основные сведения о строении атома щелочами, кислотами, солями Различные признаки классификации, химические реакции P – P2O5 – H3PO4 – Ca3(po4)2 Упр. 6-7, стр 112 Ca – CaO – Ca(OH)2 – Ca3(po4)2 Выполнение упражнений, задач. Подготовка к к/р Упр.9,10 стр.112 Практическое осуществление химических реакций Проверка и оценка знаний учащихся. Периодический Таблица закон, структура химических периодической элементов системы, группы, периоды. Доказательства сложности строения атома. Опыты Резерфорда, Пар.35,36 Пар.37 29 Протоны, нейтроны, изотопы 30 Строение электронных оболочек атомов 31 Характеристи ка химических элементов на основании положения в п/c и строения атома. «планетарная модель атома» Определение чмсла нейтронов в атоме. Изотопы как разновидности химического элемента Электронная оболочка атомов, энергетические уровни, строение электронных оболочек атомов малых перодов, завершенные и незавершенные электрические слои, орбитали, электронные формулы атомов. Физический смысл порядкового номера, номера группы, периода, изменение свойств химических элементов в группах, Стр. 127128 Таблица химических элементов Пар. 37, стр.129 – 134 Таблица химических элементов Пар.38 периодах Выполнение упражнений 33- Обобщение и 34 систематизац ия знаний 35 Контрольная работа №3 по теме «Периодическ ий закон и п/с химическихэл ементов» 36 . Анализ контрольной работы. 32 подготовка к к/р конспект подготовка к к/р Упр. 1-4, стр.140 Проверка и оценка знаний учащихся

