Форма 3.3
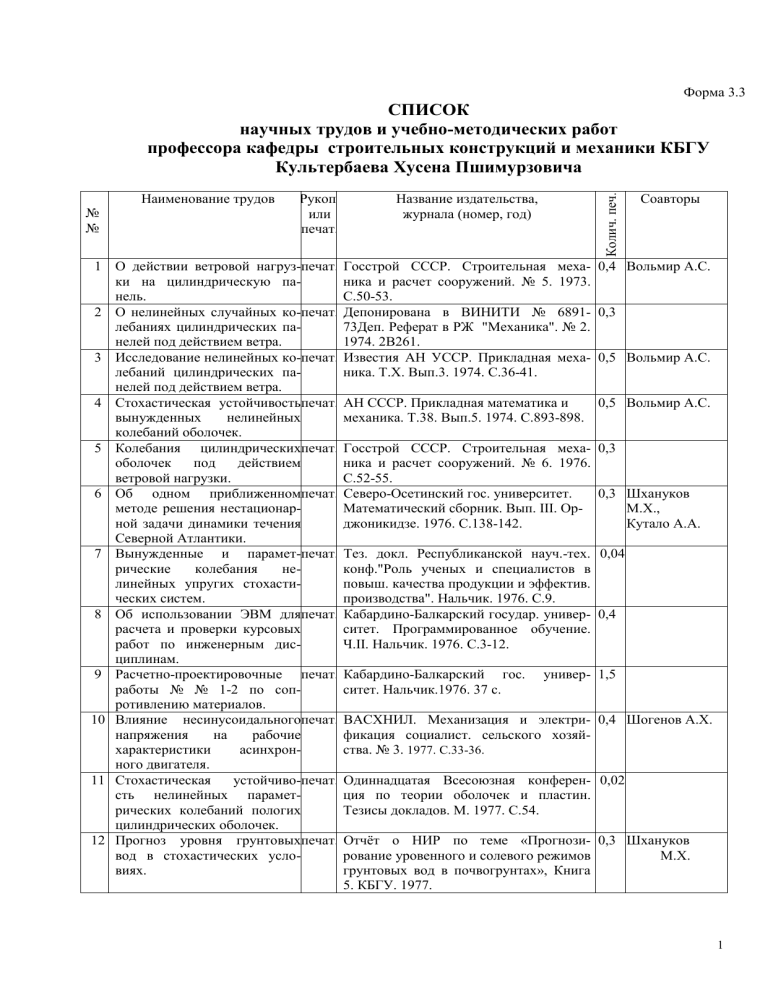
Наименование трудов
№
№
№
Рукоп.
или
печат.
Название издательства,
журнала (номер, год)
Колич. печ.
листов
СПИСОК
научных трудов и учебно-методических работ
профессора кафедры строительных конструкций и механики КБГУ
Культербаева Хусена Пшимурзовича
Соавторы
1 О действии ветровой нагруз-печат. Госстрой СССР. Строительная меха- 0,4 Вольмир А.С.
ки на цилиндрическую паника и расчет сооружений. № 5. 1973.
нель.
С.50-53.
2 О нелинейных случайных ко-печат. Депонирована в ВИНИТИ № 6891- 0,3
лебаниях цилиндрических па73Деп. Реферат в РЖ "Механика". № 2.
нелей под действием ветра.
1974. 2В261.
3 Исследование нелинейных ко-печат. Известия АН УССР. Прикладная меха- 0,5 Вольмир А.С.
лебаний цилиндрических паника. Т.X. Вып.3. 1974. С.36-41.
нелей под действием ветра.
4 Стохастическая устойчивостьпечат. АН СССР. Прикладная математика и
0,5 Вольмир А.С.
вынужденных
нелинейных
механика. Т.38. Вып.5. 1974. С.893-898.
колебаний оболочек.
5 Колебания цилиндрическихпечат. Госстрой СССР. Строительная меха- 0,3
оболочек
под
действием
ника и расчет сооружений. № 6. 1976.
ветровой нагрузки.
С.52-55.
6 Об одном приближенномпечат. Северо-Осетинский гос. университет.
0,3 Шхануков
методе решения нестационарМатематический сборник. Вып. III. ОрМ.Х.,
ной задачи динамики течения
джоникидзе. 1976. С.138-142.
Кутало А.А.
Северной Атлантики.
7 Вынужденные и парамет-печат. Тез. докл. Республиканской науч.-тех. 0,04
рические
колебания
неконф."Роль ученых и специалистов в
линейных упругих стохастиповыш. качества продукции и эффектив.
ческих систем.
производства". Нальчик. 1976. С.9.
8 Об использовании ЭВМ дляпечат. Кабардино-Балкарский государ. универ- 0,4
расчета и проверки курсовых
ситет. Программированное обучение.
работ по инженерным дисЧ.II. Нальчик. 1976. С.3-12.
циплинам.
9 Расчетно-проектировочные печат. Кабардино-Балкарский гос. универ- 1,5
работы № № 1-2 по сопситет. Нальчик.1976. 37 с.
ротивлению материалов.
10 Влияние несинусоидальногопечат. ВАСХНИЛ. Механизация и электри- 0,4 Шогенов А.Х.
напряжения
на
рабочие
фикация социалист. сельского хозяйхарактеристики
асинхронства. № 3. 1977. С.33-36.
ного двигателя.
11 Стохастическая
устойчиво-печат. Одиннадцатая Всесоюзная конферен- 0,02
сть нелинейных параметция по теории оболочек и пластин.
рических колебаний пологих
Тезисы докладов. М. 1977. С.54.
цилиндрических оболочек.
12 Прогноз уровня грунтовыхпечат. Отчёт о НИР по теме «Прогнози- 0,3 Шхануков
вод в стохастических услорование уровенного и солевого режимов
М.Х.
виях.
грунтовых вод в почвогрунтах», Книга
5. КБГУ. 1977.
1
13 Исследование вынужденныхпечат. Известия СКНЦВШ. Естественные 0,4
нелинейных колебаний упрунауки. № 1. 1978. С.23-25.
гих стохастических систем.
14 Случайные параметрическиепечат. Известия АН УССР. Прикладная меха- 0,5
колебания
цилиндрических
ника. Т. XIV. № 9. 1978. С.46-51.
пологих оболочек.
15 Вынужденные и параметри-печат. Проблемы надежности. Всесоюзная 0,1
ческие колебания цилиндриконфер. по проблемам оптимизации и
ческих оболочек под дейснадежности в строительной механике.
твием случайных нагру-зок.
М. 1979. С.103-105.
16 О движении грунтовых вод впечат. Кабардино-Балкар. госу. университет. 0,2
стохастических условиях.
Межвузовский сборник "Краевые зада- 5
чи для уравнений смешанного типа и
родственные проблемы функцио-нального анализа и прикладной математики". Вып.2. Нальчик. 1979. С.1-6.
17 Нелинейные колебания ци-печат. Вольмир А.С. Оболочки в потоке жид- 0,2
линдрической панели в покости и газа. Задачи гидроупругости.
токе ветра.
М.: Наука. 1979. С.185-188.
18 Стохастическая устойчивостьпечат. Вольмир А.С. Оболочки в потоке 0,2
колебаний оболочек.
жидкости и газа. Задачи гидроупругости. М.: Наука. 1979. С.188-191.
19 Программирование инженер- печат. Кабардино-Балкарский государ. универ- 2,7
ных задач на алголе.
ситет. Нальчик. 1980. С.50-53.
5
20 Оптимизация распределенияпечат. Кабардино-Балкарский государ.
0,3
земляной массы при вертиуниверситет. Нальчик. 1981. 45 с.
кальной планировке с использованием ЭВМ.
21 К
методике
определенияпечат. АН СССР. АН УССР. Сверхтвердые 0,3
ресурса алмазного инструматериалы. №6(21). 1982. С.29-31.
мента.
Шхануков
М.Х.
Вольмир А.С.
Вольмир А.С.
Ошхунов
М.М.
Сабанчиев
З.М.
Тхагапсоев Х.Г.,
Хапачев Б.С.,
Хажуев В.Ш.,
Гоов А.А
22 Расчетно-проектировочные печат. Кабардино-Балкарский государ. универ- 2,0
работы по сопротивлению
ситет. Нальчик. 1983. 51 с.
материалов.
23 Планы непрерывной под-печат. Кабардино-Балкарский государ. универ- 0,5
готовки студентов специситет. Нальчик. 1984. 8 с.
альностей 0501, 1202 по
использованию
вычислительной техники.
24 Программирование и ре-печат. Кабардино-Балкарский государ. универ- 2,8 Карякин В.Т.
шение задач на алгоритситет. Нальчик. 1985. 72 с.
мическом языке БЭЙСИК для
диалогового
вычислительного комплекса "Электроника
НЦ80-20/1".
25 Об организации подготовкипечат. Кабардино-Балкарский государ. универ- 0,1
специалистов в области выситет. Тезисы докл. научно-мет. конфер.
числительной техники на ин"Вычисл. техника в учеб. процессе".
женерно-техническом факульНальчик. 1987. С.3-6.
тете.
26 Об использовании вычисли-печат. Кабардино-Балкарский
государ. 0,1
тельной техники в расчетноуниверситет. Тезисы докл. научно-мет.
проектировочных
работах
конфер. "Вычисл. техника в учеб.
курса сопротивления материпроцессе". Нальчик. 1988. С.30-31.
2
алов.
27 Комплексный план непрепечат. Кабардино-Балкарский государ. универ- 1,0 Жемухов Х.К.
рывной математической подситет. Нальчик. 1988. 22 с.
Тлехугов Х.Т.
готовки студентов специальностей 2903, 1201.
28 Об аналогиях между детер-печат. Известия СКНЦВШ. Естественные
0,4
министическими и слуайнынауки. № 3-4. 1992. С.21-26.
ми колебаниями струны с
колеблющимся концом.
29 О колебаниях струны, выз-печат. Известия АН Укр. Прикладная механика. 0,3
ванных случайными колебаТ. 28. № 10. 1992. С.57-61.
ниями её конца.
30 Стохастическая краевая зада-печат. Нелинейные краевые задачи матема- 0,2
ча о колебаниях струны.
тической физики и их приложения. Сб.
науч. трудов. Институт математики АН
Украины. Киев. 1993. С.79-81.
31 Кинематически
возбуждае-печат. Известия СКНЦВШ. Естественные 0,4
мые изгибные колебания стенауки. №.3-4. 1993. С.78-88.
ржней.
32 Планы непрырывной под-печат. Кабардино-Балкарский государ. универ- 0,2 Батыров У.Д.
готовки студентов специситет. Нальчик. 1994. 5 с.
5
альностей 1201, 2903 по использованию вычислительной
техники.
33 Стохастическая краевая зада-печат. Нелинейные краевые задачи матема- 0,2
ча о колебаниях струны, возтической физики и их приложения. Сб.
буждаемых векторным слунауч. трудов. Институт математики
чайным процессом.
НАН Украины. Киев. 1994. С.118-120.
34 Нелинейные колебания цили-печат. Труды XVI Международной конферен- 0,4
ндрических оболочек при дейции по теории оболочек и пластин. Т. 1.
ствии комбинированных слуНижний Новгород, 1994. С.123-128.
чайных нагрузок.
35 Исследование колебаний гиб-печат. Вестник КБГУ. Серия технических 0,25 Тимишев В.М.
ких элементов механизмов
наук. Нальчик.1994. С.153-162.
численными методами.
36 Кинематически
возбуждае-печат. Материалы науч.-прак. конф. Каб.-Балк. 0,6
мые случайные колебания
гос. с/х акад. 1994г. Инж.- тех. науки.
балок.
Часть 3. Нальчик. 1995. С.30-32.
37 Случайные колебания и сто-рукоп. Отчёт по научно-исслед. теме. Государ. 10
хастическая устойчивость упкомитет по науке и технике. ВНТИЦ.
ругих механических систем.
1995. Рег. № 01.9.50 003841
38 Кинематически
возбужда-печат. Известия высших учеб. завед. Северо- 0,7
емые колебания мембран.
Кавказ. регион. Естественные науки.
№.3, 1995. С.34-40.
39 Научно-практическая
печат. Известия высших учеб. завед. Северо- 0,9 Шапсугов Д.Ю.
конференция
Кавказ. регион. Общественные науки.
Культербаев
«Государственность и право
№.3(95), 1996. С.88-92.
Х.П.
республики
в
составе
Мирошник С.В.
Российской Федерации»
Мамитова Н.В.
40 Дневник студента по про-печат. Кабардино-Балкарский государ. универ- 0,4
изводственной практике.
ситет. Нальчик. 1998. 41 с.
41 Случайные параметрическиепечат. Вестник КБГУ. Серия технических 0,4
колебания нелинейных полонаук. Вып. 3. Нальчик. 1999. С.49-52.
3
гих оболочек.
42 Сопротивление материалов.печат. Кабардино-Балкарский государ. универ- 3,0
Расчетно-проектировочные
ситет. Нальчик. 2000. 71 с.
работы.
43 Сопротивление материалов.печат. Кабардино-Балкарский государ. универ- 3,0
Контрольные работы для стуситет. Нальчик. 2000. 70 с.
дентов-заочников механических специальностей.
44 Кинематически
возбуждае-печат. Математическое
моделирование
и 0,3
мые случайные колебания
краевые задачи. Часть 2. Труды Десятой
распределённых систем.
межвузовской конференции. 29-31 мая
2000 г. Самарский госуд. техн. универ.
Самара. 2000. С.57-61.
45 Сопротивление материал-ов.печат. Кабардино-Балкарский государ. универ- 3,0
Лабораторные работы.
ситет. Нальчик. 2000. 52 с.
46 Стохастическая краевая за-печат. Вестник КБГУ. Серия технических 0,5
дача о колебаниях стержней.
наук. Вып. 4. Нальчик. 2000. С.3-6.
47 О влиянии широкополосно-печат. Вестник КБГУ. Серия технических 0,2
сти кинематических возмунаук. Вып. 4. Нальчик. 2000. С.6-9.
щений на случайные колебания струны.
48 Теплотехнический
расчётпечат. Вестник КБГУ. Серия технических 0,3
огнестойкости многослойных
наук. Вып. 4. Нальчик. 2000. С.9-11.
строительных конструкций.
49 Вермикулитобетон-эффектив- печат. Известия высших учеб. завед. Северо- 0,3
ная огнезащитная изоляция
Кавказский регион. Технические науки.
строительных конструкций.
№.4, 2000. С.64-66
50 Стохастическая краевая зада- печат. Математическое
моделирование
и 0,2
ча о колебаниях струны при
краевые задачи. Часть 3. Труды
случайных векторных
Одиннадцатой межвузовской конфевозмущениях.
ренции. 29-31 мая 2001 г. Самарский
госуд. техн. универ. Самара. 2001. С.7477.
51 Основы метода конечныхпечат. Кабардино-Балкарский государ.
1,5
элементов.
Расчётно-проуниверситет. Нальчик. 2001. 29 с.
ектировочные работы.
52 Сопротивление материалов. печат. Кабардино-Балкарский государ.
1,4
Курсовая работа.
университет. Нальчик. 2001. 26 с.
53 Кинематически
возбуж-печат. Известия
Кабардино-Балкарского 0,4
даемые колебания пластин.
научного центра. РАН. 2(7). 2001. С.8690.
54 Методы теории вероятностейпечат. Кабардино-Балкарский государ. универ- 1,2
в механике конструкций.
ситет. Нальчик. 2001. 19 с.
Расчётно- проек-тировочные
работы.
55 Основы теории колебаний.печат. Кабардино-Балкарский государ. универ- 1,7
Расчётно-проектировочные
ситет. Нальчик. 2001. 28 с.
5
работы. Методические указания, варианты заданий, примеры. Для специальности:
290300 – Промышленное и
гражданское строительство.
Молов Б.М.
Джанкулаев
Ам.Я.
Хежев Т.А.
Хежев Т.А.,
Жабелов
А.Ж.
Джанкулаев
Аз.Я.
Джанкулаев
Ам.Я.
Джанкулаев
Аз.Я.
Джанкулаев
Ам.Я.
4
56 Колебания струны при ком-печат. Материалы юбилейной конференции, 0,1 Джанкулаев
бинированных
случайных
посвящённой
20-летию
КБГСХА. 5 Аз.Я.
возмущениях.
Секция «Технические науки». Нальчик,
2001. С. 119-121.
58 Смешанная система диф-печат. РАН, Владикавказский научный центр. 0,3 Джанкулаев
ференциальных
уравнений
Владикавказский
математический 5 Аз.Я.
как математическая модель
журнал. Октябрь – декабрь, 2001, Том 3,
колебаний
континуальноВыпуск 4. С. 4-29-4-35.
дискретных
механических
систем.
58 Кинематически
возбуждае-печат. Кабардино-Балкарская государ. сель- 0,4 Джанкулаев
мые колебания балок.
скохоз. академия. Избранные труды наАз.Я.
учного семинара «Механика», Выпуск
1, Нальчик. 2002. С.49-56.
59 Cвободные колебания струны печат Известия высших учеб. завед. Северо- 0,65 Джанкулаев
c сосредоточенными массами.
Кавказский регион. Технические науки.
Аз.Я.
№.1, 2002. С.30-35
60 Основы теории колебаний.печат. Кабардино-Балкарский
государ. 1,75
Расчётно-проектировочные
университет. Нальчик.
работы. Методические указа2002. 35 с.
ния, варианты заданий, примеры. Для механических специальностей вуза.
61 Основы теории колебаний.печат. Кабардино-Балкарский
государ. 0,78
Расчётно-проектировочная
университет. Нальчик.2002. 14 с.
работа. Методические указания, варианты заданий,
пример выполнения. Для
студентов–заочников строительных специальностей вуза.
62 Основы теории колебаний.печат. Кабардино-Балкарский
государарст. 0,97
Расчётно-проектировочная рауниверситет. Нальчик. 2002. 18 с.
бота.
Методические указания, варианты заданий, пример выполнения. Для студентов–заочников механических специальностей вуза.
63 Свободные продольные коле-печат. Известия высших учебных заведений. 0,6 Джанкулаев
бания стержней с сосредоСеверо-Кавказский регион. ЕстестАз.Я.
точенными массами.
венные науки, № 4, 2002. C.14-18.
64 Кинематически
возбуждае-печат. Математическое
моделирование
и 0,2 Джанкулаев
мые совместные колебания
краевые задачи. Труды Двенадцатой
Аз.Я.
струны и сосредоточенных
межвузовской конференции. 29-31 мая
масс.
2002 г. Часть 2. Самарский госуд. техн.
универ. Самара. 2002. С.69-72.
65 Совместные колебания стру-печат. Известия высших учеб. завед. Северо- 1,0 Джанкулаев
ны и сосредоточенных масс
Кавказский регион. Технические науки.
Аз.Я.
при кинематических возмуще№ 1, 2003. Приложение. С.29-37
ниях опор.
66 О колебаниях демпфирован-печат. Надёжность и долговечность строитель- 0,2
ных мембран при векторных
ных
материалов
и конструкций.
возмущениях.
Материалы III Международной научнотехнической конференции (27-29 марта
2003 г.) Часть I. Волгоград. 2003. С.143146.
5
67 О вынужденных колебанияхпечат. Надёжность и долговечность строитель- 0,2 Казиев А.М.
растянутых балок при комбиных материалов и конструкций.Матенированных возмущениях.
риалы III Международной научно-технической конференции (27-29 марта
2003 г.).Часть II. Волгоград.2003.С.1518.
68 Внутренние силы при ки-печат. Вестник КБГУ. Серия технических 0,3
нематически возбуждаемых
наук. Вып. 5. Нальчик. 2003. С.3-7.
колебаниях пластин.
69 О случайных колебанияхпечат. Математическое
моделирование
и 0,2 Казиев А.М.
растянутых балок.
краевые задачи. Труды Тринадцатой
межвузовской конференции. 29-31 мая
2003 г. Часть 1. Самарский госуд. техн.
универ. Самара. 2003. С.100-103.
70 Домашние задания по соп-печат. Кабардино-Балкарский
государ. 4,65
ротивлению материалов.
университет. Нальчик. 2003. -78 с.
71 Сопротивление материалов.печат. Кабардино-Балкарский
государ. 1,4
Курсовая работа «Расчёты на
университет. Нальчик. 2003. -26 с.
прочность и жёсткость».
72 Свободные колебания балки спечат. Наука, техника и технология нового 0,4 Казиев А.М.
сосредоточенными масссами.
века
(НТТ-2003).
Материалы
Всероссийской
научно-технической
конференции.
г.Нальчик,
25-27
сентября. Нальчик. 2003.С.15-21.
73 О колебаниях балок припечат. Наука, техника и технология нового 0,4
векторных возмущениях.
века (НТТ-2003). Материалы Всероссийской научно-технической конференции.
г.Нальчик,
25-27
сентября.
Нальчик. 2003.С.52-58.
74 О гармонических колебанияхпечат. Ростовский госуд. стр. университет. Сб. 0,4 Казиев А.М.
балок, возбуждаемых векторнауч. тр.: Лёгкие строительные констными возмущениями.
рукции. Ростов-на-Дону. 2003. С.145153
75 Математика для юристов.
печат. Кабардино-Балкарский государ. уни- 6,51 Нахушева Ф.М.
верситет. Нальчик. 2003. 112 с.
76 Основы теории колебаний.печат. Кабардино-Балкарский государ. уни- 8
Основы теории, задачи для
верситет. Нальчик. 2003. 130 с.
домашних заданий, примеры
решений.
77 Сопротивление материалов.печат. Кабардино-Балкарский государ. уни- 9
Задачи для домашних задаверситет. Нальчик. 2003. 163 с.
ний, примеры решений.
78 Кинематически
возбуждае-печат. Математическое
моделирование
и 0,17 Казиев А.М.
мые колебания балки с сосрекраевые задачи. Труды Всероссийской
доточенными массами.
научной конференции. 26-28 мая 2004 г.
Часть 2. Самарский госуд. техн. универ.
Самара. 2004. С.133-135.
79 Основы теории случайныхпечат. Кабардино-Балкарский государ. уни- 7,2
процессов.
верситет. Нальчик. 2004. 130 с.
80 Кинематически
возбужда-печат. Известия высших учеб. завед. Северо- 0,9 Казиев А.М.
емые совместные колебания
Кавказский регион. Технические науки.
балок с дискретными массами
№ 4, 2004. С.57-63.
81 Кинематически
возбуждае-печат. Надёжность и долговечность стро- 0,3 Чеченов Т.Ю.
мые колебания модифицироительных материалов, конструкций и
6
ванной балки Тимошенко.
82
83
84
85
86
87
88
89
90
91
92
93
оснований фундаментов. Материалы IV
Международной
научно-технической
конференции (12-14 мая 2005 г.) Часть
II. Волгоград. 2005. С.36-41.
Колебания
пластин
припечат. Надёжность и долговечность строи- 0,3 Исламова О.В.
векторных
гармонических
тельных материалов, конструкций и
возмущениях.
оснований фундаментов. Материалы IV
Международной
научно-технической
конференции (12-14 мая 2005 г.) Часть
II. Волгоград. 2005. С.41-46.
Свободные колебания мо-печат. Математическое моделирование и кра- 0,17 Чеченов Т.Ю.
дифицированной балки Тимоевые задачи. Труды Второй всероссийшенко
ской научной конференции. 1-3 июня
2005 г. Часть 1. Самарский госуд. техн.
универ. Самара. 2005. С.176-179.
Колебания
мембран
припечат. Математическое моделирование и кра- 0,17 Исламова О.В.
разнотипных случайных возевые задачи. Труды Второй всеросмущениях
сийской научной конференции. 1-3
июня 2005 г. Часть 1. Самарский госуд.
техн. универ. Самара. 2005. С.179-182.
Сопротивление материалов.печат. Кабардино-Балкарский
государ. 2,5 Чеченов Т.Ю.,
Примеры выполнения расуниверситет. Нальчик. 2005. -38 с.
Ципинова Ф.М.
чётно-проектировочных работ. Часть I.
Колебания
мембран
припечат. Наука, техника и технология XXI века 0,3 Исламова О.В.
действии векторных случай(НТТ-2005).
Материалы
второй
ных возмущений смешанного
Всероссийской
научно-технической
типа
конференции (Нальчик, 29-30 сентяб-ря
2005 г.) Часть II. С. 3-7.
Вынужденные
колебанияпечат. Наука, техника и технология XXI века 0,3 Чеченов Т.Ю.
модифицированной
балки
(НТТ-2005).
Материалы
второй
Тимошенко при векторных
Всероссийской
научно-технической
гармонических возмущениях
конференции (Нальчик,29-30 сентября
2005 г.). Часть II. Нальчик. 2005. С.8-12.
Об
устойчивости
много-печат. Ростовский госуд. стр. университет. Ма- 0,1 Чеченов Т.Ю.
пролётного
стержня
с
териалы Международной научно-пракпеременной жёсткостью
тической конференции «Строительство–
2006». Ростов-на-Дону. 2006. С.126-128
О Тлостанове, ректоре ипечат. Он жил для людей. Сборник воспо- 0,4
человеке
минаний. Нальчик: Каб.-Балк. ун-т,
2006.-Изд. 2-ое, доп. С. 77-83
Математические модели коле-печат. Кабардино-Балкарский государ. универ- 1,16 Исламова О.В.
бательных систем и процессситет. Нальчик. 2006. -18 с.
Чеченов Т.Ю.
сов. Лабораторный практикум.
Сопротивление материалов.печат. Кабардино-Балкарский государ. универ- 2,5 Ципинова Ф.М.,
Примеры выполнения расчётситет. Нальчик. 2006. -40 с.
Чеченов Т.Ю.
но-проектировочных работ.
Часть II.
Основы теории колебаний.печат. Кабардино-Балкарский государ. универ- 2,5 Ципинова Ф.М.,
Примеры выполнения расчётситет. Нальчик. 2006. -46 с.
Исламова О.В.
но-проектировочных работ.
Численное моделирование ко-печат. Математическое моделирование и кра- 0,43 Исламова О.В.
лебаний тяжёлой струны
евые задачи. Тематический сборник научных трудов. –Нальчик: Каб.-Балк. ун7
т, 2006. С.8-17.94 Введение в MATLAB.
95
96
97
98
99
100
101
102
103
104
105
106
печат. Кабардино-Балкарский государ. универ- 3,5 Джанкулаев Ам.
ситет. –Нальчик:. Каб.-Балк. ун-т, 2006.
Я.
57 c.
Случайные процессы и коле-печат. Волгоградский гос. архит.-строит. ун-т. 21 Пшеничкина
бания строительных констру–Волгоград: ВолгГАСУ, 2006. -335 с.
В.А.
кций и сооружений.
Численное моделирование ко-печат. Вестник
ВолгГАСУ.
Серия: 0,4 Исламова О.В.
лебаний тяжёлой струны
Естественные науки. Вып. 6(23).
Волгоград. 2007. С.31-36.
Математическая модель коле-печат. Изв. вузов. Сев.-Кавк. регион. Техн. 0,6 Исламова О.В.
баний тяжёлой подвешенной
науки. 2007. № 4. С.41-46.
струны с сосредоточенной
массой
Математическое моделирова-печат. Наука, техника и технология XXI века 0,4 Исламова О.В.
ние колебаний системы: тяжё(НТТ-2007).
Материалы
III
лая
нить-сосредоточенная
Международной
научно-технической
масса.
конференции. (Нальчик,4-6 октября
2007 г.). Том II. Нальчик. 2007. С.7-13.
Вынужденные
колебанияпечат. Вестник
ВолгГАСУ.
Серия: 0,5 Чеченов Т.Ю.
балок переменного сечения
Строительство и архитектура. Вып.
при векторных гармонических
8(27). Волгоград. 2007. С.5-12.
возмущениях
Сопротивление материалов.печат. Кабардино-Балкарский
государ. 1,39 Барагунова Л.А.
Варианты заданий и методиуниверситет. Нальчик. 2007. -23 с.
ческие указания по выполнению курсовой работы.
Математическая
модельпечат. Вестник
научно-методической 0,25 Исламова О.В.
кинематически и динамикомиссии
по
деталям
машин,
чески возбуждаемых колебаприкладной механике и основам
ний мембраны
проектирования
Министерства
образования РФ и Республиканского
семинара «Механика» при КБГСХА.
Нальчик. 2008. С. 92-95.
Теоретическая механика. Рас- печат Кабардино-Балкарский
государ. 3,25 Чеченов Р.М.
чётно-графические
работы,
университет. Нальчик. 2008. -52 с.
варианты заданий, методические
указания,
примеры
выполнения
Методы теории вероятностей печат Кабардино-Балкарский
государств. 1,0
в механике конструкций.
университет. Нальчик. 2008. -52 с.
Расчётно-проектировочная
работа. Методические указания.
Свободные и кинематически печат Вестник КБГУ. Серия технических 0,5 Чеченов Р.М.
возбуждаемые колебания ненаук. Вып. 5. Нальчик. 2008. С.3-7.
Абазов Э.Э
однородной струны
Об областях неустойчивости в печат Вестник КБГУ. Серия технических 0,5 Чеченов Т.Ю.
пространстве параметров сжанаук. Вып. 5. Нальчик. 2008. С.9-14
Хажнагоев А.Р.Э
того стержня при комбинированном нагружении
Определение
спектров печат Вестник КБГУ. Серия технических 0,5 Исламова О.В.
свободных
колебаний
наук. Вып. 5. Нальчик. 2008. С.14-18.
Тхагапсов А.Х.
8
107
108
109
110
111
112
113
114
115
116
117
движущейся
струны
численными методами
Малые свободные колебания печат Надёжность и долговечность строи- 0,35 Калашников
продольно
движущейся
тельных материалов, конструкций и
С.Ю.
струны с присоединённой
оснований фундаментов. Материалы V
Чеченов Р.М.
распределённой массой
Международной
научно-технической
конференции (23-24 апреля 2009 г.)
Часть III. Волгоград. 2009. С.107-112.
О структурировании прост- печат Изв. вузов. Сев.-Кавк. регион. Техн. 0,5
ранства параметров сжатонауки. 2009. № 3. С.85-88.
растянутого
стержня
по
механическому состоянию
О границе области допусти- печат Наука, техника и технология XXI века 0,3
мых состояний в пространс(НТТ-2009).
Материалы
IV
тве параметров сжато-растяМеждународной
научно-технической
нутого стержня
конференции. (Нальчик, 9-10 октября
2009 г.). Нальчик. 2009. С.313-317.
Свободные колебания конти- печат Наука, техника и технология XXI века 0,25 Чеченов Т.Ю.
нуально-дискретной много(НТТ-2009).
Материалы
IV
пролётной балки при учёте
Международной
научно-технической
инерционных сил вращения
конференции. (Нальчик, 9-10 октября
2009 г.). Нальчик. 2009. С.223-228.
Сопротивление материалов.печат. Кабардино-Балкарский государ. уни- 9
Задачи для домашних задаверситет. Нальчик. 2009. 164 с.
ний, примеры решений.
Теоретическая
механика. печат Кабардино-Балкарский государ. уни- 6
Динамика:
расчётно-графиверситет. Нальчик. 2010. 52 с.
ческие работы, варианты
заданий, методические указания, примеры выполнения.
Всего несколько встреч
печат Пшеничкин А.П. Основы вероятностно- 0,2
статистической теории взаимодействия
сооружений с неоднородными грунтовыми основаниями: монография /
А.П.Пшеничкин; Волгогр. гос. архит.
строит. ун-т. -2-е изд., испр. и доп. –
Волгоград: ВолгГАСУ, 2010. Раздел
«Воспоминания».
Вынужденные гармоническиепечат. Вестник
ВолгГАСУ.
Серия: 0,5 Исламова О.В.
и случайные колебания струСтроительство и архитектура. Вып.
ны, движущейся в продоль21(40). Волгоград. 2011. С.33-39.
ном направлении
Кинематически
возбужда- печат Известия
Кабардино-Балкарского 0,7 Чеченов Т.Ю.
емые колебания континуальгосудар. ун-та. Т. 1. Вып. 1. Нальчик.
но-дискретной многопролёт2011. С.114-118.
ной
балки
при
учёте
инерционных сил вращения
Сопротивление материалов.печат. Кабардино-Балкарский государ. уни- 8,8
Задачи для домашних задаверситет. -Нальчик. 2011. 71 с.
ний, примеры решений. Ч I.
Кинематически
возбужда- печат Вестник Нижегородского университета 0,3
емые колебания континуальим. Н.И.Лобачевского. №4, часть 2.
но-дискретной многопролётТруды Х Всероссийского съезда по
ной балки
фундаментальным проблемам теорети-
9
118
119
120
121
122
123
124
125
126
127
128
ческой и прикладной механики. Изд-во
ННГУ им. Н.И.Лобачевского, 2011. С.
198-200.
Вынужденные
колебанияпечат. Вестник
ВолгГАСУ.
Серия: 0,6 Чеченов Т.Ю.
континуально-дискретной
Строительство и архитектура. Вып.
Барагунов Т.М.
многопролётной балки при
26(45), Волгоград. 2012. С.48-55.
учёте
инерционных
сил
вращения
Колебания дискретно-конти- печат Изв. вузов. Сев.-Кавк. регион. Техн. 0,8
нуальной балки, кинематиченауки. 2012. № 3. С. 54-59
ски возбуждаемые гармоническими
и
случайными
векторными процессами
О
реализации
проблемы печат Компьютерные
технологии
в 0,25 Барагунова
собственных значений сжатостроительстве: Материалы ВсеросЛ.А.
растянутого
стержня
на
сийской научно-технической конфекомпьютере
ренции. ДГТУ. –Махачкала: Алеф (ИП
Овчинников), 2012. С. 90-94.
О плотности собственных печат Строительство: Проблемы и перспек- 0,2
Барагунова
значений
в
задаче
об
ивы. Сборник статей по материалам
Л.А.
устойчивости
международной научно-практической
многопролётного стержня
конференции. Дагестанский государтвенный институт народного хозяйства.
- Махачкала, 2013. С. 133-135
Об устойчивости многопро- печат Вестник
ВолгГАСУ.
Серия: 0,6 Кармоков К.А.
лётного стержня переменной
Строительство и архитектура. Вып.
жёсткости на гибких опорах
34(53), Волгоград. 2013. С.90-98.
Электронный
учебник
Свидетельство
о
государственной 3,5 Джанкулаев А.Я.
«Введение в Матлаб»
регистрации программы для ЭВМ
Джанкулаева
№2013661492. Дата государственной
М.А.
регистрации в Реестре 09.12.13
Техническая
механика.печат. Кабардино-Балкарский государ. уни- 11,2 Барагунова Л.А.
Задачи для домашних задаверситет. Нальчик. 2014. 103 с.
ний, примеры решений.
Колебания многопролетпечат Вестник
ВолгГАСУ.
Серия: 0,6 Чеченов Т. Ю.,
Шогенова Ф. М.
ной балки Тимошенко при
Строительство и архитектура. Вып.
действии векторной рас37(56), Волгоград. 2014. С.143-153.
пределенной нагрузки
Кинематически
возбужпечат Современные строительные материалы, 0,5
даемые колебания вертитехнологии и конструкции. Материалы
кальной стойки переменмежд. научно-практ. конф., 2015. г.
ного сечения при векторГрозный. Т.2. С.418-426.
ных возмущениях
Колебания вертикальной
печат ХI
Всероссийский
съезд
по 0,01
стойки переменного сечефундаментальным
проблемам
ния при гармонических и
теоретической и прикладной механики.
случайных
векторных
Аннотации докладов. (Казань, 20-24
возмущениях
августа 2015 г.) – Казань: Издательство
Академии наук РТ, 2015. С. 163.
Колебания вертикальной
элек. ХI
Всероссийский
съезд
по 0,2
стойки
переменного издан.п фундаментальным
проблемам
сечения при гармоничетеоретической и прикладной механики:
ских
и
случайных
сборник докладов. (Казань, 20-24
векторных возмущениях
августа 2015 г.) / Сост. Д.Ю.Ахметов,
А.Н.Герасимов, Ш.М.Хайдаров, под
10
129
130
131
132
133
134
135
136
ред. Д.А.Губайдулина, А.М.Елизарова,
Е.К.Липачёва. Казань: Изд-во Казан. унта, 2015. С. 2181-2184
Спектральная задача об печат Известия
Кабардино-Балкарского 0,8 Алокова М.Х.
изгибных
колебаниях
государ. ун-та. Т. V. № 1. 2015 г. С.42вертикальной стойки.
48.
Математическое
моделиро- печат Изв. вузов. Сев.-Кавк. регион. Техн. 0,8 Алокова М.Х.,
вание изгибных колебаний
науки. 2015. № 4. С. 100-106
Барагунова Л.А.
вертикального стержня переменного сечения
Теоретическая
механика.печат. Кабардино-Балкарский государ. уни- 8,4 Барагунова Л.А.
Динамика.
Задачи
для
верситет. Нальчик. 2014. 103 с.
домашних заданий, примеры
решений.
Сопротивление материалов. печат -Нальчик: Каб.-Балк. ун-т, 2015. -110 с.
13
Задачи
для
домашних
заданий, примеры решений.
Методические рекомендации.
Изгибные
колебания печат Вестник Дагестанского государ. технич. 1,0 Алокова М.Х.
вертикального
стержня
ун-та. №4. Т. 39. 2015 г. С. 77-87.
переменного
сечения
с
сосредоточенной массой
Свободные
изгибные печат Теория сооружений, достижения и 0,7 Алокова М.Х.
колебания
вертикального
проблемы:
сборник
статей
по
стержня переменного сечения
материалам II всероссийской научнос сосредоточенной массой
практической
конференции,
27-28
ноября
2015
г.
Махачкала
/
Дагестанский государ. технич. ун-т.
2015. С. 13-24
Сопротивление материалов. элек. Кабардино-Балкарский государ. уни- 7,4 Алокова М.Х.
Курсовая работа. Прочность,издан. верситет. Нальчик. 2016. 73 с.
жёсткость и устойчивость
стержней
и
стержневых
систем
Математическое
печат Современная
математика
и
ее 0,31 Алокова М.Х.
моделирование
приложения: Материалы Междунар.
кинематически возбуждаемых
науч.-практ. конф., 18–20 мая 2017 г., г.
плоских
колебаний
Уфа. – Часть II / Отв. ред. С.А.
вертикального стержня
Мустафина. – Стерлитамак: Стерлитамакский филиал БашГУ, 2017. – 43
с. – ISBN 978-5-86111-586-5
11
В МЕЖДУНАРОДНОЙ БАЗЕ ДАННЫХ SCOPUS
06.08.16
12
