molekulyarnaya_fizika._teoriya
реклама

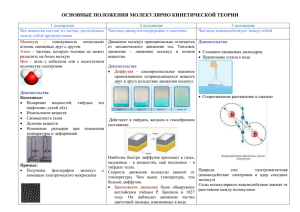
1 Молекулярная физика. Подготовка ЕГЭ. Теория. Дискретное строение вещества. Непрерывное хаотическое движение молекул. Диффузия. Броуновское движение. Взаимодействие частиц вещества. Количество вещества. Моль. Количество вещества. Постоянная Авогадро. Идеальный газ. Связь между давлением и средней кинетической энергией молекул идеального газа. Уравнение состояния идеального газа. Изопроцессы. Тепловое равновесие. Абсолютная температура. Температура – мера средней кинетической энергии. Основные положения молекулярно-кинетической теории: 1.Все тела состоят из отдельных частиц.(Опытное обоснование: крошение частиц, испарение жидкостей, смешивание веществ) 2. Частицы находятся в непрерывном беспорядочном движении.(опытное обоснование: Броуновское движение, диффузия, испарение.) Эти частицы взаимодействуют друг с другом.(опытное обоснование: сохранение формы твердых тел, наличие промежутков между частицами, слипание тел с отшлифованными поверхностями) Диффузия – самопроизвольное проникновение частиц одного вещества в промежутки между частицами другого вещества. ( Чем выше температура, тем быстрее происходит диффузия) Наблюдается в газах, в твердых телах, и в жидкостях) Броуновское движение- хаотическое движение взвешенных в жидкости или в газе частиц под действием нескомпенсированных ударов молекул жидкости или газа. m M m N ; ; ; Масса молекулы: m0 = ; m0 M NA N NA m – масса вещества; m0 = масса молекулы: М – молярная масса; N – общее число молекул NA – число Авогадро. Ν – количество вещества. Количество вещества- физическая величина, численно равная отношению числа молекул к числу Авогадро. Единица измерения – 1 моль. Число Авогадро – число молекул в одном моле( или число атомов в 12 г углерода. NA = 6,02 ·1023 моль-1.) Молярная масса – масса вещества, взятого в количестве одного моля. Относительная молекулярная масса (Мr ) – это отношение массы молекулы данного вещества к 1/12 массы молекулы углерода. m0 Мr = М = Мr·10-3; ; 1 m0 C 12 N Концентрация – число молекул в единице объема. n = ; V Зависимость молекулярных сил от расстояния между молекулами. Межмолекулярные силы являются короткодействующими. F (Fот) R r0 r Fпр Fот Fпр 0 r0 r на расстояниях, превышающих 2-3 диаметра молекулы сила отталкивания равна 0; Сила притяжения стремится к 0; при сближении молекул (r < r0 ) обе силы резко возрастают, но Fот > Fпр 2 Идеальный газ – физическая модель реального газа, в которой не учитываются взаимодействия между молекулами. (взаимным притяжением и размерами молекул пренебрегают) Основное уравнение молекулярно-кинетической теории. р= 1 n m0 V 2 ; 3 2 n Е ; p = n kT; 3 р= 1 1 m V 2 ; p = V 2 ; 3 3 V E - средняя кинетическая энергия движения молекул; k =1,38·10-23Дж/ 0К ρ – плотность; Т – абсолютная температура. Давление газа обусловлено многочисленными ударами молекул об стенки сосуда. Температура – это физическая величина, характеризующая степень нагретости тела.(отклонение тела от теплового равновесия.) Абсолютная температура (Т) – температура, измеренная по шкале Кельвина. Абсолютный ноль – температура при которой прекращается движение молекул ( недостижим). t0(C) T0(K) 100 3730К( температура кипения воды при н.у.) p= 2730К ( температура таяния льда при н.у.) 00 Т = t + 2730K 3 k T 2 Средняя кинетическая энергия хаотического поступательного движения молекул газа пропорциональна абсолютной температуре. k = 1,38·10-23 Дж/ К.( постоянная Больцмана) Средняя квадратичная скорость движения молекул газа равна: V Ек 00K (абсолютный 0) -273 3kT 3RT . m0 M Уравнение состояния идеального газа: P1V1 P2V2 ; T1 T2 РV Уравнение Менделеева-Клапейрона: m RT ; M R=8,31 Дж ; К моль R- Универсальная газовая постоянная.( Отношение произведения давления на объем к абсолютной температуре при нормальных условиях для одного моля газа) Изопроцессы – термодинамические процессы, протекающие в системе с неизменной массой при постоянном значении одного из параметров системы. 1. Изотермический процесс – процесс изменения состояния газа при неизменной температуре. Изотермический процесс подчиняется закону Бойля-Мариотта.: Для данной массы газа при неизменной температуре произведение давления на объём –есть величина постоянная. Р1V1 = P2V2 3 При Т = const. Графически зависимость давления от объёма при постоянной температуре изображается с помощью кривой, называемой изотермой. Р T1 T2 P V T1> T2 V T P 2. Изобарный процесс – процесс изменения состояния газа при неизменном давлении. Изобарный процесс подчиняется закону Гей- Люссака.: Для данной массы газа при неизменном давлении отношение объёма к абсолютной температуре –есть величина постоянная. V1 V2 T1 T2 При Р = const. Графически зависимость объёма от температуры при постоянном давлении изображается с помощью прямой, называемой изобарой. P V Т Р1> Р2 Р2 Р1 V T P 2. Изохорный процесс – процесс изменения состояния газа при неизменном объёме. Изохорный процесс подчиняется закону Шарля.: Для данной массы газа при неизменном объёме отношение давления к абсолютной температуре –есть величина постоянная. P1 P2 T1 T2 При V = const. Графически зависимость объёма от температуры при постоянном давлении изображается с помощью прямой, называемой изохорой. Р V1> V2 V2 V T V1 Т T V