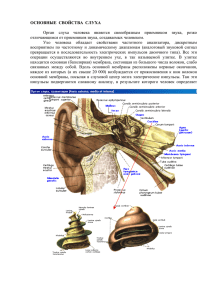
ФИЗИОЛОГИЯ КЛЕТКИ
реклама

ВВЕДЕНИЕ −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− Значение изучения раздела Раздел «Физиология возбудимых тканей» изучается первым в курсе нормальной физиологии. Возбудимые ткани играют важную роль в жизнедеятельности организма, входя в состав всех жизненно важных органов и систем. Поэтому получение глубоких знаний по этому разделу необходимо будущему врачу для дальнейшего эффективного изучения физиологии и клиники нервной, сердечно-сосудистой, пищеварительной и др. систем организма человека. Изучение основных тем раздела позволит будущему врачу также освоить прикладные аспекты функционирования возбудимых тканей (электрокардиография, электроэнцефалография, электромиография, хронаксиметрия, электрогастрография, электроретинография, исследование кожно-гальванических реакций, исследование психогальванических рефлексов). Цели и задачи пособия Создатели настоящего учебно-методического пособия преследовали цель обеспечения студента медицинского вуза, изучающего курс нормальную физиологию, эффективными средствами самоподготовки. Учебной целью изучения данного раздела является знание студентами общих закономерностей функционирования возбудимых структур, что формирует базис для изучения других разделов курса нормальной физиологии и клинических дисциплин. В результате изучения раздела студент должен знать: − механизм формирования биоэлектрических явлений в возбудимых тканях; − зависимость ответной реакции возбудимой ткани от характеристик раздражителя; − зависимость ответной реакции возбудимой ткани на действие раздражителя от функционального состояния возбудимой ткани; − механизмы и закономерности проведения возбуждения по электровозбудимой мембране (клеточная мембрана, нервное волокно); − особенности синаптического механизма передачи возбуждения; − молекулярный механизм мышечного сокращения и электромеханического сопряжения; − структурно-функциональные особенности гладкой мышцы. В результате изучения раздела студент должен уметь: − использовать фактический материал раздела для решения ситуационных задач, в процессе разбора и осмысливания возможных клинических ситуаций; − на элементарном уровне экспериментальным путем изучить основные параметры функциональной активности возбудимых тканей. Структура учебно-методического обеспечения раздела Для изучения данного раздела учебной программой предусмотрено три практических занятия: 1. Мембранно-ионная теория возбуждения. Законы раздражения. 2. Физиологические механизмы проведения возбуждения в возбудимых тканях. Физиология нервного волокна и синапса. 3. Физиология мышц. Механизм мышечного сокращения. Биомеханика скелетной мышцы. Особенности физиологии гладкой мышцы. Продолжительность каждого занятия − четыре академических часа. Все основные вопросы раздела проблемно-концептуально излагаются в лекционном курсе. Несколько вопросов раздела выносятся на самостоятельное внеаудиторное изучение: − Физиология трудовой деятельности. Работоспособность. − Утомление. Значение активного отдыха. − Влияние гипокинезии на нервно-мышечную систему. Изучая материал раздела с использованием данного пособия студент должен: − Используя информационный блок пособия, основную и дополнительную литературу глубоко изучить теоретические положения раздела. − Проверить свои знания, решая тестовые задания 1-2 уровней. − Проверить умение пользоваться своими знаниями, решая тестовые задания в формате «Крок-1», ситуационные задачи повышенной сложности с клинической направленностью. − Тесты и ситуационные задачи даны в каждой теме раздела после изложения теоретического материала. − Возникшие вопросы при решении ситуационных задач необходимо обсудить с преподавателем на практическом занятии. Основная литература для самоподготовки: 1. Смирнов В.М., ред. Физиология человека: Учебник. − М.: Медицина,2002. 2. Ткаченко Б.И.., ред. Основы физиологии человека: Учебник. В 2-х т., 1994. Т.1, сс.1520,37-55. 3. Фiлiмонов В.I., ред. Нормальна фiзiологiя: Пiдручник.− Киiв.: «Здоров,я»., 1994, с.521. 4. Ноздрачев А.Д., ред. Общий курс физиологии человека и животных: Учебник в 2-х кн. – М.: Высш. Шк., 1991, Кн.1. сс.31-56. 5. Косицкий Г.И., ред. Физиология человека: Учебник.– М.: Медицина,1985, сс.19-41. 6. Филимонова В.И., ред. Медицинская физиология: Учебник в 2-х т. Т.1. – 1998,сс.817, 28-33. Дополнительная литература: 1. Шмидт Р. И Тевс Г. Физиология человека: Т.1. – М.: Мир, 1996. 2. В.И.Скок, В.И., Шуба М.Ф. Нервно-мышечная физиология. Киев.: «Вища школа», 1986. 3. Болдырев А.А., ред. Введение в биомембранологию. – М.:Изд-во МГУ,1990. 4. Лишко В.К., Шевченко М.И.. Мембраны и жизнь клетки. – Киев.: «Наукова думка»,1987. 5. Богач П.Г., Клевець М.Ю., Рибальченко В.К. Основи електрофiзiологii. – К.:Вища шк.,1984. 6. Серков Ф.Н., ред. Физиологические особенности организма детей разного возраста. − Киев,1989. _________ 7. Фролькис В.В. Старение и увеличение продолжительности жизни. − Л.: Наука,1988. 8. Чеботарева А.Ф.,ред. Гериотрия. − М.: Медицина.1990. 9. Шеперд Г. Нейробиология. − М.: Мир. Т.1.1987. 10. Эккерт Р., Рэнделл Д., Огастин Дж. Физиология животных. Механизмы и адаптация: В 2 т. 11. − М.: Мир,1992. 12. Яковлев В.Н. Общая физиология возбудимых тканей. − Воронеж, Государственная медицинская академия, 1999. 13. Бэршоу К. Мышечное сокращение: Пер с англ. − М.: Мир,1985. 14. Гранит Р. Основы регуляции движений: Пер. с англ. − М.: Мир.1985. 15. Катц Б. Нерв, мышца, синапс: Пер. с англ. − М.−Л.: Мир.1969. 16. Котык А, Яначек К. Мемранный транспорт: Пер. с англ. М.: Мир, 1980. 17. Шмидт-Ниельсен К. Физиология животных. Приспособление и среда: Пер. с англ. − М.: Мир,1982. 18. Глебовский В.Д., ред. Физиология плода и детей.− М.: Медицина,1988. 19. Смирнов В.М. Особенности физиологии детей. − М.: Российский государственный медицинский университет, 1993. 20. Ganong W. F. Review of Medical Physiology, 7-th ed, 1995 21. Guyton A.C. Textbook of Medical Physiology, 8-th ed, 1991. −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− ИНФОРМАЦИОННЫЙ БЛОК −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 1.ОБЩАЯ ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ Раздражимость — способность живой материи активно изменять характер своей жизнедеятельности при действии раздражителя. Реакции отдельных клеток, тканей на действие раздражителя могут быть весьма разнообразными: изменение интенсивности обмена веществ, рН, ускорение клеточного деления и роста, структурно-функциональные реакции. Степень выраженности возможных изменений может быть различной. Она зависит от вида клеток или ткани, которые подвергаются действию раздражителя. По степени выраженности биоэлектрических явлений все ткани делят на возбудимые и невозбудимые. Возбудимость — это способность клетки генерировать потенциал действия (ПД) при раздражении. Возбудимость является частным случаем наиболее общего свойства всех клеток — раздражимости. К возбудимым тканям относятся только те, клетки которых генерируют ПД. Это мышечная и нервная ткань. Нередко к возбудимым тканям относят и «железистую ткань». Однако это не обосновано, поскольку железистой ткани нет — имеются различные железы и железистый эпителий как вид тканей. В процессе активной деятельности железы в ней действительно регистрируются биоэлектрические явления, поскольку железа как орган состоит из различных клеток — соединительнотканных, эпителиальных, мышечных. ПД проводится по мембранам возбудимых клеток, с его помощью передается информация и обеспечивается управление деятельностью клеток организма. Невозбудимыми являются эпителиальная и соединительная (собственно соединительная, ретикулярная, жировая, хрящевая, костная, кровь) ткани. Клетки этих тканей не генерируют ПД при действии на них раздражителя. Проводимость — это способность ткани и клетки передавать возбуждение. 1.1.СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ КЛЕТОЧНОЙ МЕМБРАНЫ По определению Робертсона, клетку можно рассматривать как трифазную систему, которая состоит из нуклео-цитоплазматического матрикса, мембранной фазы и внешней фазы. На мембраны приходится около 2/3 сухой массы клетки. Формирует клетку и поддерживает строго определенный внутриклеточный гомеостаз плазматическая, или поверхностная, мембрана. 1.1.1.Структура плазматической мембраны Клеточная мембрана (оболочка клетки) представляет собой тонкую (6—10 нм) липопротеиновую пластинку, содержание липидов в которой составляет около 40 %, белков — около 60 %. Изнутри клеточная мембрана выстлана тонким, более плотным слоем гиалоплазмы, практически лишенной органелл. На внешней поверхности мембраны имеется небольшое количество (5—10 %) углеводов, молекулы которых соединены либо с белками (гликопротеиды), либо с липидами (гликолипиды) и образуют гликокаликс, строение и функции которого у разных клеток могут различаться. Углеводы участвуют в рецепции биологически активных веществ, реакциях иммунитета. Структурную основу клеточной мембраны (матрикс) составляет бимолекулярный слой фосфолипидов, являющихся барьером для заряженных частиц и молекул водорастворимых веществ. Липиды обеспечивают высокое электрическое сопротивление мембраны клетки, например в нейронах — до 100 Ом/см2. Молекулы фосфолипидов мембраны состоят из двух частей: одна из них несет заряд и гидрофильна, другая не заряжена и гидрофобна. Это определяет способность липидов самопроизвольно образовывать двухслойные мембранные структуры под влиянием собственных зарядов. В клеточной мембране заряженные гидрофильные участки молекул фосфолипидов от одних молекул направлены внутрь клетки, а от других — наружу клетки. В толще клеточной мембраны молекулы фосфолипидов взаимодействуют незаряженными гидрофобными участками (они «спрятаны» от внутриклеточной и внеклеточной воды). В липидном слое клеточных мембран содержится много холестерина. Обмен липидов в отличие от белков происходит медленнее. Однако возбуждение, например, нейронов мозга приводит к уменьшению содержания в них липидов. В частности, после длительной умственной работы, при утомлении количество фосфолипидов в нейронах уменьшается (может быть, это связано с более яркой памятью у лиц напряженного умственного труда). Состав мембранных липидов определяется средой обитания и характером питания. Так, увеличение растительных жиров в пищевом рационе поддерживает жидкое состояние липидов клеточных мембран и улучшает их функции. Избыток холестерина в мембранах увеличивает их микровязкость, ухудшает транспортные функции клеточной мембраны. Однако недостаток жирных кислот и холестерина в пище нарушает липидный состав и функции клеточных мембран. Молекулы белков встроены в фосфолипидный матрикс клеточной мембраны. В клеточных мембранах встречаются тысячи различных белков, которые можно объединить в основные классы: структурные белки, переносчики, ферменты, белки, образующие каналы, ионные насосы, специфические рецепторы. Один и тот же белок может быть рецептором, ферментом и насосом. Каналы образованы белковыми молекулами, вкрапленными в липидный матрикс, они пронизывают мембрану. Через эти каналы могут проходить полярные молекулы. Многие мембранные белки, так же как и фосфолипиды, состоят из двух частей — заряженной и незаряженной. Незаряженные участки белков погружены в липидный слой, не несущий заряда. Заряженные участки белков взаимодействуют с заряженными участками липидов, что является важным фактором, определяющим взаиморасположение структурных элементов клеточной мембраны и ее прочность. Большинство белков, пронизывающих липидный слой, прочно связано с фосфолипидами (интегральные белки), главной их функцией является транспорт веществ через клеточную мембрану. Большая часть интегральных белков — гликопротеиды. Белки, прикрепленные к поверхности клеточной мембраны (в основном к внутренней ее части), называют периферическими. Они, как правило, являются ферментами: это ацетилхолинэстераза, фосфатазы, аденилатциклаза, протеинкиназы. Некоторые интегральные белки также выполняют функцию ферментов, например АТФаза. Рецепторами и антигенами мембраны могут быть как интегральные, так и периферические белки. Белки, примыкающие к мембране с внутренней стороны, являются также составной частью цитоскелета, который обеспечивает дополнительную прочность клеточной мембраны и эластичность. Обновление белков мембраны происходит очень быстро — в течение 2—5 дней (срок их жизни). Большинство клеток организма имеет отрицательный поверхностный заряд, который обеспечивается выступающей из мембраны клетки углеводной частью гликолипидов, фосфолипидов, гликопротеидов. Мембрана обладает текучестью: отдельные ее части могут перемещаться из одного участка к другому. Клеточные мембраны обладают избирательной проницаемостью: одни вещества пропускают, другие нет. В частности, мембрана легко проницаема для жирорастворимых веществ, проникающих через липидный слой; большинство мембран пропускает воду. Анионы органических кислот не проходят через мембрану. Но имеются каналы, избирательно пропускающие ионы К+, Na+, Са2+, Cl-. 1.1.2.Функции клеточной мембраны Основными функциями клеточной мембраны являются следующие: Барьерная (защитная) функция — наиболее очевидная функция клеточной мембраны, образующей поверхностную оболочку клетки. Особую роль в выполнении этой функции играют клеточные мембраны эпителиальной ткани. Они образуют обычно поверхности, отделяющие внутреннюю среду организма от внешней среды. Это относится также к легким и к желудочно-кишечному тракту. Барьерная функция клеточных мембран нарушается при многих патологических процессах (атеросклероз, гипоксия, интоксикация, раковое перерождение). Многие лекарственные вещества реализуют свое влияние посредством действия на мембрану, при ее повреждении эффекты лекарственных веществ могут изменяться. Клетки, образующие наружный слой эпителия, обычно соединены с помощью плотных контактов, которые ограничивают межклеточный перенос веществ. Рецепторная функция - восприятие изменений внешней и внутренней среды организма с помощью специальных структур — рецепторов, обеспечивающих узнавание различных раздражителей и реагирование на них. Клеточная мембрана располагает большим набором рецепторов, обладающих специфической чувствительностью к различным агентам — гормонам, медиаторам, антигенам, химическим и физическим раздражителям. Рецепторы отвечают за взаимное распознавание клеток, развитие иммунитета. Рецепторами на поверхности клеток могут служить гликопротеиды и гликолипиды мембран. Рецептор активирует G-белок мембраны, который с помощью фермента-предшественника, расположенного на внутренней поверхности клеточной мембраны, активирует второй посредник, реализующий эффект от раздражителя. Последовательность может быть, например, такой: адреналин — B-адренорецептор-GS-белок — аденилатциклаза-АТФ-цАМФ — протеинкиназа — фосфорилирование белков — изменение метаболизма и функций клетки. Восприятие физических и химических раздражителей (изменений внутренней и внешней среды организма) у возбудимых клеток осуществляется с помощью трансформации энергии раздражения в нервный импульс. Создание электрического заряда клетки обеспечивает клеткам возбудимых тканей возникновение локального потенциала, потенциала действия (возбуждения) и проведение последнего. Распространение возбуждения обеспечивает быструю связь возбудимых клеток между собой, а также посылку эфферентного сигнала от нервной клетки к эффекторной (исполнительной) и получение обратных (афферентных) импульсов от нее. Практически все живые клетки имеют электрический заряд, но лишь немногие из них способны генерировать потенциал действия. Выработка биологически активных веществ — простагландинов, тромбоксанов, лейкотриенов, оказывающих сильное влияние на адгезию тромбоцитов и процесс воспаления. Транспортная функция вместе с барьерной обеспечивает относительно постоянный состав веществ в клетке и ее электрический заряд. Наличие концентрационных и электрических градиентов различных веществ и ионов вне и внутри клетки свидетельствует о том, что клеточная мембрана осуществляет тонкую регуляцию содержания в цитоплазме ионов и молекул. Благодаря транспорту частиц формируется состав внутриклеточной среды, наиболее благоприятный для оптимального протекания метаболических реакций. вает: 1.1.3.Механизмы транспорта веществ через клеточную мембрану Транспорт частиц является жизненно важным для организма процессом. Он обеспечи- 1) поступление в организм через желудочно-кишечный тракт различных веществ в кровь и лимфу и в каждую клетку организма, необходимых для синтеза клеточных структур и выработки энергии; 2) регуляцию физико-химических показателей внутренней среды (осмотическое давление, рН); 3) создание электрических зарядов клеток, возникновение и распространение возбуждения; 4) сократительную деятельность поперечнополосатых (в том числе сердечной) и гладких мышц внутренних органов; 5) выделение клетками секретов (гормонов, ферментов, других биологически активных веществ); 6) выделение продуктов обмена в окружающую среду (почки, легкие, желудочно-кишечный тракт, кожа); 7) реализацию действия фармакологических препаратов. Транспорт веществ делят на пассивный (без затрат энергии) и активный (с затратой энергии). Движущей силой пассивного перемещения веществ являются концентрационный (химический), электрический и гидростатический градиенты. Согласно концентрационному градиенту, частицы перемещаются из области с высокой концентрацией в область с низкой концентрацией. При наличии разности гидростатических давлений, например в сосудах и интерстиции, жидкость движется через полупроницаемые мембраны из области с высоким гидростатическим давлением в область с более низким давлением. Вещества в этом случае следуют за растворителем, если мембрана проницаема для них. Следует заметить, что термин «пассивный транспорт» не соответствует реальной действительности, так как электрический, концентрационный и гидростатический градиенты в животном организме создаются активно — с затратой энергии. Обмен веществ между организмом и внешней средой может проходить частично без затрат энергии, если имеется концентрационный градиент, -это диффузия газов из легких в кровь или выход их из крови и всасывание питательных веществ в кровь из желудочно-кишечного тракта, если их концентрация в кишечнике больше, чем в крови. В организме транспорт веществ осуществляется с затратой энергии. Поэтому термин «пассивный транспорт» целесообразно исключить, так как подобного механизма в животном организме вообще не существуют — все виды транспорта веществ в организме осуществляются активно, с затратой энергии. Но в одних случаях энергия затрачивается непосредственно на транспорт какой-либо частицы, например иона Na+, с помощью белковой молекулы, называемой насосом. Это первично активный механизм: в данном случае создается концентрационный (химический) градиент — запас потенциальной энергии. В других случаях энергия на перенос частиц затрачивается опосредованно: например, перенос молекул глюкозы с помощью натрия — это вторично активный механизм, энергия расходуется на перенос только натрия. Считают, что движение воды, согласно закону осмоса, осуществляется пассивно: без затрат энергии вода движется в область с высокой концентрацией частиц (с высокой осмолярностью). Однако когда осмотическое давление сравняется по обе стороны мембраны, одностороннее движение воды прекратится. Движение воды, в результате которого была израсходована потенциальная энергия в виде концентрационного градиента, нельзя назвать пассивным, без затрат энергии, — это вторично активный транспорт. Если энергия расходуется непосредственно на перенос частиц, транспорт следует называть первично активным. Если же на транспорт частиц расходуется ранее запасенная энергия, например концентрационный градиент, такой транспорт следует называть вторично активным. Поскольку транспорт в обоих случаях является активным (с затратой энергии), обоснованно использовать термины первичный и вторичный транспорт веществ. 1.1.3.1.Первично активный транспорт. Первично активный транспорт - это перенос отдельных ионов вопреки концентрационному и электрическому градиентам с помощью специальных ионных насосов, а также с помощью эндоцитоза, экзоцитоза и трансцитоза. В обоих случаях энергия расходуется непосредственно на перенос частиц. Насосы (помпы) представляют собой белковые молекулы, обладающие свойствами переносчика и АТФазной активностью. Непосредственным источником энергии является АТФ. Достаточно хорошо изучены Na/К-, Са2+- и Н+-насосы. Есть основания предполагать наличие Сl- -насоса, о чем свидетельствует участие ионов Сl- в процессах торможения ЦНС, а также в возникновении возбуждения в клетках проводящей системы сердца и в клетках рабочего миокарда. Отсутствие хлорной помпы привело бы к исчезновению концентрационного градиента ионов Сl- в перечисленных клетках и нарушению процессов возбуждения и торможения в них, чего в реальной действительности не наблюдается. Насосы локализуются на клеточных мембранах или на мембранах клеточных органелл. Основными характеристиками мембранных насосов являются: - специфичность (селективность); - постоянная работа; Специфичность насосов (селективность) заключается в том, что они обычно переносят какой-то определенный ион или два иона. Например, Na/К-насос (объединенный насос для Nа+ и К+) не способен переносить ион лития, хотя по своим свойствам последний очень близок к натрию. Натрий-калиевый насос (Nа/К-АТФаза) — это интегральный белок клеточной мембраны, обладающий, как и все другие насосы, свойствами фермента, т.е. сам переносчик обеспечивает расщепление АТФ и освобождение энергии, которую он же сам и использует. Этот насос изучен наиболее хорошо, он имеется в мембранах всех клеток и создает характерный признак живого — градиент концентрации Nа+ и К+ внутри и вне клетки, что обеспечивает формирование мембранного потенциала и вторичный транспорт веществ. Главными активаторами насоса являются гормоны (альдостерон, тироксин), недостаток энергии (кислородное голодание) ингибирует насос. Его специфическими блокаторами являются строфантины, особенно уабаин. Работа натриевого насоса после удаления К+ из среды сильно нарушается. Кальциевый насос (Са2+-АТФаза) локализуется в саркоплазматическом ретикулуме мышечной ткани, в эндоплазматическом ретикулуме других клеток, клеточной мембране. Насос обеспечивает транспорт Сa2+ и строго контролирует содержание Са2+ в клетке, поскольку изменение содержания Са2+ в ней нарушает функцию. Насос переносит Са2+ либо во внеклеточную среду, например, в клетках сердечной и скелетных мышц, либо в цистерны ретикулума и митохондрии (внутриклеточное депо Са2+). Протонный насос (Н+-АТФаза) имеется в мембране обкладочных клеток в желудке, где играет важную роль в выработке соляной кислоты; в почке он участвует в регуляции рН внутренней среды организма; этот насос постоянно работает во всех митохондриях. Постоянная работа насосов необходима для поддержания концентрационных градиентов ионов, связанного с ними электрического заряда клетки и движения воды и незаряженных частиц в клетку и из клетки вторично активно, в частности согласно законам диффузии и осмоса. Совокупность этих процессов обеспечивает жизнедеятельность клетки. В результате разной проницаемости. клеточной мембраны для разных ионов и постоянной работы ионных помп концентрация различных ионов внутри и снаружи клетки неодинакова. Поскольку ионы являются заряженными частицами, то существует электрический заряд клетки. Почти во всех изученных клетках внутреннее содержимое их заряжено отрицательно по отношению к внешней среде, т.е. внутри клетки преобладают отрицательные ионы, а снаружи — положительные. Преобладающими ионами в организме человека являются Na+, К+, Сl-, причем К+ находится преимущественно в клетке, а Na+ и Сl- — во внеклеточной жидкости. Внутри клетки находятся также крупномолекулярные (в основном белкового происхождения) анионы. Роль первичного транспорта в поддержании различной концентрации разных ионов легко доказать, например, в опыте с эритроцитами. Если с помощью цианида подавить дыхание эритроцитов, то их ионный состав начинает постепенно меняться: Nа+ и Сl- диффундируют через клеточную мембрану в эритроцит, К+ — из эритроцита. Но в норме за счет энергии, поставляемой процессом дыхания, идет их первичный транспорт в обратном направлении, благодаря чему и поддерживаются концентрационные градиенты. Более трети энергии АТФ, потребляемой клеткой в состоянии покоя, расходуется на перенос только Na+ и К+, т.е. на работу Na+/К.+-насоса. Это обеспечивает сохранение клеточного объема (осморегуляция), поддержание электрической активности в нервных и мышечных клетках, транспорт других веществ в различных клетках организма. Механизм работы ионных насосов.Nа+/К+-насос — молекула интегрального белка, пронизывающая всю толщу клеточной мембраны. Молекула имеет участок, который связывает либо Na+, либо К+, — это активный участок. При конформации Е1 белковая молекула активной своей частью обращена внутрь клетки и обладает сродством к Nа+, который присоединяется к белку, в результате чего активируется АТФаза, обеспечивающая гидролиз АТФ и освобождение энергии. Последняя обеспечивает конформацию молекулы белка: она превращается в форму Е2, в результате чего активный ее участок уже обращен наружу клеточной мембраны. Теперь белок теряет сродство к Na+, последний отщепляется от него, а белок-помпа приобретает сродство к иону К+ и соединяется с ним. Это ведет снова к изменению конформации переносчика: форма Е2 переходит в форму Е1, когда активный участок белка снова обращен внутрь клетки. При этом он теряет сродство к иону К+, и тот отщепляется, а белок приобретает снова сродство к иону Na+ — это один цикл работы помпы. Затем цикл повторяется. Насос является электрогенным, поскольку за один цикл выводится из клетки 3 иона Nа+, а возвращается в клетку 2 иона К+. На один цикл работы Na/К-насоса расходуется одна молекула АТФ, причем энергия расходуется только на перенос Na+. Подобным образом работают и Са-АТФазы сарко- и эндоплазматической сетей, а также клеточной мембраны, с тем лишь различием, что переносятся только ионы Ca2+ и в одном направлении — из гиалоплазмы в сарко- или эндоплазматический ретикулум, а также — наружу клетки. Кальциевый насос (Са-АТФаза) — молекула интегрального белка, также имеет активный участок, связывающий два иона Са2+, и может быть в двух конформациях — Е1 и Е2. В конформации Е1 активный участок молекулы белка обращен в гиалоплазму, обладает сродством к Са2+ и соединяется с ним. В результате насос переходит в конформацию Е1, когда активный участок молекулы белка обращен внутрь сарко-плазматического ретикулума или наружу клетки. При этом уменьшается сродство белка к Са2+ , последний отщепляется от него. В присутствии иона магния освобождается энергия АТФ, за счет которой молекула белка СаАТФазы вновь переходит в конформацию Е1; цикл повторяется. Одна молекула АТФ переносит два иона Са2+. Эндоцитоз, экзоцитоз и трансцитоз (микровезикулярный транспорт) — это еще три вида первично-активного транспорта, близких по механизму друг к другу, посредством которых различные материалы переносятся через мембрану либо в клетку (эндоцитоз), либо из клетки (экзоцитоз), либо через клетку (трансцитоз). С помощью этих механизмов транспортируются крупномолекулярные вещества (белки, полисахариды, нуклеиновые кислоты), которые не могут транспортироваться по каналам или с помощью насосов. При эндоцитозе клеточная мембрана образует впячивания или выросты внутрь клетки, которые, отшнуровываясь, превращаются в пузырьки. Последние затем обычно сливаются с первичными лизосомами, образуя вторичные лизосомы, в которых содержимое подвергается гидролизу — внутриклеточному перевариванию. Продукты гидролиза используются клеткой. Различают два типа эндоцитоза — фагоцитоз (поглощение твердых частиц) и пиноцитоз — поглощение жидкого материала (раствор, коллоидный раствор, в том числе и белков, суспензия). Пиноцитоз характерен для амебоидных простейших и для многих других клеток, таких как лейкоциты, клетки зародыша, клетки печени и некоторые клетки почек, участвующие в водно-солевом обмене, в обмене белков: они обеспечивают пиноцитоз белков из первичной мочи в клетки проксимальных канальцев и их лизис. С помощью пиноцитоза новорожденные получают с молоком матери иммуноглобулины, которые через энтероциты попадают в кровь ребенка и выполняют свои защитные функции. Процесс эндоцитоза имеет место при всасывании веществ в желудочно-кишечном тракте. Экзоцитоз — процесс, обратный эндоцитозу; это наиболее распространенный механизм секреции. Таким способом различные материалы выводятся из клеток: из пресинаптических окончаний — медиатор, из пищеварительных вакуолей удаляются оставшиеся непереваренными частицы, а из секреторных клеток путем экзоцитоза выводится их жидкий секрет (слизь, гормоны, ферменты), из гепатоцитов — альбумины. Экзоцитозные пузырьки образуются в аппарате Гольджи. В пузырьки упаковываются белки, образовавшиеся в рибосомах эндоплазматического ретикулума. Низкомолекулярные вещества (медиаторы, некоторые гормоны) попадают в везикулы преимущественно с помощью вторичного транспорта. Пузырьки транспортируются сократительным аппаратом клетки, состоящим из нитей актина, миозина и микротрубочек, к клеточной мембране, сливаются с ней, и содержимое клеток выделяется во внеклеточную среду. Энергия АТФ расходуется на деятельность сократительного аппарата клетки. Процесс слияния везикул с клеточной мембраной активируется фосфолипидом лизолецитином и внутриклеточным Са2+. Например, поступление Са2+ в нервное окончание обеспечивает выделение медиатора через пресинаптическую мембрану в синаптическую щель. В процессе взаимодействия эндо- и экзоцитоза происходит самообновление клеточной мембраны (кругооборот, рециркуляция): в течение каждого часа в процессе эндоцитоза в разных клетках используется от 3 до 100 % клеточной оболочки, но с такой же скоростью происходит ее восстановление в результате экзоцитоза. Трансцитоз сочетает в себе элементы эндо- и экзоцитоза: это перенос частиц через клетку, например, молекул белка в виде везикул — через эндотелиальную клетку капилляров на другую ее сторону. В этом случае эндоцитозные пузырьки не взаимодействуют с лизосомами. При этом пузырьки могут сливаться друг с другом, образуя каналы, пересекающие всю клетку. 1.1.3.2.Вторично активный транспорт Вторичный транспорт — переход различных частиц и молекул воды за счет ранее запасенной (потенциальной) энергии. Потенциальная энергия создается в виде электрического, концентрационного и гидростатического градиентов (это обеспечивает диффузию, осмос, следование за растворителем) и градиента гидростатического давления жидкости, обеспечивающего фильтрацию, что создается деятельностью сердца, скелетных и гладких мышц. К вторичному транспорту относятся следующие виды транспорта. Диффузия. Согласно законам диффузии, частицы перемещаются из области с высокой концентрацией в область с низкой концентрацией. Частицы с одноименными электрическими зарядами отталкиваются, с разноименными зарядами — притягиваются друг к другу. Направление диффузии определяется взаимодействием электрического и концентрационного (химического) градиентов. Если частицы не заряжены, то направление их диффузии определяется только градиентом концентрации. Скорость диффузии определяется проницаемостью мембраны, а также градиентом концентрации для незаряженных частиц; электрическим и концентрационным градиентами — для заряженных частиц. Направления действия электрического и концентрационного градиентов могут не совпадать. Например, Na+ в процессе возникновения возбуждения продолжает поступать в клетку, когда она внутри уже заряжена положительно. Этот переход ионов обеспечивается концентрационным градиентом вопреки электрическому градиенту. Совокупность химического (концентрационного) и электрического градиентов называют электрохимическим градиентом. Различают простую и облегченную диффузию и осмос как частный случай диффузии. Простая диффузия осуществляется либо непосредственно через липидный бислой, либо через каналы. При этом заряженные частицы движутся согласно электрохимическому градиенту, а незаряженные — согласно только химическому градиенту. Через липидный бислой проходят жирорастворимые частицы. Если они находятся в воде по одну сторону мембраны, то могут внедряться в липидную оболочку благодаря тепловому движению (при этом необходимо освободиться от гидратной оболочки). Частицы-неэлектролиты обычно легко освобождаются от гидратной оболочки (разрыв водородных связей). Естественно, с уменьшением молекулярной массы способность перехода частиц через мембрану возрастает. Примером простой диффузии через липидный слой может служить диффузия малых незаряженных полярных молекул этанола, кислорода, углекислого газа, стероидных гормонов и других липидов, тироксина, мочевины, а также чуждых клетке веществ, в частности ядов и лекарств. Этот процесс происходит слишком медленно и плохо контролируется. В ходе эволюции сформировались специальные каналы, по которым могут проходить различные частицы, причем ионы — очень быстро — за 0,5—1 мс. Каналы заполнены водой и, кроме ионов, через них могут проходить малые молекулы неэлектролитов (этанол, мочевина), заряженные молекулы. Диаметр этих каналов 0,3— 0,8 нм. Скорость диффузии определяется электрохимическим градиентом и проницаемостью клеточной мембраны для данного вещества. С течением времени скорость простой диффузии изменяется мало, пока существует движущая сила (электрический или концентрационный градиенты), так как по одному и тому же каналу или через липидный бислой после прохождения одной частицы сразу же может следовать другая. Облегченная диффузия осуществляется также согласно концентрационному градиенту и обеспечивает перенос веществ, способных образовывать комплексы с другими молекуламипереносчиками. Переносчик — специфический мембранный белок должен свободно переходить с одной стороны мембраны на другую. Этот транспорт осуществляется очень быстро. С помощью простой диффузии не могут проходить через мембрану даже небольшие полярные молекулы — моносахариды, аминокислоты. Облегченная диффузия имеет ряд особенностей по сравнению с простой диффузией. 1. Имеются специфические переносчики для отдельных или нескольких веществ, близких по строению. Вещества, имеющие сходные по строению молекулы, могут переноситься одним и тем же переносчиком и конкурировать за переносчик. 2. У молекулы-переносчика может быть особый канал, пропускающий вещество только одного определенного типа. 3. С увеличением концентрации вещества с одной стороны мембраны скорость облегченной диффузии возрастает только до определенного предела в отличие от простой диффузии. Прекращение нарастания облегченной диффузии при увеличении концентрации вещества свидетельствует о том, что все переносчики уже заняты — явление насыщения. Переносчиками являются белковые молекулы мембран, которые совершают челночные движения с одной стороны мембраны на другую и обратно либо встраиваются в мембрану. В последнем случае образуется канал, по которому проходят транспортируемые вещества, в основном сахара, аминокислоты. Однако неясно, каким образом транспортируются сами переносчики. В случае предполагаемых челночных движений белковых молекул-переносчиков возникает вопрос: какая сила обеспечивает транспорт самих переносчиков? Если это одностороннее движение, то оно быстро прекратится после уравнивания концентрации самих переносчиков по обе стороны клеточной мембраны. На этот вопрос ответа пока нет. Возможны два механизма. Во-первых, за счет создания градиента концентрации самого переносчика, с помощью концентрационного градиента транспортируемого вещества. Если, например, концентрация глюкозы больше вне клетки, нежели в клетке, то она может переходить в клетку согласно своему градиенту концентрации. Образование комплекса молекул глюкоза — переносчик лишь улучшает прохождение глюкозы через мембрану согласно концентрационному градиенту глюкозы. Движущей силой является концентрационный градиент глюкозы. На внутренней стороне мембраны клетки комплекс распадается, поэтому концентрация молекул-переносчиков возрастает и они, согласно своему концентрационному градиенту, переходят на внешнюю сторону клеточной мембраны, снова соединяются с глюкозой и ускоряют ее переход в клетку. Такой транспорт возможен только при наличии концентрационного градиента транспортируемого вещества, например при более высокой концентрации глюкозы и аминокислот в кишечнике вследствие приема пищи и гидролиза пищевых веществ. Далее глюкоза и аминокислоты могут переходить из клетки в кровь согласно их концентрационным градиентам — если в энтероцитах их концентрация больше, чем в плазме крови. Из плазмы крови аминокислоты и глюкоза поступают в клетки различных органов и тканей организма согласно концентрационным их градиентам, так как клетка расходует эти вещества. По всей этой цепочке: полость кишки — энтероциты — кровь — интерстиций — клетки организма транспорт глюкозы и аминокислот осуществляется без затрат энергии — это исключение из общего правила. В кишечнике же глюкоза и аминокислоты накапливаются вследствие пищеварения, на что также затрачивается энергия — механическая обработка пищи, продвижение ее химуса по желудочно-кишечному тракту, выработка пищеварительных соков. Во-вторых, челночные движения переносчика могут осуществляться или дополняться с помощью ионов К+ Известно, что К+ постоянно диффундирует из клетки согласно концентрационному градиенту. При этом на внутренней стороне мембраны клетки может образоваться комплекс ион К+ — молекула переносчика, который и перейдет на внешнюю сторону клеточной мембраны. В этом случае движущей силой является концентрационный градиент К+, который затем переносится в клетку Na/К-помпой с непосредственной затратой энергии, т.е. первично активно. Напомним, что энергия здесь затрачивается только на транспорт Nа+ — транспорт веществ экономичен. Переносчик же транспортируется вторично активно: если не будет работать Na/K-помпа, челночные движения переносчика, согласно такому представлению, прекратятся, при этом сохраняется простая диффузия в случае наличия градиента концентрации вещества. Осмос — это частный случай диффузии: движение воды (растворителя) через полупроницаемую мембрану в область с большей концентрацией частиц, т.е. с большим осмотическим давлением. Осмотическое давление — это диффузионное давление, обеспечивающее движение растворителя через полупроницаемую мембрану. Измеряется оно минимальным механическим давлением на раствор (например, с помощью поршня), препятствующим движению растворителя через полупроницаемую мембрану. Осмотическое давление одномолярного раствора чрезвычайно велико: 22,4 атм, в плазме крови оно существенно ниже — 7,6 атм, несколько больше оно внутри клетки, что обеспечивает ее упругость вследствие поступления воды в клетку и растяжения ее мембраны. Вода поступает в клетку через водные каналы и временные поры, образующиеся между молекулами липидов и при смещении белков. Через водные каналы (аквапорионы) могут проходить также малые незаряженные молекулы: кислород, углекислый газ, этанол, мочевина. Фильтрация — переход раствора через полупроницаемую мембрану (стенку сосуда) под действием градиента гидростатического давления между жидкостями по обе стороны этой мембраны. Градиент гидростатического давления создается либо деятельностью сердца (фильтрация в артериальном конце капилляра всех органов и тканей организма, а также образование первичной мочи в почке), либо гладкой мускулатурой желудочно-кишечного тракта и мышечного пресса, обеспечивающих повышение гидростатического давления в полости желудка и кишечника, что способствует всасыванию веществ в кровь. В процессе фильтрации поток воды через мембрану увлекает за собой растворенные вещества, свободно проходящие через полупроницаемую мембрану, при этом частицы переходят через мембрану в неизмененной концентрации. Это наблюдается, например, в артериальном конце капилляров всех органов и тканей организма, в собирательных трубках почки при переходе воды в мозговой слой почки. Растворенные частицы, например мочевина, переходят с жидкостью в интерстиций почки, аминокислоты и глюкоза — в интерстиций всех органов и тканей организма. Натрийзависимый транспорт. В этом случае энергия затрачивается на создание градиента натрия. Имеется два варианта данного механизма транспорта. Первый вариант, когда направление движения транспортируемого вещества совпадает с направлением движения натрия согласно его электрохимическому градиенту (симпорт), например перенос глюкозы в проксимальных канальцах нефрона в клетку канальца из первичной мочи. Глюкоза соединяется с белком-переносчиком, последний соединяется с Nа+, а Nа+, согласно концентрационному и электрическому градиентам, диффундирует в клетку канальца и несет с собой глюкозу. На внутренней стороне клеточной мембраны комплекс распадается, Na+ выводится помпой с непосредственной затратой энергии из клетки в интерстиций вопреки электрохимическому градиенту — первично активно. Глюкоза обратно пройти не может и по механизму простой или облегченной диффузии (с переносчиком) выходит из клетки уже с другой стороны — в интерстиций, а затем в кровь согласно концентрационному градиенту. С помощью натрийзависимого транспорта всасываются аминокислоты и моносахара в кишечнике, если всасывание идет вопреки концентрационному градиенту; происходит обратный захват медиатора в пресинаптическую терминаль из синаптической щели в синапсах ЦНС. Транспорт веществ с помощью Nа+ осуществляется согласно законам диффузии для Na+. Транспортируемое вещество при этом может поступать в клетку вопреки собственному концентрационному градиенту. Движущей силой является электрохимический градиент Nа+. Глюкоза вместе с Nа+ идет в клетку даже в том случае, если ее концентрация в клетке больше, нежели в среде, если, конечно, электрохимический градиент Nа+ превосходит концентрационный градиент глюкозы. Второй вариант натрийзависимого транспорта, когда перемещение транспортируемых частиц направлено в противоположную по отношению к движению Nа+ сторону, — это антипорт (противотранспорт). Этим обменным механизмом регулируется, например, со- держание Са2+ в клетке, рН внутри клетки за счет выведения Н+-иона в обмен на внеклеточный Nа+. В большинстве клеток (а возможно, и во всех) внутриклеточная концентрация Са2+ на несколько порядков ниже внеклеточной. Концентрационный градиент Nа+ участвует в выведении Са2+ из клетки (в соотношении ЗNа+ : 1Са2+). В некоторых клетках (кардиомиоциты, гладкомышечные клетки) он играет главную роль. Об этом свидетельствует, в частности, следующий факт. Выведение Са2+ из клеток снижается, если удалить из внеклеточной среды Nа+. Это позволяет предположить, что Са2+ выводится из клетки в обмен на поступающий в нее Nа+ и противоположно направленные потоки этих ионов сопряжены друг с другом; обеспечивается он переносчиком-обменником. Исходным источником энергии этого процесса опять является градиент Nа+, который в конечном счете формируется за счет АТФ-зависимого активного транспорта Nа+. Поэтому при ингибировании Nа/К-АТФазы сердечными гликозидами, при уменьшении внеклеточной концентрации Nа+ и в бескалиевой среде.(когда Nа+ выводится из клетки недостаточно) Nа/Са-обменник блокируется, в результате чего увеличивается внутриклеточная концентрация Са2+, что ведет к увеличению силы сокращения сердца. Это свойство сердечных гликозидов используется в клинической практике. Вторичный транспорт веществ играет важную роль в деятельности почки, например работа Nа/Н-обменника в канальцах почек. В этом случае выведение Н + из клеток, выстилающих почечный каналец, в просвет канальца сопряжено с поглощением клетками Nа+ в отношении 1:1, что весьма важно: не приходится затрачивать энергию на выполнение электрической работы в процессе регуляции рН среды, поскольку происходит обмен двух одинаковых положительных зарядов. Конкретный механизм работы переносчика-обменника неясен. Переносчик может транспортировать Са2+ и Н+ вопреки их электрическим и концентрационным градиентам только в том случае, если сам переносчик имеет собственный градиент, — его концентрация в клетке больше, чем вне клетки, причем этот градиент должен постоянно поддерживаться, иначе перенос Са2+ и Н+ прекратится. Полагаем, что выведение Са2+ и Н+ из клетки в результате диффузии Nа+ в клетку (противотранспорт) осуществляется следующим образом. На постоянно поступает в клетку, согласно своему электрохимическому градиенту, и транспортирует с собой (в комплексе) молекулы-переносчики с внешней стороны клеточной мембраны на внутреннюю, что и ведет к созданию их концентрационных градиентов, направленных из клетки. Са2+ и Н+ соединяются со своими переносчиками на внутренней стороне клеточной мембраны и транспортируются из клетки в виде комплексов согласно градиентам своих переносчиков. Именно поэтому, например, блокада Nа/К насоса ведет к накоплению Са 2+ в кардиомиоцитах (транспорт Са2+ из клетки уменьшается). Это примеры вторичного транспорта вещества за счет первичного транспорта Nа+, который с помощью помпы выводится из клетки. Переносчики совершают челночные движения за счет работы Nа/К-насоса — вторично активно и транспортируют с собой Са2+ и Н+. Таким образом, механизмы вторичного транспорта веществ весьма разнообразны. Что касается вторичного транспорта ионов, то он осуществляется, как правило, с помощью простой диффузии через специальные ионные каналы. 1.1.3.3.Ионные каналы Ионные каналы образованы белками, они весьма разнообразны по устройству и механизму их действия. Известно более 50 видов каналов, каждая нервная клетка имеет более 5 видов каналов. Состояние активации управляемого ионного канала обычно длится около 1 мс, иногда до 3 мс и значительно больше, при этом через один канал может пройти 12—20 млн ионов. Классификация ионных каналов проводится по нескольким признакам. По возможности управления их функцией различают управляемые и неуправляемые каналы (каналы утечки ионов). Через неуправляемые каналы ионы перемещаются постоянно, но медленно, естественно, при наличии электрохимического градиента, как и в случае быстрого перемещения ионов по управляемым каналам. Управляемые каналы имеют ворота с механизмами их управления, поэтому ионы через них могут проходить только при открытых воротах. По скорости движения ионов каналы могут быть быстрыми и медленными. Например, потенциал действия в скелетной мышце возникает в следствие активации быстрых Nа- и К-каналов. В развитии потенциала действия сердечной мышцы наряду с быстрыми каналами для Nа+ и К+ важную роль играют медленные каналы — кальциевые, калиевые и натриевые. В зависимости от стимула, активирующего или инактивирующего, управляемые ионные каналы различают несколько их видов: а) потенциалчувствительные, б) хемочувствительные,в) механочувствительные, г) кальцийчувствительные, д) каналы, чувствительные ко вторым посредникам. Последние расположены во внутриклеточных мембранах, они изучены недостаточно, так же как и кальцийчувствительные каналы. При взаимодействии медиатора (лиганда) с рецепторами, расположенными на поверхности клеточной мембраны, может происходить открытие ворот хемочувствительных каналов, поэтому их называют также рецепторуправляемыми каналами. Л и г а н д — это биологически активное вещество или фармакологический препарат, активирующий или блокирующий рецептор. Открытие хемочувствительных каналов происходит в результате конформационных изменений рецепторного комплекса. Ворота потенциалзависимых каналов открываются и закрываются при изменении величины мембранного потенциала. Поэтому в конструкции их воротного механизма должны быть частицы, несущие электрический заряд. Механочувствительные каналы активируются и инактивируются сдавливанием и растяжением. Кальцийчувствительные каналы активируются, как видно из названия, кальцием, причем Са 2+ может активировать как собственные каналы, например Са-каналы саркоплазматического ретикулума, так и каналы других ионов, например каналы ионов К+. Мембраны возбудимых клеток (гладких и поперечнополосатых мышц, в том числе и сердечной мышцы, нервной системы) содержат потенциале-, хемо-, механо- и кальцийчувствительные каналы. Следует заметить, что кальцийчувствительные каналы — это один из примеров хемочувствительных каналов. В зависимости от селективности различают ионоселективные каналы, пропускающие только один ион, и каналы, не обладающие селективностью. Имеются Nа-, К-, Са-, С1- и Nа/Саселективные каналы. Есть каналы, пропускающие несколько ионов, например Nа+, К+ и Са2+ в клетках миокарда, т.е. не обладающие селективностью. Наиболее высока степень селективности потенциал чувствительных (потенциалзависимых) каналов, несколько ниже она у хемочувствительных (рецепторзависимых) каналов. Например, при действии ацетилхолина на Н-холинорецептор постсинаптической мембраны в нервно-мышечном синапсе активируются ионные каналы, через которые проходят одновременно ионы Nа+, К+ и Са2+. Механочувствительные каналы являются вообще неселективными для одновалентных ионов и Са2+. Один и тот же ион может иметь несколько видов каналов. Наиболее важными из них для формирования биопотенциалов являются следующие. Каналы для К+: а) неуправляемые каналы покоя (каналы утечки) через которые К + постоянно выходит из клетки, что является главным фактором в формировании мембранного потенциала(потенциала покоя); б) потенциалчувствительные управляемые К-каналы; в) К-каналы, активируемые Са2+; г) каналы, активируемые и другими ионами и веществами, например ацетилхолином, что обеспечивает гиперполяризацию миоцитов сердца. Каналы для Nа+ — управляемые быстрые и медленные и неуправляемые (каналы утечки ионов): а) потенциалчувствительные быстрые Na-каналы — быстро активирующиеся при уменьшении мембранного потенциала, обеспечивают вход Nа+ в клетку во время ее возбуждения; б) рецепторуправляемые Nа-каналы, активируемые ацетилхолином в нервно-мышечном синапсе, глутаматом — в синапсах нейронов ЦНС; в) медленные неуправляемые Nа-каналы—каналы утечки, через которые Nа+ постоянно диффундирует в клетку и пере носит с собой другие молекулы, например глюкозу, аминокислоты, молекулы-переносчики. Таким образом, Nа-каналы утечки обеспечивают вторичный транспорт веществ и участие Nа+ в формировании мембранного потенциала. Каналы для Са2+ весьма разнообразны и наиболее сложны: рецепторуправляемые и потенциалуправляемые, медленные и быстрые: а) медленные кальциевые потенциалчувствительные каналы (новое название: L-типа), медленно активирующиеся при деполяризации клеточной мембраны, обусловливают медленный вход Са2+ в клетку и медленный кальциевый потенциал, например, у кардиомиоцитов. Имеются в исчерченных и гладких мышцах, в нейронах ЦНС; б) быстрые кальциевые потенциалчувствительные каналы саркоплазматического ретикулума обеспечивают выход Са2+ в гиалоплазму и электромеханическое сопряжение . Каналы для хлора имеются в скелетных и сердечных миоцитах, эритроцитах, в небольшом количестве в нейронах и сконцентрированы в синапсах. Потенциалуправляемые С1-каналы имеются в кардиомиоцитах, рецепторуправляемые в синапсах ЦНС и активируются тормозными медиаторами ГАМК и глицином. Структура ионных каналов и их функционирование. Каналы имеют устье и селективный фильтр, а управляемые каналы — и воротный механизм; каналы заполнены жидкостью, их размеры 0,3—0,8 нм. Селективность ионных каналов определяется их размером и наличием в канале заряженных частиц. Эти частицы имеют заряд, противоположный заряду иона, который они притягивают, что обеспечивает проход иона через данный канал (одноименные заряды, как известно, отталкиваются). Через ионные каналы могут проходить и незаряженные частицы. Ионы, проходя через канал, должны избавиться от гидратной оболочки, иначе их размеры будут больше размеров канала. Диаметр иона Nа+, например, с гидратной оболочкой равен 0,3 нм, а без гидратной оболочки — 0,19 нм. Слишком мелкий ион, проходя через селективный фильтр, не может отдать гидратную оболочку, поэтому он не может пройти через канал. Однако, по-видимому, имеются и другие механизмы селективности клеточной мембраны. Гипотеза «просеивания» не в состоянии объяснить, например, почему К + не проходит через открытые Nа-каналы в начале цикла возбуждения клетки, но тем не менее она дает удовлетворительное, а в некоторых случаях и абсолютно убедительное объяснение избирательной (селективной) проницаемости клеточных мембран для разных частиц и ионов. У каналов одного и того же вида возможно взаимовлияние друг на друга. Так, открытие одних электроуправляемых каналов способствует активации рядом расположенных электрочувствительных каналов, в то время как открытие одного хемо- или механочувствительного канала и прохождение через него ионов практически не влияют на состояние соседних таких же каналов. Частичная деполяризация клеточной мембраны за счет активации механочувствительных каналов может привести к активации потенциалчувствительных каналов Nа+, К+ (или Cl-) и Са2+. Ионные каналы блокируются специфическими веществами и фармакологическими препаратами, что широко используется с лечебной целью. Специфическим блокатором механочувствительных каналов является Gadolinium (Gd3+). Блокаторами различных потенциалчувствительных каналов являются разные препараты или химические вещества. Так, например, блокатором хемочувствительного (рецепторчувствительного) канала эффекторных клеток, активируемого ацетилхолином, является атропин. Потенциалзависимые Nа-каналы блокируются тетродотоксином (действует только снаружи клетки); кальциевые — двухвалентными ионами, например ионами никеля, марганца, а также верапамилом, нифедипином. Число ионных каналов на клеточной мембране огромно. Так, на 1 мкм 2 насчитывают примерно 50 Nа-каналов, в среднем они располагаются на расстоянии 140 нм друг от друга. Успешное изучение ионных каналов дает возможность глубже понять механизм действия фармакологических препаратов, а значит, более успешно применять их в клинической практике. Новокаин, например, как местный анестетик снимает болевые ощущения потому, что он, блокируя Nа-каналы, прекращает проведение возбуждения по нервным волокнам. Затраты энергии при транспорте веществ через мембрану. На процессы транспорта веществ в организме расходуется значительная часть энергии. Тем не менее транспорт веществ осуществляется весьма экономично, поскольку обычно транспорт одних частиц обеспечивает переход других, о чем свидетельствуют многие факты. В процессе работы Nа/К-насоса энергия расходуется на перенос Na+ из клетки в окружающую ее среду, тогда как перенос К+ в клетку происходит без непосредственной затраты энергии в результате конформации белковой молекулы (Nа/К-АТФазы) после присоединения К+ к активному ее участку. Создание концентрационного градиента ионов, являясь причиной возникновения мембранного потенциала, одновременно формирует осмотический градиент, который в свою очередь создает предпосылки направленного перемещения воды. Созданный электрический градиент принимает участие в переносе заряженных частиц, обеспечивает возникновение потенциала действия и распространение возбуждения. Процесс перехода воды из одной области в другую, согласно закону осмоса, обеспечивает транспорт всех частиц, растворенных в ней и способных пройти через биологические фильтры (следование за растворителем). Энергия на переход воды непосредственно не затрачивается (вторичный транспорт), не затрачивается, естественно, энергия и на перенос частиц, растворенных в воде, которые следуют вместе с водой. Натрийзависимый транспорт (транспорт неэлектролитов) требует затрат энергии на перенос Nа+ из клетки, но при этом часто диффузия Nа+ в клетку обеспечивает перемещение мембранных переносчиков, соединенных с молекулами глюкозы, аминокислот. Следовательно, глюкоза, аминокислоты могут поступать в клетку вместе с Nа+ (симпорт). Обратный захват медиатора в пресинаптическую терминаль из синаптической щели в синапсах ЦНС также осуществляется с помощью подобного механизма. Натрийзависимый транспорт может также обеспечивать челночные движения молекул-переносчиков, которые в свою очередь транспортируют ионы Са2+, Н+ из клетки (противотранспорт, антипорт) согласно концентрационному градиенту переносчиков. Глюкоза и аминокислоты переносятся с помощью облегченной диффузии вторично активно без непосредственной затраты энергии. Диффузия газов в легких между воздухом и кровью, а также в тканях между кровью и интерстицием происходит вообще без затрат энергии, как и обмен ионов НСO3 и Сl- между эритроцитами и плазмой, когда кровь находится в различных тканях организма и легких. Диффузия веществ из кишечника, например глюкозы в кровь после приема с пищей, если ее концентрация в кишечнике больше, происходит согласно градиенту концентрации, на создание которого клетки организма энергию не затрачивают. Эти два случая (диффузия газов в легком, тканях и частиц — в кишечнике) являются исключением, когда транспорт в организме осуществляется вообще без затраты энергии. Однако энергия расходуется на доставку этих веществ в организм — дыхательные движения, приготовление пищи и обработка ее в пищеварительной системе. Энергия, затрачиваемая сердцем на движение крови по сосудам, обеспечивает не только транспорт кровью всех веществ, в том числе и газов, но и образование фильтрата (движение всех частиц) в тканях организма и мочеобразование. Таким образом, первичный транспорт нескольких ионов, главным из которых является Nа+, обеспечивает перенос подавляющего большинства веществ в организме. Все виды транспорта играют жизненно важную роль в процессе жизнедеятельности клеток и организма в целом. В частности, транспорт ионов обеспечивает формирование мембранных потенциалов клеток мышечной и нервной тканей, одной из функций последней является регуляция различных систем организма. 1.2. ЭЛЕКТРИЧЕСКИЕ ЯВЛЕНИЯ В ТКАНЯХ 1.2.1.Открытие «животного электричества» В конце XVIII в. (1786 г.) профессор анатомии Болонского университета Луиджи Гальвани провел ряд опытов, положивших начало целенаправленным исследованиям биоэлектрических явлений. В первом опыте, подвешивая препарат обнаженных задних лапок лягушек с помощью медного крючка на железной решетке, Л.Гальвани обнаружил, что всякий раз при касании мышцами решетки они отчетливо сокращались. Л.Гальвани высказал предположение о том, что сокращение мышц является следствием воздействия на них электричества, источником которого выступают «животные ткани» — мышцы и нервы. Однако другой итальянский исследователь — физик и физиолог Вольта оспорил это заключение. По его мнению, причиной сокращения мышц был электрический ток, возникающий в области контакта двух разнородных металлов (медь и железо — гальваническая пара) с тканями лягушки. С целью проверки своей гипотезы Л.Гальвани поставил второй опыт, в котором нерв нервно-мышечного препарата набрасывался на мышцу стеклянным крючком так, чтобы он касался поврежденного и неповрежденного ее участков. В этом случае мышца также сокращалась. Второй опыт Л.Гальвани считается опытом, в котором были получены абсолютные доказательства существования «животного электричества». Регистрация биоэлектрических явлений впервые осуществлена с помощью гальванометра, одна из клемм которого присоединялась к поврежденному участку мышцы, другая — к неповрежденному [Маттеучи, 1838], при этом стрелка гальванометра отклонялась. Размыкание цепи гальванометра сопровождалось возвращением стрелки гальванометра в прежнее (нулевое) положение. В настоящее время существует много различных вариантов регистрации биоэлектрических явлений, но их можно объединить в две основные группы: по местоположению электродов (внутриклеточное и внеклеточное отведения) и по числу отводящих электродов (монополярное, биполярное, мультиполярное отведения). Электроды могут быть металлическими и стеклянными. В случае монополярного отведения один электрод активный, второй — индифферентный, его площадь в десятки раз больше активного электрода. При внутриклеточном отведении применяется стеклянный микроэлектрод, который представляет собой микропипетку с диаметром кончика 0,5—1 мкм. Микроэлектрод заполняется 3М КС1. В широкую часть микроэлектрода вставляется серебряная проволочка, соединяемая с регистрирующим устройством. Индифферентным внеклеточным электродом является хлорированная серебряная пластинка. При внутриклеточном отведении клетка способна функционировать в течение нескольких часов. Микроэлектродный способ регистрации биопотенциалов обеспечил изучение механизмов создания электрических зарядов клеткой, возникновения возбуждения в живых клетках. Однако еще задолго до появления микроэлектродной техники (конец XIX в.) стало ясно, что «животное электричество» обусловлено процессами, происходящими на клеточной мембране (Герман, Дюбуа-Реймон, Бернштейн). В настоящее время достаточно хорошо изучены механизмы формирования мембранного потенциала покоя (ПП) и потенциала действия (ПД), т.е. процесса возбуждения клетки. Сущность процесса возбуждения заключается в следующем. Все клетки организма имеют электрический заряд, обеспечиваемый неодинаковой концентрацией анионов и катионов внутри и вне клетки. Различная концентрация анионов и катионов внутри и вне клетки является следствием работы ионных насосов и неодинаковой проницаемости клеточной мембраны для разных ионов. Однако свойства мембран возбудимых клеток существенно отличаются от таковых невозбудимых клеток. При действии раздражителя на клетку возбудимой ткани изменяется проницаемость ее мембраны (обычно сначала для Na+ и быстро возвращается к норме, затем для К+ и быстро возвращается к норме), вследствие чего ионы быстро перемещаются согласно электрохимическому градиенту (совокупность концентрационного и электрического градиентов) — это и есть процесс возбуждения. Его основой является потенциал покоя (мембранный потенциал). 1.2.2.Потенциал покоя (ПП) Потенциал покоя — относительно стабильная разность электрических потенциалов между наружной и внутренней сторонами клеточной мембраны. Его величина обычно варьирует в пределах 30—90 мВ (в волокнах скелетной мышцы — 60—90 мВ, в нервных клетках — 50—80 мВ, в гладких мышцах — 30— 70 мВ, в сердечной мышце — 80—90 мВ). При регистрации ПП луч осциллографа во время прокола мембраны клетки микроэлектродом скачком отклоняется и показывает отрицательный заряд внутри. ПП играет исключительно важную роль в жизнедеятельности самой клетки и организма в целом, поскольку является основой для возникновения возбуждения (потенциала действия), с помощью которого нервная система воспринимает и перерабатывает информацию, регулирует деятельность внутренних органов и опорно-двигательного аппарата посредством запуска процессов возбуждения и сокращения в мышце. Нарушение процессов возбуждения в кардиомиоцитах ведет к остановке сердца. Согласно мембранно-ионной теории [Бернштейн, Ходжкин, Хаксли, Катц, 1902— 1952], непосредственной причиной формирования ПП является неодинаковая концентрация анионов и катионов внутри и вне клетки (табл. 1 ). В нервных и мышечных клетках концентрация К+ внутри клетки в 30—40 раз больше, чем вне клетки; концентрация Na+ вне клетки в 10—12 раз больше, нежели в клетке. Ионов Сlвне клетки в 30—50 раз больше, чем внутри клетки. В клетке имеется небольшое количество ионов Mg2+. Кальций в свободном состоянии находится в основном вне клетки. Он содержится также в эндоплазматическом ретикулуме; в гиалоплазме его очень мало. Это обусловливается отчасти активным транспортом Са2+ наружу через клеточную мембрану, отчасти поглощением его эндоплазматическим ретикулумом (это резервуар для Са2+) и другими органеллами, например митохондриями, связыванием Са2+ цитратом, глутаматом. В клетке находятся также крупномолекулярные анионы; главным образом это отрицательно заряженные белковые молекулы, например глутамат, аспартат, а также органические фосфаты. Различные ионы распределены неравномерно по обе стороны клеточной мембраны, во-первых, вследствие неодинаковой проницаемости клеточной мембраны для различных ионов, во-вторых — в результате работы ионных насосов, транспортирующих ионы в клетку и из клетки вопреки концентрационному и электрическому градиентам. Таблица 1. Внутри- и внеклеточные концентрации ионов (ммоль∙ л-1) в мышечных клетках гомойотермных животных (А- — высокомолекулярные внутриклеточные анионы) Внутриклеточная концентрация Внеклеточная концентрация Na+ К+ Са2+ 12 155 -8 10 -10-7 Na+ К+ Са2+ 145 4 2 Cl- 4 Сl- 120-130 НСОз 8 НСОз 27 А- 155 Прочие катионы 5 Роль проницаемости клеточной мембраны в формировании ПП. Проницаемость клеточной мембраны — это ее способность пропускать воду, незаряженные и заряженные частицы (ионы) согласно законам диффузии и фильтрации. Проницаемость клеточной мембраны определяется следующими факторами: 1) наличием в составе мембраны различных ионных каналов — управляемых (с воротным механизмом) и неуправляемых (каналов утечки); 2) размерами каналов и размерами частиц; 3) растворимостью частиц в мембране (клеточная мембрана проницаема для растворимых в ней липидов и непроницаема для пептидов). Термин «проводимость» следует использовать только лишь применительно к заряженным частицам. Следовательно, проводимость — это способность заряженных частиц (ионов) проходить через клеточную мембрану согласно электрохимическому градиенту. Ионы, подобно незаряженным частицам, переходят через мембрану из области с высокой концентрацией в область с низкой концентрацией. При большом градиенте концентрации и хорошей проницаемости мембраны, разделяющей соответствующие растворы, проводимость ионов может быть высокой, при этом наблюдается односторонний ток ионов. Если разность концентраций ионов по обе стороны мембраны снизится, то проводимость ионов также уменьшится, хотя проницаемость сохранится прежней — высокой. Кроме того, проводимость иона при неизменной проницаемости мембраны зависит и от заряда иона: одноименные заряды отталкиваются, разноименные — притягиваются. Возможна ситуация, когда при хорошей проницаемости мембраны проводимость ионов через мембрану оказывается низкой или нулевой в случае отсутствия движущей силы — концентрационного и(или) электрического градиентов (их совокупность называют электрохимическим градиентом). Таким образом, проводимость иона зависит от его электрохимического градиента и от проницаемости мембраны: чем они больше, тем лучше проводимость иона через мембрану. Перемещения ионов в клетку и из клетки, согласно концентрационному и электрическому градиентам в состоянии покоя клетки, осуществляются преимущественно через неуправляемые (без воротного механизма) каналы, их называют также каналами утечки. Неуправляемые каналы всегда открыты, они практически не меняют своей пропускной способности при электрическом воздействии на клеточную мембрану и ее возбуждении. Неуправляемые каналы подразделяются на ионоселективные каналы (например, калиевые медленные неуправляемые каналы) и иононеселективные каналы. Последние пропускают различные ионы — К+, Na+, Сl-. Роль проницаемости клеточной мембраны и различных ионов в формировании ПП. Na+ + и К в покоящейся клетке перемещаются через мембрану согласно законам диффузии, при этом К+ из клетки выходит в значительно большем количестве, чем входит Na+ в клетку, поскольку проницаемость клеточной мембраны для К+ примерно в 25 раз больше проницаемости для Na+. Органические анионы из-за своих больших размеров не могут выходить из клетки, поэтому внутри клетки в состоянии покоя отрицательных ионов оказывается больше, чем положительных. По этой причине клетка изнутри имеет отрицательный заряд. Интересно, что во всех точках клетки отрицательный заряд практически одинаков. Об этом свидетельствует одинаковая величина ПП при введении микроэлектрода на разную глубину внутрь клетки, как это имело место в опытах Ходжкина, Хаксли и Катца. Гигантский аксон кальмара (его диаметр около 1 мм) в этом опыте находился в морской воде, один электрод вводился в аксон, другой помещали в морскую воду. Заряд внутри клетки является отрицательным как абсолютно (в гиалоплазме клетки содержится больше анионов, нежели катионов), так и относительно наружной поверхности клеточной мембраны. Однако превышение абсолютного числа анионов над числом катионов в клетке чрезвычайно мало. Но этого различия достаточно для создания разности электрических потенциалов внутри и вне клетки. Главным ионом, обеспечивающим формирование ПП, является ион К+. Об этом свидетельствуют результаты опыта с перфузией внутреннего содержимого гигантского аксона кальмара солевыми растворами. При уменьшении концентрации К + в перфузате ПП уменьшается, при увеличении концентрации К+ ПП увеличивается. В покоящейся клетке устанавливается динамическое равновесие между числом выходящих из клетки и входящих в клетку ионов К+. Электрический и концентрационный градиенты противодействуют друг другу: согласно концентрационному градиенту К+ стремится выйти из клетки, отрицательный заряд внутри клетки и положительный заряд наружной поверхности клеточной мембраны препятствуют этому. Когда концентрационный и электрический градиенты уравновесятся, число выходящих из клетки ионов К+ сравнивается с числом входящих ионов К+ в клетку. В этом случае на клеточной мембране устанавливается так называемый равновесный калиевый потенциал. Равновесный потенциал для любого иона можно рассчитать по формуле Нернста. Концентрация положительно заряженного иона, находящегося снаружи, в формуле Нернста располагается в числителе, иона, находящегося внутри клетки, — в знаменателе. Для отрицательно заряженных ионов расположение противоположное. где Eion — потенциал, создаваемый данным ионом; R — газовая постоянная (8,31 Дм); Т — абсолютная температура (273+37 °С); Z — валентность иона; F — постоянная Фарадея (9,651 04); [ion]i — концентрация иона внутри клетки inside; [ion]0 — концентрация иона во внешней среде клетки (outside). При температуре 37 °С равновесный потенциал для К+ с учетом соотношения концентрации его снаружи и изнутри (1/39) и валентности 1 равен —97 мВ. Однако реальный ПП миоцита теплокровного животного несколько меньше — около —90 мВ. Это объясняется тем, что в создании потенциала ПП принимают участие и другие ионы, хотя их роль менее значительна в сравнении с ролью иона К+. Равновесный потенциал для Na+ равен +55 мВ. В целом ПП — это производное равновесных потенциалов всех ионов, находящихся внутри и вне клетки и поверхностных зарядов клеточной мембраны. Вклад Na+ и Сl- в создание ПП. Проницаемость клеточной мембраны в покое для Na+ очень низкая — намного ниже, чем для К+, тем не менее она имеет место, поэтому ионы Na+, согласно концентрационному и электрическому градиентам, стремятся и в небольшом количестве проходят внутрь клетки. Это ведет к уменьшению ПП, так как на внешней поверхности клеточной мембраны суммарное число положительно заряженных ионов уменьшается, хотя и незначительно, а часть отрицательных ионов внутри клетки нейтрализуется входящими в клетку положительно заряженными ионами Na+. Вход Na+ внутрь клетки уменьшает ПП. Что касается Сl-, его влияние на величину ПП противоположно влиянию Na+ и зависит от проницаемости клеточной мембраны для Сl- (она в 2 раза ниже, чем для К+). Дело в том, что Сl-, согласно концентрационному градиенту, стремится и проходит в клетку. Концентрации ионов К+ и Сl- близки между собой. Но Сl- находится в основном вне клетки, а К+ — внутри клетки. Препятствует входу Сl- в клетку электрический градиент, поскольку заряд внутри клетки отрицательный, как и заряд Сl-. Наступает равновесие сил концентрационного градиента, способствующего входу Сl- в клетку, и электрического градиента, препятствующего входу Сl- в клетку. Поэтому внутриклеточная концентрация Сl- равна всего лишь 5—10 ммоль/л, а вне клетки — 120—130 ммоль/л. При поступлении Сl- внутрь клетки число отрицательных зарядов вне клетки несколько уменьшается, а внутри клетки увеличивается: Сlдобавляется к крупным белковой природы анионам, находящимся внутри клетки. Эти анионы из-за своих больших размеров не могут пройти через каналы клеточной мембраны наружу клетки — в интерстиций. Таким образом, Сl-, проникая внутрь клетки, увеличивает ПП. Частично, как и вне клетки, Na+ и Сl- внутри клетки нейтрализуют друг друга. Вследствие этого совместное поступление Na+ и Сl- внутрь клетки не сказывается существенно на величине ПП. Роль поверхностных зарядов клеточной мембраны и ионов Са2+ в формировании ПП. Наружная и внутренняя поверхности клеточной мембраны несут собственные электрические заряды, преимущественно с отрицательным знаком. Это полярные молекулы клеточной мембраны — гликолипиды, фосфолипиды, гликопротеиды. Фиксированные наружные отрицательные заряды, нейтрализуя положительные заряды внешней поверхности мембраны, уменьшают ПП. Фиксированные внутренние отрицательные заряды клеточной мембраны, напротив, суммируясь с анионами внутри клетки, увеличивают ПП. Роль ионов Са 2+ в формировании ПП заключается в том, что они взаимодействуют с наружными отрицательными фиксированными зарядами мембраны клетки и отрицательными карбоксильными группами интерстиция и нейтрализуют их, что ведет к увеличению и стабилизации ПП. Таким образом, ПП — это алгебраическая сумма не только всех зарядов ионов вне и внутри клетки, но также алгебраическая сумма отрицательных внешних и внутренних поверхностных зарядов самой мембраны. Роль проницаемости клеточной мембраны в происхождении ПП иллюстрируется на модельном опыте (рис.1). Сосуд разделен полупроницаемой мембраной. Обе его половины заполнены раствора ми K2SO4 различной концентрации (С1 и С2), причем С1< С2. Мембрана проницаема для К+ и непроницаема для SO2-4. Ионы К+ перемещаются, согласно концентрационному градиенту, из раствора С2 в раствор С1. Поскольку ионы SO2-4 не могут пройти в раствор С1, где их концентрация тоже ниже, мембрана поляризуется и между двумя ее поверхностями возникает разность электрических потенциалов, соответствующая равновесному калиевому потенциалу (Ек). В растворе С2 остается больше отрицательных зарядов, в растворе С1 становится больше положительных зарядов. При проведении измерений потенциал окружающей клетку среды принимают за величину, равную нулю. Относительно нулевого потенциала внешней среды потенциал внутренней среды клетки, как отмечалось выше, составляет величину порядка —60—90 мВ. Повреждение клетки приводит к повышению проницаемости клеточных мембран, в результате чего различие проницаемости для К+ и Na+ уменьшается; ПП при этом снижается. Подобные изменения встречаются при ишемии ткани, например миокарда. У сильно поврежденных клеток ПП может снизиться до уровня доннановского равновесия, что нарушает электрическую активность клеток органа в целом или его части. Однако и в норме происходит перемещение ионов согласно электрохимическому градиенту. Роль ионных насосов в формировании ПП. В результате непрерывного перемещения различных ионов через клеточную мембрану их концентрация внутри и вне клетки постепенно должна выравниваться. Однако, несмотря на постоянную диффузию ионов (утечку ионов), ПП клеток остается на одном уровне. Следовательно, кроме собственных ионных механизмов формирования ПП, связанных с различной проницаемостью клеточной мембраны, имеется активный механизм поддержания градиентов концентрации различных ионов внутри и вне клетки. Им являются ионные насосы, в частности Na/K-насос (помпа). Ионный насос — транспортная система, обеспечивающая перенос иона с непосредственной затратой энергии вопреки концентрационному и электрическому градиентам. Если заблокировать освобождение энергии, например, динитрофенолом, в течение 1 ч выведение Na+ из клетки сократится примерно в 100 раз. Как выяснилось, выведение Na+ сопряжено с транспортом К+, что можно продемонстрировать при удалении К+ из наружного раствора. Если К+ на наружной стороне мембраны нет, работа насоса блокируется, перенос Na+ из клетки в этом случае падает, составляя примерно 30 % от нормального уровня. Сопряженность транспорта Na+ и К+ уменьшает расход энергии примерно в 2 раза по сравнению с той, которая потребовалась бы при несопряженном транспорте. В целом траты энергии на активный транспорт веществ огромны: лишь Na/K-насос потребляет 1/3 всей энергии, расходуемой организмом в покое. За 1 с один Na/K-насос (одна молекула белка) переносит 150—600 ионов Na+. Накопление Na в клетке стимулирует работу Na/K-насоса, уменьшение Na+ в клетке снижает его активность, поскольку снижается вероятность контакта ионов с соответствующим переносчиком. В результате сопряженного транспорта Na+ и К+ поддерживается постоянная разность концентраций этих ионов внутри и вне клетки. Одна молекула АТФ обеспечивает один цикл работы Na/K-насоса — перенос трех ионов Na+ за пределы клетки и двух ионов К+ внутрь клетки. Асимметричный перенос ионов Na/K-насосом поддерживает избыток положительно заряженных частиц на наружной поверхности клеточной мембраны и отрицательных зарядов внутри клетки, что позволяет считать Na/K-насос структурой электрогенной, дополнительно увеличивающей ПП примерно на 5—10 мВ (в среднем около 10 % у разных возбудимых клеток — у одних больше, у других меньше). Данный факт свидетельствует о том, что решающим фактором в формировании ПП является селективная ,проницаемость клеточной мембраны для разных ионов. Если уравнять проницаемость клеточной мембраны для всех ионов, то ПП будет составлять только 5—10 мВ — за счет работы N/K-помпы. Нормальная величина ПП является необходимым условием возникновения процесса возбуждения клетки, т.е. возникновения и распространения потенциала действия, инициирующего специфическую деятельность клетки. 1.2.3.Потенциал действия (ПД) ПД — это электрофизиологический процесс, выражающийся в быстром колебании мембранного потенциала покоя вследствие перемещения ионов в клетку и из клетки и способный распространяться без декремента (без затухания). ПД обеспечивает передачу сигналов между нервными клетками, нервными центрами и рабочими органами, в мышцах ПД обеспечивает процесс электромеханического сопряжения. Схематично ПД представлен на рис. , А. Величина ПД колеблется в пределах 80— 130 мВ, длительность пика ПД нервного волокна — 0,5—1 мс, волокна скелетной мышцы — до 10 мс с учетом замедления ре-поляризации в конце ее. Длительность ПД сердечной мышцы —300—400 мс. Амплитуда ПД не зависит от силы раздражения — она всегда максимальна для данной клетки в конкретных условиях: ПД подчиняется закону «все или ничего», но не подчиняется закону силовых отношений — закону силы. ПД либо совсем не возникает при раздражении клетки, если оно мало, либо достигает максимальной величины, если раздражение является пороговым или сверхпороговым. Следует отметить, что слабое (подпороговое) раздражение может вызвать локальный потенциал. Он подчиняется закону силы: с увеличением силы стимула величина его возрастает. В составе ПД различают три фазы: 1 — деполяризацию, т.е. исчезновение заряда клетки — уменьшение мембранного потенциала до нуля; 2 — инверсию, т.е. изменение знака заряда клетки на обратный, когда внутренняя сторона мембраны клетки заряжается положительно, а внешняя — отрицательно (лат. inversio — переворачивание); 3 — реполяризацию, т.е. восстановление исходного заряда клетки, когда внутренняя поверхность клеточной мембраны снова заряжается отрицательно, а наружная — положительно. Механизм возникновения ПД. Если действие раздражителя на клеточную мембрану приводит к началу развития ПД, далее сам процесс развития ПД вызывают фазовые изменения проницаемости клеточной мембраны, что обеспечивает быстрое движение Na+ в клетку, а К+ — из клетки. Это наиболее часто встречаемый вариант возникновения ПД. Величина мембранного потенциала при этом сначала уменьшается, а затем снова восстанавливается до исходного уровня. На экране осциллографа отмеченные изменения мембранного потенциала предстают в виде пикового потенциала — ПД. Он возникает вследствие накопленных и поддерживаемых ионными насосами градиентов концентраций ионов внутри и вне клетки, т.е. за счет потенциальной энергии в виде электрохимических градиентов ионов. Если заблокировать процесс выработки энергии, потенциалы действия некоторый период времени будут возникать. Но после исчезновения градиентов концентраций ионов (устранения потенциальной энергии) клетка генерировать ПД не будет. Рассмотрим фазы ПД. 1) фаза деполяризации — процесс исчезновения заряда клетки до нуля; 2) фаза инверсии — изменение знака заряда клетки на противоположный, т.е. весь период ПД, когда внутри клетки заряд положительный, а снаружи отрицательный; 3) фаза реполяризации — восстановление заряда клетки до исходной величины (возврат к потенциалу покоя). 1. Фаза деполяризации (см. рис.2, А-1). При действии деполяризующего раздражителя на клетку (медиатор, электрический ток) начальная частичная деполяризация клеточной мембраны происходит без изменения ее проницаемости для ионов. Поэтому, несмотря на наличие движущей силы (концентрационный и электрический градиенты), движение Na+ в клетку через быстрые потенциалчувствительные Na-каналы отсутствует. Напомним, что клетка внутри заряжена отрицательно (разноименные заряды притягиваются друг к другу), а концентрация Na+ вне клетки в 10—12 раз больше, чем внутри клетки. Условием же, обеспечивающим вход Na+ в клетку, является увеличение проницаемости клеточной мембраны, которая определяется состоянием воротного механизма Na-каналов (в некоторых клетках, например в кардиомиоцитах, в волокнах гладкой мышцы, важную роль в возникновении ПД играют управляемые каналы для Са2+). Длительность пребывания электроуправляемого канала в открытом состоянии зависит от величины мембранного потенциала. Суммарный ток ионов в любой момент определяется числом открытых каналов клеточной мембраны и наличием электрохимических градиентов ионов. Часть ионного канала, обращенная во внеклеточное пространство, отличается от части канала, обращенной внутрь клеточной среды (П.Г.Костюк). Воротный механизм Nа-каналов расположен на внешней и внутренней сторонах клеточной мембраны, воротный механизм К-каналов — на внутренней (К+ движется из клетки наружу). В каналах для Nа+ имеются активационные m-ворота, которые расположены с внешней стороны клеточной мембраны (Na+ движется внутрь клетки во время ее возбуждения), и инактивационные h-ворота, расположенные с внутренней стороны клеточной мембраны. В условиях покоя активационные m-ворота закрыты, инактивационные h-ворота преимущественно (около 80 %) открыты (см. рис. 2, Б-1); закрыты также калиевые активационные ворота (см. рис.2, В-1), инактивационных ворот для К+ нет. Некоторые авторы называют m-ворота быстрыми, h-ворота — медленными, поскольку они в процессе возбуждения клетки реагируют позже, нежели m-ворота. Однако более поздняя реакция h-ворот связана с изменением заряда клетки, как и m-ворот, которые открываются в процессе деполяризации клеточной мембраны. h-ворота закрываются в фазе инверсии, когда заряд внутри клетки становится положительным, что и является причиной их закрытия, при этом нарастание пика ПД прекращается. По существу m-ворота являются ранними, h-ворота — поздними. Когда деполяризация клетки достигает критической величины (Екр., критический уровень деполяризации — КУД), которая обычно составляет 50 мВ (возможны и другие величины), проницаемость мембраны для Na+ резко возрастает — открывается большое число потенциалзависимых m-ворот Na-каналов (см. рис.2, Б-2) и Na+ лавиной устремляется в клетку. Через один открытый Na-канал за 1 мс проходит до 6000 ионов. В результате интенсивного тока Na+ внутрь клетки процесс деполяризации проходит очень быстро. Развивающаяся деполяризация клеточной мембраны вызывает дополнительное увеличение ее проницаемости и, естественно, проводимости Na+ — открываются все новые и новые активационные m-ворота Na-каналов, что придает току Na+ в клетку характер регенеративного процесса. В итоге ПП исчезает, становится равным нулю. Фаза деполяризации на этом заканчивается. 2. Фаза инверсии. После исчезновения ПП вход Na+ в клетку продолжается (m-ворота Na-каналов еще открыты), поэтому число положительных ионов в клетке превосходит число отрицательных ионов, заряд внутри клетки становится положительным, снаружи — отрицательным. Процесс перезарядки мембраны представляет собой вторую фазу потенциала действия — фазу инверсии (см. рис.2, А-2). Теперь электрический градиент препятствует входу Na+ внутрь клетки (положительные заряды отталкиваются друг от друга), Na-проводимость снижается. Тем не менее, некоторый период времени (доли миллисекунды) Na+ продолжает входить в клетку — об этом свидетельствует продолжающееся нарастание ПД. Это означает, что концентрационный градиент, обеспечивающий движение Na+ в клетку, сильнее электрического, препятствующего входу Na+ в клетку. Во время деполяризации мембраны увеличивается проницаемость ее и для Са2+, он также идет в клетку, но в нервных волокнах, нейронах и клетках скелетной мускулатуры роль Са2+ в развитии ПД мала. В клетках гладкой мышцы и миокарда его роль существенна. Таким образом, вся восходящая часть пика ПД в большинстве случаев обеспечивается в основном входом Na+ в клетку. Примерно через 0,5—2 мс и более после начала деполяризации (это время зависит от вида клетки) рост ПД прекращается вследствие закрытия натриевых инактивационных h-ворот и прекращения поступления Na+ в клетку (см. рис.2, Б-3) и открытия ворот К-каналов, ведущего к резкому возрастанию выхода К+ из клетки (см. рис.2, В-2). Препятствуют также росту пика ПД электрический градиент (клетка внутри в этот момент заряжена положительно), а также выход К+ из клетки по каналам утечки. Поскольку К+ находится преимущественно внутри клетки, он, согласно концентрационному градиенту, быстро выходит из клетки после открытия ворот К+ каналов, вследствие чего уменьшается число положительно заряженных ионов в клетке. Заряд клетки снова начинает уменьшаться. В период нисходящей части фазы инверсии выходу К+ из клетки способствует также и электрический градиент. К+ выталкивается положительным зарядом из клетки и притягивается отрицательным зарядом снаружи клетки. Так продолжается до полного исчезновения положительного заряда внутри клетки (до конца нисходящей части фазы инверсии — см. рис.2, А-2, пунктирная линия). Калий выходит из клетки не только по управляемым каналам, ворота которых открыты, но и по неуправляемым — каналам утечки, что несколько замедляет ход восходящей части ПД и ускоряет ход нисходящей составляющей ПД. Таким образом, изменение мембранного потенциала покоя ведет к последовательному открытию или закрытию электроуправляемых ворот ионных каналов и движение ионов, согласно электрохимическому градиенту, — возникновению ПД. Все фазы являются регенеративными — необходимо только достичь критического уровня деполяризации, далее ПД развивается за счет потенциальной энергии клетки в виде электрохимических градиентов, т.е. вторично активно. Амплитуда ПД складывается из величины ПП и величины фазы инверсии, составляющей у разных клеток 10—50 мВ. Если мембранный потенциал покоящейся клетки мал, амплитуда ПД этой клетки небольшая. 3. Фаза реполяризации (см. рис.2, А-3) связана с тем, что проницаемость клеточной мембраны для К+ все еще высока (активационные ворота калиевых каналов открыты), К+ продолжает быстро выходить из клетки согласно концентрационному градиенту. Поскольку клетка теперь уже снова внутри имеет отрицательный заряд, а снаружи — положительный (см. рис. 2, А-3), электрический градиент препятствует выходу К+ из клетки, что снижает его проводимость, хотя он продолжает выходить. Это объясняется тем, что действие концентрационного градиента выражено значительно сильнее электрического градиента. Таким образом, вся нисходящая часть пика ПД обусловлена выходом К+ из клетки. Нередко в конце ПД наблюдается замедление реполяризации, что объясняется уменьшением проницаемости клеточной мембраны для К+ и замедлением выхода его из клетки из-за закрытия значительной части ворот К-каналов. Вторая причина замедления тока К+ из клетки связана с возрастанием положительного заряда наружной поверхности клетки и формированием противоположно направленного электрического градиента. При наличии определенного ПП, как следует из описанных механизмов, ПД не должен возникать, если клетку перенести в солевой раствор, не содержащий Na+, что и было продемонстрировано в экспериментах. Если аксон помещать в растворы с различной концентрацией Na+, величина ПД будет уменьшаться с уменьшением концентрации Na+ в окружающей нервное волокно среде. ПД также уменьшается, если частично заблокировать Naканалы тетродотоксином. При их полной блокаде ПД вообще не возникает. Возможность временного нарушения работы Na-каналов широко используется в клинической практике. Так, с помощью местных анестетиков расстраивается механизм управления ворот Na-каналов. Это приводит к прекращению проведения возбуждения в соответствующем участке нерва, устранению болевых ощущений, например, при хирургических вмешательствах. Таким образом, главную роль в возникновении ПД играет Na+, входящий в клетку при повышении проницаемости клеточной мембраны и обеспечивающий всю восходящую часть пика ПД. При замене Na+ в среде на другой ион, например холин, ПД в нервной и мышечной клетках скелетной мускулатуры не возникает. Однако проницаемость мембраны для К+ тоже играет важную роль. Если повышение проницаемости для К+ предотвратить тетраэтиламмонием, мембрана после ее деполяризации реполяризуется гораздо медленнее, только за счет медленных неуправляемых каналов (каналов утечки ионов), через которые К+ будет выходить из клетки. Роль Са2+ в возникновений ПД в нервных и мышечных клетках скелетной мускулатуры незначительна. Однако Са2+ играет важную роль в возникновении ПД в сердечной и гладкой мышцах, в передаче импульсов от одного нейрона к другому, от нервного волокна к мышечному, в обеспечении мышечного сокращения. Снижение содержания Са2+ в крови на 50 %, что иногда встречается в клинической практике, может привести к судорожным сокращениям скелетных мышц. Это объясняется значительным повышением возбудимости нервных и мышечных клеток в результате снижение ПП из-за уменьшения степени нейтрализации отрицательных фиксированных зарядов на поверхности клеточной мембраны и отрицательно заряженных карбоксильных групп интерстиция. Вследствие этого повышается реактивность нейронов, так как ПП приближается к Екр, кроме того, начинается активация Naканалов. В ответ на поступление самой незначительной импульсации нейроны начинают генерировать ПД в большом количестве, что проявляется в судорожных сокращениях скелетной мускулатуры. При этом нейроны ЦНС и нервные волокна могут разряжаться и спонтанно. Следовые явления в процессе возбуждения клетки. В конце ПД (например, в скелетной мышце) нередко наблюдается замедление реполяризации, что называют отрицательным следовым потенциалом. Затем может быть зарегистрирована гиперполяризация клеточной мембраны, что более характерно для нервных клеток. Это явление называют положительным следовым потенциалом. Вслед за ним может возникнуть частичная деполяризация клеточной мембраны, которую также называют отрицательным следовым потенциалом, как и в случае замедления фазы реполяризации. Во-первых, необходимо отметить, что имеет место терминологическая путаница (два разных по происхождению отрицательных следовых потенциала). Во-вторых, замедление фазы реполяризации вообще не является следовым процессом — это часть фазы реполяризации, которая задерживается вследствие уменьшения проницаемости клеточной мембраны для К+ и замедления выхода его из клетки. В-третьих, термин «потенциал» применяется в других случаях: ПП, ПД, локальный потенциал, рецепторный потенциал, синаптический потенциал. Вслед за ПД возникают не потенциалы — сначала следовая гиперполяризация, а затем — следовая деполяризация, причем следовые явления возникают после полного восстановления мембранного потенциала до исходного уровня, но не как результат замедления фазы ре-поляризации, являющейся одной из фаз ПД. В сердечной и гладкой мышцах тоже наблюдается замедленная реполяризация, но на более высоком уровне — плато. Следовая гиперполяризация клеточной мембраны (см. рис.2) обычно является результатом еще сохраняющейся повышенной проницаемости клеточной мембраны для К+, она характерна для нейронов. Активационные ворота К-каналов еще не полностью закрыты, поэтому К+ продолжает выходить из клетки согласно концентрационному градиенту, что и ведет к гиперполяризации клеточной мембраны. Постепенно проницаемость клеточной мембраны возвращается к исходной (натриевые и калиевые ворота возвращаются в исходное состояние), а мембранный потенциал становится таким же, каким он был до возбуждения клетки. Na/K-помпа непосредственно за фазы потенциала действия не отвечает, хотя она работает непрерывно в покое и продолжает работать во время развития ПД. Потенциал действия развивается благодаря движению ионов с огромной скоростью согласно концентрационному и частично электрическому градиентам. Возможно, Na/K-помпа способствует развитию следовой гиперполяризации. В некоторых клетках, например в тонких немиелинизированных нервных волокнах (болевых афферентах), хорошо выражена длительная следовая гиперполяризация. Она обеспечивается работой Na/K-насоса, активируемого процессом возбуждения (накопившимся в клетке Na+: на каждые 2К+, возвращаемых в клетку, выводится 3Na+ из клетки). Если блокировать выработку энергии, то эта гиперполяризация исчезает. Следовая деполяризация также характерна для нейронов, она может быть зарегистрирована и в клетках скелетной мышцы. Механизм ее изучен недостаточно. Возможно, это связано с кратковременным повышением проницаемости клеточной мембраны для Na+ и входом его в клетку согласно концентрационному и электрическому градиентам. Резерв в клетке ионов, обеспечивающих возникновение возбуждения (ПД), огромен. Концентрационные градиенты ионов в результате одного цикла возбуждения практически не изменяются. Клетка может возбуждаться до 5-105 раз без подзарядки, т.е. без работы Na/Kнасоса. Число импульсов, которое генерирует и проводит нервное волокно, зависит от его толщины, что определяет запас ионов: чем толще нервное волокно, тем больше запас ионов, тем больше импульсов оно может генерировать (от нескольких сот до нескольких сотен тысяч) без участия Na/K-насоса. Однако в тонких С-волокнах на возникновение одного ПД расходуется около 1 % концентрационных градиентов Na+ и К+. Если заблокировать выработку энергии, то клетка будет еще многократно возбуждаться и в этом случае. В реальной же действительности Na/K-насос постоянно переносит Na+ из клетки, а К+ возвращает в клетку, в результате постоянно поддерживается концентрационный градиент Na+ и К+, что осуществляется за счет непосредственного расхода энергии, источником которой является АТФ. Имеются данные, Что увеличение внутриклеточной концентрации Na+ сопровождается увеличением интенсивности работы Na/K-насоса. Это может быть связано исключительно с тем, что для переносчика становится доступно большее количество внутриклеточного Na+. 1.2.4.Локальный потенциал (локальный ответ) При раздражении возбудимой ткани не всегда возникает ПД. В частности, если сила раздражителя мала, деполяризация не достигнет критического уровня, естественно, не возникнет импульсное — распространяющееся возбуждение. В этом случае ответ ткани на раздражение будет носить форму локального потенциала. Локальными являются также возбуждающий постсинаптический, рецепторные и тормозный постсинаптический потенциалы. Величина локальных потенциалов весьма вариабельна, она может достигать 10—40 мВ в зависимости от рода клеток и силы стимула. Свойства такого ответа существенно отличаются от импульсного (табл. 2). Повышение возбудимости клетки во время локального потенциала объясняется тем, что клеточная мембрана оказывается частично деполяризованной. Если Екр остается на постоянном уровне, для достижения критического уровня деполяризации во время локального потенциала нужен значительно меньшей силы раздражитель. Амплитуда ПД не зависит от силы раздражения, потому что он возникает вследствие регенеративного процесса. Таблица 2. Сравнительная характеристика локального потенциала и ПД Свойство Локальный потенциал Потенциал действия Распространение Распространяется на 1-2 мм с затуханием (декрементом) Распространяется без затухания на большие расстояния по всей Зависимость величины от силы стимула Явление суммации Амплитуда Возбудимость ткани при возникновении потенциала Возрастает с увеличением силы стимула, т.е. подчинятся закону «силы» Суммируется – возрастает при повторных частых подпороговых раздражениях 10-40 мВ Увеличивается длине нервного волокна, в частности с учетом длины конечности Не зависит (подчиняется закону «все или ничего») Не суммируется 80-130 мВ Уменьшается вплоть до полной невозбудимости (рефрактерность) Состояние проницаемости клеточной мембраны можно определить по скорости движения ионов в клетку или из клетки согласно концентрационному градиенту, т.е. по проводимости ионов Na+ и К+ (gNa и gK), но при условии, что влияние электрического градиента на движение ионов исключено или оно постоянное. Последнее условие выполняется с помощью методики фиксации напряжения (voltage-clamp) на постоянном уровне. Ток Na+ в клетку при деполяризации быстро нарастает и начинает падать уже через 0,5 мс. Ток К , напротив, нарастает медленно и приближается к максимальной величине к тому времени, когда ток Na+ возвращается к 0, причем выход К+ из клетки при всех уровнях деполяризации возникает с задержкой, возрастает с увеличением деполяризации мембраны, достигает максимума примерно через 1,5 мс, после чего начинает падать и к 3 мс приближается к исходному уровню. В обычных условиях мембранные токи при данных концентрационных градиентах зависят не только от проницаемости клеточной мембраны, но и от мембранного потенциала, точнее от электрического градиента. Ионные токи могут точно характеризовать изменения gNa и gK только при постоянном мембранном потенциале. В состоянии покоя соотношение констант проводимости ионов К+: Na+: Сl- равно 1 : 0,04 : 0,45, а во время фазы деполяризации и восходящей части фазы инверсии ПД — 1 : 20 : 0,45. Как видно, проницаемость мембраны для К+ и Сl- во время фазы деполяризации и восходящей фазы инверсии не изменяется. Это хорошо укладывается в общепринятые представления о механизме возникновения ПД: Na+ движется в этот период внутрь клетки; затем проницаемость клеточной мембраны повышается для К+, что и определяет причину реполяризации — выход К+ из клетки. Проницаемость клеточной мембраны для ионов Сl- во время развития потенциала действия не изменяется. Естественно, ион Сl- в возникновении ПД участия не принимает. 1.2.5.Изменения возбудимости клетки во время ее возбуждения Возбудимость клетки во время ее возбуждения быстро и сильно изменяется. Различают несколько фаз изменения возбудимости, каждая из которых строго соответствует определенной фазе ПД и так же, как и фазы ПД, определяется состоянием проницаемости клеточной мембраны для ионов. Схематично эти фазы представлены на рис.3. 1. Кратковременное повышение возбудимости в начале развития ПД, когда уже возникла некоторая деполяризация клеточной мембраны. Если деполяризация не достигает критической величины, то регистрируется локальный потенциал. Если же деполяризация достигает Екр., то развивается ПД. Возбудимость повышена потому, что клетка частично деполяризована, мембранный потенциал приближается к критическому уровню и, когда деполяризация достигает примерно 50 % пороговой величины, начинают открываться потенциалчувствительные быстрые Na-каналы. При этом достаточно небольшого увеличения силы раздражителя, чтобы деполяризация достигла Екр., при которой возникает ПД. 2. Абсолютная рефрактерная фаза — это полная невозбудимость клетки (возбудимость равна нулю), она соответствует пику ПД и продолжается 1—2 мс; если ПД более продолжителен, то более продолжительна и абсолютная рефрактерная фаза. Клетка в этот период времени на раздражения любой силы не отвечает. Невозбудимость клетки в фазах деполяризации и восходящей части инверсии объясняется тем, что потенциалзависимые mворота Na-каналов уже открыты и Na+ быстро поступает в клетку по всем открытым каналам. Те ворота Na-каналов, которые еще не успели открыться, открываются под влиянием деполяризации — уменьшения мембранного потенциала. Поэтому дополнительное раздражение клетки относительно движения Na+ в клетку ничего изменить не может. Именно поэтому ПД либо совсем не возникает при раздражении, если оно мало, либо является максимальным, если действует раздражение достаточной силы (пороговой или сверхпороговой). В период нисходящей части фазы инверсии клетка невозбудима потому, что закрываются инактивационные h-ворота Na-каналов, в результате чего клеточная мембрана непроницаема для Na+ даже при сильном раздражении. Кроме того, в этот период открываются (уже в большом количестве) К-каналы, К+ быстро выходит из клетки, обеспечивая нисходящую часть фазы инверсии и реполяризацию. Абсолютная рефрактерная фаза продолжается и в период реполяризации клетки до достижения уровня мембранного потенциала Екр. ± 10 мВ. Абсолютный рефрактерный период ограничивает максимальную частоту генерации ПД. Если абсолютный рефрактерный период завершается через 2 мс после начала ПД, клетка может возбуждаться с частотой максимум 500 имп/с. Существуют клетки с еще более коротким рефрактерным периодом, в которых возбуждение может в крайних случаях повторяться с частотой 1000 имп/с. С такой частотой могут возбуждаться нейроны ретикулярной формации ЦНС, толстые миелиновые нервные волокна. 3. Относительная рефрактерная фаза — это период восстановления возбудимости клетки, когда сильное раздражение может вызвать новое возбуждение (см. рис.3, Б-3). Относительная рефрактерная фаза соответствует конечной части фазы реполяризации (начиная от Екр. ±10 мВ) и следовой гиперполяризации клеточной мембраны, если она имеется. Пониженная возбудимость является следствием все еще повышенной проницаемости для К+ и избыточного выхода его из клетки. Поэтому, чтобы вызвать возбуждение в этот период, необходимо приложить более сильное раздражение, так как выход К+ из клетки препятствует ее деполяризации. Кроме того, в период следовой гиперполяризации мембранный потенциал больше и, естественно, дальше отстоит от критического уровня деполяризации. Если реполяризация в конце пика ПД замедляется (см. рис.2, А), то относительная рефрактерная фаза включает и период замедления реполяризации, и период гиперполяризации, т.е. продолжается до возвращения мембранного потенциала к исходному уровню после гиперполяризации. Продолжительность относительной рефрактерной фазы вариабельна, у нервных волокон она невелика и составляет несколько мс. 4. Фаза экзальтации — это период повышенной возбудимости. Он соответствует следовой деполяризации. В некоторых клетках, например в нейронах ЦНС, возможна частичная деполяризация клеточной мембраны вслед за гиперполяризацией. Очередной ПД можно вызывать более слабым раздражением, поскольку мембранный потенциал несколько ниже обычного и оказывается ближе к критическому уровню деполяризации, что объясняют повышенной проницаемостью клеточной мембраны для ионов Na+, Скорость протекания фазовых изменений возбудимости клетки определяет ее лабильность. 1.2.6. Метаболические потенциалы Метаболические потенциалы регистрируются в результате разного уровня обмена веществ в пунктах отведения, характеризуя степень поляризации мембран. Возникающий метаболический градиент потенциала может быть обусловлен неравномерностью кровоснабжения, местным согреванием или охлаждением и другими условиями. Типичным примером метаболических потенциалов могут служить потенциалы, возникающие между освещенной частью зеленого листа, где усиливаются процессы фотосинтеза, и остающимися в темноте. Место усиленного метаболизма оказывается электроотрицательным по отношению к окружающим тканям, а величина метаболического потенциала будет зависеть от градиента обмена веществ. 1.3. ЗАКОНЫ РАЗДРАЖЕНИЯ ВОЗБУДИМЫХ ТКАНЕЙ Ответная реакция возбудимой ткани на действие раздражителя зависит от двух групп факторов: от возбудимости возбудимой ткани и от характеристик раздражителя. Возбудимость клетки изменяется в процессе возбуждения (было рассмотрено выше - см. рис.3), а также при изменении химического состава внеклеточной жидкости, например, в результате высокой длительной активности клеток, отклонения показателей внутренней среды в патологических случаях. При снижении концентрации ионов Na+ вне клетки этот ион в меньшем количестве входит в клетку, в результате чего снижается ее возбудимость из-за гиперполяризации клетки. Это наблюдается, например, при бессолевой диете, при этом может развиваться мышечная слабость. Повышение внеклеточной концентрации Na+ вызывает противоположный эффект, например усиление тонуса сосудов вследствие возрастания возбудимости нервно-мышечных элементов. Возбудимость различных тканей сама по себе различна — у нервных клеток выше, чем у мышечных, что используется в клинической практике, например, при выяснении причины двигательных нарушений. В то же время кроме особенностей возбудимости ответная реакция возбудимой ткани на раздражение зависит характеристик раздражителя. Между уровнем возбудимости возбудимой ткани и характеристиками раздражителя, способного вызвать возбуждение, существует четкая взаимосвязь. Характеристики раздражителя могут служить показателями состояния возбудимости ткани. Раздражители. Организм непрерывно подвергается множеству воздействий. Факторы, вызывающие переход из состояния покоя в состояние деятельности, называются раздражителями. Они могут быть внешними, исходящими из окружающей среды, и внутренними, возникающими при изменении состояния органов, тканей и особенно состава крови и тканевой жидкости. В зависимости от своей природы раздражители делят на физические (электрические, механические, температурные, световые) и химические. Условия эволюции живых существ определили их отношение к разнообразным раздражителям и развитие преимущественной чувствительности к наиболее существенным из них. Так, для простейших в естественных условиях основными раздражителями являются химическое воздействие диффундирующих питательных веществ и термическое, вызывающее движение к источнику пищи и в зону температурного оптимума. У высокоорганизованных животных развиваются специализированные рецепторы, особо чувствительные, например, у рыб к механическому раздражителю – вибрациям воды, означающим движения врага или добычи, у птиц – к световому раздражителю, у хищных млекопитающих – к запахам, позволяющим находить добычу. Рецепторы сетчатки глаза обладают наибольшей чувствительностью к свету, вкусовые рецепторы — к химическим веществам. Раздражители, к действию которых ткани органов и специализированные рецепторы приспособлены исторически (эволюционно) называются адекватными. Однако раздражение этих тканей и рецепторов можно вызвать, применяя и другие раздражители, которые обозначаются как неадекватные. Для того чтобы неадекватный раздражитель оказал свое действие, он должен развивать энергию во много раз большую, чем требуется при действии адекватного раздражителя. Достаточно сравнить энергию кванта света, необходимую для адекватного раздражения фоторецептора глаза и неадекватную механическую энергию удара, требуемую для того, чтобы «искры из глаз посыпались». Электрический раздражитель неадекватен для всех тканей и рецепторов, кроме электрорецепторов некоторых рыб. Тем не менее, он вызывает раздражение любой ткани и любого рецептора, затрачивая гораздо меньшую энергию, чем другие неадекватные раздражители, и поэтому приближается к естественным. Эти особенности электрического раздражителя объясняются тем, что процессы раздражения и возбуждения связаны с перемещением ионов, определяющих структуру и свойства поляризованных мембран клетки, и электрический ток, создавая искусственно потоки ионов, видимо, сравнительно легко включает пусковые звенья механизма раздражения. Кроме того, электрический раздражитель легко дозировать по силе, длительности, частоте и крутизне нарастания силы. Благодаря этим особенностям электрический раздражитель широко применяют в физиологических экспериментах, а также в клинической практике как с диагностической, так и с лечебной целями. Основными характеристиками раздражителя, от которых зависит эффективность его действия на ткань, являются: - сила; - крутизна нарастания силы; - длительность действия; - частота стимуляции – количество раздражающих стимулов в единицу времени. 1.3.1.Значение силы раздражителя для возникновения возбуждения По силе раздражители делятся на пороговые, подпороговые и сверхпороговые. Пороговый потенциал (ΔV) — это минимальная величина, на которую надо уменьшить мембранный потенциал покоя, чтобы вызвать возбуждение (ПД). ΔV и возбудимость клеток находятся в обратных соотношениях: небольшая величина ΔV свидетельствует о высокой возбудимости клетки. Если, например, уменьшение мембранного потенциала (частичная деполяризация) на 5—10 мВ вызывает возникновение ПД, то возбудимость клетки высока. Напротив, большой ΔV (30—40 мВ) свидетельствует о более низкой возбудимости клетки. Однако во всех случаях ПД возникает только при достижении критического уровня деполяризации клеточной мембраны (Екр.). Критический уровень деполяризации Екр, (КУД) — это минимальный уровень деполяризации клеточной мембраны, при которой возникает ПД. Дальнейшее раздражение клетки и искусственное снижение ПП ничего не изменяют в процессе возникновения ПД, поскольку деполяризация клетки, достигнув критического уровня, сама по себе ведет к открытию потенциалзависимых m-ворот Na-каналов, в результате чего Na+ устремляется в клетку, ускоряя деполяризацию независимо от действия раздражителя. Критический уровень деполяризации клеточной мембраны обычно составляет около —50 мВ. При величине ПП, например, —60 мВ (Е0) деполяризация — уменьшение ПП на 10 мВ приведет к достижению Екр. (—50 мВ) и возникнет ПД. Если ПП равен —90 мВ, то для вызова ПД надо снизить ПП на 40 мВ. В последнем случае возбудимость клетки значительно ниже. Таким образом: ∆V = E0 - Eкр. Величина ПП изменяется в различных условиях деятельности клетки, вследствие этого колеблется и ее возбудимость, например при изменении концентрации Са2+, рН среды. Когда концентрация Са2+ в среде повышается, клетка становится менее возбудимой, поскольку возрастает мембранный потенциал, вследствие чего Е0 удаляется от Екр, а когда концентрация Са2+ снижается, возбудимость клетки возрастает, так как мембранный потенциал уменьшается, Е0 приближается к Екр.. Такое повышение возбудимости лежит в основе синдрома тетании, связанного с дефицитом Са2+ в крови. Изменения содержания ионов Н+ в среде действуют на возбудимость нейронов так же, как изменения концентрации Са2+, что в обоих случаях объясняется изменением величины Е0. Однако если мембранный потенциал снижается медленно ниже Екр. (-50 мВ), например, в условиях гипоксии, при действии миорелаксантов типа сукцинилхолина, то клетка становится невозбудимой вследствие инактивации Na+-каналов и невозможности достичь Екр. Несмотря на то что ∆V является наиболее точным показателям состояния возбудимости клетки, используется он в эксперименте из-за сложности процедуры реже, чем другие показатели. Чаще всего возбудимость оценивается по пороговой силе раздражителя. Пороговая сила — это наименьшая сила раздражителя, способная вызвать возбуждение (ПД) при неограничении ее действия во времени (рис. 4). Сила раздражителя — понятие собирательное, оно отражает степень выраженности раздражающего воздействия стимула на ткань. Например, сила электрического тока выражается в амперах (А), температура среды — в градусах Цельсия (°С), концентрация химического вещества — в миллимолях на 1 л (ммоль/л), сила звука — в децибелах (дБ) и т.д. При использовании в качестве раздражителя электрического тока предложенное определение пороговой силы совпадает с понятием «реобаза». Реобаза — наименьшая сила тока, способная вызвать импульсное возбуждение. Если возбудимость ткани высока, пороговая сила раздражителя мала. Чем выше возбудимость, тем ниже пороговая сила. Большая пороговая сила свидетельствует о низкой возбудимости ткани. При внутриклеточном раздражении пороговая сила электрического тока для различных клеток равна 10-7—10-9 А. После получения в ответ на пороговое раздражение потенциала действия, увеличение интенсивности раздражения не сопровождается увеличением его амплитуды. При этом лишь уменьшается латентный (скрытый) период возникновения возбуждения. При сверхпороговых раздражениях потенциал действия развивается без латентного периода и электротоническая деполяризация мембраны сливается с его восходящим коленом. Независимость амплитуды потенциала действия от силы раздражителя при определенном функциональном состоянии волокна известна под названием закона «все или ничего». В соответствии с этим законом, подпороговые раздражители не вызывают потенциала действия («ничего»); при пороговом раздражении генерируется потенциал действия максимальной амплитуды («все»), после этого (при сверхпороговых раздражениях) амплитуда потенциала действия не увеличивается при увеличении силы раздражителя. Закон «все или ничего» открыт Боудичем (1871) при исследовании сократительных свойств сердечной мышцы и был использован Готчем (1902) для объяснения генерирования потенциалов действия нерва лягушки. Позже с позиций закона «все или ничего» расценивалась деятельность все большего количества тканей и органов, а закон интерпретировался как общий принцип деятельности возбудимых тканей. Считалось, что «ничего» означает полное отсутствие ответа на подпороговые раздражения, а «все» рассматривалось как проявление полного исчерпания возбудимым образованием его потенциальных возможностей. В действительности возбудимые образования реагируют на подпороговые стимулы локальным возбуждением, электрическим проявлением которого является описанный ранее локальный ответ. Необходимо отметить также, что амплитуда потенциала действия не является абсолютно постоянной и зависит от множества факторов даже в физиологических условиях организма (утомление, различные онтогенетические периоды). При медленно нарастающей силе раздражителя возбуждение может не возникнуть даже при достижении большой его силы, значительно превосходящей пороговую. Это свидетельствует о том, что возбудимость ткани в таких условиях уменьшается — возникает явление аккомодации. 1.3.2.Роль крутизны нарастания силы раздражителя в возникновении возбуждения Другая важная закономерность касается соотношения между пороговой силой раздражения и скоростью его нарастания. Дюбуа – Реймоном (1848) был установлен закон, согласно которому раздражающее действие электрического тока тем сильнее, чем быстрее он нарастает. Пороги раздражения самые низкие при раздражении прямоугольными электрическими импульсами. Если раздражать возбудимую структуру электрическими импульсами, сила которых нарастает линейно, то пороги оказываются повышенными и тем в большей степени, чем медленнее увеличивается сила тока. Ток, крутизна нарастания силы которого достигает определенной минимальной величины, остается неэффективным для возникновения возбуждения, даже если он значительно превышает реобазу. Т.о. слишком медленно нарастающие токи вообще могут не вызывать возбуждения. Явление повышения порога с уменьшением крутизны нарастания раздражающего тока Нернстом (1908) было названо аккомодацией. Таким образом, раздражитель, чтобы оказать возбуждающее действие, должен достичь пороговой силы со скоростью, превышающей скорость развития аккомодации в данной ткани. Главной причиной аккомодации является инактивация Na-каналов, возникающая при медленной деполяризации клеточной мембраны — в течение 1с и более. Клетка теряет возбудимость, если закрывается около 50 % инактивационных h-ворот (в покое h-ворота в основном открыты, закрыто около 20 %). Меньшую роль играет активация К-каналов. Возникающая частичная деполяризация клетки при медленно нарастающей силе стимула ведет к уменьшению мембранного потенциала. Поэтому если и возникает ПД при дальнейшем резком увеличении силы раздражителя, то его амплитуда мала. Аккомодация развивается, например, в клетках ЦНС, когда они деполяризуются при суммации медленно нарастающих синаптических потенциалов. Скорость развития аккомодации у разных тканей различна, она зависит, как и скорость возникновения ПД, от скорости активации и инактивации ионных каналов, в первую очередь инактивации Na-каналов. Таким образом, аккомодация характеризует не возбудимость ткани, а изменение возбудимости ткани при действии плавно нарастающего раздражителя. Поэтому при определении возбудимости ткани в качестве раздражителя необходимо использовать прямоугольные импульсы. В этом случае скорость нарастания стимула и активация Na-каналов опережают скорость аккомодации (инактивации Na-каналов), что и приводит к возникновению ПД. Значение крутизны нарастания силы раздражителя проявляется не только при электрическом, но и при химическом, механическом, термическом и других раздражениях. Поэтому, например, отравление газом может произойти, когда он накапливается в помещении, не обнаруживая себя запахом. 1.3.3.Роль длительности действия раздражителя в возникновении возбуждения Раздражитель даже пороговой силы, нарастающий с достаточной крутизной может оказаться неэффективным, если он действовал в течение менее нужного времени. Следовательно, важным условием, обеспечивающим возникновение возбуждения при действии раздражителя, является его длительность. Поэтому для оценки свойств возбудимой ткани вводится еще одно понятие — пороговое время. Пороговое время — это минимальное время, в течение которого должен действовать на ткань раздражитель пороговой силы, чтобы вызвать ее возбуждение (см. рис. 4— проекция точки А на абсциссу). Пороговое время называют также полезным временем, так как раздражитель обеспечивает деполяризацию только до критического уровня (Екр.). Далее ПД развивается независимо от действия раздражителя, дальнейшее раздражение уже становится ненужным — бесполезным. Величина полезного времени показывает срок, в течение которого раздражитель пороговой силы успевает вызвать местные сдвиги и довести их до критического значения. При уменьшении длительности действия тока необходимо увеличивать его силу, чтобы сохранить эффективность раздражения. Таким образом, полезное время находится в обратной зависимости от силы тока (раздражителя). Эту зависимость изображают графически, откладывая на абсциссе время, а на ординате – силу тока. Графическая зависимость между длительностью и силой порогового раздражения называется кривой силы – времени (см. рис.4). Впервые такую кривую получил Гоорвег (1892) при исследовании возбудимости скелетных мышц человека, а позже – Вейс (1901) на нервно-мышечном препарате лягушки. Измерение полезного времени для оценки временных характеристик возбудимости ткани, ее подвижности, затрудняется необходимостью уловить переход от пороговой, т.е. минимальной реакции к полному ее отсутствию (пологая часть кривой, см. рис. 4). Поэтому практическое применение и широкое распространение в эксперименте и клинической практике получило измеряемое для этой цели полезное время тока удвоенной пороговой силы _хронаксия. Хронаксия (Л.Лапик, 1926) — наименьшее время, в течение которого должен действовать ток в две реобазы, чтобы вызвать возбуждение (см. рис.4— проекция точки Б на абсциссе). Хронаксия соответствует более крутой части кривой сила — время, она колеблется от сотых долей до сотен миллисекунд. Хронаксия характеризует скорость возникновения возбуждения и в определенной степени лабильность, так как чем быстрее возникает возбуждение, тем быстрее «оно протекает» в целом. Чем больше хронаксия, тем медленнее реагирует ткань возбуждением – длительность потенциала действия и рефрактерности больше, а лабильность ниже. Хронаксия – динамический показатель функционального состояния возбудимых тканей: длятельное напряжение мышцы увеличивает ее хронаксию, т.е. делает менее подвижной; болевое раздражение уменьшает хронаксию рецепторов кожи в месте его действия, т.е. повышает их подвижность; общее охлаждение тела, увеличивая хронаксию, снижает их подвижность. Измерение хронаксии (хронаксимерия) в клинической практике позволяет уточнить характер повреждений мышцы при травмах. В норме определяется фактически хронаксия нервных волокон, так как возбудимость их выше. В случае повреждения нерва и его перерождения определяют истинную хронаксию мышцы, которая намного превышает таковую до травмы. Из графика (см. рис.4 - правая часть) также следует, что, если для получения возбуждения использовать раздражитель по амплитуде меньше реобазы, возбуждение ткани не возникнет даже в том случае, если время его действия будет бесконечно большим. С другой стороны, если для получения возбуждения использовать раздражитель, длительность которого будет меньше некоторого критического интервала (левая часть графика), возбуждение ткани также не будет получено даже в том случае, если сила раздражителя будет бесконечно большой. Поэтому высокочастотный переменный ток (>10 кГц) – ток Д,Арсенваля - опасности для организма не несет: при сверхкоротком воздействии на ткань импульс электрического тока дает лишь тепловой эффект, что используется в клинической практике для глубокого прогревания тканей при различных патологических процессах. Переменный ток высокой частоты не вызывает возбуждения потому, что его полупериоды слишком коротки для того, чтобы изменить мембранный потенциал, так как небольшой эффект действия каждого полупериода нивелируется последующим полупериодом, во время которого ток имеет противоположное направление. Иначе говоря, изменения мембранного потенциала не успевают за измененияминаправлений высокочастотного тока. Электрический ток с частотой от 0,5 до 1 мГц также может использоваться в лечебных целях, в основном для прогревания тканей. Низкочастотный переменный синусоидальный ток (50 Гц) стимулирует возбудимые ткани. Стимулы синусоидального тока частотой 50 Гц большого напряжения опасны для жизни: они могут вызвать фибрилляцию сердца с летальным исходом (относительный рефрактерный период миокарда представляет собой в этом случае фазу повышенной уязвимости). Возникает вопрос о природе фактора времени в раздражении. Полезное время раздражения при определенной силе тока зависит от скорости кателектротонической деполяризации мембраны, обусловленной величиной постоянной времени мембраны (τ = Rм . См ). Хронаксия нервных волокон меньше, чем мышечных именно потому, что постоянная времени мембраны мышечных волокон больше, чем нервных. При одинаковой постоянной времени мембраны полезное время зависит от скорости нарастания амплитуды локального потенциала, который вместе с кателектротоническим потенциалом принимает участие в развитии критической деполяризации. Развитие локального потенциала зависит от постоянной времени молекулярных механизмов, ответственных за активацию натриевой проницаемости мембраны. Таким образом, величина фактора времени в раздражении обусловлена скоростью протекания пассивных и активных мембранных процессов, которые обеспечивают критическую деполяризацию. 1.3.4. Роль частоты стимуляции в возникновении возбуждения Наличие рефрактерности определяет максимальную частоту генерирования возбудимыми структурами потенциалов действия, для характеристики которой Н.Е.Введенским(1901) было предложено понятие лабильности или функциональной подвижности. Таким образом, лабильность можно определить как скорость протекания одного цикла возбуждения, т.е. ПД. Как видно из определения, лабильность ткани зависит от длительности ПД, Это означает, что лабильность, как и ПД, определяется скоростью перемещения ионов в клетку и из клетки, которая в свою очередь зависит от скорости изменения проницаемости клеточной мембраны. При этом особое значение имеет длительность рефрактерной фазы: чем больше рефрактерная фаза, тем ниже лабильность ткани. Мерой лабильности является максимальное число ПД, которое ткань может воспроизвести в 1с без искажений. Если частота раздражения превышает величину лабильности, то возникает ее трансформация. Для воспроизведения возбудимой тканью импульсов без искажения интервал между раздражающими импульсами должен равняться или быть чуть больше длительности абсолютной рефрактерной фазы. В эксперименте лабильность исследуют с помощью регистрации максимального числа ПД, которое может воспроизвести клетка при увеличении частоты ритмического раздражения. Лабильность различных тканей существенно различается. Так, лабильность нерва равна 500—1000, мышцы — около 200, нервно-мышечного синапса — порядка 100 импульсов в секунду. Лабильность ткани понижается при длительном бездействии органа и при утомлении, а также в случае нарушения иннервации. Лабильность может изменяться в ходе ритмического раздражения нерва или мышцы, так как в ритмическом ряду волны возбуждения взаимодействуют друг с другом. Это взаимодействие в одних случаях может приводить к падению лабильности, в других, напротив, — к ее повышению. При постепенном увеличении частоты ритмического раздражения лабильность ткани повышается, т.е. ткань отвечает более высокой частотой возбуждения по сравнению с исходной частотой. Это явление открыто А.А.Ухтомским и получило название усвоение ритма раздражения. Примером усвоения ритма может служить эксперимент Г.Мевеса на изолированном нервном волокне лягушки. Одиночное нервное волокно раздражали ритмическими стимулами частотой 460 в секунду. На каждый стимул возникал потенциал действия. Затем повышали частоту стимуляции до 740 в секунду. Вначале волокно отвечало только на каждый второй стимул, т.е. происходила трансформация ритма раздражения. Однако после нескольких секунд такого раздражения волокно начало усваивать навязанный ему ритм, и частота ответов повысилась до 740 импульсов в секунду. Усвоение ритма связано с убыстрением тех процессов обмена веществ, которые обеспечивают активное «выкачивание» из цитоплазмы в наружный раствор ионов Na+, проникших через мембрану во время возбуждения. В то же время переход от умеренной (оптимальной) к чрезмерной (пессимальной) частоте или силе раздражения вызывает смену возбуждения торможением при обычном функциональном состоянии объекта. Однако подобную смену возбуждения торможением можно получить при действии одного и того же раздражителя с характеристиками, оптимальными для здоровой ткани, если последнюю подвергнуть воздействиям, изменяющим функциональное состояние, в частности, снижающим ее лабильность. При этом развиваются явления, которым Н.Е.Введенский дал название — парабиоз. Парабиоз — состояние ткани, лабильность которой не удовлетворяет требованиям раздражителя, что затрудняет возникновение и распространение возбуждения. По мере углубления парабиотического состояния раздражимость ткани проходит несколько стадий. Начальная уравнительная стадия состоит в том, что даже в пределах сил раздражения, обычных для интактной ткани, более сильные раздражители оказывают для парабиотического участка пессимальными, вызывают торможение и их эффекты уравниваются с эффектами от слабых раздражений. Следующая парадоксальная стадия наступает, когда парабиоз достигает степени, при которой относительно сильные раздражения оказываются настолько пессимальными, что становятся менее эффективными, чем слабые раздражения. Наконец, тормозная стадия характеризуется таким низким уровнем лабильности парабиотического участка, при котором каждое раздражение вызывает только торможение. 1.3.5.Действие постоянного тока на ткань (полярный закон раздражения) При действии постоянного тока средней силы на ткань возбуждение возникает только в момент замыкания и в момент размыкания цепи — закон полярного действия тока [Пфлюгер, 1859]. Возбуждение возникает в момент замыкания под катодом, а в момент размыкания — под анодом. Это демонстрируется в опыте на нервно-мышечном препарате лягушки с раздражением нерва, один участок которого умерщвлен. Один электрод устанавливают на умерщвленный, другой — на интактный участок нерва. Если интактного участка нерва касается катод, то возбуждение нерва и сокращение мышцы возникают только при замыкании цепи постоянного тока. Если интактного участка нерва касается анод, то мышца сокращается только при размыкании электрической цепи. Описанные изменения возбудимости имеют место лишь при кратковременном действии постоянного тока. При длительном действии тока развиваются противоположные изменения возбудимости: под катодом повышение возбудимости сменяется ее уменьшением, а под анодом первоначально пониженная возбудимость постепенно повышается. Угнетение возбудимости длительным действием катода постоянного тока открыл Б.Ф.Вериго (1889), назвав ее катодической депрессией. При раздражении с помощью электрода, введенного в клетку, возбуждение развивается только в том случае, когда катод размещается снаружи, а анод — внутри клетки. При обратном расположении полюсов ПД не генерируется, так как в этом случае возникает не деполяризация, а гиперполяризация клеточной мембраны. В области действия катода на ткань возникает частичная деполяризация клеточных мембран, так как катод — отрицательный электрод, а клеточная мембрана снаружи имеет положительный заряд. Если деполяризация достигает Екр, то возникает ПД вследствие лавинообразного движения ионов Na+ внутрь клетки. В области действия анода, напротив, клеточная мембрана гиперполяризуется. Е0 удаляется от Екр, поэтому ПД при замыкании цепи не возникает. Почему же ПД регистрируют под анодом в момент размыкания цепи постоянного тока? При действии анода Екр. смещается в сторону гиперполяризации и может сравняться с исходным Е0. При размыкании электрической цепи в области действия анода мембранный потенциал быстро возвращается к исходному уровню и, естественно, достигает критического уровня, в результате чего открываются потенциалзависимые активационные m-ворота Naканалов и генерируется ПД — анодное размыкательное возбуждение. Если сила электрического тока мала и не вызывает возникновения ПД, то в области действия катода возбудимость ткани сначала повышается (катэлектротон), а затем падает — католическая депрессия. Возбудимость повышается вследствие уменьшения мембранного потенциала и приближения его к Екр., открытия части m-ворот Na-каналов. Главной причиной католической депрессии является развивающаяся инактивация Na-каналов (при этом Екр смещается вверх — в сторону деполяризации). Активация К-каналов играет меньшую роль. Таким образом, механизмы рефрактерности во время возбуждения ткани, аккомодации при медленно нарастающем стимуле и католической депрессии при длительном действии тока в основном совпадают. В области действия анода постоянного тока в ткани развиваются противоположные изменения: возникает гиперполяризация клеточной мембраны (мембранный потенциал увеличен), вследствие чего возбудимость клетки снижается. Это снижение возбудимости называют анэлектротоном. Затем возбудимость ткани повышается в результате смещения Екр в сторону Е0 и приближения его к исходному Е0. Поэтому для достижения критического уровня деполяризации мембраны в этот момент достаточно небольшой ее деполяризации. ТЕСТЫ 1-2 УРОВНЯ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ ПО ТЕМЕ: ОБЩАЯ ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ 1.Изменится ли величина потенциала покоя, если внутри нервной клетки искусственно увеличивать на 30% концентрацию ионов К+? А. потенциал покоя снизится до 0 В. потенциал покоя увеличится С. потенциал покоя останется без изменений D. потенциал покоя увеличится 2.Изменится ли величина потенциала покоя, если внутри нервной клетки искусственно уменьшить на 30% концентрацию ионов К+? А. потенциал покоя снизится до 0 В. потенциал покоя увеличится С. потенциал покоя останется без изменений D. потенциал покоя увеличится 3.Как изменится амплитуда потенциала действия одиночного нервного волокна, если наружную концентрацию ионов Nа+ снизить на 20%? А. амплитуда потенциала действия упадет до 0 В. амплитуда потенциала действия не изменится С. амплитуда потенциала действия снизится D. амплитуда потенциала действия возрастет 4.В постоянстве структурно-функциональной целостности мембран главную роль играют: А. фосфолипиды В. свободные жирные кислоты С. холестирин D. липопротеиды Е. белки 5. Фактором, определяющим величину потенциала покоя, является концентрационный градиент: А. иона натрия В. иона калия С. иона кальция D. иона хлора 6.Деполяризация клеточной мембраны проницаемости клеточной мембраны для: А. иона натрия В. иона калия С. иона кальция D. иона хлора Е. всех вышеперечисленных ионов ионы: может возникнуть при увеличении 7.В генезе восходящий фазы потенциала действия нервной ткани ведущую роль играют А. калия В. натрия С. хлора D. магния Е. кальция 8.Локальный ответ обусловлен повышением проницаемости мембраны для ионов: А. хлора В. калия С. натрия D. магния Е. кальция 9.Трансмембранный выходящий ионный ток обеспечивается: А. активным транспортом В. пассивной диффузией С. облегченным транспортом К+ во время потенциала покоя 10.В механизме фазы деполяризации ПД ведущую роль играет: А. пассивный ток Nа+ в клетку В. пассивный ток Nа+ из клетки С. активный транспорт Са2+ из клетки D. активный транспорт Nа+ в клетку 11.Важным фактором реполяризации мембран во время развития потенциала действия является: А. повышение проницаемости для К+ В. уменьшение проницаемости для К+ С. увеличение проницаемости для Nа+ D. уменьшение проницаемости для Nа+ Е. выходящий калиевый ток 12.Подпороговый раздражитель: А. вызывает развитие потенциала действия В. вызывает развитие локального ответа С. не деполяризирует мембрану до критического уровня D. гиперполяризирует мембрану 13.Раздражитель пороговой силы: А. вызывает развитие потенциала действия В. вызывает развитие локального ответа С. деполяризирует мембрану до критического уровня D. гиперполяризирует мембрану 14. Во время фазы абсолютной рефрактерности происходит: А. активизация калиевых каналов В. активизация натриевых каналов С. инактивация калиевых каналов D. инактивация натриевых каналов 15.Какую функцию выполняют интегральные белки мембраны? А. определяют структурную целостность мембраны В. являются рецепторами мембраны С. образуют ионные насосы D. образуют ионные каналы 16.Сколько ионов перемещает через мембрану Nа-К-насос за один цикл: А. 1 ион Nа+ и 1 ион К+ В. 2 иона Nа+ и 2 иона К+ С. 3 иона Nа+ и 3 иона К+ D. 3 иона Nа+ и 2 иона К+ Е. 2 иона Nа+ и 3 иона К+ 17.Какое из этих утверджений справедливо в отношении внутриклеточной жидкости: А. концентрация внутриклеточного калия выше, чем концентрация внеклеточного калия В. концентрация внутриклеточного натрия выше, чем концентрация внеклеточного натрия С. осмолярность внутриклеточной жидкости выше, чем концентрация внеклеточной жидкости D. концентрация внутриклеточной глюкозы выше, чем концентрация внеклеточной глюкозы Е. во внутриклеточной жидкости нет белков 18.Какие из этих веществ могут быстро проходить через мембрану? А. глюкоза В. аминокислоты С. углекислый газ D. ионы натрия Е. ионы водорода 19.При проведении исследования на изолированной возбудимой клетке установлено, что порог силы раздражения клетки существенно уменьшился. Что из указанного может быть причиной этого? А. инактивация калиевых каналов мембраны В. активация калиевых каналов мембраны С. активация натриевых каналов мембраны D. инактивация натриевых каналов мембраны Е. блокада энергообразования в клетке 20.Вследствие блокады ионных каналов мембраны клетки ее потенциал покоя уменьшился с –90мВ до –70мВ. Какие каналы заблокированы? А. калиевые В. натриевые С. магниевые D. кальциевые Е. хлоровые 21. От чего зависит лабильность ткани? А. от величины мембранного потенциала B. от длины миофибрилы C. от силы раздражителя D. от длительности абсолютно рефрактерной фазы. 22. Способность живой ткани отвечать на действия раздражителя? А. проводимость B. раздражимость C. автоматия D. лабильность E. рефрактерность 23. Причины возникновения католической депрессии А. уменьшение МП В. продолжительное действие катода постоянного тока С. увеличение лабильности D. кратковременное действие раздражителя Е. кратковременное действие катода постоянного тока 24. Что лежит в основе аккомодации ткани А. повышение амплитуды ПД В. исчезновение МП С. повышение натриевой проницаемости D. прекращение работы калий-натриевого насоса Е. инактивация натриевой проницаемости и повышение калиевой проницаемости 25. Что будет возникать в возбудимой ткани при пороговом раздражении А. локальный потенциал В. Мембранный потенциал С. ПД D. метаболический потенциал Е. Ток покоя 26.Какой электрод должен быть активным, чтобы повысить возбудимость ткани? А. Не имеет значения какой электрод В. Анод при замыкании постоянного тока С. Катод при замыкании постоянного тока D. катод и анод одновременно 27. Какой электрод должен быть активным, чтобы снизить возбудимость ткани? А. Не имеет значения какой электрод В. Анод при замыкании постоянного тока С. Катод при разамыкании постоянного тока D. Катод при замыкании постоянного тока Е. катод и анод одновременно 28. Какое по силе нужно нанести раздражение, чтобы вызвать ответ в относительно рефрактерную фазу? А. подпороговое В. сверхпороговое С. подпорогое длительное D. подпороговое кратковременное Е. любой силы 29.Почему при нанесении порогового раздражения в абсолютно рефрактерную фазу не возникает ответ в возбудимой ткани? А. недостаточная сила раздражителя В. отсутствует возбудимость С. необходимо более длительное раздражение D. высокая возбудимость Е. низкий порог раздражения 30. в какую фазу возбудимости может возникнуть ответ на порогое раздражение? А. в супернормальную фазу (повышенной возбудимости) Б. в фазу относительной рефрактерности С. вообще не возникает D. в субнормальную фазу Е. в фазу абсолютной рефрактерности СИТУАЦИОННЫЕ ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ ПО ТЕМЕ: "ОБЩАЯ ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ" 1. Под влиянием гуморальных факторов проницаемость мембраны клетки для ионов натрия увеличилась. Как это скажется на значении ПП клетки и почему? 2. При ухудшении кровоснабжения миокарда в межклеточной жидкости повышается концентрация ионов калия. Как и почему это скажется на генерации ПД в волокнах миокарда? 3. Динитрофенол, действуя на клетки блокирует метаболические процессы, поставляющие энергию. Как и почему изменится значение ПП клетки при действии на неё динитрофенола ? 4. В тканевой жидкости, окружающей клетки, увеличилась концентрация ионов калия. Как и почему это скажется на величине ПП этой клетки? 5. Под влиянием местного анестетика в мембране клетки увеличилось число инактивированных натриевых каналов. Как и почему это скажется на параметрах ПД, возникающего в клетке? 6. В тканевой жидкости, окружающей клетки, увеличилась концентрация натрия. Как и почему это скажется на величине ПД клетки? 7. Под влиянием химического фактора в мембране клетки увеличилось число каналов, которые могут активироваться при генерации ПД клетки. Как и почему это скажется на параметрах ПД клетки? 8. Какое влияние на ПП окажет увеличение содержания калия внутри клетки и почему? 9. Некоторые лекарственные препараты /например, сердечные гликозиды/ являются специфическими фармакологическими блокаторами натрий-калиевого насоса. Какое влияние оказывают сердечные гликозиды на возбудимость сердечной мышцы? Почему? 10. Какие изменения в генерации ПД возникнут в возбудимой клетке при помещении её в бессолевой раствор? Почему? 11. Установлено, что амплитуда ПД клетки увеличилась на несколько милливольт. Изменилась ли возбудимость этой клетки? 12. Критический уровень деполяризации клеточной мембраны повысился от -60 мВ до 50 мВ. Как и почему изменилась возбудимость клетки? 13. Раздражитель вызвал деполяризацию клеточной мембраны, однако, возбудимость клетки уменьшилась. Почему это могло произойти? 14. Ацетилхолин, действуя на клетки, повышает проницаемость их мембран для ионов калия. Как и почему изменится при этом возбудимость клетки? 15. Пороговый потенциал мембраны клетки -20 мВ. При электрическом раздражении клетки на её мембране возник деполяризационный местный потенциал, амплитуда которого равна 18 мВ. Что это за потенциал? 16. В клинике для местного прогревания тканей используют высокочастотные токи высокого напряжения /диатермию/. Почему эти токи проходят через клетки, не вызывая в них возбуждения? 17. Как и почему изменится минимальное время, необходимое для возникновения в клетке ПД /латентный период ПД/ при увеличении силы электрического раздражения? ------------------------------------------------------------------------------------------------------------------- 2. ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ПРОВЕДЕНИЯ ВОЗБУЖДЕНИЯ В ВОЗБУДИМЫХ ТКАНЯХ −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− Проводимость — это свойство ткани проводить потенциал действия (т.е. возбуждение) без изменения его амплитуды. Проводимость присуща всем возбудимым тканям. Специализированную функцию проведения возбуждения в возбудимых тканях осуществляют нервные волокна и синаптические образования, т.е. нервные волокна и синапсы структурно и функционально предназначены для проведения возбуждения. Но механизмы проведения возбуждения в этих структурах различны и поэтому требуют отдельного рассмотрения. 2.1.ФИЗИОЛОГИЯ НЕРВНЫХ ВОЛОКОН И НЕРВОВ 2.1.1. Структура нервного волокна Нервные волокна представляют собой отростки нейронов, с помощью которых осуществляется связь между нейронами, а также нейронов с исполнительными клетками. В состав нервного волокна входят осевой цилиндр (нервный отросток) и глиальная оболочка. По взаимоотношению осевых цилиндров с глиальными клетками выделяют два типа нервных волокон: безмиелиновые и миелиновые. Оболочку безмиелиновых волокон образуют шванновские клетки (леммоциты). При этом осевые цилиндры прогибают клеточную оболочку леммоцитов и погружаются в них. Клеточная мембрана обычно полностью окружает каждый осевой цилиндр и смыкается над ним, образуя сдвоенную мембрану (мезаксон). Оболочку миелиновых волокон образуют в периферической нервной системе также шванновские клетки, а в ЦНС — олигодендроциты. В отличие от безмиелиновых волокон в миелиновых волокнах мезаксон удлиняется и спирально закручивается вокруг осевого цилиндра, образуя слой миелина толщиной от долей мкм до 10 мкм (липидный футляр) вокруг осевого цилиндра. Миелиновая оболочка через равные участки (0,5— 2,0 мм) прерывается, образуя свободные от миелина небольшие участки — узловые перехваты Ранвье. Протяженность перехватов в волокнах периферической нервной системы находится в пределах 0,25—1,0 мкм, в волокнах ЦНС их длина может достигать 14 мкм. Участки волокон между узловыми перехватами называются межузловыми сегментами, они образованы слоем миелина. Основную часть миелина (78 % сухой массы) составляют липиды, в них на долю фосфолипидов приходится 42 %, цереброзидов — 28 %, холестерина — 25 %. Несмотря на метаболическую инертность миелина (особенно по обновлению холестерина), поддержание целостности его структуры требует затраты энергии и нарушение снабжения олигодендроцитов кислородом и питательными веществами быстро вызывает деструкцию миелина. Одной из основных функций глиальной оболочки нервных волокон является изолирующая функция, способствующая лучшему проведению биопотенциалов по отросткам нейронов. 2.1.2.Классификация нервных волокон Наиболее распространена классификация по Дж.Эрлангеру и Х.Гассеру (1937), в которой волокна разделяют на три типа: А, В и С (табл.3). Волокна типа А и В являются миелиновыми, типа С — безмиелиновыми. Волокна А делят на 4 подгруппы: α, β, γ, δ. В периферической нервной системе к волокнам Аα относятся афферентные волокна от механорецепторов кожи, мышечных и сухожильных рецепторов, а также эфферентные волокна к скелетным мышцам. К Аβ принадлежат афферентные волокна от кожных рецепторов прикосновения и давления, от части мышечных и висцеральных рецепторов. Аγ представляют собой эфферентные волокна, через которые регулируется активность мышечных рецепторов. К Аδ относят афферентные волокна от части тактильных, температурных и болевых, а также суставных рецепторов. К волокнам типа В принадлежат преганглионарные волокна вегетативной нервной системы. К волокнам типа С относят постганглионарные волокна вегетативной нервной системы, афферентные волокна от некоторых болевых (вторичная боль), тепловых и висцеральных рецепторов. Таблица 3. Типы волокон в нервах млекопитающих (по Эрлангеру—Гассеру) Тип волокон Диаметр волокна, мкм А А А А В С 12-20 5-12 3-6 2-5 1-3 0,3-1,3 Скорость проведения возбуждения, м/с 70-120 30-70 15-30 12-30 5-12 0,5-2,3 Длительность абсолютного рефракторного периода, 0,4-1,0мс 1,2 2 Из данных, представленных в табл.3, видно, что средний диаметр каждого типа волокна снижается от типа А до С (каждый примерно в 2 раза по отношению к предыдущему). Соответственно этому снижается и скорость проведения возбуждения. Низкая скорость проведения нервного импульса в волокнах типа С связана с особенностями проведения возбуждения в безмиелиновых волокнах. Лабильность также уменьшается от волокон Аα до С и находится в обратной зависимости от продолжительности фазы абсолютной рефрактерности. Возбудимость тоже уменьшается от волокон Аα (наибольшая возбудимость) к волокнам С (наименьшая возбудимость). Например, пороговая сила электрического тока у волокон С в 30—50 раз больше, чем у волокон Аα. Исследование факторов, блокирующих нервную проводимость, показало, что к давлению наиболее чувствительны волокна А, к кислородному голоданию (гипоксии) — волокна В, к местным анестетикам — волокна С. Нервные волокна имеют две основные функции — проведение возбуждения и транспорт веществ, обеспечивающих трофическую функцию. 2.1.3.Механизм проведения возбуждения по нервному волокну Биопотенциалы могут быть локальными (местными), распространяющимися с декрементом (затуханием) на расстояние, не превышающее 1—2 мм, и импульсными (ПД), распространяющимися без декремента по всей длине волокна — на несколько десятков сантиметров, например от мотонейронов спинною мозга по всей длине нервного волокна до мышечных волокон конечностей с учетом длины самой конечности. Распространение локальных потенциалов. Локальные потенциалы (препотенциал, рецепторный потенциал, возбуждающий постсинаптический потенциал — ВПСП) изменяют мембранный потенциал покоя, как правило, в сторону деполяризации в результате входа в клетку Na+ согласно электрохимическому градиенту. В результате этого между участком волокна, в котором возник локальный потенциал, и соседними участками мембраны формируется электрохимический градиент, вызывающий передвижение ионов. В частности, вошедшие в клетку ионы Na+ начинают перемещаться в соседние участки, а ионы Na+ на наружной поверхности клетки движутся в противоположном направлении. В итоге поляризация мембраны соседнего участка уменьшится. Фактически это означает, что локальный потенциал из первичного очага распространился на соседний участок мембраны. Он затухает на расстоянии 1—2 мм от очага первичной деполяризации, что связано с отсутствием ионных управляемых каналов на данном участке мембраны или неактивацией управляемых ионных каналов, продольным сопротивлением цитоплазмы волокна и шунтированием тока во внеклеточную среду через каналы утечки мембраны. Если возникшая деполяризация мембраны не сопровождается изменением проницаемости потенциалзависимых натриевых, кальциевых и калиевых каналов, такую деполяризацию называют электротонической. Электротоническое распространение возбуждения — физический механизм, оно характерно для тех фрагментов мембран возбудимых клеток, где нет потенциалзависимых ионных каналов. Такими участками являются, например, большая часть мембраны дендритов нервных клеток, межперехватные промежутки в миелиновых нервных волокнах. Если местный потенциал (рецепторный или ВПСП), распространяясь электротонически, достигает участков мембраны, способных генерировать ПД (аксонный холмик, перехваты Ранвье, часть мембраны дендритов и, возможно, сомы), но его амплитуда при этом не достигнет критического уровня деполяризации, то такой потенциал называют препотенциалом. В его возникновении и распространении частично участвуют потенциалзависимые ионные каналы, однако при этом нет регенеративной (самоусиливающейся) деполяризации, характерной для ПД. Поэтому распространение такого потенциала происходит с затуханием амплитуды. Если локальный потенциал достигает участков мембраны, способных генерировать ПД, и его амплитуда выходит на критический уровень деполяризации, формируется ПД, который распространяется по всей длине нервного волокна без затухания. Эффективность электротонического распространения биопотенциалов зависит от физических свойств нервного волокна — сопротивления и емкости его мембраны, сопротивления цитоплазмы. Электротоническое проведение в нервном волокне улучшается при увеличении его диаметра, что связано с уменьшением сопротивления цитоплазмы, а также при миелинизации волокна, увеличивающей сопротивление мембраны (до 105 Ом/см2) и уменьшающей ее емкость (до 0,005 мкФ/см2). Эффективность электротонического проведения характеризует постоянная длины мембраны (λm). Это расстояние, на которое может электротонически распространиться биопотенциал, пока его амплитуда не уменьшится до 37 % от исходной величины. Постоянная длины для локальных потенциалов реально не превышает 1 мм, и их амплитуда затухает на расстоянии 1—2 мм от места возникновения. Для передачи возбуждения на большие расстояния необходимо формирование ПД. В его распространении, кроме электротонического механизма, существенная роль принадлежит механизму регенеративной деполяризации, позволяющей сохранить амплитуду ПД на всем пути его следования. Проведение потенциала действия. Обязательным условием проведения нервного импульса является наличие на всем протяжении или в ограниченных, но повторяющихся участках волокна потенциалзависимых ионных каналов, ответственных за формирование ПД. В распространении ПД можно выделить два этапа: этап электротонического проведения, обусловленный физическими свойствами нервного волокна, и этап генерации ПД в новом участке на пути его движения, обусловленный реакцией ионных каналов. В зависимости от расположения и концентрации ионных каналов в мембране волокна возможно два типа проведения ПД: непрерывный и сальтаторный (скачкообразный). Непрерывное распространение ПД осуществляется в безмиелиновых волокнах типа С, имеющих равномерное распределение потенциалзависимых ионных каналов, участвующих в генерации ПД. Проведение нервного импульса начинается с этапа электротонического распространения возникшего ПД. Амплитуда ПД нервного волокна (мембранный потенциал + инверсия) составляет около 90 мВ, постоянная длины мембраны (λm) в безмиелиновых волокнах равна 0,1—1,0 мм. Поэтому ПД, распространяясь на этом расстоянии как электротонический потенциал и сохранив как минимум 37 % своей амплитуды, способен деполяризовать мембрану до критического уровня и генерировать на всем протяжении новые ПД (рис.5). При этом на этапе электротонического распространения нервного импульса ионы движутся вдоль волокна между деполяризованным и поляризованным участками, обеспечивая проведение возбуждения в соседние участки волокна. Реально при неповрежденном нервном волокне этап чисто электротонического распространения ПД (вдоль мембраны) предельно мал, так как потенциалзависимые каналы имеются в непосредственной близости друг от друга и, естественно, — от возникшего потенциала действия и наблюдается только до достижения деполяризации, равной 50 % Екр. Далее включается перемещение ионов в клетку (нервное волокно) и из клетки за счет активации ионных каналов. При формировании нового ПД в соседнем участке в фазе деполяризации возникает мощный ток ионов натрия в клетку вследствие активации натриевых каналов, приводящий к регенеративной (самоусиливающейся) деполяризации. Этот ток обеспечивает формирование нового ПД той же амплитуды, представляющий собой, как обычно, сумму двух величин — мембранного потенциала покоя и инверсии. В связи с этим проведение ПД осуществляется без декремента (без снижения амплитуды). Таким образом, непрерывное распространение нервного импульса идет через генерацию новых ПД по эстафете, когда каждый участок мембраны выступает сначала как раздражаемый (при поступлении к нему электротонического потенциала), а затем как раздражающий (после формирования в нем нового ПД). Сальтаторный ( прерывистый, скачкообразный ) тип проведения нервного импульса осуществляется в миелиновых волокнах (типы А и В), для которых характерна концентрация потенциалзависимых ионных каналов только в небольших участках мембраны (в перехватах Ранвье), где их плотность достигает 12 000 на 1 мкм2, что примерно в 100 раз выше, чем в мембранах безмиелиновых волокон. В области миелиновых муфт (межузловых сегментов), обладающих хорошими изолирующими свойствами, потенциалзависимых каналов почти нет, и мембрана осевого цилиндра там практически невозбудима. В этих условиях ПД, возникший в одном перехвате Ранвье, электротонически (вдоль волокна, без участия ионных каналов) распространяется до соседнего перехвата, деполяризуя там мембрану до критического уровня, что приводит к возникновению нового ПД, т.е. возбуждение проводится скачкообразно (рис. 6). Постоянная длина мембраны миелинового волокна достигает 5 мм. Это значит, что ПД, распространяясь электротонически на этом расстоянии, сохраняет 37 % своей амплитуды (около 30 мВ) и может деполяризовать мембрану до критического уровня (пороговый потенциал в перехватах Ранвье равен около 15 мВ). Поэтому в случае повреждения ближайших на пути следования перехватов Ранвье потенциал действия может электротонически возбудить 2—4-й и даже 5-й перехваты. Сальтаторное проведение ПД по миелиновым волокнам является эволюционно более поздним механизмом, возникшим впервые у позвоночных. Оно имеет два важных преимущества по сравнению с непрерывным проведением возбуждения. Во-первых, оно более экономично в энергетическом плане, т.к. возбуждаются только перехваты Ранвье, площадь которых менее 1 % мембраны, и, следовательно, надо меньше энергии для восстановления трансмембранных градиентов Na+ и К+, уменьшающихся в процессе формирования ПД. Во-вторых, возбуждение проводится с большей скоростью (см. табл.3), чем в безмиеликовых волокнах, так как возникший ПД на протяжении миелиновых муфт распространяется электротонически, что в 107 раз быстрее, чем скорость непрерывного проведения ПД в безмиелиновом волокне. 2.1.4. Проведение возбуждения в нервных стволах В периферической нервной системе волокна объединены с помощью соединительнотканных оболочек в нервные стволы (нервы). В одном нерве могут быть тысячи нервных волокон: например, в срединном и мышечно-кожном нервах имеется 27—37 тыс. нервных волокон. Волокна в нервах могут быть миелиновыми и безмиелиновыми, афферентными и эфферентными. В естественных условиях каждое волокно нерва возбуждается от своего источника (например, эфферентное — от аксонного холмика, афферентное — от рецептора), и ПД в них проводятся асинхронно. Кроме того, чувствительные и двигательные волокна проводят импульсы в противоположных направлениях. Суммарная электрическая активность нерва создается электрической активностью составляющих его волокон и зависит от числа возбужденных волокон, степени шунтирования местных токов невозбужденными волокнами, синхронности проведения ПД в волокнах. В связи с этим анализ суммарной электрической активности нерва (нейрограммы) представляет трудную задачу. В лабораторных условиях при монополярном отведении, когда один электрод расположен на неповрежденном участке нерва, а второй — на поврежденном (деполяризованном) участке, можно зафиксировать суммарный монофазный ПД нерва и его дисперсию (расслоение) во времени. Если отводящий электрод расположен близко (до 3 мм) к раздражающему, через который подают сильный одиночный стимул, то регистрируется суммарный ПД нерва, напоминающий по форме ПД отдельного нервного волокна, но растянутый по времени. Суммарный ПД нерва в отличие от ПД отдельного волокна не подчиняется закону «все или ничего». Это означает, что при увеличении силы раздражения увеличивается число возбужденных нервных волокон: в возбуждение вовлекаются, кроме Аα-волокон, менее возбудимые Аβ-, Аγ-, Аδ-, Вволокна и, наконец, наименее возбудимые С-волокна (закон силовых отношений — увеличение ответной реакции с увеличением силы раздражения). Если отводящий электрод расположен на достаточном удалении от раздражающего электрода (до 80—100 мм), то фиксируется расслоение суммарного ПД нерва на несколько пиков соответственно типам нервных волокон. Это связано с неодинаковой скоростью проведения ПД в разных волокнах нерва: сначала до места регистрации доходят нервные импульсы по быстропроводящим Аα-волокнам, через некоторое время по Аβ, затем по Аγ и т.д. Позже всего до места регистрации доходят ПД по С-волокнам. Если отведение биполярное и оба отводящих электрода расположены на неповрежденных участках нерва и недалеко от раздражающего электрода (чтобы избежать дисперсии потенциала, то при сильном одиночном стимуле фиксируется двухфазный суммарный потенциал. Возникновение этих фаз связано с тем, что, когда волна возбуждения находится под первым (ближайшим к месту раздражения) отводящим электродом, этот участок становится электроотрицательным по отношению к покоящемуся участку под вторым отводящим электродом и луч осциллографа отклоняется вверх. Когда же волна возбуждения доходит до второго электрода, а под первым электродом мембраны волокон уже реполяризованы, то луч осциллографа отклоняется в противоположную сторону — вниз. 2.1.5. Законы проведения возбуждения по нервным волокнам − Закон двустороннего проведения возбуждения. Прямые доказательства этой закономерности были получены во второй половине XIX в. А.И.Бабухиным и Э.Дюбуа- Реймоном. Если стимул действует на средний участок изолированного нерва (Дюбуа-Реймон), то распространение возбуждения регистрируется как в проксимальном, так и в дистальном участках нерва. В опытах на электрическом органе у рыб, иннервируемом разветвлениями аксона одного нейрона, было показано (А.И.Бабухин), что при раздражении перерезанной веточки аксона возбуждение распространяется в необычном центростремительном направлении, передается на другие разветвления аксона, по которым идет в центробежном направлении (так называемый аксон-рефлекс). В условиях организма двустороннее проведение показано в аксонном холмике; возникший в этом месте ПД распространяется не только в аксон, но и в тело нейрона. На уровне целого организма аксоны нервных клеток проводят возбуждение только в одном направлении: от рецепторного отдела рефлекторной дуги к исполнительному органу (эффектору). Роль выпрямителя в рефлекторной дуге выполняют химические синапсы. − Закон изолированного проведения возбуждения. В обычных условиях деятельности нервного ствола (возбуждение только части нервных волокон, асинхронное распространение в них ПД) проведение возбуждения в составляющих его волокнах происходит практически изолированно. Это обусловлено тем, что петли тока в межклеточной жидкости ствола, имеющей низкое сопротивление, почти не проникают в невозбужденные волокна нерва из-за большого сопротивления их оболочек. Изолированное проведение импульсов по нервным волокнам обеспечивает точное афферентное и эфферентное влияния функционально разнородных волокон нерва. Однако при одновременном раздражении значительного количества волокон в межклеточной жидкости ствола возникает достаточно сильный внешний ток, способный возбудить неактивные (прежде всего высоковозбудимые) волокна и таким образом увеличить количество функционирующих нервных волокон в нерве, его эфферентное или афферентное влияние. − Закон физиологической непрерывности нерва. Обязательным условием проведения возбуждения по нервному волокну является анатомическая и функциональная целость возбудимой мембраны осевого цилиндра. Поэтому не только перерезка нерва, но и любое воздействие, нарушающее целость мембраны осевого цилиндра, например перевязка нерва, чрезмерное натяжение нервных волокон, создают непроводимость. Возможность функционального блока проведения возбуждения возможна при морфологической целостности волокон. Непроводимость наступает при воздействиях, нарушающих генерацию нервного импульса. Так, чрезмерное охлаждение или согревание, прекращение кровоснабжения, различные химические агенты, в частности местные обезболивающие — новокаин, кокаин, дикаин, прекращают проведение по нерву. Н.Е.Введенский (1901) показал, что при действии различных факторов на нерв (кокаина, хлороформа, фенола, хлористого калия, сильного фарадического тока) в нем сначала возникает трансформация ритма проводимого возбуждения (блокируется проведение высокочастотных потенциалов действия, и проводятся только низкочастотные ПД), а в дальнейшем может возникать полный блок проведения нервных импульсов — участок парабиоза. В этом участке возникает длительная деполяризация мембраны волокон, которая в результате закрытия инактивационных h-ворот в натриевых каналах сначала затрудняет генерацию ПД (уменьшается его амплитуда, увеличивается длительность, затягивается фаза абсолютной рефрактерности), а в дальнейшем, если инактивация натриевых каналов превысит 50 %, приводит к полной невозбудимости этого участка нервного волокна. Для возникновения блока в проведении возбуждения протяженность парабиотического участка должна превысить постоянную длину мембраны (λm), иначе ПД может распространиться через этот участок электротонически. Нарушение физиологической непрерывности нервных волокон возникает при действии анестетиков, электрического тока, при гипоксии, воспалении, охлаждении. После прекращения действия этих факторов проведение возбуждения по волокнам нерва восстанавливается. Однако, при углублении и усилении действия вызвавшего парабиоз агента обратимые изменения могут переходить в необратимое нарушение жизнедеятельности — смерть. 2.1.6. Особенности проведения возбуждения в нервных волокнах − Большая скорость проведения возбуждения. Скорость проведения ПД в различных типах волокон нерва равна 0,5—120 м/с. Она значительно выше в миелиновых волокнах в связи с сальтаторным типом проведения ПД, а среди миелиновых волокон прямо пропорциональна диаметру волокна. Скорость проведения возбуждения в миелиновых нервных волокнах значительно выше, чем в других удлиненных возбудимых структурах, — в гладких миоцитах (0,02—0,10 м/с), рабочих кардиомиоцитах (около 1 м/с), и только в миоцитах проводящей системы сердца и скелетных миоцитах скорость проведения ПД (2—5 м/с) достигает величин распространения ПД в низкоскоростных нервных волокнах (тип С и В). Передача возбуждения по нервным волокнам является наиболее скоростным из известных способов передачи информации на значительные расстояния в организме. Для сравнения отметим, что скорость передачи гуморальных влияний ограничена скоростью кровотока, которая равна от 0,5 мм/с в капиллярах до 0,25 м/с в аорте (средняя скорость). − Малая утомляемость нервного волокна. При нормальном кровоснабжении (доставке кислорода и питательных веществ) проводящий возбуждение нерв практически неутомляемость. «Изумительно долгая неутомляемость нерва» впервые была показана Н.Е.Введенским (1883): в его опытах нерв сохранял способность к проведению возбуждения в течение 6— 8 ч непрерывного раздражения несильными токами в условиях наличия кислорода в окружающей среде и поддержания влажного состояния нерва. Это обусловлено тем, что при проведении ПД по нервным волокнам используется всего лишь одна миллионная часть запасов трансмембранных ионных градиентов и, следовательно, нужны небольшие количества АТФ для восстановления (например, посредством Nа/К-насоса) ионных градиентов. Об энергетической экономности проведения возбуждения свидетельствует и низкая величина теплопродукции в работающем нерве, отражающая степень окислительного фосфорилирования в митохондриях. Ее величина в нерве (0,06 кал/г ткани в течение 1 ч) примерно в 16 раз меньше, чем на соответствующую единицу массы в целом организме в условиях основного обмена, и в миллион раз меньше, чем в работающей мышце. − Высокая лабильность. 2.1.7. Аксонный транспорт Наличие у нейрона отростков, длина которых может достигать 1 м (например, аксоны, иннервирующие мускулатуру конечностей), создает серьезную проблему внутриклеточной связи между различными участками нейрона и ликвидации возможных повреждений его отростков. Основная масса веществ (структурных белков, ферментов, полисахаридов, липидов и др.) образуется в трофическом центре (теле) нейрона, расположенном преимущественно около ядра, а используются они в различных участках нейрона, включая его отростки. Хотя в аксонных окончаниях существуют синтез медиаторов, АТФ и повторное использование мембраны пузырьков после выделения медиатора, все же необходима постоянная доставка ферментов и фрагментов мембран из тела клетки. Для транспорта этих веществ (например, белков) путем диффузии на расстояние, равное максимальной длине аксона (около 1 м), потребовалось бы 50 лет! Для решения этой задачи эволюция сформировала специальный вид транспорта в пределах отростков нейрона, который более хорошо изучен в аксонах и получил название аксонного транспорта. С помощью этого процесса осуществляется трофическое влияние не только в пределах различных участков нейрона, но и на иннервируемые клетки. В последнее время появились данные о существовании нейроплазматического транспорта в дендритах, который осуществляется из тела клетки со скоростью около 3 мм в сутки. Различают быстрый и медленный аксонный транспорт. Быстрый аксонный транспорт идет в двух направлениях: от тела клетки до аксонных окончаний (антеградный транспорт, скорость 250—400 мм/сут) и в противоположном направлении (ретроградный транспорт, скорость 200—300 мм/сут). Посредством антеградного транспорта в аксонные окончания доставляются везикулы, образующиеся в аппарате Гольджи и содержащие гликопротеины мембран, ферменты, медиаторы, липиды и другие вещества. Посредством ретроградного транспорта в тело нейрона переносятся везикулы, содержащие остатки разрушенных структур, фрагменты мембран, ацетилхолинэстераза, неидентифицированные «сигнальные вещества», регулирующие синтез белка в соме клетки. В патологических условиях по аксону к телу клетки могут транспортироваться вирусы полиомиелита, герпеса, бешенства и столбнячный экзотоксин. Многие вещества, доставленные путем ретроградного транспорта, подвергаются разрушению в лизосомах. Быстрый аксонный транспорт осуществляется с помощью специальных структурных элементов нейрона: микротрубочек и микрофиламентов, часть которых представляет собой актиновые нити (актин составляет 10—15 % белков нейрона). Для транспорта необходима энергия АТФ. Разрушение микротрубочек (например, колхицином) и микрофиламентов (цитохолазином В), снижение уровня АТФ в аксоне более чем в 2 раза и падение концентрации Са2+ блокируют аксонный транспорт. Медленный аксонный транспорт осуществляется только в антеградном направлении и представляет собой передвижение всего столба аксоплазмы. Он выявляется в опытах со сдавлением (перевязкой) аксона. При этом происходит увеличение диаметра аксона проксимальнее перетяжки в результате «наплыва гиалоплазмы» и утончение аксона за местом сдавления. Скорость медленного транспорта равна 1 —2 мм/сут, что соответствует скорости роста аксона в онтогенезе и при его регенерации после его повреждения. С помощью этого транспорта перемещаются образованные в эндоплазматической сети белки микротрубочек и микрофиламентов (тубулин, актин и др.), ферменты цитозоля, РНК, белки каналов, насосов и другие вещества. Медленный аксонный транспорт не нарушается при разрушении микротрубочек, но прекращается при отделении аксона от тела нейрона, что свидетельствует о разных механизмах быстрого и медленного аксонного транспорта. Функциональная роль аксонного транспорта. − Антеградный и ретроградный транспорт белков и других веществ необходимы для поддержания структуры и функции аксона и его пресинаптических окончаний, а также для таких процессов, как аксонный рост и образование синаптических контактов. − Аксонный транспорт участвует в трофическом влиянии нейрона на иннервируемую клетку, так как часть транспортируемых веществ выделяется в синаптическую щель и действует на рецепторы постсинаптической мембраны и близлежащих участков мембраны иннервируемой клетки. Эти вещества участвуют в регуляции обмена веществ, процессов размножения и дифференцировки иннервируемых клеток, формируя их функциональную специфику. Например, в опытах с перекрестной иннервацией быстрых и медленных мышц показано, что свойства мышц меняются в зависимости от типа иннервирующего нейрона, его нейротрофического воздействия. Передатчики трофических влияний нейрона до сих пор точно не определены, важное значение в этом плане придается полипептидам и нуклеиновым кислотам. − Роль аксонного транспорта особенно ярко выявляется при повреждении нерва. Если нервное волокно на каком-либо участке прервано, его периферический отрезок, лишенный контакта с телом нейрона, подвергается разрушению, которое называется валлеровской дегенерацией. В течение 2—3 суток наступает распад нейрофибрилл, митохондрий, миелина и синаптических окончаний. Надо отметить, что распаду подвергается участок волокна, снабжение которого кислородом и питательными веществами с кровотоком не прекращается. Считают, что решающим механизмом дегенерации является прекращение аксонного транспорта веществ от тела клетки до синаптических окончаний. − Аксонный транспорт играет важную роль и при регенерации нервных волокон. 2.1.8. Развитие и регенерация отростков нейрона После рождения у человека деления нейронов и нейробластов практически не происходит, хотя отдельные случаи митоза могут быть и сохраняется способность нейрона к размножению, что показано при культивировании нервной ткани. Созревание нервной системы в процессе онтогенеза и усложнение структуры при функциональной нагрузке осуществляется в результате развития нервных отростков — увеличения их числа и степени ветвления. Например, у взрослого человека по сравнению с новорожденным число точек ветвления дендритов увеличивается в 13 раз, а общая длина дендритов нейронов коры — в 34 раза. Увеличивается также число коллатералей и терминальных разветвлений аксона. В результате роста нервных отростков осуществляется также их регенерация при повреждении. Конечной целью развития и регенерации нервных волокон является образование синаптических контактов, новых или на месте разрушения. Важным структурным элементом при развитии или регенерации отростка нейрона является образование конуса роста волокна - утолщение неправильной формы с множеством длинных и тонких отростков толщиной 0,1—0,2 мкм и длиной до 50 мкм, отходящих в разные стороны. Конус роста является зоной интенсивного экзо- и эндоцитоза. Мембранный материал, образованный в теле нейрона, переносится посредством быстрого аксонного транспорта в виде пузырьков к конусу роста и посредством экзоцитоза встраивается в клеточную мембрану, удлиняя ее. Для передвижения конуса роста необходимы актиновые филаменты, повреждение которых прекращает рост. Для стабилизации структуры удлиняющегося волокна важное значение имеют микротрубочки, разрушение которых приводит к укорочению растущего волокна. Белки, необходимые для образования микротрубочек и микрофиламентов (тубулин, актин и др.), доставляются посредством медленного аксонного транспорта. В механизмах передвижения конуса роста выделены два фактора, направляющих этот процесс: «фактор адгезивности клеток» представляет собой гликопротеид, который находится на плазматической мембране отростков нейрона и обеспечивает сцепление между развивающимися отростками, группируя их в пучки; другим веществом является белок — «фактор роста нервов», который выделяется в межклеточную жидкость клеткой-мишенью для растущего нервного волокна и оказывает хемотаксическое влияние, направляя движение конуса роста в сторону клетки-мишени. При регенерации поврежденных волокон в периферической нервной системе важную роль в контроле направления роста играют шванновские клетки дистального (от зоны травмы) участка волокна. Они образуют после распада осевого цилиндра трубковидный тяж, в который должно попасть в случае успешной регенерации одно из ответвлений конуса роста. Как только конус роста достигает клетки-мишени, он превращается в пресинаптическое окончание; при этом процессы экзо- и эндоцитоза обеспечивают выделение и последующие поглощение медиатора. 2.2.СИНАПТИЧЕСКАЯ ПЕРЕДАЧА ВОЗБУЖДЕНИЯ Синапс (греч. synapsis — соединение) — специализированная структура, обеспечивающая передачу возбуждающих или тормозных влияний между двумя возбудимыми клетками. Через синапс наряду с прямым влиянием на возбудимость иннервируемой клетки осуществляется и более медленное трофическое влияние, приводящее к изменению метаболизма иннервируемой клетки, ее структуры и функции. Понятие синапс как тип межклеточного соединения, при котором осуществляется перенос нервной информации, ввел в науку Ч.Шеррингтон (1897). По данным современной нейрофизиологии, в области синапсов происходят важнейшие процессы регуляции нейронной активности. Большое значение имеют синапсы в образовании условных связей, памяти, формировании пластичности нервных центров. Синапсы являются ареной деятельности многих лекарств, механизмов заболевания и выздоровления. Классификация синапсов.— По виду соединяемых клеток синапсы можно разделить на межнейронные, нейроэффекторные и нейрорецепторные. Межнейронные синапсы находятся в ЦНС и вегетативных ганглиях. Нейроэффекторные (нейромышечные и нейросекреторные) синапсы соединяют эфферентные нейроны соматической и вегетативной нервной системы с исполнительными клетками — поперечнополосатыми и гладкими миоцитами, секреторными клетками. К нейрорецепторным синапсам относят контакты во вторичных рецепторах между, рецепторной клеткой и дендритом афферентного нейрона. — По эффекту синапсы делят на возбуждающие, т.е. запускающие генерацию потенциала действия, и тормозные, препятствующие возникновению потенциала действия. — По способу передачи сигнала синапсы делят на химические, электрические и смешанные. Химические синапсы являются специфическим межклеточным контактом для нервной системы. В них передача влияния на постсинаптическую клетку осуществляется с помощью химического посредника — медиатора. Этот тип синапсов преобладает в нервной системе человека и высших позвоночных. В электрических синапсах потенциалы действия непосредственно (электротонически) передаются на постсинаптическую клетку. Эти синапсы являются разновидностью щелевых межклеточных контактов (высокопроводимые контакты), которые встречаются и в других тканях (например, нексусы в миокарде и гладкомышечной ткани). Электрические синапсы немногочисленны в нервной системе млекопитающих, особенно в постнатальном периоде. Обнаружены также смешанные синапсы, в которых наряду с химической передачей имеются участки с электротоническим механизмом передачи (например, в реснитчатом ганглии птиц, спинном мозге лягушки). — По природе медиатора химические синапсы делят на холинергические (медиатор — ацетилхолин), адренергические (норадреналин), дофаминергические (дофамин), ГАМКергические (γ-аминомасляная кислота), глутаматергические (глутамат), аспартатергические (аспартат), пептидергические (пептиды), пуринергические (АТФ). 2.2.1. Проведение возбуждения в химическом синапсе. Физиология нервномышечного синапса 2.2.1.1. Структурная характеристика Нервно-мышечный синапс имеет общие для всех синапсов структурные элементы: пресинаптическое окончание, постсинаптическую мембрану и связывающую их синаптическую щель (рис. 7). Вместе с тем структура нервно-мышечного синапса имеет и отличия от других синапсов, связанные с иннервацией длинных клеток (миоцитов) и необходимостью из одного синапса при передаче одного импульса практически одновременно активировать все сократительные единицы (саркомеры) миоцита. Рис.7. Нервно-мышечный синапс скелетной мышцы 1− ветвь аксона; 2 – пресинаптическое окончание аксона; 3 – митохондрии;4 − синаптические пузырьки, содержащие ацетилхолин; 5 − синаптическая щель; 6 − молекулы медиатора в синаптической щели; 7 − постсинаптическая мембрана мышечного волокна с рецепторами. Пресинаптическое окончание образуется расширениями по ходу разветвления аксона, иннервирующего мышечное волокно. В нервно-мышечном синапсе пресинаптическое окончание имеет большую длину (около 1—2 мм). Главным ультраструктурным фрагментом пресинаптического окончания являются синаптические пузырьки (везикулы) диаметром около 40 нм. Они образуются в комплексе Гольджи, с помощью быстрого аксонного транспорта доставляются в пресинаптическое окончание и там заполняются медиатором и АТФ. В пресинаптическом окончании содержится несколько тысяч везикул, в каждой из которых имеется от 1 до 10 тыс. молекул химического вещества, участвующего в передаче влияния через синапс и в связи с этим названного медиатором (посредником). В нервно-мышечном синапсе везикулы преимущественно расположены вблизи периодических утолщений пресинаптической мембраны, называемых активными зонами. В неактивном синапсе везикулы с помощью белка синапсина связаны с белками цитоскелета, что обеспечивает их иммобилизацию и резервирование. Напротив скопления в пресинаптической мембране «синаптических» пузырьков (кластеров) постсинаптическая мембрана образует глубокие складки (рис.8). Каждой из них соответствует активная зона пресинаптической мембраны желобок на ее внутренней поверхности, вдоль обеих сторон которого располагаются в ряд синаптические пузырьки. Некоторые из них открыты наружу, в синаптическую щель. Очевидно, активные зоны и ассоциированные с ними пузырьки следует рассматривать как аппарат, специализированный для экзоцитоза, т.е. для выброса содержимого этих пузырьков в синаптическую щель. Рис. 8 . Ультраструктура нервно-мышечного синапса. Вверху слева: нервные окончания на мышечном волокне; на схеме рядом - пресинаптическое окончание вместе с лежащей под ним складчатой мышечной мембраной при большем увеличении. Внизу: еще большее увеличение: мембрана пресинаптического нейрона с частично разъединенными внутренним и внешним слоями, а под ней соответствующие слои субсинаптической мембраны мышцы. «Частицы» - это ацетилхолиновые рецепторы и молекулы холинэстеразы в мембране Важными структурами пресинаптического окончания являются митохондрии, осуществляющие энергетическое обеспечение процесса синаптической передачи, цистерны гладкой эндоплазматической сети, содержащие депонированный Са2+, а также микротрубочки и микрофиламенты, участвующие во внутриклеточном передвижении везикул. Часть мембраны пресинаптического окончания, ограничивающая синаптическую щель, называется пресинаптической мембраной. Через нее осуществляется выделение (экзоцитоз) медиатора в синаптическую щель. Синаптическая щель в нервно-мышечном синапсе имеет ширину в среднем 50 нм Она содержит межклеточную жидкость и мукополисахаридное плотное вещество в виде полосок, мостиков, которое обеспечивает связь между пре- и постсинаптической мембранами и может содержать ферменты. Это вещество хорошо выражено в щели нервно-мышечного синапса, где оно формирует базальную мембрану и содержит фермент ацетилхолинэстеразу. Постсинаптическая мембрана — утолщенная часть клеточной мембраны иннервируемой клетки, содержащая белковые рецепторы, имеющие ионные каналы и способные связать молекулы медиатора. Ее особенностью в нервно-мышечном синапсе является наличие множества мелких складок, которые образуют слепые карманы, открывающиеся в синаптическую щель. Благодаря им резко увеличиваются площадь постсинаптической мембраны и количество ее рецепторов, которое в одном синапсе достигает 10—20 млн. Постсинаптическую мембрану нервно-мышечного синапса называют также концевой пластинкой. 2.2.1.2. Механизм синаптической передачи и ее регуляция Передача в синапсе имеет два главных этапа. 1. Преобразование электрического сигнала в химический (электросекреторное сопряжение). Потенциал действия (ПД), поступивший в пресинаптическое окончание, вызывает деполяризацию его мембраны, открывающую потенциалзависимые Са-каналы. Ионы кальция входят, согласно концентрационному и электрическому градиентам, внутрь клетки, что ведет к увеличению его содержания в цитозоле в 10—100 раз. Ионы кальция активируют фосфорилирование синаптосина, что ослабляет связь везикулы с цитоскелетом, и везикула перемещается вдоль микротрубочек на позицию у активной зоны. При контакте везикулы с пресинаптической мембраной происходит ферментативное «плавление» ее стенки, а также активация белка синаптопорина, формирующего канал, через который медиатор выходит в синаптическую щель посредством первично-активного транспорта — экзоцитоза. В нервномышечном синапсе медиатором является ацетилхолин, который образуется в пресинаптическом окончании из ацетилкоэнзима А и холина под действием фермента холинацетилтрансферазы. Впервые экспериментальное доказательство химического механизма передачи возбуждения в нервно-мышечном синапсе получил А.Ф.Самойлов (1924). Он показал, что скорость передачи возбуждения с нерва на мышцу в отличие от проведения возбуждения по нерву зависит от температуры в такой же степени, как и скорость химических реакций. Английский физиолог Г.Дейл (1934) установил, что медиатором нервно-мышечного синапса является ацетилхолин. Этот медиатор был обнаружен одним из первых − он был известен также как «вещество блуждающего нерва» из-за своего действия на сердце. Выделение молекул медиатора из пресинаптического окончания пропорционально количеству поступившего туда Са2+ в степени n = 4. Следовательно, химическое звено пресинаптического окончания работает как усилитель. Один из возможных механизмов усиления связан с тем, что поступивший в пресинаптическое окончание Са2+ активирует рианодиновые рецепторы в цистернах эндоплазматической сети, имеющие в своем составе Са-каналы, что приводит к дополнительному выделению Са2+ в цитозоль из цистерн. Выделение ацетилхолина в синаптическую щель осуществляется квантами, каждый из которых в нервно-мышечном синапсе содержит от нескольких тысяч до 10 тыс. молекул. На один ПД из пресинаптического окончания нервно-мышечного синапса выделяется 200—300 квантов медиатора. В промежутках между ПД из пресинаптического окончания происходит спонтанное выделение 1—2 квантов медиатора в синаптическую щель в течение 1 с. Молекулы медиатора, поступившие в синаптическую щель, диффундируют к постсинаптической мембране и вступают во взаимодействие с ее рецепторами. В нервно-мышечном синапсе ацетилхолин действует на Н-холинорецепторы, которые способны активизироваться и под влиянием никотина, вследствие чего они и получили свое название. Н-холинорецептор имеет в своем составе Nа/К-канал и состоит из пяти очень сходных субъединиц (α)2, β, γ, δ) примерно одинакового размера, группирующихся вокруг центрального канала. Такого рода макробелок составляет основу рецепторов различных типов, а для ацетилхолинового рецептора установлена его полная аминокислотная последовательность. Молекулярная масса этого белка 258 000. Открывание каналов в химических синапсах происходит в результате связывания медиатора или его агониста с комплексом рецептор-канал. Скорость диффузии молекул медиатора позволяет им пройти расстояние синаптической щели в течение 0,1—0,2 мс. Длительность действия медиатора на рецепторы постсинаптической мембраны, определенная по продолжительности открытия в ней ионных каналов, равна около 1 мс. Это значительно меньше периода полураспада медиатора и свидетельствует о его удалении из синаптической щели. Оно осуществляется путем диффузии ацетилхолина из щели в окружающую жидкость и разрушения его под действием ацетилхолинэстеразы. Этот фермент выделяется миоцитом и прикрепляется к мукополисахаридному веществу в синаптической щели. Одна молекула ацетилхолинэстеразы может гидролизовать до ацетата и холина 10 молекул ацетилхолина в 1 мс, что обеспечивает его разрушение в синаптической щели в течение нескольких десятых долей миллисекунды. При этом большая часть (около 60 %) холина захватывается обратно пресинаптическим окончанием. Значительная доля высвобожденного ацетилхолина разрушается уже в ходе диффузии через синаптическую щель, не успевая достигнуть рецепторов, и через несколько миллисекунд его практически не остается: синапс вновь готов к передаче возбуждения. 2. Преобразование химического сигнала обратно в электрический. Этот этап осуществляется в постсинаптической мембране. Действие молекул медиатора на ее рецепторы ведет к открытию ионных каналов и перемещению ионов, имеющих высокий электрохимический градиент на протяжении канала. Присоединение двух молекул ацетилхолина к α-субъединицам Н-холинорецептора открывает канал. Открытое состояние сохраняется 1 мс, в течение которой через него проходит около 500 000 ионов. Один квант медиатора (десятки тысяч его молекул) создает на несколько миллисекунд около рецепторов его высокую концентрацию, которая затем быстро падает. Начальный подъем концентрации медиатора повышает вероятность открывания канала, причем его открытые состояния перемежаются кратковременными закрываниями. После такой вспышки открываний он окончательно закрывается, потому что концентрация медиатора становится слишком низкой. Серии открываний суммируются, так что квант тока складывается из нескольких сотен токов одиночных каналов. Поскольку квант медиатора почти всегда вызывает только одну вспышку открываний, постоянная времени спада синаптического тока тоже примерно соответствует средней продолжительности такой вспышки. Канал на внутреннем суженном конце имеет диаметр 0,65 нм, хорошо проницаем для Nа+ и К+, плохо проницаем для Са2+. Поскольку канал имеет слабую избирательность в отношении Nа+ и К+, то ионные токи через канал зависят главным образом от электродвижущей силы (ЭДС) этих ионов. ЭДС иона равна разности между мембранным потенциалом покоя и равновесным потенциалом данного иона (ЭДС = МПП - Еиона). Отрицательная величина ЭДС характеризует движение иона в клетку, положительная — из клетки. В связи с этим входящий в клетку ток натрия (ЭДС = -140 мВ) резко преобладает над выходящим из клетки током калия (ЭДС = 14 мВ). Иными словами, ион Nа+ движется в клетку согласно концентрационному и электрическому градиенту (клетка внутри имеет положительный заряд), а ион К+ выходит из клетки только согласно концентрационному градиенту, причем вопреки электрическому (снаружи клетка имеет положительный заряд). Поэтому суммарный ток ионов Nа+ в клетку превосходит ток К+ из клетки, что и приводит к деполяризации постсинаптической мембраны (концевой пластинки). Эта деполяризация называется возбуждающим постсинаптическим потенциалом (ВПСП), который в нервномышечном синапсе называют потенциалом концевой пластинки (ПКП). Особенностью нервномышечного синапса фазного мышечного волокна является то, что при одиночной его активации формирующийся ПКП имеет большую амплитуду (30—40 мВ), которая превышает критический уровень деполяризации и вызывает генерацию ПД в миоците. Тоническое мышечное волокно имеет 7—10 синапсов, принадлежащих, как правило, нескольким мотонейронам. При этом ПКП не вызывает генерации ПД, а непосредственно запускает мышечное сокращение. Как было отмечено, в промежутках между передачей нервного импульса происходит спонтанное выделение 1—2 квантов медиатора в синаптическую щель. При этом в постсинаптической мембране формируется деполяризация амплитудой 0,12—0,24 мВ, возникающая в среднем 1 раз в 1 с. Такие потенциалы, изученные в нервно-мышечном синапсе, были названы миниатюрными потенциалами концевой пластинки. Они, вероятно, поддерживают высокую возбудимость синапсов в условиях функционального покоя нервных центров. Кроме экзоцитоза медиатора, существует постоянная неквантовая утечка молекул медиатора в синаптическую щель. Предполагают, что неквантовая секреция играет трофическую роль. Саморегуляция в синапсе осуществляется с использованием функциональных обратных связей. Веществами, влияющими на эффективность синаптической передачи, могут быть медиаторы, продукты их распада. В нервно-мышечном синапсе ацетилхолин, выделившийся в небольшом количестве в синаптическую щель, может стимулировать более сильный выброс ацетилхолина из пресинаптического окончания по механизму обратной связи (самоусиление секреции). Высокие концентрации ацетилхолина в синаптической щели, напротив, угнетают секрецию его из пресинаптического окончания. Показано, что холин (продукт гидролиза ацетилхолина) в концентрации 10 -4—10-5 М тормозит выделение ацетилхолина из пресинаптического окончания. 2.2.1.3. Особенности проведения возбуждения в химических синапсах Проведение возбуждения в химическом синапсе имеет ряд характерных особенностей, отличающих этот процесс от такового в нервных волокнах: — Одностороннее проведение возбуждения. Синапсы функционально асимметричны и работают по принципу физиологического клапана, осуществляя одностороннее проведение возбуждения только в направлении от пресинаптического окончания в сторону постсинаптической мембраны. Это связано с тем, что медиатор выделяется из пресинаптического окончания, а взаимодействующие с ним рецепторы, имеющие ионные каналы, необ- ходимые для формирования синаптических потенциалов, находятся только на постсинаптической мембране. — Замедленное проведение возбуждения в синапсе (синаптическая задержка). Синаптическая задержка в нервно-мышечном синапсе составляет 0,5—1,0 мс (время от момента поступления импульса к нервному окончанию до момента возникновения ПД в мышечном волокне). Это время затрачивается на процессы секреции медиатора, диффузию его к постсинаптической мембране, действие на рецепторы, возникновение ионных токов, формирование постсинаптических потенциалов и их суммацию, способную вызвать ПД. — Низкая лабильность. Синапсы имеют низкую лабильность (по сравнению с нервным волокном). Она равна около 100 Гц, что в 5—6 раз ниже лабильности аксона. Главной причиной низкой лабильности синапса является синаптическая задержка проведения возбуждения. —Трансформация ритма возбуждения в синапсах. Частота потенциалов действия, поступающих в синапс, обычно не совпадает с частотой ПД, генерируемых нейроном, имеющим данный синаптический вход. Однако в нервно-мышечном синапсе быстрого мышечного волокна трансформация ритма не выражена: один импульс нервного волокна вызывает один ПД в мышечном волокне. — Высокая чувствительность к химическим агентам. Проводимость химических синапсов сильно изменяется под влиянием биологически активных веществ, лекарств и ядов. — Синаптическое облегчение. Эти изменения синаптической передачи возбуждения более детально изучены в нервно-мышечных синапсах, хотя имеют место и в синапсах ЦНС. Передача ПД через синапс, как было рассмотрено выше, сопровождается повышением концентрации Са2+ в пресинаптическом окончании, которая снижается до межимпульсного уровня в течение нескольких десятков миллисекунд. Если следующий ПД попадает в этот следовый период, то выброс медиатора в синаптическую щель увеличивается и формируется более высокоамплитудный ВПСП (в нервно-мышечном синапсе — ПКП), что приводит к повышению эффективности синаптической передачи — синоптическому облегчению). Активация пресинаптического окончания может осуществляться ретроградными посредниками (окисью азота, арахидоновой кислотой, нейропептидами), которые выделяются постсинаптической клеткой. При передаче серии ПД через синапс концентрация Са2+ оказывается повышенной и вблизи постсинаптической мембраны. Активация при этом Са 2+зависимых ферментов (киназ, фосфатаз, протеаз) приводит к активации рецепторных белков и расщеплению белков, блокирующих рецепторы (например, белка фодрина, маскирующего глутаматные рецепторы). Облегчение синаптической передачи может быть связано также с увеличением синтеза рецепторов последовательно, их количества на постсинаптической мембране. Синаптическое облегчение является причиной оптимума частоты раздражения, открытого Н.Е.Введенским (1885) на нервно-мышечном препарате. В ЦНС синаптическое облегчение обозначается как феномен длительной потенциации. Он имеет важное значение в образовании условных рефлексов, формировании памяти и обучения. 2.2.1.4. Физиологические основы нарушений проведения возбуждения в нервномышечном синапсе Зная физиологический механизм проведения возбуждения в нервно-мышечном синапсе легко представить возможные механизмы нарушений этого процесса. − Блокада проведения возбуждения по нервному волокн . При нарушении морфологической (повреждение) или функциональной целости нервного волокна возбуждение не достигает пресинаптической мембраны и возбуждение синапсом не передается. Примером нарушения функциональной целости нервного волокна является действие местных анестетиков (новокаин и др.), при применении которых снижается или исчезает чувствительность и двигательная функция в зоне анестезии. − Нарушение синтеза ацетилхолина. В нервно-мышечном синапсе токсин возбудителя ботулизма подавляет синтез ацетилхолина в пресинаптическом окончании, угнетая обратное поглощение холина из синаптической щели. − Нарушения высвобождения медиатора. Уже давно было известно, что химическая синоптическая передача нарушается при значительном снижении внеклеточной концентрации Са2+. Этот эффект примерно пропорционален четвертой степени, следовательно, для высвобождения одного кванта медиатора требуется реакция четырех ионов Са с активатором на внутренней стороне пресинаптической мембраны. Однако действие активатора зависит, повидимому, еще и от потенциала, т. е. даже при достаточно высокой внутриклеточной концентрации Са2+, синхронное высвобождение медиатора требует деполяризации мембраны. Можно предполагать, что она влияет на активатор примерно таким же образом, как и на молекулу ионного канала. Следовательно, пресинаптические активные зоны с их участками связывания пузырьков и мембранными белками («частицами») (рис. 8) должны представлять собой аппарат для быстрого регулирования экзоцитоза посредством деполяризации мембраны и повышения концентрации Са2+. Рост концентрации Са2+, возможно, влияет на сократительные элементы цитоскелета или инициирует фосфорилирование функциональных белков. − При высоких частотах передачи импульсов через синапс (например, для нервномышечного синапса более 100 Гц) снижается эффективность синаптической передачи, что получило название «синаптическая депрессия» (пессимум Н.Е.Введенского) — блок проведения возбуждения в результате стойкой деполяризации постсинаптической мембраны мышечного волокна, поскольку механизмы инактивации ацетилхолина не успевают срабатывать (пессимальное торможение). Синаптическая депрессия может развиться и при редкой, но длительной активации синапса. Ее механизм на пресинаптическом уровне связывают с истощением запаса медиатора в пресинаптическом окончании, которого по расчетам хватает на 10 000 синаптических передач и который может иссякнуть в течение нескольких минут. Другие механизмы депрессии связаны с накоплением высокой концентрации медиатора в синаптической щели вследствие того, что выброс медиатора в щель превышает возможности систем его разрушения и удаления. Высокий же уровень медиатора оказывает тормозящее влияние на секрецию его из пресинаптического окончания. Происходит также уменьшение чувствительности (десенситизация) рецепторов постсинаптической мембраны к медиатору. Механизм десенситизации может быть связан с фосфорилированием рецепторов постсинаптической мембраны, что в несколько раз снижает их сродство к медиатору. Другим механизмом десенситизации является эндоцитоз комплекса медиатор + рецептор внутрь клетки. Поглощенные рецепторы могут опять встраиваться в мембрану (при ослаблении стимула) или разрушаться в лизосомах. Эти процессы затрудняют развитие ПД в постсинаптической клетке и, следовательно, могут привести к блокаде синаптической передачи. − Блокада синаптической передачи антагонистами ацетилхолина. Синаптические антагонисты − это некоторые молекулы, которые, связываясь с синаптическими рецепторами, не вызывают изменений проводимости, поскольку, занимая рецептор, они препятствуют действию медиаторов или их агонистов. (Агонисты − это вещества, способные связываться с рецептором и полностью заменять медиатор. К агонистам ацетилхолина в концевой пластинке относятся, например, карбамилхолин или суберилдихолин). Связывание антагонистов может быть обратимым: спустя определенный период времени антагонист отделится от рецептора. Такие вещества называют конкурентными антагонистами, так как они конкурируют с медиаторами и их агонистами за участки связывания. К этим веществам относятся кураре и курареподобные вещества (диплацин, тубокурарин и др.). Эти вещества являются конкурентными антагонистами ацетилхолина: обратимо связываются с Н-холинорецепторами постсинаптической мембраны и блокируют действие на нее ацетилхолина. Яд кураре (dтубокурарин) давно известен в Южной Америке. Индейцы использовали его для отравления своих стрел. По мере повышения его концентрации он блокирует все больше рецепторов, и эффект ацетилхолина ослабляется из-за уменьшения доступных мест связывания. Под действием кураре потенциал концевой пластинки снижается и при достаточной дозе яда уже не может достичь порогового уровня, т.е. мышца парализуется. Кураре и аналогичные вещества часто используются в качестве мышечных релаксантов при наркозе. Разумеется, во время полного мышечного расслабления требуется искусственное дыхание. Другую форму такого расслабления обеспечивает антагонист ацетилхолина с пролонгированным действием, вызывающий устойчивую деполяризацию концевой пластинки. Этот деполяризующий мышечный релаксант инактивирует Nа+-каналы в мембране мышечного волокна и в результате предотвращает его естественное возбуждение (сукцинилхолин, декаметоний). − Действие антагонистов холинорецепторов, необратимо связывающихся с холинорецепторами.Необратимо связывает холинорецепторы и полностью блокирует передачу возбуждения через синапс полипептид из яда змей α-бунгаротоксин. Таким образом, действуя на холинорецептор вещества могут блокировать рецептор путем необратимого связывания с ним (α-бунгаротоксин) или длительно вытеснять ацетилхолин (кураре и курареподобные вещества); инактивировать (стойко деполяризовать) рецептор (сукцинилхолин, декаметоний). −Нарушение нервно-мышечной передачи под действием ингибиторов холинэстеразы. Значение фермента холинэстеразы для синаптической передачи в концевой пластинке хорошо заметно при его блокаде ингибиторами, Ряд веществ подавляют активность холинэстеразы, разрушающей ацетилхолин в синаптической щели. Ингибиторы холинэстеразы используются в медицинской практике для устранения мышечного расслабления при наркозе (лечебные дозыпрозерина и эзерина), а также при заболеваниях типа миастении (см. ниже). При небольшой ее инактивации происходят умеренное накопление ацетилхолина и облегчение синаптической передачи. С другой стороны, известны отравления людей инсектицидами на основе этих ингибиторов. В основе действия фосфорорганических отравляющих веществ также лежит угнетение фермента холинэстеразы. При этих отравлениях возникают судороги результат пролонгированной активации ацетилхолинергических синапсов, особенно в вегетативной нервной системе. При большой инактивации ацетилхолинэстеразы и значительном накоплении ацетилхолина синаптическая передача блокируется — развивается синаптическая депрессия и возможна смерть. − Химическое (фармакологическое) угнетение механизмов обратного захвата медиаторов или продуктов их распада. Во всех подробно изученных синапсах медиатор либо быстро разрушается, либо поглощается из синаптической щели через мембраны клеток. Мембранные транспортные механизмы особенно важны в случае адреналина, норадреналина, ГАМК и глутамата. В ацетилхолинергических синапсах транспортируется не сам ацетилхолин, а продукт его расщепления холин. Удаляемое вещество поступает в пресинаптическое окончание, что снижает потребность в ресинтезе медиатора. Подобно холинэстеразе, такие транспортные механизмы служат мишенями для действия многих важных лекарственных веществ, влияющих на синаптическую передачу. − Уменьшение количества синаптических рецепторов. Примером подобного нарушения может служить тяжелая миастения (myasthenia gravis) − относительно хорошо изученное глобальное нарушение функции нервно-мышечных синапсов. При этом заболевании тонус и сокращения скелетных мышц ослабевают; например, больные не в состоянии держать открытыми глаза или же с трудом передвигаются. Причина заключается в снижении плотности субсинаптических рецепторов ацетилхолина. Сам медиатор высвобождается в нормальных количествах, однако, связывается лишь с малым их числом; в результате потенциал концевой пластинки может не достигать порогового уровня, необходимого для возбуждения мышцы. Уменьшение количества функциональных ацетилхолиновых рецепторов обусловлено аутоиммунной реакцией: организм больного вырабатывает антитела, разрушающие или сокращающие время жизни собственных ацетилхолиновых рецепторов. При таком состоянии очень хорошо помогают ингибиторы холинэстеразы (амбеноний, неостигмин, пиридостигмин), позволяющие высвобождаемому в синапсах ацетилхолину действовать дольше, чем в норме, вызывая, таким образом, достаточную деполяризацию мембраны во время потенциала концевой пластинки. 2.2.2. Электрическая синаптическая передача возбуждения После того как концепция химической синаптической передачи стала общепринятой, примерно между 1930 и 1950 гг., к большому удивлению специалистов выяснилось, что межклеточная передача возбуждения может осуществляться и электрическим способом [Furshpan,Potter,1959]. Две соседние клетки прилегают друг к другу так тесно, что сопротивление двух их мембран протекающему через них электрическому току сравнимо с сопротивлением остальной, внесинаптической области мембраны. При возбуждении 1-ой клетки натриевый ток (INa) входит в нее через открытые Nа-каналы и выходит через пока невозбужденные участки мембраны; при этом часть тока входит через участок мембранного контакта во 2-ю клетку, вызывая ее деполяризацию. Разумеется, здесь уровень деполяризации гораздо ниже - скажем, в 10 раз, чем в 1-ой клетке, однако он может оказаться выше порога генерирования потенциала действия во 2-ой клетке. Часто такая деполяризация подпороговая, и тогда 2-ая клетка возбуждается только в результате суммации синаптических потенциалов, возникающих в результате химической или электрической передачи от других клеток. Итак, перечислим основные характеристики, которые отличают химическую синаптическую передачу от электрической. 1. В химическом синапсе постсинаптический ток генерируется за счет открывания каналов в постсинаптической мембране и обусловлен ионными градиентами постсинаптической клетки. 2. В электрическом синапсе источник постсинаптического тока - мембрана пресинаптической клетки. Здесь нет химического медиатора, и все факторы, влияющие на его высвобождение и действие (например, снижение внеклеточной концентрации Са2+ или устранение разрушающих медиатор ферментов), на передаче возбуждения не сказываются. Щелевые контакты. Ионы, переносящие электрические токи, не могут проходить через липидные мембраны, следовательно, для их транспорта в «мембранных контактах» между электрически сопряженными клетками необходимы канальные белки. Такие межклеточные связи называются нексусами, или «щелевыми контактами» (рис.9). В каждой из двух соседних клеточных мембран находятся регулярно распределенные через небольшие промежутки коннексоны, пронизывающие всю толщу мембраны; они расположены так, что в месте контакта клеток находятся друг против друга и их просветы оказываются на одной линии. У образованных таким образом каналов крупные диаметры и, значит, высокая проводимость для ионов: через них могут проходить даже относительно крупные молекулы с молекулярной массой до 1000 (около 1.5 нм в поперечнике). Коннексон состоит субъединиц числом до шести с молекулярной массой примерно 25000 каждая. Щелевые контакты обычны для ЦНС позвоночных и, как правило,соединяютгруппы синхронно функционирующих клеток. Такие контакты характерны также длябеспозвоночных. Функциональные синцитии. В тканях, не относящихся к нервной системе, клетки тоже очень часто соединены щелевыми контактами. Рис.9. Ультраструктура нексуса (щелевого контакта). В пре- и постсинаптической мембранах регулярно распределены «коннексоны», находящиеся точно друг против друга. Внутри них есть просвет, так что каждая пара расположенных по одной линии коннексонов образует канал, через который сообщаются две клетки. Говоря о передаче возбуждения, стоит, прежде всего, упомянуть миокард и гладкую мускулатуру, где эти контакты создают функциональный синцитий. Возбуждение здесь переходит от одной клетки к другой без заметной паузы или снижения амплитуды потенциала действия на границе. Для таких органов важна регулируемость щелевых контактов; в самом деле, их каналы закрываются при снижении рН или повышении концентрации Са2+. Это неизбежно происходит в случае повреждения клеток или глубокого нарушения обмена. За счет такого механизма пораженные места изолируются от остальной части функционального синцития, и распространение патологии ограничивается (например, при инфаркте миокарда). Кроме этих возбудимых тканей существует и много других (в частности, все эпителии, печень), где клетки также соединены щелевыми контактами. В принципе такая связь присуща любой клетке на ранних стадиях эмбрионального развития, когда все клетки соединены между собой щелевыми контактами и сохраняют их до стадии дифференцировки органов. Роль таких контактов у невозбудимых клеток неясна. Через них возможен обмен многими мелкими молекулами; не исключено, что это важно для метаболизма. Через щелевые контакты могли бы также диффундировать внутриклеточные вторые посредники, передавая по ткани сигналы, регулирующие клеточные процессы. Учитывая широкое распространение щелевых контактов, кажется удивительным, почему в нервной системе они не используются для синаптической передачи повсеместно. Видимо, сложнее организованные химические синапсы обеспечивают настолько более высокую специфичность и регулируемость межклеточной коммуникации, что в значительной степени вытеснили электрические. Тормозные электрические синапсы. Щелевой контакт наиболее распространенный тип электрического синапса. Однако существуют и другие. Например, электрическим путем может передаваться и торможение. В этом случае потенциал действия особым образом расположенных пресинаптических волокон генерирует во внеклеточном пространстве вокруг постсинаптического аксона местный положительный потенциал такой амплитуды, что деполяризация аксона не может достичь порогового уровня, и проведение по нему потенциала действия блокируется. Эфаптическая передача. При некоторых заболеваниях аксоны повреждаются. После перерезки аксона дегенерирует не только его дистальная, но и проксимальная часть. В периферической нервной системе он через несколько недель регенерирует, но его отрастающие участки сначала немиелинизированы. При невропатиях разнообразного происхождения аксоны также теряют свою миелиновую оболочку, становясь демиелинизированными. Кроме того, встречаются аксонные невропатии, главный симптом которых, вероятно, является нарушение аксонного транспорта. Демиелинизированные аксоны особенно часто вступают в аномальные взаимодействия. Импульсы, проходящие по группам нервных волокон, индуцируют возбуждение других параллельно идущих аксонов. Это называется эфаптической передачей. Когда такие аномальные потенциалы действия генерируются в сенсорных нервных волокнах, у больного появляются аномальные ощущения, парестезии. Они могут быть мучительными, особенно когда связаны с ноцицептивными(болевыми) волокнами: возникают такие неприятные синдромы, как невралгия, каузалгия, невромные боли. Межаксонные помехи бывают следствием не только недостаточной изоляции (миелиновыми оболочками), но и повышенной возбудимости аксонов. ТЕСТЫ 1-2 УРОВНЯ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ ПО ТЕМЕ: ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ПРОВЕДЕНИЯ ВОЗБУЖДЕНИЯ В НЕРВНЫХ ВОЛОКНАХ И СИНАПСАХ 1.Накопление избыточного количества ацетилхолина в нервно-мышечном синапсе приводит: А. к усилению мышечного сокращения В. к ослаблению мышечного сокращения С. мышечное сокращение станет максимальным D. мышечное сокращение не изменяется 2. При проведении возбуждения по нервному волокну величина потенциала действия: А. увеличивается В. уменьшается С. увеличивается до определенного предела D. не изменяется 3. В эксперименте на постсинаптическую мембрану нейрона подействовали веществом, которое вызвало ее гиперполяризацию. Проницаемость для каких ионов на постсинаптической мембране увеличилась в данной ситуации? А. натрия В. кальция С. магния D. калия Е. марганца 4.Физиологические свойства нервных волокон: А. возбудимость В. проводимость С.сократимость D. автоматия Е. пластичность 5. Специфическое свойство нервных волокон: А. возбудимость В. проводимость С. сократимость D. автоматия Е. пластичность 6. Механизм проведения возбуждения по безмиелиновому нервному волокну: А. непрерывный В. сальтаторный С. электротонический 7. Механизм проведения возбуждения по миелиновому нервному волокну : А. непрерывный В. сальтаторный С. электротонический 8. Скорость проведения возбуждения в безмиелиновых нервных волокнах: А. 30-100 м/с В. З-18 м/с С. 0.5 - 3 м/с D. 10-15 м/с 9. Скорость проведения возбуждения миелинизированных нервных волокнах типа А: А. 30-100 м/с В. З-18 м/с С. 0.5 - 3 м/с D. 10-15 м/с 10. Закономерности проведения возбуждения по нервным волокнам: А. изолированное проведение возбуждения В. проведение при условии физиологической целостности волокна С. двустороннее проведение возбуждения D. «все или ничего» Е. одностороннее проведение возбуждения 11. Функции миелиновой оболочки: А. изоляционная В. участие в ионном гомеостазе С. участие в обмене медиатора D. трофическая 12.Физиологические особенности нервных волокон: А. высокая утомляемость В. низкая утомляемость С. низкая лабильность D. высокая лабильность Е. имеет короткий абсолютный период F. имеет длительный абсолютно рефрактерный период 13. Сложный характер ПД нервного ствола обусловлен: A. двусторонним распространением возбуждения по нервным волокнам B. высокой лабильностью нерва C. изолированным проведением возбуждения по нервным волокнам D. практической неутомляемостью нерва E. различной скоростью проведения по нервным волокнам 14. Фермент, обеспечивающий гидролиз ацетилхолина: A. ацетилхолинэстераза: B. холинацетилтрансфераза C. КОМТ D метилтрансфераза E. МАО 15. В нервно-мышечном синапсе скелетных мышц выделяется медиатор: A. серотонин B. норадреналин C. ГАМК D. ацетилхолин E. глицин 16. Сколько раз может сократиться мышца, если раздражать нерв нервно-мышечного аппарата с частотой 247 Гц? A. 247 B. 300 C.500 D. 150 E. не будет сокращаться 17. Какова лабильность синапса? A. 150 имп/с B. 300 имп/с C. 1000 имп/с D. 500 имп/с E.50 имп/с 18. Особенности проведения возбуждения в синапсе: A. одностороннее проведение возбуждения B. двусторонне проведение возбуждения C. высокая утомляемость D. низкая утомляемость E. низкая скорость проведения возбуждения F. низкая лабилбность СИТУАЦИОННЫЕ ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ ПО ТЕМЕ: ПРОВЕДЕНИЕ ВОЗБУЖДЕНИЯ В НЕРВНЫХ ВОЛОКНАХ И СИНАПСАХ 1. Нервное волокно, помещенное в дистиллированную воду, не возбуждается при раздражении любой силы. Объясните причину. 2. Как и почему изменится скорость проведения нервных импульсов при повышении проницаемости мембраны нервного волокна для ионов калия? 3. Установлено, что новокаин увеличивает проницаемость мембран для ионов калия. Объясните, почему при действии на нервные волокна новокаина возбудимость в них снижается. 4. При одном из заболеваний нервной системы человека, называемом миастенией, каждый нервный импульс, поступающий к нервно-мышечному синапсу, вызывает выделение небольшого количества ацетилхолина. Какая закономерность нервно-мышечной передачи окажется нарушенной в результате этого явления? ___________________________________________ _________________________________ −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 3. ФИЗИОЛОГИЯ МЫШЦ −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− Функция двигательного аппарата является одной из важнейших в жизнедеятельности организма. Только передвигаясь, индивидуум может защищать свою жизнь, находить и поглощать пищу, производить потомство, обеспечивать свое существование. При помощи разнообразных движений человек осуществляет трудовую деятельность, общается с людьми, творит произведения искусства, занимается спортом. Трудовая деятельность создала мозг человека, выделила его из животного мира. И.М.Сеченов подчеркивал, что поперечнополосатая мышца «научила нервную систему работать импульсами». Все двигательные акты, происходящие в организме высшего животного (за исключением движений мерцательного эпителия и амебоидного движения лейкоцитов), происходят при участии элементов мышечной ткани. С сокращением мышц связаны не только поддержание позы, локомоция, но и теплопродукция, кровоток, большинство реакций, направленных на поддержание гомеостазиса. У позвоночных животных и человека различают поперечнополосатые (исчерченные) и гладкие (неисчерченные) мышцы. Они обладают тремя основными свойствами: 1) возбудимостью — способностью отвечать на раздражения возникновением потенциала действия (ПД); 2) проводимостью — способностью к проведению потенциала действия вдоль мышечного волокна; 3) сократимостью — способностью изменять свои длину и напряжение при возбуждении. Мышечная ткань, как и все биологические ткани, обладает растяжимостью и эластичностью. Поперечнополосатыми мышцами являются скелетные и сердечная, гладкие мышцы включены в состав стенок внутренних органов, сосудов и кожи. 3.1. СКЕЛЕТНЫЕ МЫШЦЫ Взаимодействие человека с внешней средой не может осуществляться без сокращений его мышц. Производимые при этом движения необходимы как для выполнения простейших манипуляций, так и для выражения самых тонких мыслей и чувств посредством речи, письма, с помощью мимики или жестов. Масса скелетных мышц намного больше, чем других органов; они составляют 40-50% массы тела. Мышцы - это “машины”, преобразующие химическую энергию непосредственно в механическую работу и в теплоту. Поперечнополосатые мышцы (мышцы двигательного аппарата скелета, жевательные, дыхательные, глазодвигательные мышцы и т.д.) полностью лишены автоматизма, они не способны работать без управляющей импульсации из ЦНС. Эти мышцы называют произвольной мускулатурой, так как их сокращением можно управлять произвольно, по собственному желанию. 3.1.1. Структурно-функциональная характеристика Структурной и сократительной единицей мышцы является мышечное волокно, представляющее собой сильно вытянутую многоядерную клетку. Толщина волокна — в пределах 10—100 мкм, чаще всего около 50 мкм. Длина волокна определяется размером мышцы и может составлять от нескольких миллиметров до нескольких сантиметров. У человека количество мышечных волокон устанавливается через 4—5 месяцев после рождения и затем практически не меняется. При рождении ребенка их диаметр составляет примерно 1/5 толщины волокон взрослых людей. Диаметр мышечных волокон может значительно увеличиваться под воздействием тренировки (функциональная гипертрофия). Основными структурно-функциональными элементами мышечной клетки являются: − мембранная оболочка; − саркоплазма с органоидами; − миофиламенты. Как и всякая клетка, мышечное волокно имеет мембранную оболочку — сарколемму. Мембрана мышечного волокна образована типичной плазматической мембраной, укрепленной соединительно-тканными волокнами. Эти волокна объединяясь у концов мышечных волокон образуют сухожилия, с помощью которых мышца крепится к костям. В саркоплазме (цитоплазме) мышечного волокна находится типичный набор органоидов: многочисленные ядра, митохондрии, саркоплазматический ретикулум (см. ниже), растворимые белки (миоглобин), капельки жира, гранулы гликогена, фосфатсодержащие вещества, другие малые молекулы, ионы. От одного конца мышечного волокна до другого тянется масса нитей — миофибрилл, с которыми связана способность мышцы к сокращению. Их диаметр составляет 1— 2 мкм, так что в одном мышечном волокне может насчитываться более 2000 миофибрилл. Миофибриллы группируются в пучки, по 4—20 штук в каждом. В одиночной миофибрилле насчитывается 2000—2500 протофибрилл — толстых и тонких. Они располагаются параллельно друг другу внутри мышечной клетки. Миофибриллы представляют собой сократимые пучки “нитей” (филаментов) диаметром около 1 мкм. Перегородки, называемые Z-пластинками, разделяют их на несколько компартментов – саркомеров − длиной примерно по 2,5 мкм. Структура саркомеров схематически показана на рис. С помощью светового микроскопа в них можно видеть регулярно чередующиеся поперечные светлые и темные полосы. Согласно теории Хаксли и Хансон [1954], такая поперечная полосатость миофибрилл обусловлена особым взаиморасположением актиновых и миозиновых филаментов. Середину каждого саркомера занимают несколько тысяч толстых нитей миозина диаметром примерно по 10 нм. На обоих концах саркомера находятся около 2000 тонких (толщиной по 5 нм) нитей актина, прикрепленных к Z-пластинкам наподобие щетинок в щетке. Пучок лежащих в определенном порядке миозиновых нитей длиной 1,6 мкм в середине саркомера выглядит в световом микроскопе темной полосой шириной 1,6 мкм. Из-за свойства двойного лучепреломления в поляризованном свете (т. е. анизотропии) она называется А-диском. По обе стороны от А-диска находятся изотропные участки, содержащие только тонкие нити и поэтому выглядящие светлыми; эти так называемые I-диски тянутся до Zпластинок. Рис. 10. Структура миофибрилл. Показаны диски А и I, полоски Z и Н (а). Взаимное расположение толстых (миозиновых) и тонких (актиновых) нитей в расслабленной (б) и сокращенной (в) миофибрилле. Светлые I-диски делятся пополам поперечной темной Z-линией, с обеих сторон которой крепятся тонкие (актиновые) протофибриллы. Участок между двумя соседними Z-линиями называется саркомером. Он представляет собой основную повторяющуюся структуру миофибриллы. Длина саркомера обычно лежит в пределах 2—3 мкм. Эта зона перекрывания в А-диске выглядит в световом микроскопе гораздо темнее центральной Н-зоны, в которой нет актиновых нитей. На электронных микрофотографиях Н-зоны видна очень тонкая темная Млиния в середине саркомера − сеть опорных белков, по-видимому, удерживающих толстые нити в составе единого пучка. При длине типичного мышечного волокна человека 5 см его миофибриллы насчитывают порядка 20 000 последовательно расположенных саркомеров. Миофибриллы, точнее их саркомеры, являются сократительным аппаратом, «мотором» мышечного волокна. Итак, в каждом саркомере имеется два набора тонких нитей, прикрепленных к Z-линиям, и один комплект толстых нитей, сосредоточенных в А-диске. В покоящейся мышце концы толстых и тонких филаментов лишь незначительно перекрываются на границе между Аи I-дисками. При сокращении мышцы зона перекрытия тонких и толстых филаментов увеличивается, ширина А-дисков и Н-зон уменьшается (см. рис. ). Один грамм ткани скелетной мышцы содержит около 100 мг сократительных белков. В настоящее время в основных чертах установлена тонкая структура тонких и толстых филаментов. Толстые филаменты состоят из сократительного белка миозина, а тонкие — из актина. Миозиновые филаменты образуются более чем 200 молекулами миозина (молекулярная масса 42000). Каждая из них скручена попарно и имеет выступающий отросток, называемый головкой. Головки направлены под углом от центра в сторону тонких нитей (напоминают ёрш для мытья посуды). В основании головки миозина имеется фермент АТФ-аза, а на самой головке располагаются легкие цепи и молекула АТФ. Актиновые филаменты скомпанованы из двух актиновых нитей, представляющих собой как бы бусинки глобулярных молекул актина (молекулярная масса 500000). Тонкие нити имеют активные центры, расположенные друг от друга на расстоянии 40 нм, к которым могут прикрепляться головки миозина. Кроме актина в тонких нитях имеются и другие белки − тропомиозин, тропонины (I,T,C). Тропомиозин и тропонин образуют регуляторный белковый комплекс, который в невозбужденной мышце блокирует взаимодействие между актином и миозином. В результате невозбужденная мышца расслаблена. Блокирующая роль тропонина снимается ионами кальция (Са2+), поступающими к сократительным белкам при возбуждении. В поперечном сечении толстые и тонкие филаменты расположены правильными шестиугольниками так, что каждая толстая нить окружена шестью тонкими, а каждая тонкая может вступать в контакт с тремя толстыми. Система микротрубочек скелетной мышцы представляет собой сложный биокомплекс. Во многих участках поверхностная мембрана мышечной клетки образует углубления в виде Т-трубочек (диаметром 50 нм), перпендикулярных продольной оси волокна; эта система поперечных трубочек соединяется с внеклеточной средой и обычно окружает каждую миофибриллу в области I-дисков (у высших позвоночных ). Перпендикулярно поперечным трубочкам, т.е. параллельно миофибриллам, расположена система продольных трубочек (истинный саркоплазматический ретикулум). Пузырьки на их концах (терминальные цистерны) прилегают к мембранам ситемы поперечных трубочек, образуя так называемые триады. В этих пузырьках и хранится внутриклеточный кальций. В отличие от поперечной системы продольная не сообщается с внеклеточной средой. Саркоплазматический ретикулум выполняет важную функцию в инициации сокращения мышцы, являясь депо Са2+. Мембраны саркоплазматического ретикулума содержат работающий на энергии АТФ кальциевый насос, который осуществляет активный транспорт Са2+ из миоплазмы в продольные трубочки, снижая таким образом примерно до 10-7 М миоплазматическую концентрацию этих ионов в покоящейся (расслабленной) мышце. 3.1.2. Механизм сокращения мышцы Механизм мышечного сокращения на молекулярном уровне объясняет теория скользящих нитей, разработанная Хаксли и Хансон (1954). При электронной микроскопии обнаружено, что на миозиновых нитях имеются выступы, получившие название поперечных мостиков. Поперечные мостики, состоящие из головки и шейки, протянувшиеся от миозиновых нитей, в спокойном состоянии не могут соединиться с актиновыми нитями из-за особого расположения тропомиозина, закрывающего активные центры актина и препятствующего их взаимодействию с поперечными мостиками миозина. Тропонин подавляет миозин-АТФазную активность, что делает невозможным расщепление АТФ, в результате мышечные волокна пребывают в расслабленном состоянии (рис.11). Рис.11. Действие Са2+ во время активации миофибриллы. А. Актиновая и миозиновая нити на продольном сечении волокна. Б. Они же на поперечном сечении. Когда Са 2+ связывается с тропонином, тропомиозин попадает в желобок между двумя мономерами актина, обнажая участки прикрепления поперечных мостиков (по Haxley, 1973 c изменениями Р.Шмидта и Г. Тевса, 1995). Сокращение скелетной мышцы волокон начинается с приходом нервного импульса к сарколемме, который приводит к формированию ПД. Возникающий ПД распространяется по поверхностной мембране, а также по мембранам, выстилающим поперечные трубочки Тсистемы. Проникая внутрь волокна, электрическая волна приводит к деполяризации мембран продольных трубочек и цистерн саркоплазматического ретикулума. Деполяризация мембраны цистерн открывает электровозбудимые кальциевые каналы. В связи с тем, что в саркоплазме концентрация кальция менее 10-7 М/л, а в саркоплазматическом ретикулуме − более 10-4 М/л, начинается интенсивный выход ионов кальция в саркоплазму. Выделившийся свободный Са2+ и является инициатором мышечного сокращения. Достаточный для начала мышечного сокращения уровень ионов кальция достигается через 12-15 мс после прихода нервного импульса. Это скрытый, латентный период мышечного сокращения. В связи с тем, что скорость распространения ПД по сарколемме выше времени, необходимого для выделения Са2+из саркоплазматического ретикулума, то все фибриллы участка мышцы, иннервируемого одним нервом, сокращаются одновременно. Совокупность явлений, обусловливающих связь между возбуждением (потенциалом действия) и сокращением мышечных волокон, получила название «электромеханического сопряжения», или «электромеханической связи». Рис. 12. Взаимоотношения клеточной мембраны (1), поперечных трубочек (2), боковых цистерн (3) и продольных трубочек (4) саркоплазматического ретикулума, миозиновых и актиновых нитей (5) мышечного волокна. А—в состоянии покоя; Б—во время сокращения. Деполяризация мембраны и поперечных трубочек вызвала освобождение ионов Са 2+ из боковых цистерн. Освободившиеся ионы Са2+ диффундируют по направлению к миофибриллам и частично захватываются продольными трубочками ретикулума. Механизм инициации сократительного процесса представляется в настоящее время следующим образом. В присутствии ионов Са2+, а также АТФ тропонин изменяет свою конфигурацию и отодвигает нить тропомиозина, открывая возможность соединения головки поперечного мостика миозина с актином (см. рис.11). Соединение головки фосфорилированного миозина с актином приводит к тому, что головка приобретает АТФазную активность, в ней происходит гидролиз АТФ, сопровождаемый изменением пространственной ориентации. Последнее носит форму гребкового движения, обеспечивающего втягивание тонких актиновых миофиламентов в промежутки между толстыми миозиновыми миофиламентами на один шаг (примерно 20 нм) без изменения длины миофиламентов. После этого, образующиеся Ф и АДФ, отходят, а на их место присоединяется новая молекула АТФ. Это приводит к разрыву связи миозина с активным центром актина. Затем следуют отрыв мостика и повторение всего цикла. При каждом гребковом движении головки поперечного мостика расщепляется одна молекула АТФ. Скорость расщепления АТФ является фактором, предопределяющим частоту гребковых движений и, таким образом, скорость скольжения нитей актина относительно нитей миозина. Целая мышца укорачивается в результате сокращения множества саркомеров, соединенных последовательно в миофибриллах (рис. 12). Обнаружено, что при сокращении скелетной мышцы лягушки поперечные мостики должны совершить за 0,1 с 50 гребковых движений, чтобы обеспечить укорочение каждого саркомера волокна на 50 %. Таким образом, при сокращении мышцы: − актиновые и миозиновые нити практически не укорачиваются; − взаимодействие актина с миозином приводит к взаимному вхождению нитей в промежутки между ними; − в результате две соседние Z-мембраны приближаются друг к другу и при максимально сильном сокращении расстояние между ними может уменьшиться почти в два раза; − так как заключенная внутри саркомера саркоплазма несжимаема, то при уменьшении длины саркомер (мышца) расширяется; − подобные процессы одновременно протекают во всех саркомерах мышечного волокна, поэтому оба конца мышцы подтягиваются к центру. Расслабление мышцы. Гребковые движения («шаги») поперечных мостиков будут повторяться до тех пор, пока в саркоплазме есть свободный Са2+ (в концентрации более 10-5) и АТФ. Если нет новой волны деполяризации, то кальций быстро убирается обратно в цистерны саркоплазматического ретикулума. Работа насоса активируется самим кальцием, вернее возрастанием его концентрации в саркоплазме. Работа насоса требует затраты большого количества АТФ: для удаления каждого иона кальция используется 2 молекулы АТФ. Результатом откачивания кальция из саркоплазмы является разрыв всех связей актина и миозина и расслабление мышцы. В целом последовательность событий в цикле сокращение—расслабление мышечного волокна представляется в следующем виде: — поступление ПД по нервному волокну к мионевральному синапсу; — синаптическая активация мышечного волокна; — возникновение ПД, проведение его вдоль клеточной мембраны и в глубь волокна по Т-трубочкам; — освобождение ионов Са2+ из боковых цистерн саркоплазматического ретикулума, диффузия его к миофибриллам; — конформация тропонин-тропомиозинового комплекса; — контакт поперечных мостиков миозина с актином; — освобождение энергии АТФ; — скольжение актиновых и миозиновых нитей, выражающееся в укорочении миофибриллы; — активация кальциевого насоса; — снижение концентрации свободных ионов Са2+ в саркоплазме; — расслабление миофибрилл. 3.1.3. Энергетика мышцы. Тепловые явления, сопровождающие мышечное сокращение Значение АТФ в мышечном сокращении впервые выявили В.А.Энгельгардт и М.Н.Любимова, которые в 1939 г. обнаружили, что мышечный белок миозин обладает свойствами фермента АТФазы. Эти же авторы показали, что под воздействием АТФ меняются и механические свойства миозина: увеличивается растяжимость его нитей. В последующие годы был открыт белок актин, который, как оказалось, активирует АТФазную активность миозина. АТФаза миозина активируется актином в присутствии Мg2+. Следовательно, при физиологическом ионном составе среды, т.е. в присутствии Мg2+, АТФ расщепляется, высвобождая АДФ и фосфат, только в случае прикрепления головки миозина к активирующему белку - актину. (В отсутствие актина, образующийся АДФ не высвобождается, а блокирует на несколько секунд каталитический центр миозина и, таким образом, дальнейшее расщепление АТФ). В каждом цикле прикрепления-отделения поперечного мостика АТФ расщепляется только один раз (вероятно, одна молекула на каждый мостик). Следовательно, чем больше мостиков находится в активном состоянии, тем выше скорость расщепления АТФ и сила, развиваемая мышцей; значит, эта скорость (интенсивность метаболизма), как правило, пропорциональна силе, развиваемой мышцей. Скорость мышечного сокращения тем выше, чем быстрее движутся поперечные мостики, т.е. чем больше “гребков” они совершают в единицу времени. В результате быстрые мышцы потребляют в единицу времени больше и сохраняют при тоническом напряжении меньше АТФ (энергии), чем медленные. Поэтому для поддержания позы используются преимущественно медленные мышечные волокна , богатые миоглобином, а для быстрых движений - бедные им “белые” или светлые волокна. Механизм, с помощью которого донор энергии − молекула АТФ − обеспечивает перемещение поперечного мостика, интенсивно изучается. По-видимому, АТФ связывается с поперечным мостиком после завершения “гребка”, давая энергию для разделения взаимодействующих сократительных белков − актина и миозина. Почти сразу же после этого миозиновые головки отделяются от актина, а АТФ расщепляется до АДФ и фосфата. Продукты гидролиза остаются на короткое время связанными с каталитическим центром, что необходимо для нового присоединения поперечного мостика к актину и следующего генерирующего силу “гребка”, во время которого происходит высвобождение АДФ и фосфата. Затем до отделения поперечного мостика с ним должна связаться новая молекула АТФ и начинается новый цикл. Ритмичная активность поперечных мостиков т. е. циклы их прикрепления к актину и отсоединения от него, обеспечивающие мышечное сокращение, возможны только при гидролизе АТФ, а значит, при активации АТФазы. Если расщепление АТФ блокировано, мостики не могут прикрепляться к актину, сопротивление растяжению и сила мышечных волокон падают до нуля и мышца расслабляется. При гибели организма содержание АТФ в клетках снижается; когда оно переходит критический уровень, поперечные мостики остаются устойчиво прикрепленными к актиновой нити. При этом мышца находится в состоянии трупного окоченения (rigог mortis) − спастического сокращения мышц. Лишь после нарушения целостности лизосом и поступления в саркоплазму их ферментов, вызывающих лизис белков, окоченение постепенно проходит. Таким образом, энергия АТФ в скелетной мышце используется для следующих процессов: 1) работы натрий-калиевого насоса, обеспечивающего поддержание постоянства градиента концентрации ионов по обе стороны мембраны; 2) образования мостиков − процесса скольжения актиновых и миозиновых нитей, приводящих к укорочению миофибрилл (сокращения); 3) разрыва мостиков (расслабления); 4) работы кальциевого насоса, активируемого при расслаблении волокна. Во время активации мышцы повышение внутриклеточной концентрации Са2+ ведет к сокращению и к усиленному расщеплению АТФ; при этом интенсивность метаболизма мышцы возрастает в 100-1000 раз. Согласно первому началу термодинамики (закону сохранения энергии), химическая энергия, высвобождаемая в мышце, должна быть равна сумме механической энергии (мышечной работы) и теплообразования. Даже в отсутствие физически измеримой работы (например, во время устойчивого изометрического тетануса) происходит непрерывное преобразование химической энергии в тепловую (теплота изометрического сокращения) со скоростью, пропорциональной длительности тетануса и развиваемому напряжению. Даже изометрическое сокращение сопровождается непрерывной циклической активностью поперечных миозиновых мостиков, и “внутренняя” работа, связанная с расщеплением АТФ и теплообразованием, при этом значительна. Недаром даже такая “пассивная деятельность”, как “стойка смирно”, утомительна. Когда мышца поднимает груз, совершая “внешнюю” работу, расщепляется дополнительное количество АТФ. При этом усиление интенсивности метаболизма пропорционально выполненной работе (эффект Фенна). Коэффициент полезного действия. Гидролиз одного моля АТФ дает примерно 48 кДж энергии. Однако лишь около 40-50% ее превращается в механическую энергию работы, а остальные 50-60% рассеиваются в виде тепла при запуске (начальная теплота) и во время сокращения мышцы, температура которой при этом несколько повышается. Таким образом, к.п.д. элементарного преобразования АТФ в миофибриллах составляет примерно 40-50%. Однако в естественных условиях механический к.п.д. мышц обычно гораздо ниже - около 2030%, так как во время сокращения и после него процессы, требующие затрат энергии, идут и вне миофибрилл. Эти процессы, например работа ионных насосов и окислительная регенерация АТФ, сопровождаются значительным теплообразованием (теплота восстановления). Чем больше совершенная работа, тем больше образуется тепла и расходуется энергоресурсов (углеводов и жиров) и кислорода. Такая закономерность, кстати, объясняет усталость, усиленное потоотделение и одышку при подъеме в гору, но не при спуске. Энергетический метаболизм. Во время продолжительной равномерной мышечной активности происходит аэробная регенерация АТФ, главным образом за счет окислительного фосфорилирования. Необходимая для этого энергия выделяется в результате окисления углеводов или жиров. Вся система находится в состоянии динамического равновесия, при котором скорости образования и расщепления АТФ равны, так что внутриклеточные концентрации АТФ ( = 5 мМ ) и креатинфосфата ( = 30 мМ ) постоянны. При продолжительных спортивных нагрузках скорость расщепления АТФ в мышцах, от которой непосредственно зависит их мощность, часто в 100 или даже в 1000 раз больше, чем в состоянии покоя. Устойчивое состояние, а следовательно, и продолжительная нагрузка возможны, только если скорость ресинтеза АТФ в результате окислительного фосфорилирования возрастает параллельно его расходу. При этом потребление О2 мышечной тканью увеличивается в 50-100 раз по сравнению с состоянием покоя, потому что для образования 1 моля АТФ требуется примерно 1/6 моля О2. Соответственно повышается и скорость расщепления гликогена в мышце. Интенсивность ее работы может ограничиваться активностью митохондриальных ферментов, определяющей скорость окислительного расщепления глюкозы; эта активность достигает предела, на пример во время бега хорошо тренированного стайера со скоростью 6 м/с. Предел, характерный для продолжительной работы, может быть превзойден при кратковременном усилии (например, при финальном спурте во время соревнований по бегу) за счет расщепления дополнительного количества гликогена анаэробным путем, т.е. посредством гликолиза. При этом АТФ образуется в 2-3 раза быстрее, а механическая энергия мышцы в 2-3 раза выше, чем при длительной работе, обеспечиваемой аэробными механизмами. Спринтер может бежать почти вдвое быстрее(10 м/с) стайера. Предельное время для такой повышенной нагрузки составляет примерно 30с из-за ограниченности ресурсов анаэробного метаболизма, необходимых для поддержания высокой скорости образования АТФ, а также вследствие накопления в клетке и крови молочной кислоты, образующейся при гидролизе АТФ. В конечном итоге развивается метаболический ацидоз, ограничивающий работоспособность и вызывающий утомление. Применение метода ядерного магнитного резонанса (ЯМРспектроскопии) теперь позволяет проследить in situ за вязанными с утомлением изменениями внутриклеточного рН и накоплением таких метаболитов, как фосфат и АДФ в сердечной и скелетной мускулатуре. Анаэробные процессы необходимы для обеспечения энергией не только кратковременного экстремального усилия, но и в начале продолжительной мышечной работы, потому что адаптация скорости окисления (и гликолиза) к возросшей нагрузке требует некоторого времени. Равновесное состояние, когда путем окислительного фосфорилирования в единицу времени образуется столько же АТФ, сколько расщепляется АТФазой, наступает только через 0,5-2 мин (“второе дыхание”). До достижения этого динамического равновесия АТФ ресинтезируется по реакции Ломана из АДФ и креатинфосфата со скоростью, позволяющей поддерживать внутриклеточный уровень АТФ практически постоянным: АДФ + креатинфосфат = АТФ + креатин В результате внутриклеточный уровень креатинфосфата падает до тех пор, пока скорость аэробного образования АТФ не вырастет настолько, что будет удовлетворять текущие потребности мышцы. Запас креатинфосфата обычно не пополняется до тех пор, пока не закончится сокращение и реакция Ломана не пойдет в обратном направлении; в первые минуты покоя, требуемый для этого АТФ, обеспечивается окислительным фосфорилированием, т. е. реакциями с потреблением О2. В результате покрывается кислородная задолженность (кислородный долг), которая приблизительно соответствует количеству энергии, полученному анаэробным путем в начале или во время работы мышцы и еще не компенсированному за счет аэробного синтеза АТФ. Кислородная задолженность, целиком обусловленная (анаэробным) гидролизом креатинфосфата, может достигать 4 л; образование энергии путем гликолиза во время предельного физического усилия способно увеличить ее до 20 л, поскольку для удаления образовавшейся и поступившей в кровь (до 1,5 г/л) молочной кислоты необходим О2. Часть лактата окисляется в миокарде, а некоторое его количество (преимущественно в печени) используется для синтеза гликогена. Таким образом, для активной деятельности мышцы необходим постоянный ресинтез АТФ. Запас АТФ в скелетных мышцах невелик — всего примерно на 10 одиночных сокращений. Необходимый постоянный ресинтез АТФ осуществляется тремя путями. 1. Ресинтез АТФ за счет ферментативного переноса фосфатной группы от богатого энергией креатинфосфата на аденозиндифосфорную кислоту. Этот эффективный путь позволяет за несколько секунд совершить большую работу, которая выполняется, например, спринтером или штангистом. В случае интенсивной мышечной работы запасы креатинфосфата быстро истощаются и реализуются другие, более медленные способы пополнения АТФ. 2. Гликолитический путь, связанный с анаэробным расщеплением глюкозы до молочной кислоты. В результате образуются 2 молекулы АТФ на 1 молекулу глюкозы. Этот способ ресинтеза АТФ идет быстро, но накапливающаяся молочная кислота тормозит активность гликолитических ферментов. Этот вид энергопродукции используется при больших, но непродолжительных нагрузках, например при беге на средние дистанции, и способствует сдвигам кровообращения в работающей мышце для обеспечения адекватного хода третьего типа ресинтеза АТФ. 3. Аэробное окисление глюкозы и жирных кислот в цикле Кребса, совершаемое в митохондриях. При этом экономичном процессе из 1 молекулы глюкозы образуется около 38 молекул АТФ, а при окислении 1 молекулы жирной кислоты — около 128 молекул АТФ. Для получения энергии таким способом требуется больше времени, чем при первых двух способах, поэтому 3-й путь ресинтеза АТФ используется во всех случаях, когда мощность сократительной активности мышцы невысокая. Отметим, что аэробное окисление глюкозы и жирных кислот (запасы свободной глюкозы, гликогена и жиров в мышцах достаточно велики) — наиболее типичный способ энергообеспечения скелетных мышц. Однако при длительной работе в организме накапливаются недоокисленные продукты (молочная кислота и др.). Создается кислородная задолженность. Такой долг погашается после работы за счет компенсатор-ной мобилизации кровообращения и дыхания (тахикардия, повышение кровяного давления, одышка). Если же работа, несмотря на наличие кислородного долга, продолжается, наступает выраженное состояние утомления, которое иногда прекращается за счет мобилизации дополнительных резервов кровообращения и дыхания («второе дыхание» спортсменов). Максимальная мощность путей ресинтеза АТФ: − фосфагенный (с помощью креатинфосфата) − 3,6 моль АТФ/мин; − гликолитический − 1,2 моль АТФ/мин; − окислительный − при окислении глюкозы − 0,8, жиров − 0,4 моль АТФ/мин. 3.1.4. Биомеханика мышц 3.1.4.1. Типы и режимы мышечных сокращений − В зависимости от условий, в которых происходит мышечное сокращение, различают два его основных типа — изотоническое и изометрическое. Сокращение мышцы, при котором ее волокна укорачиваются, но напряжение остается постоянным, называется изотоническим. Изометрическим является такое сокращение, при котором мышца укоротиться не может, если оба ее конца закреплены неподвижно. В этом случае по мере развития сократительного процесса напряжение возрастает, а длина мышечных волокон остается неизменной. В натуральных двигательных актах сокращения мышц смешанные: даже поднимая постоянный груз, мышца не только укорачивается, но и изменяет свое напряжение вследствие реальной нагрузки. Такое сокращение называется ауксотоническим. − В зависимости от частоты стимуляции выделяют одиночные и тетанические сокращения. Одиночное сокращение (напряжение) возникает при действии на мышцу одиночного электрического или нервного импульса. Волна возбуждения возникает в месте приложения электродов для прямого раздражения мышцы или в области нервно-мышечного соединения и отсюда распространяется вдоль всего мышечного волокна. В изотоническом режиме одиночное сокращение икроножной мышцы лягушки начинается через короткий скрытый (латентный) период — до 0,01 с, далее следуют фаза подъема (фаза укорочения) — 0,05 с и фаза спада (фаза расслабления) — 0,05—0,06 с. Обычно мышца укорачивается на 5—10 % от исходной длины. Как известно, продолжительность волны возбуждения (ПД) мышечных волокон варьирует, составляя величину порядка 1—10 мс (с учетом замедления фазы реполяризации в ее конце). Таким образом, длительность одиночного сокращения мышечного волокна, наступающего вслед за его возбуждением, во много раз превышает продолжительность ПД. Мышечное волокно реагирует на раздражение по правилу «все или ничего», т.е. отвечает на все надпороговые раздражения стандартным ПД и стандартным одиночным сокращением. Однако сокращение целой мышцы при ее прямом раздражении находится в большой зависимости от силы стимуляции. Это связано с различной возбудимостью мышечных волокон и разным расстоянием их от раздражающих электродов, что ведет к неодинаковому количеству активированных мышечных волокон. При пороговой силе стимула сокращение мышцы едва заметно, потому что в реакцию вовлекается лишь небольшое количество волокон. При увеличении силы раздражения число возбужденных волокон растет, пока все волокна не окажутся сокращенными, и тогда достигается максимальное сокращение мышцы. Дальнейшее усиление стимулов прироста амплитуды сокращения не вызывает. В естественных условиях мышечные волокна работают в режиме одиночных сокращений только при относительно низкой частоте импульсации мотонейронов, когда интервалы между последовательными ПД мотонейронов превышают длительность одиночного сокращения иннервируемых ими мышечных волокон. Еще до прихода следующего импульса от мотонейронов мышечные волокна успевают полностью расслабиться. Новое сокращение возникает после полного расслабления мышечных волокон. Такой режим работы обусловливает незначительную утомляемость мышечных волокон. При этом ими развивается относительно небольшое напряжение. Тетаническое сокращение — это длительное слитное сокращение скелетных мышц. В его основе лежит явление суммации одиночных мышечных сокращений. При нанесении на мышечное волокно или целую мышцу двух быстро следующих друг за другом раздражении возникающее сокращение будет иметь большую амплитуду. Сократительные эффекты, вызванные первым и вторым раздражениями, как бы складываются, происходит суммация, или суперпозиция, сокращений, поскольку нити актина и миозина дополнительно скользят друг относительно друга. При этом в сокращение могут вовлекаться ранее не сокращавшиеся мышечные волокна, если первый стимул вызвал у них подпороговую деполяризацию, а второй увеличивает ее до критической величины. При получении суммации в одиночном волокне важно, чтобы второе раздражение наносилось после исчезновения ПД, т.е. после рефрактерного периода. Естественно, что суперпозиция сокращений наблюдается и при стимуляции моторного нерва, когда интервал между раздражениями короче всей длительности сократительного ответа, в результате чего и происходит слияние сокращений. При сравнительно низких частотах наступает зубчатый тетанус, при большой частоте — гладкий тетанус (рис. 13). Рис. 13. Сокращения икроножной мышцы лягушки при увеличении частоты раздражения седалищного нерва. Суперпозиция волн сокращения и образование разных видов тетануса. а — одиночное сокращение (Г = 1 Гц); б, в — зубчатый тетанус (Г= 15—20 Гц); г, д — гладкий тетанус и оптимум (Г = 25—60 Гц); е — пессимум — расслабление мышцы во время раздражения (Г= 120 Гц). Их амплитуда больше величины максимального одиночного сокращения. Напряжение, развиваемое мышечными волокнами при гладком тетанусе, обычно в 2—4 раза больше, чем при одиночном сокращении. Режим тетанического сокращения мышечных волокон в отличие от режима одиночных сокращений быстрее вызывает их утомление и поэтому не может поддерживаться длительное время. Из-за укорочения или полного отсутствия фазы расслабления мышечные волокна не успевают восстановить энергетические ресурсы, израсходованные в фазе укорочения. Сокращение мышечных волокон при тетаническом режиме с энергетической точки зрения происходит «в долг». До сих пор нет общепризнанной теории, объясняющей, почему напряжение, развиваемое при тетанусе, или суперпозиции сокращений, гораздо больше, чем при одиночном сокращении. Во время кратковременной активации мышцы вначале одиночного сокращения в поперечных мостиках между нитями актина и миозина возникает упругое напряжение. Однако недавно было показано, что такой активации недостаточно для прикрепления всех мостиков. Когда она более длительная, обеспечиваемая ритмической стимуляцией (например, при тетанусе), их прикрепляется больше. Количество поперечных мостиков, связывающих актиновые и миозиновые филаменты (а, следовательно, и развиваемая мышцей сила), согласно теории скользящих нитей, зависит от степени перекрывания толстых и тонких нитей, а значит, и от длины саркомера или мышцы. Высвобождение Са2+ при тетанусе. Если стимулы поступают с высокой частотой (не менее 20 Гц), уровень Са2+ в интервалах между ними остается высоким, потому что кальциевый насос не успевает вернуть все ионы в продольную систему саркоплазматического ретикулума. В таких условиях отдельные сокращения почти полностью сливаются. Это состояние устойчивого сокращения, или тетанус, наблюдается в том случае, когда промежутки между стимулами (или потенциалами действия в клеточной мембране) меньше примерно 1/3 длительности каждого из одиночных сокращений. Следовательно, частота стимуляции, необходимая для их слияния, тем ниже, чем больше их длительность; по этой причине она зависит от температуры. Минимальный промежуток времени между последовательными эффективными стимулами во время тетануса не может быть меньше рефрактерного периода, который приблизительно соответствует длительности потенциала действия. Как выяснилось, амплитуда гладкого тетануса колеблется в широких пределах в зави-\ симости от частоты стимуляции нерва. При некоторой оптимальной (достаточно высокой) частоте стимуляции амплитуда гладкого тетануса становится наибольшей. Такой гладкий тетанус получил название оптимума. При дальнейшем повышении частоты стимуляции нерва развивается блок проведения возбуждения в нервномышечных синапсах, приводящий к расслаблению мышцы в ходе стимуляции нерва — пессимум Введенского. Частота стимуляции нерва, при которой наблюдается пессимум, получила название пессимальной (см. рис. 6.4). В эксперименте легко обнаруживается, что уменьшенная в ходе пессимальной ритмической стимуляции нерва амплитуда мышечного сокращения моментально возрастает при возвращении частоты раздражения от пессимальной к оптимальной. В этом наблюдении — хорошее доказательство того, что пессимальное расслабление мышцы не является следствием утомления, истощения энергоемких соединений, а является следствием особых соотношений, складывающихся на уровне пост- и пресинаптических структур нервно-мышечного синапса. Пессимум Введенского можно получить и при прямом, но более частом раздражении мышцы (около 200 имп/с). Контрактура. Контрактурой называется состояние обратимого местного устойчивого сокращения. Оно отличается от тетануса отсутствием распространяющегося потенциала действия. При этом может наблюдаться длительная локальная деполяризация мышечной мембраны, например при калиевой контрактуре, или же мембранный потенциал, близкий к уровню покоя, в частности при кофеиновой контрактуре. Кофеин при нефизиологически высоких (миллимолярных) концентрациях проникает в мышечные волокна и, не вызывая возбуждения мембраны, способствует высвобождению Са2+ из саркоплазматического ретикулума; в результате развивается контрактура. При калиевой контрактуре степень стойкой деполяризации и сократительного напряжения волокна зависит от концентрации К+ в наружном растворе. 3.1.4.2. Сила мышцы, ее работа и мощность Благодаря упругости поперечных мостиков саркомер может развивать силу даже без скольжения нитей относительно друг друга, т. е. в строго изометрических экспериментальных условиях. Рис.14.Б иллюстрирует такой процесс генерирования изометрической силы. Сначала головка миозиновой молекулы (поперечный мостик) прикрепляется к актиновой нити под прямым углом. Затем она наклоняется под углом примерно 45°, возможно, благодаря притяжению между соседними точками прикрепления на ней и на актиновой нити. При этом головка действует как миниатюрный рычаг, приводя внутреннюю упругую структуру поперечного мостика (видимо, “шейки” между головкой и миозиновой нитью) в напряженное состояние. Возникающее в результате упругое растяжение достигает лишь около 10 нм. Упругое натяжение, создаваемое индивидуальным поперечным мостиком, так слабо, что для развития мышечной силы, Рис. 14. Функция поперечных мостиков. А. Модель механизма сокращения: миозиновая нить с поперечными мостиками, прикрепленными к соседним актиновым нитям; вверху - до, внизу - после “гребка” мостиков (на самом деле они функционируют асинхронно). Б. Модель Хаксли [1974] механизма генерирования силы поперечными мостиками; слева - до, справа после” гребка”. Поперечные мостики химически соответствуют субфрагменту миозина - “тяжелому меромиозину”, который состоит из субфрагментов I (головка) и II (шейка) равной 1 мН, нужно объединить усилия по крайней мере миллиарда таких соединенных параллельно мостиков. Они будут тянуть соседние актиновые нити, каккоманда игроков тянет канат. Даже при изометрическом сокращении поперечные мостики не находятся в непрерывно напряженном состоянии (это наблюдается только при трупном окоченении ). На самом деле каждая миозиновая головка уже через сотые или десятые доли секунды отделяется от актиновой нити; однако через такое же короткое время следует новое прикрепление к ней. Несмотря на ритмичное чередование прикреплений и отделений с частотой порядка5-50 Гц, сила, развиваемая мышцей в физиологических условиях, остается неизменной, так как статистически в каждый момент времени в прикрепленном, обусловливающем напряжение, состоянии находится одно и то же количество мостиков. Мышца, поддерживающая определенное сократительное напряжение в изометрических условиях, отличается от сокращающейся изотонически тем, что не выполняет внешней работы (произведение силы на расстояние равно нулю). Однако в каждом цикле прикрепленияотделения поперечных мостиков совершается внутренняя работа по растяжению их упругих структур, которая преобразуется в тепло в момент отсоединения миозиновых головок. Теплота изометрического сокращения (“изометрическая работа”) за единицу времени возрастает с увеличением количества функционирующих поперечных мостиков и частоты “гребков”, требующих расхода АТФ. Степень укорочения (величина сокращения) мышцы зависит от ее морфологических свойств и функционального состояния. В разных мышцах тела соотношение между числом медленных и быстрых мышечных волокон неодинаково и очень сильно отличается у разных людей, в разные периоды жизни. При старении человека быстрые волокна в мышцах истончаются (гипотрофируются) быстрее, чем медленные волокна, быстрее уменьшается их число. Это связывается со снижением физической активности пожилых людей, с уменьшением физических нагрузок большой интенсивности, при которых требуется активное участие быстрых мышечных волокон. Мышечная сила при прочих равных условиях определяется обычно поперечным сечением мышцы. Сила, развиваемая мышцей или пучком мышечных волокон, соответствует сумме сил отдельных волокон. Чем толще мышца и больше “физиологическая” площадь ее поперечного сечения (сумма площадей поперечных сечений отдельных волокон), тем она сильнее. Например, при мышечной гипертрофии ее сила и толщина волокон возрастают в одинаковой степени. В пересчете на единицу площади поперечного сечения (1см2) поперечнополосатые мышцы млекопитающих обычно развивают максимальную силу – более 40 Н, тогда как мышцы лягушки - лишь около 30 Н. В некоторых мышцах (например, портняжной) все волокна параллельны длинной оси мышцы — параллельно-волокнистый тип. В других (их большинство) — перистого типа — волокна расположены косо, прикрепляясь с одной стороны к центральному сухожильному тяжу, а с другой — к наружному сухожильному футляру. Поперечное сечение этих мышц существенно различается. Физиологическое поперечное сечение, т.е. сумма поперечных сечений всех волокон, совпадает с геометрическим только в мышцах с продольно расположенными волокнами, у мышц с косым расположением волокон. Первое может значительно превосходить второе. «Общая» сила мышцы − определяется максимальным напряжением в килограммах, которое она может развить. Чем больше физиологическое поперечное сечение мышцы, тем больше груз, который она в состоянии поднять. По этой причине сила мышцы с косо расположенными волокнами больше силы, развиваемой мышцей той же толщины, но с продольным расположением волокон. Для сравнения силы разных мышц используется понятие «удельная сила мышцы». Удельная сила мышц − это максимальный груз, который они в состоянии поднять, делённый на площадь их физиологического поперечного сечения [кг/см2]. Вычисленная таким образом сила (в килограммах на 1 см2) для трехглавой мышцы плеча человека — 16,8, двуглавой мышцы плеча — 11,4, сгибателя плеча — 8,1, икроножной мышцы — 5,9, гладких мышц — 1. Величина сокращения мышцы при данной силе раздражения зависит от ее функционального состояния. Так, если в результате длительной работы развивается утомление мышцы, то величина ее сокращения снижается. Характерно, что при умеренном растяжении мышцы ее сократительный эффект увеличивается, но при сильном растяжении уменьшается. Справедливость этих закономерностей можно продемонстрировать в опыте с дозированным растяжением мышцы и легко объяснить разным числом актомиозиновых мостиков, формирующихся при различной степени растяжения мышечного волокна и соответственно перекрытия толстых и тонких нитей (рис. 15). Оказывается, если мышца перерастянута так, что тонкие и толстые нити ее саркомеров не перекрываются, то общая сила мышцы равна нулю. По мере приближения к натуральной длине покоя, при которой все головки миозиновых нитей способны контактировать с актиновыми нитями, сила мышечного сокращения вырастает до максимума. Однако при дальнейшем уменьшении длины мышечных волокон из-за «заползания» тонких нитей в соседние саркомеры и уменьшения возможной зоны контакта нитей актина и миозина сила мышцы снова уменьшается. Подсчитано, что одиночное мышечное волокно способно развить напряжение 100-200 мг. Рис. 15. Зависимость силы сокращения мышечного волокна от степени его растяжения, изменяющего взаимоотношения актиновых и миозиновых миофиламентов. На абсциссе — длина саркомеров, на ординате — степень укорочения (%) от исходной длины волокон в состоянии покоя при длине саркомера 2,2 мкм. Мышечная сила зависит не только от активирующего влияния центральной нервной системы, но и в очень высокой степени от внешних механических условий работы мышцы. Ауксотоническое и изометрическое сокращения. В организме человека скелетные мышцы передают силу частям скелета посредством упругих, отчасти растяжимых структур сухожилий. Во время развития силы у мышцы есть тенденция укоротиться, а, следовательно, − растянуть и напрячь упругие структуры, прикрепляющие ее к скелету. Мышечное сокращение, при котором длина мышцы уменьшается по мере увеличения развиваемой ею силы, называется ауксотоническим. Максимальная сила при ауксотонических экспериментальных условиях (с растяжимой упругой связью между мышцей и датчиком силы) называется максимумом ауксотонического сокращения. Она гораздо меньше силы, развиваемой мышцей при постоянной длине, т.е. при изометритрическом сокращении. Для его экспериментального исследования мышцу в расслабленном состоянии (в покое) закрепляют с обоих концов, чтобы во время активации и измерения напряжения она не могла укорачиваться. Однако даже в этих условиях сократительные элементы мышечных волокон (миозиновые головки) передают силу сухожилиям или регистрирующему устройству только через упругие внутримышечные структуры. Они входят в состав поперечных мостиков, актиновых нитей, Ζ-пластинок и сухожильно-мышечных соединений. Упрощенно мышцу можно представить как систему сократительных (СЭ) и упругих (УЭ) элементов, последовательно соединенных друг с другом. Во время активации СЭ укорачиваются (ауксотонически) примерно на 1%, растягивая последовательно соединенные с ними УЭ; измеряется именно сила этого растяжения. Работа мышцы измеряется произведением поднятого груза на величину ее укорочения. Зависимость мышечной работы от нагрузки подчиняется закону средних нагрузок. Соотношение между величиной нагрузки и величиной работы мышцы легко выявляется в эксперименте. Если мышца сокращается без нагрузки, ее внешняя работа равна нулю. По мере увеличения груза работа увеличивается, достигая максимума при средних нагрузках. Затем она постепенно уменьшается. Работа становится равной нулю при очень большом грузе, который мышца поднять не способна. Все сказанное справедливо и для мощности мышцы, измеряемой величиной ее работы в единицу времени. Она также достигает максимального значения при средних нагрузках. 3.1.5. Регуляция мышечного сокращения Обычно мышца возбуждается при поступлении потенциалов действия от иннервирующих мотонейронов; в результате передачи возбуждения через нервно-мышечные синапсы генерируются мышечные потенциалы действия( непрямая стимуляция ). Возможна и прямая стимуляция мышечных волокон, но только в экспериментальных условиях. Например, при раздражении изолированной мышцы лягушки одиночным электрическим импульсом длительностью около 1 мс по мышечному волокну от места раздражения примерно через 1-2 мс со скоростью примерно 2 м/с будет распространяться потенциал действия, а еще через несколько миллисекунд оно сократится. Таким образом, сокращение вызывается потенциалом действия, т.е. возбуждением мембраны волокна. Двигательные единицы. Иннервация поперечнополосатых мышечных волокон позвоночных осуществляется мотонейронами спинного мозга или ствола мозга. Один мотонейрон веточками своего аксона иннервирует несколько мышечных волокон. Комплекс мотонейрона со всеми его коллатералями и группой иннервируемых им мышечных волокон называют двигательной (нейромоторной) единицей. Среднее число мышечных волокон, входящих в состав двигательной единицы, характеризует среднюю величину нейромоторной единицы и варьирует в широких пределах в разных мышцах. Двигательные единицы невелики в мышцах, приспособленных для «тонких» движений, — от нескольких мышечных волокон до нескольких десятков их (мышцы пальцев, глаза, языка). Наоборот, в мышцах, осуществляющих «грубые» движения (например, поддержание позы мышцами туловища), двигательные единицы велики и включают сотни и тысячи мышечных волокон. Оценка деятельности двигательных единиц осуществляется с помощью электромиографии (ЭМГ) — регистрации электрической активности интактной мышцы с помощью введенных в мышцу или приложенных к ней электродов. В клинике обычно используют накожные электроды, укрепляемые над исследуемой мышцей. Многоканальные электромиографы дают возможность усиливать и записывать одновременно ЭМГ нескольких мышц. Суммарные, интерференционные ЭМГ, представляющие собой разноамплитудный частокол импульсов, анализируются по градациям амплитуды и частоты импульсов. При этом учитывается, что существует примерно линейная зависимость между интегрированной амплитудой потенциалов ЭМГ и развиваемой мышцей силой. Расшифровка ЭМГ существенно облегчается при отведении разрядов отдельных двигательных единиц. Количество работающих двигательных единиц, характер их деятельности легко выявляются по амплитуде их разрядов. У здорового человека в абсолютно расслабленной мышце электрическая активность почти отсутствует. При небольшом напряжении, например при поддержании позы, двигательные единицы разряжаются с небольшой частотой (5—10 имп/с), при большом напряжении частота импульсации повышается в среднем до 20—30 имп/с. Особенности слитного (тетанического) сокращения мышц в условиях целого организма. Обычным режимом естественной сократительной активности мышечных волокон двигательной единицы является зубчатый тетанус или даже ряд последовательных одиночных сокращений. Однако форма сокращения целой мышцы в этой ситуации напоминает гладкий тетанус. Причина этого — асинхронность разрядов мотонейронов и асинхронность сократительной реакции отдельных мышечных волокон, вовлечение (рекрутирование) большего их количества, вследствие чего мышца плавно сокращается и плавно расслабляется, может длительно находиться в сокращенном состоянии за счет чередования сокращений множества мышечных волокон. При этом мышечные волокна каждой двигательной единицы сокращаются синхронно. Функциональная дифференцировка двигательных единиц. В разных мышцах у человека и даже в пределах одной мышцы составляющие ее двигательные единицы могут значительно отличаться друг от друга по своему строению, обмену веществ и функциональным особенностям. Прежде всего двигательные единицы отличаются друг от друга размерами: объемом тела мотонейрона, толщиной его аксона и числом мышечных волокон, входящих в состав двигательной единицы. Мотонейроны. Большая двигательная единица по сравнению с малой включает крупный мотонейрон с относительно толстым аксоном, который образует большое число концевых веточек в мышце и тем самым иннервирует большое число мышечных волокон. Скорость проведения по аксону находится в прямой связи с величиной его диаметра. Соответственно в большинстве случаев скорость проведения импульсов у медленных мотонейронов (малых) меньше, частота импульсации в них также реже. Это касается как начальной (пусковой), так и максимальной частоты импульсации. С функциональной точки зрения двигательные единицы разделяют на медленные и быстрые. Свойства мотонейронов и иннервируемых ими мышечных волокон тесно коррелируют друг с другом. Чем меньше сома мотонейрона, тем большим входным сопротивлением он обладает, тем выше его возбудимость, рекрутируемость в рефлекторные акты, и наоборот (принцип размерности Хеннемана). Медленные низкопороговые мотонейроны— обычно малые мотонейроны. Устойчивый уровень импульсации у медленных мотонейронов обнаруживается уже при очень слабых статических сокращениях мышц, при поддержании позы. По мере увеличения силы сокращения мышцы частота импульсации медленных мотонейронов изменяется незначительно. Медленные мотонеироны способны поддерживать длительный разряд без заметного снижения частоты импульсации на протяжении длительных отрезков времени. Поэтому их называют малоутомляемыми или неутомляемыми мотонейронами. Быстрые высокопороговые мотонейроны включаются в активность только для обеспечения относительно больших по силе статических и динамических сокращений мышц, а также в начале любых сокращений, чтобы увеличить скорость нарастания напряжения мышцы («градиент силы») или сообщить движущейся части тела необходимое ускорение. Чем больше скорость и сила движений, иначе, чем больше мощность сократительного акта, тем больше участие быстрых двигательных единиц. Быстрые мотонейроны относятся к утомляемым, так как они не способны к длительному поддержанию высокочастотного разряда. Мышечные волокна быстрых и медленных двигательных единиц также различаются между собой. Быстрые мышечные волокна: − более толстые, содержат больше миофибрилл; − обладают большей силой, чем медленные волокна; − их окружает меньше капилляров; − содержат меньше митохондрий, миоглобина и жиров; − имеют меньшую активность окислительных ферментов, чем медленные; − имеют более высокую активность гликолитических ферментов и запасы гликогена; − не обладают большой выносливостью и более приспособлены для мощных, но относительно кратковременных сокращений. Активность волокон этого типа (их еще называют белыми) имеет значение для выполнения кратковременной высокоинтенсивной работы (например, бег на короткие дистанции); − подчиняются закону «всё или ничего». В соответствии с этим законом подпороговые стимулы не вызывают потенциалов действия и высвобождения Са2+. Как только интенсивность стимула превысит определенный пороговый уровень генерируется распространяющийся потенциал действия и происходит максимальное высвобождение Са2+; это обеспечивает максимальную силу сокращения, уже не возрастающую при повышении интенсивности стимула. Вместе с тем при электрическом раздражении целой мышцы сила ее сокращения зависит от интенсивности стимула. Например, если он едва превышает пороговый уровень, ответ по типу «все или ничего» наблюдается только в волокнах, находящихся вблизи от электрода, где плотность тока максимальна; для возбуждения всех волокон требуется гораздо более сильный (максимальный) стимул. Таким образом, только сверхмаксимальное раздражение может равномерно и достаточно надежно активировать изолированную целую мышцу. Закон «все или ничего» не означает, что ответ раздражаемого мышечного волокна будет всегда одинаков по величине. Например, если мышца только что расслабилась после тетануса, одиночный стимул часто вызывает гораздо более сильное одиночное сокращение, чем до такого «кондиционирования». Причины этой посттетанической потенциации известны так же мало, как и механизм мышечного утомления - снижения силы сокращения при ритмической стимуляции. В обоих случаях у потенциалов действия нормальная амплитуда. При кислородной недостаточности и в еще большей степени при нарушении метаболизма иодацетатом ритмическая стимуляция сопровождается не только снижением силы сокращения, но и замедлением расслабления; в конечном итоге, когда запас АТФ истощается, «отравленная» мышца вообще утрачивает способность к расслаблению - становится ригидной. Состояние необратимой ригидности и тетанус следует отличать от контрактуры. Медленные мышечные волокна: − окружены богатой капиллярной сетью, позволяющей получать большое количество кислорода из крови; − содержат большое количество миоглобина, который облегчает транспорт кислорода в мышечных клетках к митохондриям (миоглобин обусловливает красный цвет этих волокон − отсюда их второе название − красные); − содержат большое количество митохондрий и субстратов окисления — жиров; − более эффективно используют аэробный, окислительный путь энергопродукции; − обладают высокой выносливостью, т.е. способны к выполнению длительной работы преимущественно аэробного характера. Имеются также тонические мышечные волокна, на них локализуются по 7—10 синапсов, принадлежащих, как правило, нескольким мотонейронам. ПКП этих мышечных волокон не вызывают генерации ПД в них, а непосредственно запускают мышечное сокращение. Скорость сокращения мышечных волокон находится в прямой зависимости от активности миозин-АТФазы — фермента, расщепляющего АТФ и тем самым способствующего образованию поперечных мостиков и взаимодействию актиновых и миозиновых миофиламентов. Более высокая активность этого фермента в быстрых мышечных волокнах обеспечивает и более высокую скорость их сокращения по сравнению с медленными волокнами. Клинические аспекты. При некоторых нарушениях, затрагивающих иннервацию мышц, их пассивное движение или растяжение вызывает рефлекторное повышение тонуса и в результате сопротивление растяжению. Соответственно электромиографическая активность мышцы возрастает во время ее пассивного движения (спастичность, или ригидность). При заболеваниях типа миотонии мембраны мышечных волокон так легко возбудимы, что даже введение игольчатого электрода для электромиографии вызывает разряды мышечных импульсов. Когда после периода покоя человек произвольно напрягает мышцу, в таких гипервозбудимых мембранах возникают продолжительные следовые разряды (залпы потенщиалов действия), в результате чего она сокращается дольше, чем нужно, и становится ригидной. В отличие от дегенеративных мышечных заболеваний (дистрофий) при миотонии сократительный аппарат не страдает. Спонтанные потенциалы действия (потенциалы фибрилляции) регистрируются также на первой стадии после денервации мышцы, прежде чем ее действие приведет к денервационной атрофии. Волокна, атрофирующиеся вследствие длительной денервации (например, при полиомиелите или боковом амиотрофическом склерозе), замещаются соединительной тканью. Однако в случае частичных повреждений нервов аксоны оставшихся интактными мотонейронов могут врастать в денервированные участки мышцы и иннервировать не только «собственные», но и «чужие» мышечные волокна. В результате размеры двигательных единиц и амплитуда потенциалов действия увеличиваются. 3.2. ГЛАДКИЕ МЫШЦЫ В организме высших животных и человека гладкие (неисчерченные) мышцы находятся во внутренних органах, сосудах и коже. Их активность не управляется произвольно, функции многих из них слабо контролируются ЦНС, некоторые из них обладают автоматизмом и зачастую собственными интрамуральными нервными сплетениями, в значительной мере обеспечивающими их самоуправление. Поэтому гладкую мускулатуру, как и мышцу сердца, называют непроизвольной. Медленные, часто ритмические сокращения гладкомышечных стенок внутренних органов — кишечника, желудка, мочеточников, протоков пищеварительных желез и др.− обеспечивают перемещение содержимого этих органов. Тоническое сокращение стенок артерий и артериол поддерживает оптимальный уровень кровяного давления и кровоснабжение органов и тканей. 3.2.1. Структурно-функциональные особенности гладких мышц Гладкие мышцы построены из веретенообразных одноядерных мышечных клеток. Их толщина составляет 2—10 мкм, длина — от 50 до 400 мкм. Волокна очень тесно примыкают друг к другу и связаны между собой низкоомными электрическими контактами — нексусами. Несмотря на наличие межклеточных щелей шириной 60—150 нм, гладкая мышца функционирует как синцитий — функциональное образование, в котором возбуждение (медленные волны деполяризации и ПД) способно беспрепятственно передаваться с одной клетки на другую по крайней мере в пределах одного мышечного пучка, являющегося обычно функциональной единицей гладкой мышцы). Этим свойством гладкая мышца отличается от скелетной и сходна с сердечной, которая тоже представляет собой функциональный синцитий. Однако в сердце достаточно возбудить один миоцит — и возбуждение охватит весь миокард. В гладких мышцах ПД, возникший в одной клетке, распространяется лишь на определенное расстояние. Потенциал покоя некоторых гладкомышечных волокон, обладающих автоматией, обнаруживает постоянные небольшие колебания. Его величина меньше значения мембранного потенциала скелетных мышц и составляет в волокнах, не обладающих автоматией, 60—70 мВ, она несколько ниже в спонтанно активных клетках — 30-70 мВ. Потенциал действия. В гладких мышцах внутренних органов регистрируются ПД двух основных типов: пикоподобные ПД и ПД с выраженным плато. Длительность пикоподобных ПД составляет 5—80 мс; ПД с плато, характерными для гладких мышц матки, уретры и некоторых сосудов, длятся от 30 до 500 мс. Ионный механизм возникновения ПД в гладких мышцах существенно отличается от такового в скелетных мышцах. Удаление из омывающего раствора ионов Nа+ (замена их ионами Li+ или холина) не препятствует возникновению полноценных ПД гладких мышц. Удаление из раствора ионов Са2+ или воздействие на мышечные клетки блокаторов кальциевых каналов (например, верапамила) приводит к обратимому угнетению ПД. Все эти факты говорят о главной роли ионов Са2+ в генерации ПД гладких мышц. Электровозбудимые медленные кальциевые каналы обладают меньшей ионной избирательностью, нежели «быстрые» натриевые каналы нервных и поперечно исчерченных мышечных волокон. Помимо двухвалентных катионов, они проницаемы и для ионов Nа+. ПД гладких мышц, состоящие из начального пикового компонента и последующего плато, имеют более сложную ионную природу. Например, в гладких мышцах мочеточников начальный фрагмент ПД имеет преимущественно кальциевую природу, а последующий медленный компонент (плато) — преимущественно натриевую природу. 3.2.2. Механизм сокращения и пластичность гладкой мышцы Процесс сокращения гладкомышечных волокон совершается по тому же механизму скольжения нитей актина и миозина относительно друг друга, что и в скелетных мышцах. Однако у гладкомышечных клеток нет той стройной аранжировки сократительных белков, как у скелетных мышц. У этих клеток миофибриллы с саркомерами расположены нерегулярно, поэтому клетка не имеет поперечной исчерченности. Электромеханическое сопряжение в этих клетках идет иначе, чем в скелетных мышцах, так как в них слабо выражен саркоплазматический ретикулум. В связи с этим триггером для мышечного сокращения служит поступление ионов Са2+ в клетку из межклеточной среды в процессе генерации ПД. Того количества кальция, которое входит в клетку при возбуждении, вполне достаточно для полноценного фазного сокращения. Инициация сокращений гладких мышц с помощью ионов Са2+ также имеет несколько другой механизм, чем в поперечнополосатых волокнах. Ионы Са2+ воздействуют на белок кальмодулин, который активирует киназы легких цепей миозина. Это обеспечивает перенос фосфатной группы на миозин и сразу вызывает срабатывание, т.е. сокращение, поперечных мостиков. О существовании тропонин-тропомиозиновой системы сведений не имеется. При снижении в миоплазме концентрации ионов Са2+ фосфатаза дефосфорилирует миозин, и он перестает связываться с актином. Скорость сокращения гладких мышц невелика — на 1—2 порядка ниже, чем у скелетных мышц. Сила сокращений некоторых гладких мышц позвоночных не уступает силе сокращений скелетных мышц. Подобно сердечной и скелетной мускулатуре, гладкие мышцы всегда расслабляются при падении внутриклеточной концентрации Са2+ ниже 10-7 М. Однако их расслабление происходит гораздо медленнее, поскольку скорость поглощения ионов Са2+ саркоплазматическим ретикулумом или удаления их через клеточную мембрану здесь ниже. Удаление Са2+ приводит к расщеплению фосфатазой функционально важной фосфатной группы миозина. Его дефосфорилированные головки теряют способность образовывать поперечные мостики с актином. Пока неясно, каким образом образующиеся в гладкомышечных клетках цАМФ и цГМФ вызывают понижение их тонуса. Возможно, цАМФ ингибирует активность киназы легких цепей миозина или усиливает поглощение Са2+ саркоплазматическим ретикулумом. С другой стороны, вполне вероятна роль цГМФ как внутриклеточного посредника в расслаблении гладких мышц сосудов, которое индуцируется расслабляющим фактором эндотелия. Регуляция сокращений гладких мышц. Среди гладкомышечных клеток можно выделить несколько групп по механизму возбуждения. − Гладкие мышцы с миогенной (спонтанной) активностью. Во многих гладких мышцах кишечника (например, толстой кишки) одиночное сокращение, вызванное потенциалом действия, продолжается несколько секунд. Следовательно, сокращения с интервалом менее 2 с накладываются друг на друга, а при частоте выше 1 Гц сливаются в более или менее гладкий тетанус (тетанообразный “тонус”), который отличается от тетануса скелетных мышц только низкой частотой сливающихся одиночных сокращений и необходимых для этого потенциалов действия. Природа такого “тонуса” -миогенная; в отличие от скелетной мускулатуры, гладкие мышцы кишечника, мочеточника, желудка и матки способны к спонтанным тетанообразным сокращениям после изоляции и денервации и даже при блокаде нейронов интрамуральных ганглиев. Следовательно, их потенциалы действия не обусловлены передачей к мышце нервных импульсов, т. е. у них не нейрогенное, а миогенное происхождение (как в сердце). Миогенное возбуждение возникает в клетках – ритмоводителях (пейсмекерах), идентичных другим мышечным клеткам по структуре, но отличающихся электрофизиологическими свойствами. Препотенциалы, или пейсмекерные потенциалы, деполяризуют их мембрану до порогового уровня, вызывая потенциал действия. Из-за поступления в клетку катионов (главным образом Са2+) мембрана деполяризуется до нулевого уровня и даже на несколько миллисекунд меняет полярность до + 20 мВ. За реполяризацией следует новый препотенциал, обеспечивающий генерирование следующего потенциала действия. Интервал между потенциалами действия пейсмекера зависит как от скорости деполяризации, вызываемой препотенциалами, так и от разницы между исходным мембранным и пороговым потенциалами.При нанесении напрепарат мышцы толстой кишки ацетилхолина пейсмекерные клетки деполяризуются до околопорогового уровня, и частота потенциалов действия возрастает. Вызываемые ими сокращения сливаются до почти гладкого тетануса. Чем выше частота потенциалов действия, тем слитнее тетанус и тем сильнее сокращение, возникающее в результате суммации одиночных сокращений. И напротив, нанесение на тот же препарат норадреналина гиперполяризует мембрану и в результате снижает частоту потенциалов действия и величину тонуса. Таковы механизмы модуляции спонтанной активности пейсмекеров вегетативной нервной системой и ее медиаторами. Возбуждение распространяется по гладкой мыщце через особые «щелевые контакты» (нексусы) между плазматическими мембранами сопредельных мышечных клеток. Эти области с низким электрическим сопротивлением обеспечивают электротоническую передачу деполяризации от возбужденных клеток к соседним. Как только местный ток, протекающий через нексус, деполяризует мембрану до порогового уровня, возникает потенциал действия, который в свою очередь вызывает возбуждение в других электротонически сопряженных клетках. Таким образом, активность распространяется по всей мышце со скоростью около 5-10 см/с, и мышца ведет себя как единая функциональная единица, почти синхронно воспроизводя активность своего пейсмекера. Таким образом, среди гладкомышечных клеток есть фоновоактивные — водители ритма (пейсмекеры). Непосредственной причиной их ПД является спонтанная медленная деполяризация мембраны (препотенциал). Эти периодические ПД пейсмекерных клеток, распространяясь по прочей массе мышечных клеток (со скоростью 5—10 см/с), создают миогенный тонус гладких мышц. − Другие гладкомышечные клетки, будучи растяжимыми и пластичными, как и все гладкомышечные ткани, при определенной степени растяжения способны возбуждаться (деполяризоваться) и отвечать на это растяжение сокращением. После обусловленного эластическими свойствами начального подъема напряжения гладкая мышца развивает пластическую податливость, и ее напряжение падает постепенно — вначале быстро, потом медленнее. Таким образом, пластичность объясняет характерное свойство гладкой мышцы: она способна быть расслабленной в укороченном и в растянутом состояниях. Благодаря пластичности гладкой мускулатуры стенок мочевого пузыря давление внутри него относительно мало изменяется при значительной градации наполнения, и лишь при более значительном депонировании мочи давление, а следовательно, и растяжение стенок резко возрастает и происходит сокращение мышц детрузора — эвакуация мочи даже в тех случаях, когда его нервная регуляция нарушена в результате повреждения спинного мозга.. Этот феномен лежит в основе периферической саморегуляции тонуса гладких мышц некоторых кровеносных сосудов, лимфангионов, мочевого пузыря и других органов. − Третий вид гладкомышечных клеток (цилиарное тело, радужка глаза, артерии и семенные протоки) имеет более мощную (плотную) иннервацию и слабое развитие межклеточных контактов. Спонтанная активность этих мышц обычно слабая или её вообще нет. Тонус этих мышц и его колебания имеют в основном нейрогенную природу. Гладкие мышцы иннервируются вегетативными нервами, многие имеют парасимпатические и симпатические входы. Нервные влияния регулируют активность висцеральных гладкомышечных образований. Функции висцеральных гладких мышц управляются также нейронами интрамуральных нервных сплетений, не только перерабатывающих центробежную импульсацию, но и формирующих собственные автономные команды. При наличии чувствительных, вставочных и моторных нейронов в интрамуральных узлах осуществляется рефлекторная деятельность. Так, мускулатура кишечного тракта функционирует под влиянием импульсов из ауэрбахова и мейснерова сплетений, заложенных в кишечной стенке. Эта особенность делает возможной автоматизированную, четко организованную моторную функцию кишечника. Эффектором вегетативных входов чаще является пучок неисчерченных мышечных клеток, а не отдельная мышечная клетка. Плотность иннервации различна в разных гладких мышцах и даже в соседних участках одной и той же мышцы. ТЕСТЫ 1-2 УРОВНЯ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ ПО ТЕМЕ: ФИЗИОЛОГИЯ МЫШЦ 1.Автоматические сокращения гладких мышц обусловлены: А. поступлением нервных импульсов из ЦНС В. возникновением возбуждения в интрамуральных нервных структурах С. возникновением возбуждения в самой мышце D. гуморальными факторами 2. Активация сокращения скелетного волокна происходит при действии ионов кальция: А. на тропонин В. на саркоплазматический ретикулум С. на кальмодулин D. на активные центры актина 3. Какое из перечисленных ниже событие не участвует в цикле поперечных мостиков в гладкой мышце? А. Са2+ -кальмодулиновый комплес активирует киназу легкой цепи миозина В. АТФ используется для фосфорилирования легкой цепи миозина и повышения его сродства к актину С. Фосфорилированный миозин самопроизвольно соединяется с актином D. АТФ используется для связывания и поворота миозиновой головки и генерации сокращения Е. толстые и тонкие филаменты укорачиваются, вызывая мышечные сокращения 4. Сопряжение возбуждения и сокращения в скелетной мышце: А. происходит без изменения трансмембранного потенциала В. опосредуется преимущественно притоком ионов Са2+ из внеклеточной жидкости С. опосредуется натрий-кальциевым обменным механизмом D. опосредуется внезапным снижением активности Са-АТФ-фазы, которая откачивает Са2+ в саркоплазматический ретикулум Е. ничто из перечисленного выше 5. Система поперечных трубочек поперечно-полосатой мышцы: А. откачивает Са2+ из внеклеточной жидкости в концевые цистерны саркоплазматического ретикулума В. проводит потенциал действия внутрь клетки С. содержит кальсеквестрин, который связывает ионы Са2+ D. депонирует Са2+, который высвобождается во время сопряжения возбуждения и сокращения Е. все выше перечисленное верно 6. Важнейшей функцией процесса деполяризации мембраны в процессе сопряжения возбуждения и сокращения скелетной мышце является: А. инициация притока ионов кальция из внеклеточной жидкости в цитоплазму В. поддержание теплообмена за счет гидролиза АТФ С. деполяризация саркоплазматического ретикулума D. инициация высвобождения Са2+ из саркоплазматического ретикулума Е. ни одна из перечисленных функций 7. При повышении концентрации Са2+ в цитоплазме сокращение гладких мышц активизируется посредством: А. связывания с тропонином с последующей активацией миозиновой АТФ-фазы, которая инициирует цикл поперечных мостиков В. связывание с тропомиозином с последующей активацией миозиновой АТФфазы, которая инициирует цикл поперечных мостиков С. связывание с кальмодулином, вызывающим выдение инозитолтрифосфата для активации цикла поперечных мостиков D. связывание с кальмодулином, активирующим киназу легкой цепи миозина, которая инициирует гидролиз АТФ и цикл поперечных мостиков Е. связывание с кальмодулином, активирующим фосфатазу легкой цепи миозина, которая инициирует гидролиз АТФ и цикл поперечных мостиков 8. Функции АТФ-фазы миозина: А. цикл поперечных мостиков в скелетных и сердечных мышцах В. уменьшение сродства миозиновых поперечных мостиков к активным участкам тонкого филамента С. откачивание Са2+ обратно в саркоплазматический ретикулум D. поддержание состояния сокращения скелетной мышцы Е. ничто из перечисленного выше 9. Роль кальция в мышечном сокращении: А. вызывает распад АТФ В. блокирует работу калий-натриевого насоса С. способствует взаимодействию миозина с актином D. вызывает образование тропомиозина Е. уплотняет Z-мембрану 10. Что такое электромеханическое сопряжение? А. проведение возбуждения по Т- системе В. передача сигнала от мембраны клетки к миофибриллам и их скольжение С. деформация головок молекул миозина D. образование энергии при распаде АТФ Е. увеличение дины саркомера 11. С чего начинается расслабление мышцы? А. с блокирования тропонина В. с разрушения поперечных мостиков С. с активации тропомиозина D. с откачивания ионов Са в цистерны Е. с расщепления АТФ 12. Физиологические свойства всех мышц: А. возбудимость В. проводимость С. сократимость D. автоматия Е. пластичность 13. Что такое контрактура? А. снижение максимальной силы мышцы В. замедление расслабления мышцы С. утомление мышц D. повышение сократимости мышцы Е. истощение запасов энергии 14.Какую роль в мышечном сокращении играет кальций-тропониновый комплекс? А. обеспечивает расщепление АТФ В. возвращает Са в саркоплазматические цистерны С. деполяризует сарколемму D. снимает блокаду актина тропомиозином Е. снимает блокаду актина тропонином 15. Что является непосредственной причиной скольжения нитей актина относительно миозина? А. упругие свойства миофибрилл В. изменения положения головки миозина относительно ее тела С. конформация тропонина D. конформация тропомиозина Е. все выше перечисленное 16. Источник энергии: 16.1 при кратковременном мышечном сокращении? 16.2 при длительном мышечном сокращении? А. креатинфосфат В. АТФ С. окисление углеводов и жирных кислот D. молочная кислота Е. все выше перечисленное 17.Что выполняет роль АТФ-фазы в механизме мышечного сокращения? А. актин В. миозин С. тропонин D. тропомиозин Е. актомиозиновый комплекс 18. При мышечном сокращении не изменяется ширина диска: А. А В. Н С. I D. Z Е. всех вышеперечисленных 19. При мышечном сокращении уменьшается ширина диска: А. А В. H С. I D. Z Е. всех вышеперечисленных 20. Специфическое проявление возбуждения скелетной мышцы: А. возникновение ПД В. генерирование импульсов С. выделение секрета D. сокращение мышцы Е. повышение уровня обмена веществ 21. Электромиограмма – это? А. электрическая активность одного элемента волокна В. запись уровня возбудимости скелетной мышцы С. электрическая активность нервных волокон D. электрическая активность мышцы при возбуждении Е. запись МП мышцы 22. Средняя длительность сокращения скелетной мышцы А. 0,1 мсек. В. 1 сек. С. 0,1 сек. D. 12 мсек. Е. 15 мсек. 23. Какова лабильность скелетных мышц? А. 50имп/сек. В. 150имп/сек. С. 200имп/сек. D. 300имп/сек. Е. 1000имп/сек. 24. Какой режим сокращения мышц шеи имеет место при удержании головы в определенном положении? А. изотоническое сокращение В. изометрическое сокращение С. ауксотоническое сокращение D. концентрическое сокращение Е. эксцентрическое сокращение 25. Какой режим сокращения имеет место при длительном медленном опускании поднятого груза? А. изотоническое сокращение В. изометрическое сокращение С. ауксотоническое сокращение D. концентрическое сокращение Е. эксцентрическое сокращение 26. какое сокращение получим при раздражении скелетной мышцы с частотой 25 Гц при длительности ее одиночного сокращения 0,1 сек.? А. зубчатый тетанус В. гладкий тетанус С. сокращения не будет D. 25 одиночных сокращений Е. одиночное сокращений 27. Как реагирует скелетная мышца на увеличение силы раздражения? А. амплитуда мышечного сокращения уменьшается В. амплитуда мышечного сокращения градуально увеличивается С. амплитуда мышечного сокращения градуально увеличивается определенного предела D. амплитуда мышечного сокращения не изменяется Е. по закону «все или ничего» 28. Как реагирует на увеличение силы раздражения отдельное мышечное волокно? А. амплитуда мышечного сокращения увеличивается В. амплитуда мышечного сокращения уменьшится С. по закону «все или ничего» D. градуально растет до определенного предела Е. градуально растет 29. Откуда поступает Са2+ в саркоплазму при сокращении скелетной мышцы? А. из Т-системы В. из саркоплазматических цистерн С. из внеклеточной жидкости до D. из внеклеточной жидкости и саркоплазматических цистерн Е. из Т-системы и саркоплазматических цистерн 30. Зубчатый тетанус возникает, если межимпульсный интервал: А. меньше латентного периода В. больше латентного периода сокращения мышцы, но меньше длительности одиночного мышечного сокращения С. больше латентного периода сокращения мышцы, но меньше суммы длительностей латентного периода и периода укорочения D. больше латентного периода сокращения мышцы Е. больше длительности одиночного сокращения 31.Внешнюю механическую работу мышца выполняет: А. в изометрическом режиме сокращения В. в ауксотоническом режиме сокращения С. в изотоническом режиме D. в концентрическом режиме Е. в эксцентрическом режиме сокращения 32. Внешняя механическая работа мышцы максимальна при: А. минимальной нагрузке В. максимальной нагрузке С. средней нагрузке D. без нагрузки 33. Сила мышцы зависит от: А. длины В. характера расположения мышечных волокон С. физиологических условий: возраста, тренированности, питания, состояния утомления и т.д. D. площади поперечного сечения мышцы Е. всего выше перечисленного 34. Внешними проявлениями утомления мышцы являются: А. уменьшение амплитуды сокращения В. увеличение латентного периода сокращения С. увеличение периода расслабления D. контрактура Е. все выше перечисленное 35. При развитии утомления изолированной мышцы имеет значение: А. истощение запасов кислорода В. истощение запасов энергии С. отравление накапливающимся СО2 D. отравление продуктами метаболизма – метаболический ацидоз Е. утомление нервных центров 36 При развитии утомления мышцы в целостном организме основной причиной являет ся: А. истощение запасов кислорода В. истощение запасов энергии С. отравление накапливающимся СО2 D. отравление продуктами метаболизма – метаболический ацидоз Е. утомление нервных центров 37. Основная причина увеличения длительности периода расслабления скелетной мышцы при утомлении: А. инактивация кальциевых каналов В. нарушение работы кальциевого насоса С. уменьшение скорости проведения возбуждения D. уменьшение скорости развития возбуждения 38. При развитии утомления скелетной мышцы амплитуда сокращения ее уменьшается, т.к.: А. нарушается процесс фосфолирирования миозина В. не происходит образование актомиозинового комплекса С. не происходит отсоединение миозина от актина D. блокируется проведение возбуждения по мембране Е. нарушается работа кальциевого насоса 39. Физиологические свойства гладкой мышцы: А. возбудимость В. проводимость С. сократимость D. автоматия, пластичность Е. все выше перечисленное 40. Откуда поступает Са в саркоплазму при сокращении гладкой мышцы? А. из поперечных трубочек В. из саркоплазматического ретикулума (СПР) С. из внеклеточной жидкости D. из внеклеточной жидкости и СПР Е. из миофибрилл 41.Гладкие мышцы наиболее чувствительны к: А. недостатку кислорода В. серии нервных импульсов С. химическим веществам D. одиночным нервным импульсам 42. Автоматия пейсмекерных гладкомышечных клеток обусловлена: А. более медленной работой кальциевого насоса В. функциональным синцитием С. наличием «дрейфующего» мембранного потенциала D. нерегулярным распределением актиновых и миозиновых нитей Е. вегетативной иннервацией 43. Скорость распространения возбуждения по гладкой мышце: А. 0,1 см/с В. 5-10 см/с С. 10 м/с D. 0,02-0,04 м/с 44. Длительность сокращения гладкой мышцы: А. 0,1с В. 1с С. 10с D. 1мин Е. несколько десятков минут 45. Медленное расслабление гладкой мышцы в значительной степени объясняется: А. отсутствием Т-системы В. функциональным синцитием С. особенностью функционирования кальциевого насоса СПР D. нерегулярным распределение актина и миозина Е. наличием нексусов 46. В сокращении гладкой мышцы принимают участие белки: А. актин В. миозин С. тропонин D. тропомиозин Е. кальмодулин 47. Гладкая мышца способна к длительному тоническому сокращения без развития утомления, потому что: А. имеет автоматию В. имеет низкую скорость сокращения С. имеет низкие траты энергии D. имеет низкую силу сокращения Е. имеет высокую скорость сокращения 48. Быстрое и сильное растягивание гладких мышц вызывает их: А. расслабление В. сокращение так как растяжение вызывает: С. деполяризацию мембран гладкомышечных клеток D. гиперполяризацию СИТУАЦИОННЫЕ ЗАДАЧИ ПОВЫШЕННОЙ СЛОЖНОСТИ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ ПО ТЕМЕ: ФИЗИОЛОГИЯ МЫШЦ 1. Как и почему будет изменяться амплитуда одиночных сокращений мышечного волокна, если под влиянием кофеина в этом волокне удлинится период максимума активного состояния? 2. В ближайшие после смерти несколько часов имеет место трупное окоченение мышц. Объясните механизм. 3. В результате утомления в волокнах мышцы уменьшилось содержание АТФ. Как и почему это скажется на длительности и амплитуде одиночных сокращений мышцы? 4. Под влиянием анионов йода в мышечных волокнах понижается активность кальциевого насоса саркоплазматического ретикулума. Как и почему это скажется на длительности и амплитуде одиночных сокращений мышцы? 5. Как можно объяснить механизм развития у бегуна на длинные дистанции "второго дыхания"? 26. Объясните, почему наиболее мощным движениям соответствует наибольшая амплитуда? 7. Какой вид мышечный работы неблагоприятно влияет на крово- и лимфо- обращение? 8. Удержание мочи в мочевом пузыре обеспечивается сокращением гладких мышц сфинктеров, потому что гладкие мышцы сфинктеров способны к длительному тоническому сокращению. 9. Передвижение содержимого по пищеварительному тракту происходит за счет сокращения гладких мышц, потому что гладкие мышцы стенки пищеварительной трубки способны к медленным ритмическим сокращениям. 10. Гладкие мышцы внутренних органов и сосудов даже при длительном сокращении не утомляются, потому что тонические сокращения гладких мышц происходят при незначительных энергетических затратах. 11. Медленное наполнение желудка или мочевого пузыря в пределах физиологической нормы не вызывает повышения давления в этих органах, потому что гладкие мышцы внутренних органов обладают автоматизмом. 12. Двигательная активность гладкомышечных клеток полых органов усиливается при их быстром и сильном растягивании, потому что быстрое и сильное растяжение вызывает гиперполяризацию мембран гладкомышечных клеток. При ответах на вопросы 8 - 12 используйте приведенный ниже код. е1 Утверждени Верно Верно Верно Неверно Неверно е2 Утверждени Связь Ответ Верно Верно Неверно Верно Неверно Верно Неверно Неверно Неверно Неверно А В С D E 4.ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ НЕРВНО-МЫШЕЧНОЙ СИСТЕМЫ В РАЗЛИЧНЫЕ ПЕРИОДЫ ОНТОГЕНЕЗА 4.1.ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ НЕРВНО-МЫШЕЧНОЙ СИСТЕМЫ У ДЕТЕЙ Нервно-мышечная система осуществляет двигательную функцию и является одной из важнейших систем организма, выполняющей роль основного средства общения организма с окружающей средой. В ходе онтогенеза эта система претерпевает резко выраженные изменения как структурные, так и функциональные. Структурные изменения проявляются увеличением общей массы мускулатуры и преобразованием строения мышц. Функциональные изменения характеризуются эволюцией основных свойств мышечной ткани, ее функции, чувствительностью к действию раздражителей и т.д. В процессе развития нервно-мышечной системы различают 2 основных периода: 1/ внутриутробный или антенатальный; 2/ период после рождения или постнатальный. Последний, в свою очередь, делится на: а/ период до реализации позы /от момента рождения до одного года жизни/; б/ период реализации позы /после года жизни/. Во внутриутробном периоде функция скелетной мускулатуры сводится к обеспечению роста плода и деятельности сердечно-сосудистой и дыхательной систем. Структурные и функциональные особенности проявляются следующим образом: − имеет место неравномерность развития отдельных мышц и мышечных групп. Быстрее формируются те системы, которые обеспечивают функции, необходимые новорожденному; − в мышечной ткани плода мало содержится сократимых белков, они обладают слабо выраженной способностью взаимодействовать с АТФ и у них отсутствует реакция взаимодействия между миозиновой и актиновой фракциями; − формирование мышечного рецепторного аппарата опережает созревание моторных нервных окончаний. С 10-12 недели внутриутробной жизни начинается формирование мышечных веретен и к моменту рождения они уже хорошо развиты; − двигательные нервные окончания в мышцах появляются к 13-14 неделе внутриутробного развития и затем продолжается их длительное формирование; − периферические спинно-мозговые нервы тонки в связи с недоразвитием миэлиновой оболочки. Происходит постепенная миэлинизация нервных волокон. Раньше всего покрываются миэлиновой оболочкой волокна задних и передних корешков спинно-мозговых нервов; − для внутриутробного перехода характерна наиболее низкая лабильность нервномышечного аппарата. Если у взрослых животных она составляет 60-80 в 1 секунду, то у плода лабильность колеблется в пределах 3-4 в 1 секунду; − низкая лабильность мышц эмбрионов определяет их тонические свойства. Мышечная активность в этот период характеризуется признаками, типичными для тонуса. При этом преобладает тонус сгибателей, что обеспечивает характерную внутриутробную позу, которая поддерживается рефлекторно; − характерным является невозможность получения пессимального торможения мышц плода. При повышенной оптимальной частоте раздражения мышца продолжает сокращаться столько времени, сколько длится раздражение; − электропроводность эмбриональных мышц очень низка. Чувствительность к электрическому току снижена как при прямом, так и при непрямом раздражении; − поперечно-полосатые мышцы млекопитающих в эмбриональном периоде обладают повышенной чувствительностью к ацетилхолину и никотину; − в ответ на одиночное раздражение нерв плода отвечает не одиночным потенциалом действия, а групповым, затухающим разрядом импульсов; − наблюдается извращение закона Пфлюгера: возбуждение возникает не на катоде, а на аноде. В постнатальном периоде, до реализации позы, функция скелетной мускулатуры сводится также к обеспечению роста плода и, кроме того, к терморегуляции. Поэтому адекватной формой стимуляции двигательной активности скелетных мышц является температура окружающей среды. Для детей этого периода характерна постоянная активность скелетной мускулатуры. Даже во время сна мышцы не расслабляются и находятся в состоянии тонуса. Постоянная активность скелетных мышц является стимулом бурного роста мышечной массы. В период реализации позы терморегуляционная функция скелетной мускулатуры снижается и появляется локомоторная функция. В связи с этим тоническая форма деятельности заменяется фазнотонической. Скелетная мускулатура переходит к выполнению собственно анимальной функции. В период после рождения продолжаются значительные изменения структуры и функции нервно-мышечной системы: − продолжается увеличение общей массы мышечной ткани. За весь период роста ребенка масса мускулатуры увеличивается в 35 раз, значительно больше, чем масса многих других органов. У новорожденных масса мышц составляет 23%, к 8 годам – 27%, к 15 годам – 33%, у взрослых – 44% от общей массы. При этом, рост отдельных групп мышц происходит неравномерно. Имеет место относительное преобладание мускулатуры туловища и слабое развитие мускулатуры конечностей. У новорожденных и детей 1-2 месяцев продолжает преобладать тонус сгибателей, что определяет позу грудных детей и большее развитие у них сгибателей. У детей 3-5 месяцев появляется нормотония, с равновесием мышц антагонистов. К 5 годам происходит более интенсивное развитие разгибателей и соответственно увеличение их тонуса; − изменения в микроструктуре мышечной ткани проявляются в следующем: а) рост мышечной массы в постнатальном периоде происходит в основном за счет увеличения размеров каждого из мышечных волокон, тогда как общее количество их практически не увеличивается. Мышечные волокна новорожденных в 5 раз тоньше, чем у взрослых. Диаметр их составляет у новорожденных 6,5-7,8 мкм, а к 12-16 годам – 26-28 мкм. Мышечные волокна новорожденных богаты саркоплазмой, поперечная полосатость выражена слабо. Рост их происходит за счет утолщения миофибрилл; б) происходит постепенное уменьшение ядерной массы иизменение формы ядер. Они из округлых у новорожденных к 2-3 годам жизни становятся продолговатыми; в) мышцы новорожденных совмещают признаки тонических и фазных мышц. В первые же дни постнатальной жизни происходит дифференцирование на медленные и быстрые мышцы, свойственное взрослому организму; г) рецепторы мышц /нервно-мышечные веретена/ к моменту рождения уже сформированы и теперь происходит их перераспределение. Мышечные веретена начинают перемещаться из средних частей мышечного волокна в проксимальные и дистальные части, которые испытывают наибольшее растяжение; д) мышцы новорожденных монотерминальны, т.е. они имеют один синапс в виде типичной концевой бляшки. В дальнейшем продолжается развитие двигательных нервных окончаний в мышцах. Число синапсов увеличивается. Пубертатный возраст характеризуется перестройками всех основных систем организма, в том числе и системы движения. В частности изме- няется энергетическое обеспечение мышечной деятельности. С началом пубертатного периода повышается максимально достижимая концентрация молочной кислоты в крови и вели- чина максимального кислородного долга. Все это говорит об усилении роли анаэробных источников энергии при мышечной деятельности. В то же время максимальное потребление кислорода, являющееся мерой аэробных возможностей организма, увеличивается пропорционально увеличению массы тела; − изменения в структуре спинномозговых нервов проявляются продолжением их миелинизации. В первые годы жизни они утолщаются вдвое за счет развития миелиновой оболочки. Филогенетические старые пути миелинизируются раньше, чем филогенетические новые. Передние спинномозговые корешки у человека достигают состояния свойственного взрослым людям между 2-5 годами жизни, а задние спинномозговые корешки – между 5-9 годами. Соответственно к этим годам и достигается максимальная скорость распространения нервного импульса; − соответственно изменениям структуры изменяется и функция нервно-мышечного аппарата. В период после рождения она характеризуется следующими особенностями: а) отмечается пониженная возбудимость нервно-мышечной системы. Это проявляется большим порогом раздражения, длительной хронаксией и низкой лабильностью. Возрастные изменения лабильности связаны с длительностью абсолютной и относительной рефракторных фаз. Так, в эксперименте получено, что у взрослых собак длительность абсолютной рефракторной фазы составляет 1,5-2 мс, относительной рефракторной фазы 6-8 мс. У щенков, в возрасте 16-18 дней абсолютная рефракторная фаза составляет 5-8 мс, относительная – 40-60 мс. Фаза экзальтации отсутствует. Изменение лабильности связывают и с состоянием нервномышечных синапсов в период новорожденности. На это указывает тот факт, что по мере созревания мионеврального синапса длительность перехода возбуждения с нерва на мышцу укорачивается в среднем в 4 раза, что способствует увеличению лабильности. Для суждения об изменениях функциональной лабильности мышц были исследованы реакции пессимума. За порог частичного пессимума принималась минимальная частота раздражения, при которой отмечалось первое ослабление сокращения мышцы, за порог полного – частота, при которой все мышечные волокна реагировали пессимальной реакцией. Хронаксия у взрослых и школьников равна десятым долям миллисекунд /0,1-0,5 мс/. У новорожденных же она в 1,5-10 раз длиннее. Достижение хронаксии уровня взрослых про- исходит к 9-15 годам жизни. У новорожденных сохраняется низкая электровозбудимость нервно-мышечного аппарата. У детей первых недель жизни при токе силой 5 ампер сокращение получается только при замыкании катода /КЗС/. У детей старшего возраста – при замыкании и катода и анода /КЗС и АЗС/. б) для раннего детского возраста как и для внутриутробного периода, характерным является невозможность получения пессимального торможения мышц. Мышцы независимо от характеристики раздражителя по частоте и интенсивности, отвечают тоническим типом сокращения, которое длится столько, сколько продолжается раздражение, без признаков перехода в состояние пессимума. При увеличении частоты раздражения, амплитуда сокращения мышц сначала снижается, а затем устанавливается на некотором уровне. Отсутствие фазы экзальтации и невозможность получения интенсивного пессимума связывают с недостаточным структурным оформлением мионевральных синапсов; в) кривая одиночного мышечного сокращения у новорожденных резко растянута во времени по сравнению с кривой взрослого. Кривая тетануса новорожденного имеет пологое начало и постепенное расслабление, напоминая тетанус утомленной мышцы. Считают, что это связано с более быстрым накоплением продуктов обмена в мышцах новорожденного; г) характерным является большая эластичность мышц ран- него детского возраста; д) в процессе онтогенеза увеличивается сила и работа мышц, а также быстрота движения, но для разных групп мышц по-разному; е) важным показателем состояния нервно-мышечного аппарата является уровень поляризации мембран мышечных клеток. Он значительно ниже у детей, чем у взрослых. Так, величина мембранного потенциала у взрослых составляет 75-85 мВ, а у новорожденных – 23-40 мВ. Этот факт связан с изменением содержания ионов в клетках в разные возрастные периоды. У новорожденных отмечается низкий уровень содержания ионов К+ в клетке и больше, чем у взрослых, содержание ионов Na+; ж) в связи с недостаточностью миэлинизации нервных волокон, проведение возбуждения по ним осуществляется более медленно и менее изолировано; з) значительно снижена резистентность к действию раздражителя. Это проявляется тем, что в раннем возрасте время развития парабиоза в среднем в 10 раз короче, чем у взрослых; и) чем моложе ребенок, тем быстрее он утомляется. Это связано в основном с особенностями ЦНС, так как сама мышца практически может сокращаться без утомления длительное время. В грудном возрасте утомление наступает уже через 1,5-2 часа после начала бодрствования. Утомление может развиваться и при неподвижности, длительном торможении движений. Большое значение в детском возрасте имеет «активный» отдых /смена игр, занятий, физпаузы и пр./. Все отмеченные выше особенности нервно-мышечной системы с возрастом уменьшаются, приближаясь у детей школьного возраста к показателям взрослых. К 14-15 годам функциональное состояние нервно-мышечной системы мало чем отличается от взрослых. 2.2.5. Особенности физиологии синапсов детей Структурно-функциональное созревание нервно-мышечных синапсов охватывает период антенатального и раннего постнатального периодов развития. Оно имеет свои особенности для пре- и постсинаптических мембран. Созревание пресинаптической мембраны. Двигательные нервные окончания в мышцах появляются на 13—14-й неделе внутриутробного развития. Формирование их продолжается длительное время и после рождения. Мышечное волокно новорожденного, как и взрослого человека, имеет один синапс в виде типичной концевой бляшки. Созревание пресинаптической мембраны проявляется в увеличении терминального разветвления аксона, усложнении его формы, увеличении площади всего окончания. Степень созревания нервных окончаний значительно увеличиваются к 7—8 годам, при этом проявляются более быстрые и разнообразные движения. В процессе развития усиливается синтез ацетилхолина в мотонейронах, увеличиваются количество активных зон в пресинаптическом окончании и количество квантов медиатора, выделяющегося в синаптическую щель. Созревание постсинаптической мембраны. Когда окончание аксона достигает миотрубки, в соответствующем ее участке появляются скопления митохондрий, рибосом, микротрубок. На поверхности миотрубки образуются выемки, в которых помещается окончание аксона. Образуется примитивное нервно-мышечное соединение. Особенностью ранних стадий развития мышечных волокон является разлитая чувствительность всей поверхности мембраны к ацетилхолину, присущая донервной стадии развития мышц. В процессе развития на каждом мионе сохраняется единственный синапс, формирование его сопровождается появлением в постсинаптической мембране холинэстеразы, увеличение концентрации которой приводит к повышению скорости гидролиза ацетилхолина. Образуются складки на постсинаптической мембране, в результате чего растет амплитуда ПКП и повышается надежность передачи возбуждения через синапс. Внесинаптическая поверхность мышечного волокна постепенно теряет чувствительность к ацетилхолину. После денервации в эксперименте чувствительность к ацетилхолину вновь распространяется на всю поверхность мембраны. Вследствие незрелости нервно-мышечного синапса у плода и новорожденного синаптическая передача возбуждения происходит медленно. Без трансформации ритма через такой синапс передается не более 20 импульсов в 1 с, а к 7—8 годам жизни — около 100 импульсов в 1 с, т.е. как у взрослого. Утомляемость синапса объясняется истощением медиатора и снижением чувствительности постсинаптической мембраны к медиатору в результате накопления продуктов обмена, закислением среды — все это приводит к снижению ПКП. 4.2.ИЗМЕНЕНИЯ НЕРВНО-МЫШЕЧНОЙ СИСТЕМЫ В ПРОЦЕССЕ СТАРЕНИЯ 4.2. . Изменения нервных проводников, периферических синапсов и рецепторов в процессе старения В нервных стволах и ганглиях в процессе старения развиваются дегенеративные изменения, появляются участки демиелинизации, повышается доля соединительнотканных элементов. После 75 лет количество нервных волокон в корешках спинного мозга уменьшено на 32 %. С увеличением возраста снижаются возбудимость и лабильность нервных проводников и нервно-мышечных синапсов, повышается длительность рефракторных фаз. После 55 лет развиваются атрофические процессы в волосковых клетках кортиева органа, уменьшается число вкусовых и обонятельных рецепторов, появляются дистрофические изменения кожных рецепторов Синаптическая депрессия является причиной пессимума частоты раздражения (торможение Введенского), открытого в исследованиях на нервно-мышечном препарате. В синапсах ЦНС она обозначается термином длительная депрессия и играет важную роль в торможении условных рефлексов и процессах забывания. 5. ФИЗИОЛОГИЧЕСКИЕ ЗАКОНОМЕРНОСТИ ТРУДОВОЙ ДЕЯТЕЛЬНОСТИ ЧЕЛОВЕКА В основе различных видов трудовой деятельности лежит установка, на базе которой в центральной нервной системе (ЦНС) создается определенная программа действий, реализующаяся в целенаправленной деятельности человека, ориентированной на достижение конкретной цели. В процессе трудового действия в центральную нервную систему постоянно поступает информация о ходе выполнения программы, на основании которой возможны текущие поправки действий (сенсорные коррекции). Точность программирования и успешность осуществления программы действия зависят от опыта работающего, количества предшествующих повторений этого действия, степени автоматизма, состояния физиологических систем человека в момент работы, гигиенических условий окружающей среды. Еще до начала работы, в соответствии с имеющейся программой предстоящих рабочих действий, возрастает уровень активности физиологических систем, обеспечивающих ее последующее выполнение. Это состояние носит название предупредительной иннервации или преднастройки. Во время выполнения трудового процесса те же физиологические системы активируются еще в большей степени. Характер изменения физиологических функций определяется видом работы, величиной трудовой нагрузки, условиями окружающей среды. Совокупность напряжения физиологических функций при трудовой деятельности определяет ее физиологическую стоимость. 5.1. ИЗМЕНЕНИЯ ФИЗИОЛОГИЧЕСКИХ ФУНКЦИЙ ПРИ ФИЗИЧЕСКОМ ТРУДЕ Физическое напряжение вызывает изменения практически во всех системах организма человека, в особенности, сердечно-сосудистой и дыхательной. Выраженность этих изменений служит мерой реакции организма на физическую работу и лежит в основе классификации физического труда по степени его тяжести. 5.1.1.Изменения физиологических функций при физических нагрузках динамического характера. Основу любого физического труда составляет выраженная в различной степени активация мышечного аппарата. Тотчас после начала сокращения скелетной мышцы в ней происходит расширение сосудов и возрастание кровотока. Увеличение кровоснабжения работающих мышц происходит постепенно и достигает максимума через 60-90 с после начала работы. При тяжелой динамической работе кровоток в мышцах возрастает в 2040 раз наряду с усилением обмена веществ в них и, тем не менее, отстает от запросов метаболизма. При легкой динамической работе через 60-90 с после ее начала кровоток приходит в соответствие с метаболическими потребностями мышцы, которая начинает работать в аэробном режиме. При легкой работе энергия, необходимая для сокращения мышцы, образуется анаэробным путем только в течение короткого периода времени, на протяжении которого происходит увеличение кровотока в мышце. После этого ресинтез АТФ переходит на аэробный путь, с использованием в качестве энергетических субстратов глюкозы, жирных кислот и глицерина. В отличие от этого, при тяжелой работе, когда доставка к мышцам кислорода отстает от потребностей их метаболизма, часть энергии образуется за счет анаэробных процессов. Во время динамической работы для обеспечения активных мышц кровью значительно возрастают все показатели, характеризующие деятельность сердечно-сосудистой системы. При легкой работе с постоянной нагрузкой частота сердечных сокращений (ЧСС) возрастает в течение 3-6 мин и достигает постоянного уровня. Это стационарное (устойчивое) состояние ЧСС может сохраняться на протяжении многих часов, вплоть до окончания работы, и свидетельствует об отсутствии утомления работающего. В процессе тяжелой работы с постоянной нагрузкой стабильного уровня частота сердечных сокращений не достигает. По мере развития утомления оно увеличивается до максимума, величина которого зависит от возраста человека. Таким образом, на основании изменений частоты сердечных сокращений работу делят на: (1) легкую, неутомительную — с небольшим начальным увеличением ЧСС и последующим развитием устойчивого состояния; (2) тяжелую, утомительную — с постоянным нарастанием ЧСС вследствие утомления. Оценить степень физиологического напряжения при работе можно по характеру восстановления ЧСС. Чем тяжелее работа, тем длительнее она восстанавливается и тем больше сумма числовых значений ЧСС за этот период. Минутный объем кровообращения (МОК) также возрастает в соответствии с тяжестью работы, при этом систолический объем (СО), как один из его компонентов, возрастает на 2040% при увеличении мощности работы до 30-40% от максимальной и далее сохраняется на постоянном уровне. Систолическое артериальное давление при динамической работе возрастает как функция мощности выполняемой работы, достигая при предельных нагрузках 200-220 мм рт.ст. Диастолическое давление меняется мало, чаще даже несколько снижается, поэтому среднее артериальное давление почти всегда. повышается. Во время легкой динамической работы легочная вентиляция нарастает также как и минутный объем кровообращения в зависимости от уровня метаболической активности организма. При тяжелой работе увеличение легочной вентиляции происходит в большей степени, чем это необходимо для возрастания потребления кислорода соответствующего уровню метаболических потребностей. Это происходит вследствие накопления в крови молочной кислоты (метаболический ацидоз крови), оказывающей стимулирующее воздействие на систему дыхания. Во время и после динамической работы имеют место относительно небольшие изменения парционалыюго напряжения О2 и СО2 в артериальной крови. При тяжелой работе РСО2 в крови снижается без изменений в ней РО2. Уменьшение РСО2является следствием избыточного нарастания легочной вентиляции в ответ на снижение рН крови (накопление молочной кислоты в мышцах и в крови). Насыщение кислородом смешанной венозной крови уменьшается с ростом нагрузки. Соответственно этому артерио-венозная разница по кислороду (АВР-02) при тяжелой работе достигает у нетренированных лиц 140 мл О2/л, а у тренированных — 170 млО2/л. При физической работе увеличивается показатель гематокрита в результате снижения объема циркулирующей плазмы (вследствие ее усиленной фильтрации через стенку капилляров) и дополнительного выброса эритроцитов из мест их образования. Возрастает также количество лейкоцитов в крови (пропорционально тренированности человека, мощности и длительности работы), достигая 15000-30000 клеток в 1 мкл. Легкая работа не изменяет кислотно-основного состояния, так как избыточное количество СО2, выделяется легкими. При тяжелой работе развивается метаболический ацидоз, выраженность которого пропорциональна анаэробной мощности и, следовательно, скорости выработки лактата. В покое концентрация лактата в артериальной крови составляет около 1 ммол/л. При короткой тяжелой работе концентрация лактата может достигать 15 ммоль/л и даже больших величин. В механизмах регуляции физиологических функций при физических нагрузках важную роль играют две системы. Это, во-первых, симпато-адреналовая система. При работе из мозгового вещества надпочечников в кровь выделяется адреналин и, в меньшей степени, норадреналин. Адреналин активизирует деятельность сердечно-сосудистой системы и центральной нервной системы, мобилизует гликоген и жир из депо, стимулирует усиленную выработку циклической АМФ. Во-вторых, это гипофизарно-адреналовая система. Спустя 2-3 мин после начала работы происходит усиленное выделение аденогипофизом АКТГ, который стимулирует выделение кортикостероидов из коркового вещества надпочечников. Значение кортикостероидов состоит в увеличении работоспособности мышц, благодаря их способности усиливать мобилизацию гликогена из мышц и печени. При динамической работе потребление кислорода (также как и повышение частоты сердечных сокращений) пропорционально нагрузке (мощности работы). Вплоть до достижения максимальных величин частота сердечных сокращений и потребление кислорода человеком возрастают в линейной зависимости от мощности работы. Именно поэтому частота сердечных сокращений и потребление кислорода при динамической работе с участием крупных мышц тела могут являться критериями мощности работы и мерой физиологического напряжения (физиологической стоимости работы). В реальных условиях работы потребление кислорода организмом возрастает на величину, зависящую от нагрузки, тренированности человека и коэффициента полезного действия каждого конкретного вида деятельности. При легкой работе в скорости потребления кислорода достигается стационарное состояние, уровень которого ниже максимально возможной скорости потребления кислорода человеком и соответствует метаболическим потребностям для аэробных процессов ресинтеза АТФ. При тяжелой мышечной работе потребление кислорода возрастает постоянно, до достижения максимально возможного для человека уровня. После этого, несмотря на продолжение работы, потребление кислорода больше не увеличивается (ложное устойчивое состояние; ) в связи с тем, что уже исчерпаны все возможности кислородтранспортной системы. В этом случае работа крайне утомительна и не может продолжаться длительное время. 5.1.2.Изменения физиологических функций при физических нагрузках статического характера. При статической работе, в отличие от динамической, кровоток в мышце начинает отставать от нужд ее метаболизма, когда сила сокращения превышает 8-10% максимальной произвольной силы (МПС). Причиной уменьшения кровотока является сжатие внутримышечных сосудов давлением, которое при изометрических сокращениях с усилием более 40% максимальной произвольной силы, становится больше величины систолического артериального давления. В связи с недостаточным кровоснабжением мышц преобладающим путем энергообеспечения становится анаэробный с образованием и накоплением лактата в мышцах. Поэтому при статической работе мышц с нагрузками более 30% МПС быстро развивается утомление и снижается работоспособность. При статической работе, в отличие от динамической, имеет место небольшое увеличение минутного объема кровообращения и легочной вентиляции. Наиболее характерными изменениями в сердечно-сосудистой системе при изометрических нагрузках являются увеличение частоты сердечных сокращений и системного артериального давления. При одинаковой длительности статической работы частота сердечных сокращений и артериальное давление возрастают пропорционально силе сокращения мышц. В случае работы до отказа, то есть до момента, когда нагрузка не может больше удерживаться на прежнем уровне, частота сердечных сокращений и артериальное давление увеличиваются примерно до одинаковых величин (ЧСС до 110-140 уд/мин; АД — до 170/110 — 190/130 мм рт.ст.). Следовательно, при статической работе возрастают и систолическое, и диастолическое артериальное давление. При этом прирост системного артериального давления в малой степени зависит от объема работающих мышц. Так, например, при сокращении до отказа мышц, приводящих большой палец кисти (МПС 12 кг) и мышц голени (МПС 190 кг) с усилением в 40% максимальной произвольной силы, артериальное давление повышается до 170/110 мм рт.ст. Столь значительные изменения в сердечно-сосудистой системе при локальной статической работе обусловлены активацией нервных центров, управляющих деятельностью сердца и сосудов, как импульсами от рецепторов самих мышц, работающих в ишемических условиях, так и вследствие иррадиации возбуждения к ним из моторной зоны коры. 5.1.3. Характеристика тяжести и напряженности труда. Для рациональной организации режимов работы и отдыха, а также нормирования трудовой деятельности, требуется объективная оценка физической тяжести и нервной напряженности труда. Понятие физической тяжести труда отражает, в основном, нагрузку на нервно-мышечный аппарат человека. Ее оценивают как по эргометрическим показателям работы, так и по степени изменения физиологических функций во время ее выполнения. К первым относят мощность внешней нагрузки величины переносимого груза, перемещения рабочего в пространстве, характер рабочей позы, величину статической нагрузки. Из физиологических показателей для оценки тяжести работы используют величины энерготрат, среднерабочую частоту сердечных сокращений, минутный объем и частоту дыхания, степень утомления работающего. По уровню физической тяжести выделяют четыре группы работ: 1 — легкая работа; 2 — средней тяжести; 3 — тяжелая; 4 — очень тяжелая. Значительно сложнее оценить степень нервной напряженности труда, под которой понимают преимущественно нагрузку на центральную нервную систему. Хотя изменения физиологических функций (частота сердечных сокращений, артериальное давление, дыхание и др.) связаны со степенью нервной напряженности трудовой деятельности, такой закономерной зависимости, как это имеет место при физическом труде, в данном случае не наблюдается. Поэтому помимо физиологических показателей (прирост частоты сердечных сокращений, артериального давления, изменения дыхания, выброс в кровь катехоламинов) для оценки степени нервной напряженности трудовой деятельности используют также эргометрические показатели нагрузки на нервно-психическую сферу человека. Чаще применяют критерии, характеризующие степень напряжения внимания, длительность сосредоточенного наблюдения, время активных действий, объем оперативной памяти, сменность работы, степень ее монотонности. В зависимости от количественных характеристик этих признаков труд подразделяют на четыре группы: 1 — ненапряженный; 2 — малонапряженный; 3 — напряженный; 4 — очень напряженный. Таким образом, произведя необходимые физиологические исследования на протяжении рабочей смены и получив профессиографическую характеристику трудовой деятельности, можно отнести работу человека к соответствующей группе нервно-напряженного труда. Затем, для каждой из них разрабатывают практические рекомендации, направленные на снижение утомления и увеличение работоспособности. 5.2. ИЗМЕНЕНИЯ ФИЗИОЛОГИЧЕСКИХ ФУНКЦИЙ ПРИ УМСТВЕННОМ ТРУДЕ. Умственный труд, в отличие от физического, характеризуется менее выраженными изменениями функций в организме. В то же время показатели деятельности нервной, эндокринной, сердечно-сосудистой и дыхательной систем во время умственной деятельности свидетельствуют о возрастании нервного напряжения, которое обусловлено несколькими факторами трудового процесса: 1) необходимостью одновременного наблюдения за несколькими меняющимися во времени производственными процессам; 2) восприятием и переработкой большого объема разнообразной информации; 3) дефицитом времени для переработки значимой информации и принятия решения; 4) частым переключением внимания с одного объекта наблюдения на другой и необходимостью использования разных информационных потоков; 5) необходимостью поддержания в течение длительного времени высокой интенсивности внимания, памяти, мышления; 6) выполнением работ в ночное время; 7) возможностью возникновения аварийной ситуации и дефицитом времени, отпущенного на ее устранение; 8) повышенной ответственностью за принимаемые решения. Специфической особенностью умственного труда является сопутствующее ему изменение функционального состояния центральной нервной системы. Психические процессы сопровождаются активацией как специфических, так и неспецифических образований мозга. Генерализованные изменения активности мозга сопровождают любой вид умственного труда, а локальные процессы активации развиваются в различных областях коры и глубоких структур мозга в зависимости от вида деятельности (перцептивной, моторной, вербальной, мнестической и др.). Значительная роль в осуществлении психических функций принадлежит лобным долям мозга. Благодаря своим многочисленным связям с неспецифическими структурами разных уровней, лобные доли участвуют в неспецифических формах активации, необходимых для реализации любого акта. В лобных долях объединяется обширная информация об эмоциональном состоянии человека, поступающая из внешнего мира, от внутренней среды организма, а также от нижележащих структур мозга и центров старой коры. Активация различных структур головного мозга в процессе умственной деятельности вызывает повышение уровня обменных процессов в этих структурах, а значит, и усиление в них кровотока и доставки кислорода. Общая же величина кровоснабжения головного мозга мало меняется при различных видах умственной деятельности (выраженная ауторегуляция кровотока в сосудах мозга). При этом постоянно и количество потребляемого основного энергетического субстрата мозга — глюкозы (около 80 мг/мин). Поэтому увеличение поступления кислорода и энергетических веществ к усиленно работающим зонам мозга обеспечивается за счет внутреннего перераспределения поступающего в мозг потока крови. Менее активные области получают крови меньше, чем более активные. Так, в частности, во время мышечной работы умеренной интенсивности, при почти не меняющейся общей величине кровоснабжения мозга, регионарный кровоток в моторной зоне возрастает на 50% по отношению к уровню покоя. При работе, требующей напряжения зрительного анализатора, усиливается кровоснабжение зрительной области коры. При максимальном напряжении функции кровоток, в структурах мозга ее обеспечивающих, может увеличиться в два раза и больше. Умственная работа, связанная с нервно-эмоциональным напряжением, вызывает повышение активности симпато-адреналовой и гипоталамо-гипофизарноадренокортикалъной систем, обеспечивающих проявление вегетативных компонентов эмоций. При эмоциональном возбуждении увеличиваются синтез катехоламинов в надпочечниках, их метаболизм в тканях и органах, усиливается выделение норадреналина в симпатических окончаниях. Следствием этого является повышение содержания в крови катехоламинов и кортикоидов. Все это приводит к активации минерального, углеводного и жирового обменов, повышению возбудимости центральной нервной системы, усилению сократительной функции мышц, деятельности сердечно-сосудистой и дыхательной систем. С увеличением нервно-психического напряжения при умственной деятельности вследствие повышения активности симпато-адреналовой системы изменяется состояние сердечно-сосудистой и дыхательной систем. Увеличиваются частота сердечных сокращений и артериальное давление, изменяется соотношение амплитуд зубцов ЭКГ. Увеличивается частота дыхания, снижается дыхательный объем, нарушается структура дыхательного цикла. Напряженная умственная деятельность сопровождается значительным увеличением обмена веществ. Это связано с тем, что происходит непроизвольное сокращение скелетных мышц, не имеющих прямого отношения к выполняемой работе. В условиях возрастающей психоэмоциональной нагрузки у человека нередко возникают трудноподавляемые двигательные беспокойства (жестикуляция, хождение и т.д.). В случае произвольного подавления или ограничения подобных двигательных реакций компенсаторно усиливается познотоническое (изометрическое) напряжение скелетной мускулатуры. 5.2.1.Физиологическая характеристика труда в условиях зрительного напряжения. Под контролем зрения совершается до 80-90% трудовых операций. Множество тонких и точных операций выполняется в электронной и приборостроительной промышленности. К этому же виду работ относят труд операторов радиотехнических и видеотерминальных устройств, сортировщиков, огранщиков драгоценных камней, картографов и др. Все эти профессии объединяет один общий фактор — зрительное напряжение, которое может служить и самостоятельным фактором, определяющим физиологическую нагрузку на организм работающих, и усиливать напряженность умственного труда в случаях, когда зрительное напряжение сочетается с другими факторами трудового процесса (дефицит времени, высокая ответственность, плохая освещенность). Значительное место среди работ, вызывающих зрительное напряжение, занимает труд операторов, работающих на дисплеях ЭВМ. Такая работа приводит к развитию зрительного утомления. Причиной этого являются фиксация близко расположенных, двигающихся объектов, длительное рассматривание мелких деталей, постоянный перевод взгляда с одного объекта на другой (нередко, разных размеров), частые и резкие переходы от света к тени и обратно, пульсации освещенности и др. К неблагоприятному воздействию этих факторов добавляется строго фиксированная рабочая поза и гипокинезия. Кроме того, работа за видеотерминалами требует большого нервно-психического напряжения, связанного с необходимостью длительного наблюдения, концентрации памяти и внимания, решения сложных задач. При работе в условиях зрительного напряжения изменяется рефракция и аккомодационная способность глаз, ухудшается контрастная чувствительность, снижается устойчивость хроматического и ахроматического видения, сокращаются границы поля зрения, снижается острота зрения и скорость восприятия и переработки информации. Все эти изменения свидетельствуют о развитии зрительного утомления. При чрезмерной интенсивности зрительного напряжения утомление накапливается и приводит к развитию перенапряжения, а затем и к возможности патологии зрительного аппарата. Объективными симптомами перенапряжения являются понижение способности глаз фокусировать и фиксировать объект наблюдения, значительное уменьшение объема аккомодации, ухудшение бинокулярного зрения, вплоть до появления дисплопии. Появляются «вуаль» перед глазами, затуманенность объекта, размывание очертаний предмета. 5.3. ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ЧЕЛОВЕКА В ПРОЦЕССЕ МОНОТОННОГО ТРУДА. Монотонный (однообразный) труд характеризуется либо выполнением на протяжении рабочего дня простых операций, либо работой с сенсорной или умственной нагрузкой низкой или средней интенсивности. При выполнении такой работы у человека возникает состояние монотонии. Монотонный труд делят на две основные категории. Это, во-первых, труд при котором состояние монотонии возникает в результате выполнения несложных однообразных действий, требующих небольших затрат энергии (труд на конвейерах и поточных линиях). Во-вторых, это труд, при котором состояние монотонии возникает в связи с однообразием обстановки и дефицитом поступающей информации. Например, труд оператора в условиях низкой ответственности, небольшого количества объектов наблюдения, «бедности» внешних раздражителей. Влияния монотонного труда на человека многообразны и проявляются, прежде всего, в изменении функционального состояния различных отделов центральной нервной системы: от высших центров коры большого мозга до спинальных мотонейронов. Типичным их них является снижение возбудимости и активности нервных структур, ответственных за поддержание соответствующего уровня бодрствования и бдительности. Ведущая роль в этих процессах принадлежит ретикулярной формации. При синдроме монотонии механизмы уменьшения активности корковых центров могут состоять в следующем. 1) Усиливаются тормозные влияния ретикулярной формации (активное тормозное действие). Это имеет место при монотонном труде 1-го типа, когда вследствие длительного повторения действия раздражителя (например, установка заготовки под пресс) усиливаются тормозные влияния ретикулярной формации, снижается возбудимость нервных центров на разных уровнях центральной нервной системы. 2) Снижаются активирующие влияния ретикулярной формации на функции центральной нервной системы (пассивное тормозное действие ретикулярной формации). Такая ситуация складывается при монотонном труде 2-го типа, когда развитие состояния монотонии обусловлено монотонностью обстановки и дефицитом информации, поступающей в центральную нервную систему. Вследствие уменьшения важной для работы информации, т.е. отсутствия адекватной нагрузки на высшие корковые функции, резко уменьшается поток импульсов по кортикофугальным путям ретикулярной формации. В то же время снижается объем импульсации по коллатералям неспецифических восходящих путей. Благодаря этому, происходит уменьшение активирующих влияний ретикулярной формации и снижение ее стимулирующего действия на кору головного мозга и на другие нервные центры регуляции вегетативных и соматических функций. Рассмотренные механизмы приводят к снижению уровня бодрствования у работающих, нарушению адекватности реакции человека на внешние раздражители, ухудшению автоматизма и точности двигательных действий, снижению внимания, нарушению способности к переключениям с одного вида деятельности на другой, к изменению биологических ритмов человека. Снижение активности центральной нервной системы, проявляющееся в субъективных ощущениях скуки, апатии и сонливости приводит, в конечном итоге, к снижению "надежности" работающего человека, следствием чего может являться возрастание брака выпускаемой продукции, возникновение различного рода аварий (на транспорте, на поточных линиях, на производствах, управляемых операторами). Помимо центральной нервной системы, монотонная работа приводит к изменениям вегетативных функций, причиной которых является снижение активности симпато-адреналовой системы. В процессе работы снижаются (на 20-30%) частота сердечных сокращений и артериальное давление, причем систолическое — в большей мере, чем диастолическое. Выраженное уменьшение частоты дыхания, развивающееся уже после 1,5-2 часов работы, также характерно для состояния монотонии. 5.4. ГИПОКИНЕЗИЯ ЧЕЛОВЕКА В ПРОЦЕССЕ ТРУДОВОЙ ДЕЯТЕЛЬНОСТИ Типичной чертой профессиональной деятельности большинства работников являются низкие физическая активность и, соответственно, затраты энергии на протяжении рабочего дня. Преобладающими стали работы в вынужденной рабочей позе, с небольшими по величине локальными физическими нагрузками, с монотонностью действия или обстановки. У лиц малоподвижных профессий общие энергозатраты, как правило, составляют не более 1,5-2,2 ккал/мин, а затраты энергии на физическую активность не превышают 800-1200 ккал в сутки, т.е. находятся за пределами даже ориентировочной нижней границы «нормы» (1200 ккал/сут). В большинстве случаев недостаток двигательной активности во время работы не восполняется и во внерабочее время. Последствия длительной гипокинезии. связанной с характером трудовой деятельности, неблагоприятны как в медико-биологическом, так и социально-экономическом отношениях. Это обуславливает рассмотрение гипокинезии в качестве одного из ведущих неблагоприятных факторов трудового процесса, влияющего на состояние здоровья и работоспособность человека. В механизме снижения функциональных резервов организма человека и его работоспособности под влиянием гипокинезии выделяют четыре ведущих момента. 1) Изменения в нервно-мышечной системе под влиянием гипокинезии приводят к снижению активности метаболических процессов в мышечных клетках, ухудшению функций сокращения и расслабления мышцы, значительному снижению их силы и выносливости, а значит, и работоспособности. Все это приводит к увеличению тяжести труда (его физиологической стоимости). 2) Уменьшение функциональных возможностей центральной нервной системы при длительном недостатке физической активности человека приводит к снижению устойчивости работающих лиц к действию стрессогенных факторов, увеличению утомляемости человека при умственной работе, повышению нервной напряженности труда, увеличению утомления в сфере зрительного и слухового анализатора. 3) Под влиянием пониженной двигательной активности на производстве и в быту значительно снижаются кислородтранспортные возможности организма и, следовательно, общая физическая работоспособность; возрастают реакции сердечно-сосудистой системы на одни и те же физические и эмоциогенные раздражители; снижаются возможности человека работать в экстремальных условиях; увеличиваются заболевания сердечно-сосудистой и дыхательной систем. 4) Снижение специфической и неспецифической резистентности организма человека под влиянием гипокинезии приводит к увеличению у одних и тех же лиц числа заболеваний как инфекционной, так и неинфекционной природы. Таким образом, гипокинезия, обусловленная характером трудового процесса, приводит к снижению функциональных возможностей многих систем организма человека и, в конечном итоге, к уменьшению его работоспособности и ухудшению состояния здоровья. Интегральными показателями степени воздействия на человека гипокинезии, а также уровня его физического здоровья являются величины общей физической работоспособности (PWC170, мл/мин.кг), оцениваемые по мощности работы при частоте сердечных сокращений в 170 уд/мин и уровню максимального потребления кислорода (МПК, мл/мин.кг). 5.5. ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ ТРУДОВЫХ НАВЫКОВ Процесс трудового обучения и формирования наиболее экономичных (с точки зрения затрат энергии) и рациональных рабочих действий проходит три этапа развития, каждый из которых имеет свою физиологическую основу. На первом этапе обучения новым, непривычным трудовым действиям движения человека в плане координации несовершенны вследствие недостаточно сформированной системы трудовых навыков. В работе принимает участие большее, чем нужно для ее выполнения, количество мышц. В целом, на первом этапе обучения, который обозначают термином "фаза генерализации", движения мало эффективны, на работу затрачивается больше энергии, чем она того требует. На этом этапе одна и та же работа более тяжела и утомительна, чем на последующих. На втором этапе обучения, способствующего становлению трудового навыка, процессы возбуждения в двигательных центрах концентрируются. Движения становятся плавными и координированными, осуществляются более экономично с точки зрения затрат энергии. Работать становится легче и менее утомительно. Третий этап формирования трудовых навыков называют «фазой стабилизации и образования устойчивой доминанты». Рабочие движения становятся высококоординированными и экономичными. В работе принимают участие лишь те мышцы, которые непосредственно обеспечивают достижение конечного результата труда. Стабильный и высокий уровень работоспособности поддерживается на протяжении всего рабочего дня. В процессе обучения, на завершающем его этапе, формируется динамический стереотип, то есть цепь психомоторных реакций, выработанная в ответ на постоянно повторяющееся действие одних и тех же раздражителей (последовательная цепь рабочих действий, сигналов). В этом случае достаточно одного начального раздражителя (вербального, зрительного, звукового, образного и др.), чтобы запустить в ход всю программу рабочих действий. При хорошо закрепленном динамическом стереотипе условнорефлекторные связи достигают автоматизма. Благодаря этому, исключаются лишние мышечные напряжения и лишние движения, ускоряются программирование и текущая коррекция движений, закрепляются ассоциативные связи между рефлексами, составляющими рабочий динамический стереотип. В результате, рабочие действия становятся более экономичными, менее утомительными, менее подверженными влиянию внешних раздражителей, не требуют постоянного сосредоточения внимания. Таким образом, в процессе обучения в организме работающего возникает ряд приспособительных изменений, обеспечивающих повышение интенсивности трудовой деятельности, увеличение работоспособности. ее эффективности, длительное поддержание высокой 5.6. РАБОТОСПОСОБНОСТЬ И УТОМЛЕНИЕ Работоспособность — это свойство человека на протяжении длительного времени и с определенной эффективностью выполнять максимальное количество физической или умственной работы. На протяжении рабочей смены работоспособность меняется в широких пределах. Это связано с тем, что на нее влияют как внешние, по отношению к человеку факторы (характер труда, условия окружающей среды, режимы труда и отдыха, рабочая поза, организация трудового процесса с точки зрения эргономики), так и внутренние (мотивация, степень совершенства трудовых навыков, функциональные резервы человека). В производственной обстановке работоспособность изменяется на протяжении рабочей смены и условно подразделяется на четыре фазы. Первая фаза — фаза врабатывания, во время которой повышается активность ЦНС, возрастает уровень обменных процессов в организме работающего, усиливается деятельность сердечно-сосудистой и дыхательной систем. Продолжительность этой фазы зависит от вида деятельности. Она всегда короче при физическом труде, чем при умственном. Причем, чем физически тяжелее работа, тем быстрее происходит врабатывание. Вторая фаза — фаза относительно устойчивой работоспособности, характеризуется оптимальным, с точки зрения достижения полезного результата, уровнем функционирования обеспечивающих работу систем организма, максимальной эффективностью труда. Продолжительность периода устойчивой работоспособности зависит от физической тяжести и нервной напряженности труда (чем тяжелее работа, тем короче период устойчивой работоспособности), от психофизиологического состояния человека, от гигиенических условий труда. Третья фаза — фаза снижения работоспособности, связанная с развитием утомления. Четвертая фаза — фаза вторичного повышения работоспособности в конце рабочего дня. В ее основе лежит условнорефлекторный механизм, связанный с предстоящим концом работы и последующим отдыхом. Аналогичным образом меняется профессиональная работоспособность человека и на протяжении рабочей недели. Причиной снижения работоспособности на протяжении рабочего дня, недели или года является утомление. Во время работы утомление проявляется в уменьшении силы и выносливости мышц, ухудшении координации движений, в возрастании затрат энергии при выполнении одной и той же работы, в замедлении скорости переработки информации, ухудшении памяти, затруднении процессов сосредоточения и переключения внимания с одного вида деятельности на другой. Субъективно утомление проявляется в ощущении усталости, вызывающего желание прекратить работу или снизить нагрузку. При динамической работе с интенсивностью, лежащей ниже предела утомления, восстановление макроэргических фосфатов, используемых при сокращении мышц, происходит на протяжении самой работы, во время расслабления мышц (микропауз). Если продолжительность расслабления мышц соответствует времени, необходимому для синтеза АТФ и удаления из них продуктов метаболизма, то такая работа является малоутомительной. При динамической работе большой интенсивности возможность непрерывного восстановления АТФ в процессе самой работы отсутствует. Это объясняется тем, что длительность периодов расслабления мышцы меньше, чем время, необходимое для текущего восстановления ее энергетического потенциала. Восстановление запасов энергии и удаление молочной кислоты из мышц происходят неполностью. Физиологические механизмы нервно-психического утомления точно не известны. Типичными симптомами такого утомления являются замедление передачи и осмысления информации, снижение эффективности умственной деятельности в целом, ослабление сенсорных и сенсомоторных функций. Подобное утомление не только снижает работоспособность, но иногда приводит к снижению социальной активности человека, раздражительности, эмоциональной нестабильности, беспричинной тревоге и даже депрессии. Нервно-психическое утомление возникает в следующих ситуациях: 1) при длительной и напряженной умственной работе, требующей усиленной концентрации внимания, решения сложных производственных задач в условиях дефицита времени; 2) при тяжелом физическом труде; 3) при однообразной монотонной работе; 4) при труде в условиях слабой освещенности, повышенной температуры, шума и вибрации; 5) при частых конфликтных ситуациях в коллективе, отсутствии интереса к работе, несоответствии психофизиологических возможностей человека характеру его трудовой деятельности. В отличие от мышечного утомления, утомление центрального происхождения (нервнопсихическое) может быстро исчезать. Это происходит, например, в ситуациях, когда один вид деятельности сменяется другим; человек попадает в стрессовые ситуации, угрожающие его жизни; если появляется новая информация, повышающая интерес к работе. Поскольку утомление в нервно-психической сфере может проходить столь быстро, это свидетельствует о том, что его первопричиной не являются ни уменьшение энергетических субстратов в нервных структурах, ни накопление в них продуктов метаболизма, ни недостаточное кровоснабжение головного мозга. Любой вид труда не будет приводить к развитию переутомления и перенапряжения и, напротив, окажет положительное влияние на работоспособность и здоровье человека, если придерживаться физиологических принципов его рациональной организации. 5.6.1. Физиологические основы рациональной организации трудовых процессов Рациональные режимы труда и отдыха. Работоспособность человека определяется условиями его работы и отдыха. За время отдыха физиологические показатели, изменившиеся в процессе работы, должны возвратиться к исходному уровню. Поэтому среди мер физиологической рационализации трудовой деятельности ведущее место занимают физиологически обоснованные режимы труда и отдыха, представляющие собой систему чередования периодов работы и отдыха на протяжении рабочей смены, недели или года. Эта система регламентирует время начала, продолжительность и содержание периодов отдыха. Разработка рациональных режимов труда и отдыха возможна лишь на основе психофизиологических исследований функционального состояния человека в процессе труда. Правильно организованные режимы чередования периодов работы и восстановления являются одним из наиболее эффективных способов сохранения высокой работоспособности и здоровья человека. При построении рациональных внутрисменных режимов труда и отдыха организаторы производства руководствуются следующими принципами: 1) процесс включения в работу (фаза врабатывания) занимает меньше времени при использовании специальных активирующих воздействий (вводная гимнастика, музыкальные передачи); 2) на протяжении рабочей смены необходимо устраивать микропаузы в работе и регламентированные перерывы на отдых. В зависимости от тяжести и напряженности труда время на отдых может составлять 9-10% рабочего времени; 3) регламентированные перерывы будут эффективными лишь тогда, когда они назначаются на начальных стадиях развития утомления; 4) продолжительность периодов отдыха зависит от тяжести и напряженности труда. Так, при легкой работе на конвейере длительность перерывов должна быть 5-7 мин, а при тяжелой физической работе — 20-25 мин. При особо физически тяжелых работах 15-20 минутные периоды работы необходимо чередовать с такими же по продолжительности периодами отдыха. При работах, требующих нервного напряжения и внимания, а также точных, мелких движений пальцев в высоком темпе и в условиях повышенной монотонности, целесообразно устраивать работающим лицам частые, но короткие (5 -10 мин) перерывы; 5) чем тяжелее и напряженнее работа, тем ближе по времени к началу смены (или к обеденному перерыву для второй половины рабочего дня) должны быть введены регламентированные перерывы; 6) во второй половине рабочего дня, в связи с более выраженным утомлением, количество перерывов на отдых должно быть больше, чем в первой половине смены; 7) перерыв на обед, длительностью 40-60 мин, целесообразно предоставлять в середине рабочего дня или с отклонением от нее в пределах до одного часа; 8) характер заполнения перерыва (активный или пассивный отдых, использование физических и психостимулирующих средств рекреации) зависит от вида трудовой деятельности. 5.6.2. Физиологические принципы профилактики перенапряжений опорнодвигательного аппарата. Основными этиологическими факторами развития перенапряжений и связанных с ними заболеваний нервно-мышечного и костно-суставного аппарата человека являются чрезмерные по интенсивности физические нагрузки (количество совершаемых за смену движений пальцев рук, величины усилий развиваемых мышцами, вес поднимаемого груза) и нерациональная, вынужденная рабочая поза. Следовательно, оздоровительные мероприятия, направленные на предупреждение развития переутомления и перенапряжения, должны обеспечивать следующее: 1) ограничение верхнего предела энерготрат при глобальной, региональной или локальной мышечной работе в течение 7- 8 часов соответственно 4,2; 2,8 и 1,7 ккал/мин; 2) уменьшение числа движений пальцев рук (менее 80 000 за смену) и статических напряжений мышц (менее 15% максимальной произвольной силы); 3) снижение величин динамических напряжений мышечного аппарата при выполнении рабочих операций; 4) рациональную организацию режимов труда и отдыха с регламентированными перерывами для выполнения рекреационных процедур, ускоряющих процессы восстановления (например массаж, гидромассаж, электростимуляция мышц); 5) организацию труда в пределах оптимальной рабочей зоны для позы стоя и сидя; 6) использование рабочей мебели, соответствующей антропометрическим характеристикам человека; 7) смену рабочих поз и исключение их однообразия. Принципы профилактики зрительного утомления и перенапряжения. Снижение зрительного переутомления достигается реализацией следующих рекомендаций: (1) устранить пульсации освещенности рабочего места, постоянную смену полей зрения, резкие световые и цветовые контрасты, сильную освещенность, слепящие поверхности; 2) при работе с дисплеями необходимо регламентировать яркость фонового свечения экрана, яркость и контрастность изображения на экране, цвет свечения экрана и высвечивания информации, частоту мельканий изображений, ширину линий. По своему усмотрению операторы должны иметь возможность изменять наклон корпуса, высоту пульта с клавиатурой, высоту экрана, расстояние от экрана до глаз, наклон экрана; 3) с целью предотвращения развития перенапряжения органов зрения необходимо соблюдать правильный режим труда и отдыха, включающий распорядок и продолжительность рабочего дня, введение регламентированных перерывов в работе, сеансов релаксации, выполнение упражнений для глаз, соблюдение рекомендаций по организации активного отдыха; 4) проведение окулистами отбора лиц на работу, требующую напряжения органов зрения. Принципы профилактики отрицательных последствий труда в условиях монотонии. Мероприятия, способствующие ограничению развития монотонии, должны быть направлены на повышение уровня активности центральной нервной системы и обеспечение работающих лиц оптимальной информационной и двигательной нагрузками. Речь идет об использовании большого комплекса организационно технических и психофизиологических мер. Среди них первостепенное значение имеют: 1) организация работ таким образом, чтобы производственные операции имели смысловую и структурную завершенность и продолжались не менее 30 с., а межоперационные микропаузы составляли не менее 15% оперативного времени; 2) внезапные ускорения темпа работы на 5-10% по 1-2 мин 2-3 раза в час; 3) периодическая смена заданного темпа и ритма работы на относительно свободный; 4) укрупнение производственных операций, освоение смежных операций и их чередование; 5) изменения скорости движения конвейера в соответствии с динамикой работоспособности человека; (6) внедрение режимов работы и отдыха, способствующих уменьшению ощущения монотонии; 7) использование в качестве средств, повышающих уровень бодрствования, производственной гимнастики, музыкальных передач, дополнительной интересной информации; 8) профотбор и профориентация лиц для работы в условиях монотонного труда. Принципы оптимизации умственного труда и труда, вызывающего нервнопсихическое напряжение. Рекомендации, ориентированные на повышение продуктивности умственного труда и снижение нервно-психического напряжения, заключаются в следующем: 1) поддерживать свои профессиональные знания на уровне, достаточном для решения любых возникающих во время работы задач; 2) поддерживать умеренный и постоянный уровень производственной нагрузки; 3) соблюдать ритмичность в работе; 4) создавать условия для формирования положительных эмоций и возможности для быстрого снятия отрицательных; 5) перерывы на отдых должны быть заполнены деятельностью, снимающей психоэмоциональное напряжение (физическая активность, психологическая разгрузка, специальные психогигиенические процедуры); 6) во внерабочее время 3-4 раза в неделю по 30-40 мин выполнять физические упражнения с интенсивностью в переделах 70-75% от индивидуальной максимальной частоты сердечных сокращении. 6.ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ ФИЗИЧЕСКОЙ КУЛЬТУРЫ И СПОРТА Спортивная физиология — один из разделов физиологии человека, основным содержание которого является изучение механизмов физиологических функций в процессе выполнения различных спортивных упражнений. 6.1. Классификация различных видов мышечной деятельности При физиологической систематизации мышечной работы в качестве классификационных признаков выделяют объем активной мышечной массы, тип мышечных сокращений, силу и мощность сокращений мышц, энерготраты. В зависимости от объема работающих мышц выделяют локальные нагрузки, при которых активируется менее 1/3 всей мышечной массы тела, регионарные, когда сокращается от 1/3 до 2/3 всей мышечной массы, и глобальные, в осуществлении которых задействовано более 2/ 3 всей мышечной массы тела. При занятиях физической культурой и спортом большее число нагрузок относится к глобальным. В соответствии с типом сокращения основных мышц, осуществляющих выполнение заданной работы, выделяют статические (сохранение фиксированной позы, некоторые упражнения у гимнастов, стойка стрелка и др.) и динамические напряжения (ходьба, бег, езда на велосипеде, плавание и др.). С учетом зависимости «нагрузка — скорость укорочения мышцы» при динамической работе проявляемая сила обратно пропорциональна скорости укорочения мышцы. Это означает, что чем больше внешняя нагрузка на мышцу, тем меньше скорость движения участка (звена) тела или укорочения мышцы. По проявлению силы мощности сокращений мышц физические упражнения подразделяются на: 1) силовые; 2) скоростно-силовые; 3) упражнения на выносливость. При мышечной деятельности силового характера основные мышцы, участвующие в работе, развивают максимальное или почти максимальное напряжение в статическом или динамическом режиме, при малой скорости движений в условиях большого внешнего сопротивления. К скоростно-силовым относят такие виды работы, при которой ведущие мышечные группы проявляют относительно большую силу (30-50% от максимальной) и скорость сокращения (30-60% от максимальной скорости укорочения). При работе на выносливость активные мышцы развивают не очень большие по силе и скорости сокращения, но способны выполнить их на протяжении от нескольких десятков минут до многих часов. По показателям энерготрат работу обычно подразделяют на легкую, умеренную, тяжелую и очень тяжелую. По мощности, развиваемой человеком во время выполнения различных видов спортивных упражнений, выделяют работу максимальной мощности (предельное время такой работы 20-30 с), субмаксимальной мощности (от 20-30 с до 3-5 мин), большой мощности (от 3-5 мин до 30-40 мин) и относительно умеренной мощности (больше 30-40 мин). Эти зоны мощности являются общими для всех циклических движений. В зависимости от характера изменений структуры движений во времени все их виды делят на циклические и ациклические. К циклическим упражнениям относят бег, езду на велосипеде, бег на лыжах и т.д. Для циклической работы характерно многократное повторение стереотипных движений при относительно постоянной силе и скорости сокращения. При ациклических упражнениях (метания, прыжки, единоборства, гимнастические упражнения, спортивные игры и др.) постоянно меняется не только характер двигательной активности, но и мощность выполняемой работы. 6.2. Физиологическая характеристика состояний организма при спортивной деятельности Во время тренировочных занятий или соревнований в изменениях функционального состояния организма человека выделяют три периода: предстартовый, основной (период работы) и восстановительный. Предстартовое состояние. В предстартовом состоянии, возникающем за несколько минут или часов до начала соревнований, возрастают частота сердечных сокращений, систолический объем и минутный объем кровообращения, повышается артериальное давление, возрастают легочная вентиляция, энерготраты, температура тела. Предстартовые изменения функций являются условно-рефлекторными реакциями. Они готовят организм в целом к предстоящей работе и ускоряют процессы врабатывания. Обусловлены эти изменения усилением деятельности симпато-адреналовой системы, о чем свидетельствует повышение концентрации норадреналина и адреналина в крови еще до начала работы. В зависимости от характера изменений физиологических функций и эмоционального статуса спортсмена выделяют три вида предстартовых состояний: первый — характеризуется умеренным эмоциональным возбуждением и обеспечивает высокий спортивный результат; для второго — характерно повышенное возбуждение центральной нервной системы, под влиянием которого работоспособность может как увеличиваться, так и уменьшаться; третий вид состояний отличается преобладанием тормозных процессов, приводящих, как правило, к снижению спортивного результата. Изменения состояния организма при разминке. Разминка — комплекс специальных упражнений, выполняемый перед тренировкой или соревнованием и способствующий ускорению процесса врабатывания, повышению работоспособности. Физиологические эффекты разминки разнообразны. Она повышает возбудимость и активность сенсорных, моторных и вегетативных центров, усиливает деятельность эндокринных желез, создавая тем самым условия для более эффективной регуляции вегетативных и моторных функций при последующей работе. Повышается температура тела и, особенно, работающих мышц, благодаря чему увеличивается активность ферментов и, следовательно, скорость биохимических реакций в мышечных волокнах, возбудимость и лабильность мышц, повышается скорость их сокращения. Разминка усиливает работу систем, обеспечивающих транспорт кислорода к работающим мышцам. Возрастают легочная вентиляция, скорость диффузии Од из альвеол в кровь, минутный объем кровообращения, расширяются артериальные сосуды скелетных мышц, увеличивается венозный возврат, повышается (благодаря увеличению температуры тела) интенсивность диссоциации оксигемоглобина в тканях. Разминка спортсмена бывает общей и специальной. Общая разминка состоит из упражнений, способных повысить возбудимость центральной нервной системы, температуру тела, активизировать систему транспорта кислорода. Специальная часть разминки по своей структуре должна быть как можно ближе к характеру предстоящей деятельности. Врабатывание. Постепенное увеличение работоспособности человека в начале выполнения спортивных упражнений называется врабатыванием. В это время происходит перестройка нейрогуморальных механизмов регуляции движений и вегетативных функций на новый, более напряженный режим деятельности и улучшение координации движений. Скорость усиления деятельности физиологических систем во время врабатывания неодинакова. Двигательный аппарат, обладающий относительно высокой возбудимостью и лабильностью, на новый рабочий уровень настраивается быстрее, чем вегетативные системы. Так, например, во время интенсивного бега максимальная скорость движения достигается к 5-6 с. В то же время расширение артериальных сосудов мышц происходит за 60-90 с, а частота сердечных сокращений, систолический объем и минутный объем кровообращения достигают максимальных величин только через 1,5-2 мин. Даже при работе максимальной аэробной мощности требуемый уровень потребления кислорода достигается лишь через 2- 3 мин. В связи с тем, что транспорт кислорода усиливается постепенно, в начале любой работы сокращение мышц осуществляется, в основном, в анаэробных условиях. Разница между потребностью организма в кислороде во время периода врабатывания и его реальным поступлением называется кислородным дефицитом. При не тяжелых нагрузках дефицит кислорода покрывается еще во время самой работы. При выполнении суб максимальных и максимальных физических упражнений возникающий дефицит кислорода ликвидируется после завершения работы, составляя часть общего кислородного долга. Скорость изменения физиологических функций во время врабатывания зависит от интенсивности (мощности) выполняемой работы. Чем больше мощность, тем быстрее происходит усиление деятельности сердечно-сосудистой и дыхательной систем. При одинаковых по характеру и мощности упражнениях врабатывание происходит тем быстрее, чем выше уровень тренированности человека. Состояние физиологических функций при работе. После окончания периода врабатывания при длительной аэробной работе возникает устойчивое состояние, на протяжении которого работоспособность и показатели физиологических функций, обеспечивающих транспорт кислорода, меняются незначительно. При работе максимальной и субмаксимальной мощности период устойчивого состояния отсутствует, так как на всем ее протяжении происходит постоянное нарастание частоты сердечных сокращений, систолического объема, минутного объема кровообращения и, соответственно, потребления О2. Различают истинное и ложное устойчивое состояние физиологических функций при работе. Истинное устойчивое состояние характеризуется высокой согласованностью работы двигательного аппарата и вегетативных систем, участвующих в ее обеспечении. Функции сердечно-сосудистой и дыхательной систем не достигают своих предельных величин. Ресинтез макроэргических фосфорных соединений происходит за счет аэробных окислительных реакций. Потребление кислорода, как правило, ниже максимально возможных для человека величин. Молочная кислота почти не накапливается в мышцах, что обеспечивает сохранение кислотно-основного равновесия в жидких средах организма. При ложном устойчивом состоянии потребление кислорода человеком либо близко к максимально возможной для него величине, либо даже равно ей. Несмотря на это, потребность мышц в кислороде все же полностью не удовлетворяется. Постепенно в организме образуется и нарастает кислородный долг. С целью восполнения недостаточного поступления кислорода легочная вентиляция, частота сердечных сокращений и минутный объем кровообращения увеличиваются и достигают максимально возможных величин. Недостаток кислорода ведет к усилению доли анаэробных процессов в обеспечении мышц энергией. В результате этого, в мышцах и в крови возрастает концентрация молочной кислоты. Происходит сдвиг рН крови в кислую сторону. Таким образом, при ложном устойчивом состоянии относительная стабильность физиологических функций на протяжении работы обусловлена не соответствием их уровней запросам организма для обеспечения работы требуемой мощности, а невозможностью их дальнейшего усиления. Утомление — функциональное состояние человека, временно возникающее под влиянием продолжительной или интенсивной работы и приводящее к снижению ее эффективности. Локализация и механизмы утомления. Относительно локализации утомления, то есть о тех конкретных морфологических структурах и физиологических системах, в которых развивается утомление, и о механизмах проявления утомления пока нет единого мнения. В зависимости от локализации структур, изменения в которых приводят к уменьшению работоспособности, механизмы утомления делятся на центральные и периферические. В случае ведущего значения центральных механизмов в развитии утомления, снижение работоспособности (например, при работе максимальной мощности) происходит вследствие понижения уровня функциональной активности нервных структур, управляющих деятельностью мышц и их вегетативным обеспечением. При физической работе большой длительности утомление возникает из-за изменений в деятельности вегетативной нервной и эндокринной систем. Следствием этих изменений являются снижение скорости доставки кислорода к работающим мышцам и ухудшение эффективности энергообмена. Помимо изменений в центральной нервной системе, утомление может вызываться процессами, происходящими в исполнительном звене нервно-мышечного аппарата. В этом случае говорят о периферических механизмах утомления, среди которых выделяют, во-первых, блокаду проведения нервных импульсов с аксона мотонейрона на мембрану мышечного волокна вследствие уменьшения выброса ацетилхолина из концевых веточек двигательного аксона (пресинаптический блок), или снижения скорости его разрушения ацетилхолинэстеразой (постсинаптический блок). Во-вторых, выделяют недостаточность кальциевых механизмов мышечных клеток, ухудшающую процессы электромеханического сопряжения в развитии сократительного процесса. Снижение рН, уменьшение запасов креатинфосфата и гликогена, увеличение температуры мышц увеличивают задержку выхода ионов кальция из цистерн саркоплазматического ретикулума, усиливая тем самым скорость развития утомления. В-третьих, отмечают изменения в самих работающих мышцах, возникающие вследствие: 1) истощения энергетических ресурсов скелетных мышц. При мощной и непродолжительной работе (длительность от 10 с до 2-3 мин) развитию утомления способствует уменьшение запасов фосфагенов (АТФ и Крф). Во время упражнений, длящихся более 15 мин, одной из причин утомления является истощение внутримышечных запасов гликогена; 2) накопления в мышцах продуктов метаболизма, в первую очередь, молочной кислоты. При выполнении работы субмаксимальной мощности, то есть при ее предельной длительности от 20 с до 2-3 мин, в энергообеспечении активных мышц преобладает анаэробный гликолиз. При этом концентрация молочной кислоты в крови возрастает в 10-20 раз, а в мышцах даже в сотни раз. В результате значительного уменьшения рН происходит снижение скорости образования актин-миозиновых мостиков и, следовательно, ухудшение сократительной функции мышц. Кроме того, понижается активность ключевых ферментов гликолиза, а значит и скорость энергопродукции; 3) недостаточного кровоснабжения мышц и, соответственно, увеличения доли продукции энергии за счет анаэробных процессов, уменьшения скорости вымывания из мышц молочной кислоты и других продуктов метаболизма, снижающих эффективность сократительных процессов мышечных клеток. Восстановление физиологических функций после прекращения спортивных упражнений. После окончания физической работы деятельность физиологических систем, обеспечивающих возможность ее выполнения, постепенно уменьшается и достигает дорабочего уровня. Этот процесс называется восстановлением, на протяжении которого количественные показатели работы систем кровообращения и дыхания возвращаются к исходным параметрам, удаляются продукты метаболизма, восполняются энергетические субстраты, пластические вещества (белки и др.), ферменты. В этот период происходят также процессы, обеспечивающие повышение работоспособности организма, то есть имеет место явление суперкомпенсации. Восстановление кислородного запаса организма, фосфагенов, углеводов отражается в повышенном, по сравнению с дорабочим уровнем, потреблении кислорода — кислородном долге. Процесс отдачи кислородного долга состоит в избыточном расходовании кислорода сверх уровня покоя за время периода восстановления. Потребляемый дополнительно кислород обеспечивает организм энергией, необходимой для осуществления всех восстановительных процессов. Скорость потребления кислорода на протяжении первых 2-3 мин после работы снижается очень быстро. Это — алактатный компонент кислородного долга, связанный с использованием кислорода на быстрое восстановление израсходованных при работе фосфагенов мышц, пониженного содержания кислорода в венозной крови, с насыщением кислородом миоглобина. Последующее, замедленное восстановление скорости потребления кислорода организмом человека на протяжении 30-60 мин — медленный (лактатный) компонент кислородного долга — связано, в основном, со сравнительно медленным устранением лактата из крови и межтканевой жидкости, накопившегося там во время тяжелой мышечной работы. 6.3.Физиологические основы спортивной тренировки Состояние высокой работоспособности, которое достигается в результате спортивной тренировки, называется тренированностью. Различают общую тренированность и специальную — в избранном виде спорта. Физиологическая сущность развития тренированности состоит в том, что под влиянием систематической повторной работы с постепенным увеличением ее общего объема в организме человека происходят морфологические, биохимические и физиологические изменения, приводящие к повышению его работоспособности. Все эти изменения специфичны, то есть они зависят от особенностей тренирующих нагрузок. Повышение работоспособности в избранном виде спорта обусловлено формированием и совершенствованием необходимых двигательных навыков и развитием двигательных качеств — силы, скорости, выносливости, ловкости. Физиологические механизмы развития двигательных навыков. Совершенствование спортивных упражнений связано с формированием двигательных навыков. Двигательный навык представляет собой индивидуально приобретенную форму различных по сложности координации двигательных действий, образующуюся путем систематической тренировки. Фонд двигательных навыков человека состоит, с одной стороны, из врожденных двигательных действий (сосание, глотание, сгибание и разгибание конечностей в ответ на действие раздражителей и т.д.), с другой — из двигательных актов, формирующихся в процессе специального обучения на протяжении индивидуальной жизни. Человек рождается с крайне ограниченными по числу и сложности проявлений двигательных действий. В то же время, по наследству передается чрезвычайно важное свойство нервной системы — пластичность, обеспечивающее хорошую тренируемость, то есть способность в процессе обучения овладевать новыми, сложными по координации, формами движений. Физиологическим механизмом образования двигательных навыков, то есть механизмом тренируемости, благодаря которому формируются новые виды двигательной деятельности, являются условные рефлексы. Формирование новых двигательных навыков происходит на базе ранее приобретенных организмом координации. Чем больше у человека запас выработанных ранее двигательных актов, тем легче и быстрее он способен разучивать новые движения. Успешнее всего новые формы движений осваивают спортсмены, владеющие большим комплексом уже закрепленных сложных двигательных актов (гимнасты, акробаты, фигуристы). В осуществлении новых двигательных актов важное значение имеет способность центральной нервной системы к экстраполяции. Процесс экстраполяции позволяет осуществлять как бы перенос уже имеющихся навыков и реализовать без предварительной подготовки новые координированные двигательные действия. Двигательный навык представляет собой цепь двигательных актов, включающую несколько самостоятельных элементов (фаз, циклов), объединенных общей конечной целью. В процессе тренировки, направленной на формирование двигательного действия, отдельные компоненты движения выстраиваются в своеобразную систему последовательных двигательных актов в виде двигательного динамического стереотипа. Динамический стереотип в спортивных движениях относится только к последовательности осуществления их отдельных фаз. Временные отношения между фазами движений могут постоянно варьировать. Формирование двигательного навыка при занятиях спортом проходит через несколько стадий. Первая стадия: объединение отдельных элементов движения в целостное действие, характеризуется иррадиацией возбуждения в моторной зоне коры с генерализацией ответных двигательных реакций и вовлечением в работу «лишних» мышц. Во второй стадии, благодаря постепенной концентрации возбуждения, происходит улучшение координации движений, усиление стереотипности двигательных актов. В третьей стадии навык закрепляется, стабилизируется, достигается высокая степень координации и стереотипности движений. Двигательные навыки, как и другие условные рефлексы, по мере закрепления становятся все более стойкими. При этом чем они проще по своей структуре, тем прочнее. После прекращения систематической тренировки навык начинает утрачиваться. Быстрее всего разрушаются наиболее сложные в координационном плане компоненты двигательного навыка. Простые компоненты навыка могут сохраняться годами и даже десятилетиями. Так, человек, научившийся плавать, ездить на велосипеде, сохраняет эти навыки в простейшем варианте даже после больших перерывов. Физиологические основы тренировки силы и скоростно-силовых качеств. Максимальная произвольная сила (МПС) мышц человека зависит от двух групп факторов: мышечных (периферических) и координационных (центральных). Зависимость максимальной произвольной силы мышцы от периферических факторов связана с механическими условиями действия мышечной тяги, с исходной длиной мышцы, площадью ее поперечного сечения, с соотношением быстрых и медленных волокон в сокращающейся мышце, с внутренней ее температурой. При равенстве всех перечисленных факторов максимально возможная сила мышцы в изометрическом режиме достигается в случае активации всех двигательных единиц и при сокращении всех волокон в режиме гладкого тетануса. Координационные факторы, определяющие максимальную произвольную силу, — это центральные механизмы управления деятельностью мышц. Среди них выделяют механизмы внутримышечной координации (число возбуждаемых мотонейронов мышцы и синхронизацию их импульсации во времени) и межмышечные координационные механизмы (выбор необходимых для выполнения поставленной задачи мышц-синергистов и сопряженное торможение мышц-антагонистов). В естественных условиях максимальная произвольная сила всегда меньше, чем истинная максимальная сила мышцы. Последнюю определяют, раздражая у человека нерв, иннервирующий мышцу (например, трехглавую мышцу голени), импульсами электрического тока. Разница между истинной максимальной силой мышц и их максимальной произвольной силой называется силовым дефицитом. При тренировке силы мышц происходит умеренное повышение активности нейронов сенсорных и моторных центров. Усиливаются внутрицентральные и корково-спинальные функциональные связи моторных центров, обеспечивающие при выполнении силовых упражнений максимально возможное по числу вовлечение в работу двигательных единиц. Улучшаются центральные координационные процессы управления различными мышечными группами. В развитии максимальной силы сокращения мышцы имеют значение ее структурные особенности: общее число мышечных волокон, их ход (прямой, косой), толщина волокон, количество миофибрилл в каждом волокне. При прочих равных условиях сила мышцы зависит от ее поперечного сечения. Увеличение поперечника мышцы в результате специальной физической тренировки называется рабочей гипертрофией. Выделяют два крайних типа рабочей гипертрофии мышечных волокон — миофибриллярную и саркоплазматическую. При миофибриллярной рабочей гипертрофии увеличение поперечных размеров волокон обусловлено ростом числа и объема миофибрилл. Миофиб-риллярная гипертрофия возникает лишь при использовании в качестве тренировочных нагрузок усилий более 75% от максимальной произвольной силы. В основе рабочей гипертрофии лежит интенсивный синтез мышечных белков. Роль стимулятора синтеза актина и миозина, а значит и рабочей гипертрофии, выполняет креатин, содержание которого в сокращающихся мышцах растет. Под влиянием гипоталамогипофизарной системы повышается продукция андрогенов (тестостерона). Возрастает количество рецепторов андрогенов в ядрах и цитоплазме миоцитов. Повышается концентрация соматотропина и синтезируемых печенью соматомединов, ускоряющих утилизацию аминокислот и глюкозы мышечными клетками, синтез протеинов и развитие мышечной гипертрофии. Усиление поглощения аминокислот и глюкозы, синтеза РНК, ДНК и тканевых белков, а также увеличение количества сократительных белков актин-миозинового комплекса происходят преимущественно в быстрых волокнах. Кроме того, в процессе силовой тренировки возрастает количество белков саркоплазматического ретикулума, миозиновой АТФазы и миоглобина. Все это приводит к развитию миофибриллярной гипертрофии, в основном, быстрых гликолитических волокон, увеличению занимаемой ими площади в тренируемых мышцах и, следовательно, силы мышцы. Структурные адаптивные перестройки сопровождаются метаболическими. Имеет место локальное увеличение запасов креатинфосфата и гликогена, содержания и активности миокиназы, КФ-киназы и гликолитических ферментов, повышение мощности фосфагенной и гликолитической энергетических систем скелетных мышц. Как и другие виды тренировки, силовая не изменяет композиции мышц, то есть соотношения в них быстрых и медленных волокон. При тренировке силовой направленности в мышце увеличивается процент быстрых гликолитических волокон и, соответственно, уменьшается процент быстрых окислительно-гликолитических. Саркоплазматическая рабочая гипертрофия имеет место при длительной тренировке ритмическими сокращениями, в процессе которых мышцы работают в аэробных условиях. При этом типе гипертрофии увеличение размеров мышечных волокон происходит, главным образом, за счет увеличения объема саркоплазмы, а не сократительных белков. Возрастает содержание несократительных белков, гликогена, креатинфосфата, миоглобина, число митохондрий. В связи с этим мышечная сила либо не меняется, либо может даже уменьшаться. В то же время существенно возрастает аэробная выносливость таких мышц, то есть способность длительное время выполнять работу в аэробных условиях. Наиболее предрасположены к саркоплазматической гипертрофии медленные и быстрые окислительногликолитические волокна. В реальной жизни гипертрофия мышечных волокон представляет собой комбинацию двух описанных типов. Преобладание миофибриллярного или саркоплазматического типа зависит от характера тренировочных нагрузок. Физиологические основы скоростно-силовых качеств (мощности). Мощность, как ведущее качество спортсмена, необходима для выполнения многих спортивных упражнений (метания, прыжки, борьба, спринтерский бег и т.д.). Чем большую мощность развивает спортсмен, тем большую скорость он может сообщить снаряду или собственному телу. Максимальная мощность является результатом оптимального сочетания силы и скорости. Отсюда следует, что мощность можно увеличить за счет повышения либо силы, либо скорости сокращения, либо силы и скорости одновременно. Силовой компонент мощности. В значительной мере мощность определяется максимальной силой участвующих в работе мышц. Максимальная динамическая сила, измеряемая при концентрическом сокращении мышц, меньше, чем максимальная сила в изометрическом режиме. В связи с высокой специфичностью эффектов тренировки, изометрические нагрузки мало влияют на динамическую силу, а динамические - на статическую. Отсюда следует, что для повышения динамической силы необходимо использовать, в первую очередь, динамические нагрузки. Одной из разновидностей динамической мышечной силы является взрывная сила, характеризующая способность к быстрому проявлению мышечной силы. Взрывная сила определяет результативность метателей, прыгунов, спринтеров, борцов др. Критерием оценки и количественным показателем взрывной силы является градиент силы, то есть скорость ее нарастания. Градиент силы определяется как отношение величины максимально достигаемой силы ко времени ее нарастания. Основными факторами, ответственными за развитие взрывной силы, являются координационные способности моторных центров и скоростные сократительные способности мышц. Среди координационных способностей центральной нервной системы основное значение имеют частота импульсации мотонейронов в начале разряда и степень синхронизации импульсации разных двигательных нейронов. Чем больше начальная частота импульсации (активации мышечных клеток), тем быстрее нарастает сила мышц. Скоростные сократительные свойства скелетной мышцы зависят также от ее композиции, то есть соотношения числа быстрых и медленных волокон. Быстрые волокна составляют значительно большую часть мышечной массы у представителей скоростно-силовых видов спорта (спринтеры, прыгуны, метатели). Скоростной компонент мощности, развиваемой спортсменом во время выполнения физических упражнений, определяется, во-первых, силой сокращения мышц. Согласно второму закону Ньютона, чем больше усилие прилагается к массе тела, тем больше скорость, с которой оно движется. Отсюда, чем больше сила мышц бедра, тем выше предельная скорость бега спринтера. Во-вторых, скоростными сократительными свойствами мышц. Чем больший процент быстрых волокон в мышце, тем с большей скоростью может выполняться каждое отдельное движение, тем большее количество двигательных циклов может совершаться в единицу времени. У выдающихся спринтеров процент быстрых мышечных волокон значительно выше, чем у неспортсменов. И, в-третьих, внутри — и межмышечными координационными способностями центральной нервной системы. Физиологические основы аэробной выносливости. Под выносливостью понимают способность человека длительное время поддерживать определенный вид деятельности. Выносливость специфична, то есть проявляется у каждого человека лишь при выполнении определенного вида деятельности. В спортивной физиологии под выносливостью понимают способность человека длительное время выполнять глобальную динамическую работу аэробного характера. Большой аэробной выносливости требуют, например, такие спортивные упражнения, как бег на дистанции 1500 м и больше, академическая гребля, лыжные гонки, шоссейные велогонки, бег на коньках на дистанциях 3000 м и более, плавание на длинные дистанции, спортивная ходьба, ориентирование. Во всех видах спорта, требующих выносливости, спортсмены должны обладать большими аэробными возможностями: максимальной скоростью потребления кислорода и способностью длительное время поддерживать высокую скорость потребления кислорода. Аэробные возможности человека определяются, прежде всего, максимально возможной для него скоростью потребления кислорода. Чем она больше, тем большую мощность работы может выполнять спортсмен в аэробных условиях. Чем длительнее по времени эта работа может продолжаться, тем, следовательно, выше его спортивный результат. Максимальное потребление кислорода у лиц, тренирующих выносливость, значительно выше, чем у не спортсменов того же возраста и пола. Так, например, если у нетренированных мужчин 20-29 лет максимальное потребление кислорода составляет 2,5-3,5 л/мин (или 40-50 мл/мин/кг), то у бегунов-стайеров и лыжников высокой квалификации она достигает 5-6 л/мин (или 75-80 мл/мин/кг). У нетренированных женщин максимальное потребление кислорода равно 1,5-2,5 л/мин (или 30-40 мл/мин/кг), а у спортсменок лыжниц составляет около 4 л/мин (или более 70 мл/ мин/кг). Выделяют абсолютные показатели максимального потребления кислорода (л/мин) и относительные, то есть максимальное потребление кислорода, отнесенное к единице массы тела (мл/мин/кг). Абсолютные показатели максимального потребления кислорода находятся в прямой зависимости от размеров тела. Они наибольшие у гребцов, пловцов, конькобежцев, велосипедистов. В этих видах спорта абсолютные величины максимального потребления кислорода имеют наибольшее значение для оценки состояния тренированности. Относительные показатели максимального потребления кислорода у высококвалифицированных спортсменов находятся в обратной зависимости от массы тела. Наибольшие величины относительных показателей характерны для лыжников и бегунов на длинные дистанции, наименьшие — для гребцов. У спортсменов, специализирующихся в беге на длинные дистанции, в спортивной ходьбе, ориентировании, лыжных гонках, максимальные аэробные возможности и состояние тренированности оценивают по относительным величинам максимального потребления кислорода. Уровень максимального потребления кислорода зависит от максимальных возможностей: 1) системы доставки кислорода к работающим мышцам и другим усиленно функционирующим органам; 2) системы потребления кислорода, включающей, в основном, работающие мышечные клетки. Система доставки кислорода. Предельные возможности организма доставлять кислород к усиленно функционирующим органам и тканям определяются системами внешнего дыхания и крови, а также сердечно- сосудистой системой. Внешнее дыхание. У спортсменов, тренирующих выносливость, максимальные величины легочной вентиляции при работе значительно больше, чем у нетренированных лиц. У бегунов-стайеров во время бега на длинные дистанции легочная вентиляция длительное время поддерживается на уровне 120- 140 л/мин. У нетренированных людей ее максимальные величины обычно не превышают 70- 100 л/ мин. Поскольку частота дыхания по мере тренировки не возрастает, прирост легочной вентиляции достигается лишь увеличением дыхательного объема. Значительное возрастание максимально возможных величин дыхательного объема у спортсменов происходит вследствие повышения на 15-25% легочных объемов и емкостей и, следовательно, жизненной емкости легких, которая у гребцов, например, достигает 8-9 л. Другим результатом тренировки системы внешнего дыхания является повышение эффективности легочной вентиляции. Об этом свидетельствует увеличение вентиляционного эквивалента кислорода, то есть объема дыхания, затрачиваемого на один литр использованного кислорода. В процессе тренировки значительно возрастает диффузионная способность легких как в покое, так и при физических нагрузках. У бегунов-марафонцев, например, она даже в покое почти не отличается по величине от диффузионной способности легких при максимальной работе у нетренированных лиц. В результате тренировки повышается вентиляционный анаэробный порог, то есть мощность работы, начиная с которой легочная вентиляция растет быстрее, чем интенсивность нагрузки. Так, у нетренированных людей вентиляционный анаэробный порог соответствует мощности нагрузки в пределах 50-60%, а у хорошо тренированных спортсменов — 80-85% от максимального потребления кислорода. Итак, главный эффект тренировки выносливости в отношении функций внешнего дыхания состоит в увеличении предельных величин рабочей и произвольной легочной вентиляции вследствие возрастания легочных объемов и емкостей, в повышении эффективности легочной вентиляции и в увеличении диффузионной способности легких. Система крови. Транспорт кислорода и аэробная выносливость человека зависят от объема крови и содержания в ней эритроцитов и гемоглобина. При тренировке выносливости объем крови у спортсмена значительно возрастает. С учетом массы тела у бегунов-стайеров, лыжников, велосипедистов-шоссейников он на 15-20% больше, чем у нетренированных людей. У представителей скоростно-силовых видов спорта (спринтеры, метатели, прыгуны, борцы и др.) объем крови почти не отличается от его величин у неспортсменов. Таким образом, увеличение объема крови является результатом тренировки выносливости. Увеличение объема крови происходит, в основном, за счет повышения объема плазмы. При этом величина гематокрита, от которой в значительной мере зависит вязкость крови, у спортсменов несколько ниже, чем у нетренированных лиц. Увеличение объема плазмы у лиц, тренирующих выносливость, связано с повышением общего содержания белков в крови вследствие усиления их синтеза в печени. Содержание эритроцитов и гемоглобина в крови определяют ее кислородную емкость, а значит и способность доставлять кислород к работающим мышцам. В связи с этим довольно неожиданно выглядит отсутствие существенной разницы в содержании эритроцитов и гемоглобина у тренированных лиц с высокой аэробной выносливостью (эритроциты — 4,77 млн/мм3; гемоглобин — 14,6 — 16,0 г %) и нетренированных (эритроциты — 4,97 млн/мм3; гемоглобин — 15,1 г %). В то же время, из-за большего (на 15-20%) объема крови у спортсменов значительно выше общее количество эритроцитов и содержание гемоглобина в крови. Так, у тренированных на выносливость мужчин общее содержание в крови гемоглобина равно 10001100 г, или 13-16 г/кг массы (у женщин 700-850 г или 12 г/кг), а у нетренированных — соответственно 700-900 г или 10-12 г/кг (у женщин 400-500 г или 7-9 г/кг). Одной из причин, стимулирующих усиленный эритропоэз и образование гемоглобина, является рабочий гемолиз, то есть разрушение эритроцитов во время интенсивных тренировочных и соревновательных нагрузок. Как у спортсменов, так и у нетренированных лиц при нагрузках любой аэробной мощности содержание кислорода в артериальной крови по сравнению с состоянием покоя не снижается. Небольшое уменьшение насыщения гемоглобина кислородом компенсируется повышением концентрации гемоглобина в крови в результате происходящего при работе перехода жидкости за пределы сосудистого русла и увеличения гематокрита, то есть в результате рабочей гемоконцентрации. Благодаря увеличению на 15-20% содержания 2,3 дифосфоглицерата в эритроцитах спортсменов, тренирующих выносливость, в капиллярах тканей значительно облегчается отдача гемоглобином кислорода. Этот механизм повышает эффективность работы системы транспорта кислорода кровью. Таким образом, в отношении системы крови основные эффекты тренировки человеком аэробной выносливости состоят в существенном увеличении объема внутрисосудистой крови и общего содержания гемоглобина. Благодаря этому, возрастают суммарная кислородная емкость и общая масса циркулирующей крови, обеспечивается возможность большего увеличения минутного объема кровообращения и перераспределения его в пользу работающих мышц. Улучшаются возможности организма увеличивать кровоток в коже с целью усиления теплоотдачи во время длительной работы, усиливается скорость вымывания метаболитов (например, молочной кислоты) из интерстициального пространства. Сердечно-сосудистая система. В процессе многолетней тренировки аэробной выносливости в сердечно-сосудистой системе происходят адаптивные изменения, существенно повышающие способность сердца подавать большее количество крови в сосуды, тем самым увеличивая объемную скорость кровотока через легкие и работающие мышцы. Поскольку кислород-транспортные возможности лимитируются в большей степени состоянием сердечнососудистой системы, а не внешнего дыхания, велика роль различных звеньев этой системы в развитии аэробной выносливости. В соответствии с уравнением Фика потребление кислорода (V О2) находится в прямой зависимости от минутного объема кровообращения (МОК) и артерио-венозной разницы по кислороду (АВР О2), то есть V О2 = МОК х АВРО2. Исходя из этой закономерности, увеличение потребления кислорода, организмом и, следовательно, аэробной работоспособности человека, определяется производительностью сердца. В условиях покоя скорость потребления кислорода и минутный объем кровообращения мало отличаются у тренированных и нетренированных людей. Однако, механизмы поддержания минутного объема кровообращения у них различны. В результате усиления парасимпатических и ослабления симпатических влияний на сердце, уменьшения выделения катехоламинов надпочечниками и снижения чувствительности сердца к этим веществам у лиц, тренирующих выносливость, значительно уменьшается частота сердечных сокращений, становясь у элитных спортсменов меньше 40 и даже 30 уд/мин. Урежение частоты сердечных сокращений в покое у спортсменов компенсируется более высокими показателями систолического объема. Так, если у нетренированного в положении лежа частота сердечных сокращений составляет 70-75 уд/мин, а систолический объем — 80-90 мл, то у тренированных соответственно — 40-45 уд/ мин и 100-120 мл. Возрастание систолического объема в результате длительной тренировки является следствием увеличения объема полостей сердца и сократительной способности миокарда желудочков. Максимальные величины деятельности сердца при выполнении аэробных физических упражнений у спортсменов также значительно больше, чем у нетренированных. В связи с тем, что максимальная частота сердечных сокращений при тренировке выносливости не возрастает, но даже несколько снижается (на 3-5 уд/ мин), существенно большие величины минутного объема кровообращения у спортсменов обусловлены исключительно повышением систолического объема. Чем больше возрастает систолический объем, тем больше повышается минутный объем кровообращения, а значит и максимальное потребление кислорода. Следовательно, увеличение систолического объема — это основной результат тренировки выносливости для сердечно-сосудистой системы. Максимально возможный систолический объем у нетренированных мужчин обычно не превышает 110-130 мл, тогда как у хорошо тренированных он может достигать 180-210 мл. Высокий уровень аэробной работоспособности спортсменов зависит не только от больших величин минутного объема кровообращения, но и от способности наиболее эффективного его использования. Эта способность определяется величиной артерио-венозной разницы по кислороду и совершенством механизмов перераспределения крови между активными и неактивными органами и тканями. Чем больше артерио-венозная разница по кислороду, тем более эффективно используется минутный объем кровообращения. По мере тренировки выносливости при любых нагрузках артерио-венозная разница по кислороду увеличивается. Поскольку содержание 0^ в артериальной крови у спортсменов и не спортсменов практически не отличается ни в покое, ни при аэробных нагрузках любой мощности, увеличение артерио-венозной разницы по кислороду вызывается снижением содержания О2 в смешанной венозной крови, то есть большей его утилизацией. При максимальной аэробной работе у нетренированных лиц содержание О2, снижается в среднем до 55 млО2/л крови, а у тренированных — до 25 мл/О2/л крови. Следовательно, лица, тренирующие выносливость, более эффективно используют один и тот же объем притекающей к их мышцам крови, извлекая из него больше кислорода. Система потребления кислорода и выносливость. Изменениям в кислородтранспортной системе, происходящим в результате тренировки выносливости, сопутствуют морфофункциональные изменения самих мышечных клеток, направленные на увеличение скорости утилизации приносимого кислорода. Чем больше в мышце медленных волокон с окислительным характером анаболизма, тем больше ее способность использовать кислород в окислительных реакциях ресинтеза АТФ. Следовательно, аэробная выносливость спортсмена зависит от композиции принимающих участие в работе мышц, то есть от процентного соотношения содержащихся в них медленных (окислительных) и быстрых (окислительногликолитических и гликолитических) волокон. Характерной чертой композиции мышц у выдающихся представителей видов спорта, тренирующих выносливость, является высокий (не менее 70) процент медленных волокон, приспособленных к длительной динамической работе средней интенсивности с аэробными процессами энергопродукции. Композиция мышц, а значит и высокий процент медленных волокон у спортсменовстайеров, предопределены генетически ("Великими стайерами не становятся, а рождаются"). Это значит, что человек уже с момента рождения, имея больше медленных волокон, чем быстрых, обладает предпосылками к достижению выдающихся результатов в видах спорта, требующих выносливости. Изменить тренировкой соотношение медленных и быстрых волокон практически невозможно. В то же время при неменяющемся соотношении числа медленных и быстрых волокон тренировка выносливости приводит к превращению быстрых гликолитических волокон в быстрые окислительно-гликолитические. Благодаря этому увеличивается общее число волокон, способных длительно работать в аэробных условиях. В процессе тренировки выносливости происходит рабочая гипертрофия саркоплазматического типа. Помимо увеличения содержания в клетке энергетических субстратов, у высокотренированных спортсменов значительно возрастает число и плотность центральных (на 50%) и поверхностных (на 300%) митохондрий. Следствием этого является существенное увеличение утилизации мышцей приносимого кровью кислорода. Усиление процессов утилизации кислорода в мышечных клетках происходит одновременно с ростом числа капилляров, окружающих мышечные волокна, особенно медленного типа. Так, у тренированных на выносливость лиц каждое медленное волокно окружено 6-7 капиллярами, а быстрое — 3-4. У неспортсменов эти цифры составляют соответственно 3,5-4,5 и 2,5-3,2. Увеличение плотности капилляров, обусловленное образованием новых капилляров, происходит лишь в мышцах, тренирующих выносливость. Благодаря повышенной плотности капилляров в мышце (400-500 на 1 мм2 вместо 300-350 на 1 мм2 у нетренированных) улучшается обмен жидкостью между интерстициальным пространством и кровью, сокращается путь транспорта кислорода и других веществ от капилляра до клетки и обратно, увеличивается поверхность диффузии. Все это способствует повышению аэробной мышечной работоспособности. Повышение выносливости в результате тренировки связано также со значительными адаптивными изменениями метаболических процессов в мышце: увеличивается содержание и активность ферментов окислительного метаболизма (в 2-3 раза), возрастает содержание миоглобина (в 1,5-2 раза), повышается содержание энергетических субстратов — гликогена мышц и липидов (на 30-50%), усиливается способность мышц использовать гликоген и, особенно, жиры («жировой сдвиг»). Таким образом, длительная тренировка выносливости вызывает, во-первых, значительное усиление деятельности систем захвата кислорода из окружающего воздуха, доставки его к работающим мышечным волокнам и использования клетками для нужд метаболизма. Во-вторых, способствует повышению эффективности деятельности систем дыхания, крови и кровообращения во время выполнения физических упражнений. 7. ФИЗИЧЕСКАЯ РАБОТОСПОСОБНОСТЬ В ОСОБЫХ УСЛОВИЯХ ОКРУЖАЮЩЕЙ СРЕДЫ 7.1. Влияние температуры и влажности воздуха на физическую работоспособность. Во время интенсивной и длительной физической работы теплопродукция в мышцах возрастает в 20-25 раз по сравнению с условиями покоя. Почти все тепло передается в кровь и переносится с нею в ядро тела, температура которого повышается до 39-40°С. При прочих равных условиях, чем выше температура окружающего воздуха, тем больше поднимается температура тела при работе. Снижение работоспособности при выполнении интенсивных физических нагрузок на фоне повышенных температуры и влажности воздуха обусловлено перегреванием тела, дегидратацией организма и уменьшением кровоснабжения работающих мышц. Во время интенсивной физической работы скорость потообразования возрастает в десятки раз, достигая, например, во время марафонского бега 20-25 мл/мин. Потери воды за время бега могут достигать 2,5-4,5 л. Самым тяжелым последствием усиленного потоотделения является дегидратация, характеризующаяся уменьшением содержания жидкости в организме и снижением концентрации электролитов в жидких средах. Дегидратация во время мышечной работы приводит к существенному снижению физической работоспособности. Причинами этого являются: 1) снижение эффективности регуляции температуры тела вследствие ухудшения переноса тепла от ядра к оболочке и уменьшения активности потовых желез; 2) уменьшение объема плазмы крови, приводящее к снижению объема циркулирующей крови, венозного возврата, систолического объема, а также к увеличению показателя гематокрита и вязкости крови; 3) уменьшение объема межклеточной и внутриклеточной жидкости, а также концентрации электролитов в них, приводящее к нарушению равновесия электролитов, замедлению скорости протекания биохимических процессов и вследствие этого к нарушению функции как самих мышечных клеток, так и регуляторных механизмов, управляющих их работой. Снижение физической работоспособности в условиях повышенной температуры и влажности воздуха является также следствием уменьшения притока крови к работающим мышцам. С целью предотвращения перегревания организма система терморегуляции, не имея собственных исполнительных механизмов, использует другие системы и, в частности, кровообращение. Для усиления теплоотдачи с поверхности кожи расходуется до 20-25% минутного объема кровообращения. В результате, значительное количество крови (5-8 л/мин) не поступает к работающим мышцам. Это, в свою очередь, уменьшает доставку кислорода к мышечным клеткам и снижает их аэробную работоспособность. 7.2. Физическая работоспособность в условиях пониженного атмосферного давления (среднегорья). Находясь на высотах выше уровня моря, спортсмен вынужден выполнять интенсивные физические нагрузки в условиях пониженного атмосферного давления (гипобарии) и сниженного парциального давления кислорода (гипоксии), то есть в условиях гипобарической гипоксии. С увеличением высоты, на которой находится человек, дефицит кислорода в атмосферном воздухе ведет к снижению парциального давления кислорода в альвеолярном воздухе, уменьшению его содержания в артериальной крови и, как следствие, ухудшению снабжения тканей кислородом и снижению физической работоспособности при максимальных и субмаксимальных нагрузках. Для спортивной практики наибольший интерес представляют физиологические эффекты среднегорья, на которых часто проводятся соревнования. При пониженном парциальном давлении кислорода у лиц, выполняющих субмаксимальные аэробные нагрузки без предварительной адаптации к высоте, происходят характерные изменения физиологических функций. Потребность в кислороде при выполнении одной и той же физической нагрузки на высоте 1500-2500 м остается такой же, как и на уровне моря. Поэтому, для того чтобы обеспечить работающий организм требуемым количеством кислорода, уменьшение его молекул в единице объема горного разреженного воздуха должно быть компенсировано соответствующим увеличением легочной вентиляции. В этом и состоит основной физиологический механизм срочной адаптации организма к гипоксическим условиям. Поэтому, если в покое, на высоте среднегорья легочная вентиляция меняется незначительно, то при выполнении мышечной работы она всегда существенно больше, чем на равнине. У одного и того же человека при одинаковой мощности работы минутный объем дыхания тем больше, чем больше высота. Пониженное насыщение крови кислородом на высоте при выполнении субмаксимальной аэробной работы компенсируется увеличением минутного объема кровообращения, который возрастает за счет увеличения частоты сердечных сокращений при мало меняющемся систолическом объеме. Максимальные величины частоты сердечных сокращений, систолического объема и минутного объема кровообращения на высоте и на уровне моря одинаковы. Однако, при работе в гипоксических условиях предельные величины частоты сердечных сокращений и минутного объема кровообращения достигаются при меньших величинах нагрузки, чем на равнине. Уменьшение содержания О2, в артериальной крови у человека, находящегося в среднегорье, приводит к уменьшению максимального потребления кислорода. Cущественное для спортивной практики снижение максимального потребления кислорода начинается с подъема на высоты более 1500 м. Далее оно уменьшается примерно на 1% при подъеме на каждые 100 м. Снижение максимального потребления кислорода является основной причиной уменьшения аэробной выносливости человека в условиях среднегорья. С увеличением высоты, наряду со снижением барометрического давления, уменьшается плотность воздуха и, следовательно, его сопротивление движущемуся телу. Поэтому, в скоростно-силовых упражнения (спринтерский бег, прыжки, метания и др.) и силовых упражнениях, в отличие от упражнений на выносливость, спортивный результат в среднегорье может быть выше, чем на равнине. В процессе адаптации к высоте (горной акклиматизации) уменьшается влияние сниженного парциального давления кислорода во вдыхаемом воздухе на организм человека и повышается его физическая работоспособность. Минимальная продолжительность времени, необходимая для адаптации кислород-транспортной системы к условиям пониженного парциального давления О2 зависит, прежде всего, от высоты, на которой находится спортсмен. Так, на высотах 2000-2500 м это время составляет не менее 8-10 дней, а на высотах 3600 м — 15-21 день. Продолжительность периода адаптации к условиям среднегорья уменьшается в результате выполнения правильно подобранных по интенсивности и длительности физических нагрузок. В то же время при любой продолжительности пребывания на высоте никогда не достигается уровень физической работоспособности человека, характерный для него в условиях равнины. Повышение работоспособности человека в процессе адаптации к сниженному парциональному давлению кислорода связано с активизацией механизмов транспорта кислорода к тканям тела и усилением эффективности использования кислорода клетками для целей аэробного образования энергии. Достигается это увеличением легочной вентиляции при выполнении одной и той же нагрузки; возрастанием диффузионной способности легких; повышением кислородной емкости крови в результате увеличения числа эритроцитов и содержания гемоглобина; увеличением плотности капилляров в скелетных мышцах; повышением концентрации миоглобина в мышцах; увеличением плотности митохондрий в клетках, а также содержания и активности окислительных ферментов в них. Клеточные структурно-метаболические механизмы адаптации к сниженному содержанию кислорода в воздухе требуют значительно большего периода времени, чем физиологические механизмы. В результате всех этих адаптивных изменений максимальное потребление кислорода постепенно возрастает и через 3-4 недели пребывания в среднегорье становится лишь на 10-20% меньше, чем на уровне моря. Даже постоянно проживающие в горах спортсмены обладают более низкими величинами максимального потребления кислорода на «своей» высоте, чем на равнине. Таким образом, физическая работоспособность человека снижается по мере повышения высоты над уровнем моря и снижения парциального давления кислорода. В первую очередь это касается аэробной выносливости. Мышечная сила, максимальная аэробная мощность и координация движений при выполнении физических упражнений спортсменами практически не меняются. Более того, из-за пониженной плотности воздуха спортивные результаты на спринтерских дистанциях, в прыжках, метаниях, могут быть даже выше, чем на уровне моря. Поскольку процессы восстановления физиологических функций после напряженной физической работы на высоте замедленны, с целью предотвращения развития переутомления в этих условиях реализация повторных нагрузок допустима лишь после более длительных, чем на равнине, периодов отдыха. ВОПРОСЫ К АТТЕСТАЦИИ ПО РАЗДЕЛУ: «ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ» 1. Возбудимые ткани. Характеристика возбудимых тканей. Общие свойства (возбудимость, раздражимость, проводимость, лабильность). 2. Возбудимость как высокодифференцированная специализированная форма раздражимости. Способы оценки возбудимости. Мера возбудимости – порог раздражения. 3. Электрические явления в возбудимых тканях. История их открытия (Л. Гальвани, Э. ДюбуаРеймон). 4. Современные представления о процессе возбуждения. Возбуждение как биологическая реакция. Мембранно-ионная теория возбуждения. 5. Методы изучения и современные представления о строении и функции клеточной мембраны. 6. Мембранный потенциал. Роль концентрационных градиентов и избирательной проницаемости мембраны в возникновении мембранного потенциала. 7. Потенциал действия и его фазы. Критический уровень деполяризации. Местный процесс (локальный ответ) и переход его в распространяющийся потенциал – потенциал действия. 8. Динамика возбудимости в процессе формирования потенциала действия. 9. Законы раздражения возбудимых тканей. 10. Понятие о реобазе и хронаксии. Аккомодация возбудимых тканей. 11. Физиологические свойства мышечной ткани. 12. Скелетные мышечные волокна. Морфологические особенности «быстрых» и «медленных» мышечных волокон. 13. Сократимость как специфическое свойство мышечной ткани. Сокращение мышцы, методика регистрации. Электромиография. Клиническое значение электромиографии. Изометрический и изотонический режим сокращения мышц. Электронно-микроскопическое строение мышцы. 14. Механизм мышечного сокращения. Роль потенциала действия, ионов кальция и АТФ в механизме мышечного сокращения. 15. Явления, сопровождающие мышечное сокращение (химические, тепловые, биоэлектрические). 16. Одиночное сокращение мышцы и его фазы. Изменения возбудимости мышцы в процессе одиночного сокращения. Влияние силы раздражения на величину сокращения мышцы. 17. Суммация сокращений и тетанус. Механизм тетануса (Л. Гельмгольц, Н. Е. Введенский). 18. Оптимум и пессимум частоты раздражения. Лабильность. 19. Утомление мышцы. Анализ утомления нервно-мышечного препарата. Утомление в целом организме. Явления, сопровождающие утомления. Критическая оценка теории утомления. Физиологическая основа тренировки. 20. Эргография. Значение активного отдыха в восстановлении работоспособности после утомления. 21.Физиологические свойства гладких мышц (возбудимость, проводимость, сократимость, пластичность, автоматия). Сравнение свойств гладких и поперечно-полосатых мышц. Особенности нервно-мышечной передачи возбуждения в гладких мышцах. 22. Физиологические свойства нервных волокон. (возбудимость, проводимость). 23. Структурно-функциональная характеристика нервных волокон (миелиновых и безмиелиновых). 24. Классификация нервных волокон. Волокна типа A, B, C. Скорость проведения возбуждения в различных нервных волокон. 25. Законы проведения возбуждения в нервных волокон. 26. Механизм проведения возбуждения в мякотных (миелиновых) и безмякотных (безмиелиновых) нервных волокнах – сальтаторный и непрерывный. 27. Параметры функционального состояния нерва (порог раздражения, лабильность, полезное время, реобаза, хронаксия). Закон Дюбуа-Реймона. 28. Ультраструктура нервно-мышечного синапса. Медиаторный механизм передачи возбуждения с нерва на мышцу (А. Ф. Самойлов). Роль ацетилхолина и холинэстеразы в процессе нервно-мышечной передачи. 29. Функциональные свойства и особенности нервно-мышечного синапса. Одностороннее проведение возбуждения в синапсах. Синаптическиая задержка. Быстрая «утомляемость» синапсов. Низкая лабильность. 30 Моторные единицы скелетных и гладких мышц. Рецепторный аппарат мышечной системы (мышечные веретена, тельца Гольджи). Роль рецепторов мышечной системы в организации движений. 31. Учение Н. Е. Введенского о пессимуме и оптимуме силы и частоты раздражений. ТЕСТЫ КОМПЬЮТЕРНОГО КОНТРОЛЯ ЗНАНИЙ ПО РАЗДЕЛУ: ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ 1. Поддержание на постоянном уровне градиента концентрации ионов калия и натрия внутри и вне клетки обусловлено: A. выходом калия из клетки В. входом натрия в клетку C. выходом калия из клетки и входом натрия в клетку D. входом калия в клетку Е. работой калий-натриевого насоса 2. От чего зависит лабильность ткани? А. от длительности абсолютно рефрактерной фазы В. от величины мембранного потенциала С. от амплитуды потенциала действия D. от силы раздражения Е. от частоты раздражения 3.Специфическое свойство скелетных мышц: А. сократимость В. возбудимость С. проводимость D. автоматия Е. пластичность 4. Роль кальция в мышечном сокращении: А. вызывает распад АТФ В. блокирует работу калий-натриевого насоса С. способствует взаимодействию миозина с актином D. вызывает образование тропомиозина Е. уплотняет 2-мембраны 5. Внешнюю механическую работу скелетная мышца выполняет : А. в ауксотоническом режиме сокращения В. в изометрическом режиме сокращения С. в изотоническом режиме сокращения D. в концентрическом режиме сокращения Е. в эксцентрическом режиме сокращения 6. Откуда поступает кальций в саркоплазму гладкой мышцы при её сокращении? А. из миофибрилл В. из внеклеточной жидкости С. из саркоплазматического ретикулума D. из поперечных трубочек Е. из внеклеточной жидкости и саркоплазматического ретикулума 7. Сложный характер потенциала действия нервного ствола обусловлен ; А. высокой лабильностью нерва В. двусторонним проведением возбуждения по нервным волокнам С. различной скоростью проведения возбуждения по нервным волокнам D. изолированным проведением возбуждения по нервным волокнам Е. не утомляемостью нерва Где первично развивается утомление в нервно-мышечном препарате? А. В. С. D. Е. в мышце в нервном волокне в мотонейроне в нервно-мыщечном синапсе в синапсе, нервном волокне и мышце 9. Сколько раз может сокращаться скелетная мышца, если раздражать нерв нервномышечного препарата с частотой 300 Гц ? А. 247 В. 300 С. 500 D. не будет сокращаться 10. Какой механизм пессимального торможения в синапсе? А. истощение запасов медиатора В. стойкая деполяризация постсинаптической мембраны С. гиперполяризация постсинаптической мембраны D. гиперполяризация пресинаптической мембраны Е. блок проведения возбуждения в нервном волокне 11. Величина потенциала покоя (ПП) в основном зависит от неравномерного распределения снаружи и внутри клетки: А. магния В. натрия С. хлора D. кальция Е. калия 12. Какова возбудимость возбудимой ткани в фазу медленной деполяризации? А. нормальная В. супернормальная С. субнормальная D. относительная рефрактерность Е. абсолютная рефрактерность 13. Что лежит в основе аккомодации ткани? А. инактивация натриевой проницаемости и проницаемости В. повышение амплитуды потенциала действия (ПД) С. исчезновение мембранного потенциала (ПП) D. повышение натриевой проницаемости Е. прекращение работы калий-натриевого насоса активация калиевой 14. Воп: Какова лабильность скелетных мышц? А. 50 В. 150 С. 300 D. 500 Е. 1000 15. Что такое электромеханическое сопряжение? А. передача сигнала от мембраны клетки к миофибриллам и их скольжение В. проведение возбуждения по т-системе С. деформация головок молекул миозина D. образование энергии ПРИ распаде АТФ Е. увеличение длины саркомера 16. Внешняя механическая работа мышцы максимальна при: А. без нагрузки В. максимальной нагрузке С. D. Е. средней нагрузке субмаксимальной нагрузке невозможности укорочения мышцы 17. Автоматия пейсмекерных гладкомышечных клеток обусловлена: А. наличием "дрейфующего" мембранного потенциала В. функциональным синцитием С. более медленной работой кальциевого насоса D. нерегулярным расположением актиновых и миозиновых нитей Е. вегетативной иннервацией 18. Какой силы раздражитель может вызвать ответную реакцию возбудимой ткани в фазу следовой гиперполяризации? А. подпороговый В. пороговый C. сверхпороговый D. сверхпороговый и пороговый E. подпороговый и пороговый 19. Специфическое свойство нервных волокон: А. проводимость В. возбудимость C. сократимость D. автоматия E. пластичность 20. Скорость проведения возбуждения в нервных волокнах типа А: А. 1-5 м /сек В. 3-18 м/сек C. 0,5-3 м/сек D. 10-15 м/сек E. 30-100 м/сек 21. Какова лабильность синапса? А. 50 имп/сек В. 150 имп/сек C. 300 имп/сек D. 500 имп/сек E. 1000 имп/сек 22. Потенциал покоя (ПП) обусловлен преимущественно пассивным транспортом ионов: А. натрия в клетку В. калия из клетки C. хлора в клетку D. калия в клетку E. натрия из клетки 23. Как возбудимая ткань отвечает на подпороговое раздражение? А. локальным ответом В. потенциалом действия С. метаболическим потенциалом D. током покоя E. мембранным потенциалом 24. Причина возникновения католической депрессии: А. продолжительное действие катода постоянного тока В. уменьшение мебранного потенциала C. увеличение лабильности D. кратковременное действие раздражителя E. кратковременное действие катода постоянного тока 25. Какова возбудимость скелетной мышцы в латентный период одиночного сокращения? А. относительная рефрактерность В. абсолютная рефрактерность C. нормальная возбудимость D. субнормальная возбудимость E. супернормальная возбудимость 26. Что такое контрактура? А. снижение максимальной силы мышцы В. истощение запасов энергии C. замедленное расслабление мышцы D. повышение сократимости мышцы E. утомление мышцы 27. Сила мышцы зависит от: А. поперечного сечения мышцы В. характера расположения мышечных волокон C. длины мышцы D. количества мышечных волокон E. от характера иннервации мышцы 28. Длительность сокращения гладкой мышцы: А. одна секунда В. 10 секунд C. 0.1 секунды D. несколько десятков минут E. одна минута 29. В какую фазу одиночного сокращения скелетная мышца имеет повышенную возбудимость? А. в латентный период В. в фазу укорочения C. в фазу расслабления D. в фазу укорочения и расслабления Е. после окончания сокращения 30. Скорость А. В. C. D. E. проведения возбуждения в нервных волокнах типа В: 0,5 - 3, 0 м/сек 3-18 м/сек 30 - 100 м/сек 10 - 15 м/сек 20 - 50 м/сек 31. Причина одностороннего проведения возбуждения в синапсе: А. широкая синаптическая щель В. электрический механизм проведения возбуждения в синапсе C. выделение медиатора постсинаптической мембраной D. локализация холинорецепторов на постсинаптической мембране E. наличие холинэстеразы в нервно-мышечном синапсе 32. Потенциал действия (ПД) обусловлен, преимущественно, пассивным транспортом ионов: А. хлора в клетку В. калия из клетки C. хлора из клетки D. натрия в клетку E. кальция из клетки 33. Какова возбудимость возбудимой ткани в фазу следового отрицательного потенциала ? A. относительная рефрактерность В. субнормальная C. нормальная D. абсолютная рефрактерность E. супернормальная 34. Какой будет ответная реакция возбудимой ткани на действие различной силы раздражителей? А. локальный ответ В. потенциал действия С. по закону "всё или ничего D. метаболический потенциал E. различная амплитуда потенциалов действия 35. Какой режим сокращения имеет место при длительном медленном опускании поднятого груза: A. концентрическое сокращение В. изометрическое сокращение C. изотоническое сокращение D. ауксотоническое сокращение E. эксцентрическое сокращение 36.Какую роль в мышечном сокращении играет кальций-тропониновый комплекс? А. обеспечивает расщепление АТФ В. обеспечивает выход кальция из саркоплазматических цистерн C. возвращает кальций в саркоплазматические цистерны D. деполяризует сарколемму E. снимает блокаду активных центров актина тропомиозином 37. При развитии утомления мышцы в целостном организме основной причиной является: А. утомление нервных центров В. истощение запасов энергии С. истощение запасов кислорода D. отравление накапливающимся углекислым газом E. отравление накапливающимися продуктами метаболизма 38. Медленное расслабление гладкой мышцы в значительной степени объясняется: А. отсутствием Т-системы В. наличием нексусов C. функциональным синцитием D. нерегулярным распределением актина и миозина E. особенностью функционирования кальциевого насоса саркоплазматического ратикулума 39. Скорость проведения возбуждения в нервных волокнах типа С: А. 3 - 18 м/сек В. 5 – 3,0 м/сек С. 10 - 15 м/сек D. 20 - 30 м/сек E. 30 - 100 м/сек 40. Фермент, обеспечивающий гидролиз ацетилхолина в нервно-мышечном синапсе: A. МАО В. холинацетилтрансфераза C. КОМТ D. альфа-метилтрансфераза E. ацетилхолинэстераза 41. Деполяризация мембраны обусловлена, преимущественно, пассивным транспортом ионов: А. калия из клетки В. хлора из клетки С. калия в клетку D. натрия в клетку E. кальция из клетки 42. Какой электрод должен быть активным, чтобы снизить возбудимость ткани? A. катод ПРИ размыкании постоянного тока В. не имеет значения, какой электрод C. катод ПРИ замыкании постоянного тока D. анод при замыкании постоянного тока E. катод и анод одновременно 43. Способность живой ткани отвечать на действие раздражителя: A. рефрактерность В. возбудимость C. проводимость D. лабильность E. раздражимость 44. Какой силы раздражитель способен вызвать ответную реакцию возбудимой ткани в субнормальную фазу возбудимости? A. сверхпороговый В. пороговый C. подпороговый D. не имеет значения E. все перечисленные 45. В какую фазу одиночного мышечного сокращения необходимо нанести следующее раздражение, чтобы возник гладкий тетанус? A. в любую фазу В. в фазу укорочения C. в фазу расслабления D. после окончания одиночного сокращения E. в латентный период 46. Что является непосредственной причиной скольжения нитей актина относительно миозина? А. изменение положения головки миозина относительно ее тела В. упругие свойства миофибрилл С. конформация тропонина D. конформация тропомиозина E. возбуждение сарколеммы 47. Основная причина увеличения длительности периода расслабления скелетной мышцы при утомлении? А. уменьшение скорости проведения возбуждения В. уменьшение скорости развития возбуждения С. нарушение работы кальциевого насоса активация натриевых каналов D. инактивация кальциевых каналов E. нарушение работы кальциевого насоса 48. Гладкая мышца способна к длительному тоническому сокращению без развития утомления, потому что: A. имеет высокую скорость сокращения В. имеет автоматию C. D. E. имеет низкую скорость сокращения имеет низкую силу сокращения имеет низкие траты энергии 49. Сколько раз может сократиться скелетная мышца при прямом ее раздражении с частотой 300 Гц? A. 50 В. 100 C. 300 D. 500 E. 200 50. Какова возбудимость мембраны в фазу медленной реполяризации (следового отрицательного потенциала)? A. нормальная В. субнормальная C. супернормальная D. относительная рефрактерность E. абсолютная рефрактерность ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ В ФОРМАТЕ «КРОК -1» ПО РАЗДЕЛУ «ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ» 1. При проведении исследований на изолированных возбудимых тканях, установлено, что её возбудимость уменьшилась. Уменьшение концентрации каких ионов является наиболее вероятной причиной изменения возбудимости клетки? А. Натрия в клетке В. Калия в клетке С. Калия во внеклеточной жидкости D. Натрия во внеклеточной жидкости Е. Хлора во внеклеточной жидкости 2. В клинической практике применяют местные анестетики. Какой из перечисленных механизмов обеспечивает эффект обезболивания? А. Увеличение возбудимости ткани В. Уменьшение потенциала покоя С. Уменьшение продолжительности потенциал действия D. Снижение критического уровня деполяризации Е. Увеличение порога деполяризации 3. При проведении внеклеточной биполярной регистрации суммарного потенциала действия (ПД) нервного ствола установлено, что первая фаза ПД имеет большую амплитуду и меньшую длительность, чем вторая. Причиной этого является то, что волокна, которые входят в состав ствола, имеют разный ( разную): А. Амплитуду ПД В. Пороговый потенциал С. Потенциал покоя D. Длительность ПД Е. Быстроту проведения 4. При проведении исследования на изолированном нервном волокне, стараются увеличить скорость проведения возбуждения по волокну. Концентрацию каких ионов целесообразно увеличить? А. Натрия в волокне В. Натрия во внеклеточной жидкости С. Хлора во внеклеточной жидкости D. Калия в волокне Е. Калия во внеклеточной жидкости 5. При проведении исследования на изолированной возбудимой клетке установлено, что порог силы раздражения клетки существенно уменьшился. Что из указанного может быть причиной этого явления? А. Активация натриевых каналов мембраны В. Активация калиевых каналов мембраны С. Инактивация кальциевых каналов мембраны D. Блокада энергообразования в клетке Е. Инактивация натриевых каналов мембраны 6. Почему наиболее мощным движениям отвечает наибольшая амплитуда? А. Величина работы мышцы пропорциональна величине растяжения мышцы В. Величина сокращения мышцы не зависит от её предшествующего растяжения С. Величина сокращения мышцы пропорционально зависит от величины погрузки D. Величина сокращения мышцы не зависит от нагрузки Е. Величина работы мышцы до определённой границы пропорциональна величине растяжения мышцы 7. Какой вид мышечной работы неблагоприятно влияет на крово- и лимфообращение? А. Динамическая работа в концентрическом режиме В. Статическая работа в изометрическом режиме C. Статическая работа в эксцентричном режиме D. Статическая работа в концентрическом режиме E. Динамическая работа в эксцентрическом режиме 8. В клинике для местного прогревания тканей используют высокочастотный ток высокого напряжения (диатермию). Почему этот ток проходит через клетки, не вызывая в них возбуждение ? А. Развитие стойкой деполяризации мембраны клетки В. Уменьшение порога деполяризации ткани С. Увеличение порога деполяризации ткани D. Недостаточная длительность пороговой деполяризации клетки E. Недостаточная крутизна возрастания силы тока для достижения порогового уровня 9. У больного с наложенным жгутом на плечо для остановки кровотечения превышен допустимый срок его наложения (1 час), что явилось причиной нарушения чувствительности и двигательной активности конечности. Нарушение какого из перечисленных процессов явилось наиболее вероятной причиной этого явления? А. Синтеза медиатора В. Проведения возбуждения в нервно-мышечных синапсах С. Функциональной целостности нервных волокон D. Аксонного транспорта Е. Выделення медиатора 10. Для временной остановки сердца, во время операции с применением аппарата искусственного кровообращения, используют раствор с высоким содержанием калия (кардиоплегический раствор). Какой из названных принципов действия кардиоплегического раствора на миокардиоциты наиболее вероятно используется в этом случае ? А. Увеличение мембранного потенциала В. Увеличение натриевой проницаемости мембраны С. Деполяризация мембраны D. Стойкая деполяризация мембраны Е. Исчезновение потенциала покоя 11. При передозировке блокираторов кальция возникает сердечная слабость. Что из перечисленного является наиболее вероятным основанием для возникновения этого осложнения? А. Ухудшение электромеханической связи В. Прекращение работы кальциевого насоса С. Нарушение работы калий-натриевого насоса D. Блокада взаимодействия кальция с тропонином Е. Конформационные изменения миозина 12. Токсин возбудителя ботулизма блокирует выделение ацетилхолина конечными пластинками нервно-мышечного синапса. Какая из названных причин наиболее вероятно создаёт угрозу для жизни человека при ботулиновом отравлении? А. Интоксикация В. Паралич дыхательных мышц С. Сердечная слабость D. Парез кишечника Е. Нарушение глотания 13. Динитрофенол, действующий на клетки, блокирует метаболические процессы, являющиеся источником энергии. Как при этом изменится возбудимость ткани? А. Исчезнет В. Увеличится С. Уменьшится D. Значительно увеличится Е. Не изменится 14. Ацетилхолин при действии на миокардиоциты увеличивают проницаемость их мембран для ионов калия. Как при этом изменится возбудимость и проводимость миокарда? А. Возбудимость увеличивается, проводимость уменьшается В. Возбудимость и проводимость увеличиваются С. Возбудимость и проводимость уменьшаются D. Возбудимость уменьшается, проводимость увеличивается Е. Возбудимость не изменяется, проводимость уменьшается 15. При ухудшении кровоснабжения миокарда в межклеточной жидкости увеличивается концентрация ионов каля. Как это отражается на генерировании потенциала действия (ПД) в волокнах миокарда? А. Частота генерирования ПД уменьшается В. Частота генерирования ПД увеличивается С. Амплитуда ПД увеличивается D. ПД прекращает генерироваться Е. Амплитуда ПД уменьшается 16. Сердечные гликозиды уменьшают активность натрий-калиевых насосов. Как при этом изменится возбудимость сердечной мышцы? А. Значительно увеличивается В. Уменьшается С. Не изменяется D. Увеличивается Е. Исчезает 17. У человека, который плывет в холодной воде, может возникнуть контрактура мышц. Что из перечисленного является причиной этого явления? А. Низкая активность калий-натриевого насоса В. Увеличение проницаемость мембраны миоцитов для калия С. Низкая активность кальциевой АТФ-азы D. Увеличение проницаемости мембраны миоцитов для кальция Е. Уменьшение проницаемости мембраны миоцитов для кальция 18. При унаследованной миастении уменьшается количество холинорецепторов в мионевральных синапсах. Какие из перечисленных процессов будут затронуты при этом? А. Выделение медиатора В. Синтез медиатора С. Аксонный транспорт медиатора D. Нервно-мышечная передача возбуждения Е. Проведение возбуждения по нервным волокнам 19. При проведении обследований у больного с нарушением двигательной функции верхней конечности установлено увеличение хронаксии. Что из перечисленного является наиболее вероятной причиной этого явления? А. Увеличение возбудимости мышц В. Уменьшение возбудимости нервных волокон С. Увеличение проводимости нервных волокон D. Увеличение возбудимости нервных волокон Е. Нарушение нерно-мышечной передачи 20. Быстрее возникает утомление при статической роботе. Что из перечисленного является причиной развития утомление в этом случае? А. Аэробное энергообразование с образованием лактата В. Аэробное энергообразование С. Прекращение энергообразования D. Уменьшение количества миоглобина Е. Анаэробное энергообразование с образованием лактата 21. Норадреналин, медиатор симпатической нервной системы, при действии которого на миокардиоциты увеличивается проницаемость их мембран для ионов натрия. Как при этом изменится возбудимость миокардиоцитов? А. Исчезает В. Увеличивается С. Уменьшается D. Не изменяется Е. Незначительно уменьшается 22. Медиатор глицин вызывает увеличение проницаемости мембраны нервной клетки для К+. Что из перечисленного в данном случае является причиной уменьшение возбудимости? А. Стойкая деполяризация мембраны В. Деполяризация мембраны С. Уменьшение критического уровня деполяризации D. Гиперполяризация мембраны Е. Уменьшение порога раздражения 23. Динитрофенол, действуя на клетку, блокирует метаболические процессы, поставляя энергию. Потенциал покоя при этом уменьшается и исчезает. Что из перечисленного является непосредственной причиной этого? А. Активация К+ каналов В. Инактивация К+ каналов С. Блокирование работы К+ - Na+ насоса D. Изменения структуры мембраны Е. Инактивация Na+ каналов 24. При кровоснабжении миокарда в межклеточной жидкости повышается концентрация ионов калия ( К+) и потенциал действия не возникает. Какие из перечисленных изменений состояния мембраны являются непосредственной причиной этого? А. Исчезновение потенциала покоя В. С. D. Е. Увеличение потенциала покоя Увеличение критического уровня деполяризации Уменьшение критического уровня деполяризации Стойкая деполяризация мембраны 25. При увеличении концентрации К+ во внеклеточной жидкости до уровня внутриклеточной среды потенциал покоя клетки исчезает. Что из перечисленного является наиболее вероятной причиной этого? А. Блокирование К+ - Na + насоса В. Уменьшение проницаемости мембраны для К+ С. Отсутствие градиента концентрации К+ D. Увеличение проницаемости мембраны для К+ Е. Изменения в структуре мембраны 26. При проведении исследования на изолированной возбудимой клетки установлено, что её возбудимость уменьшается. Увеличение концентрации каких ионов является наиболее вероятной причиной изменений возбудимости клетки? А. К + в клетке В. К + во внеклеточной жидкости С. Na + во внеклеточной жидкости D. Na + в клетке Е. Хлор во внеклеточной жидкости 27. При проведении исследований на изолированном нервном волокне стараются уменьшить скорость проведения возбуждения по волокну. Концентрацию каких ионов целесообразно уменьшить? А. Хлора во внеклеточной жидкости В. Na + во внеклеточной жидкости С. К + во внеклеточной жидкости D. К + в волокне Е. Na + в волокне 28. При погружении изолированного нервного волокна в дистиллированную воду, возбуждение в нервном волокне не возникает. При добавлении к дистиллированной воде какого из перечисленных ионов возбуждение может возникнуть? А. Магния В. Калия С. Хлора D. Кальция Е. Натрия 29. При действии на изолированную возбудимую ткань динитрофенола блокируется работа К + - Na + насоса. Ткань теряет возбудимость. Что из перечисленного является наиболее вероятной причиной потери возбудимости ткани? А. Инактивация Na + каналов В. Инактивация К + каналов С. Исчезновение градиента ионов D. Увеличение градиента ионов E. Уменьшение градиента ионов 30. Некоторые лекарственные препараты (например, сердечные гликозиды) являются специфическими фармакологическими ингибиторами К + - Na + насоса. Какие из перечисленных изменений возбудимости сердечной мышцы возникают при действии сердечных гликозидов? Возбудимость: А. Уменьшается В. Увеличивается С. Не изменяется D. Е. Существенно увеличивается Исчезает 31. Раздражитель вызвал деполяризацию клеточной мембраны. При этом возбудимость клетки уменьшилась. Что из перечисленного является наиболее вероятной причиной этого? А. Повышение критического уровня деполяризации В. Активация К + - Na + насоса С. Снижение критического уровня деполяризации D. Угнетение работы К + - Na + насоса Е. Стойкая деполяризация мембраны 32. Раздражитель вызвал деполяризацию клеточной мембраны. При этом возбудимость клетки уменьшилась. Какие из перечисленных особенностей действия раздражителя наиболее вероятно могли привести к тому? А. Подпороговая сила В. Надпороговая сила С. Низкая частота действия D. Низкая скорость возрастания силы Е. Низкая продолжительность действия 33. Под влиянием анионов йода в мышечных волокнах уменьшается активность кальциевого насоса саркоплазматического ретикулума. Продолжительность амплитуды одиночных сокращений мышцы изменяются. Какие изменения продолжительности амплитуды будут наблюдаться в этом случае? А. Продолжительность и амплитуда уменьшаются В. Продолжительность увеличивается, амплитуда уменьшается С. Продолжительность уменьшается, амплитуда увеличивается D. Продолжительность и амплитуда увеличиваются Е. Продолжительность уменьшается, амплитуда не изменяется 34. Несколько часов после смерти наблюдается трупное окоченение. Что из перечисленного является непосредственной причиной этого явления? А. Стойкое прикрепление миозина к актину В. Уменьшение содержания АТФ в мышечных клетках С. Угнетение работы Са ++ - насоса D. Длительное повышение концентрации Са ++ в саркопрлазме Е. Стойкое сокращение мышц 35. При развитии усталости в волокнах мышцы наблюдается уменьшение содержания АТФ и продолжительности амплитуды одиночных сокращений мышц. Какие изменения продолжительности амплитуды одиночных сокращений мышц являются наиболее типичными в этом случае? А. Продолжительность уменьшается, амплитуда не изменяется В. Продолжительность увеличивается, амплитуда уменьшается С. Продолжительность и амплитуда уменьшаются D. Продолжительность и амплитуда увеличиваются E. Продолжительность уменьшается, амплитуда увеличивается 36. Гладкие мышцы внутренних органов и сосудов при продолжительном сокращении не утомляются, так как тонические сокращения гладких мышц в осуществляются: А. Медленно В. По синтициальному типу С. Длительно D. С незначительными энергозатратами Е. С незначительной амплитудой 37. Медленное наполнение желудка или мочевого пузыря в границах физиологической нормы не вызывает повышения давления в этих органах. Какое из перечисленных свойств лежит в основе этого явления? А. Пластичность В. Возбудимость С. Сократимость D. Автоматия Е. Раздражимость 38. Двигательная активность клеток гладких мышц полых органов усиливается при их быстром и сильном растяжении. Какие мембранно-ионные изменения наиболее вероятно возникают в клетках гладких мышц при этом? А. Деполяризация В. Гиперполяризация С. Стойкая деполяризация D. Быстрая реполяризация Е. Медленная реполяризация 39. Моча может содержаться в мочевом пузыре продолжительное время без развития напряжения в гладких мышцах. Какое из перечисленных свойств гладких мышц обусловливают эту особенность? А. Автоматия В. Пластичность С. Сократимость D. Возбудимость Е. Раздражимость 40. В результате продолжительного сокращения в полосатой мышце развилось утомление. Продолжительность одиночного сокращения мышцы увеличилось. В каких фазах процесса сокращения изменения продолжительности будут наиболее существенными? А. Период расслабления В. Период сокращения С. Латентный период D. Латентный период и период сокращения Е. Период сокращения и период расслабления 41. В результате продолжительного сокращения в полосатой мышце развилось утомление. Продолжительность одиночного сокращения увеличилась в основном за счет увеличения длительности фазы расслабления. Какой из перечисленных механизмов является наиболее вероятным для увеличения продолжительности фазы расслабления? А. Нарушение работы К + - Na + насоса В. Стойкая деполяризация мембраны С. Снижение чувствительности рецепторов к медиатору D. Нарушение работы Са ++ - насоса Е. Повышение критического уровня деполяризации 42. В нервных волокнах скорость проведения возбуждения колеблется в широких границах от 0.5 до 120 м/сек. Какие из названных особенностей нервных волокон наиболее существенно влияют на скорость проведения возбуждения? А. Отсутствие миелиновой оболочки В. Наличие миелиновой оболочки С. Толщина нервного волокна D. Функция нервного волокна E. Толщина нервного волокна и миелиновой оболочки 43. При раздражении мышцы нерно-мышечного препарата лягушки "через нерв" мышца прекращает сокращаться при частоте раздражения больше 150 имп/сек. В каком структурно-функциональном образовании нервно-мышечного препарата блокируется проведение возбуждения при этой частоте? А. В нервной клетке В. В нервном волокне С. В нервно- мышечном синапсе D. В полосатой мышце Е. В целостном организме 44. При длительном раздражении мышцы нервно-мышечного препарата лягушки "через нерв" утомление мышцы возникает быстрее, чем при раздражении "через мышцу". Таким образом, утомление первично развивается в: А. Мышце В. Нервном волокне С. Нервно-мышечном синапсе D. На поверхностной мембране мышцы Е. Нервной клетке 45. Яд змеи альфа-бунгаротоксин стойкий блокатор холинорецепторов. Одним из симптомов поражения ядом змеи является мышечный паралич. Какая наиболее вероятная причина развития этого симптома? А. Проведение возбуждения по мышечному волокну В. Проведение возбуждения по нервному волокну С. Проведение возбуждения в нервно-мышечном синапсе D. Возникновение возбуждения в нервной клетке Е. Сократимость мышцы ____________________________________________________________________ ПРИЛОЖЕНИЕ _____________________________________________________________________________ 1.ОТВЕТЫ К СИТУАЦИОННЫМ ЗАДАЧАМ ПО РАЗДЕЛУ: «ВОЗБУДИМЫЕ ТКАНИ» 1.1. Ответы к ситуационным задачам по теме: Общая физиология возбудимых тканей. Задача 1 При повышении проницаемости клеточной мембраны для ионов натрия увеличивается диффузионный поток положительно заряженных ионов, входящих в клетку. Это приведёт к деполяризации клеточной мембраны, т.е. к уменьшению значения ПП клетки. Задача 2 При повышении концентрации ионов калия в межклеточной жидкости возникает деполяризация мембран миокардиальных волокон. Значение их ПП приблизится к нулю, в результате чего генерация ПД станет невозможной. Задача 3. При действии на клетку динитрофенола будет нарушаться работа энергозависимого калий-натриевого насоса клеточной мембраны. В результате этого произойдёт выравнивание трансмембранных концентрационных градиентов ионов калия и натрия. Это приведёт к уменьшению ПП клетки вплоть до нуля. Задача 4. При повышении концентрации ионов калия вне клетки уменьшится диффузионный поток положительно заряженных ионов, выходящих из клетки. Это приведёт к деполяризации клеточной мембраны, т.е. к уменьшению значения ПП клетки. Задача 5. При увеличении числа инактивированных натриевых каналов клеточной мембраны уменьшается её проницаемость для ионов натрия. В результате этого уменьшится поток дифундирующих положительно заряженных ионов натрия, входящих в клетку во время восходящей фазы ПД. Это приведёт к уменьшению крутизны этой фазы и к уменьшению амплитуды ПД. Задача 6. При увеличении концентрации натрия в тканевой жидкости концентрационный градиент для этого иона увеличивается. Это приведёт к увеличению входящего натриевого потока при возбуждении, а следовательно, к увеличению амплитуды ПД. Задача 7. Если во время генерации ПД увеличится число активированных калиевых каналов клеточной мембраны, то возрастет диффузионный поток положительно заряженных ионов калия, который выходит из клетки в основном во время нисходящей фазы ПД. Это приведёт к уменьшению длительности этой фазы, следовательно, и всего ПД в целом. Кроме этого, может несколько уменьшиться амплитуда ПД. Задача 8. При увеличении содержания калия внутри клетки величина ПП увеличится, т.к. увеличится выходящий диффузионный поток положительно заряженных ионов калия, обусловливающий величину ПП. Задача 9. Сердечные гликозиды уменьшают возбудимость сердечной мышцы, т.е. при уменьшении активности калий-натриевого насоса концентрационный градиент калия уменьшается, а следовательно, величина ПП уменьшается. Задача 10. В бессолевом растворе возбудимая клетка не способна генерировать ПД, т.к. формирование ПД связано с вхождением в клетку положительно заряженных ионов. Задача 11. Сделать заключение об изменении возбудимости нельзя, т.к. между амплитудой ПД и значением возбудимости клетки не существует прямой зависимости. Задача 12. Возбудимость клетки уменьшилась, т.к. увеличился пороговый потенциал её мембраны. Задача 13. Уменьшение возбудимости клетки при деполяризации мембраны наблюдается при одновременном повышении её критического уровня. Задача 14 При повышении проницаемости мембраны для ионов калия усилится их выход из клетки. Это приведёт к гиперполяризации мембраны, а следовательно, к увеличению её порогового потенциала. Возбудимость уменьшится. Задача 15. Амплитуда возникшего местного потенциала составляет более 75% значения порогового потенциала мембраны клетки. Следовательно, этот местный потенциал является суммой КЭТП и ЛО. Задача 16. Импульсы высокочастотных токов обладают очень малой длительностью, недостаточной для пороговой деполяризации клеточной мембраны. Задача 17. Длительность латентного периода ПД уменьшится, т.к. при увеличении силы электрического раздражителя увеличивается возрастание как КЭТП, так и ЛО. 1.2. Ответы к ситуационным задачам по теме: Физиологические механизмы проведения возбуждения в возбудимых тканях. Задача 1. При раздражении любой силы возбуждение не возникает, т.к. в дистиллированной воде отсутствуют ионы, необходимые для развития ПД. Задача 2. При повышении проницаемости мембраны нервного волокна для ионов калия их выход из волокна усилится, что приведёт к гиперполяризации мембраны и, следовательно, к увеличению её порогового потенциала, а также к некоторому уменьшению амплитуды ПД. В результате этих двух сдвиговскорость проведения нервных импульсов по волокну уменьшится. Задача 3. При увеличении калиевой проницаемости на мембране нервного волокна развивается гиперполяризация. Критический уровень деполяризации такого волокна увеличивается, а следовательно, возбудимость понижается. Задача 4. При значительном уменьшении выброса медиатора в нервно-мышечном синапсе уменьшится амплитуда ПКП, возникающих на постсинаптической мембране, и одиночные ПКП не будут достигать порогового значения. В результате этого каждый отдельный пресинаптический ПД потеряет возможность проходить через нервно-мышечный синапс. Синаптическая передача возбуждения будет возможной лишь при суммации нескольких одиночных ПКП, вызываемых следующими друг за другом пресинаптическими ПД. 1.3. Ответы к ситуационным задачам по теме: Физиология мышц. 1 с. Задача 1. Расчет минимальной частоты, с которой надо раздражать мышцу, чтобы получить: зубчатый тетанус - 1 с : /0,04с+0,05с/ = 11 раз в 1 с; гладкий тетанус -1 с : 0,04 с = 25 раз в Задача 2. Длительность одиночного сокращения мышцы составляет 0,03с + 0,04с = 0,07 с. Интервал времени между соседними раздражениями - 1:10 = 0,1 с. При сопоставлении данных видно, что каждое последующее раздражение будет действовать на мышцу, когда её одиночное сокращение, вызванное предыдущим раздражением, уже завершилось. Следовательно, при частоте раздражения 10 Гц мышца будет сокращаться в режиме одиночных сокращений. Задача 3. Во время латентного периода изометрического одиночного сокращения мышечного волокна /при прямом раздражении/ происходят следующие основные процессы: распространение возбуждения по поверхностной мембране и по системе поперечных трубочек мышечного волокна; выход из цистерн ионов кальция и повышение их концентрации в саркоплазме до порогового значения; замыкание поперечных мостиков. Задача 4. Если в мышечном волокне удлинится период максимума активного состояния, то его одиночное сокращение будет достигать вершины при более высокой концентрации ионов кальция в саркоплазме волокна и, следовательно, амплитуда этих сокращений увеличится, приближаясь к амплитуде тетанических сокрашений. Задача 5. После смерти содержание АТФ в мышечных клетках снижается. Когда оно переходит критический уровень, поперечные мостики оказываются устойчиво прикрепленными к актиновой нити. Это продолжается до тех пор, пока не произойдёт аутолиз. Задача 6. Длительность одиночных сокращений мышцы увеличится за счёт удлинения фазы расслабления вследствие нарушения работы кальциевого насоса саркоплазматического ретикулума. Амплитуда одиночного сокращения мышцы уменьшится вследствие нарушения процесса фосфорилирования миозина. Задача 7. Длительность и амплитуда одиночных сокращений мышцы увеличатся, так как в её волокнах удлинится период максимума активного состояния. Задача 8. В начале длительной мышечной деятельности происходит приспосабливание уровня окислительного метаболизма к возросшим требованиям. Стационарное состояние, когда в единицу времени путем окислительного фосфорилирования образуется столько же АТФ, сколько его расщепляется под действием АТФ-азы, наступает только через 0,5-2 мин. Лишь после этого периода метаболической перестройки изнемогающий бегун может получить "второе дыхание". Задача 9. Это связано с тем, что величина работы мышцы до определённого предела пропорциональна величине растяжения мышцы. Задача 10. Наиболее неблагоприятно на крово- и лимфообращение влияет статическая работа, когда мышцы сокращаются в изометрическом режиме. При этом значительно увеличивается внутримышечное давление, превышая капиллярное давление. Кровоток и лимфоток становятся неадекватными, энергия должна вырабатываться анаэробным путём с образованием лактата. Поэтому при изометрической нагрузке, требующей приложения значительных сил, быстро наступает утомление. Задача 11. С Задача 12. А Задача 13. А Задача 14. В Задача 15. С