Химические свойства веществ в заданиях ЕГЭ
реклама

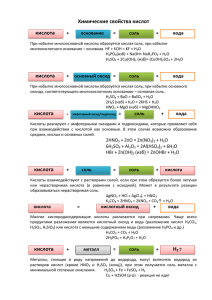
Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ» Занятие 6 . Методика решения заданий С 2 Прежде, чем мы начнем разбирать методику выполнения заданий С2, небольшой анализ примеров С2, которые Вы прислали во входных заданиях.. Всего мной было обнаружено 56 разных заданий, некоторые из них повторялись от 2 до 8 раз. Именно поэтому я решила разобрать самые «популярные» из присланных Вами заданий. Пример 1. Задание, которое повторяется 8 раз. Даны: Нитрат натрия, фосфор, бром, гидроксид калия (раствор). Напомню, что в соответствии с новыми правилами, эксперты проверяют и учитывают только первые четыре уравнения реакций, записанные учеником. Остальные уравнения, даже если они правильные, не рассматриваются. Именно поэтому очень важно научить выпускников определять реакции, идущие наверняка. Шаг первый: записать формулы предложенных в задании веществ. NaNO3, P, Br2, KOH Шаг второй: под каждым веществом подписать, к какому классу оно относится: NaNO3, P, Br2, KOH Соль Неметалл Неметалл Щелочь Шаг третий: следуя схеме взаимодействия (см. занятие №5) соединить те вещества, которые могут реагировать NaNO3, P, Br2, KOH Соль Неметалл Неметалл Щелочь Шаг четвертый: проверить, все ли из выбранных реакций возможны. В нашем случае реакция соль + щелочь не идёт, так как не образуются неэлектролиты или слабые электролиты. (Соединяющую эти вещества линию нужно убрать) Следовательно, нужно искать еще один вариант. Для этого выполняется шаг 5. Шаг пятый: под всеми веществами подписать окислительно-восстановительные свойства. Нитрат – окислитель, так как азот находится в высшей степени окисления, фосфор и бром проявляют окислительно-восстановительную двойственность, приём у Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ» брома в большей степени проявляются свойства окислителя, у фосфора восстановителя. Щелочи не проявляют окислительно-восстановительных свойств. NaNO3, Ок-ль P, о/в Br2, KOH о/в Шаг шестой: соединим вещества, которые могут реагировать между собой как окислители и восстановители. NaNO3, P, Br2, KOH Ок-ль о/в о/в Шаг седьмой: совместим эти схемы и проанализируем результат: NaNO3, P, Br2, KOH Соль Неметалл Щелочь ок-ль о/в Неметалл о/в Итак: 1)Неметаллы с щелочью вступают в реакцию диспропорционирования, так как обладают окислительно-восстановительной двойственностью, а щелочь не обладает о/в свойствами. 2) Фосфор с бромом реагируют, при этом бром выступает окислителем, а фосфор восстановителем. 3) Нитрат натрия окисляет фосфор. Шаг восьмой: записываем уравнения реакций, начиная с самого простого: 1. 2P + 5Br2 = 2PBr5 ( или 2P + 3Br2 = 2PBr3) 2. 5NaNO3 + 2P = Р2О5 + 5NaNO2 3. 2KOH + Br2 = KBrO + KBr + H2O (на холоде) или 6KOH + 3Br2 = KBrO3 + 5KBr + 3H2O (в горячем растворе) 4. 3KOH + 4P + 3H2O = PH3 + 3KPH2O2 Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ» Пример 2. Задание, которое повторяется 7 раз. Даны: дихромат калия, серная кислота (конц.), фторид калия, гидроксид рубидия Шаг первый: записать формулы предложенных в задании веществ. K2Cr2O7, H2SO4, KF, RbOH Шаг второй: под каждым веществом подписать, к какому классу оно относится: K2Cr2O7, H2SO4, KF, RbOH Соль кислота соль Щелочь Шаг третий: следуя схеме взаимодействия (см. занятие №5) соединить те вещества, которые могут реагировать K2Cr2O7, H2SO4, KF, RbOH Соль кислота соль Щелочь Шаг четвертый: проверить, все ли из выбранных реакций возможны. Не будут взаимодействовать фторид калия с дихроматом калия, фторид калия с гидроксидом рубидия, так как не получаются неэлектролиты и слабые электролиты. (Соединяющие эти вещества линии нужно убрать) K2Cr2O7, H2SO4, KF, RbOH Соль кислота соль Щелочь Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ» Шаг пятый: под всеми веществами подписать окислительно-восстановительные свойства. Дихромат и концентрированная серная кислота – окислители, так как хром и сера в них находятся в высших степенях окисления, щелочь и фторид калия не проявляют окислительно-восстановительных свойств. Следовательно, окислительновосстановительных реакций не может быть. K2Cr2O7, H2SO4, KF, RbOH Ок-ль ок-ль Шаг шестой: проанализируем результат: Итак: 1) Концентрированная серная кислота будет вытеснять более летучую и слабую фтороводородную кислоту из фторида; 2) Концентрированная серная кислота будет вытеснять более слабую и менее устойчивую кислоту из дихромата. 3) Между гидроксидом рубидия и серной кислотой пройдет реакция нейтрализации. 4) Дихроматы в щелочной среде превращаются в хроматы. Шаг седьмой: записываем уравнения реакций, начиная с самого простого: 1. H2SO4 + 2RbOH = Rb2SO4 + 2H2O (или H2SO4 + RbOH = RbНSO4 + H2O) 2. H2SO4 + 2KF = K2SO4 + 2HF (или H2SO4 + KF = KНSO4 + HF) 3. K2Cr2O7 + 2H2SO4 = 2KНSO4+ H2O + 2CrO3 4. K2Cr2O7 +2RbOH = Rb2CrO4 + K2CrO4+ H2O Пример 3. Задание, которое повторяется 6 раз. Даны вещества: сера, сероводород, азотная кислота (конц.), серная кислота (конц.). Шаг первый: записать формулы предложенных в задании веществ. S H2S HNO3 H2SO4 Шаг второй: под каждым веществом подписать, к какому классу оно относится: S H2S HNO3 H2SO4 неметалл кислота кислота кислота Шаг третий: следуя схеме взаимодействия (см. занятие №5) соединить те вещества, которые могут реагировать. В соответствии со схемой вещества не могут реагировать. Шаг четвертый: под всеми веществами подписать окислительно-восстановительные свойства. Концентрированные серная и азотная кислоты – окислители, так как азот и сера в них находятся в высших степенях окисления, сероводород – восстановитель, так как сера находится в низшей степени окисления, сера проявляет окислительновосстановительную двойственность. S H2S HNO3 H2SO4 О/В в-ль ок-ль ок-ль Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ» Шаг пятый: соединим вещества, которые могут реагировать между собой как окислители и восстановители. S H2S HNO3 H2SO4 О/В в-ль ок-ль ок-ль Шаг шестой: проанализируем результат Итак: 1) Концентрированная серная кислота будет окислять серу и сероводород, восстанавливаясь до сернистого газа; 2) Концентрированная азотная кислота будет окислять серу и сероводород, восстанавливаясь до диоксида азота 3) Сероводород и серой образуют дисульфид водорода. Шаг седьмой: записываем уравнения реакций, начиная с самого простого: 1. 2H2SO4 + S = 3SO2 + 2H2O 2. 6HNO3 + S = H2SO4 + 6NO2 + 2H2O 3. 3H2SO4 + H2S = 4SO2 + 4H2O ( или H2SO4 + H2S = SO2 + S +2H2O) 4. 8HNO3 + H2S = H2SO4 + 8NO2 + 4H2O (или 2HNO3 + H2S = S + 2NO2 + 2H2O ) 5. H2S+ S = H2S2 Пример 4. Задание, которое повторяется 2 раза. Даны: раствор тетрагидроксоалюмината натрия, углекислый газ, магний, раствор хлорида алюминия Это задание нужно рассмотреть, так как здесь используется комплексное соединение, многие участники мастер-класса прислали задания с комплексными солями. Шаг первый: записать формулы предложенных в задании веществ. Na[Al(OH)4] CO2 Mg AlCl3 Шаг второй: под каждым веществом подписать, к какому классу оно относится: Na[Al(OH)4] CO2 Mg AlCl3 Соль кислотный оксид металл соль Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ» Шаг третий: следуя схеме взаимодействия (см. занятие №5) соединить те вещества, которые могут реагировать Na[Al(OH)4] CO2 Mg AlCl3 Соль кислотный оксид металл соль Шаг четвертый: проверить, все ли из выбранных реакций возможны. В нашем случае комплексная соль не будет реагировать с магнием (магний не может вытеснить натрий), углекислый газ не может реагировать с хлоридом алюминия, так как это соль бескислородной и сильной кислоты, а углекислый газ может вытеснить кислотный оксид из состава соли более слабой кислоты, или соответствующей более летучему оксиду. Уберем линии, соединяющие эти вещества. Na[Al(OH)4] CO2 Mg AlCl3 Соль кислотный оксид металл соль Шаг пятый: под всеми веществами подписать окислительно-восстановительные свойства. CO2 – окислитель, так как углерод находится в высшей степени окисления, магний –восстановитель. Предложенные соли могут проявлять слабые окислительные свойства из-за того, что алюминий находится в высшей степени окисления. Хлоридион может проявлять свойства восстановителя с сильным окислителем, которого в нашем примере нет. Na[Al(OH)4] CO2 Mg AlCl3 Ок-ль Ок-ль вос-ль Ок-ль Шаг шестой: соединим вещества, которые могут реагировать между собой как окислители и восстановители. Na[Al(OH)4] CO2 Mg AlCl3 Ок-ль Ок-ль вос-ль Ок-ль Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ» Шаг седьмой: совместим эти схемы и проанализируем результат: Na[Al(OH)4] CO2 Mg Соль кислотный оксид Ок-ль Ок-ль AlCl3 металл соль вос-ль Ок-ль Итак: Продублировались реакции между углекислым газом и магнием, хлоридом алюминия и магнием, они обязательно пойдут. Из оставшихся реакций более вероятны взаимодействия комплексной соли с углекислым газом и хлоридом алюминия (это кислотно-основные взаимодействия), так как комплекс сильно щелочной, а углекислый газ и хлорид алюминия при растворении создают кислую среду. Магний же с щелочами при обычных условиях не реагирует. Шаг восьмой: записываем уравнения реакций, начиная с самого простого: 1. 2Mg + CO2 = 2MgO + C 2.3Mg + 2AlCl3 = 2Al + 3MgCl2 3. Na[Al(OH)4] + CO2 = NaHCO3+ Al(OH)3 4. 3Na[Al(OH)4] + AlCl3 = 3NaCl + 4Al(OH)3 Хочу обратить Ваше внимание на следующую закономерность: если реакция продублировалась, то она точно будет окислительно-восстановительной (обменное или кислотно-основное взаимодействие не пойдет). Рассмотрим последний пример: Пример 5. Задание повторяется 2 раза. Даны: железо, оксид железа (III), иодоводород и оксид железа (II). Fe Шаг первый: записать формулы предложенных в задании веществ. Fe2O3 HI Fe Шаг второй: под каждым веществом подписать, к какому классу оно относится: Fe2O3 HI FeO металл амфотерный оксид кислота FeO основный оксид Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ» Шаг третий: следуя схеме взаимодействия (см. занятие №5) соединить те вещества, которые могут реагировать Fe Fe2O3 HI FeO металл амфотерный оксид кислота основный оксид Шаг четвертый: проверить, все ли из выбранных реакций возможны. В нашем случае реакция железа с оксидом железа (II) не идёт, железо не может вытеснить само себя из оксида. (Соединяющую эти вещества линию нужно убрать) Шаг пятый: под всеми веществами подписать окислительно-восстановительные свойства. Железо – восстановитель, все остальные вещества проявляют окислительновосстановительную двойственность, но у оксида железа (III) в большей степени проявляются окислительные свойства, у оксида железа (II) – восстановительные, йодоводородная кислота – восстановитель за счет анионов йода, окислитель – счёт катионов водорода. Fe Fe2O3 HI FeO в-ль о/в о/в о/в Шаг шестой: соединим вещества, которые могут реагировать между собой как окислители и восстановители. Fe Fe2O3 HI FeO в-ль о/в о/в Шаг седьмой: совместим эти схемы и проанализируем результат: Fe Fe2O3 HI металл в-ль амфотерный оксид о/в кислота о/в о/в FeO основный оксид о/в Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ» Итак: все взаимодействия продублировались, все они возможны. Шаг восьмой: записываем уравнения реакций, начиная с самого простого (или очевидного): 1. Fe + 2HI = FeI2 + H2 2. FeO + 2HI = FeI2 + H2O 3. Fe + Fe2O3 = 3FeO 4. Fe2O3+ 6HI = 2FeI2 + I2 + 3H2O При работе по этой методике с учащимися нужно требовать, чтобы они выучили схему взаимодействий веществ, первоначально можно разрешать подсматривать в нее, но по мере того, как накапливается опыт решения заданий, использование схемы в качестве подсказки нужно исключить. Задание Вам предстоит решить 5 заданий С2 (все примеры взяты из входных заданий участников мастер-класса). Рассуждения можно не записывать. Нужен только ответ – 4 уравнения реакций, которые возможны между предложенными веществами. Если реакция может проходить по-разному, второй вариант записывайте в скобках. Обращайте внимание на то, в каком виде даются вещества: раствор, концентрированный раствор, кристаллическое вещество. Если это в задании не указывается, Вы имеете право использовать как разбавленные и концентрированные растворы, так и чистые вещества. При составлении уравнений реакций нужно указывать, в каком виде Вы использовали вещество. Для всех реакций желательно указывать условия. 1) Даны вещества: кремний, гидрокарбонат натрия, гидроксид калия, соляная кислота. 2) Даны вещества: хлорид меди (II), кислород, концентрированная серная кислота, йодоводород. 3) Даны вещества: оксид кальция, углерод (графит или кокс), оксид железа(II), азотная кислота (конц.). 4) Даны растворы: тетрагидроксоалюмината калия, хлорида хрома (III), карбоната калия и угольной кислоты. 5) Даны вещества: конц. азотная кислота и растворы карбоната натрия, хлорида алюминия, сульфита натрия. Напишите уравнения четырех возможных реакций между всеми предложенными веществами, не повторяя пары реагентов. Ответы (с указанием фамилии) оформляются в файле WORD, имя файла Familija-Z-6. (Familija- фамилия участника – англ.) Работы, выполненные в WORDe, отправляются электронной почтой на адрес [email protected], с обязательным указанием в Теме письма слов "Мастер-класс" с указанием номера задания ( Z6) и фамилии (Например: Мастер-класс, Z6, Иванов А.А.). Контрольный срок выполнения задания №6 до 21-00 мск вр, 28.02.11 (понедельник).