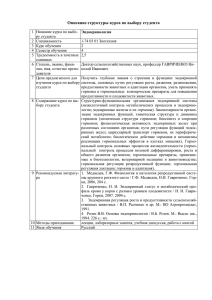
Биохимия гормонов
реклама

Государственное образовательное учреждение высшего профессионального образования Московский государственный медико-стоматологический университет Кафедра биохимии Огнивенко В. М. Биохимия гормонов Учебно-методическое пособие для самостоятельной работы студентов медицинских вузов Москва 2007 1. Гормоны – сигнальные молекулы. Взаимоотношения между клетками в организме являются важным моментом в их существовании и реализуются с участием нервной и эндокринной систем. Эндокринные железы продуцируют для этого гормоны. Гормоны – органические вещества различной химической природы, выделяемые железистыми клетками в кровь или лимфу, регулирующие обмен веществ и физиологические функции путем передачи сигналов от ЦНС клеткам тканей и органов. Биохимия изучает химическую структуру гормонов, их биосинтез и катаболизм, влияние на обмен веществ и механизм действия, в том числе на молекулярном уровне. Термин «гормоны» (от греч. χορμείω – пришпориваю, побуждаю) был предложен Э. Г. Старлингом в 1905 году для обозначения ряда известных к тому времени химических регуляторов. Однако из этого не следует , что все гормоны обладают только стимулирующим действием. Для них характерно участие в комплексных процессах и возбуждения, и торможения. Существует понятие «гормональная регуляция», учитывающая оба эти эффекта. Согласно классической модели эндокринной системы, гормоны, вырабатываемые железами внутренней секреции, поступают в кровь, доставляются ею в органы (ткани)-мишени и связываются со специфическими рецепторами. Гормонам присущ ряд общих признаков: а) дистантность действия, т. е. проявление активности в отдалении от места выделения; б) строгая специфичность эффекта; в) высокая биологическая активность; г) высокая скорость биосинтеза и распада; д) наличие посреднических функций между ЦНС и тканями. Регуляторы, у которых нет хотя бы одного из выше названных признаков, относятся к гормоноидам (парагормонам). Гормоны, как сигнальные молекулы, входят в группу так называемых информонов – веществ, вне зависимости от их химической природы, места образования и механизма действия, передающих межклеточную информацию. Все клетки должны «работать» согласованно, в соответствии с нуждами целого организма, о которых они узнают из посылаемых им сигналов. Различают несколько групп регуляторов, передающих в клетки эти сигналы. К ним относятся гормоны, нейростимуляторы, белки иммунной системы, оксид азота.(рис. 1.1) Гормоны Гормоноиды (медиаторы, вещества, вырабатываемые клетками APUDГормоноиды (медиаторы, вещества, системы, эйкозаноиды, цитонины, ретиноевая кислота и другие) Информоны – cигнальные молекулы Нейромедиаторы Семейства белков иммунной системы: иммуноглобулины (Ig), Трецепторные белки, белки главного комплекса гистосовместимости (белки ГКГ) Оксид азота (NO) Рис. 1.1 Виды сигнальных молекул – информонов. Сигналы таких биологически активных соединений регистрируются клетками-мишенями. Это сопровождается изменениями режима их функционирования. Различают несколько видов регуляции , осуществляемой информонами. (табл. 1.1) Таблица 1.1. Виды регуляции, осуществляемой сигнальными молекулами. Вид регуляции Общая характеристика информонами регуляции Эндокринная Гормоны из желез переносятся кровью к отдаленным органам (тканям)-мишеням Паракринная Конкретные случаи данного вида регуляции Кортикотропин, вырабатываемый аденогипофизом, воздействует на кору надпочечников. Вазопрессин из нейрогипофиза влияет на клетки почечных канальцев Сигнальные молекулы Инсулин из B(β)-клеток действуют на близлежащие поджелудочной железы клетки подавляет секрецию глюкагона A(α)-клетками, находящимися здесь же. Соматостатин, вырабатываемый D(δ)-клетками островков Лангерганса, снижает выделение и инсулина, и Аутокринная глюкагона. Секреторная клетка является В островках Лангерганса сама же своей мишенью поджелудочной железы инсулин, синтезируемый в βклетках, регулирует собственную выработку в этих же клетках. Среди сигнальных молекул есть неполярные, например, стероидные гормоны, йодтиронин, ретиноевая кислота, которые попадают внутрь клетокмишеней, преодолевая плазматические мембраны и полярные (белки, полипептиды, катехоламины и др.), которые в клетки не проникают. Они связываются на их поверхности со специализированными белками-рецепторами, которые и отвечают за передачу сигналов. Образование комплекса «сигнальная молекула – рецептор» инициирует цепь последовательно протекающих событий внутри клеток. Изучение их характера позволяет раскрыть механизм передачи сигнала и механизм действия различных информонов. Считают, что сигнальные молекулы регулируют как минимум два вида клеточной активации. Это могут быть процессы, не затрагивающие геном и эффекты, сопровождающиеся ускорением экспрессии генов. Не касаясь пока гормонов, кратко о других сигнальных молекулах. Медиаторы – группа гормоноидов с пара- и аутокринным действием, вырабатываемых в клетках различных тканей и органов, нередко с конкретной целью. Например, медиаторы воспаления представляют из себя факторы, формирующие видимые проявления этого процесса: боль, отек, покраснение, локальное повышение температуры. В их число входят гистамин, серотонин, кинины, эйкозаноиды, цитокины и др. Дж. Э. Пирс в 1968 году назвал клетки, способные секретировать такие сигнальные молекулы, «апудоцитами» и выдвинул концепцию APUD-системы (АРИД – это аббревиатура от англ. фразы Amine Precursor Uptake, Decarboxylate – предшественников аминов захват, декарбоксилирование). Он считал, что секреторные клетки, находящиеся в различных тканях и органах и формирующие APUD-систему, имеют общие черты: содержат амины, могут in vivo захватывать их предшественников, т. е. аминокислоты, содержат ферменты декарбоксилазы аминокислот. В эту систему он объединил 12 типов клеток (нейроэндокринные, энтерохромаффинные, аргептаффинные, осмофильные и др.), секретирующих 15 гормонов (ГАМК, дофамин, триптамин, гистамин и т. д.). Впоследствии количество видов «апудоцитов» достигло 50 и более. Их обнаружили в различных органах как обладающих, так и не обладающих эндокринной функцией (гипофизе, эпифизе, щитовидной и паращитовидной железах, желудочно-кишечном тракте, поджелудочной железе, печени, надпочечниках, пищеводе, трахее, бронхах, почках и др.). Оказалось, что эти клетки продуцируют не только амины, они могут образовывать и регуляторные пептиды (атриопептизин, секретин, энтерогастрон, химоденин, вилликинин, холецистокинин-панкреозимин, ЖИП, VIP, субстанция Р, мотилин и т. д.) и даже химические соединения другой природы. К последним относятся гепарин – гетерополисахарид, образующийся в тучных клетках соединительной ткани, полиамины (спермин, спермидин), закись азота (NO˙ сигнальная молекула), синтезирующиеся во многих тканях организма и другие. В настоящее время представление об APUD-системе имеет исторический интерес. Эйкозаноиды – медиаторы, обладающие широким спектром биологической активности. В эту группу сигнальных молекул входят простагландины, простациклины, тромбоксаны, лейкотриены. Все они синтезируются из полиненасыщенных жирных кислот (ПНЖК), содержащих 20 углеродных атомов (греч. είκοςί, эйкози – двадцать). Именно поэтому их называют эйкозаноиды. В организме они представлены тремя семействами, синтезируемыми из ПНЖК, содержащими от 3-х до 5-ти двойных связей: эйкозатриеновой ( C20: Δ8, 11, 14 , ω- 6), эйкозатетраеновой (арахидоновой, C20: Δ5, 8, 11, 14, ω – 6), эйкозапентаеновой (тимнодоновой, C20: Δ5, 8, 11, 14, 17, ω – 3). Наиболее активными являются эйкозаноиды второго семейства, образованные из арахидоновой кислоты. (рис. 1.2) Указанные кислоты освобождаются из свободных глицерофосфолипидов фосфолипазой А2, ингибиторами которой являются стероидные гормоны. Они также могут синтезироваться из линолевой кислоты, попадающей в организм с пищей. Она, как известно, для человека является незаменимым (эссенциальным) фактором – витамин F. Эйкозаноиды – чрезвычайно лабильные вещества. Так, простагландины при однократном прохождении через легкие почти полностью окисляются и теряют 98% своей активности. Тромбоксан А2 (ТхА2) при 37˚С имеет период полужизни 30 сек. Простациклины также нестабильны. Период полужизни (Т 1/2) их составляет всего 2 – 3 минуты при нейтральном рН. Все они быстро катаболизируют. При этом происходит их окисление с ω-конца и образование растворимых дикарбоновых кислот, которые далее включаются в общий метаболический пул. Первоначально были открыты простагландины. Их рассматривали как компоненты секрета предстательной железы – простаты. Отсюда название, которое им дал Эйлер (1937г.). Сейчас известно, что они образуются во всех клетках тканей организма, за исключением эритроцитов. Номенклатура простагландинов несовершенна. Различия циклической части в структуре простагландинов отображены в делении их на несколько типов, обозначаемых буквами латинского алфавита (A, B, C, D, E, F, G, H). Число двойных связей в боковых частях молекул показано подстрочными цифровыми индексами (например, Pg E7, Pg E2, Pg E3). Биосинтез простагландинов включает внедрение кислорода в ПНЖК – предшественники и формирование циклопентанового кольца (рис. 1.2). Это происходит под действием оксигеназы, входящей в состав полиферментного комплекса – простагландинсинтазы. Вначале образуются биологически активные промежуточные продукты – эндопероксиды простагландинов (Pg H2), превращающиеся в разных клетках тканей в неодинаковые конечные продукты (Pg E2, Pg F2, Pg A2), тромбоксаны (ТхА2), простациклины (Pg I2). Лейкотриены (Lt A, B, C), не имеющие в своей структуре цикла, образуются под действием липоксигеназы. Из линолевой кислоты (С18: Δ9, 12, ω – 6) при участии эпоксигеназы (цитохром Р 450) могут синтезироваться эпоксиды. (рис. 1.2) Рис. 1.2. Биосинтез простагландинов, тромбоксанов, простациклинов, лейкотриенов, эпоксидов. Эйкозаноиды обладают широким спектром биологического действия и чрезвычайно высокой активностью. Нередко по своим эффектам они бывают антагонистами. Так, Pg F2, синтезирующийся почти во всех тканях и органах, способствует сокращению гладких мышц (бронхи, матка, кишечник и др.) и сужению сосудов. Pg E2, напротив, расслабляет эти мышцы и расширяет сосуды. В целом Pg F2 – медиатор воспаления, аллергии, а Pg E2 – противовоспалительный, противоаллергический фактор. Pg E1, E2 подавляют секрецию HCl в желудке, блокируя Н2 рецепторы. Этим объясняют ускорение ими заживления язв желудка и двенадцатиперстной кишки. Препараты Pg F2, например динопрост, используются в акушерстве для прерывания беременности и как средство стимуляции родовой деятельности матки. Лекарственные препараты Pg E2 (динопростон, простенон) применяются для купирования приступов бронхиальной астмы, язвенной болезни, гипертонических кризов. Тромбоксаны (ТхА1, ТхА2), образующиеся в тромбоцитах, способствуют тромбированию сосудов, так как вызывает слипание этих клеток и тем самым облегчает участие тромбоцитарных факторов в свертывании крови. Простациклины (Pg I2), напротив, секретируясь в кровь из клеток сосудистых стенок, подавляют агрегацию тромбоцитов. Соотношение простациклины/тромбоксаны имеет важное значение в развитии тромбоза. Тромбоксаны и простациклины, являясь антагонистами, по-разному влияют на сосудистый тонус. Первые сужают сосуды и повышают артериальное давление. Эффект у вторых противоположный. Лейкотриены (Lt A, B, C, D, E) – эйкозаноиды лейкоцитов. Физиологическое действие оказывают в виде парных соединений с глутатионом. (рис. 1.3) Рис. 1.3. Лейкотриен С4 в комплексе с глутатионом. Их считают медиаторами воспаления. Они увеличивают проницаемость капилляров, способствуют хемотаксису лейкоцитов, т. е. стимулируют их движение в зону воспаления. Лейкоциты усиленно фагоцитируют чужеродные частицы, в них активируется биосинтез лизосомальных ферментов и образование супероксид анион радикала (О2¯˙) и других активных форм кислорода. Лейкотриены также сужают коронарнуе сосуды и усиливают сокращение гладких мышц бронхов, пролонгируя приступ бронхиальной астмы. Эпоксиды ПЖНК образуются преимущественно в клетках почек и печени. Оказывая сильное сосудорасширяющее действие, они порой способствуют неоваскуляризации тканей. Глюкокортикоиды (кортизол, кортизон, кортикостерон) и их синтетические аналоги (дексаметазон, и др.) индуцируют биосинтез белков липотриенов. Последние ингибируют фосфолипазу А2. Наблюдается снижение секреции эйкозаноидов, в том числе и противовоспалительного ряда (Pg F2, лейкотриены и др.). В этом суть противовоспалительного эффекта стероидных гормонов. Негормональные противовоспалительные средства (аспирин, диклофенак, индометацин и др.), ингибируя циклооксигеназу, препятствуют синтезу простагландинов, а рутин и его аналоги с Р-витаминной активностью, угнетая липоксигеназу, снижает образование лейкотриенов. Этим и те, и другие уменьшают признаки воспаления. А снижение аспирином и его аналогами боисинтеза тромбоксанов придает им слабый антикоагулянтный эффект. При этом увеличивается длительность кровотечения. Цитокины – сигнальные молекулы, продуцируемые различными типами клеток (моноциты, макрофаги, базофилы, фибробласты, тучные клетки и т. д.) при их определенных функциональных состояниях и стадиях развития. Часто они образуются в ответ на различные стимулы, как то: механические повреждения клеток, вирусная инфекция, метаболические нарушения и др. Но в любом случае они участвуют в регуляции межклеточных взаимодействий. Спектр активности цитокинов многогранный. Они контролируют рост, дифференцировку и продолжительность жизни клеток, управляют апоптозом. Различные их группы участвуют в реализации неспецифических защитных реакций организма, оказывая влияние на воспалительные процессы, свертывание крови, артериальное давление, биосинтез белков острой фазы и другие. Цитокины контролируют формирование и «работу» иммунной системы. В целом все они образуют своеобразную регуляторную сетку с перекрещивающимися эффектами. В действии многих из них наблюдается синергизм, а в ряде случаев и антагонизм. Цитокины паракринно или апокринно влияют на клетки через мембранные рецепторы. Каскадным механизмом они активируют белки, регулирующие транскрипцию в геном. Последние могут ее либо ускорять через энхансерные элементы ДНК, либо замедлять через сайленсорные нуклеотидные последовательности. В результате они усиливают или подавляют биосинтез различных белков, а это отражается на функциональном состоянии клеток. Будучи пептидами или белками по химической природе, цитокины образуют многочисленные семейства со специфическими для каждого из них эффектами. 1. Регуляторные факторы развития, чаще называемые факторами роста (ФР) – большая группа цитокинов. Ускоряя репликацию ДНК и транскрипции РНК, воздействуя на проницаемость биологических мембран и различные реакции метаболизма в клетках, они обладают митогенным и морфогенным эффектами. Следовательно, они стимулируют деление клеток-предшественников и способствуют их дифференцировке. Первым был открыт фактор роста из тромбоцитов (ТФР), который, как потом было показано, образуется и во многих других клетках. К этой группе регуляторов относятся факторы роста скелета, фактор роста эпидермиса (ФРЭ), фактор роста фибробластов (ФРФ), инсулиноподобные факторы I, II – соматомедины I, II (ИФР I, II), фактор роста из хряща (ФРХ), фактор роста нервов (ФРН), эритропоэтины, эндотелиальный фактор роста (ЭФР) и др. Большинство факторов роста были первоначально открыты благодаря митогенным эффектам, однако действие их нередко оказывалось сложнее. При определенных ситуациях один и тот же фактор может стимулировать или подавлять клеточную дифференцировку, вызывая совершенно различные изменения. В связи с этим термин «регуляторный фактор развития» для цитокинов этого семейства представляется более приемлемым. В остеобластах, остеоцитах синтезируются и секретируется во внеклеточный матрикс морфогенетический белок кости (МБК). Это комплекс двух протомеров: 17,5 кДа и 1,4 кДа. Его действие, еазываемое остеоиндукцией, проявляется в инициации митоза и дифференцировке перицитов (стволовые клетки) в скелетогенные. Фактор роста скелета (ФРСк, Мr 83 кДа) оказывает митогенное действие, стимулируя деление скелетогенных клеток, и обладает морфогенетическим эффектом, вызывая дифференцировку скелетогенных клеток в остеогенные. Костноэкстрагируемый фактор роста (КЭФР) представляет из себя два белка гликопротеина , Mr 25 и 10 кДа. Эти белки стимулируют митозы остеогенных клеток контактным способом. Трансформирующие факторы роста – α, β (ТФР α, β) влияют на рост и дифференцировку клеток различных тканей, стимулирующих биосинтез и секрецию компонентов внеклеточного матрикса. ТФР-β выделен из почек и тромбоцитов. Его образование активно происходит в случае необходимости заживления ран. Он стимулирует процессы восполнения компонентов внеклеточного матрикса в местах повреждения. Это способствует пролиферации и миграции клеток, и в итоге восстановлению нормальной ткани. 2. Интерлейкины (ИЛ) – это сигнальные молекулы, обеспечивающие взаимодействия между клетками, вовлекаемыми в защитный, в том числе иммунный ответ. Отдельным их представителям присущи и другие эффекты. Свое название они получили, когда было показано, что посредством их секреции одни лейкоциты оказывают влияние на другие лейкоциты. Известно не менее 15 интерлейкинов: ИЛ-1 (синоним монокин) – медиатор воспаления, способствующий биосинтезу белков острой фазы, ИЛ-2 (лимфокин) – стимулирует пролиферацию Т-лимфоцитов; ИЛ-8 (хемонин), вызывает хемотаксис нейтрофилов и т. д. вплоть до №15. 3. Колониестимулирующие факторы (КСФ) необходимы для пролиферации и дифференцировки гемопоэтических клеток. А назвали их впервые так потому, что в эксперименте они стимулировали рост колоний определенных лейкоцитов. 4. Факторы некроза опухолей (ФНО) – многофункциональные цитокины, обладающие цитостатическим и цитотоксическим эффектами по отношению к злокачественным клеткам. Использование их в качестве противоопухолевого средства оказалось безуспешным из-за их высокой токсичности для человека. Предпринимаются попытки разработать их модифицированные нетоксичные формы с преимущественным противоопухолевым действием. 5. Факторы супрессии (ФС) – белки, предотвращающие возникновение мутаций ДНК путем восстановления первоначальной рамки считывания. 6. Интерфероны (ИФН) – гликопротеины с антивирусной активностью. Установлено существование их нескольких типов (α, β, γ, ω). Это белки с М r от 25 до 40 кДа. Образуясь в различных клетках (лейкоциты, фибробласты, макрофаги и др.), они снижают проявление вирусной агрессии. Благодаря антипролиферативной активности интерфероны защищают клетки не только от вирусной инфекции, но и обладают противоопухолевым действием. Хотя работа иммунной системы контролируется цитокинами и регулируется другими факторами, некоторые ее белки и сами являются на определенных этапах сигнальными молекулами, либо играют роль рецепторов для различных антигенов. Она включается в ответ на попадание в организм различных молекул (антигенов) совместно с патогенной микрофлорой, а также используется для борьбы с собственными мутантными клетками. Все это надо сначала распознать, а затем и уничтожить. В биосинтезе трех семейств белков иммунной системы участвуют почти все клетки организма. В-лимфоциты секретируют в кровь иммуноглобулины (Ig), которые формируют в плазме крови фракцию γ-глобулинов. Это первое семейство белков гуморального иммунитета. Т-лимфоциты синтезируют второе семейство белков – Т-рецепторов, которые затем встраиваются в их плазматические мембраны (ПМ) и подобно Ig связываются с различными антигенами. Их вариабельные центры связывания экспонированы наружу. Третье семейство белков иммунной системы – белки главного комплекса гистосовместимости (белки ГКГ) имеются в ПМ клеток почти всех тканей и органов. Белки второго и третьего семейств формируют т. н. клеточный иммунитет. Лигандами для них являются небольшие пептиды, образующиеся при протеолизе как собственных белков организма, так и чужеродных белков-антигенов. Способность взаимодействовать с самыми различными химическими соединениями достигается широкой вариабельностью структуры Т-рецепторов и белков ГКГ. Существование в организме иммунной системы обеспечивает его защиту от чужеродных или собственных антигенов, играющих в этом случае роль своеобразных сигнальных молекул. Эффекты оксида азота как сигнальной молекулы зависят от его redoxформы. Наиболее активным является N˙O-радикал, имеющий неспаренный электрон (˙N=O). Он имеет высокую реакционную способность и обладает многочисленными, порой неоднозначными эффектами. Оксид азота легко диффундирует через мембраны. Он обеспечивает передачу аутокринных и паракринных сигналов и, следовательно, является участником процессов межклеточного взаимодействия. Если N˙O синтезируется в значительных количествах, происходит его взаимодействие с супероксид анион радикалом (O2¯˙). И тогда нарабатывается пероксинитрит (ONOO¯). Последний обеспечивает образование гидроксильного радикала (О˙Н). Все они (N˙O, ONOO¯, O˙H) могут инициировать свободнорадикальное окисление липидов, белков, нуклеиновых кислот. В этом случае можно говорить о цитотоксическом действии N˙O – сигнальной молекулы. Образование N˙O в клетках тканей происходит с участием фермента N˙Осинтазы при окислении гуанидиновой группы катаболизируемого аргинина. Реакция идет в несколько стадий. Для этого требуется НАД∙Н+Н+, ФАД, ФМН, ТГБП, Zn2+, гем, белок кальмодулин. (рис. 1.4) Рис. 1.4. Реакция образования N˙O-радикала при катаболизме аргинина. Время полужизни молекулы N˙O (Т1/2) составляет несколько секунд. Они быстро превращаются в нитриты, нитраты и выводятся с мочой, а также обнаруживаются и в смешанной слюне. Как сигнальная молекула N˙O выступает в роли фактора, контролирующего секрецию ряда медиаторов и гормонов, обладает сосудорасширяющим действием (рис. 4.9), является активным участником таких процессов как экспрессия генов, пролиферация клеток, апоптоз. Молекула NО обладает способностью ускорять и блокировать апоптоз. Последний является запрограммированной гибелью клеток путем их «аккуратной» разборки. Двойственность NO в отношении этого процесса объясняется его способностью существовать в различных redox-формах, различной продолжительностью его биосинтеза, взаимодействиями с окружающими молекулами. В медицине нашли применение как препараты-доноры оксида азота, так и ингибиторы N˙O-синтазы. К числу первых относятся нитроглицерин, нитрокруосид, аэрозоль изокет®, содержащая изосорбида динитрат и др. Их применение снижает тонус сосудов , уменьшает силу сердечных сокращений и является эффективным при необходимости купирования резких болей в области сердца. Использование ингибиторов NO-синтазы оказывается полезным при оказании помощи больным с сосудистыми коллапсами. Задание 1.1. 1. Назовите признаки, присущие гормонам. 2. Перечислите виды регуляции, осуществляемые сигнальными молекулами. 3. Составьте схему образования эйкозаноидов в клетках различных тканей и органов. 4. Обсудите роль эйкозаноидов в реализации глюкокортикоидами их противовоспалительной активности. 5. Назовите семейства, выделяемые у цитокинов. 6. Ответьте на вопросы: Что такое гормоны? Из чего слагается классическая модель эндокринной системы? Какие сигнальные молекулы относятся к гормоноидам? Почему концепция Дж. Э. Пирса (1968г.) представляет лишь исторический интерес? Какие семейства различают среди белков иммунной системы? Почему оксид азота обладает неоднозначными эффектами? Для чего в медицине применяют лекарственные препараты доноры N˙O и ингибиторы N˙O-синтазы? Задание 1.2. Решите тесты: Относительно гормонов биохимия изучает: А. Химическую природу Б. Механизм действия В. Дозы гормональных лекарственных препаратов Г. Биосинтез и катаболизм в тканях организма Д. Противопоказания при лечении гормонами различных заболеваний Оцените достоверность утверждений в каждом предложении и связь между ними: Понятие «гормональная регуляция» учитывает стимулирующее и тормозящее влияние на обмен веществ и физиологические функции, потому что гормоны обладают высокой биологической активностью и дистантностью действия. Эйкозаноиды являются медиаторами с широким спектром биологической активности, потому что в организме они представлены тремя семействами, синтезируемыми из ПНЖК с двадцатью углеродными атомами. Регуляторными факторами развития – факторами роста – являются: А. Факторы роста эпилермиса Б. Соматомедины В. Соматотропин Г. Тромбоцитарный фактор роста Д. Морфогенетический белок кости Указанные цитокины проявляют эффекты: 1. Факторы некроза А. Обладает митогенным и опухолей морфогенным действием 2. Факторы роста Б. Предотвращает возникновение 3. Колониестимулирующие мутаций ДНК путем восстановления факторы первоначальной формы считывания 4. Факторы супрессии В. Обладает цитостатическим и 5. Интерлейкины цитокинетическим действием 6. Интерфероны Г. Обеспечивает взаимодействие между клетками, вовлекаемыми в защитный, в том числе иммунный, ответ Д. Нет правильного ответа Задание 1.3. Решите задачу: Больной ревматизмом длительное время принимал аспирин. В результате у него стали появляться носовые кровотечения, выделение крови долго не останавливалось при ссадинах и порезах кожи. С чем связано возникновение указанных осложнений продолжительной терапии аспирином? 2. Номенклатура, классификация, биосинтез и катаболизм гормонов. Не существует единого принципа классификации и номенклатуры гормонов. Хотя химическая природа почти всех их выяснена и каждому из них может быть дано точное название в соответствии с его структурой, более приемлемой оказалась тривиальная номенклатура. Объясняется это тем, что химические названия многих гормонов необычайно громоздкие и сложные, а в случаях гормонов-белков или полипептидов практически неприемлемы. Тривиальные названия могут отражать происхождение гормона, т. е. место его образования. Примерами таких гормонов служат инсулин (от лат. insula – островок), тимозин – гормон тимуса, паратирин, секретируемый паратиреоидными железами. В некоторых случаях в названии гормонов отражена их функция (вазопрессин, кальцитонин, глюкагон и др.) Неоднозначной оказалась номенклатура гормонов гипоталамуса, открытых в 1971 – 75 г. г. Эти вещества контролируют выработку гормонов гипофиза. Вначале они получили наименование нейрогормонов, затем рилизингфакторов (от англ. release – освобождать) и лишь позже либеринов. Гормоны с противоположным действием назвали ингибирующими факторами, или статинами. Теперь принято в первой части названия произносить соответствующий гормон гипофиза и добавлять окончания «либерин» или «статин». (см. табл. 2.1) Иногда пользуются аббревиатурой прежних названий. Таблица 2.1. Номенклатура гормонов гипоталамуса. Прежнее название Гонадотропин-рилизинг-фактор Тиреотропин-рилизинг-фактор Кортикотропин-рилизинг-фактор Соматотропин-рилизинг-фактор Пролактин-рилизинг-фактор Меланотропин-рилизинг-фактор Соматотропинингибирующий фактор Пролактинингибирующий фактор Меланотропинингибирующий фактор Аббревиатура ГРФ ТРФ КРФ СРФ ПРФ МРФ СИФ ПИФ МИФ Современное название Гонадолиберин Тиреолиберин Кортиколиберин Соматолиберин Пролактолиберин Меланолиберин Соматостатин Пролактостатин Меланостатин Тропные гормоны гипофиза имеют тройственную номенклатуру. Реже используются громоздкие названия этих гормонов или аббревиатура. Чаще рекомендуют применять лаконичные их аналоги. (см. табл. 2.2) Таблица 2.2. Номенклатура тройных гормонов передней и средней долей гипофиза. Реже используемые Аббревиатура Лаконичное название громоздкие названия Адренокортикотропный гормон Соматотропный гормон Тиреотропный гормон Лактогенный гормон Фолликулостимулирующий гормон Лютеинизирующий гормон α, β, γ-меланоцитостимулирующие гормоны β, γ-липотропные гормоны АКТГ СТГ ТТГ ЛТГ ФСГ ЛГ α, β, γ-МСГ β, γ-ЛПГ Кортикотропин Соматотропин Тиреотропин Пролактин Фоллитропин Лютропин α, β, меланотропины β, γ-липотропины γ- Существует и несколько принципов классификации гормонов. Анатомический – предусматривает деление эндокринных желез на т. п. центральные и периферические. К первым относятся эпифиз, гипоталамус, гипофиз, ко вторым – все остальные. В эпифизе вырабатывается мелатонин – ингибитор синтеза гонадотропинов в гипофизе и адреногломерулотропин, который, возможно, стимулирует секрецию альдостерона в коре надпочечников. Гипоталамус является местом биосинтеза регуляторов функции гипофиза. (см. табл. 3.1) Здесь также синтезируются вазопрессин и окситоцин в виде пептидовпредшественников, которые по аксонам нейронов поступают в нейрогипофиз, а там методом ограниченного протеолиза превращаются в активные гормоны. Гипофиз секретирует тропные гормоны (см. табл. 2.3), регулирующие широкий спектр физиологических функций в организме. Гормоны периферических желез представлены в таблице 2.3. Таблица 2.3. Общие сведения о гормонах периферических эндокринных желез. Названия желез, их зон, клеток Гормоны Щитовидная железа: эпителиальные Трийодтиронин (L-3, 5, 3'-трийодтиронины) фолликулярные клетки Тироксин (3, 5, 3', 5'-тетрайодтиронин) светлые парафолликулярные Кальцитонин (тиреокальцитонин) клетки («С»-клетки) Паращитовидные железы: главные клетки Надпочечники: Кора надпочечников клубочковая зона Паратирин (паратиреокрин, паратгормон, паратиреоидный гормон, гормон паращитовидных желез) Минералокортикоиды (альдостерон, 11- (15% толщины коры) сетчатая зона (10% толщины коры) Мозговая часть надпочечников (хромаффинные клетки) дезоксикортикостерон) Глюкокортикоиды (кортизол, 17-гидрокортизон, кортизон, кортикостерон) Гормоны типа андрогенов (дегидроэпиандростерон, андростендион) Катехоламины (адреналин и норадренали) Поджелудочная железа островки Лангерганса (около 1 млн) Втом числе от всей массы островков составляют: Глюкагон A(α)-клетки около 15% Инсулин B(β)-клетки около 70% Панкреатический соматостатин D(δ)-клетки около 10% Панкреатический полипептид F(f)-клетки около 5% Половые железы а) Семенники яичек клетки Лейдига клетки Сертоли б) Яичники клетки theca interna («тека») клетки theca granulos («гранулеза») 1. Андрогены (андростендион, тестостерон, частично превращающийся в клетках-мишенях в 5α-дигидростерон) 2. 80% эстрогенов: - ингибируются - активируются Андрогены, мигрирующие через базальную мембрану в клетки гранулеза и там с участием ароматидного ферментного комплекса превращающиеся в эстрогены (эстрадион, эстрон, эстрион) Прогестин (прогестерон) в) Желтое тело, образующееся из остатков доминантного фолликула г) Плацента (временная эндокринная железа во время беременности) 1. Прогестины (прогестерон) 2. Эстрогены 3. Тестостерон 4. Плацентарный лактоген 5. Хорионический гонадотропин 6. Тиреотропин Тимозин Тимус Однако классификация гормонов в зависимости от места их происхождения оказалась несостоятельной. Есть случаи, когда одни и те же гормоны синтезируются несколькими железами. Они синтезируются в одних, а секретируются другими эндокринными органами (вазопрессин, окситоцин). По химической природе гормоны и гормоноиды представляют собой довольно разные химические соединения, но в основном они делятся на три группы. 1. Гормоны белковой природы: а) гормоны-белки (лютотропин, фоллитропин, тиреотропин, соматотропин, инсулин и др.) б) гормоны-пептиды (кортикотропин, вазопрессин, окситоцин, гормоны гипоталамуса, ангиотензин, кинины и т. д.) в) гормоны – производные белкового обмена, например, производные аминокислот (адреналин, йодтиронин, мелатонин) 2. Гормоны стероидной природы – производные холестерола. Различают две их разновидности: а) гормоны с интактным стероидным ядром (состоят из 4-х колец – A, B, C, D циклопентанпергидродгенантрена), вырабатываемые в коре надпочечников глюкокортикоидами (кортизол, кортизон, кортикостерон) и минералокортикоидами (альдостерон, дзоксикортикостерон), в гонадах андрогенами (тестостерон) и эстрогенами (эстриол, эстрадиол, эстрон), в плаценте прогестинами (прогестерон) б) стероиды с разорванным β-стероидным кольцом, представлены гормональными формами витамина D 1, 25-дигидроксикальциферолом (1, 25(ОН)2D3) и 24, 25-дигидроксикальциферолом (24, 25(ОН)2D3) 3. Эйкозаноиды – продукты превращения полиненасыщенных (С20:Δn) жирных кислот (простагландины, лейкотриены, тромбоксаны, простациклины). По биологической активности гормоны делятся на пять групп. 1. Гормоны, регулирующие обмен углеводов, липидов, белков, аминокислот (йодтиронин, инсулин, глюкагон, адреналин, глюкокортикоиды). 2. Гормоны, регулирующие водно-солевой обмен (минералокортикоиды, вазопрессин, АНФ, компоненты ренин-ангиотензивной системы. 3. Гормоны, действующие не фосфорно-кальциевый обмен (паратирин, кальцитонин, 1, 25(ОН)2D3, 24, 25(ОН)2 D3, каротин). 4. Гормоны, реализующие репродуктивные функции (андрогены, эстрогены, прогестины). 5. Гормоны, влияющие на функциональное состояние эндокринных желез (рилизинг-факторы гипоталамуса, тропные гормоны гипофиза). По растворимости гормоны делятся на: 1. Гидрофильные, растворимые в воде. 2. Липофильные (гидрофобные), растворимые в неполярных растворителях. К гидрофильным относятся гормоны белково-пептидной природы, адреналин. Липофильными являются стероидные гормоны, йодтиронин, с определенными допущениями ретиноевая кислота и регулятор некоторых процессов оксид азота (NO˙). Биосинтез гормонов происходит обычно так же, как и образование аналогичных им веществ в неэндокринных тканях. Отличия состоят лишь в том, что секреторные клетки как правило синтезируют те или иные гормоны с целью поставки их на экспорт. Они обладают для этого аппаратом секреции, реализующим свою функцию при поступлении соответствующих сигналов. Биосинтез белково-пептидных гормонов включает те же этапы, что и у любых других белков. Транскрипция и посттранскрипционный процессинг обеспечивают образование в ядре мРНК. На рибосомах в цитоплазме обычно синтезируются белки-предшественники. Последние мигрируют в аппарат Гольджи, одновременно претерпевая серии различных посттрансляционных превращений. В виде сформировавшихся гормонов они накапливаются и хранятся в секреторных гранулах до тех пор, пока не поступят соответствующие сигналы об их высвобождении. Превращение белков-предшественников в активные гормоны обычно происходит методом ограниченного протеолиза. Белки или расщепляются на несколько отдельных молекул, или постепенно укорачиваются, образуя в конце концов, дееспособный гормон. Этот процесс порой происходит и в секреторных гранулах, но может осуществляться и после его секреции во внеклеточный матрикс. Например, в передней и промежуточной долях гипофиза синтезируется белок проопиомеланокортин (Mr 28,5 кДа, 265 аминокислотных остатков). Из него ограниченным протеолизом синтезируется кортикотропин. Вместе с тем в нем есть аминокислотные последовательности, обеспечивающие биосинтез и других гормонов, а именно, α, β, γ-меланотропинов, β, γ-липотропинов, α, βэндорфинов, мет-эпкедалина (рис. 2.1). Проопиомеланокортин γ-меланотропин (12 АМК остатков) прокортикотропин β-липотропин (91 АМК остаток) кортикотропин (39 АМК остатков) остатков) γ-липотропин (59 АМК остатков) β-эндорфин (30 АМК α-меланотропин (13 АМК остатков) β-меланотропин (17 АМК остатков) γ-эндорфин (14 АМК остатков) α-эндорфин (13 АМК остатков) мет-эпкедалин (4 АМК остатка) Рис. 2.1. Схема образования гормонов передней и средней долей гипофиза методом органического протеолиза из проопиомеланокортина. Паратгормон вырабатывается в виде большой молекулы-предшественникапрепрогормона, содержащего 115 аминокислотных остатков. В эндоплазматическом ретикулуме от него отщепляется 25 аминокислотных остатков. Образовавшийся прогормон в аппарате Гольджи превращается в зрелый гормон, включающий 84 аминокислотных остатка (паратирин 1 – 84). Паратгормон упаковывается и хранится в секреторных гранулах (везикулах). Белки, полипептиды, находящиеся в этих везикулах, высвобождаются путем экзоцитоза, при котором происходит слияние пузырьков с плазматической мембраной и выход содержимого во внеклеточный матрикс. Аминокислоты не только являются структурными единицами гормонов белково-пептидной природы, но и могут служить субстратами биосинтеза таких гормонов, как адреналин, йодтиронин, мелатонин. Адреналин синтезируется из незаменимой аминокислоты фенилаланина. Последний в монооксигеназной реакции превращается в тирозин. А еще раз гидроксилируясь, он становится дигидрооксифенилаланином (ДОФА). Далее ДОФА декарбоксилируется и превращается в дофамин. Еще одно гидроксилирование приводит к образованию адреналина, а его метилирование, осуществляющееся преимущественно в цитоплазме и гранулах хромаффинных клеток мозгового слоя надпочечников, приводит к образованию адреналина (рис. 2.2). Рис. 2.2. Схема биосинтеза катехоламинов в хромаффинных клетках мозгового слоя надпочечников. ТГБП – тетрагидробиоптерин; ДГБП – дигидробиоптерин; ПАЛФ – пиридоксальфосфат; SAL-S – аденозилметионин; SAF-S – аденозилгомоцистеин. Тиреоидные гормоны также являются производными тирозина (рис. 2.3). Рис. 2.3. Химическая природа гормонов щитовидной железы – йодтиронинов. Их биосинтез происходит в фолликулярных клетках и коллоиде, заполняющем полости фолликулов щитовидной железы. В клетках синтезируется белок гликопротеин, получивший название тиреоглобулин ( Mr 660 кДа). Он содержит 115 остатков тирозина. Из него позже получаются йодтиронины. Сюда же поступает и активируется йод, используемый для образования этих гормонов (рис. 2.4). Последовательность событий при этом следующая: 1. Поглощение йода клетками вторично активным транспортом с участием + Na , К¯-АТФ-азы. 2. Активирование йода в реакции: e¯(2e¯)···········→ H2O2 I I0(I+) Тиреойодидпироксидаза Активный йод Его поступление в коллоид. 3. Биосинтез тиреоглобулина на рибосомах. 4. Экзоцитоз тиреоглобулина в коллоид. 5. Йодирование тирозилов в тиреоглобулине с образованием йодтиреоглобулина. 6. Эндоцитоз йодтиреоглобулина обратно в клетки. 7. Гидролитическое расщепление йодтиреоглобулина лизосомальными протеиназами и образование йодтиронинов (трийодтиронина, Т3 и тироксина, Т4). 8. Секреция Т3, Т4 в кровь. Синтез и секреция Т3, Т4 находятся под контролем тиреотропина из аденогипофиза. В крови йодтиронины образуют комплексы с белками (транстиретином (ТСБ), альбуминами, α1-глобулинами (ТСГ)) и лишь небольшая часть из них остается свободной. В щитовидной железе образуется ≈ 15% циркулирующего в крови Т3. Остальной трийодтиронин образуется при монодейодировании тироксина, происходящем преимущественно в печени. Биологическая активность обусловлена свободной фракцией гормонов. Количество свободного Т3 в крови в 3 – 5 раз выше, чем Т4, а его аффинность к рецепторам в клетках-мишенях в 10 раз выше, чем у Т4. Все это объясняет значительное преобладание биологических эффектов у Т3 по сравнению с Т4, хотя его время полужизни вдвое меньше. Коллоид фолликула Тиреоглобулин Тирозинйодиназа Йодирование тиреоглобулина ПМ Йодтиреоглобулин I0(I+) Экзоцитоз Эндоцитоз ПМ Цитоплазма фолликулярной клетки e¯(2e¯) Тиреоглобулин I¯тирейодидпероксидаза I0(I+) Биосинтез на рибосомах АМК ПМ I¯ Йодтиреоглобулин Гидролиз в лизосомах Na+, К+-АТФ-аза Белок-транспортер Йодтиронины (Т3, Т4) Секреция ПМ Кровь Т3, Т4 → ТСБ, ТСГ АМК Рис. 2.4. Схема биосинтеза и секреции йодтиронинов в эпителиальной клетке стенок фолликулов щитовидной железы. ПМ – плазматическая мембрана, Т3 – I¯ трийодтиронин, Т4 – тетрайодтиронин (тироксин), ТСБ – тиронинсвязывающий белок (транстиретин), ТСГ – тироксинсвязывающий глобулин (α1-глобулин). Из аминокислоты триптофана в эпифизе синтезируется мелатонин. Промежуточным продуктом является серотонин. Он вначале ацетилируется с участием серотонин-N-ацетилтрансферазы, и затем метилируется под действием метилтрансферазы (рис. 2.5) Рис. 2.5. Схема биосинтеза мелатонина. ТГБП – тетрагидробиптерин, ДГБП – дигидробиоптерин, ПАЛФ – пиридоксальфосфат, SAM-S-аденозилметионин, SAF-S-аденозилгомоцистеин. Мелатонин активно образуется в темное время суток и не вырабатывается на свету. Он подавляет синтез гонадотропинов в аденогипофизе, замедляет половое созревание в молодом возрасте. Мелатонин регулирует сезонные колебания половой активности, которая возрастает с увеличением освещенности в весенне-летнем сезоне и снижается при удлинении ночей в осенне-зимний период. Гормоны стероидной природы синтезируются в митохондриях клеток стероидных тканей. Субстратом является холестерол, который модифицируется в ходе последовательных ферментативных монооксигеназных реакций гидроксилирования и расщепления различных углерод-углеродных связей (рис. 2.6). Вначале у холестерола утрачивается боковая цепь и образуется прегненолон, а он окисляется (цикл А) в прогестерон. Прогестерон превращается в тестостерон либо непосредственно путем удаления боковой цепи у D-кольца, либо опосредованно через стадии дегидроэпиандростерона – андростендиона. Эстрадиол образуется в процессе ароматизации А-цикла с участием ароматазного ферментного (рис. 9.3) Прогестерон в этой цепи взаимопревращений является также субстратом для биосинтеза гормонов коры надпочечников кортизола и альдостерона. Рис. 2.6. Схема биосинтеза некоторых стероидных гормонов (в кружочках показано максимальное количество углеродных атомов). Холестерол по сути является субстратом биосинеза 1, 25дигидроксикальциферола (1, 25(ОН)2D3) и 24, 25-дигидроксикальциферола (24, 25(OH)2D3) – активных форм витамина D. Их рассматривают как гормональные формы этого витамина. Они образуются при двукратном гидроксилировании холекальциферола, образующегося в коже из 7-дегидрохолестерола (рис. 2.7). Вначале осуществляется окисление в положении 25 с помощью 25монооксигеназы холекальциферола. Реакция идет в печени. Получающийся 25гидроксикальциферол (25(OH)2D3) переносится кровью в почки и в клетках проксимальных канальцев повторно гидроксилируется с образованием 1, 25(ОН)2D3 и 24, 25(OH)2D3. Обе бигидроксилированные формы витамина D3 транспортируются в плазме крови в комплексе со специальным белком-транспортером из α2глобулиновой фракции. Рис. 2.7. Метаболический цикл витамина D3, приводящий к образованию активных форм 1, 25(ОН)2D3 (кальцитриола) и 24, 25(OH)2D3. Активные формы витамина D катаболизируют перед своей экскрецией. Подавляющая часть продуктов распада витамина D3 (93%) поступает с желчью в кишечник и выделяется с калом. Тропные гормоны передней доли гипофиза (кортикотропин (АКТГ), фоллитропин (ФСГ), лютропин (ЛГ)) активируют аденилатциклазу в плазматических мембранах клеток коры надпочечников или гонаду, увеличивает концентрацию 3', 5' цАМФ, который в свою очередь, активирует ферменты, катализирующие образование стероидных гормонов. Эти гормоны обычно не накапливаются в клетках, а, перемещаясь через плазматические мембраны, покидают их вскоре после синтеза. Секреция гормонов может происходить в различных режимах. Многие железы секретируют минимальные количества гормонов постоянно в режиме т. н. базального уровня секреции. Сигналы, поступающие в секреторные клетки могут изменять этот уровень, повышая его или понижая. Содержание гормонов в крови обычно зависит от скорости их секреции железистыми клетками. Интенсивность поступления гормонов в кровь зависит от скорости их синтеза. В секреторных гранулах обычно аккумулируются небольшие количества гормонов. В ответ на стимуляцию биосинтез гормонов возрастает. Исключением являются лишь два случая. Йодтиронин запасается в щитовидной железе в больших количествах, защищая организм от дефицита йода при нерегулярном его поступлении в организм. Холекальциферол депонируется в жировой ткани, мобилизуясь оттуда в случаях слабой инсоляции организма. Гидрофильные гормоны (белки, пептиды и т. д.) после секреции циркулируют в плазме крови в растворенном состоянии. Йодтиронины и почти не растворимые в воде стероидные гормоны транспортируются белкамипереносчиками. Комплексы этих белков с гормонами могут играть роль своеобразного депо готовых гормонов. В роли неспецифических белковтранспортеров в плазме крови выступают альбумины, переносящие, например, альдостерон, и белок транстиретин (преальбумин), образующий так называемый тироксинсвязывающий белок(ТСБ). Белки разных глобулиновых фракций чаще выступают в роли специфических транспортеров, так как имеют на своей поверхности высоко аффинные центры связывания гормонов. Такими белками являются транскортин (для глюкокортикоидов) и тироксинсвязывающий глобулин (ТСГ) из α1-глобулиновой фракции. К β-глобулинам относятся глобулины, связывающие половые гормоны (ГСПГ). Гормоны белковой природы имеют короткий период полураспада (от нескольких минут до нескольких часов). Деградация их часто начинается уже в крови или на стенках кровеносных сосудов. Продолжение и завершение ее осуществляется в клетках печени, почек и других тканей после эндоцитоза. Некоторые белки-гормоны, содержащие дисульфидные связи, например инсулин, начинают инактивацию за счет восстановления остатков цистеина. В последующем их катаболизм происходит как и у других белков под действием тканевых протеиназ. Ферменты эти могут быть экзо- или эндотоксинами. А образующиеся промежуточные пептиды порой проявляют самостоятельную биологическую активность. Аминокислоты как конечный продукт распада белково-пептидных гормонов могут продолжить путь катаболизма или включаются в общий пул и служат субстратами в анаболических процессах. Время полусуществования (Т1/2) стероидных гормонов составляет 70 – 90 минут. Процесс инактивации стероидных гормонов происходит в печени. Кортикостероиды при этом подвергаются или восстановлению с образованием парных соединений, или окисляются у С17. В первом случае вначале происходит восстановление по оксогруппе и двойной связи в цикле А (рис. 2.8), протекающее с использованием НАДФ•Н+Н+. Образующиеся метаболиты вступают в реакции конъюгирования при участии ФАФС или УДФГК. Получающиеся водорастворимые парные соединения выводятся из организма с мочой и через желчные пути с калом. Рис. 2.8. Инактивация стероидных гормонов по пути восстановления и конъюгирования. а) восстановление по методу двойной связи и оксогрупп в цикле А с использованием НАДФ•Н+Н+ в качестве донатора водорода б) конъюгирование с участием ФАФС или УДФГК с образованием парных водорастворимых соединений (сернокислые эфиры, глюкокортикоиды), экскретирующихся с мочой, калом Во втором случае кортикостероиды подвергаются окислению с отщеплением боковой цепи у С17. Образующиеся 17-кетостероиды выводятся с мочой как конечные продукты обмена. У мужчин 17-кетостероиды образуются также при катаболизме тестостерона, поэтому суточная их экскреция составляет 10 – 20 мг против 5 – 12 мг у женщин, т. е. в два раза выше. Выведение 17кетостероидов с мочой возрастает при гиперпродукции кортикостероидов, а у мужчин и андрогенов, и уменьшается при гипопродукции. Определение их содержания в моче долго использовали в качестве критерия диагностики поражений коры надпочечников, семенников. В настоящее время предложенные чувствительные и специфичные методы иммунологического анализа стероидных гормонов вытеснили устаревшие способы диагностики заболеваний надпочечников. Измерение экскреции кортизола с мочой помогает диагностике синдрома «ИценноКушинга». «Стероидный профиль» мочи, при исследовании которого стероиды разделяются и измеряются методом газожидкостной хроматографии, позволяет получить точные данные о функциональном состоянии коры надпочечников. Для определения концентрации тестостерона, дигидротестостерона, глобулина, связывающего половые гормоны, существуют специфические методики. Отпала необходимость определять 17-кетостероиды в моче для оценки функции половых желез. К тому же на две трети эти метаболиты в моче проходят из андрогенов коры надпочечников. Считают, что инактивация эстрогенов в печени идет в основном по пути образования глюкуронидов или эфиров с серной кислотой с последующей их экскрецией с мочой, желчью, калом. Время полужизни йодтиронинов составляет несколько дней (Т3 2 – 3 дня, Т4 5 – 7 дней). Их катаболизм идет в несколько стадий. Он сопряжен с участием аминотрансфераз (непрямое дезаминирование), дегалогеназ (освобождение йода) и завершается в печени конъюгированием фенолов с участием ФАФС и УДФГК. Парные соединения, а также частично неизмененные гормоны экскретируются почками или кишечником. Некоторое количество Т4 в кишечнике реабсорбируется и включается в общий пул йодтиронинов. Деградация катехоламинов (адреналин и другие биогенные амины) происходит в тканях-мишенях и прежде всего в печени по пути дезаминирования с участием моноаминоксидаз (МАО) и метилирования катехол-о-метилтрансфераз, работающих с S-аценозилметионином в качестве кофермента. В результате образуются и экскретируются с мочой 3-метокси-4гидрокси-миндальная кислота (80%) и метанефрины (15%). Небольшая часть адреналина (5%) выделяется с мочой в неизмененном виде (рис. 2.9). Мелатонин инактивируется путем образования конъюгатов с сульфатом, реже с глюкуронатом, с участием ФАФС- и УДФГК-зависимых трансфераз. Рис. 2.9. Схема катаболизма катехоламинов и выделения с мочой конечных продуктов. Цифрами обозначены ферменты: 1 – дигидроксифенилэтаноламинN-метилтрансфераза; 2 – моноаминоксидаза; 3 – катехол-ометилтрансфераза. Задание 2.1. 1. Составьте схемы, отражающие принципы классификации гормонов: анатомически, по химической природе, по биологической активности, по растворимости. 2. Перечислите этапы биосинтеза тиреоидных гормонов (Т3, Т4). 3. Напишите реакции синтеза из триптофана гормона мелатонина. 4. Дайте общую характеристику структурных отличий андрогенов и эстрогенов. 5. Обсудите возможные пути катаболизма гормонов различной природы. 6. Ответьте на вопросы: Чем отличается биосинтез гормонов в секреторных клетках от такого же процесса в неэндокринных тканях? Какие гормоны образуются из прооксимеланокортина методом ограниченного протеолиза? Какие ферменты участвуют в биосинтезе из триптофана серотонина и образования из него мелатонина? Из чего синтезируются гормоны стероидной природы? Где и как синтезируются гормональные формы витамина D? Что такое базальный уровень секреции гормонов? С какой целью и где могут создаваться депо йодтиронинов и холекальциферола? Какие гормоны катаболизируют по пути образования парных соединений? Задание 2.2. Решите тесты: Соматостатин: А. Синтезируется в аденогипофизе Б. Имеет прежнее название соматотропин-рилизинг-фактор В. Образуется в гипоталамусе Г. Контролирует выработку соответствующего гормона аденогипофиза Д. Имеет стероидную природу Оцените достоверность утверждений в каждом предложении и связь между ними: Время полусуществования (Т1/2) стероидных гормонов составляет 70 – 90 минут, поэтому при их катаболизме не происходит разрыва В-стероидного кольца. Местом синтеза указанных гормонов является: 1. Трийодтиронин А. Гипоталамус 2. Прогестерон Б. Надпочечники 3. Паратирин В. Эпифиз 4. Глюкагон Г. Поджелудочная железа 5. Вазопрессин Д. Нет правильного ответа 6. Эстрадиол 7. Тиреотропин Последовательность событий при биосинтезе йодтиронинов: А. Эндоцитоз тиреоглобулина в коллоид Б. Йодирование остатков тирозина в тиреоглобулин с образованием йодтиреоглобулинов В. Поглощение йода клетками вторично активным транспортом с участием Na+, К+-АТФ-азы Г. Гидролиз йодтиреоглобулина лизосомальными протеиназами Д. Биосинтез тиреоглобулина на рибосомах Перечисленные сигнальные молекулы по химическому строению являются: 1. Простагландины А. Стероиды 2. Фоллитропин Б. Белки 3. Окситоцин В. Пептиды 4. Альдостерон Г. Другой природы 5. Инсулин 6. Ингибин 7. Мелатонин Задание 2.3. Решите задачи: Мужчина 22 лет обратился с жалобами на импотенцию. Осмотр пациента позволил установить наличие внешних признаков гипогонадизма: инфантильные половые органы, мышцы развиты слабо, астеническое телосложение и др. Предложите лаборатории тесты для подтверждения первичного диагноза. У пациента жалобы на мышечную слабость, особенно мышц нижних конечностей. При осмотре обращает внимание отложение жира в области шеи, «лункообразное лицо». Изменение экскреции кортизола с мочой выявило ее увеличение. Укажите патологию, для которой характерны перечисленные признаки. 3. Ключевые моменты в работе эндокринной системы. Основным понятием регуляции в животном организме является концепция гомеостаза. Она базируется на том, что различные количественные показатели, например, уровень глюкозы в крови, содержание кальция в сыворотке крови, артериальное давление, объем циркулирующей крови, соотношение свертывающей и антисвертывающей систем крови и другие поддерживаются в узких пределах, характерных для нормы. При отклонении от нее включаются различные регуляторные механизмы, включая гормональные. Гормоны в организме контролируют самые различные физиологические функции и метаболические процессы. Некоторые из них представлены в табл. 3.1. Таблица 3.1. Некоторые физиологические функции и метаболические процессы, контролируемые гормонами. Физиологические функции и Гормоны их Метаболические процессы контролирующие Обеспечение гомеостаза в организме, Глюкокортикоиды, адаптация к изменяющимся условиям минералокортикоиды, вазопрессин, внешней среды, выработка, хранение и атриопептины, соматотропин, инсулин, утилизация энергии. глюкагон, йодтиронины, половые гормоны, кальцитонины, паратирин. Половые лактация. поведения, репродукция, Гонадолиберин, фоллитропин, лютропин, андрогены, эстрогены, прогестерон, лактотропин. Рост и развитие организма. Соматотропин, половые йодтиронины, инсулин. гормоны, Многие из них регулируют метаболические процессы, идущие с накоплением или расходованием энергии. Депонирование энергоемких химических соединений (гликоген, белки, триацилглицеролы) позволяет организму справляться с внезапными возрастаниями энерготрат в стрессовых ситуациях. Нередко эндокринные железы функционируют по принципу реципрокных сочетаний. В результате возможно достижение точной настройки контролируемых процессов и быстрая их адаптация к изменениям окружающей среды. Так инсулин снижает уровень глюкозы в крови, а его антагонист глюкагон – повышает. При этом следует отметить, что гипергликемизирующее действие, крайне необходимое для адекватной реакции организма в острых ситуациях, обеспечивается с некоторой избыточностью гормональных эффектов, создающей своеобразную полосу безопасности. Контригулярных гормонов известно несколько. Наряду с глюкагоном ими являются кортизол, адреналин, соматотропин и ряд других. Многие гормоны контролируют экспрессию генов и этим влияют на способность тканей к росту и созреванию. Соматотропин, йодтиронин, инсулин, андрогены, эстрогены следует считать жизненно важными для растущего организма. В некоторых случаях гормоны не играют фундаментальной роли как регуляторные факторы, но их присутствие крайне актуально. Так йодтиронины не являются фундаментальными регуляторами роста и развития, но требуются для завершения этих процессов. Гипофункция щитовидной железы ведет к задержке роста. Многие гормоны обладают в организме не одним, а несколькими эффектами. В качестве примера можно привести инсулин. Он способствует снижению содержания глюкозы в крови, способствуя его поступлению в моноциты и адипоциты, стимулирует ее превращение в гликоген, задерживает распад гликогена и глюконеогенез в печени. Повышая поступление аминокислот в клетки тканей, инсулин стимулирует биосинтез белков. Регулирующее влияние инсулина на липидный обмен заключается в ускорении биосинтеза жирных кислот и триацилглицеролов в клетках тканей. Основополагающим моментом в функционировании эндокринной системы является контроль выработки и секреции гормонов по механизму обратной связи. Чаще всего эта связь носит отрицательный характер, когда конечный продукт системы регуляторных факторов подавляет продукцию первоначального. Однако существует и положительная связь, когда последний продукт стимулирует дальнейшую секрецию первого и этим ускоряет работу всей системы. В регуляции выработки гормонов могут участвовать катионы. Например, увеличение уровня Са2+ в плазме крови снижает выработку паратирина в паращитовидных железах и образование 1, 25(ОН) 2-кальциферола в почках. Повышение осмотического давления внеклеточной жидкости (гиперосмолярность) стимулирует выработку антидиуретического гормона, а его снижение усиливает образование альдостерона. Высокое артериальное давление сопровождается усиленной секрецией атриопептинов в предсердиях, низкое – ренин-ангиотензина. Известны и более сложные системы регуляции по принципу обратной связи. Одна из них – регуляция функции щитовидной железы (рис. 3.1). Гипоталамус (Тиреолиберин) ¯ + Передняя доля гипофиза (аденогипофиз) (Тиреотропин) Щитовидная железа + Т3 Т4 Кровь ¯ Ткани Рис. 3.1. Регуляция секреторной функции щитовидной железы. Йодтиронины (Т3, Т4) контролируют свою собственную продукцию по принципу обратной связи, влияя на выработку тиреолиберина в гипоталамусе и тиреотропина в передней доле гипофиза (аденогипофизе). Биосинтез гормонов нарушается при патологии эндокринной системы. Различают синдромы гормональной недостаточности или избытка гормонов. Они могут быть результатами гипофункции или гиперфункции желез. Причин эндокринных гипофункций желез выделяют несколько: 1. Наиболее часто встречающаяся – аутоиммунное разрушение железистой ткани. Примерами такой патологии являются: инсулинзависимый сахарный диабет, первичный гипотиреоз (болезнь Грейвса), первичная недостаточность коры надпочечников. 2. Разрушение или частичные повреждения эндокринных органов, вызываемые инфекционными поражениями (туберкулез), грануломатозными заболеваниями (саркоидоз), инфарктом желез. 3. Хирургическое удаление или деструкция железы под воздействием химиотерапевтического лечения или облучения также порождают гормональную недостаточность. 4. Причиной гипофункции желез могут быть мутации генов, приводящие к изменению структуры гормонов или белков-рецепторов для них. В обоих случаях имеет место состояние «гормональной резистентности». Резистентность к действию гормонов может быть наследственной, генетически обусловленной (псевдогипопаратиреоз), приобретенной (инсулинорезистентность при ожирении) или сочетанной (инсулинонезависимый сахарный диабет). Механизмы развития гиперфункций эндокринных состояний также разнообразны: 1. В крови могут появляться вещества, имитирующие гормональную активность. Они связываются с рецепторами и инициируют внутриклеточную последовательность событий, которую вызвал бы истинный гормон. Например, повышенная тиреоидная активность, наблюдаемая при болезни Грейвса, возникает в связи с избытком в крови тиреостимулирующего иммуноглобулина. Последний имитирует функцию тиреотропина на поверхности клеток щитовидной железы, усиливает выработку йодтиронинов и способствует возникновению ее гиперфункции. 2. Эндокринные опухоли, вырабатывающие избыточное количество гормонов, также могут воспроизводить картину гиперфункционального состояния. 3. Причиной состояний, сопровождающихся избытком гормонов, бывают экзогенные источники, например, передозировка вводимого в качестве лекарственного препарата инсулин при лечении сахарного диабета. Эндокринную патологию выявляют в результате комплексного обследования. Характерные симптомы дают лишь предварительную информацию. Количественное определение гормонов в крови дает более полное представление о характере эндокринной патологии. Часто используют исследование пар тестов, гормон-регулируемый параметр, например паратирин и Са2+ в крови. Иногда для точного диагноза прибегают к выполнению тестов со стимуляцией или угнетением эндокринной системой. При синдромах гормональной недостаточности проводят стимуляционный тест, при синдромах избыточной продукции гормонов – тест с подавлением функции. Еще один подход к изучению функции желез – оценка гормональной секреции или регулируемого параметра в течение длительного отрезка времени. Так определение каких-либо параметров в суточной порции мочи явно более информативно, чем в однократно полученной порции. Определение у больных сахарным диабетом в крови количества гликозилированного гемоглобина дает возможность судить о концентрации глюкозы в нем на протяжении предшествующих трех месяцев и используется для контроля за течением заболевания. Визуализирующие методы исследования: ядерные сканирования, ультразвуковые и рентгенологические исследования, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) позволяют завершить диагностику эндокринной патологии. Для лечения эндокринных гипофункций чаще всего применяют заместительную терапию. Так при недостаточности тиреоидной функции назначают таблетки тиреоидина или лиотиронина. Заместительная терапия инсулином состоит в применении для инъекций различных его препаратов, медленно высвобождающихся в кровь и имитирующих его биосинтез в поджелудочной железе. В ряде случаев заместительная терапия проводится для восполнения только конечного продукта гормональной системы. Так при поражении передней доли гипофиза со снижением выработки тиреотропина или кортикотропина назначают тиреоидин или кортизол и гипофункции желез-мишеней не проявляются. Дефицит соматотропина при гопоталамической или гипофизарной недостаточности у детей восполняют инъекциями гормона роста, получаемогопо рекомбинантной технологии. Это позволяет ребенку нормально расти. Заместительная терапия дефицита стероидных гормонов относительно проста и восстанавливает многие элементы нормального функционирования соответствующих желез. Подходов к лечению синдромов избытка гормонов существует несколько. 1. Можно применять препараты, подавляющие синтез и секрецию гормонов. Примером служит использование синтетического тиреостатического препарата мерказолина, вызывающего уменьшение продукции йодтиронинов в щитовидной железе при лечении ее гиперфункции. Препарат ускоряет выведение из железы йодидов, угнетает активность ферментов, участвующих в биосинтезе гормонов. 2. Иногда лечением проводят коррекцию метаболических нарушений, возникающих при гиперпродукции гормонов. Например, калийсберегающий диуретик альдактон применяется для нормализации водно-солевого обмена при гиперальдостеронизме. Оказываемый альдактоном диуретический эффект связан с антагонизмом по отношению к гормону коры надпочечников альдостерону. 3. Гиперфункцию эндокринных желез можно устранить разрушением их тканей при помощи облучения. 4. Хирургическое удаление части потологически измененной железы способствует восстановлению ее нормальной функции, как это бывает, например, при тиреотоксикозе, когда прибегают к оперативному его лечению. Задание 3.1. 1. Назовите некоторые общие параметры параметры гомеостаза, контролируемого эндокринной системой. 2. Обсудите принципы положительной и отрицательной обратной связи регуляции гормонов. 3. Перечислите возможные причины гипо- и гиперфункций желез внутренней секреции. 4. Обсудите методы лечения эндокринной патологии. 5. Ответьте на вопросы: На чем базируется концепция гомеостаза в животном организме? Какие физиологические функции и метаболические процессы контролируются гормонами? Как реализуются реципрокные сочетания регуляции гормонами уровня глюкозы в крови? Что означает избыточность гормональных эффектов в реализации некоторых реципрокных сочетаний? Что такое регуляторная полифункциональность гормонов? Какие принципы положены в основу диагностики эндокринной патологии? Что такое визуализирующие методы исследования эндокринных заболеваний? Задание 3.2. Физиологические функции и метаболические регулируемые гормонами: А. Гипноз как особое состояние человека. Б. Обеспечение гомеостаза в организме. В. Выработка, хранение и утилизация энергии. Г. Сон, индуцируемый пептидами «дельта-сна». Д. Рост и развитие организма. процессы, Оцените достоверность утверждений в каждом предложении и связь между ними: Принцип обратной отрицательной связи является единственным в механизме регуляции выработки паратиреоидного гормона, потому что активность паращитовидных желез контролируется аденогипофизом. При гипофункции щитовидной железы в кровь поступает избыток тиреостимулирующего иммуноглобулина, усиливающего выработку йодтиронинов, поэтому возникает ее гиперфункция. Визуализирующими методами исследования эндокринных желез являются: А. Определение в сыворотке крови показателей обмена веществ. Б. Магнитно-резонансная томография (МРТ). В. Ультразвуковое исследование (УЗИ). Г. Исследование в крови количества циркулирующего гормона. Д. Рентгенологическое исследование. Методами лечения гиперфункции эндокринных желез являются: А. Введение гормональных препаратов извне. Б. Применение веществ, подавляющих секреторную функцию соответствующей железы. В. Использование средств коррекции метаболических процессов. Г. Назначение лучевой терапии. Д. Введение конечных продуктов гормональной системы. Задание 3.3. Решите задачу: У женщины 39 лет изменились черты лица. Нижняя челюсть выступила вперед, появились щели между зубами. Она стала носить обувь большего размера. Ее пальцы кисти значительно увеличились. Все эти данные позволили предположить развитие акромегалии. Однако возникла проблема выявления очага поражения, которым нередко бывает доброкачественная опухоль, секретирующая гормон роста. Предложите методы визуализирующей диагностики этой патологии. 4. Механизм действия гормонов. В соответствии с делением гормонов по растворимости на гидрофильные и липофильные различают два механизма передачи сигналов в клетки-мишени: I. Мембранно-цитозольный, или косвенный. II. Внутриклеточно-ядерный, или прямой. I. Мембранно-цитозольный механизм характерен для гидрофильных гормонов и других сигнальных молекул, которые не проникают в клетки и влияют на метаболические процессы в них опосредованно. В общем виде реализация таких сигналов может быть сведена к трем основным моментам: 1. Взаимодействие гормонов с рецепторами, структурированными в плазматические мембраны клеток-мишеней. 2. Конформационная перестройка специализированных белков – первичных посредников, передающих сигналы от рецепторов белкамэффекторам. Роль первичных посредников часто выполняют G-белки. Их так называют, потому что они связаны с гуаниновыми нуклеотидами (от англ. Guanine nucleotides). 3. Активация вторичных посредников (мессенджеров – от англ. messenger – вестник, курьер, рассыльный) – небольших молекул или ионов, диффузия которых в клетке к определенным субклеточным структурам обеспечивает стремительное распространение сигнала гормона и его реализацию каскадными механизмами. Далее о рецепторах, посредниках, каскадных механизмах подробнее. Белки-рецепторы относятся к гликопротеинами должна выполнять как минимум две функции: 1. Прием сигнала гормона. Это осуществляет гормонсвязывающий локус (домен). 2. Преобразование принятого сигнала и инициация специфических гормональных эффектов. Это реализует эффекторный локус (домен). В молекулах белков-рецепторов, локализованных в плазматические мембраны клеток, выделяют три постоянных структурных компонента: 1. Экстрацеллюлярный, находящийся снаружи. 2. Трансмембранный, пронизывающий билипидный слой плазматической мембраны. 3. Интрацеллюлярный, расположенный в цитозоле. Функции этих элементов у мембранных рецепторов в разных клеткахмишенях у одного и того же гормона могут быть разные. Так α1-, α2-, β1-, β2адренорецепторы инициируют в клетках отличающиеся по сути эффекты. Различают три типа мембранных рецепторов. 1. Рецепторы первого типа представляют из себя интегральные белки с ферментативной активностью. Сигнальные молекулы, связывающиеся с рецептором снаружи, являются аллостерическими модуляторами, изменяющими конформацию всего белка и его ферментативную активность. Последняя обеспечивает фосфорилирование остатка тирозина в белках (рис. 4.1). Рецепторы инсулина являются тирозинкиназами. Они структурированы в плазматические мембраны клеток-мишеней. Период их полужизни составляет 7 – 12 часов. Они представляют из себя гликогенпротеины (Mr 460 кДа), состоящие из четырех субъединиц, соединенных дисульфидными связями (рис. 4.1). Наружу экспонированы две α-субъединицы (Mr по 135 кДа каждая), а две βсубъединицы (Mr по 95 кДа каждая) пронизывают плазматическую мембрану. Первые выполняют функцию гормон связывающего локуса. Вторые своими участками, выступающими в цитозоль, играют роль тирозинкиназы. Присоединение гормона к рецептору сопровождается фосфорилированием тирозина в соответственных цитоплазматических доменах. При этом одна β-цепь может фосфорилировать другую β-цепь той же молекулы рецептора (аутофосфорилирование). Теперь тирозинкиназа способна фосфорилировать и другие белки-субстраты инсулинового рецептора (англ. Insulin Receptor Substrates - IRS). В любом случае это активирует внутриклеточный сигнальный путь (Ras-путь) и реализацию информации, доставленной сюда инсулином (см. рис. 4.14). Рис. 4.1. Схема активирования инсулином рецептора первого типа, являющегося тирозинкиназой. 1 – гормон связывающий локус в α-субъединицах; 2 – центр тирозинкиназной активности в β-субъединицах; 3 – субстрат инсулинового рецептора (IRS) неактивный; 4 – субстрат инсулинового рецептора (IRS) активный; 5 – активация внутриклеточного сигнального пути (Ras-пути). 2. Рецепторы второго типа являются олигомерными трансмембранными белками, образующими гормон активирующие ионные каналы. Связывание сигнальных молекул с рецепторами ведет к открыванию каналов для Na+, K+, Cl¯ и др. Так «работают» нейромедиаторы, например ацетилхолин через Nхолинорецепторы, в которых формируются Na+-каналы (рис. 4.2), ГАМК (γаминомасляная кислота, γ-аминобутират) через А-рецепторы (Cl¯-каналы) и др. Рис. 4.2. Схема рецептора третьего типа на примере N-ацетилхолина. 1 – участки связывания сигнальной молекулы. 2 – сформированный ионный (Na) канал. 3. Интегральные белки, относящиеся к рецепторам третьего типа, участвуют в реализации гормональных сигналов в сочетании с G-белками. Полипептидные цепи этих белков включают по семь трансмембранных тяжей и по три примембранных петли с каждой стороны (рис. 4.3). Рис. 4.3. Строение гормональных рецепторов третьего типа, сопряженных с G-белками. 1 – олигосахарид; 2 – N-конец; 3 – трансмембранные петли; 4 – Сконец. Связывание гормона с рецептором третьего типа изменяет конформацию трансмембранных тяжей и примембранных петель. Происходит резкое повышение сродства рецептора к G-белку. Возникает сигнал, передаваемый белками-эффекторами, которые являются либо ферментами (например, аденнилатциклаза, фосфолипаза С), либо ионными каналами. Функция белковэффекторов заключается в изменении коцентрации вторичных посредников (мессенджеров). G-белки как первичные посредники передают сигналы от рецепторов третьего типа к белкам-эффекторам (рис. 4.4 А). Они состоят из трех субъединиц: α, β, γ. α-субъединица может связывать гуаниновые нуклеотиды ( англ. Guanine nucleotide): ГТФ или ГДФ. Отсюда их название G-белки. Они образуют семейство, включающее около 20 их разных форм. Но различают два их типа: Gs – стимулирующие (от англ. stimulate) «работают» с рецепторами, передающими стимулирующие сигналы возбуждения (Rs), Gi – ингибирующие белки (от англ. inhibite – ингибировать) передают от Ri сигналы торможения. В неактивном G-протеине α, β, γ-субъединицы ассоциированы в единую молекулу и к α-субъединице присоединен ГДФ (рис. 4.5 А). После взаимодействия гормона с рецептором ГДФ замещается на ГТФ (рис. 4.4.Б). Вслед за этим происходит диссоциация G-белка на две части: αсубъединицу в сочетании с ГТФ и комплекс β, γ-субъединиц. α-субъединицаГТФ активирует белки-эффекторы. α-субъединица-ГТФ активирует белки-эффекторы (например ферменты аденилатциклазу или фосфорилазу С), что в дальнейшем приводит к накоплению в клетках вторичных посредников (рис. 4.4 В). α-субъединица проявляет слабую ГТФ-азную активность. Медленно гидролизуя ГТФ до ГДФ, она переводит саму себя в неактивное состояние и вновь ассоциирует с β, γ-комплексом и ГДФ. G-белок возвращается в исходное неактивное состояние. Передача гормонального сигнала прекращается (рис. 4.4 Г), Gs- и Gi-белки, имея одинаковые β- и γ-субъединицы (Mr 40 кДа обеих вместе), включают разные α-субъединицы. В Gs-белке α-субъединица имеет Mr 45 кДа, в Gi – 41 кДа. Рис. 4.4. Цикл конформационных изменений G-белков в процессе передачи гормонального сигнала. 1 – гормон; 2 – рецептор первого типа; 3 – G-белок; 4 – белок-эффектор (например аденилатциклаза). Вторичные посредники (мессенджеры) – это внутриклеточные вещества, концентрация которых строго контролируется внеклеточными сигналами, передаваемыми гормонами и другими сигнальными молекулами. Такие вещества образуются из доступных субстратов и имеют короткий период полураспада или являются ионами. Ими являются 3', 5' цАМФ, 3', 5' цГМФ. 1. 3', 5'-циклический аденозинмонофосфат (3', 5' цАМФ); 2. 3', 5'-циклический гуанозин монофосфат (3', 5' цГМФ); 3. Диацилглицерол (ДАГ); 4. Инозитол-1, 4, 5-трифосфат (ИФ3); 5. Инозитол-1,3, 4, 5-тетрафосфат (ИФ4); 6. Са2+. Известно несколько путей передачи сигналов с их участием. 1. Аденилатциклазный. 2. Гуанилатциклазный. 3. Фосфоинозитидный. 4. Через «медленные» неэлектрогенные Са2+-каналы. 5. Тирозинкиназный. 6. Через «быстрые» электрогенные Na+- и другие ионные каналы. I. Аденилатциклазный путь мембранно-цитозольного механизма. Это самый распространенный путь передачи гормональных сигналов. В его реализации и завершении участвуют, как минимум, шесть белков. 1. Белки-рецепторы третьего типа (рис. 4.3) взаимодействуют с сигнальными молекулами. 2. Gs- или Gi-белки играют роль первичных посредников (рис. 4.4). 3. Белок-эффектор аденилатциклаза (АЦ) катализирует реакцию образования из АТФ 3', 5' цАМФ – вторичного посредника (рис. 4.5). Он выполняет роль аллостерического активатора протеинкиназы А (индекс «А» от англ. сАМР). Аденилатциклаза (интегральный белок, имеющий 12 трансмембранных доменов) обнаружена во всех тканях и органах. Выявлено 8 ее изоформ, из которых 4 являются Са2+-активируемыми. 4. Протеинкиназа А принимает сигналы от аденилатциклазы. Фермент состоит из четырех субъединиц. Два регуляторных (R) и два католитических (С) протомера образуют структуру R2C2 (рис. 4.7). Связываясь обратимо с регуляторными субъединицами, 3', 5' цАМФ вызывает диссоциацию комплекса (C2R2 → цАМФ4R2 + C + C). Освобождающиеся отдельно друг от друга две каталитические субъединицы фактически и являются активной протеинкиназой. Она фосфорилирует различные белки, включая ферменты, и изменяет их активность (ковалентная модификация). См. рис. 4.6. 5. Фосфодиэстераза, катализирует дециклизацию 3', 5' цАМФ (рис. 4.6) с образованием просто АМФ. Ингибиторами ее являются ураты, ксантины, кофеин, теофиллин, теобромин. 6. Фосфопротеинфосфатаза, возвращающая белки, ранее фосфорилированные протеинкиназой «А», в нативное состояние (рис. 4.6). Ее активность повышается под действием инсулина. Два последних фермента обрывают передачу сигналов по аденилатциклазному пути. Рис. 4.5. Реакции, катализируемые аденилатциклазой и фосфодиэстеразой. 1 – ингибиторы фосфодиэстеразы (ураты, ксантины, кофеин, теофиллин, теобромин). Рис. 4.6. Реакции, катализируемые протеинкиназой «А» с изменением активности белка и фосфопротеинфосфатазой, возвращающей белок в нативное состояние. 1 – инсулин, активирует фосфопротеинфосфатазу. Гормоны, «работающие» по аденилатциклазному пути, могут передавать сигналы возбуждения и торможения (табл. 4.1). Таблица 4.1. Гормоны и другие сигнальные молекулы (информоны) – стимуляторы или ингибиторы аденилатциклазы. Информоны – стимуляторы Информоны – ингибиторы аденилатциклазы, передающие сигналы аденилатциклазы, передающие сигналы чарез Rs → Gs-белки через Ri → Gi-белки Некоторые либерины гипоталамуса (кортиколиберин, тиреолиберины, соматолиберин) Большинство тропинов гипофиза (кортикотропин, тиреотропин, фоллитропин, лютропин, липотропин, меланотропин) Кальцитонин Паратирин Глюкагон Секретин Адреналин, норадреналин (через β1, β2адренорецепторы) Вазопрессин (через V2-рецепторы) Гистамин (через Н2-рецепторы) Холецистокинин Gip (желудочно-интестинальный пептид) Соматостатин Pg Е1 (простагландин Е1) Энкефалины, эндорфины Адреналин, норадреналин (через α2адренорецепторы) Ацетилхолин (через Мхолинорецепторы) Гистамин (через Н2-рецепторы) Ангиотензин II Как же работает аденилатциклазная система? Гормон взаимодействует с рецептором. Образующийся гормонрецепторный комплекс передает сигнал G-белку, а он, претерпевая ряд изменений (рис. 4.4), активирует аденилатциклазу. Последняя нарабатывает 3', 5' цАМФ (рис. 4.5). Молекулы 3', 5' цАМФ обратно связываются с регуляторными субъединицами протеинкиназы А (рис 4.7) и ее активируют. Активная протеинкиназа фосфорилирует специфические белки и в том числе ферменты. Так, если это был сигнал глюкагона или адреналина через β1, β2адренорецепторы, в гепатоцитах фосфорилируется гликогенсинтаза, становясь инертной, и киназа фосфорилазы, затем активирующая гликогенфосфорилазу. В итоге биосинтез гликогена замедляется, а распад ускоряется (рис. 4.7). Реализация сигнала завершается дециклизацией 3', 5' цАМФ фосфодиэстеразой (рис. 4.5) и дефосфорилированием белков (ферентов) фосфопротеинфосфатазой (рис. 4.6). Рассмотренный механизм передачи сигнала является многостадийным, что обеспечивает его амплификацию, т. е. многократное усиление. Даже единственная молекула гормона способствует в образовании огромного числа 3', 5' цАМФ, которые, в свою очередь, активируют еще больше молекул протеинкиназы А. Одна молекула этого фермента фосфорилирует множество молекул белков. В итоге меняется активность тысяч молекул ферментов. Рис. 4.7. Схема аденилатциклазного пути мембранно-цитозольного механизма передачи сигналов (на примере сигнала глюкагона, адреналина в печени, мышцах) 2. Не оправдал ожидания гуанилатциклазный путь передачи информации. Предполагали, что его используют многие сигнальные молекулы, а их оказалось лишь несколько (атриальный, натрийуретический фактор (АНФ) или еще его называют атриопептин, натрийуретический пептид из мозга, кишечный пептид гуанилин, термостабильный токсин грамотрицательных бактерий, оксид азота (NO˙)). Различабт четыре формы гуанилатциклазы. Три из них структурированы в плазматические мембраны и играют роль белков-рецепторов первого типа. При этом гуанилатциклазной активностью обладает внутриклеточный домен. Связывание гормона с экстрацеллюлярным доменом-рецептором приводит к активированию внутриклеточного активного центра. В цитозоле есть еще одна растворимая форма гуанилатциклазы. В качестве простетической группы она содержит гем, с которым связывается самая простая межклеточная сигнальная молекула NO˙ (оксид азота). Все формы гуанилатциклазы синтезируют 3', 5' цГМФ по схеме, аналогичной образованию 3', 5' цАМФ из АТФ (рис. 4.5). А какими возможностями располагает 3', 5' цГМФ? Их условно выделяют три: а) он активирует протеинкиназу G (от англ. GMP) Протеинкиназа G состоит из 2-х субъединиц, каждая из которых имеет два центра связывания 3', 5' цГМФ. Конформационные изменения молекулы фермента после присоединения 3', 5' цГМФ повышают его активность. Он начинает интенсивно катализировать фосфорилирование различных белков по радикалам серина, треонина (рис. 4.8). Рис. 4.8. Схема активирования протеинкиназы G и ее каталитическая активность. б) 3', 5' цГМФ регулирует активность фосфорилазы, которая дециклизует 3', 5' цАМФ и, следовательно, контролирует его уровень в) активируя Са2+-АТФ-азу и снижая эффективность работы Са2+-каналов в мембранах, 3', 5' цГМФ способствует снижению уровня Са2+ в цитоплазме клеток Некоторые из этих эффектов присущи NO˙ - сигнальной молекуле (рис. 4.9). Она образуется в клетках многих тканей и органов при катаболизме аргинина. В состав фермента нитроксидсинтазы, катализирующей синтез NO˙, входят ФМН, ФАД, гем, ТГБП, Zn2+. В реакции участвует НАДФ·Н + Н+. Ацетилхолин стимулирует образование оксида азота, из чего следует, что она может опосредоваться нервной регуляцией. Он также активнее нарабатывается в ответ на механическое воздействие на стенки кровеносных сосудов при повышении кровяного давления. Образуясь в эндотелиальных клетках, NO˙ диффундирует в гладкомышечные. Там он взаимодействует с ионом железа, входящим в гем цитозольной гуанилатциклазы и активирует ее. Нарабатываемый 3', 5' цГМФ, воздействуя на протеинкиназу G, увеличивает поток Са2+ наружу и этим инактивирует киназу легких цепей. В итоге наступает мышечная релаксация и расширение сосудов. Возник повод называть оксид азота эндотелиальным релаксирующим фактором (ЭРФ, от англ. EndoteliumDrived Relaxing Factor, EDRF). На этом основано применение нитровазодилататоров (нитроглицерин, нитропруссид, аэрозоль изокет®, содержащая изосорбида динитрат и др.) для купирования загрудинных болей при стенокардии, инфаркте миокарда и т. д. Они медленно высвобождают NO˙, вызывая тем самым расслабление сосудов и улучшение кровоснабжения сердца. Рис. 4.9. Схема, иллюстрирующая участие NO˙-сигнальной молекулы в расслаблении гладких мышц. 3. Гормоны и другие сигнальные молекулы, фосфоинозитидный путь, представлены в табл. 4.2. использующие Таблица 4.2. Сигнальные молекулы, действующие по фосфоинозитидному пути Гормоны Прочие сигнальные молекулы Тиреолиберин Ангиотензин II Гонадолиберин Брадикинин Соматотропин Гастрин Вазопрессин (через V1-рецепторы) Холецистокинин Окситоцин ВИП Адреналин (через α1- Ацетилхолин (через Мадренорецепторы) холинорецепторы) Важным моментом в передаче сигналов по этому пути является активирование фермента фосфолипазы С, которая расщепляет минорные фосфолипиды плазматических мембран фосфатидилинозитол-4, 5-бисфосфаты (рис. 4.9). Образующиеся диацилглицеролы (ДАГ) и 1, 4, 5-трифосфоинозитолы (ИФ3) играют роль вторичных посредников. Как и в случае аденилатциклазного механизма первичными посредниками здесь являются G-белки, но не абсолютно те же, а несколько отличающиеся – Gplc-белки. ДАГ и ИФ3 инициируют в клетках-мишенях два отдельных каскадных механизма (рис. 4.10). ДАГ, оставаясь в плазматической мембране, активирует протеинкиназу С. В структуре этого фермента выделяют два домена: регуляторный и каталитический. Первый, имея высокое сродство к ионам кальция и максимально активируясь в его присутствии, присоединяет ДАГ. Конформационные изменения затрагивают каталитическую субъединицу и фермент становится активным. Протеинкиназа С фосфорилирует белки, имеющие отношение к пролиферации клеток (белки цитоскелета и ядерного хроматина, митогены, факторы роста). Следует отметить, что уровень Са 2+ в цитозоле клеток зависит от второго внутриклеточного посредника (ИФ3), хотя он и сам по себе является вторичным посредником. Каким образом ИФ3 повышает содержание Са2+ в цитозоле клеток? ИФ3 усиливает его мобилизацию из цистерн эндоплазматического ретикулума, а, превращаясь в 1, 3, 4, 5-инозитолтетрафосфат (ИФ4), открывает в плазматических мембранах «медленные» неэлектрогенные лиганд-зависимые кальциевые каналы, обеспечивая поступление Са2+ в клетки из внеклеточного матрикса в цитоплазму. Действие Са2+ опосредовано специальными Са2+-вязывающими белками кальмодулином, аннексином. Кальмодулин представляет из себя белок (Mr 17 кДа), имеющий четыре участка связывания Са2+. При повышении уровня этого иона в цитозоле до ≥10-5 моль/л образуются активные Са2+-кальмодулиновые комплексы, способные изменять функциональное состояние разных белков. Они активируют кальций-зависимые аденилатциклазу и гуанилатциклазу, а в некоторых типах клеток, стимулируя фосфодиэстеразу, гасят сигналы, передаваемые по аденилатциклазному пути. Кроме того, Са2+-кальмодулиновые комплексы активируют различные протеинкиназы, в том числе протеинкиназу С, которые, например, в гладких мышцах фосфорилируют легкие цепи миозина и инициируют их сокращение. В париетальных клетках стенки желудка киназы фосфорилируют и этим стимулируют функцию Н+, К+-АТФ-азы, обеспечивающей секрецию Н+ для последующего образования HCl. В разных тканях Са2+-зависимая протеинкиназа активирует киназу липомодулина. Этот мембранный белок повышает активность фосфолипазы А2 и стимулирует в конечном итоге биосинтез эйкозаноидов (простагландинов, тромбоксанов, простациклинов, лейкотриенов). В мышцах Са2+ активирует особую форму киназы фосфорилазы В, стимулирующую гликогенолиз. Этот механизм реализуется адреналином через α1-адренорецепторы. Терминация эффектов кальмодулина происходит при его взаимодействии с кальций-связывающими белками типа кальцийнейрина. Кроме того, сам Са2+ активирует Са2+-АТФ-азу, обеспечивающую удаление его туда, откуда он поступал в цитозоль (ВКМ, цистерны ЭР). И, наконец, вторичные посредники ИФ3 и ДАГ могут удаляться путем вовлечения в ресинтез минорных фосфатидилинозитолов. Все это приводит к прекращению передачи гормонального сигнала. Рис. 4.10. Фосфоинозитидный путь действия сигнальных молекул: Pg – простагландины; Lt – лейкотриены; Tx – тромбоксаны; Pg I2. 4. Путь включения Са2+ неэлектрогенных медленных каналов. Уже отмечено в предыдущем разделе, что эти каналы в плазматических мембранах открываются под воздействием инозитол-1, 3, 4, 5-тетрафосфата (ИФ4). Однако в ряде случаев эти каналы могут включаться напрямую гормонрегуляторными комплексами или через G-белки. Таких информонов известно несколько (табл. 4.3). Таблица 4.3. Информоны, напрямую действующие на медленные неэлектрогенные Са2+ каналы. Гормоны Другие информоны Соматолиберин Гастрин Тиреолиберин Холецистокинин Гонадолиберин Вазопрессин (через V1-рецепторы) Данный путь накопления Са2+ в клетке является менее эффективным, чем фосфоинозитидный, но при достижении уровня Са2+ в цитозоле ≥ 10-5 моль/л их эффекты совпадают (см. раздел №4, стр. ). 5. Тирозинкиназный путь. Его включают рецепторы, обладающие тирозинкиназной активностью (см. рецепторы первого типа, рис. 4.1, 4.12, 4.14), или инициирующие ее у других белков (рис. 4.15). Уникальность этих протеинкиназ состоит в том, что они фосфорилируют белки не по остаткам серина, треонина, как это традиционно делают другие протеинкиназы, а по радикалам тирозина. Рецепторы – собственно тирозинкиназы (инсулиновый, фактора роста эпидермиса и др.) активируют необычный сигнальный путь (Ras-путь), особенностью которого является отсутствие низкомолекулярных вторичных посредников. Все его участники представлены белками. Один из них Ras Gбелок, давший название всему пути. Это небольшой мономерный ГТФсвязывающий белок, обладающий ГТФ-азной активностью. В неактивном состоянии Ras-белок прикреплен к внутренней поверхности плазматической мембраны и связан с ГДФ. В активной его форме ГДФ заменен на ГТФ. Как же реализует инсулин свою информацию в клетках-мишенях? а) После связывания с гормоном рецептор аутофосфорилируется по тирозиновым радикалам и активируется. б) Это приводит к фосфорилированию находящихся в цитоплазме белковсубстратов инсулинового рецептора (IRS). См. рис. 4.11. Известны разные их варианты. в) Эти субстраты инициируют в клетках несколько видов дальнейших превращений. Один из них связан с активированием Ras G-белков. При этом образуется комплекс, включающий четыре компонента: 1 – фосфорилированный инсулиновый рецептор (IR-тир-О-Р); 2 – фосфорилированный субстрат инсулинового рецептора (IRS-тир-О-Р); 3 – GEF; 4 – SOS-белок (сокращеня расшифрованы в комментариях к рис. 4.11). Комплекс инициирует изменения, происходящие дальше с Ras G-белками. Вначале в Ras G-белке происходит замена ГДФ на ГТФ. Это очень похоже, хотя и не полностью, на активирование G-белков, ассоциированных с рецепторами третьего типа (рис. 4.4). Ras-ГТФбелок обладает ГТФ-азной активностью, то есть он сам себя постепенно инактивирует и возвращается в инертную форму (Ras-ГДФ-белок). Показано, что ГТФ-азная его активность стимулируется специальным GAP – 5. См. рис. 4.11. Рис. 4.11. Схема активирования и последующего аутоинактивирования Ras Gбелка. 1 - фосфорилированный инсулиновый рецептор (IR-тир-О-Р); 2 фосфорилированный субстрат инсулинового рецептора (IRS-тир-О-Р от англ. Insuline Receptor substrate); 3 – GEF, осуществляющий обмен ГТФ (от англ. GTF-ase Exchange Factor); 4 – SOS-белок (от англ. Son of Sevenless – белок, участвующий в этом сигнальном пути, получивший название по имени соответствующей мутации гена (Sevenless mutation) у мушки дрозофилы; 5 – GAP от англ. GTP-ase Activatiny Protein. г) На пике своей активности Ras ГТФ-белок фосфорилирует и этим стимулирует функцию следующего компонента Raf-1-белка, представляющего из себя протеинкиназу серин-треонинового типа. Raf-1-белок в неактивном состоянии находится в цитозоле. Он комплексирован с шаперонами. Его активирование Ras ГТФ-белком – сложный многоэтапный процесс. д) Активная Raf-киназа стимулирует каскад реакций фосфорилирования по серин/треониновому типу. Изменяется функциональное состояние нескольких белков, в частности, митоген активируемых протеинкиназ (МАП). Последние активируются в две стадии: вначале фосфорилируется киназа МАП, а потом ею активируются и они сами. е) Мишенями МАП являются белки-эффекторы, также как протеинкиназа рр90S6, фосфорилаза А2, белки рибосом, а также переносчики сигнала и активаторы транскрипции (ПСАТ). В их число входят Gun-, Fos-факторы и др. Здесь следует отметить, что Gun-, Fos-факторы, как и ранее упоминавшиеся Ras- и Raf-белки, обязаны своими необычными названиями ретровирусным онкогенам. Оказалось, что эти онкогены имеют в нормальных клетках своих «двойников». И хотя эти нормальные гены кодируют белки Rasпути, назвали их по онкогенам вирусов. ж) После димеризации и транслокации в ядро ПСАТ выступают в роли индукторов, узнающих энхансеры. Этим они стимулируют транскрипцию генов, клеточную пролиферацию и дифференцировку. Инсулин влияет на скорость транскрипции более чем 100 мРНК в клетках печени, скелетных мышц, сердца, жировой ткани. Обращает внимание, что некоторые факторы транскрипции являются ее репрессорами, узнающими сайленсеры на ДНК. Тогда биосинтез мРНК и соответствующих белков замедляется. Инсулин таким способом подавляет образование фосфоенолпируваткарбоксикиназы и блокирует глюконеогенез. Окончание гормонального действия через инсулиновые рецепторы наступает под влиянием протеинфосфатаз, возвращающих их в неактивное состояние или их фосфорилирование протеинкиназами по радикалам серина и треонина, их сродство к инсулину. Еще одним путем снижения чувствительности клеток к инсулину является захватывание ими комплексов рецептор-инсулин внутрь эндоцитозом. Часть рецепторов потом возвращается обратно в мембрану, а часть расщепляется лизосомальными протеиназами. з) Одной из особенностей Ras-пути является его взаимодействие в нескольких точках с другими регуляторными путями. Так Raf-1-белок может активироваться не только Ras ГТФ-белком, но и протеинкиназой С – ферментом участником фосфоинозитидного пути (рис. 4.10). И, напротив, некоторые протеинкиназы Ras-пути могут иметь в качестве мишеней белки альтернативных регуляторных механизмов. Например, протеинкиназа рр90S6 каскадного этапа Ras-пути рр90S6 стимулирует функцию протеинфосфатазы, которая затем фосфорилирует киназу гликогенфосфорилазы, гликогенфосфорилазу, гликогенсинтазу – регуляторные ферменты метаболизма гликогена по аденилатциклазному пути. Распад гликогена в печени под действием инсулина замедляется, а биосинтез ускоряется. Уже было отмечено, что митогенактивируемые протеинкиназы (МАП) стимулируют функцию фосфорилазы А2, обеспечивающей образование эйкозаноидов. Это сближает эффекты тирозинкиназного и фосфоинозитидного путей передачи сигналов. Вторичные посредники последнего (ИФ3, ИФ4, Са2+) через киназу липомодулина также активируют фосфорилазу А2 (рис. 4.10). Обнаружена способность субстратов (IRS), активируемых инсулинрецепторным комплексом, стимулировать функцию фосфатидилинозитол-3киназы (ФИ-3-киназы). Через ряд стадий это приводит к образованию минорных фосфофосфатидилинозитолов и повышению уровня вторичных посредников фосфоинозитидной сигнальной системы ФИ3, ФИ4, Са2+ (рис.4.10). Считают также, что ФИ-3-киназа в адипоцитах активирует фосфодиэстеразу. Это приводит к торможению липолиза за счет уменьшения внутриклеточной концентрации вторичного посредника аденилатциклазного пути 3'5' цАМФ. ФИ-3-киназа принадлежит способность в мышцах и жировых клетках ускорять встраивание белков транспортеров глюкозы четвертого типа (Глют-4) в плазматические мембраны и стимулировать облегченную диффузию глюкозы из крови в клетки. Уровень глюкозы в крови снижается (рис. 4.13). На жировых клетках было показано, что встраивание Глют-4 завершается уже через 7 минут после связывания инсулина с рецепторами. После удаления инсулина процесс обращается, и через 20 – 30 минут транспортные белки выходят из мембраны в цитоплазму. Рис. 4.13. Мобилизация Глют-4 под действием инсулина в клетках скелетных мышц и жировой ткани. 1 – инсулиновый рецептор; 2 – гормон инсулин; 3 – Глют-4 в цитозольных везикулах; 4. После образования гормон-рецепторного комплекса везикулы перемещаются к плазматической мембране, сливаются с ней и встраивают Глют-4 в мембрану. После этого происходит облегченная диффузия глюкозы в клетки. Рис. 4.12. Краткая схема Ras-пути, сигнальных молекул, передающих информацию через рецепторы, ассоциированные с тирозинкиназой, на примере инсулина. Буквами а, б, в, г, д, е, ж, з обозначены основные стадии Ras-пути, характеристика которых дана в тексте (стр. ) IRS – субстрат инсулинового рецептора; Глют-4 – белок-транспортер глюкозы (глюкозный транспортер-4); ФИ3 – инозитол-1, 4, 5-трифосфат; ФИ4 – инозитол-1, 3, 4, 5-тетрафосфат; SOS-белок – (от англ. Son of Sevenless), названный по мутации гена у мушки дрозофилы; Gun-, Fos-факторы, Ras-, Raf – белки получили свои названия по названиям ретровирусных онкогенов, «двойниками» которых они оказались в нормальных клетках; МАП – митоген, активирующий протеинкиназу; ПСАТ – переносчики сигнала и активаторы транскрипции. Глюкозные транспортеры (Глют-4) обнаружены во всех тканях, инсулинзависимые – в жировой и мышечной. Различают их несколько типов (табл. 4.4). Таблица 4.4. Типы белков транспортеров глюкозы, их локализация и функции. Типы Распределение Глют по клеткам Функции разных Глют Глют тканей и органов 1 Головной мозг, почки, толстый Стабильная облегченная диффузия кишечник, плацента, эритроциты глюкозы в клетки этих тканей 2 Печень, почки, энтероциты, β- Облегченная диффузия глюкозы из клетки поджелудочной жедезы клеток этих тканей в кровь 3 Головной мозг, почки, плацента и Стабильная облегченная диффузия др. глюкозы в клетки тканей, но более интенсивная, чем с участием Глют-1, т. к. Глют-3 обладает к ней повышенным сродством 4 Скелетные мышцы, ткань, сердце 5 Тонкий кишечник жировая Стимулируемая инсулином облегченная диффузия глюкозы из крови в клетки (см. рис. 4.13) Трансмембранный транспорт глюкозы эпителиальными клетками, осуществляющими всасывание Иначе выглядит инициация Ras-пути у ЭФР. а) Связывание сигнальной молекулы вызывает димеризацию рецептора (рис. 4.14) и его аутофосфорилирование (1). б) С фосфотирозинами рецепторов взаимодействует (2) SH2-домен белка переносчика сигнала (SH2БПС), который связан с так называемым (3) SOSбелком (см. рис. 4.14). в) Образовавшийся тройной комплекс: (1) димер фосфорилированного рецептора ЭФР/(2) SH2БПС/(3) SOS-белок активирует Ras-G-белок (рис. 4.11). Дальнейшая передача сигнала вплоть до генома реализуется по Ras-пути (рис. 4.14), этапы которого во многом совпадают с таковыми у инсулина. Рис. 4.14. Краткая схема активирования Ras-пути эпидермальным фактором роста (ЭФР). 1 – фосфорилированный рецептор ЭФР после димеризации; 2 SH2БПС – белок переносчик сигнала, имеющий в структуре SH2-домен, узнающий остатки тирозина; 3 - SOS-белок (от англ. Son of Sevenless), названный по мутации гена у мушки дрозофилы. Буквами а, б, в обозначены начальные этапы инициации Ras-пути ЭФР, характеристика которых дана в тексте. Рецепторы, передающие сигналы таких гормонов как соматостатин, пролактин, а также почти всех цитокинов, хотя и реализуют их по тирозинкиназному пути, при этом сами ферментами не являются и, следовательно, не обладают способностью к аутофосфорилировнию. Их фосфорилируют другие тирозинкиназы. Ими часто являются так называемые Янус-киназы, имеющие два активных центра (от «двуликий Янус», т. е. проявляющийся в двух лицах). Они принадлежат к протеинкиназам особого ЯКсемейства. Участие рецепторов в передаче сигналов происходит по пути димеризации или без нее. По первому варианту активируются, например, рецепторы соматостатина. Они представляют из себя белки (Mr 70 кДа) с одним трансмембранным доменом (рис 4.15). а) После связывания с ними гормона молекулы рецепторов ассоциируют, образуя гомодимеры. б) Последние через белки-переносчики сигналов (SH2БПС) активируют Янус-киназы. В клетках тканей и органов обнаружено несколько типов SH2БПС. Их условно называют белки GP 130, βс, γс и др. Одинаковые спектры биологической активности у разных сигнальных молекул объясняют тем, что они активируют одни и те же SH2БПС. И наоборот, отличающиеся эффекты одного и того же гормона могут объясняться участием разных SH2БПС. в) Янус-киназы фосфорилируют по тирозиновым радикалам и себя (аутофосфорилирование), и цитоплазматические домены рецепторов, и различные белки. У соматостатина таким белком может быть и фосфокиназа С. Она, как известно, участвует в передаче сигналов по фосфоинозитидному пути (рис. 4.10). г) В итоге повышается уровень ДАГ, ИФ3, Са2+ - вторичных посредников (рис. 4.10) д) Янус-киназы могут фосфорилировать и факторы транскрипции, называемые часто переносчиками сигнала и активаторами транскрипции (ПСАТ или STAT (от англ. Signal Tranducers and Activators of Transcription)). После димеризации и транслокации в ядро ПСАТ (STAT) в качестве фактора транскрипции связывается с энхансерами генов и активируют их транскрипцию. Этот финал «работы» Янус-киназ характерен для большинства цитокинов, в том числе интерлейкинов, интерферонов, факторов некроза опухолей, колониестимулирующих факторов и др. В итоге они контролируют рост и дифференцировку клеток, отвечают за биосинтез белков острой фазы и т. д. Рис. 4.15. Передача сигналов по тирозинкиназному пути через рецепторы, лишенные ферментативной активности и Янус-киназы. Буквами а, б, в, г обозначены основные стадии реализации сигнала соматотропина. Буквами а, б, д обозначены основные стадии реализации сигнала цитокинов, характеристика которых дана в тексте. 6. Путь, включающий электрогенные (потенциалзависимые) ионные каналы. Связывание лиганда ведет к открыванию каналов Na+, K+, Cl¯. По такому механизму нейромедиаторы, такие как ацетилхолин (через N-холинорецепторы – Na+ и K+-каналы), γ-аминомасляная кислота (ГАМК через А-рецепторы - Cl¯каналы), β-аланин, глицин, серотонин в центральных и периферических синапсах. Этот путь рассматривается в теме: «Биохимия нервной системы». II. Внутриклеточно-ядерный механизм. Местом действия липофильных гормонов являются ядра клеток-мишеней, где они регулируют экспрессию генов на стадии инициации транскрипции. В итоге синтезируются новые мРНК, новые белки, реализующие клеточный ответ. Гормоны после проникновения в клетки-мишени связываются со своими рецепторами, которые находятся или в цитозоле (глюкокортикоиды, минералокортикоиды, 1, 25(ОН)2D3, 24, 25(OH)2D3) или в ядре (эстрогены, андрогены, прогестерон, Т3, Т4). Рецепторы гормонов, являясь гликопротеинами, принадлежат к группе релких белков. Присутствуя в клетках-мишенях в количестве 103 – 104 молекул, они характеризуются высоким сродством к гормонам и у разных из них существенно отличаются. Так, рецепторный белок для кортизола имеет Mr 67 кДа, а для эстрадиола – Mr 200 кДа. В последнем случае он состоит из двух субъединиц. В неактивном состоянии рецепторы связаны с белками-протекторами (шаперонами – Ш 90 или shp 90). Особенностью этих белков является высокое сродство к гидрофобным радикалам аминокислот. Они обеспечивают вновь синтезированным белкам правильное пострибосомальное созревание (англ. shaperon – буквально пожилая дама, сопровождающая молодую девушку на балах, а также спутник, компаньон), снижая вероятность возникновения ошибок. В зависимости от молекулярной массы выделяют Ш 40, Ш 60, Ш 70, Ш 90 и др. Различают конститутивные и индуцибельные формы шаперонов. Синтез вторых усиливается при повышении температуры тела и других проявлениях стресса. В этой связи их еще называют белками теплового шока (англ. heat shock proteins – hsp 60, hsp 70, hsp 90 и т. д.). Помимо участия в посттрансляционном процессинге, шапероны: а) участвуют в завершающем этапе существования белков, обеспечивая их разворачивание при денатурации, с которой начинается их катаболизм; б) направляют белки в протеасомы и лизосомы для их разрушения; в) переносят белки через биомембраны; г) инициируют апоптоз; д) участвуют в превращениях конструктивных прионовых белков (Pr, Pc) в патологические их конформации – белки в форме, (Pr, Pc), инициирующие ряд прионовых болезней; е) связываясь с рецепторами липофильных гормонов, они их стабилизируют. Образование гормон-рецепторных комплексов влечет за собой конформационные перестройки молекул рецепторных белков и диссоциацию от шаперонов. Если это произошло в цитозоле, комплекс перемещается в ядро. Там молекулы рецепторов объединяются в димеры, обладающие повышенным сродством к ДНК. Нередко процессы активирования рецепторов сопряжены с их фосфорилированием. Важным этапом в передаче гормональных сигналов является связывание гормон-рецепторных комплексов с двунитевой ДНК. Это происходит в регуляторных участках генов, получивших название гормон-чувствительные элементы (ГЧЭ). Последние, выступая в роли энхансеров, могут стимулировать транскрипцию, а являясь сайленсерами, ее подавляют. Функции ГЧЭ выполняют короткие симметричные фрагменты ДНК (палиндромы). Молекулы рецепторных белков включают несколько доменов, имеющих разное предназначение: регуляторный ДНК-связывающий, сайтспецифичный и С-терминальный гормонсвязывающий. В ДНКсвязывающем домене содержатся аминокислотные последовательности, образующие два цинковых кластера (или иначе два «цинковых пальца»). Один из них отвечает за связь рецептора с палиндромами ДНК, второй за димеризацию рецептора. В каждом «цинковом пальце» атом цинка связан с 4 остатками цистеина (рис. 4.14). Рис. 4.14. Структура цинкового пальца в белке-рецепторе, ответственная за связывание с ГЧЭ ДНК. Рецепторы тиреоидных гормонов относят к факторам транскрипции. Они всегда на ДНК. В отсутствие гормонов они играют роль репрессоров, а при их поступлении инициируют экспрессию соответствующих генов. Обсуждение внутриклеточно-ядерного механизма передачи гормональных сигналов можно завершить кратким изложением последовательности событий, приводящих к активированию транскрипции (рис. 4.15). Гормон поступает в клетку-мишень, преодолевая билипидный слой плазматической мембраны. Взаимодействие гормона с рецептором приводит к его конформационным изменениям и снижению сродства к hsp 90, который отделяется от гормон-рецепторного комплекса. Если комплекс образовался в цитоплазме, он перемещается через поры в ядро, и там происходит димеризация рецепторов. Димер взаимодействует с ГЧЭ ДНК (энхансером или сайленсером). Это способствует увеличению (при взаимодействии димера с энхансером) или снижению (в случае взаимодействия димера с сайленсером) доступности промотора для РНК-полимеразы. Скорость транскрипции структурных генов увеличивается или уменьшается. Аналогично изменению транскрипции меняется скорость трансляции на рибосомах. Изменяется содержание соответствующих белков в том же типе ферментов, что сказывается на метаболических процессах и функциональном состоянии клетки. Возникает клеточный ответ. Эффекты липофильных гормонов проявляются не сразу, так как для осуществления матричных биосинтезов (транскрипция, трансляция) требуется время (десятки минут, часы). Рис. 4.15. Схема реализации сигналов липофильными гормонами (на примере кортизола). Терминация рецепторного цикла липофильных гормонов наступает при распаде тройного комплекса гормон/рецептор/ГЧЭ. Вопрос «когда и как это происходит» остается дискуссионным. Есть несколько вариантов его решения: а) Значительное повышение количества мРНК приводит к ее конкуренции с ДНК за гормон-рецепторный комплекс. Вытесняя его из ГЧЭ ДНК, мРНК временно транслирует процесс. б) Инактивация рецептора путем его фосфорилирования протеинфосфатазами. в) Протеолиз рецептора ядерными протеиназами. г) Необратимой ферментативной инактивации может подвергаться и сам гормон. Такая возможность наиболее вероятна в печени. Задание 4.1. 1. Дайте характеристику типам рецепторов, обеспечивающих передачу гормональных сигналов. 2. Назовите пути передачи сигналов по мембранно-цитозольному механизму. 3. Составьте схемы, отражающие последовательностьсобытий при передаче информации сигнальными молекулами по аденилатциклазному и фосфоинозитидному путям. 4. Перечислите этапы Ras-пути тирозинкиназного механизма на примере передачи сигналов инсулина. 5. Ответьте на вопросы: Почему мембранно-цитозольный механизм передачи информации называют косвенным, а внутриклеточно-ядерный – прямым? Каких ижиданий не оправдал гуанилатциклазный механизм? Аденилатциклаза и гуанилатциклаза кактлизируют идентичные реакции. А в чем их отличия? Какую роль играет гуанилатциклаза в реализации информации NO˙-сигнальных молекул? В чем сходства и отличия аденилатциклазного и фосфоинозитидного путей мембранно-цитозольного механизма? В чем отличия тирозинкиназной активности, проявляемой белками при передаче сигналов инсулина, эпидермального фактора роста (ЭФР), соматотропина? Какое отношение имеют белки-шапероны к липофильным гормонам? Что такое гормончувствительный элемент (ГЧЭ)? Почему эффекты липофильных гормонов проявляются не мгновенно? Как прекращается передача сигналов гормонов, передающих их по внутриклеточно-ядерному механизму? Задание 4.2. Решите тесты: Инозитолтрифосфаты как внутриклеточные посредники: А. Активируют фосфокиназу С Б. Образуются из минорных фосфолипидов плазматических мембран фосфатидилинозитол-4, 5-бисфосфатов В. Усиливают мобилизацию Са2+ из цистерн эндоплазматического ретикулума Г. Может превращаться в 1, 3, 4, 5-инозитолтетрафосфат Д. Состоит из трех субъединиц Указанные группы гормонов: 1. Проникают в клетки-мишени из крови А. Белково-пептидные 2.Изменяют активность метаболических Б. Стероидные процессов В. И те, и другие 3. Реализуют свои сигналы, Г. Ни один из них взаимодействуя с белками-рецепторами 4. Участвуют в построении биомембран 5. Не проникают в клетки-мишени Гормоны: А. Секретируются в ответ на специфические стимулы Б. Каждый из них влияет на метаболизм в любых клетках организма В. Могут реализовывать свои сигналы без участия белков-рецепторов Г. Образуются в клетках-мишенях Д. Все имеют первичных и вторичных посредников передачи информации 1. 2. 3. 4. 5. Гормоны передают свои сигналы через рецепторы: Атриопептин А. Рецепторы, передающие сигналы с Глюкагон участием Янус-киназ Соматотропин Б. Внутриядерные рецепторы Трийодтиронин В. Рецепторы с тирозинкиназной Инсулин активностью Г. Рецепторы с гуанилатциклазной активностью Д. Нет правильного ответа Оцените достоверность утверждений в каждом предложении и связь между ними: Янус-киназы, участвуя в передаче гормональных сигналов по гуанилатциклазному пути, активируют факторы транскрипции ПСАТ, фосфорилируя их по радикалам серина, потому что они имеют один активный центр. Ras-G-белки подобно α-субъединицам G-белков обладают ГТФазной активностью, поэтому они являются участниками Ras-пути передачи гормональных сигналов. Для передачи гормональных сигналов липофильными гормонами характерно: А. Взаимодействие с внутриклеточными белками-рецепторами Б. Участие в процессе трансляции белков В. Образование 3', 5' цАМФ Г. Проникновение в клетки-мишени Д. Инициация репликации ДНК Задание 4.3. Решите задачу: У больного стала возникать сильная боль за грудиной, усиливающаяся при ходьбе и физических нагрузках. Пациент при этом останавливается и при этом боль может утихнуть через несколько минут. Иногда боль появляется при волнении и вне связи с физическими напряжениями. Периодически боль стала появляться даже ночью. Больной просыпается с чувством страха и остается неподвижным, опасаясь ее усиления. Характерным для этих приступов оказалось то, что они быстро купируются после приема под язык нитроглицерина. Примите решение относительно заболевания пациента. Объясните механизм лечебного эффекта нитроглицерина. 5. Гормоны центральных эндокринных желез. Йодтиронин щитовидной железы. Эндокринная система является важным звеном в передаче сигналов от головного мозга к тканям и органам. Ведущую роль в этом играют центральные железы гипоталамус и гипофиз. Мозг воспринимает сигналы от всех тканей организма. Это происходит путем возбуждения афферентных (приносящих) нервных волокон, а также в результате изменения состава крови, поступающей в него. Эфферентные (центробежные) нервные импульсы, передаваемые из головного мозга в гипоталамус, активируют его секреторные возможности. Гормоны гипоталамуса поступают в переднюю долю гипофиза через специальную портальную систему сосудов, которая соединяет эти железы. Каждый из либеринов гипоталамуса (см. табл. 2.1) влияет на определенные клетки гипофиза и инициирует в них синтез соответствующих тропинов (см. табл. 2.2). Влияние на гипофиз статинов (см. табл. 2.1) противоположное. Они подавляют выработку тропинов. С током крови гормоны гипофиза попадают в периферические железы и в клетках-мишенях активируют секреторные процессы. На каждом этапе передачи сигналов происходит их усиление за счет увеличения количества вырабатываемых гормонов. Особенностью эндокринного пути передачи информации является и то, что, воздействуя одним стимулом, можно получитьмножество ответных эффектов. Например, при стрессе сигналы, инициирующие выработку кортиколиберина в гипоталамусе, стимулируют биосинтез в передней доле гипофиза проопиомеланокортина. При распаде этого белка образуется не только кортикотропин и медиаторы (рис 2.1) В то время, как глюкокортикоиды, вырабатываемые в коре надпочечников в ответ на сигнал кортикотропина, способствуют повышению уровня глюкозы в крови, липотропин напрямую стимулирует липолиз и мобилизацию жирных кислот в адипоцитах. Меланотропин стимулирует иммунную систему. Эндорфины, энкефалины уменьшают болевые ощущения. А все вместе они обеспечивают наиболее выгодную адаптацию организма к стрессу. Образование и выделение гормонов в гипоталамусе и гипофизе тесно связаны, поэтому целесообразно их рассматривать вместе. У гормонов гипоталамуса главной, а чаще единственной, функцией является регуляция «работы» гипофиза. Гормоны последнего не только стимулируют функции соответствующих желез, но и нередко оказывают прямое влияние на метаболические процессы в периферических тканях и органах. По химическому строению гормоны гипоталамуса представляют из себя пептиды. В гипофизе синтезируются гормоны полипептиды, простые белки, сложные белки гликопротеины. Тиреолиберин состоит всего лишь их трех аминоацилов, два из которых образованы остатками редко встречающихся аминокислот (Mr 262 кДа). См рис. 5.1. Рис. 5.1. Химическая структура тиреолиберина. 1 – остаток пироглутаминовой кислоты; 2 – остаток гистидина; 3 – остаток пролинамида. Удивительным является и то, что синтезируется этот небольшой пептид ограниченным протеолизом из довольно большого предшественника препротиреолиберина, состоящего из 242 аминоацилов. Секреция тиреолиберина усиливается норадреналином, а замедляется серотонином. В клетках-мишенях передней доли гипофиза тиреолиберин по аденилатциклазному и фосфоинозитидному путям усиливает биосинтез тиреотропина и некоторых других гормонов, однако считают, что последнее физиологического значения не имеет. Тиреотропин представляет из себя сложный белок гликопротеин (Mr 30 кДа), состоящий из двуз (α, β) субъединиц. Субъединицы синтезируются на рибосомах отдельно, их сборка в единую молекулу происходит в гладком эндоплазматическом ретикулуме. Йодтиронины механизмом обратной связи как на гипоталамическом через тиреолиберин, так и на гипофизарном уровне регулируют биосинтез тиреотропина, а следовательно, и свой собственный. Относительно гипофизарного уровня известно, что йодтиронины через ГЧЭ с сайленсерной активностью подавляют транскрипцию генов как α-, так и βсубъединиц тиреотропина. Тиреотропин оказывает мощное влияние, исчисляемое минутами, на функцию щитовидной железы. Его эффекты, реализуемые по аденилатциклазному пути, включают стимуляцию всех стадий биосинтеза йодтиронинов (см. рис. 2.4). Хронические его эффекты в течение нескольких дней приводят к ускорению в щитовидной железе биосинтеза нуклеиновых кислот, белков и др., а заканчивается все тем же ускорением секреции йодтиронинов. Меланолибеоин и меланостатин являются гекса- и пентапептидами соответственно. Они взаимно противоположно влияют на выработку в средней доле гипофиза меланотропинов. Последние, как оказалось, не только стимулируют в меланоцитах синтез из тирозина темных пигментов меланинов, но и обладают липомобилизирующим действием в клетках жировой ткани, реализуя свои сигналы по аденилатциклазному пути. Считают, что пролактолиберин по строению чем-то похож на тиреолиберин. Пролактостатин является полипептидом, включающим 56 аминокислотных остатка. Эти оба гормона стимулируют выработку в передней доле гипофиза пролактина. Последний представляет из себя белок (199 аминоацилов, Mr 22,5 кДа, Т1/2 15 – 20 мин). Свои сигналы он реализует по тирозинкиназному пути с участием Янус-киназ. В течение беременности пролактин совместно с кортизолом и инсулином способствует дифференцировке альвеолярных клеток грудных желез. подготавливая их к предстоящей секреции молока. В период лактации пролактин стимулирует биосинтез белков, преимущественно казеина и α-лактальбумина. Последний является главным белком молока с трофической функцией. Кроме того, взаимодействуя с галактозилтрансферазой, он снижает ее Km для глюкозы. Этим он стимулирует биосинтез лактозы – дисахарида молока. Спектр биологической активности этого гормона превышает тот, что заложен в его названии. Он не только стимулирует лактацию, индуцируя в молочных железах биосинтез выше названных белков и углеводов, но и контролирует совместно с лютропином выработку тестостерона в клетках Лейдига семенников у мужчин. Он также обладает антидиуретическим действием, усиливая в почках реабсорбцию воды и влияя на выделение Na+ и К+. У мужчин часть молекул пролактина остается в гипофизе в связанном состоянии и из него не секретируется. Это сказывается на концентрации гормона в плазме крови. У мужчин она в 1,5 – 2 раза ниже, чем у женщин (5 – 7 нг/мл против 8 – 10 нг/мл). Кортиколиберин, состоящий из 41 аминоацила, стимулируя по аденилатциклазному пути биосинтез в передней доле гипофиза белка предшественника проопиомеланокортина, на самом деле усиливает продукцию не только кортикотропина, но и других гормонов и медиаторов (рис. 2.1). Кортикотропин представляет из себя полипептид, состоящий из 39 аминокислотных остатков (Т1/2 15 – 20 мин). Передавая в клетки-мишени свои сигналы по аденилатциклазному пути, кортикотропин в коре надпочечников обеспечивает фосфорилирование ферментов, необходимых для образования из холестерола прегнелона (рис. 2.6) и тех, что усиливают в дальнейшем биосинтез из него глюкокортикоидов (монооксигеназы и др.). Кортикотропин, выделяясь в значительных количествах при стрессовых ситуациях и стимулируя биосинтез глюкокортикоидов, с помощью последних по механизму отрицательной обратной связи, но гасит свою собственную секрецию. Передавая по аденилатциклазному пути свои сигналы в клетки жировой ткани, кортикотропин активирует тканевую липазу и этим усиливает липолиз. Однако даже тогда, когда отмечается пик его активности, этот эффект невелик и требуются сверхфизиологические концентрации гормона. Соматолиберин и соматостатин контролируют биосинтез в передней доле гипофиза соматотропина. Соматолиберин – полипептид, в образовании которого принимают участие 44 аминокислоты. Соматотропин состоит из 14 аминокислотных остатков. Установлено, что последний синтезируется не только в гипоталамусе, но и в некоторых других тканях (кишечник, D (δ) клетки островков Лангерганса поджелудочной железы). Только во втором случае он образован 28 аминокислотами и может служить субстратом для получения пептида из 14 аминоацилов. Спектр биологической активности соматостатина оказался широким. Он тормозит биосинтез не только соматотропина, но и глюкагона, инсулина, кальцитонина, паратирина, гастрина, секретина, холецистокинина, пищеварительных ферментов щитовидной железы. Соматотропин является белком, состоящим из 191 аминоацила, Mr 22 кДа. Его секреция аденогипофизом стимулируется не только соматолиберином, но и другими стимулами (стресс, гипоглюкоземия, богатая белками пищи и др.). Его выработку повышают глюкокортикоиды. Клетки-мишени соматотропина находятся в печени, скелетных мышцах, костной и хрящевой тканях, кишечнике, почках, легких и др. Свои сигналы этот гормон реализует по тирозинкиназному пути через Янус-киназы (рис. 4.15) и фосфоинозитидному пути с участием фосфолипазы С и вторичных посредников ДАГ, ИФ3, Са2+ (рис. 4.10). Сматотропин – анаболический гормон, стимулирует рост всех тканей. Различают прямое и опосредованное влияние соматотропина на метаболические процессы. Прямые его эффекты двухфазны (см. табл. 5.1). В первые час – два (ранняя фаза) после секреции эффекты соматотропина оцениваются как инсулиноподобные. Увеличивается поглощение глюкозы мышцами и жировой тканью. В печени и мышцах усиливается поступление аминокислот в клетки и ускоряется протеиногенез. В жировой ткани угнетается липолиз. Через несколько часов (поздняя фаза) эффекты становятся антиинсулиновыми («диабетогенными»). Угнетается поглощение и утилизация глюкозы тканями. Содержание ее в крови повышается. В адипоцитах усиливается липолиз. Содержание свободных жирных кислот повышаетя. Однако протеиногенез в тканях по-прежнему активизирован. Поступление аминокислот в печень усиливает глюконеогенез и поступление глюкозы в кровь. № 1 2 3 4 Таблица 5.1. Эффекты соматотропина при прямом его действии на органы и ткани Характер эффекта Ранняя фаза Поздняя фаза (первые час – два (через несколько после секреции) часов) Инсулиноподобный эффект действие Поглощение глюкозы мышцами, Усиливается Угнетается жировой тканью Содержание глюкозы в сыворотке Повышается крови (в норме 3,3 – 5,5 ммоль/л) Липолиз в жировой ткани Угнетается Усиливается Содержание свободных жирных Повышается кислот в сыворотке крови (в норме 0,5 – 1 ммоль/л) 5 6 Поглощение аминокислот клетками Усиливается тканей-мишеней и протеиногенез Глюконеогенез печени, почках и поступление глюкозы в ровь Усиливается Ускоряется Опосредованное действие соматотропина связано с его стимуляцией синтеза инсулиноподобных факторов роста (ИФР-1 и ИФР-2). Их еще называют соматомедины С и А. Они обладают мощным ростстимулирующим действием. В костной ткани они стимулируют пролиферацию предшественников остеобластов и синтез остеобластами коллагеновых и неколлагеновых белков. Индуцируя митозы и дифференцировку прехондроцитов, соматомедины усиливают хондрогенез, а в клетках, формирующихся энхондральным остеогенезом, стимулируют и его. Ускоряется, кроме того, рост других тканей, в том числе скелетных мышц, внутренних органов и др. К гормонам, контролирующим репродукцию, относятся гонадолиберин гипоталамуса, фоллитропин и лютропин передней дили гипофиза. Гонадолиберин – это декапептид с Mr 1182 Да. В клетках гипоталамуса он синтезируется ограниченным протеолизом из белка-предшественника (92 аминокислотных остатка). Являясь звеном репродуктивной системы организма (рис. 9.1), гонадолиберин стимулирует выделение из гипофиза лютропина и фоллитропина. Реализация его сигналов осуществляется по фосфоинозитидному пути. В свою очередь, его секреция контролируется рядом нейромедиаторов и гормонов, в том числе катехоламинами, эндорфинами, пролактином, андрогенами, эстрогенами. Характер выработки гонадолиберина зависит от типа гонадной оси, отличающейся у мужчин и женщин, сексуальной активности, эмоционального состояния, времени года, освещенности. Фоллитропин и лютропин, секретируемые базофильными клетками аденогипофиза, являются подобно тиреотропину гликопротеинами (Mr 26 кДа). Их молекулы состоят из двух субъединиц. α-субъединицы у них идентичны. Различия β-субъединиц придают каждому из них гормональную специфичность. Оба гормона реализуют свои сигналы по аденилатциклазному пути. Фоллитропин вызывает созревание фолликулов в яичниках у самок и сперматогенез в извитых семенных канальцах яичек у самцов. Лютропин у самок стимулирует секрецию эстрогенов и прогестерона, а также разрыв фолликулов при образовании желтого тела (рис. 9.1). У самцов лютропин усиливает секрецию тестостерона и развитие интерстициальной ткани. Подробнее их эффекты рассматриваются в 9-ой главе. Уже было отмечено, что при распаде проопиомеланотропина образуются β-, γ-липотропины (рис. 2.1). β-липотропин состоит из 91 аминоацила и содержит последовательности γ-липотропина, β-меланотропина, α, β, γ-эндорфинов, метэнкефалина, то есть все они из него могут синтезироваться. К биологическим свойствам β-липотропина относится липомобилизующая активность. реализуемая по аденилатциклазному пути за счет фосфорилирования тканевой липазы. Однако эта его роль невелика. Очевидно, он имеет значение как предшественник выше названных биологически активных молекул и, прежде всего, эндорфинов, энкефалинов. Интерес к ним заключается в необычной способности, подобно морфину, снимать болевые ощущения. Обсуждение биологической роли гипоталамо-гипофизарных гормонов можно завершить изложением патологии, возникающей при поражениях этих эндокринных желез. Врожденные аномалии гипоталамуса могут быть результатом неправильного развития некоторых ядер. При этом нарушается доставка рилизинг-факторов в переднюю долю гипофиза. Доброкачественные опухоли различных клеточных линий гипофиза – самая частая причина его дисфункций. Если опухолью секретируется гормон, выработка которого не поддается воздействию регулирующих факторов, то может возникнуть синдром избытка гормона. Часто это касается пролактина, соматотропина. Гиперпродукция тиреотропина, лютропина, фоллитропина встречается редко. Сдавливание опухолями соседних участков ткани гипофиза, аутоиммунное воспаление, гранулематозная инфильтрация и другие деструктивные процессы нередко являются причинами гипофункции гипофиза. Недостаток тропных гормонов гипофиза ведет к снижению функций периферических желез или проявляется нарушениями метаболизма в тканях и органах. Для диагностики нарушений функций гипофиза производят определение содержания его гормонов в крови. Чаще проводят т. н. парные пробы, когда исследуют поступление в кровь не только стимулирующего гормона, но и гормона железы-мишени. При подозрении на наличие гипофункции точную диагностическую информацию удается получить только с помощью стимуляционного теста. Если предполагается избыток гормонов, прибегают с супрессионным тестам, при выполнении которых подавляют секрецию гипофиза. Магнитно-резонансная томография (МРТ) с гадолинием, компьютерная томография во фронтальной проекции позволяет визуализировать гипофиз и гипоталамус. Иногда аномалии удается выявить на рентгенограммах черепа. Косвенную информацию для диагностики дает исследование полей зрения, которые при этом могут изменяться. Гиперсекреция соматоропина в молодом возрасте проявляется в виде гигантизма. Его главным признаком является пропорционально увеличенные кости и все ткани и органы. Избыточная секреция соматотропина в зрелом возрасте приводит к состоянию, называемому акромегалией. Проявляется она в увеличении выступающих частей лица (носа, подбородка, надбровных дуг) и мягких тканей языка и полости рта. Иногда увеличиваются в размерах отдельные пальцы ног, рук или в целом стоп и кистей. При дефиците соматотропина в молодом организме наблюдается преждевременная остановка роста, ведущая к карликовости (гипофизарный нанизм, от греч. nanos – карлик). Гипосекреция соматотропина может наблюдаться примутациях гена гормона роста, в результате аутоиммунных повреждений клеток гипофиза, радиационном поражении и др. В отличие от карликовости, развивающейся при гипотиреозе, у гипофизарных карликов телосложение остается правильным, отсутствуют признаки умственной отсталости. Карликовость может возникать и как следствие снижения синтеза соматомединов (ИФР-1, ИФР-2) на фоне повышенной выработки соматотропина. Она также может быть результатом нарушений передачи сигналов гормона по тирозинкиназному пути с участием Янус-киназ. При снижении секреции кортикотропина в гипофизе может возникать хронический гипокортицизм. Гипопродукция фоллитропина, лютропина является одной из причин задержки полового созревания, юношеского инфантилизма, проявляющегося задержкой развития гонад, матки, молочных желез, аменореей. К гормонам задней доли гипофиза относятся окситоцин, вазопрессин (антидиуретический гормон, АДГ). Уже было отмечено, что они синтезируются в гипоталамусе в виде больших молекул прогормонов. Последние упаковываются во внутриклеточные гранулы, которые спускаются по аксонам нейронов в нейрогипофиз. Там гормоны ограниченным протеолизом освобождаются и секретируются вновь. Они оба представляют из себя нанопептиды, структура которых включает кольца из шести аминокислотных остатков, образованные при замыкании дисульфидных связей, и боковые цепи из трех аминоацилов (рис. 5.2). Рис. 5.2. Строение молекул вазопрессина и окситоцина. После секреции они циркулируют в виде свободных полипептидов с коротким периодом полураспада (Т1/2 1 – 10 мин). Разрушение гормонов происходит в почках и печени. Окситоцин реализует свои сигналы по фосфоинозитидному пути в тканях-мишенях миометрия и молочных желез. Он стимулирует сокращение гладкомышечных клеток матки при оргазме, в менструальную фазу, при родах. Для усиления родовой деятельности и стимуляции сокращений матки часто вводят окситоцин извне. Секретируясь гипофизом в ответ на сигналы, возникающие при раздражении сосков и околососковых полей, этот гормон стимулирует сокращение миоэпителиальных клеток альвеол лактирующих молочных желез, ускоряя секрецию молока. По некоторым данным окситоцин в жировой ткани обладает инсулиноподобным действием. Он стимулирует поглощение глюкозы адипоцитами, активирует в них липогенез. Вазопрессин человека (нанопептид, Mr 1100 Да, Т1/2 2 – 4 мин), имеющий в 2-ом положении остаток аргинана в отличие от его аналога из гипофиза свиньи, еще называют аргинин-вазопрессин. Такое название связано с тем, что он обладает вазоконстрикторным действием. Кроме того, он способствует формированию каналов для воды в собирательных трубочках почек и обеспечивает ее реабсорбцию. Моча становится концентрированной, а действие характеризуется как антидиуретическое. Выработка вазопрессина как антидиуретического гормона регулируется через баро- и осморецепторы. Его высвобождение из секреторных гранул нейрогипофиза усиливают стрессовые реакции, состояние тревоги, боль и др. факторы, хотя механизм этой стимуляции не до конца выяснен. В клетках-мишенях вазопрессин стимулирует свои сигналы через мембранные V1a-, V1b- и V2-рецепторы. Вазоконстрикторные действия АДГ опосредуются V1a-рецепторами, расположенными в плазматических мембранах гладкомышечных клеток стенок сосудов. Сигналы реализуются по фосфоинозитидному пути через активирование протеинкиназы С и увеличение уровня Са2+, что обеспечивает сокращение гладкомышечных клеток (см. рис. 4.10). Через V1a-рецепторы вазопрессин в печени стимулирует гликогенолиз. Связываясь с V1a-рецепторами в тромбоцитах, он активирует их агрегацию. V1b-рецепторы участвуют в аденогипофизе в модуляции вазопрессином секреции пролактина, кортикотропина, β-эндорфина. Антидиуретическое действие вазопрессина через V2-рецепторы в клетках дистальных извитых канальцев почек рассмотрено в главе 7 (стр. ). Щитовидная железа секретирует две группы гормонов с различным влиянием на обмен веществ. Йодтиронины (Т3, Т4 см. рис. 2.3) вырабатываются эпителиальными клетками стенок фолликулов (рис. 2.4), регулируют энергетический обмен и влияют на деление и дифференцировку клеток тканей и органов. Кальцитонин (белок с Mr 30 кДа), синтезирующийся в светлых клетках, регулирует фосфорно-кальциевый обмен и рассматривается в главе 8 (стр. ). Выделение йодтиронинов щитовидной железой регулируется тиреотропином аденогипофиза. На выработку последнего влияет тиреолиберин гипоталамуса. А их образование регулируется тиреоидными гормонами по принципу отрицательной обратной связи (см. рис. 3.1). Передавая свою информацию по внутриклеточно-ядерному механизму, тиреоидные гормоны реализуют сигналы через рецепторы, локализованные на ДНК и исполняющие роль факторов транскрипции. Известно не менее трех их подтипов: α1, α2, β. Рецепторы подтипа α1 выявлены преимущественно в ЦНС, α2 – в печени, почках, подтипа β – во многих тканях и органах. Функции йодсодержащих гормонов многочисленны. Влияние на геном проявляется в ускорении репликации ДНК в период митоза клеток, в избирательной активности транскрипции определенных генов. Йодтиронины в различных тканях и органах стимулируют биосинтез более 100 различных ферментов. Большинство из них имеют отношение к энергетическому обмену в аэробных условиях (ферменты цитратного цикла, цепи переноса электронов и др.). Поглощение кислорода тканями под действием йодтиронинов возрастает. В конечном итоге это способствует повышению генерирования АТФ окислительным фосфорилированием. При этом йодтиронины увеличивают не только валовую продукцию энергии в митохондриях, но и теплообразование. Избыточные количества АТФ тратятся на различные синтетические процессы в тканях и обеспечение активного транспорта многих веществ. В качестве примера можно указать на всасывание моносахаридов (глюкоза, галактоза), аминокислот как продуктов переваривания углеводов, белков в энтероциты в тонком кишечнике или реабсорбцию их в клетки почечных канальцев при формировании мочи. Эти процессы осуществляются вторично активным транспортом с участием Na+, K+ АТФ-азы – мощного потребителя АТФ. Известно, что в организме этот фермент использует в разных тканях от 20 до 45% всего образующегося АТФ. Йодтиронины являются мощным стимулятором его биосинтеза. С целью обеспечения потребностей в больших количествах АТФ йодтиронины способствуют массивной мобилизации энергетических ресурсов. Одним из ферментов, транскрипцию гена которого усиливает Т3, является аденилатциклаза, способствующая увеличению в клетках тканей уровня 3', 5' цАМФ. В итоге активируются липолиз в жировой ткани, гликогенолиз в печени и мышцах. Интенсивное сгорание метаболитов липидного и углеводного обменов успешно обеспечивает субстратами работу ЦПЭ, где образуется АТФ окислительным фосфорилированием. Все это объясняет наблюдаемое повышение йодтиронинами в печени и жировой ткани чувствительности клеток к действию адреналина. На данном этапе эффекты этих гормонов совпадают. Влияя на обмен холестерола, тиреоидные гормоны усиливают его биосинтез в печени, но в еще большей мере они способствуют окислению его боковой цепи, а также превращение в желчные кислоты. Они усиливают выведение его самого, а также продуктов катаболизма с желчью, фекалиями из организма и способствует снижению холестерола в крови (норма общего холестерола в сыворотке крови 3,5 – 6,5 ммоль/л). В скелетных мышцах Т3 стимулирует биосинтез белков и увеличивает мышечную массу. А общий анаболический эффект объясняет наблюдающийся положительный азотистый баланс, под действием йодтиронинов. В костной ткани эти гормоны увеличивают биосинтез остеобластами остеокальцина и в большей мере остеопонтина. Остеокальцин является белком, участвующим в инициации минерализации, а в комплексе с Са2+ выступает в роли факторов хемотаксиса для остеокластов и их предшественников моноцитов. Остеопонтин обеспечивает адгезию клеток костной ткани с гидроксиапатитами – главным минеральным компонентом, заполняющим внеклеточный матрикс и комплексирование последних с коллагеновыми белками I типа. Перечисленные молекулярные процессы, запускаемые йодтиронинами, а именно, пролиферация клеток, их рост, дифференцировка стимулируют развитие эмбриона. В растущем организме это проявляется в правильном развитии тканей и органов, поддерживается в нормальном состоянии у взрослых благодаря тиреоидным гормонам. Указанные эффекты совпадают с таковыми у соматотропина. Если учесть, что Т3 усиливает в аденогипофизе транскрипцию гена гормона роста, а следовательно, и его биосинтез, то их синергизм становится вполне очевидным. Оценка функционального состояния щитовидной железы проводится по многим параметрам. К ним относятся измерения содержания Т3, Т4 радиуиммунологическим анализом, исследование поглощения радиоактивного йода (123I или 131I) щитовидной железой, сканирование ее при помощи изотопов технеция (99mТс) с целью выявления дефектов паренхимы органа. Проводят тесты выявления антител к рецепторам тиреотропина с целью выявления иммуноглобулинов, изменяющих функциональную активность щитовидной железы. Отсутствие каких-либо отклонений в ее функции называется эутиреоидия. Избыточность эффектов йодтиронинов – пертиреоз. Недостаточность эндокринной функции железы называют гипотиреозом. Последний бывает врожденным, выявляемым по уровню тиреотропина на пятый день жизни, ювенильным (приобретенным), чаще встречающимся у девочек и гипотиреозом у взрослых. Ювенильный гипотиреоз может быть следствием аутоиммунного поражения щитовидной железы. У взрослых частой причиной гипотиреоза бывает хронический тиреоидит, но он может возникать и при поражениях гипоталамуса или гипофиза. Врожденная гипофункция щитовидной железы или возникающая в раннем возрасте приводит к кретинизму. Он характеризуется выраженной физической и умственной отсталостью. Больные имеют карликовый рост, непропорциональное телосложение. Крайняя умственная отсталость делает их профнепригодными ко всему. Проявлением гипотиреоза у взрослых является микседема (слизистый отек, от греч. myxa – слизь, oedema – отек). Отечность обусловлена избыточным накоплением воды и гликозаминогликанов (гиалуроновая кислота, хондроитинсульфаты) во внеклеточном матриксе подкожной клетчатки. Избыток гликозаминогликанов связывает ионы натрия, что приводит к задержке воды. У таких больных снижен основной обмен, температура тела, объем мышц. Ухудшается память, появляется вялость, сонливость. Кожа становится сухой, приобретает землистый оттенок, волосы теряют блеск. Нарушения метаболизма характеризуются замедлением всех энергогенерирующих процессов (липолиз, аэробный распад глюкозы, цитратный цикл, цепь переноса электролитов и др.). Снижается теплопродукция. Гипотиреоз может возникать при дефиците йода в организме в местностях с недостаточным содержанием его в воде, почве, растениях – эндемический зоб. Затрудняется биосинтез и поступление йодтиронинов в кровь. По механизму отрицательной обратной связи усиливается выработка тиреотропина в аденогипофизе. Избыток последнего стимулирует увеличение массы щитовидной железы. В ней преимущественно разрастается соединительная ткань. Секреция Т3, Т4 при этом не повышается. Болезнь не приводит к серьезным метаболическим нарушениям. Однако увеличенная в размерах щитовидная железа, механически воздействующая на окружающие ткани, является причиной определенных неудобств и жалоб больных. Профилактика и лечение этого заболевания состоит в обогащении продуктов питания, например поваренной соли, неорганическим йодом. Разработаны различные биологически активные добавки (БАД), содержащие йод (йод-актив, йодомарин и др.). По показаниям проводят хирургическое лечение. При лечении разных форм гипотиреоза прибегают и к заместительной терапии, когда вводят гормональные препараты извне. При гиперфункции щитовидной железы наблюдается избыточная секреция йодтиронинов, превышающая норму в 2 – 5 раз. Такие нарушения получили название тиреотоксикоза, поскольку все метаболические слвиги при этом связаны как бы с интоксикацией организма йодтиронинами. Это заболевание еще называют диффузный токсический зоб, а с учетом истории и этиологических факторов – болезнь Грейва или Базедова болезнь. Болезнь Грейва как вариант тиреотоксикоза – аутоиммунное заболевание, при котором образуются иммуноглобулины, способные имитировать функцию тиреотропина. Нарабатываясь в возрастающих количествах, они бесконтрольно стимулируют образование йодтиронинов, способствуя диффузному увеличению железы. Характерными признаками тиреотоксикоза являются ускоренный распад углеводов и триацилглицеролов, потеря в весе, незначительное повышение температуры тела (субфебрильная температура) из-за усиленного теплообразования, потливость, экзофтальм (пуеглазие), тахикардия, повышенная нервная возбудимость. Чрезмерно большие количества йодтиронинов ускоряют катаболизм белков, что подтверждается отрицательным азотистым балансом. Образование йодтиронина при этом снижено, так как возрастающие количества йодтиронинов по механизму отрицательной обратной связи это подавляют. Узелковые образования в щитовидной железе, выявляемые при ее сканировании, могут оказаться карциномами, аденомами, кистами, ограниченными участками хронического тиреоидита, коллоидными узелками, геморрагической некротической тканью. Метаболические нарушения в организме при этом могут на определенных этапах не возникать. Задание 5.1. 1. Составьте таблицу с графиками: номенклатура гормонов гипоталамуса, гипофиза, их биологическая активность. 2. Обсудите механизм действия пролактина на метаболические процессы в грудных железах в период беременности и во время лактации. 3. Укажите на отличие молекул соматостатина, синтезирующихся в гипоталамусе, в D (S)-клетках щитовидной железы. 4. Дайте характеристику прямому и опосредованному действию соматотропина на метаболические процессы. 5. Назовите эффекты, вызываемые вазопрессином через V1a-, V1b- и V2рецепторы. 6. Обсудите изменения метаболических процессов при гипо- и гипертиреозе. 7. Перечислите методы, используемые для оценки функционального состояния щитовидной железы. 8. Ответьте на вопросы: Чем отличаются биологические эффекты пролактостатина от пролактолиберина? Остатки каких редко встречающихся аминокислот входят в тиреолиберин? В чем состоит превышение спектра биологической активности пролактина по сравнению с тем, что отражен в названии? Чем отличается ранняя и поздняя фазы действия соматотропина на метаболические процессы? Как образуются эндорфины, энкефалины? В чем отличие гигантизма от акромегалии? Какими эффектами обладает окситоцин? Какие гормоны синтезируются в щитовидной железе? Как влияют йодтиронины на обмен углеводов, липидов, белков? В чем заключается действие тиреоидных гормонов на метаболические процессы в костной ткани? Что приводит к возникновению эндемического зоба? Что такое тиреотоксикоз? Задание 5.2. Решите тесты: Гормоны по химической природе представляют из себя: 1. Тиреотропин, фоллитропин А. Сложные белки гликопротеины 2. Соматолиберин, соматостатин Б. Простые белки 3. Окситоцин, вазопрессин В. Полипептиды 4. Трийодтиронин, тироксин Г. Олигопептиды 5. Соматотропин, пролактин Д. Производные аминокислот Либерины: А. Реализуют свои сигналы в аденогипофизе Б. Являются пептидами по химическому строению В. Стимулируют выработку β, γ-липотропинов Г. Взаимодействуют с мембранными рецепторами Д. Образуются в задней доле гипофиза Следующим заболеваниям характерно: 1. Микседема А. Увеличение массы щитовидной 2. Эндемический зоб железы за счет разрастания 3. Болезнь Грейвса соединительной ткани 4. Кретинизм Б. Крайняя умственная отсталость и профнепригодность ко всему В. Снижение основного обмена, ухудшение памяти, вялость, сонливость, накопление воды и протеогликанов в подкожной клетчатке Г. Является следствием образования и иммуноглобулинов, имитирующих действие тиреотропина Симптомы тиреотоксикоза: А. Снижение аппетита Б. Экзофтальм В. Потеря в весе Г. Умственная отсталость Д. Тахикардия Оцените достоверность утвекрждений в каждом предложении и связь между ними: Меланотропины стимулируют биосинтез меланинов в меланоцитах, потому что они обладают липомобилизирующим действием в жировой ткани. Задание 5.3. Решите задачу: Мужчина 43 лет был вынужден обратиться за медицинской помощью из-за происшедших у него изменений. Он стал отмечать у себя снижение памяти, умственных способностей, сонливость. Его стало преследовать постоянное чувство озноба. Изменился и его внешний вид. Появилась сухость кожи и она приобрела землистый цвет. Волосы стали грубыми и потерявшими блеск. Назовите причину данной патологии. 6. Гормоны поджелудочной железы, надпочечников В поджелудочной железе выделяют ацинарную (экзокринную) и инкреторную ткани. Вторая представлена совокупностью островков Лангерганса (около 1 миллиона). Они составляют только 2 – 3% массы железы. При этом объем крови, доставляемый к ним, в 5 – 10 раз превышает кровоснабжение экзокринной ткани. Гормоны, вырабатываемые в эндокринном отделе (см. табл. 6.1), через панкреатическую вену и v.portae попадают в печень, где проявляются многие их эффекты. Поступая затем в печеночную вену, они оказываются в большом круге кровообращения и добавляются в другие ткани-мишени. Островки Лангерганса содержат четыре типа клеток, каждый из которых вырабатывает свои гормоны. Клетки А-типа (α-клетки) секретируют глюкагон, В-типа (β-клетки) выделяют инсулин, D-типа (δ-клетки) синтезируют панкреатический соматостатин, F (ƒ)-клетки нарабатывают панкреатический полипептид. Инсулин синтезируется на рибосомах ШЭР β-клеток в виде препроинсулина (104 АМК остатка, Mr 11,5 кДа), который содержит сигнальный пептид (20 аминоацилов). Этот пептид направляет полипептидную цепь внутрь эндоплазматического ретикулума, где после его отщепления и замыкания трех дисульфидных матинов образуется проинсулин с 84 аминокислотными остатками в своем составе (рис. 6.1). Рис. 6.1. Схема строения молекулы препроинсулина, проинсулина, инсулина. Показано последовательное превращение предшественников в инсулин (имеет две межпочечные –S-S-связи и одну внутри А-цепи). Цифрами в кружочках показаны количества АМК остатков в фрагментах полипептидной цепи. Последний поступает в комплекс Гольджи и депонируется в клеточных везикулах – β-гранулах. В этих гранулах от проинсулина отщепляется Сполипептид (33 АМК остатка) и образуется зрелый инсулин. Молекула инсулина состоит из 51 аминоацила, образующих две полипептидные цепи (А-цепь из 21 аминокислотного остатка и В-цепь с 30-ю остатками), соединенных двумя полипептидными связями. Кроме того, в А-цепи есть еще один внутрицепочечный дисульфидный мостик (рис. 6.1). В гранулах инсулин сохраняется в форме мономеров, димеров, гексамеров. Гексамерная структура его стабилизируется двумя ионами цинка (рис. 6.2.), которые связываются с остатками гистидина (№ 10) β-цепей. Здесь же аккумулируется и С-полипептид. Рис. 6.2. Условная схема гексамера зрелого инсулина с двумя ионами цинка. Таблица 6.1. Гормоны, вырабатываемые клетками островков Лангерганса поджелудочной железы Тип Количество Название Основные эффекты клеток Клеток в гормона островках Лангерганса в% А (α) ≈15 Глюкагон В печени (гепатоциты) стимулирует гликогенолиз, глюконеогенез, кетогенез. В жировой ткани (адипоциты) ускоряет липолиз. В (β) ≈70 Инсулин Регулирует обмен углеводов, липидов, белков (см. табл. 6.2). D (δ) ≈10 Панкреатический Подавляет выработку других гормонов Соматостатин поджелудочной железы, контролирует некоторые процессы в работе пищеварительного тракта. F (ƒ) ≈5 Панкреатический Стимулирует желудочно-кишечную и полипептид панкреатическую секрецию ферментов. Тормозит перистальтику кишечника и расслабляет желчный пузырь. Влияет на содержание гликогена в печени. Выделение инсулина и С-полипептидов из гранул осуществляется методом экзоцитоза. Скорость секреции зависит от глюкозо-сенсорной функции β-клеток островков Лангерганса. Поступая из крови в эти клетки с участием Глют-2, глюкоза фосфорилируется глюкокиназой в глюкозо-6-фосфат. Повышение ее концентрации и катаболизм приводит к стимуляции биосинтеза АТФ. В результате АТФ-зависимых К+-каналы закрываются, 2+ + 2+ потенциалзависимые Са -каналы открываются. К и Са инициируют слияние β-гранул с плазматическими мембранами и выделение инсулина во внеклеточный матрикс (рис. 6.3). Рис. 6.3. Схема стимуляции глюкозой секреции инсулина β-клетками островков Лангерганса поджелудочной железы. И – инсулин, ВКМ – внеклеточный матрикс. Выработку инсулина стимулирует адреналин через β 2-рецепторы. В высоких концентрациях такими же эффектами обладают глюкокортикоиды, эстрогены, соматотропин. Через α2-рецепторы адреналин подавляет секрецию инсулина (см. рис. 6.4). В крови олигомеры инсулина распадаются. Период его 1 полусуществования в ней (Т /2) составляет 6 – 10 минут, однако продолжительность действия в тканях-мишенях может быть значительно больше. Т1/2 С-полипептида равняется 30 – 40 минутам. Катаболизм инсулина происходит в печени и частично в почках после восстановления в нем остатков цистеина. Это происходит под действием фермента инсулинпротеиназы (инсулиназы). В кровеносном русле инсулин циркулирует в свободном или связанном с белками состоянии. Во втором случае он выявляется в βглобулиновой фракции плазмы. Свободный инсулин влияет на метаболизм всех инсулинчувствительных тканей, а связанный только на жировую. К инсулинзависимым тканям относят печень, скелетные мышцы, соединительную ткань, включая жировую. Не зависят от инсулина метаболические процессы в нервной ткани, эритроцитах. Рецепторы инсулина в клетках-мишенях обладают аутотирозинкиназной активностью (рис. 4.1, 4.12). После взаимодействия с гормоном он инициирует передачу сигналов по Ras-пути, подробно рассмотренному в главе 4 (стр. ). Вместе с тем, существует предположение о множественности механизмов действия инсулина с учетом того, что он регулирует разные, порой не связанные друг с другом, процессы. Общая оценка эффектов инсулина может быть краткой: он усиливает анаболизм и угнетает катаболизм (см. табл. 6.2). Инсулин – главный регулятор гомеостаза глюкозы. Он также играет важную роль в регуляции обмена липидов и белков. Таблица 6.2. Основные эффекты инсулина в тканях-мишенях Ткани Анаболические Катаболические и органы \ Эффекты Печень Стимулирует биосинтез гликогена Тормозит распад гликогена (гликогеногенез) (гликогенолиз), глюконеогенез, кетогенез Жировая ткань Стимулирует поступление глюкозы Тормозит мобилизацию из крови в адипоциты триацилглицеролов (липолиз) Стимулирует биосинтез жирных кислот и триацилглицеролов (липогенез) Скелетные мышцы Стимулирует поступление в клетки Тормозит тканевой глюкозы, аминокислот протеолиз и освобождение Стимулирует биосинтез гликогена аминокислот (гликогеногенез) и белков (протеиногенез) Более подробное обсуждение эффектов инсулина стоит начать с его участия в регуляции углеводного обмена. В фокусе регуляции этого обмена находится содержание глюкозы в плазме крови. В норме оно составляет 3,3 – 5,5 ммоль/л. Величина менее 3,3 ммоль/л оценивается как гипоглюкоземия, а превышающая 5,5 ммоль/л свидетельствует о гиперглюкоземии. Почечный порог глюкозы в крови составляет 8 – 10 ммоль/л, при превышении которого она может обнаруживаться в моче (глюкозурия). Поддержание глюкозы в крови на нормальном уровне зависит от соотношения процессов ее поступления и удаления. В случае гипоглюкоземии многие гормоны-регуляторы углеводного обмена (адреналин, глюкагон, кортизол, йодтиронины и др.) стимулируют первые и тормозят вторые (рис. 6.4). В этом состоит их гипергликемизирующее действие. Содержание глюкозы в клетках тканей и органов значительно ниже, чем в плазме крови. Следовательно, удаление ее в них идет диффузией в направлении падения градиента концентрации. Оно осуществляется с участием белковпереносчиков и называется облегченной диффузией. В клетках печени и головного мозга скорость этого транспорта регулируется уровнем глюкозы в крови (рис. 6.4). В мышцах и жировой ткани облегченная диффузия глюкозы ускоряется инсулином (рис. 6.4). Гормон осуществляет свой контроль путем включения «в работу» специальных белковпереносчиков. Их еще называют глюкозные транспортеры (Глют). В различных тканях и органах обнаружено пять видов глюкозных транспортеров (табл. 6.3). Все они имеют сходное строение и получают номера (1 – 5) по мере их открытия. В каждом из них выделяют по несколько доменов. Эти белки способны располагаться в мембранах, пересекая их несколько раз. Инсулинзависимыми являются лишь Глют-4, обнаруженные в адипоцитах, миоцитах и кардиомиоцитах (см. табл. 4.4, 6.3). В отсутствие инсулина они находятся в специальных гранулах (рис. 4.13). При поступлении сигнала гормона последние перемещаются к плазматическим мембранам и сливаются с ними. При этом происходит встраивание белков-транспортеров в мембраны. Далее экстрацеллюлярные домены Глют-4 связывают глюкозу. Последующие их конформационные изменения обеспечивают перемещение глюкозы к их интрацеллюлярным доменам, а затем и ее освобождение внутрь клеток. В случае прекращения передачи инсулинового сигнала Глют-4 возврвщаются в гранулы цитоплпзмы и поступление глюкозы в клетки-мишени приостанавливается. Таблица 6.3. Эффекты инсулина на транспортные системы глюкозы (Глют) в клетках различных тканей Ткани Белки-транспортеры глюкозы Эффект инсулина на (Глют) транспорт глюкозы Головной мозг и другие Глют-1, 3 0 отделы нервной системы Печень (гепатоциты) Глют-2 0 Эритроциты Глют-1 0 Жировая ткань Глют-4 + (адипоциты) Мышцы, сердечная мышца (миоциты, кардиомиоциты) Глют-4 + Хотя инсулин напрямую не влияет на диффузию глюкозы в клетки печени, он делает это опосредованно. Реализуя свои сигналы в гепатоцитах, гормон активирует гексокиназу и способствует ингибированию глюкозо-6фосфатазы (рис. 6.5). Количество свободной глюкозы в печени снижается, диффузия ее сюда из крови ускоряется. Следует отметить, что инсулин стимулирует все процессы утилизации глюкозы в клетках тканей (рис. 6.4), влияя на их ферменты (рис. 6.5): а) Активирует гликонеогенез в печени, почках, мышцах. б) Активирует дихотомический путь распада глюкозы до CO2 и H2O с извлечением энергии в различных тканях и органах. в) Активирует пентозофосфатный путь распада глюкозы с образованием НАДФ·Н + Н+, используемого для ряда синтезов, в том числе и жирных кислот, холестерола (многие ткани и органы). г) Активирует липогенез в жировой ткани, печени. д) Активирует протеиногенез в скелетных мышцах, сердце, печени. Напротив, инсулин подавляет процессы, способствующие образованию свободной глюкозы и ее поступлению в кровь (рис. 6.4, 6.5): а) Задерживает распад гликогена в печени, почках. б) Замедляет реакции глюконеогенеза в этих органах. В результате инсулин снижает уровень глюкозы в крови до нормальных величин (гипогликемизирующий эффект). Рис. 6.4. Процессы, обеспечивающие поступление глюкозы в кровь (слева). Процессы, способствующие ее удалению из крови и последующему использованию в тканях (справа). + Активизирующее влияние гормонов − Тормозящее действие гормонов Внутриклеточные эффекты инсулина, стимулирующие утилизацию глюкозы, реализуются по Ras-пути (рис. 4.12) и проявляются изменениями активности различных доменов. Его сигналы могут привести к их активированию или ингибированию, а через факторы транскрипции индуцировать или репрессировать биосинтез многих мРНК и ферментов (рис. 6.5). Рис. 6.5. Способы регуляции инсулином активности ферментов углеводного и липидного обменов. Относительно липидного обмена следует отметить, что эффекты инсулина здесь в большинстве своем противоположны действиям других гормонов-регуляторов. Стимулируемое инсулином поглощение глюкозы адипоцитами (рис. 4.13) способствует превращению ее в ТАГ. При этом он ускоряет и биосинтез жирных кислот – субстратов липогенеза и обеспечивает за счет индукции синтеза ферментов гликолиза образование ДАФ, превращающегося в глицерол-3-фосфат (рис. 6.5). Повышение скорости биосинтеза жирных кислот достигается стимуляцией «работы» цитратного челночного механизма, транспортирующего ацетил-КоА из матрикса митохондрий в цитозоль. Он активирует и ферменты – участники этого механизма цитратсинтазу и малатдегидрогеназу, декарбоксилирующую «малик-фермент». Кроме того, инсулин индуцирует биосинтез пальмитатсинтазы I и способствует активированию ацетил-КоАкарбоксилазы (рис. 6.5), нарабатывающей малонилы-КоА. Дефосфорилированная форма этого фермента активна. Инсулин способствует количественному преобладанию этой формы двумя путями. С одной стороны он активирует фосфодиэстеразу, снижая уровень 3', 5' цАМФ (рис. 4.12), с другой стороны стимулирует функцию протеинфосфатазы (рис. 6.5). Повышая уровень малонилов-КоА – аллостерических ингибиторов ацилкарнитин-трансферазы I, инсулин подавляет β-окисление жирных кислот. Он также замедляет распад триацилглицеролов (липолиз) в адипоцитах и др. клетках за счет репрессии синтеза тканевой липазы или ускоряя ее дефосфорилирование (механизм здесь тот же, что и выше рассмотренный для ацетил-КоА-карбоксилазы, хотя результат противоположный – дефосфорилированная липаза неактивна). Снижение скорости биосинтеза кетоновых тел (кетогенеза) в гепатоцитах, как один из эффектов инсулина, наблюдается в связи с дефицитом ацетилов-КоА – субстратов этого процесса. Гормон достигает этой цели, замедляя β-окисление жирных кислот (см. выше), ускоряя реакции цитратного цикла (рис. 6.5), усиливая биосинтез жирных кислот (см. выше). Активирнуя ГМГ-КоА-редуктазу, инсулин в стероидогенных тканях усиливает биосинтез холестерола – субстрата гормонов, желчных кислот, витамина D3. Инсулин оказывает анаболическое действие, влияя на белковый обмен. В мышцах он стимулирует поступление в клетки нейтральных аминокислот – субстратов биосинтеза белков и этим активируют протеиногенез (рис. 6.3, 6.4). Кроме того, инсулин стимулирует сборку рибосом и их участие в трансляции. Долговременные его эффекты связаны с усилением синтеза ДНК, РНК и митотической активности клеток инсулинзависимых тканей. При недостаточности инсулина в организме или при отсутствии ответов на его сигналы в тканях-мишенях возникает сахарный диабет. Примерно у 10% больных развивается инсулинозависимый диабет I типа. У 90% болеющих развивается инсулиннезависимы диабет II типа. По заключению экспертов Всемирной организации здравоохранения (1981) сахарный диабет – синдром хронической гиперглюкоземии, развивающейся вследствие абсолютного или относительного дефицита инсулина и проявляющейся глюкозурией (появление глюкозы в моче), полиурией (увеличение суточного количества мочи), полидипсией (жажда), нарушениями липидного, белкового и минерального обменов и развитием характерных осложнений (острых и хронических). Инсулин играет важную роль и как гормон, и как медикаментозное средство, поскольку ≈5% людей болеют сахарным диабетом и ≈5% к нему предрасположены. Причинами инсулинзависимого диабета могут быть: вирусные поражения поджелудочной железы, образование антител к инсулину, которые его связывают, генетические дефекты системы синтеза этого гормона, усиление расщепления инсулина в печени инсулиназой. У больного инсулиннезависимым сахарным диабетом синтез этого гормона не нарушен, но ткани-мишени не реагируют ни на свой, ни на введенный извне в виде инъекций инсулин. В основе развития этого диабета лежат: снижение количества или биосинтез мутантных рецепторов; образование антител к этим рецепторам; генетические дефекты белков – участников реализации инсулиновых сигналов по Ras-пути, в том числе Глют-4. Лечение больных со второй формой диабета инсулином оказывается малоэффективным. Ранние симптомы заболевания связаны с дефицитом функции инсулина. Гиперглюкоземия, глюкозурия возникают в связи со снижением утилизации глюкозы в инсулинчувствительных тканях. Это вызывает преобладание эффектов контринсулярных гормонов (глюкагон, адреналин, кортикотропин, кортизол и др.). Они стимулируют распад гликогена в печени, почках с поставкой глюкозы «на экспорт» в кровь. Из-за ускорения липолиза в адипоцитах в крови повышено содержание жирных кислот и глицерола и поступление их в печень. Кетонемия, кетонурия возникают в связи с усилением контринсулярными гормонами β-окисления жирных кислот в гепатоцитах использования ацетилов-КоА для кетогенеза. В норме их (ацетоацетат, 3гидроксибутират) содержание в плазме крови составляет 0,1 – 0,6 ммоль/л, при диабете может достигать 20 ммоль/л. В этом случае в дополнение к вышеназванным веществам появляется ацетон. Полиурия, полидипсия. Первая появляется в связи с увеличением жидкости в крови. Повышение уровня глюкозы в крови стимулирует в связи с повышением осмотического давления выход воды из тканей и выведение ее из организма. Потеря жидкости является причиной полидипсии (жажды). Гипокалиемия возникает в связи с потерей К+, Cl¯ с мочой. Назначают прием KCl. Полифагия (повышение аппетита) связана с дефицитом глюкозы в клетках тканей на фоне ее избытка в крови («голод среди изобилия»). Гипераминацидемия, гипераммониемия, азотемия – следствие ускорения распада белков в тканях. Из-за избытка субстратов (аминокислоты) в печени и почках усилен глюконеогенез. Это еще одна из причин гиперглюкоземии. При истощении резервов буферных систем крови (рН в норме – 7,36 – 7,44) может возникнуть кетоацидоз, приводящий к кетоацидотической (гиперглюкоземической) коме. Поздние осложнения сахарного диабета связаны в основном с повышением уровня глюкозы в крови и неферментативным гликозилированием белков. Гликозилируются белки плазмы крови (липопротеины, гемоглобин и др.), внеклеточного матрикса стенок сосудов (коллаген, эластин и др.), базадьных мембран (коллаген и др.). Белки становятся функционально неполноценными. Базальные мембраны утолщаются, эластичность артерий утрачивается. В почках, сетчатке глаза это проявляется нефро- и ретинопатией. При поражении периферических сосудов конечностей возникают трофические язвы, трудно поддающиеся лечению. Этому же способствует лизилирование гемоглобина, сопровождаемое гипоксией. Взаимодействие с глюкозой липопротеинов (ЛНП), богатых холестеролом, затрудняет их метаболизм в эндотелтоцитах и может инициировать развитие атеросклероза или отягощать его течение, если он до этого уже был. Причиной поздних осложнений сахарного диабета является повышение скорости превращения глюкозы в условиях ее избытка в сорбитол (рис. 6.6). Рис. 6.6. Реакция превращения глюкозы в сорбитол. Сорбитол плохо проходит через плазматические мембраны и накапливается в клетках (шванновские в нервной ткани, эритроциты, семенники, сетчатка, хрусталик и т. д.). Наблюдается осмотическое набухание клеток. В результате появляются диабетический полиневрит, катаракта хрусталиков с ухудшением зрения. Неспецифическими проявлениями сахарного диабета являются кожный зуд, ослабление регенерации, из-за чего часто возникают дерматиты, гнойные осложнения ран, фурункулы, карбункулы, гингивиты, стоматиты, пародонтиты. При длительном безуспешном лечении воспалительных заболеваний полости рта стоматолог может предположить существование сахарного диабета, который порой развивается исподволь. Глюкагон как один из контринсулярных гормонов секретируется αклетками островков Лангерганса поджелудочной железы в ответ на снижение уровня глюкозы в крови. Вначале синтезируется проглюкагон, состоящий из 160 аминокислот. В ходе посттрансляционного созревания ограниченным протеолизом освобождается активный пептид глюкагон из 29 аминокислотных остатков (Mr ≈ 3,5 кДа). В крови гормон циркулирует в свободном состоянии, где его время полужизни составляет 3 – 5 минут, инактивация происходит в печени. Его клетками-мишенями являются гепатоциты и адипоциты (см. табл. 6.1). В мышцах нет рецепторов для глюкагона. Сигналы свои он передает по аденилатциклазному каскадному пути. Его рецепторы, т. н. глюкагонсвязывающие белки, с Gs-белками активируют аденилатциклазу, а образующиеся 3' 5' цАМФ (см. рис. 4.5) активируют соответствующие цАМФзависимые протеинкиназы (рис. 4.7). В печени одновременное фосфорилировние этими протеинкиназами гликогенсинтазы и киназы фосфорилазы, а затем и самой гликогенфосфорилазы, приводит к ускорению распада гликогена и замедлению его биосинтеза. Глюкагону присущи и другие эффекты, приводящие к гиперглюкоземии. Фосфорилирование и инактивирование пируваткиназы, а также бифункционального фермента (БИФ) вызывает торможение гликолиза и активирование глюконеогенеза. Здесь следует подробнее рассмотреть роль БИФ как одного из регуляторов этих процессов. Этот фермент катализирует две взаимно противоположные реакции образования фруктозо-2,6-бисфосфата и его дефосфорилирования. Киназная активность БИФ проявляется в его дефосфорилированном состоянии (БИФ-ОН), фосфатазная, напротив, в фосфорилированном (БИФОРО32-). Отсюда его название (рис. 6.7). Рис. 6.7. Схема проявления двойственной активности бифункциональным ферментом (БИФ) в печени. Что же касается фруктозо-2,6-бисфосфата, что он является аллостерическим активатором фосфофруктокиназы – фермента гликолиза и ингибитором фруктозо-1,6-бисфосфатазы, катализирующей соответствующую реакцию глюконеогенеза (рис. 6.8). Рис. 6.8. Схема, отражающая роль фруктозо-2,6-бисфосфата как аллостерического модулятора ферментов гликолиза (активатор фосфофруктокиназы) и глюконеогенеза (ингибитор фруктозо-1,6бисфосфатазы). При низком инсулин/глюкагоновом индексе, например, в постадсорбтивном периоде, в условиях преобладания сигнала глюкагона БИФ фосфорилируется и «работает» как фосфатаза. Количество фруктозо-2,6бисфосфата снижается, глюконеогенез ускоряется, гликолиз замедляется, уровень глюкозы в крови повышается. Отметим еще, что инсулин, активирующий протеинфосфатазу и фосфодиэстеразу (см. рис. 4.12), мог бы повысить киназную активность БИФ (рис. 6.7), но его мало. Этот эффект инсулина реализуется при возрастании вышеуказанного индекса. Глюкагон стимулирует глюконеогенез из аминокислот, усиливая также биосинтез его ключевых ферментов фосфоенолпируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы, глюкозо-6-фосфатазы. Это достигается усилением по аденилатциклазному пути фосфорилирования соответствующих факторов транскрипции. Эффекты глюкагона на липидный обмен можно оценить как катаболические. В адипоцитах он через аденилатциклазный каскад активирует тканевую липазу и стимулирует липолиз. Активируя ацилкарнитинтрансферазу, глюкагон стимулирует βокисление жирных кислот. Образующиеся в избытке ацетилы-КоА усиленно используются для биосинтеза кетоновых тел (ацетоацетат, β-гидроксибутират). Это является важным аспектом нарушений метаболизма при сахарном диабете, поскольку при этом падает инсулин/глюкагоновый индекс. Снижая активность ацетил-КоА-карбоксилазы, глюкагон подавляет биосинтез жирных кислот, а вслед за этим и триацилглицеролов. Этому же способствуют снижение количества глицерол-3-фосфатов и АТФ из-за замедления гликолиза и цитратного цикла. Соматостатин как гормон поджелудочной железы синтезируется в виде огромного прогормона (Mr 11,5 кДа) в D (δ)-клетках островков Лангерганса. Этот предшественник в результате многостадийной посттрансляционной модификации превращается в зрелый гормон, который состоит из 14 аминоацилов (Mr ≈ 1,6 кДа). Действуя паракринно на А(α) – В(β)-клетки островков, соматостатин подавляет выработку инсулина, глюкагона. Ему присущ еще ряд эффектов, проявляющихся на работе желудочно-кишечного тракта: тормозит секрецю гастрина и, как следствие, соляной кислоты в желудке, снижает выработку ферментов в поджелудочной железе, замедляет всасывание моносахаридов в тонком кишечнике. Панкреатический полипептид состоит из 36 аминокислотных остатков (Mr 4,2 кДа). Показано, что он начинает активно секретироваться F(ƒ)-клетками поджелудочной железы при значительных физических нагрузках. Его выработку усиливает голодание или, напротив, прием богатой белками пищи. Гипоглюкоземия стимулирует, а введение глюкозы подавляет его секрецию. Полный спектр эффектов и механизм действия этого гормона до конца не ясны. Показано лишь, что он стимулирует желудочно-кишечную и панкреатическу секркцию ферментов и влияет на содержание гликогена в печени. Кроме того, этот полипептид тормозит перистальтику кишечника и расслабляет желчный пузырь. Надпочечники состоят из двух разных в морфологическом и функциональном отношении слоев: мозгового и коркового. Мозговое вещество является и эндокринным органом, высоко специализированным отделом симпатической нервной системы. Его рассматривают подобно задней доле гипофиза производным нервной ткани. Оно состоит из хромаффинных клеток, также называемых феохромоцитами из-за гистологическиз характеристик, выявляемых при окрашивании. Эти клетки вырабатывают несколько типов катехоламинов, каждый из которых представляет из себя модифицированную молекулу тирозина (рис. 2.2). Собственно гормоном считается адреналин. Накапливаясь в гранулах хромаффинных клеток, адреналин покидает их, преодолевая плазматическую мембрану экзоцитозом. Это происходит при физическом или нервном стрессе благодаря существованию нервно-рефлекторных связей надпочечников. Усиление синтеза и секреции адреналина наблюдается в ответ на болевые и эмоциональные раздражители (страх, сильное волнение), кровотечение, гипоксию, мышечную нагрузку, охлаждение и т. д. По чревному нерву приходят возбуждающие импульсы. В синапсы выбрасывается ацетилхолин. Он связывается с N-холинорецепторами и возникают потенциалы действия. На короткое время в цитоплазме хромаффинных клеток возрастает концентрация Са2+, что служит сигналом как для секреции катехоламинов, так и их дополнительного синтеза. Выработка адреналина не зависит от концентрации глюкозы в крови. Адреналин явлеятся гормоном «тревоги». Его сигналы инициируют метаболические и гемодинамические сдвиги, позволяющие экстренно обеспечить головной мозг, сердце, скелетные мышцы и другие органы достаточным количеством энергетического материала для срочного образования АТФ. Выработка адреналина стимулируется глюкокортикоидами. Высокие их концентрации, доставляемые из коркового вещества по портальной системе сосудов, активируют фермент дигидроксифенилэтаноламин-Nметилтрансферазу, катализирующую непосредственно образование адреналина из норадреналина (рис. 2.2). В крови он циркулирует в комплексе с альбуминами. Его период полужизни в ней (Т1/2) составляет 1 – 3 минуты. Катаболизм катехоламинов рассмотрен в разделе 2 (рис. 2). Клетками-мишенями для адреналина являются клетки скелетных мышц, печени, жировой ткани, сердечно-сосудистой системы. Механизм действия мембранно-цитозольный. Адренэргические рецепторы являются интегральными белками, семь раз пронизывающими плазматические мембраны и сопряженные с G-белками – рецепторы третьего типа (рис. 4.3). Идентифицированы как минимум девять их подтипов – α1A-, α1B-, α1C-, α2A-, α2B-, α2C-, β1-, β2-, β3-адренорецепторы. Точная функция конкретно каждого из них до конца не определена. Все α1-рецепторы «работают» по фосфоинозитидному механизму (табл. 4.3, рис. 4.10). Все α2рецепторы передают сигналы, ингибирующие аденилатциклазу, а все βрецепторы ее активируют (табл. 4.1, рис. 4.7). Установлено также, что через α2Аи α2В-рецепторы передаются сигналы, ингибирующие Са2+-каналы, а через β1рецепторы их активирующие. Показано участие в стимулирующем влиянии на каналы К+-каналы α2А-рецепторов. Катехоламины имеют широкий спектр эффектов в различных тканях и органах. Они воздействуют на гликогенолиз, глюконеогенез, липолиз, существенно влияют на сердечно-сосудистую систему и др. Некоторые из эффектов адреналина, опосредованные различными типами рецепторов (без учета их подтипов), представлены в таблице 6.4. Таблица 6.4. Метаболические и некоторые другие эффекты адреналина, опосредованные α1-, α2-, β1-, β2-рецепторами в тканях- и органах-мишенях Ткани- и органымишени Печень Скелетные мышцы Тип Метаболические и другие эффекты адреналина адренор ецептор ов α1; β2 Стимуляция распада гликогена за счет активирования β2 каскадным путем через аденилатциклазную систему гликогенфосфорилазы. Подавление биосинтеза гликогена, так как по аденилатциклазному пути инактивируется гликогенсинтаза. Усиление катаболизма глюкозы в процессе гликолиза в связи с активированием фосфофруктокиназы. Повышение активности глюконеогенеза в печени за счет активирования 4 ферментов: пируваткарбоксилазы, фосфоенолпируваткарбоксикиназы, фруктозо-1,6бисфосфатазы, глюкозо-6-фосфатазы. В результате адреналин повышает уровень глюкозы в крови. Усиление распада триацилглицеролов при активировании каскадным механизмом тканевой липазы. Активирование реакций β-окисления жирных кислот, в условиях замедления их биосинтеза сигналы от адреналина с участием 3'5'цАМФ-зависимой протеинкиназы «А» способствуют фосфорилированию и инактивированию ацетил-КоА-карбоксилазы. Печень Жировая ткань α1; β2 α1; β2 Скелетные мышцы α1 Аналогично подавляется активность ацетил-КоАкарбоксилазы и снижается биосинтез жирных кислот с помощью Са2+-калмодулинзависимой протеинкиназы «С». Почки β1 Увеличение секреции ренина β-клетки островков Лангерганса поджелудоч ной железы α2 Уменьшение выработки инсулина β2 Увеличение секреции инсулина Кровеносны е сосуды α1 β2 Вазоконстрикция Вазодилатация Легкие β2 Расширение бронхиол Кожа α Увеличение потоотделения Кора надпочечников является местом синтеза трех групп гормонов. В гломерулярном (клубочковом) слое, расположенном субкапсулярно, образуются минералокортикоиды (11-дезоксикортикостерон, альдостерон). Необходимая для синтеза альдостерона 18-монооксигеназа имеется только здесь. В следующих, фасцикулярной (пучковой) и ретикулярной (сетчатой), зонах вырабатываются глюкокортикоиды (кортизол, кортикостерон, кортизон) и гормоны типа андрогенов (дегидроэпиандростерон, андростендион). Стероидные гормоны представляют из себя модифицированные молекулы холестерола. При их многостадийном биосинтезе без изменений остается лишь наличие циклического компонента, включающего четыре (A, B, C, D) кольца (рис. 6.9). Рис. 6.9. Основные этапы биосинтеза минералокортикоидов, глюкокортикоидов и гормонов типа андрогенов в коре надпочечников. 1 - 3βгидроксистероиддегидрогеназаΔ5,4-изомераза. 450С17, 450С21, 450С18, 450С11, 450SCC – ферменты монооксигеназы, обеспечивающие гидроксилирование в 17-м, 18-м, 11-м, 21-м и других положениях. Функциональная активность коры надпочечников контролируется гипоталамо-гипофизарной системой. На ее активность влияет ряд факторов. В особых условиях эта система работает в суточном ритме. Пик ее активности отмечается к 7 – 8 часам утра. Самые низкие уровни кортикотропина и глюкокортикоидов регистрируются, начиная с полуночи и до 4 часов утра. Этот цикл может быть нарушен стрессом. Сигналы из головного мозга при сирессе усиливают выработку гормонов. По принципу обратной отрицательной связи активность гипоталамогипофизарной системы подавляется кортизолом. Воспалительные цитокины, фактор некроза опухолей, интерлейкины усиливают секрецию кортиколиберина с последующим возрастанием выработки кортикотропина и глюкокортикоидов (рис. 6.10). Рис. 6.10. Регуляция функциональной активности гипоталамо-гипофизарнонадпочечниковой системы, контролирующей выработку глюкокортикоидов. Кроме подавления активности гипоталамуса, аденогипофиза кортизолом (отрицательная обратная связь) на их секреторные возможности влияют + другие факторы (суточные ритмы, стресс, воспалительные цитокины). Существовало предположение, что адреногломерулотропин эпифиза регулирует секрецию минералокортикоидов. Показано стимулирующее влияние на выработку альдостерона ангиотензина II, передающего свои сигналы в клетки клубочковой зоны по фосфоинозитидному пути (табл. 4.2). Холестерол, используемый для стероидогенеза, в основном поступает в кору надпочечников из крови в виде эфиров в составе ЛПН и лишь незначительная его часть синтезируется здесь по пути de novo. В цитозоле стероидогенных клеток при участии холестеролэстеразы происходит отщепление жирной кислоты и свободный холестерол поступает в матрикс митохондрий (рис. 6.10). Там под действием ряда ферментов, включая цитохром-Р450SCC-содержащую монооксигеназу, из него образуется прегненолон. Эта стадия стероидогенеза считается лимитирующей. Прегненолон переходит в цитозоль и продолжает многостадийные превращения. В клетках пучковой и сетчатой зон коры надпочечников процесс завершается образованием во внутренней мембране митохондрий кортизола (рис. 6.9, 6.11). Рис. 6.11. Регуляция и компартментализация в клетках пучковой зоны коры надпочечников процесса биосинтеза глюкокортикоидов. 1 – рецептор ЛПН, 2 – белки аденилатциклазной системы, 3 – протеинкиназа А. В клетках клубочкового слоя отсутствует цитохром-Р450С17-зависимая монооксигеназа, но есть митохондриальная С18 монооксигеназа. При ее участии из кортикостерона синтезируется альдостерон (рис. 2.6, 6.9). Основным глюкокортикоидом является кортизол (рис. 2.6, 6.9). На его долю приходится до 80% всей глюкокортикоидной активности. Роль кортизона и кортикостерона (рис. 2.6, 6.9) может считаться незначительной (по 10% у каждого). Секретированный кортизол в крови транспортируется белком транскортином, входящим в α1-глобулиновую фракцию. Время полусуществования кортизола в плазме крови составляет 70 – 90 минут, но длительность биологических эффектов может быть порой больше. Инактивация глюкокортикоидов происходит в печени и рассмотрена в разделе 2 (рис. 2.8). Свои сигналы кортизол и его аналоги передают по внутриклеточноядерному механизму. Он рассмотрен в главе 4 (рис. 4.15). Цитозольные рецепторы к глюкокортикоидам обнаружены практически во всех тканях и органах – печени, почках, лимфоидной ткани (лимфоузлы, селезенка, лимфоидные бляшки кишечника, лимфоциты, тимус и др.), соединительной ткани (костная, жировая и др.), скелетных мышцах и т. д. В разных из них эффекты этих гормонов могут быть прямо противоположными. В печени, почках кортизол усиливает синтез РНК, белков, в остальных тканях и органах подавляет. В лимфоидной ткани происходит распад клеток (лимфоцитолиз). Активный протеолиз в большинстве тканей увеличивает пул свободных аминокислот, поступающих в кровь (рис. 6.12), а затем в печень и почки. Там они являются субстратами для новообразования белков и глюкозы, то есть глюкокортикоиды способствуют передвижению «энергетического материала» из периферических тканей в печень для глюконеогенеза. Последнему благоприятствует стимуляция кортизолом биосинтеза ферментов глюконеогенеза (пируваткарбоксилаза, фосфоенолпируваткарбоксикиназа, фруктозо-1,6-бисфосфатаза, глюкозо-6-фосфатаза), а также тех, которые обеспечивают этот процесс субстратами за счет ускорения деградации аминокислот (сериндегидратаза, треониндегидратаза, аланинаминотрансфераза, тирозинаминотрансфераза, триптофанмонооксигеназа). Содержание глюкозы в крови повышается. Кроме того, кортизол активирует фермент протеинфосфатазу, фосфорилирующий гликогенсинтазу и гликогенфосфорилазу. В результате биосинтез гликогена в печени, почках ускоряется, а распад его замедляется. Повышая образования субстратов для глюконеогенеза из аминокислот в печени, кортизол стимулирует реакции орнитинового цикла синтеза мочевины. В нее включается азот катаболизирующих аминокислот. Уровень мочевины в плазме крови при этом повышается. Она экскретируется с мочой (рис. 6.12). Рис. 6.12. Влияние глюкокортикоидов на метаболизм белков, углеводов. В костной ткани глюкокортикоиды тормозят синтетическую активность остеобластов. Они снижают биосинтез коллагеновых белков, остеонектина и других белков. В результате нарушается процесс ремоделирования костей, может развиться остеопороз. Избыток кортизола уменьшает всасывание кальция в кишечнике за счет подавления биосинтеза Са2+-связывающих белков. Снижение ими протеиногенеза лежит в основе возникающей мышечной слабости и атрофии мышц, плохого заживления ран, истончения кожи, остеопороза, задержки формирования тканей в растущем организме. Иммунодепрессивный эффект глюкокортикоидов является суммарным результатом подавления разных этапов иммуногенеза. Замедление миграции стволовых клеток в лимфоидной ткани приводит к ее инволюции. Они также снижают миграцию В-клеток и взаимодействия Т- и В-лимфоцитов, что уменьшает их количество в периферической крови. Глюкокортикоидам присущ и противовоспалительный эффект. Известно, что любому воспалению в организме можно дать двойственную оценку. Оно одновременно является и защитно-приспособительной реакцией, и может оказаться разрушительным и опасным для жизни процессом. В зоне воспаления происходит гибель клеток. Всасывание продуктов их распада вызывает общую интоксикацию, нарушения различных реакций метаболизма. Глюкокортикоиды, не являясь антибактериальными средствами, уменьшают воспалительные реакции и вызывают положительные сдвиги. Противовоспалительное действие их связывают с усилением биосинтеза белков липокортинов, которые ингибируют фосфорилазу А2 (рис. 1.2). Это приводит к снижению биосинтеза простагландинов, тромбоксанов, лейкотриенов (рис. 1.3), в том числе в эозинофилах тех, что считаются медиаторами воспаления (Pg E2, Tx, Lt). Показано также, что кортизол подавляет выработку лимфоцитами, макрофагами противовоспалительных цитокинов (например, ИЛ-1, ИЛ-6, ФРТ, βТФР, ФНО, γИФ и др.) тормозит хемотаксис и фагоцитирующую активность нейтрофилов, моноцитов. Тенденция к перемещению «энергетическиз материалов» глюкокортикоидами прослеживается и на примере липидного обмена. При их избытке усиливается распад триацилглицеролов в нижних конечностях и усиливается биосинтез в области лица, шеи, верхней части туловища (синдром «бизоньего горба»). Однако механизм подобных изменений в метаболизме липидов еще требует своего объяснения. Существует предположение, что липогенетический эффект может быть связан с выбросом инсулина в кровь в ответ на избыток глюкокортикоидов. А липолиз, возможно, ускоряется под действием адреналина (см. табл. 6.4) и соматотропина (см. табл. 5.1), выработка которых стимулируется глюкокортикоидами (рис. 2.2). Во всяком случае показано, что кортизол повышает концентрацию глицерола и свободных жирных кислот в плазме крови, активирует β-окисление жирных кислот и вовлечение образующихся ацетилов-КоА в кетогенез. Уровень кетоновых тел в плазме крови возрастает (норма 0,1 – 0,6 ммоль/л). Возрастание в крови при избытке глюкокортикоидов содержания глюкозы, аминокислот, жирных кислот, глицерола, кетоновых тел, а также сопутствующая ему глюкозурия, аминацидурия, кетонурия соответствуют изменениям, характерным для сахарного диабета. Однако в этом случае он называется стероидным. Опасность его возникновения, а также остеопороз, подавление иммунитета, замедление процессов регенерации, повышение свертываемости крови, начало ожирения и др. должны учитываться как побочные явления стероидотерапии. А спектр их применения с этой целью широкий. В основе их лечебного действия лежит подавление активности лимфоидной ткани и снижение выработки антител. Уменьшение состояния сенсибилизации к чужеродным веществам и антиаллергическое действие могут считаться широко востребованными. Угнетение кортикостероидными препаратами коллагеногенеза в клетках соединительной ткани препятствует образованию в местах заживления воспаления грубых рубцов, спаек, контрактур. В основе этого лежат подавление активности лимфоидной ткани, снижение выработки антител, уменьшение состояния сенсибилизации к аутоаллергенам и чужеродным веществам. Глюкокортикоиды и их синтетические аналоги (дексаметазон, преднизолон, преднизон и др.) применяют при аллергических, аутоиммунных заболеваниях (коллагенозах, ревматоидных артритах, бронхиальной астме, нейродерматитах, экземе, ревматизме, остром лимфобластном и миелобластном лейкозе, инфекционном мононуклеозе, гломерулонефрите, остром панкреатите, вирусном гепатите и т. д.). Иммунодепрессивное действие глюкокортикоидов позволяет использовать их при трансплантации органов и тканей для подавления реакции отторжения. Глюкокортикоиды участвуют в поддержании уровня глюкозы в крови при хроническом стрессе, когда запасы гликогена в печени, почках истощены и глюконеогенез становится главным источником глюкозы. Нарушения функциональной активности коры надпочечников могут развиваться по типу избыточной или недостаточной секреции гормонов. Различают четыре варианта гиперкортицизма. Первичный – возникает при гиперплазии и гиперфункции собственно клеток коры надпочечников. Вторичный гиперкортицизм является следствием избыточного образования кортиколиберина в гипоталамусе или кортикотропина в аденогипофизе. Эктопический гиперкортицизм возникает при возникновении патологических очагов стимуляции системы гипоталамус-/гипофиз-кора надпочечников. Длительное применение глюкокортикоидов в качестве лекарственных препаратов может осложняться экзогенным гиперкортицизмом. Болезнь Иценко-Кушинга возникает при опухоли передней доли гипофиза или может быть результатом мутации гена GS-белка в клетках аденогипофиза. GS-белок неопределенно долго остается в активированном состоянии и инициирует передачу псевдосигналов кортиколиберина. Гиперкортицизм, возникающий как следствие первичного поражения коркового вещества надпочечников (гормонально активная опухоль, гиперплазия ткани железы под действием адренокортикостимулирующих аутоантител и др.) называют кортикотропин-независимой болезнью ИценкоКушинга или синдромом Иценко-Кушинга. Проявления гиперкортицизма во всех случаях соответствуют биологическим эффектам избытков глюкокортикоидов: остеопороз (пустота в костях из-за задержки ремоделирования в связи с замедлением биосинтеза коллагена, протеогликанов), ожирение в верхней части туловища, признаки стероидного диабета, атрофия подкожной и других участков соединительной ткани, мышечная слабость из-за потери белков мышечной тканью, отрицательный азотистый баланс, гипертония, возникающая вследствие вторичного усиления выработки адреналина. Повышение артериального давления отчасти может быть связано с продукцией альдостерона и также с тем, что все кортикостероиды обладают смешанными эффектами. Например кортизол, будучи глюкокортикоидом, оказывает слабое минералокортикоидное действие, следовательно, он вызывает задержку хлористого натрия и этим в определенной мере способствует развитию гипертонии. Гипокортицизм, часто возникающий в результате аутоаллергической деструкции коры надпочечников, называют бронзовой болезнью (болезнь Аддисона). В связи с дефицитом глюкокортикоидов заболевание проявляется снижением устойчивости к различным формам стресса из-за наступающей глюкоземии и действию повреждающих факторов (инфекционных, механических и др.). Гиперпигментация кожи (бронзовый оттенок) связана с ослаблением регуляции по принципу обратной связи системы гипоталамус-гипофиз-кора надпочечников из-за дефицита глюкокортикоидов. Напряженный биосинтез в этом случае в гипофизе кортикотропина из белка-предшественника проопиомеланокортина непроизвольно сопровождается избыточным образованием меланотропинов (рис. 2.1), действующих на меланоциты в коже. Эти проявления заболевания усугубляются нарушениями водно-минерального обмена из-за недостатка минералокортикоидов, который практически всегда сопутствует гипопродукции глюкокортикоидов, т. к. не бывает повреждения только какого-то одного слоя надпочечников (клубочковый, пучковый, сетчатый). Задание 6.1. 1. Составьте схему превращения предшественников инсулина в активный гормон. 2. Обсудите этапы реализации глюкозо-сенсорной функции β-клетками поджелудочной железы. 3. Назовите источники пополнения запасов глюкозы в крови и пути ее утилизации. 4. Перечислите ферменты углеводного обмена, активность которых повышается и понижается под действием сигналов, передаваемых инсулином по Ras-пути. 5. Перечислите ферменты углеводного обмена, индукция и репрессия синтеза которых происходит в результате реализации сигналов инсулина по Ras-пути. 6. Дайте определение термину «сахарный диабет» по заключению экспертов Всемирной организации здравоохранения. 7. Укажите на характер и причины возникновения поздних осложнений сахаоного диабета. 8. Обсудите роль бифункционального фермента (БИФ) в реализации гиперглюкоземического эффекта глюкагоном. 9. Назовите основные метаболические эффекты адреналина. 10. Составьте схему регуляции выработки глюкокортикоидов в коре надпочечников по принципу отрицательной обратной связи. 11. Обсудите применение в медицинской практике глюкокортикоидов и их синтетических аналогов. 12. Ответьте на вопросы: Какие гормоны вырабатываются в инкреторной ткани поджелудочной железы? В каких формах инсулин аккумулируется в β-гранулах β-клеток островков Лангерганса? Что такое почечный порог глюкозы в крови? Зачем поддерживается определенное соотношение процессов поступления и удаления глюкозы из крови? Почему инсулин стимулирует поступление глюкозы только в клетки жировой ткани, сердечной и скелетных мышц? Изменение активности каких ферментов под действием инсулина способствует повышению скорости биосинтеза жирных кислот в адипоцитах? Какие причины лежат в основе развития сахарного диабета? Какие ранние симптомы характерны для сахарного диабета? Почему эффекты глюкагона на липидный обмен оценивают как катаболические? Какое влияние на пищеварительный тракт оказывает соматостатин, синтезирующийся в D(δ)-клетках поджелудочной железы? Какими эффектами обладает панкреатический полипептид – продукт F(ƒ)-клеток островков Лангерганса? Как усиливается синтез и секреция адреналина в мозговом слое надпочечников? Какие химические соединения относятся к глюкокортикоидам? Как регулируется выработка глюкокортикоидов? В чем заключается влияние глюкокортикоидов на обмен углеводов, белков, липидов? Как проявляется действие глюкокортикоидов на костную ткань? Почему при гипокортицизме может возникать гиперпигментация кожи? Задание 6.2. Решите тесты: Инсулин: А. Состоит из трех полипептидных цепей Б. Образуется из предшественника ограниченным протеолизом В. Реализует свои сигналы по тирозинкиназному механизму Г. Имеет короткий период полураспада Д. Используется в качестве энергетического материала Последовательность событий при биосинтезе инсулина: А. Включение в секреторные гранулы Б. Отщепление сигнального полипептида (20 аминоацилов) и замыкание трех дисульфидных мостиков В. Отщепление G-полипептида (33 аминокислотных остатка) Г. Образование препроинсулина (104 аминокислотных остатка) Д. Слияние β-гранул с плазматическими мембранами Указанным гормонам характерны эффекты: 1. Кортизон А. Стимулирует мобилизацию 2. Адреналин гликогена в мышцах 3. Инсулин Б. Протововоспалительное действие, 4. Глюкагон связанное со стимуляцией биосинтеза 5. Панкреатический соматостатин белков липопротеинов В. Ускоряет липолиз в адипоцитах Г. Ускоряет утилизацию глюкозы клетками Д. Нет правильного ответа Поздними осложнениями сахарного диабета являются: А. Полиартрит Б. Нефропатия, ретинопатия В. Неферментативное гликозилирование белков Г. Бронзовая болезнь Д. Метаболический алкалоз Оцените достоверность утверждений в каждом из предложений и связь между ними: Инсулин не влияет на активность фосфофруктокиназы, поэтому при сахарном диабете образование фруктозо-1,6-бисфосфата не меняется. Глюкокортикоиды вызывают гиперглюкоземию, потому что они усиливают метаболизм гликогена в печени, почках. Задание 6.3. Решите задачу: Пациент жалуется на жажду, ухудшение зрения, общую слабость, быструю утомляемость, повышенный аппетит. При осмотре обращают внимание воспалительные явления на коже (фурункулы), в слизистой оболочке полости рта (пародонтит). В крови выявлено повышение глюкозы до 10 ммоль/л. Назовите патологию, для которой характерны указанные признаки. 7. Гормоны, регулирующие водно-солевой обмен В организме человека вода составляет ≈60% то массы тела. В ее среде происходят метаболические процессы. Суточная потребность в ней достигает 1,5 – 2 л. В тканях генерируется 350 – 400 мл эндогенной воды. Из общего количества 5% ее находится в крови, 25% - во внеклеточном матриксе тканей и органов, 70% составляет внутриклеточная вода. Между тремя этими объемами идет постоянный обмен жидкостью. Хотя регуляторы водно-солевого обмена вырабатываются в разных местах и реализуют свои сигналы разными механизмами, их объединяет то, что они контролируют одни и те же процессы. Их эффекты могут быть разнонаправленными, но в любом случае они достигают одной цели – поддержания постоянства жидкой среды организма. А оно характеризуется величинами осмотического давления, рН и объема внеклеточной жидкости. Изменения этих параметров сопровождаются колебаниями артериального давления, появлением отеков или, напротив, дегидратацией организма, алкалозом, ацидозом. Поддержание осмотического давления внеклеточной жидкости (плазма крови и жидкость экстрацеллюлярного матрикса тканей и органов), артериального давления достигается изменениями скорости выделения воды и NaCl в почках, регуляцией сосудистого тонуса. К гормонам, контролирующим эти процессы, относятся вазопрессин, атриопептин, альдостерон и тесно с ними сопряженные сигнальные молекулы ренин-ангиотензиновой и кининовой систем. Вазопрессин – нанопептид (см. рис. 5.1), выделяемый в кровь нейрогипофизом. Его секреция усиливается при снижении объема жидкости в организме (гиповолемия) и повышении осмотического давления крови (гиперосмолярность). Гиповолемия воспринимается барорецепторами, расположенными в каротидных синусах, левом предсердии, дуге аорты. Гиперосмолярность действует через осморецепторы гипоталамуса, роль которых выполняют белки аквапорины 4, образующие водные каналы (см. табл. 7.1). Они структурированы в клеточные мембраны нейросекреторных нейронов гипоталамуса, вырабатывающих вазопрессин. Боль, стресс, гипоксия, гиперкапния (избыток СО2 в крови), состояние тревоги, тошнота также стимулируют высвобождение этого гормона, хотя объяснение этому не всегда удается найти. Атриопептин (предсердный натрийуретический фактор) подавляет выработку вазопрессина (рис. 7.6). В дистальных извитых канальцах почек антидиуретический эффект вазопрессина реализуется через υ2-рецепторы по аденилатциклазному пути (см. рис. 4.7). Присоединение гормона к υ2-рецептору стимулирует образование аденилатциклазой 3',5'цАМФ. Запускающийся при этом процесс фосфорилирования каскада протеинкиназ приводит к активированию энхансеров, стимулирующих экспрессию генов белка аквапорина 2 (рис. 7.1), молекулы которого встраиваются в апикальные мембраны. Через образующиеся канала вода из первичной мочи поступает в клетки. А базолатеральные мембраны она пересекает простой диффузией. Реализуя эти эффекты, вазопрессин сохраняет необходимый объем жидкости в организме, не влияя не экскрецию натрия. Осмотическое давление внеклеточной жидкости снижается. Моча становится концентрированной. Именно поэтому вазопрессин получил название антидиуретического гормоно (АДГ). Усиливающаяся реабсорбция воды замыкает петлю обратной регуляции. Через осморецепторы гипоталамуса в нейросекреторные гормоны поступают сигналы, подавляющие образование вазопрессина. Почечный эффект АДГ проявляется при относительно низком его уровне. В более высоких концентрациях через υ1а-рецепторы по фосфоинозитидному пути он обеспечивает сокращение гладких мышц стенок сосудов и повышает артериальное давление. Считают, что этот эффект часто физиологического значения не имеет. Рис. 7.1. Схема антидиуретического действия вазопрессина через υ2 рецепторы в клетках дистальных извитых канальцев почек. АДГ активирует аденилатциклазу. Образовавшийся 3',5'цАМФ через каскад протеинкиназ активирует энхансер гена белков аквапоринов 2, через которые реабсорбируется вода. Аквапорины 2, 4 относятся к семейству мембранных белков – водных каналов, образующих поры для воды. Они обнаружены во многих тканях и органах (табл. 5.2). Таблица 7.1. Типы белков аквапоринов, их распределение по клеткам тканей и органов и функции, которые они выполняют Типы Локализация аквапоринов в Функции разных аквапоринов аквапо клетках тканей и органов ринов 1 Эритроциты. Дегидратация эритроцитов Почки. Клетки проксимальных Обеспечивает почкам способность извитых канальцев и тонкого концентрировать мочу отдела петли Генле. Ткани глаза. Гомеостаз внутриглазной жидкости 2 Почки. Клетки дистальных Синтезируясь под действием АДГ, извитых канальцев и обеспечивает реабсорбцию воды из собирательных трубочек. просвета канальцев и трубочек в клетки-ВКМ-кровь 3 Почки. Базолатеральные Обеспечивают перемещение воды мембраны собирательных через мембраны трубочек. Печень. Поджелудочная железа. Кишечник. Предстательная железа. Селезенка. Мембраны клеток. 4 Гипоталамус. нейроны, вазопрессин. 5 Слюнные железы. Слезные Участвуют в формировании железы. Железы воздухоносных слюны, слезной жидкости, секрета путей. желез воздухоносных путей Нейросекреторные Канал выполняет синтезирующие осморецептора роль Проявлением дефицита функций антидиуретического гормона в организме является несахарный диабет – состояние, характеризующееся неспособностью концентрировать мочу. Главный симптом этого заболевания – гипотоническая полиурия. Суточный диурез может достигать 15 – 20 литров, ее плотность <1,010 (в норме 1,020). Жажда (полидипсия) возникает из-за полиурии и вторичного повышения осмотического давления. Различают два вида несахорного диабета: 1) Центральный (гипофизарный); 2) Нефрогенный. Причинами первого являются: а) генетические дефекты белка-предшественника АДГ в гипоталамусе; б) нарушения аксонального транспорта между гипоталамусом и гипофизом; в) нарушения процессинга белка-предшественника АДГ в гипофизе; г) повреждения тканей гипоталамуса или гипофиза вследствие черепномозговых травм, опухолей, ишемии, аутоиммунного воспаления. Нефрогенный несахарный диабет обусловлен отсутствием ответа в почках на АДГ. Это бывает либо из-за изменений структуры его рецепторов (υ2), либо из-за дефекта водных каналов – аквапоринов 2, являющихся следствием мутаций гена этих белков. Основными минералокортикоидами, синтезирующимися в клубочковой зоне коры надпочечников, являются альдостерон и 11-дезоксикортикостерон (рис. 2.6, 6.9). На долю первого приходится 90% их совместной активности. Действие этих гормонов тесно связано с функцией ренин-ангиотензиновой и атриопептиновой систем. Ангиотензин II как компонент ренин-ангиотензиновой системы является главным регулятором синтеза и секреции альдостерона. Он стимулирует его биосинтез и выброс в кровь. Pg Е1, Е2, травмы, стрессовые состояния, гиперкалиемия увеличивают секрецию альдостерона. Гипокалиемия ее тормозит. Эффекты гипо- и гиперкалиемии опосредованы через систему «ренин-ангиотензины». Считают, что обмен минералокортикоидов контролируется, хотя и слабо, кортикотропином аденогипофиза и адреногломерулотропином эпифиза. И все же главными стимуляторами секреции альдостерона являются ангиотензин II и гиперкалиемия (рис. 7.2). Подавляет выработку альдостерона атриопептин (предсердный натрийуретический фактор), см. рис. 7.2, 7.6. Свои сигналы он реализует через мембранные рецепторы гуанилатциклазы в клетках-мишенях, продуцирующих альдостерон. Рис. 7.2. Стимулирующее влияние ангиотензина II и гиперкалиемии на секрецию альдостерона в клубочковой зоне коры надпочечников. 1 – ангиотензинпревращающий фермент; 2 – стимулирующее влияние ангиотензина II на синтез и секрецию альдостерона; 3 – ангиотензин II сужает периферические сосуды (вазоконстрикция), передавая сигналы по фосфоинозитидному пути; 4 – механизм стимуляции секреции альдостерона калиемдо конца не выяснен; 5 – атриопептин (предсердный натрийуретический фактор, ПНФ), гипокалиемия тормозят выработку альдостерона. В крови минералокортикоиды транспортируются в комплексе с альбуминами. Мишенями для них являются клетки дистальных канальцев почек, исчерченных протоков слюнных желез, тонкого и толстого кишечника, потовых желез. Сигналы минералокортикоидов передаются по внутриклеточно-ядерному механизму, который рассмотрен в разделе 4 (рис. 4.15). В клетках-мишенях они стимулируют биосинтез белков-транспортеров ионов, а также белков-ферментов энергетического обмена. Эти белки обеспечивают облегченную диффузию через апикальные мембраны Na+ внутрь клеток, К+ - наружу (рис. 7.3). Ускорение биосинтеза ферментов цитратного цикла, стимулирующих образование АТФ, а также Na+, К+-АТФ-азы обеспечивает активный транспорт ионов через базолатеральные мембраны: антипорт трех ионов Na+ из цитоплазмы клеток во внеклеточный матрикс и далее в кровь в обмен на два иона К+ внутрь клеток. В результате под действием альдостерона повышается реабсорбция Na+ и его противоиона Cl¯ в почечных канальцах. В то же время увеличивается выделение К+ почками, кожей и со слюной. В эпителиальных клетках потовых желез альдостерон стимулирует активный транспорт Na+ через клеточные мембраны. При недостатке этого гормона потоотделение может привести к опасной потере организмом хлорида натрия. В целом эффект минералокортикоидов сопровождается задержкой натрия хлорида и воды (вода удерживается Na+ вторично) в тканях и потерей калия. Рис. 7.3. Реализация сигналов альдостерона в клетках дистальных почечных канальцев, исчерченных протоков слюнных желез и др. Альдостерон стимулирует биосинтез белков, обеспечивающих облегченную диффузию через апикальную мембрану Na+ внутрь, К+ наружу. Ускорение биосинтеза ферментов цитратного цикла обеспечивает Na+, К+-АТФ-азу энергией АТФ. В итоге Na+, Cl¯, вода реабсорбируются, К+ выходит наружу. 1 – белок-транспортер К+; 2 – аквапорин-2 в почечных канальцах (-5- в слюнных железах); 3 – белок-транспортер Na+. Время полусуществования (Т1/2) минералокортикоидов составляет 20 – 30 минут. Как и другие стероидные гормоны, они инактивируются путем образования водорастворимых парных соединений с глюкуронатом (см. рис. 9.4), выделяющихся затем с мочой и желчью. Хотя в чистом виде не бывает поражений какого-либо одного слоя коры надпочечников, которые могли бы приводить к парциальным формам патологии, все же избыточный неконтролируемый выброс альдостерона в ряде случаев носит изолированный характер. Выделяют первичный и вторичный гиперальдостеронизм. Первый его вариант может быть проявлением альдостеронпродуцирующей аденомы (болезнь Кона), или оказаться результатом гиперплазии клубочковой зоны коры надпочечников. Он проявляется артериальной гипертензией, гипокалиемией, повышенной возбудимостью миокарда, низким уровнем ренина в плазме крови. Вторичный гиперальдостеронизм, составляющий на самом деле большую часть случаев этой патологии, возникает по вненадпочечниковым причинам (стеноз почечных артерий, злокачественная гипертензия, ренин-секретирующие опухоли и др.). При этом содержание ренина в крови значительно повышено и стимулирует биосинтез альдостерона. Гипоальдостеронизм может быть компонентом тотального гипокортицизма (болезнь Аддисона – бронзовая болезнь). К проявлениям дефицита глюкокортикоидов присоединяются симптомы недостатка альдостерона. Организм накапливает калий, возникает гиперкалиемия. С мочой теряются натрий, вода, что сопровождается гипонатриемией, гиповолемией. Вследствие всего развивается гипотензия, метаболический ацидоз, резкая мышечная слабость, прогрессирующая утомляемость вплоть до полного бессилия. Все это связано с т. н. гиперполяризацией мембраны мышечных клеток из-за выше указанных изменений обмена ионов Na+, K+. Калийнатриевый градиент на мембранах нарушается, возбулимость мышц снижается. В тяжелых случаях бывают обмороки, брадикардия вплоть до блокад, судороги, помрачнение сознания. При гипокортицизме больные погибают из-за нарушений водно-минерального баланса. Первичный изолированный гипоальдостеронизм может быть результатом наследственного дефекта биосинтеза ферментов 18-монооксигеназы и 18дегидрогеназы, тех самых, которые ответственны за образование этого гормона (рис. 6.9). Вторичный гипоальдостеронизм развивается от недостаточной функции ренин-ангиотензиновой системы. При этом выявляется снижение уровня ренина в крови. Псевдогипоальдостеронизм – это синдром резистентности почек, слюнных желез и других мишеней альдостерона к его сигналам. Причинами этого могут быть дефекты минералокортикоидных рецепторов. А проявления заболевания развиваются на фоне высоких концентраций в крови и альдостерона, и ангиотензина II. В связи с существенной ролью ангиотензина II в стимуляции биосинтеза альдостерона их эффекты во многом схожи, а ренин-ангиотензиновая система относится к числу регуляторов водно-солевого обмена. Пусковым моментом в ее «работе» является образование ренина. Ренин-аспартатная протеиназа, гликопротеин с Mr 40 кДа (274 аминокислотных остатка) синтезируется в юкстагломерулярных клетках афферентных артериол клубочков почек. Он также образуется в крупных слюнных железах, преимущественно в поднижнечелюстных, аденогипофизе, семенниках. Фермент состоит из двух полипептидных цепей, соединенных дисульфидными связями. Синтезируется он в виде препроренина и активируется путем ограниченного протеолиза (рис. 7.4). Рис. 7.4. Стадии пострибосомального созревания препроренина в ренин методом ограниченного протеолиза в юкстагломерулярных клетках афферентных артериол клубочков почек, в клетках слюнных желез и др. Выработка ренина почками является одним из способов участия этого органа в поддержании нормальных параметров водно-солевого баланса. Период полураспаде ренина (Т1/2) составляет 15 – 20 минут. Его продукция усиливается при падении артериального давления в просвете афферентных артериол клубочков почек. Ренин-синтезирующие клетки в этом случае функционируют как барорецепторы. Влияние гипотензии усиливается при перемене горизонтального положения тела на вертикальное. Установлен стимулирующий эффект на выработку ренина снижения уровня ионов натрия в первичной моче дистальных канальцев почек. Секреция ренина возрастает также под действием простагландинов (например Pg F2α), передающих сигналы паракринно, а также адреномиметиков через β1адренорецепторы в юкстагломерулярных клетках почек. Активность ренина повышается сигналами от андрогенов, йодтиронинов и др. Антагонистом ренин-ангиотензиновой системы является атриальный натрийуретический фактор (АНФ, атриопептин). Он подавляет выработку ренина (рис. 7.5, 7.6). Субстрат ренина – белок ангиотензиноген (Mr 57 кДа, 400 аминокислотных остатков), продуцируемый печенью, в крови циркулирует в составе α1-глобулиновой фракции. Его биосинтез стимулируют глюкокортикоиды, эстрогены, йодтиронины. Ограниченным протеолизом от его N-конца ренин отщепляет декапептид ангиотензин I, не имеющий собственной биологической активности. Фермент дипептидил-карбоксипептидаза («ангиотензин конвертирующий фермент») обеспечивает образование в плазме крови при прохождении ее по капиллярам легких ключевого эффектора рениновой системы ангиотензина II. При отщеплении у него с N-конца аспартата аминопептидазой образуется ангиотензин III (рис. 7.5). Последний по биологической активности, хотя и очень слабой, похож на предшественника. Его уровень в крови составляет ≈20% от концентрации ангиотензина II. Это в еще большей степени ослабляет его роль в организме. Рис. 7.5. Образование ангиотензина I под действием ренина, дальнейшие его превращения в активные ангиотензины II, III при участии карбокси- и аминопептидаз и расщепление последнего ангиотензиназой. Цифрами обозначены: 1 – факторы, стимулирующие выработку ренина в печени: гипотензия в просвете афферентных артериол почечных клубочков, влияние которой усиливается при перемене горизонтального положения тела на вертикальное, снижение Na+ в первичной моче дистальных канальцев почек, адреномиметики через β1-адренорецепторы в юкстагломерулярных клетках почек, Pg E2, Pg F2α, действующих паракринно, сигналы андрогенов, йодтиронинов и др.; 2 – атриопептин (атриальный натрийуретический фактор, АНФ), подавляющий образование ренина; 3 – участки расщепления показаны маленькими стрелками. Мишенями ангиотензина II являются клетки клубочковой зоны коры надпочечников, гладкомышечные клетки сосудистых стенок, клетки почечных канальцев. Его сигналы передаются по фосфоинозитидному пути (см. табл. 4.2). В надпочечниках он стимулирует биосинтез и секрецию альдостерона (рис. 7.2). В артериолах он вызывает сокращение гладких мышц. В результате уменьшается просвет сосудов и повышается артериальное давление. С этим эффектом связано его название – ангиотензин. В почках он подобно альдостерону стимулирует реабсорбцию воды и NaCl, что также способствует повышению артериального давления. Период полужизни ангиотензинов (Т1/2) составляет ≈60 секунд. Они катаболизируют до негативных пептидов, аминокислот под действием ангиотензиназ на эндотелий сосудов во всех тканях и органах за исключением легких. Антагонистом вазопрессина, альдостерона ангиотензина II по влиянию на метаболизм натрия, воды в организме, а также на сосудистый тонус является атриопептин (атриальный натрийуретический фактор, АНФ), предсердный натрийуретический фактор (ПНФ). Он вырабатывается в секреторных кардиомиоцитах предсердий, которые в незначительных количествах есть в желудочках сердца. Вначале синтезируется белок-предшественник, состоящий из 151 аминокислотного остатка, который в результате пострибосомального созревания ограниченным протеолизом превращается либо в атриопептин А (28 аминокислотных остатков), либо в атриопептин В (32 аминокислотных остатка). Установлено, что атриопептины продуцируются также нейроэндокриноцитами нервной ткани, а пудоцитами легких и др. В головном мозге доминирует атриопептин С (22 аминокислотных остатка). Все они имеют в своей структуре сходный циклический фрагмент, состоящий из 17 аминокислотных остатков, и различающиеся боковые ветви. Образования этих сигнальных молекул увсиливается при гипреволемии, гипертензии, физических нагрузках, серцебиении и переходе вертикального положения в горизонтальное. Другими стимуляторами секреции их является повышенный уровень катехоламиенов и глюкокортикоидов в плазме крови. Уровень атреопептинов в крови возрастает под действием альдостерона, вазопрессина, при середечной недостаточности. И, напротив, атриопептины подавляют выработку вазопрессина (рис. 7.2, 7.6), альдостерона (рис. 7.6), ренина (рис. 7.5, 7.6), т.е. выключают «работу» своих антагонистов. Основные клетки-мишени атриопептинов находятся в стенках сосудов почек и переферических артериях, а также в нейрогипофизе, коре надпочечников. В них эти сигнальные молекулы дейтсвуют через особые рецепторы, являющиеся экстрацеллюлярными локусами трансмембранной гуанилатциклазы. В отсутсвие атриопепттинов они фосфолированы и не активны. Связываясь с ними, гормоны инициируют конформационные изменения фермента и возрастание гуанилатциклазной активности. Образующийся 3',5' цГМФ из ГТФ стимулирует протеинкиназу G (рис. 4.8). Увеличивающиеся под действием ее потоки Са2+ наружу сопровождаются инактивацией киназы легких цепей миозина гладких мышц сосудистых стенок. Наступает мышечная релаксация и расширение сосудов. В отличие от своих антагонистов (вазопрессин, альдостерон), действующих на процессы реабсорбции в почечных канальцах (рис. 7.2, 7.3), атриопептины реализуют сигналы на уровне клубочков, т.е. на стадии образования первичной мочи. Расширяя афферентные (приносящие) артериолы, они повышают клубочковую фильтрацию. В результате увеличивается выведение воды и NaCl. За счет периферического сосудорасширяющего действия атрипептины понижают артериальное давление (рис. 7.6). Рис. 7.6. Реализация сигналов атриопептинов (атриальный натриуретический фактор (АНФ), предсердный натриуретический фактор (ПНФ)) в клеткахмишенях. 1 – Различают атриопептины А (28 аминокислотных остатков), В (22 аминокислотных остатка), образующиеся из белка-предшественника (151 аминокислотный остаток) ограниченным протеолизом. Все они имеют в своей структуре сходный циклический фрагмент из 17 аминокислотных остатков и различающиеся боковые ветви. Время полувыведения атриопептинов из крови (Т1/2) составляет 3 – 5 минут. Их катаболизм осуществляется в печени специфическими эндопептидазами. Синергистами атриопептинов по влиянию на сосудистый тонус являются кинины, обладающие спазмолитическим и гипотензивным действием. К ним относятся нанопептид брадикинин (H3+Nарг-про-про-гли-фен-сер-про-фен-аргСОО¯), и каллидин, имеющий на N-конце дополнительный остаток лизина. Его порой называют лизил-брадикинин. Субстратами для их образования служат белки кининогены. В глобулиновой фракции плазмы крови присутствуют два их вида: высокомолекулярный (Heawy Weight, HW) с Mr 120 кДа, pHi 4,3 и низкомолекулярный (Light Weight, LW) с Mr 6,5 кДа pHi 4,7. Они имеют доменное строение. HW-белок включает 6 доменов (D1 – D6), в LW-протеине их выделяют 5 (D1 – D5). Кининовую последовательность содержит D4 в обоих белках. Образование кининов происходит при участии протеолитических ферментов каллигеринов (кининогеназ). Катаболизируют они под действием киназ. Все это дает повод говорить о т.н. колликреин-кининовой системы. Каждый из его участников (белки кининогены, ферменты калликреины (кининогеназы), кининазы, пептид брадикинин, каллидин) помимо отношения к кининовому обмену обладают широким спектром прочих эффектов и не только в норме, но и при патологии. Калликреины являются трипсиноподобными протеиназами. Они синтезируются в виде предшественников и локализованы в плазме крови, а также в некоторых тканях и органах (поджелудочная железа, почки, половые и потовые железы, стенка кишечника и др.). Их синтез увеличивается под влиянием андрогенов, йодтиронинов, Pg F2α, ацетилхолина, адреналина через βадренорецепторы. Калликреиноген (прекининогеназа) представляет из себя гликопротеин (Mr 40 кДа), состоящий из одной полипептидной цепи с 619 аминокислотными остатками. Он активируется путем расщепления пептидной связи между арг-371 и 372. Образовавшиеся легкая и тяжелая цепи остаются связанными друг с другом одной дисульфидной связью. Каталитический домен находится в легкой цепи. Активаторами калликреинов в тканях, расщепляющими выше указанную пептидную связь, являются лизосомальные катепсины, в поджелудочной железе – трипсин. В плазме крови это происходит под влиянием фактора Хагемана (XII фактор свертывания крови), плазмина (фермент системы фибринолиза), трипсина, поступающего сюда при поражении поджелудочной железы и др. В отличие от других тканей, в слюнных железах и почках предшественники калликреинов не найдены, и поэтому считают, что они здесь вырабатываются сразу в активной форме. А в чем состоит главная роль калликреинов? В плазме крови они образуют из высокомолекулярных кининогенов брадикинин (рис. 7.7). Тканевые калликреины из низкомолекулярных кининогенов нарабатывают каллидин (лизил-брадикинин). Последний превращается в брадикинин при отщеплении лизина у N-конца. Активность калликреинов контролируется ингибиторами белковой природы, которые присутствуют как в плазме крови, так и в тканях. Период полураспада (Т1/2) брадикинина равен 17 – 25 секундам. Инактивация кининов осуществляется кининазами, в том числе «ангиотензинпревращающим ферментом» (кининаза II), карбоксипептидазами N и B, локализованными в плазме крови и тканях. Конечные продукты их катаболизма – неактивные пептиды, аминокислоты (рис. 7.7). Рис. 7.7. Схема образования и катаболизма кининов. Существует тесная связь между калликреин-кининовой системой, свертыванием крови и фибринолизом, так как у них общие активаторы – фактор Хагемана и плазмин. Свои многочисленные эффекты кинин реализует по фосфоинозитидному пути (см. табл. 4.2) через два типа рецепторов, получивших название В1 и В2. Взаимодействие с ними брадикинина запускает каскад событий, приводящих к мобилизации внутриклеточного Са2+ с последующим увеличением каталитической активности протеинкиназы С (рис. 4.10). Этот фермент инициирует сигнал внутри клеток, приводящий к образованию оксида азота (N·O·). Его поступление из эндотелиоцитов в гладкомышечные клетки стенок сосудов и стимуляция образования 3',5' цГМФ с участием цитозольной гуанилатциклазы обеспечивает сосудистую релаксацию (рис. 4.9). Кинины вызывают расширение периферических и коронарных кровеносных сосудов, снижают артериальное давление, стимулируют сокращения сердца. Через β2-рецепторы брадикинин в тучных клетках усиливает освобождение гистамина. Его сигналы, опосредованные β1-, β2-рецепторами в разных тканях способствует образованию Pg G2, в легких вызывает спазм бронхов, участвуя в реализации приступов бронхиальной астмы. Взаимодействие кининов с β2-рецепторами приводит к нарушению проницаемости капилляров, тем самым усиливая проявления воспаления при его наличии, а также склонность к развитию атеросклероза. В слюнных железах они усиливают секрецию слюны. В костной ткани брадикинин, активируя β1рецепторы, усиливает ее резорюцию, увеличивает высвобождение Са2+. В остеобластах он способствует образованию Pg E2, Pg I2, ИЛ-1, фактора некроза опухолей и этим влияет на процессы ремоделирования костей. Участие «ангиотензинконвертирующего фермента» (дипептидилкарбоксипептидаза) в качестве кининазы в распаде кининов (см. рис. 7.5) делает его ключевым звеном ренин-ангиотензиновой и калликреинкининовой систем. Первая повышает, а вторая снижает сосудистый тонус и артериальное давление. Дипептидилкарбоксипептидаза включает первую систему путем образования ангиотензина II и снижает эффект второй, расщепляя брадикинин. Этим она обеспечивает реципрокную регуляцию ими сосудистого тонуса (рис. 7.8). Рис. 7.8. Схема реципрокной регуляции сосудистого ангиотензиновой и кининовой системами, «ангиотензинконвертирующим (дипептидилдкарбоксипептидазой). тонуса ренинобеспечиваемой ферментом» Кининогены, помимо участия в биосинтезе кининов, обладают несколькими самостоятельными функциями, наличие которых обусловлено их доменным строением (рис. 7.7). Домены D1, D2, D3 имеют аминокислотные последовательности, сходные с цистатинами, которые являются ингибиторами цистеиновых протеиназ. Домен D1 обеспечивает кининогенам слабую Са2+связывающую активность. Эти белки также контролируют адгезию и активность тромбоцитов, полиморфноядерных лейкоцитов, эндотелиоцитов, модулируют воспалительные и антитромботические реакции. Кроме кининогеназной активности, калликреинам характерно участие в реализации ряда защитных механизмов, таких как гемокоагуляция, фибринолиз, лизис клеток, регуляция артериального давления. В плазме крови их активность контролируется ингибиторами (α2-макроглобулин, инактиватор С1, антитромбин III и др.). При их недостатке калликреины могут способствовать развитию патологических состояний. Например, осуществляя фрагментацию Аро В 100 в ЛНП они снижают способность последних связываться с соответствующими рецепторами на эндотелиоцитах, что может инициировать развитие атеросклероза. Показано участие калликреинов в развитии острого и хронического воспаления, аллергических реакций, тромбо-геморрагических нарушений, опухолевых процессов. Стимуляция ими в нейтрофилах эластазы способствует разрушению эластиновых белков в легких и развитию бронхоэктазов. Ингибиторы калликреинов или ферментов их биосинтеза применяются для лечения заболеваний, в основе которых лежат нарушения кининового обмена. Впервые это произошло при включении в перечень средств противошоковой терапии. Ингибиторы протеиназ применяют для лечения острых панкреатитов, геморрагических состояний, онкологических заболеваний. Инактиватор С1 применяют при лечении ангионевротического отека, в основе которого лежат генетически детерминированные нарушения биосинтеза этого ингибитора калликреинов. Задание 7.1. 1. Составьте схему механизма реализации вазопрессином антидиуретического действия. 2. Перечислите типы белков аквапоринов, структурированных в мембраны клеток различных тканей. 3. Обсудите причины возникновения центрального (гипофизарного) и нефрогенного несахарного диабета. 4. Перечислите этапы реализации альдостероном его эффектов, заключающихся в задержке натрия, хлора, воды и потере калия. 5. Составьте схему процесса биосинтеза ангиотензинов I, II, III. 6. Назовите принципиально отличные действия в почках атриопептинов от вазопрессина и альдостерона. 7. Обсудите пути биосинтеза и катаболизма кининов в тканях организма. 8. Ответьте на вопросы: Какими параметрами характеризуется постоянство жидкой среды организма? Сколько литров воды содержится у человека с массой тела 65 кг? Что является стимулом для выработки вазопрессина? Какие химические соединения обладают активностью минералокортикоидов? Через какую систему опосредовано влияние гипо- и гиперкалиемии на биосинтез и секрецию альдостерона? Что такое первичный и вторичный гиперальдостеронизм? Какую роль играет дипептидилкарбоксипептидаза («ангиотензинконвертирующий фермент»)? Что такое атриопептины? Какие выделяют их виды? Какими эффектами обладают кинины? Задание 7.2. Решите тесты: Секрецию альдостерона стимулируют: А. Гипокалиемия Б. Повышение артериального давления В. Стрессовые реакции Г. Понижение осмотического давления Д. Снижение Гормоны синтезируются: 1. Вазопрессин 2. Альдостерон 3. Атриопептин 4. 11-Дезоксикортикостерон А. В гипоталамусе Б. В коре надпочечников В. В предсердиях Г. В почках Д. В легких Ангиотензин II: А. Является аспартильной протеиназой Б. Образуется из ангиотензина III под «ангиотензинконвертирующего фермента» В. Стимулирует биосинтез и секрецию альдостерона Г. Расширяет просвет сосудов и снижает артериальное давление Д. В почках стимулирует реабсорбцию воды действием Оцените достоверность утверждений в каждом предложении и связь между ними: «Ангиотензинконвертирующий фермент» способствует образованию ангиотензина II, потому что он в качестве кининазы ускоряет распад кининов. Альдостерон в дистальных канальцах почек усиливает реабсорбцию Na , потому что способствует ускорению белков-транспортеров этих ионов. + Задание 7.3. Решите задачу: Женщина 45 лет жалуется на непрекращающуюся жажду и повышение мочеотделения. Жажда становится невыносимой, если она не пьет несколько часов. Кроме того, у пациентки нарушился сон из-за частого мочеиспускания и потребности пить воду. При общем обследовании глюкозурия не выявлена. Концентрация креатинина, мочевины в моче снижены. Назовите причину данной патологии и предложите методы обследования с целью уточнения диагноза. 8. Гормоны, регулирующий кальций-фосфорно-магниевый обмен. Уровень кальция в организме подвергается местному регулированию. Содержание фосфатов магния контролируется менее четко. Общее количество кальция у человека достигает 1200 гр., фосфора 650 гр., магния 25гр. По распределению кальций принято делить на две неравные части. Приблизительно 99% его структурировано в минерализованной ткани в составе кристаллов гидроксиапатитов, имеющих эмпирическую формулу Ca10(PO4)6·(OH)2 или иначе [Са3(РО4)2]·Са(ОН)2 и некоторых их изоионных формул (магниевые апатиты, хлорапатиты и др.). Около 1% кальция находится в составе жидкостей (внутриклеточная, внеклеточная, плазма крови). В плазме общее содержание кальция составляет 2,2-2,7 ммоль/л. Он представлен тремя формами (рис. 8.1): В их числе: 1 – кальций, связанный с белками (в основном с альбуминами); 2 – комплексированный с фосфатом и цитратом; 3 - свободный в виде ионов. Физически активной формой является только последняя, и именно концентрация ионов кальция в плазме крови поддерживается механизмом гомеостаза. Общий кальций плазма крови (2,2-2,7 ммоль/л) Кальций, связанный с белком, и не перемещающийся через биомембраны (≈40%) Кальций, комплексированный с фосфатом и цитратом (≈10%) Кальций, способный преодолевать биомембраны (≈60%) Кальций ионизированный (≈50%) . Рис. 8.1 Формы, образуемые кальцием в плазме крови. Среднесуточное поступление кальция с пищей составляет 0,6-1,5 гр. (≈24 ммоль/сут). Им богаты молочные продукты, темно-зеленные овощи, сардины, шоколад. Всасывание кальция происходит преимущественно в тощей кишке и зависит от витамина D (рис.8.2). Присутствие в пище веществ, связывающих его и уменьшающих всасывание, повышает потребность в кальции содержащих пищевых продуктах. Абсорбируется только 50-70% кальция, поступившего с пищей. Небольшое количество выделяется в кишечник в составе секретов печени и поджелудочной железы. И все же пищеварительный тракт рассматривают в основном как место всасывания, а не экскреции кальция в организм. Для клеток этот элемент считается токсичным, поэтому его внутриклеточная концентрация составляет 10-4 – 10-3ммоль/л. это более чем в 10000 раз меньше, чем снаружи (1,2 ммоль/л). При попадании в цитозоль кальций немедленно переваривается в сигнальные цистерны или митохондрии и освобождается оттуда лишь под действием соответствующих сигналов. Отмеченная разность концетраций кальция создается Са+2-АТФ-азы, структурированные в плазматические мембраны и мембранах эндоплазматического ретикулума. Кроме того, в этом участвует система ионных каналов типа Nа+, Са2+ или Н+, Са2+-обменников или пропускающие Са2+ по градиенту концентрации. Некоторые из них реагируют на изменения мембранного потенциала или в ответ на гормональные сигналы через внутриклеточных посредников (рис.4.10). Некоторые сигнальные молекулы включают Са2+ неэлектрогенные медленные каналы напрямую (см. табл. 4.3). Кальций, помимо очевидного участия в построении минерализованных тканей, выполняет много и других функций (см. табл. 8.1). Его присутствие имеет большое значение для мышечного сокращения. От его концентрации зависит возбудимость нервов. Он является вторичным посредником при передаче гормональных сигналов. Кальций играет роль ΙV-го фактора системы свертывания крови и входит во многие ферменты в качестве кофактора. Таблица 8.1 Функции кальция в организме. Названия функций Их реализация. Структурная Входит в состав кристаллов гидроксиапатитов и их ионных агентов в минеральной ткани. Нейромышечная Контролирует возбудимый нерв. Инициирует мышечные сокращения. Прокоагулянтная Играет роль ΙV-го фактора системы свертывания крови. Участие в Входит в состав ферментов в качестве кофакторов, ферментном катализе может быть аллостерическим модулятором ферментной активности. Участие в передачи Играет роль вторичных посредников (менеджера) гормональных См. рис. 4.10, табл.4.3. сигналов Сходная физико-химическая характеристика щелочноземельных металлов кальция и магния способствует тому, что их метаболизмы в чем-то близки. Магний является четвертым по распространенности катионом в организме. При общем количестве 25гр. большая часть его (60%) тоже структурирована в минерализованные ткани. Остальной магний содержится в других тканях и органах. Максимальное его количество в пересчете на единицу массы приходится на миокард и мышечную ткань. Мышечная ткань содержит магния в 10 раз больше, чем плазма крови, поэтому его уровень в ней (0,8-1,2 ммоль/л) даже при значительных потерях длительное время может оставаться стабильным, пополняясь из мышечного депо. Около 75% магния в плазме крови находится в ионизированной форме, 25% связано с белками, основном с альбуминами. Сбалансированная диета содержит 0,3-0,4 гр. магния в сутки. Главные его источники орехи, мясо, зелень. Почти весь он всасывается в тонком кишечнике. В клетках тканей магний необходим для поддержания структуры рибосом, нуклеиновых кислот, некоторых белков. Он является кофактором более 300 ферментов. Среди них ферменты белкового синтеза, гликолиза, трансмембранного транспорта ионов и многих других процессов. Комплекс магния и АТФ является субстратом для многих АТФ-зависимых реакций. Магний косвенно влияет на рост и дифферинцировку клеток, поддерживая пул пуриновых и пиримидиновых нуклеотидов, необходимых для биосинтеза ДНК и РНК. Он также необходим на всех этапах синтеза белка. С обменом кальция и магния тесно переплетен и метаболизм фосфатов. Примерно 85% фосфора из 650 гр. содержится в организме, приходится на минерализованные ткани, где он в составе фосфатов участвует в образовании кристаллов апатитов. Фосфаты обнаруживаются также во внутриклеточной и внеклеточной жидкостях в количествах, которые внутри в 100 раз превышают снаружи. Макроэргические фосфатные соединения и фосфорилированные активные метаболиты не могут свободно преодолевать мембраны и попадать клетки. В плазме крови значительная часть фосфатов представлена анионами НРО42- и Н2РО4-. Только небольшое количество (≈10%) связано с белками. Перемещения их через плазматические мембраны являются пассивными и определяются в основном током кальция. Регуляция гемостаза фосфатов осуществляется теми же факторами, которые контролируют баланс кальция. Помимо участия в построении апатитов в минеральных тканях фосфор входит в многочисленные органические и неорганические химические соединения. Основными процессами, в которых они играют роль, являются обмены углеводов, липидов, нуклеиновых кислот, белков. В костной ткани постоянно идут процессы деминерализации и реминерализации. В результате за 5-6 лет весь кальций костей, а, следовательно, и они сами полностью обновляется. Остеогенез идет с участием остеобластов, образующихся из остеогенных клеток. Они нарабатывают коллаген І типа, а также минарные неколлагеновые кальций связывающие белки (остеонектин, glaпротеин), инициирующие минерализацию, и выполняющие адгезивные функции, а также роль факторов хемотаксиса клеток (остеопонтин, костный мелопротеин, остеокальцин, костный фибропептин). Маркером их активности является щелочная фосфатаза. Известно, что здесь она действует как гидролаза, отщепляя фосфаты от органических соединений, и на фосфотрансферазы, перенося их на акцепторы органической природы. Окружая себя минеральным компонентом, остеобласты превращаются в остеоциты. Остеолитическую активность в местах ремоделирования костей проявляют остеокласты. Эти гигантские многоядерные макрофаги образуются из моноцитов. Они выделят коллагеназу, кислую фосфатазу, другие гидролазы, создают локальный ацидоз (рН 4,0). Для этого они с помощью Н+/К+-АТФ-азы нагнетают сюда протоны (Н+), нарабатывая их в своем цитозоле С. Процессы деминерализации и реминерализации поддерживают в динамическом равновесии уровни кальция в минерализованных тканях с внеклеточными жидкостями. Кальций высвобождается из костей и снова в них накапливается по мере необходимости. Механизмы, участвующие в поддержании нормальных концентраций этого элемента в плазме крови включают, кроме того, регуляцию их всасывания в пищеварительном тракте и экскрецию почками, кожей. В норме содержания кальция в крови составляет 2,7 – 2,9 ммоль/л (рис. 8.2). Организм защищает себя от гиперкальцемии, снижая абсорбцию его в кишечнике, ослабляя реабсорбцию в почечных канальцах, замедляя деминерализацию костной ткани. Низкая концентрация кальция в плазме крови стимулирует его всасывание в кишечнике, усиливая реабсорбцию в почечных канальцах и деминерализацию костной ткани (рис. 8.2). Рис 8.2 Схема обмена кальция в организме (вес тела 70 кг). Кальций, поступающий с пищей, в присутствии витамина D всасывается преимущественно в тощей кишке. Значительная часть кальция не всасывается, а небольшое его количество секретируется и выделяется с калом. Кальций во внеклеточном пространстве, включая плазму крови, находится в динамическом равновесии с депонированным в костной ткани. В почках малая часть не реабсорбировавшегося кальция выводится с мочой. Колебания уровня кальция могут привести к изменениям порога возбудимости нервных и мышечных клеток, нарушениям активности ферментов, гормональной регуляции метаболизма и других процессов. Концентрация этого иона в плазме крови регулируется с высокой точностью. Отклонения на 1% приводит в действие контролирующую систему, восстанавливающую равновесие. Регуляторами являются паратприн 1,25(ОН)2-- кальцидорол, способствующий повышению кальция в плазме крови в случае гипокальцемии и кальцитонии, а также 24,25 (ОН)2-кальциферол, обладающие противоположным эффектом. Эти же гормоны регулируют концентрации неорганического фосфата и ряда других ионов в жидкостях организма. Паратирин – гормон белковой природы, секретируемый главными клетками паращитовидных желез в ответ на низкую концентрацию кальция во внеклеточной жидкости. Четыре паращитовидные железы с диаметром менее 5 см и весом 15 – 72 гр. каждая расположены непосредственно за щитовидной железой и снабжаются артериальной кровью из ее задней капсулы. Венозный отток происходит в цервикальные венозные сплетения. В паратиреоидной системе заложен большой функциональный резерв. Для проявления их полноценной активности достаточно функционирования только двух из четырех, т.е. существует возможность замены одних другими. И хотя с возрастом происходит некоторое снижение их функций, гипопаратиреоидизм не возникает. Паратирины, как многие другие гормоны белково-пептидной природы, синтезируется в виде более крупного предшественника – препропаратирина (115 аминокислотных остатков). Удаление 25 аминоацилов приводит к образованию прогормона (90 аминокислотных остатков). Последующее отщепление гексапептида формирует паратирин (84 кислотных остатка). Биологическая активность его молекулы связана с N – терминальной (1 – 34) аминокислотной последовательностью (рис. 8.3). Секреция паратирина регулируется кальцием сыворотки крови по механизму отрицательной обратной связи. Гипокальциемия её усиливает, гиперкальциемия – уменьшает. Это происходит с участием кальциевых рецепторов на поверхности секреторных клеток. Они относятся к классу рецепторов, связанных с G-белками. Несмотря на важное значение паратирина в контроле экскреции фосфатов, изменение их концентрации непосредственно не влияет на секрецию гормона. Умеренная гипомагниемия стимулирует, более значительная – подавляет значение паратирина, то есть его секреция является магниезависимым процессом. Клетки-мишени для паратирина находятся в костной ткани и почках. Остеокласты не имеют рецепторов к этому гормону, но они есть в плазматических мембранах остеобластов. В почках они структурированы в мембраны клеток проксимальных и дистальных канальцев. Сигналы паратирина реализуются по аденилатциклазному пути (рис. 4.7, табл. 4.1). Этот гормон оказывает различные воздействия на метаболизм кальция, но всегда приводит к повышению его концентраций в плазме крови (см. табл. 8.2). В костной ткани этот гормон стимулирует функцию остеокластов, но не прямо, а опосредованно. Взаимодействуя с рецепторами на остеобластах, он ускоряет биосинтез и секрецию ими остеокальцина, остеопонтина, некоторых цитокинов (ИЛ-1, ИФР-I, ИЛ-6, колониестимулирующий фактор, кахексин лимфотоксин). Все эти вещества действуют паракринно. Остеокальцин вызывает хемокинез остеокластов. Остеопонтин через свои рецепторы на плазматических мембранах стимулирует их метаболическую активность. Это же делают и цитокины. В дистальных извитых почечных канальцах паратирин повышает реабсорбцию ионов этого металла. В проксимальных канальцах он снижает обратное всасывание фосфатов, а вместе с ним сульфатов, бикарбонатов, хлоридов. Это способствует развитию выделительного ацидоза. В клетках проксимальных канальцев почек паратирин стимулирует образование кальцитриола (рис. 2.7, 8.4), вследствие чего повышается абсорбция кальция в кишечнике. Таблица 8.2. Эффекты паратирина и их результаты Ткани-мишени Эффекты Результаты Минерализованные Стимуляция остеобластов, Повышение Са2+ ткани функционирующих сопряжено с плазме крови. остеокластами. Усиление последними резорбции костной ткани, быстрое высвобождение кальция. Почки: дистальные Увеличение реабсорбции кальция извитые канальцы. из первичной мочи. Снижение реабсорбции фосфатов, фосфатурическое действие. Клетки проксимальных канальцев в Повышение Ca2+ в плазме крови. Понижение фосфатов в плазме крови. Ускорение образования активной формы витамина D 1,25(ОН)2 Повышение Са2+ кальциферола, стимулирующего плазме крови. абсорбцию кальций в кишечнике (см. рис.). в Циркулирующий в крови паратирин имеет период полужизни (Т1/2) 5 – 10 минут. При его распаде в печени происходит расщепление пептидных связей в области 34 – 35-го аминокислотных остатков и в других местах. После этого N-, С-концевые и срединные фрагменты, циркулируют в крови. Первый из них, содержащий 34 аминоацила, обладает полной биологической активностью гормона. Его период полураспада, как и самого гормона, составляет 3 – 4 минуты. У С-концевого пептида, лишённого гормональной активности, этот полупериод достигает 2 – 3 часов (рис. 8.3). Рис. 8.3. Образование и катаболизм паратирина. Цифрами обозначены порядковые номера аминокислотных остатков. В кружочках цифрами показано количество аминоацилов в отщепляющихся пептидах при ограниченном протеолизе препропаратирина и пропаратирина. Гиперфункция паращитовидных желез или гиперпаратиреоз связаны с гипертрофией и гиперплазией ткани или вызывается опухолью, обычно аденомой. Избыточная продукция паратирина приводит к патологически высокому уровню кальция в крови и снижению содержания фосфатов, которые активно выводятся с мочой. Массивная мобилизация кальция из костей вплоть до их рассасывания может быть причиной самопроизвольных переломов. Кальций накапливается во внутренних органах и тканях, что ведет к кальцификации сосудов, печени, почек, желудочно-кишечного тракта. Постоянная гиперкальциемия способствует образованию почечных камней в клубочковом фильтрате. Другими состояниями, сопутствующими гиперпаратиреозу, часто бывает гипертония и язвенная болезнь желудка. Возникновение последней связывают с гиперсекрецией пентагастрина, спровоцированной кальцитонином, вырабатываемым в ответ на гиперкальциемию. Клинически гиперпаратиреоз проявляется нейромышечными и нейропсихическими нарушениями. Нередко имеет место мышечная слабость и атрофия мышц. Могут наблюдаться депрессия, нарушения памяти, концентрации внимания и даже изменения личности. Диагностика гиперпаратиреоза включает одновременные определения паратирина и регулируемого им параметра кальция в сыворотке крови. Это дает более достоверную информацию, чем исследования каждого показателя отдельно. В связи с хирургическим лечением гиперпаратиреоза актуальным становится знание анатомической локализации источника избыточного образования гормона. Этому способствует компьютерная ангиальная томография, радиоизотопные сканирования, артериография и др. Гипофункция паращитовидных желез (гипопаратиреоз) возникает редко и может быть следствием ошибок различных оперативных вмешательств в области шеи. Характерными её признаками являются повышенная нервномышечная возбудимость, судорожные сокращения мышц. Причиной этого считают низкое содержание кальция в крови и межклеточной жидкости. Оно усиливает деполяризацию мембран, вызываемую током Na+ внутрь мышечных и нервных клеток. В лёгких случаях могут наблюдаться лишь парестезии, в более тяжёлых развивается тетания с мышечными спазмами или даже с конвульсиями. Устранить эти явления можно введениями препаратов кальция и паратирина или витамина D. Псевдогипопаратиреоз возникает при снижении чувствительности клетокмишеней к паратирину. Усиление секреции гормона в этих условиях способствует гипертрофии гиперплазии паращитовидных желез, но компенсаторного эффекта не достигает. Кальцитонин, в общем, считается антагонистом паратирина. Этот гормон вырабатывается парофолликулярными С-клетками щитовидной железы, и представляют собой пептид (Мr 3,4 кДа) включающий 32 аминокислотных остатка, из которых семь на N-конце замкнуты дисульфидным мостиком в цикл. Он синтезируется из прокальцитонина с Мr 15 кДа. С-клетки располагают кальциевым сенсором, реагирующим на гиперемию. Считают, что стимулировать секрецию кальцитонина могут также гастрин, глюкагон, секретин, эстроген, холецитонин-панкреозилин. В отличие от паратирина, у которого N-концевой пептид из 34 аминокислотных остатков обладает функцией гормона, кальцитонин активен только в интактном состоянии. Клетки-мишени кальцитонина структурированы в костную ткань и почки. Сигналы гормона в них реализуется по аденилатциклазному пути (рис.4.7, табл. 4.1). Гормон восстанавливает нормальный уровень кальция в плазме крови, оказывая прямое инактивирующее действие на остеокласты. В их плазматических мембранах есть его рецепты, ассоциированные с аденилатциклазой. У женщин в период менопаузы в условиях дефицита эстрогенов выработка кальцитонина замедляется. Это вызывает ускоренную резорбцию костной ткани и приводит к возникновению остеропороза. Последний может быть причиной спонтанных переломов костей. В почках клетки-мишени кальцитонина находятся преимущественно в восходящем колене петли Генле. Здесь он подавляет реабсордцию кальция и фосфора, а также и натрия, калия, магния. В целом кальцитонин является антигиперкальциемическим и гипофосфатемическим гормоном. Там не менее в условиях нормы его вклад в контроль над гомеостазом этих ионов считается более чем скромным. Показано, например, что при нормальной функции паращитовидных желез ни тиреоэктомия, ни создание некоторого избытка кальцитонина не сопровождаются сколько-нибудь существенными нарушениями кальциевого обмена. Однако мдуллярные опухоли щитовидной железы, продуцирующие гигантские количества кальцитонина, ремодолирование минерализованных тканей замедляют. Полагают, что при аномалиях паращитовидных желез роль кальцитониновой регуляции фосфорно-кальциевого обмена возрастает. Хотя физиологическое значение кальцитонина, возможно, мало, нет сомнений в его лечебном действии, особенно при атеросклерозе, гиперпаратиреозе, болезни Педжета. Последняя характеризуется ускорением и резорбции, и воссоздания костей. При этом второй процесс сопровождается дезорганизацией структуры, костей ткани, чреватой возникновением патологических процессов сдавлением окружающих тканей. Применение кальцитонина нормализует резко повышенный круговорот минеральных полипептидов. Кальцитонин может блокировать действие кальцитриола на костную ткань (рис.8.4), приводя к увеличению всасывания кальция в кишечнике без потерь этого иона из костной ткани. Обнаружение кальцитонина в ряде тканей, в частности, в кишечнике, ЦНС, дало основание предположить о его роли в качестве трансмитора. Одним из интересных эффектов проявления этой функции является способность тормозить секрецию пентагастрина. Возможно, в этом состоит его участие в регуляции работы пищеварительного тракта. Уровень кальцитонина повышается у женщин в период беременности и кормления. Это свидетельствует о его роли в предотвращении потерь организмом кальция. Однако фосфатуритическое действие этого гормона трудно согласовать с эффектом его на минерализованные ткани, поскольку снижение уровня фосфата в плазме крови способствует мобилизации кальция из костей. На этот счет Д.Темпермен и Х.Темпермен (1989) приводят провозглашенную Некноном фразу: «Мудрость организма подчас непостижима!» Период полужизни (Т1/2) кальцитонина в плазме крови составляет в среднем 5 минут. Его катаболизм осуществляется в почках. Клинических проявлений недостаточности кальцитонина не выявлено. Гиперфункция этого гормона наблюдается при медуллярной тиреокарциноме. Гипофункция возникает при условии превышения нормы кальцитонина в плазме крови (2 – 400нг/л) в тысячи раз. В действительности витамин D – это гормон. Термин «витамин D» стал условным с тех пор, когда было установлено, что основная часть потребности организма в нем (80%) удовлетворяется за счет синтеза в коже из 7дегидрохолестерола. При этом образуется холекальциферол или иначе витамин D3. Bитамин присутствует в различных пищевых продуктах. В растениях он представлен витамином D2 или эргокальциферолом, в животных продуктах холеферолом. Наиболее богат этим витамином рыбий жир. Суточная потребность в витамине для детей составляет 12 – 25 мкг (5001000 МЕ), для взрослого человека она в десятки раз меньше. Обе формы витамина D лишены биологической активности до тех пор, пока в печени не произойдет их гидроминерализация с образованием 25 (ОН)- кальцеферола (рис.2.7). Далее рассмотрим метаболизм витамина D3, имея в виду его полное совпадение с таковым у витамина D2. Основная часть 25 (ОН) D3 в печени превращается в 23,25 (ОН)2 D3 и 25,26(ОН)2 D3 – неактивные метаболиты, которые сразу же экскретируются с желчью. Малая часть 25(ОН) D3 переносится кровью в почках и там, в клетках проксимальных канальцев, при участии цитохрома Р450 в митохондриальном монооксигенезном окислении превращается в активные формы 1,25 (ОН)2 D3 (кальцитриол) и 24,25 (ОН)2D3 (рис. 2.7, 8.4). B норме второй формы образуется в 10 раз больше, чем первой. Гипокальциемия, гипофосфатемия и высокий уровень паратина стимулируют активность 1-монооксигеназы 25-кальциферола образование 1,25(ОН)2D3 возрастает. При обратных изменениях этих показателей активность указанного фермента падает, и функция 24-монооксидазы 25гидроксикальциферола начинает доминировать. Факторами прямой или опосредованной стимуляции образования кальцитриола считаются также соматотропин, пролактин, эстроген, имеющие более длительные эффекты. Эстрогены, кроме того, стимулируют биосинтез рецепторов к кальцитриолу. В период менопаузы эффективность кальцитриола снижается и всасывание кишечника затрудняется. Кальцитонин подавляет выработку 1,25(ОН)2 D3 (рис.8.4). Гидроксилирование в печени не подчинено контролю по механизму отрицательной связи. В почках продукция активных метаболитов подвергается саморегуляции этим механизмом. Повышение уровня 1,25(ОН)2 D3 тормозит гидроксилирование 25(ОН) D3 по 1-ому положению и образование 24,25(ОН)2 D3 начинает преобладать. Получившиеся активные формы в крови циркулируют в комплексе с витамином D – связывающим белком 2-глобулиновой фракции. Клетками-мишенями кальцитриола, содержащими его специфические рецепторы, являются энтероциты в тонком кишечнике, клетки канальцев почек, остеобласты в костной ткани. Для 24,25(ОН)2D мишенями являются только остеобласты. Гормональные формы витамина D3 реализуют свои эффекты по внутриклеточно – ядерному механизму через цитозольные рецепторы (рис.4.15). В комплексе с ними они проникают в ядро и регулируют активность генома. Рецепторы витамина D3, как и у стероидных гормонов, имеют несколько доменов, в том числе и ДНК-связывающий, включающий аминокислотные последовательности, образующие структуры типа «цинковых пальцев». Сконцевой домен рецептора отвечает за связывание активных форм витамина D3. 1,25(ОН)2D3 по действию на уровень Са2+ в плазме крови похож на паратирин, 24,25(ОН)2D3 в этом смысле является синергистом кальцитонина. В тканях-мишенях кальцитриолу присущ ряд общих эффектов: индукция биосинтеза различных Са2+-связывающих белков; блокада Са2+-зависимых К+-переносящих каналов, приводящая к изменению потенциала плазматических мембран клеток. Всасывание кальция в энтероцитах включает как минимум три этапа: а) захват ионов ворсинчатой поверхностью клеток; б) внутриклеточный транспорт; в) выброс кальция через базально-латеральную мембрану во внеклеточную жидкость и в кровь. Кальцитриол ускоряет этот процесс за счёт изменения заряда мембран и синтеза Са2+ связывающих белков кальбиндинов, участвующих во всех стадиях этого процесса. Другой важный эффект 1,25 (ОН)2D3 на клетки кишечника заключается в повышении всасывания фосфатов. Молекулярный механизм этого эффекта неизвестен. В дистальных извитых канальцах почек кальцитриол стимулирует реабсорбцию кальция, а в проксимальных канальцах – фосфатов. Полагают, что Са2+ преодолевает мембраны клеток здесь, так же как и в энтероцитах, только Са2+ связывающие белки синтезируются другие. В костной ткани кальцитриол повышает активность остеобластов, которые начинают усиленно синтезировать остеокальцин. Последний, выступая в роли факторов хемотоксина остеокластов, стимулирует их лизирующую функцию. Резорбция минерального компонента ускоряется. Результатом всех рассмотренных эффектов является поступление кальция и фосфатов в плазму крови. Что касается 24,25(ОН)2D3, то он усиливает в остеобластах биосинтез коллагеновых белков. Это в клетке ускоряет остеогенез и поступление в костную ткань кальция и фосфатов. Их содержание в плазме крови снижается. Поскольку во многих тканях к кальцитриолу имеются рецепторы, это даёт основание говорить о наличии у него дополнительных эффектов помимо роли в гомеостазе кальция и фосфора. Ими являются усиление выработки ряда цитокинов, стимуляция клеточной дифференцировки, участие в иммуномодуляции. Рис.8.4. Контроль синтеза кальцитриола в клетках проксимальных канальцев почек и его основные функции. Кальцитриол увеличивает концентрацию кальция и фосфатов в плазме крови. Цифрами в кружочках обозначены: 1) 1монооксигеназа 25-гидроксикальциферола; 2) Гормоны соматотропин, пролактин, эстрогены стимулируют биосинтез кальцитриола; 3) Гормон кальцитонин подавляет выработку кальцитриола; + Стимуляция; Ингибирование. Проявлением нарушений регуляции фосфорно-кальциевого обмена витамином D при его дефиците является рахит. Его можно охарактеризовать, как неспособность костного матрикса минерализоваться с нормальной скоростью. Рахит – нарушение, проявляющееся в период роста организма. Именно в это время может возникнуть несоответствие между непрерывной наработкой органического матрикса остеобластами и формированием на нём минерального компонента. Эти несовпадения могут оказаться проявлениями наследственных заболеваний, таких как кальцитриол-зависимый рахит I или II типа. В первом случае наблюдается недостаточность почечной 1-монооксигеназы 25гидроксикальциферола (см. рис.2. ,8.4), во втором – нечувствительность клетокмишеней к действию кальцитриола. Наследование в обоих случаях аутосомнорецессивное. Алиментарный рахит является результатом недостатка в пище продуктов содержащих витамин D, или недостаточное воздействие солнечных лучей. В кишечнике нарушается всасывание кальция. Чтобы обеспечить костную ткань необходимым ей кальцием, увеличивается секреция паратирина, мобилизующего его из костей. При этом одновременно мобилизируются и фосфаты. Паратирин усиливает их выведение с мочой и возникает, гипофосфатемия. По мере прогрессирования процесса уровень фосфора в плазме падает до такой степени, что не может обеспечить нормальную минерализацию. Поскольку при этом продукция коллагена продолжается в обычном темпе, накапливается минерализованный остеоид. Клинические симптомы вначале едва заметны. Чаще всего это апатия, гипотония и слабость мышц. Затем ребёнок становится раздражительным. Поражение костей проявляется выбуханием лобных бугров, поздним закрытием переднего родничка, деформацией скелета (рахитические «чётки» на границе костной и хрящевой ткани рёбер и грудины, искривление нижних конечностей по О- или Х-типу). Первые зубы появляются с запозданием, они, как правило, деформированы. У взрослых людей дефицит функции витамина D3 проявляется размягчением костей, называемым остеомаляцией. Относительная недостаточность витамина D может возникать при заболеваниях печени и почек, так как эти органы принимают участие в образовании его активных форм. Причиной гипервитаминоза D может быть нерациональное применение концентрированных растворов этого витамина, используемых для профилактики и лечения рахита, туберкулёза кожи т.д. Гипервитаминоз D проявляется раздражительностью, слабостью, тошнотой, рвотой, жаждой, головными болями, потерей аппетита. Возникают характерные признаки выведения Са2+ из костей – их деминерализация (остеопороз) и склонность к переломам. Уровень кальция в крови резко повышается. Это приводит к кальцификации внутренних органов – печени, почек, лёгких, стенок сосудов и др. В медицинской практике применяют природные препараты витамина D (рыбий жир) и синтетические аналоги (эргокальциферол, холекальциферол) для профилактики и лечения рахита и для лечения других заболеваний (туберкулёз костей, кожи). Нарушение регуляции фосфорно-кальциевого обмена наблюдается и при болезни Педжета. Данное заболевание, этиология которого неизвестна, характеризуется усилением активности остеокластов, что в свою очередь, вызывает активизацию остеобластов и образование новой костной ткани. Последнее имеет часто дезорганизованную структуру. Кости истончаются, искривляются, становятся болезненными, хрупкими, могут возникать патологические переломы. Это заболевание в основном возникает у пожилых людей. Диагностике его помогает выявление чрезвычайно высокой активности щелочной фосфатазы в сыворотке крови, вследствие активации метаболической активности остеобластов. Определение этого показателя в динамике используется для контроля за течением и лечением заболевания. Этому же способствует и определение гидроксипролина в моче, как продукта метаболизма коллагеновых белков. Лечение включает применение анальгетиков и бифосфонатов, угнетающих активность остеокластов. Задание 8.1 1. Назовите величины, характеризующие в среднем количество кальция, фосфора, магния в организме человека. 2. Общие функции, выполняемые кальцием в организме. 3. Составьте схему, отразив в ней основные моменты обмена кальция в тканях и жидкостях. 4. Перечислите основные этапы образования и катаболизм паратирина. 5. Обсудите причины возникновения и симптомы гипер- и гипопаратиреоза. 6. Перечислите основные эффекты кальцитонина. 7. Назовите факторы, контролирующие биосинтез и секрецию кальцитриола. 8. Обсудите проявление дефицита витамина D3 в организме детей и взрослых. 9. Ответьте на вопросы. На какие части принято делить кальций по распределению в тканях и жидкостях организма? Какие формы образует кальций в плазме крови? Что происходит с кальцием в случае его попадания в цитозоль клеток? Как количественно распределяется магний по тканям и органам? Какие функции выполняет магний в организме человека? Какие гормоны влияют на фосфорно-кальциевый обмен? Что такое псевдогипопаратиреоз? Какие гормональные формы образуют витамин D? Как действуют гормональные формы витамина D3 на фосфорнокальциевый обмен? Что такое гипервитаминоз D? Какие признаки характерны для болезни Педжета? Задание 8.2. Решите тесты: Клетки-мишени: А. Энтероциты Б. Остеобласты В. Клетки дистальных извитых канальцев почек Г. Гепатоциты Д. Клетки проксимальных канальцев почек Кальцитриол повышает уровень Са2+ в плазме крови, стимулируя: А. Освобождение Са2+ из цистерн цитоплазмы клеток и митохондрий Б. Всасывание Са2+ в кишечнике В. Реабсорбцию Са2+ в дистальных извитых канальцах почек. Г. Выделение Са2+ через потовые железы Д. Резорбцию минерального компонента в костной ткани Гормонам присущи эффекты: 1. Кальцитонину А. Индукция биосинтеза различных 2. Кальцитриолу Са2+-связывающих белков 3. Пратирину Б. Стимуляция функции остеокластов 4. 24,25(ОН)2-кальциферолу опосредованно В. Инактивирующее влияние на остеокласты Г. Ускорение биосинтеза коллагеновых белков в остеобластах Признаками рахита у детей являются: А. Деформации скелета Б. Самопроизвольные переломы костей В. Позднее прорезывание зубов Г. Остеопороз Д. Позднее закрытие родничков черепа Оцените достоверность утверждений в предложениях и связь между ними: Паратирин усиливает синтез остеокальцина, поэтому он стимулирует Остеогенез. Кальцитриол повышает скорость образования остеокальцина, поэтому он ускоряет процесс минерализации костной ткани. Задание 8.3. Решите задачу: У мужчины 38 лет наблюдается мышечная слабость и атрофия мышц. Ухудшилась память, он часто впадает в депрессию. В плазме крови повышен уровень Са2+ и снижено содержание фосфатов. Иммунореактивный паратирин в сыворотке крови составляет 150 мг/л, что значительно выше нормы (10 – 65 мг/л). Рентгенологически выявлена деструкция костной ткани. Укажите патологию, для которой характерны данные признаки. 9. Гормоны, регулирующие репродуктивную функцию организма. Репродуктивная система человека включает гипоталамус, гипофиз, половые железы, ткани-мишени половых гормонов. Гипоталамус участвует в этом, синтезируя и секретируя гонадолиберин (см. табл. 2.1, рис. 9.1). Последний стимулирует выделение из аденогипофиза фоллитропина, лютропина (см. табл. 2.2, рис 9.1). А они, в свою очередь, стимулируют функцию половых желез. Эти железы, обладая способностью к смешанной секреции, в кровь выделяют половые гормоны, наружу продуцируют сперматозоиды, яйцеклетки. Гормональные отличия у людей обоих полов носят и качественный, и количественный характер. Секреция половых гормонов, контролируемая гонадотропинами аденогипофиза, осуществляется у мужчин по ациклическому, у женщин по циклическому типу. В мужском организме лютропин, имеет рецепторы на клетках Лейдига, структурированных в соединительную ткань между извитыми семенными канальцами яичек. Связываясь с ними, он стимулирует синтез и секрецию тестостерона и эстрогенов. Клетки Лейдига секретируют 80% эстрогенов, вырабатываемых в организме мужчины. Остальное количество этих гормонов (20%) синтезируется в коре надпочечников и клетках Сертолия. Последние, являются к тому же мишенями другого гонадотропного гормона аденогипофиза фолитропина и стероида тестостерона. Эти клетки расположены на базальной мембране извитых семенных канальцев. Считается, что они поддерживают гаметы, выстилающие стенки канальцев гамет с их предшественниками. Последние находятся на различных стадиях дифференцирования: сперматогонии, сперматоциты первого и второго порядков, сперматиды, сперматозоиды. Клетки Сертоли обеспечивают их питательными веществами, поглощают продукты метаболизма, фагоцитируют остатки цитоплазмы, образующиеся в ходе формирования сперматозоидов. Через клетки Сертоли фоллитропин и тестостерон оказывают влияние на сперматогенез. Однако для этого их совместное присутствие не является обязательным. Рис. 9.1. Схема репродуктивной системы организма. Выработка фоллитропина и лютропина происходит с момента полового созревания в течение всего репродуктивного возраста циклически у женщин и ациклически у мужчин. Гормоны половых желез по механизму обратной связи регулируют активность гипоталамуса и гипофиза. Условно обазначены: + стимуляция; − снижение. Фоллитропин и тестостерон побуждают клетки Сертоли синтезировать ряд химических соединений, выполняющих важные функции. Усиливается биосинтез апурогенсвязывающего белка, представляющего собой гликопротеин. Он отвечает за поддержание высокого уровня тестостерона в жидкости семенных канальцев. Этот белок секретируется в просвет канальцев и переносит тестостерон из клеток Лейдига к местам сперматогенеза. Эффект усиления биосинтеза андрогенсвязывающего белка сопряжён с накоплением мРНК, кодирующей его структуру. Трансферрин обеспечивает доставку железа в сперматогенный эпителий для последующего обеспечения им образующихся сперматозоидов. Активаторы плазминогена контролируют протеолитические реакции, играющие важную роль в миграции сперматозоидов из базального пространства. Эстрогены образуются из тестостерона, поступающего сюда из клеток Лейдига путём ароматизации А-цикла. Этим клетки Сертоли влияют на образование тестостерона. Эстрогены связываются с рецепторами в клетках Лейдига и подавляют биосинтез тестостерона. Важным продуктом систематической активности клеток Сертоли является ингибин. Он представляет из себя гликопротеин (см. табл. 2.3) (Мr 31 кДа), состоящий их двух субъединиц (α или А с Мr 18 кДа, β или В с Мr 13 кДа), соединённых нестойкими дисульфидными связями. Выделяясь в ответ на сигналы фоллитропина, он подавляет дальнейшую выработку его самого по механизму отрицательной обратной связи. По механизму положительной связи с аденогипофизом реализует свои сигналы другой полипептидный гормон клеток Сертоли активин (см. табл. 2.3). Он стимулирует секрецию фоллитропина. Ингибин и активин считаются ключевыми гормонами, контролирующими сперматогенез. Вместе с тем, следует отметить, что константа сперматообразования у взрослого человека составляет 74 дня. Этим объясняется отсутствие изменений функциональной активности сперматогенного эпителия и количество сперматозоидов более двух месяцев в ответ на какие-либо острые воздействия. Биосинтез гонадолиберина в гипоталамусе и лютропине в аденогипофизе угнетается тестостероном. С возрастом отмечается некоторое снижение содержания тестостерона и количества спермы. Тем не менее, резкого прекращения функции половых желез, как это происходит у женщин в период менопаузы и в последующем периоде у мужчин не бывает. У женщин в аденогипофизе синтезируются все три гонадотропина. Выработка их задает тон процессам, получившим название «половые циклы». Они включают два тесно сопряженных процесса: яичниковый (овариальный), происходящий в яичниках, и маточный или менструальный осуществляющийся в матке. Их суммарная длительность чаще всего составляет 28 дней. В период овариального цикла (1-ый – 14-ый дни) фоллитропин в яичнике способствует развитию фолликулов, которое происходит по схеме: примордиальный, первичный, вторичный, третичный (графов пузырек). Примордиалные фолликулы покрыты одним слоем фолликулярных клеток, совокупность которых называют тека гранулеза (theca granulosa) или просто гранулеза, и окружена базальной мембраной. Рецепторы фоллитропина образуются в клетках гранулеза. При рождении девочки в яичниках содержится около двух миллионов примордиальных фолликулов. С наступлением полового созревания их остается 200 400 тысяч. Из них 98% в течение репродуктивного периода погибают, 2% достигают стадии первичного фолликула и последующих этапов их преобразования. Не более 400 из них трансформируются в графовы пузырьки и подвергаются овуляции. Остальные претерпевают атрезию. Рост фолликулов стимулирует инсулиноподобный фактор роста I (ИФР I). На стадии вторичных фолликулов появляется доминантный, опережающий в развитии остальные. В составе его оболочки различают внутреннюю часть (theca interna), образованную интерстициальными клетками и наружную (theca externa), сформированную соединительной тканью. В клетках theca interna, часто называемой просто тека, появляются рецепторы лютропина. С их участием в клетках теки он стимулирует синтез андрогенов (андростендиона и тестостерона). Андрогены через базальную мембрану переходят в клетки гранулезы и там, как это ни парадоксально, превращается в эстрогены (рис. 2.6) А.Ленинджер (1985) на этот счёт с иронией восклицает: «Поистине, не только из ребра Адама была создана Ева». Основным женским половым гормоном является эстрадиол. Другие из них (эстрон, эстриол) синтезируются в малых количествах. Реакции биосинтеза эстрадиола из тестостерона, протекающие в эндоплазматическом ретикулуме клеток гранулеза катализируют три фермента ароматического комплекса (рис. 9.2). Для протекания реакции требуется О2, НАДФ·Н + Н+, НАД+ . Рис. 9.2 Превращение тестостерона в эстрадиол. При реакции этого процесса катализируется ферментами ароматазного комплекса: 1.19 – цитохром Р450 монооксигеназой; 3. 10, 19 лиазой. Биосинтез протекает в эндоплазматическом ретикулуме клеток гранулеза яичников. Следует отметить, что биосинтез эстрадиола ускоряется фоллитропином, активирующим ароматазный комплекс. Этот гормон аденогипофиза стимулирует продукцию фолликулярными клетками ингибина. Выделяясь в кровь, эстрогены и ингибин по механизму отрицательной обратной связи блокируют высвобождение фоллитропина (рис. 9.1) и одновременно инициируют секрецию лютропина. Считают, что при низком содержании эстрогенов и ингибина в крови гонадолиберин стимулирует в аденогипофизе активность клеток, продуцирующих фоллитропин. Высокий их уровень активирует секреторную функцию клеток, нарабатывающих лютропин. К 15-ому дню образование лютропина становится доминирующим. Фоллитропин, эстрогены, лютропин, присутствуя в определенной концентрации в период с 12-го по 14-ый дни и действуя совместно, способствуют усиленному синтезу в фолликуле протеолитических ферментов на уровне транскрипции и трансляции, приводящему к разрушению фолликулярной стенки и выходу яйцеклетки из яичника в брюшную полость (овуляция). Зрелая яйцеклетка захватывается ворсинками фаллопиевых труб и движется по направлению к слизистой оболочке матки. На месте бывшего фолликула под влиянием лютропина формируется важнейшая железистая структура яичников, состоящая из особых лютеиновых клеток – желтое тело. Основной функцией его является выработка прогестерона и его аналогов (рис. 2.6). Активность этого гормона становится преобладающей в организме женщины с 15-го дня. Он тормозит секрецию лютропина и стимулирует выделение пролактина в аденогипофизе. В матке прогестерон побуждает эндометрий к дальнейшему утолщению и усиливает его васкуляризацию и секреторную активность. А начинаются эти процессы ещё раньше под действием эстрогенов. Происходит подготовка эндометрия и имплантации яйцеклетки в случае ее оплодотворения. Далее события могут развиваться по двум вариантам. В отсутствие оплодотворения желтое тело регрессирует в связи со снижением уровня лютропина. Это сопровождается уменьшением выработки прогестерона и эстрадиола. Их снижение приводит на 28-ой день к гибели клеток. Эндометрий дегенерирует, отторгается, поступает в полость матки и экскретируется (менструация). Низкий уровень прогестерона по принципу отрицательной обратной связи усиливает биосинтез гонадолиберина в гипоталамусе. Инициируется новая половой цикл. По второму варианту в случае оплодотворения желтое тело не только не регрессирует, а увеличивается. Во время беременности формируется еще одна эндокринная железа в организме женщины плацента. Она вместе с тканями развивающегося эмбриона секретирует в крови прогестерон, хорионический гонадотропин (хориогонадотропин), плацентарный лактоген, тиреотропин, эстрогены, андрогены (см. табл. 2.3). Еще активнее она это делает после лизиса в яичнике желтого тела. Эти гормоны изменяют метаболизм в женском организме, создают условия для роста и развития плода, сохраняют беременность на всех ее стадиях, подготавливают молочные железы к будущей лактации. К концу беременности уровень хорионического гонадотропина, а затем и прогестерона падает. Фетальный кортизол ускоряет эти изменения. Материнские и дистальные клетки выделяют F22 и окситоцин, стимулирующие сокращения матки и наступление родовой деятельности. Все половые гормоны синтезируются из общего предшественника холестерола (рис. 2.6). Многие стадии их образования совпадают. Этим объясняют присутствие андрогенов и эстрагенов у лиц противоположного пола. Биосинтез тестостерона в яичках и коре надпочечников может идти путем образования из дегидроэпиандростерона или через прогестерон в качестве промежуточного продукта (рис. 2.6). Его суточная секреция у мужчин может достигать 5 мл. Выше было отмечено, что эстрогены синтезируются в яичниках путем ароматизации андрогенов (тестостерона, андростендиона) с участием ароматазы (рис. 2.6). Они могут нарабатываться в коре надпочечников, адипоцитах, гепатоцитах, желтом теле, фетоплацентарном комплексе, где выявляется высокая ароматазная активность. В крови подавляющая часть половых гормонов циркулирует в комплексе со специфическими белками глобулиновой фракции и альбуминами, связывающими как тестостерон, так эстрадиол. Лишь 2% андрогенов и 5% эстрогенов транспортируются в крови в свободном виде и именно с этими молекулами связано проявление их гормональной активности. В клетках тканей-мишеней тестостерон может превращаться в более активный 5α-дигидротестостерон в реакции восстановления с участием НАДФ•Н+Н+-5α-стероидредуктазы (рис. 9.3). Рис.9.3. Реакция образования активного дигидротестостерона. Оба андрогена обладают одинаковым спектром эффектов, но 5αдигидротестостерон более активен в одних тканях, а тестостерон, служащий для первого прогормоном, в других. У 5α-дигидротестостерона ими являются, например, предстательные железы, сальные железы, волосяные фолликулы, у тестостерона – мышцы. Формирование пола предопределено не только половыми хромосомами, но и особенностями секреции половых гормонов гонадами в эмбриональном периоде. Начало развития половых желез проходит на разных стадиях эмбриогенеза. Фетальные клетки Лейдига синтезируют тестостерон, необходимый для дифференцировки вольфовых протоков в мужских половых структурах (предстательная железа, семенные пузырьки, мошонка, мужской половой орган). В женском организме вольфовы протоки дегенерируют. Андрогены в этот период осуществляют половую дифференцировку гипоталамуса. После достижения половой зрелости он обеспечивает секрецию гонадотропинов в аденогипофизе по мужскому типу (ациклическая). В отсутствие андрогенной активности в период эмбриогенеза развития гипоталамус идёт по женскому типу и в будущем секреция гонадотропинов окажется циклической (женский тип). Клетки Сертоли яичек плода секретируют мюллеров ингибирующий фактор, показываемый еще гликопротеиновый фактор роста («тормозная мюллерова субстанция»). Этот фактор вызывает регрессию мюллеровых протоков у плода мужского пола, что предотвращает их развитие в женские половые структуры (матка, фаллопиевы трубы, верхние две трети влагалища). После рождения яички продолжают еще в течение 5-6 месяцев выделять тестостерон под действием гонадолиберина гипоталамуса и лютропина аденогипофиза. Затем их выработка падает до очень малых величин и так продолжается до полового созревания. Механизм этого торможения гонадной оси остается неясным. В пубертатном периоде эта ось начинает функционировать. Наблюдается также повышение выработки корой надпочечников дегидроандростерона (рис. 2.6), являющегося слабым андрогеном, и значительное увеличение в печени продукции фактора роста ИФР I. Механизм возобновления активности гонадной оси остается не до конца выясненным. Первый физический признак начала пубертатного периода (9,5 13,5 лет) является увеличение яичек, сопровождающийся существенным возрастанием секреции тестостерона, и началом выработки спермы. Формирующиеся в последующем вторичные половые признаки характеризуются возрастанием мышечной массы, ростом волос на лице и теле, увеличением размеров хрящей гортани и утолщением голосовых связок с формированием характерного мужского тембра голоса, повышением секреторной активности сальных желез. Частым процессом может быть увеличение роста скелета. Андрогены предопределяют поведенческие реакции полового влечения и психологические особенности мужчины. В клетках-мишенях их сигналы реализуются, как и у других стероидных гормонов внутриклеточно-ядерному механизму (рис. 4.15). Рецепторы андрогенов, локализованы в ядрах, содержат ДНК-связывающие области. Через них гормоны активируют транскрипцию специфических генов. Будучи сигнальными молекулами с анаболическим действием, андрогены усиливают биосинтез белков в мужских половых органах, скелетных мышцах, почках, миокарде, печени, слюнных, потовых, сальных и молочных железах. Тестостерон индуцирует синтез белков в хондроцитах хрящевой зоны роста и в остеобластах, что способствует усилению минерализации и увеличению массы костной ткани. Он также повышает образование ингибитора остеоиндукции и поэтому с наступлением половой зрелости рост скелета прекращается. В практическом отношении наиболее востребованным оказался анаболический эффект андрогенов. Синтезирован ряд стероидных соединений, близких по структуре к мужским половым гормонам и обладающих избирательной анаболической активностью. Анаболические стероиды оказывают положительное влияние на азотистый обмен и применяются при заболеваниях, протекающих с истощением, нарушениями роста, и физического развития у детей. Их применяют также для стимуляции сращивания костей при переломах и повышении мышечной массы организма. К числу этих препаратов относятся перабол, феноболин, ретаболин, силаболин, метиландростендион и другие. Стимулирующее влияние на транскрипцию мРНК, содержащих информацию о различных ферментах, является основным звеном механизма действия андрогенов на обмен углеводов, липидов, трансформации энергии в ИПФ. Тестостерон увеличивает скорость биосинтеза гиалуроновой кислоты в ряде тканей (клапаны сердца, кожа и др.). Повышая активность ферментов альдозоредуктазы и кетозоредуктазы, он способствует увеличению содержания фруктозы в секрете семенных канальцев, которая используется сперматозоидами как источник энергии. В жировой ткани андрогены усиливают липолиз, β-окисление жирных кислот, сопровождающиеся освобождением энергии. Установлено, что они активируют биосинтез глицерофосфолипидов участвующих в построении биомембран. Повышенное образование андрогенов служит одним из факторов, предраспологающих к возникновению подагры, которой мужчины болеют в 20 раз чаще, чем женщины и дети обоих полов. Период полу жизни (Т1/2) тестостерона составляет 30 – 40 минут. Распад его происходит в основном в печени по пути окисления в 17-м положении с образованием 17-кетостероидов. Последние затем конъюгируются с глюкуронатом (рис. 9.4) или сульфатом (рис. 9.5) с образованием парных соединений. По сравнению с исходными стероидами конъюгаты лучше растворимы в воде и легко экскретируются. Из печени они выводятся рецепторзависимой экскрецией в желчные капилляры или попадают в кровь, откуда выводятся почками за счет фильтрации. Количественные их определения в моче ранее даже использовали для суждения об андрогенном статусе мужского организма. Позже оказалось, что этих данных для решения указанного вопроса недостаточно. Рис. 9.5 Инактивация стероидных гормонов в печени путем конъюгации с сульфатом (фермент сульфотрансфераза, кофермент ФАФС) и выведение конъюгатов в кровь, мочу или желчь, кал). Другим, менее значимым путем катаболизма тестостерона, протекающим в основном в тканях-мишенях, являются восстановление по месту двойной связи в цикле А и 3-кето(оксо)-группы. Нарушения функции гонадной оси в мужском организме делятся на состояния, возникающие при расстройствах процесса нормального развития, и появляющиеся уже после стабилизации нормальной работы репродуктивных органов. В первом случае недостаточность половых желез может быть следствием анатомических дефектов или пороков развития. Известно, например, несколько генетических дефектов биосинтеза ферментов участников метаболизма тестостерона. Ими могут оказаться недостаточность 5αстероидредуктаза, нарабатывающая дигидротестостерон. Изменения порой касаются рецепторов этих гормонов. Они или совсем не обнаруживаются, или существенно изменены. Как следствие наблюдается полная феминизация наружных половых органов при наличии семенников и секреции тестостерона. Во втором случае патологией репродуктивной системы в постпубертатном периоде часто является гипогонадизм. Этим термином принято обозначать нарушения или сперматогенеза, или продукции тестостерона. Гипогонадизм бывает первичный, возникающий при заболеваниях яичек, или вторичный, как следствие поражений гипоталамуса или гипофиза (гипогонадотропный гипогонадизм). Синдромы гиперфункции репродуктивной оси наблюдается относительно редко. Они могут быть проявлением избыточной секреции гонадотропинов или гиперфункцией яичек. Иногда наблюдается раннее половое созревание. Диагностика всех названных состояний требует больших усилий. Проводят измерения концентрации свободного тестостерона в сыворотке крови. Определение содержания лютропина особенно важно выполнять при диагностике гипогонадизма, так как он стимулирует выработку и секрецию тестостерона. Уровень фоллитропина, усиливающего сперматогенез, повышается при недостаточности функции семенников яичек и снижении в связи с этим продукции спермы. Повышение концентрации пролактина у мужчин вызывают дисфункцию гонадной оси. Их определяют в случаях бесплодия и импотенции. Для выявления синдрома Клайнфелтера (встречается у 1 из 1000 новорожденных мальчиков), характеризующегося наличием дополнительной Х-хромосомы (кариотип 47 ХХY), применяют помимо всего визуализирующие методы диагностики. С этой целью проводят рентгенографию грудной клетки и черепа, компьютерную и магнитно-резонансную томографии, ультразвуковое исследование. Проверяют функции аденогипофиза и надпочечников. Наличие эстрогенов не является обязательным для развития первичных женских половых признаков. Вместе с тем они необходимы для созревания репродуктивных органов – матки, влагалища, фаллопиевых труб. Эстрогены также стимулируют развитие молочных желез и отвечают за депонирование жира в организме по женскому типу, их концентрация меняется в широких пределах в течение половых циклов у женщин в результате появления относительного ферментативного блока, в стероидогенезе усиливается образование прогестерона. Этот гормон стимулирует развитие железистой ткани молочных желез, а во время беременности отвечает за ее сохранения. Одним из первых признаков полового созревания у женщин является развитие груди, инициируемое эстрогенами. Оно начинается в среднем в возрасте 9,5 лет. В это же время начинается рост подмышечных и лобковых волос. В течение следующего года усиленно растет скелет. Менструации начинаются примерно в 12,5 лет. Вначале они бывают нерегулярными и объем выделений небольшой. Ритм их стабилизируется через год-полтора. В течение жизни женщины только часть овариальных фолликулов созревает до овуляции. Большинство их регрессирует с наступлением менопаузы примерно в 51 год. К этому возрасту выработка эстрогенов падает, и появляются скоротечные эпизоды внезапного ощущения жара и потоотделения. Слизистая оболочка влагалища постепенно атрофируется. Потери минеральных компонентов костной ткани усиливаются, что повышает риск развития остеопороза и связанных с ним угроз переломов бедра или позвонков. С наступлением менопаузы исчезает относительная защита женского организма от угрозы возникновения атеросклероза. Уменьшается благоприятное воздействие эстрогенов на липидный обмен и состояние кровеносных сосудов. Если же оценивать влияние эстрогенов на обмен липидов в период их активной секреции, то следует отметить, что они ускоряют биосинтез ЛВП. Это способствует поддержанию низких значений коэффициента атерогенности крови, как и индекса атерогенности (ИА). Отметим, что: в норме ≤ 3, а в норме ≤ 1,2. Другие метаболические эффекты эстрогенов состоят в стимуляции по внутриклеточно-ядерному механизму биосинтеза белков в различных тканях, они имеют рецепторы в остеокластах и остеобластах, поэтому их действие здесь неоднозначно. В остеобластах ими усиливается биосинтез α-фактора некроза опухолей (белок из 157 аминокислотных остатков), инициирующего их апоптоз. Указанный фактор связывается со специфическими для него рецепторами и запускает многоступенчатый процесс белок-белковых взаимодействий, завершающийся активированием цистеиновых протеиназ. Эти ферменты расщепляют поли-(АДФ-рибозил)-полимеразу, белки SN-рибонуклеинового комплекса, белок ядерной мембраны ламин и другие. Протеолитические измененные белки инициируют апоптоз остеокластов. Резорбция костной ткани замедляется. Указанные эффекты эстрогенов на свертывающую и активирующую системы могут способствовать развитию тромбоэмболической болезни. Их воздействие на ренин-ангиотензиновую систему инициирует у женщин увеличение артериального давления. Вследствие ускорения биосинтеза ЛВП снижается предрасположенность женщин в репродуктивном возрасте к атеросклерозу и инфаркту миокарда в отличие от мужчин аналогичного возраста. Особенностью действия эстрогенов на обмен холестерола в гепатоцитах является снижение образования из него желчных кислот (корепрессоры биосинтеза 7--монооксигеназы). Желчь при этом перенасыщается холестеролом и содержит мало желчных кислот. Это приводит к образованию желчных камней и объясняет причину склонности женщин к заболеванию желчнокаменной болезнью. Эстрогены индуцируют биосинтез ферментов гликолиза и пентозофосфататного пути распада глюкозы. Кроме того, эстрогены действуют на макрофаги предшественники остеокластов и блокируют образование последних. Это также способствует снижению скорости резорбции костей. Ускорение женскими половыми гормонами биосинтеза интерлейкина-1 (ИЛ-1) способствует увеличению количества остеобластов. В них синтезируются коллаген I типа, белок остеопонтин, щелочная фосфатаза. В итоге это проявляется ускорением остеогенеза. В период полового созревания эстрогены активируют образование ингибитора остеоиндукции и рост костей прекращается. В печени эти гормоны стимулируют биосинтез белков-переносчиков глюкокортикоидов, половых и тиреоидных гормонов. Под их влиянием здесь же ускоряется выработка факторов системы свертывания крови (II, VII, IX, X) ЛОНП, ЛВП, ангиотензиногена субстрата ренина, катализирующего образования ангиотензина I, (см. рис. 7.5), превращающегося затем в ангиотензины II, III. Эстрогены уменьшают образование антитромбина III, являющегося антикоагулянтом, а также образование жирных кислот и триациглицеролов в тканях. Это обеспечивает создание жировых депо, характерных для женского организма. Воздействие эстрогенов на сосуды гладкой мускулатуры состоит в усилении образования оксида азота (см. рис. 4.9), что вызывает их расширение и усиливает теплоотдачу. Период полу жизни эстрогенов Т1/2 составляет 30 40 минут. В печени эстрадиол гидроксилируется по атому С2 и при участии УДФГК образует конъюгаты с глюкуроновой кислой (рис. 9.4). Эстрон, эстриол присоединяют преимущественно сульфатные группы, поставляемые ФАФС. Конъюгированные продукты, будучи водорастворимыми химическими соединениями, легко выделяются с желчью, калом, мочой. Нарушения репродуктивной системы в женском организме могут проявляться как снижением функциональной активности гонад, так и ее повышением. Кроме того, эндокринные дисфункции яичников делят на препубертатные, относящиеся к репродуктивному периоду, а также к менопаузе и постменопаузе. Наиболее частой причиной женского бесплодия является гипогонадизм с аменореей, т.е. с отсутствием менструаций. Различают первичную и вторичную. Аменорея может быть следствием как тяжелого острого, так и продолжительного хронического стресса, тяжелых физических нагрузок, хронических заболеваний, при атрофии эндометрия в связи с его травмами при выскабливании, в случаях применения лекарственных препаратов (адренергические, дефоминэргические и др. средства). Эти факторы инициируют расстройства гипоталамо-гипофизарной секреции, вследствие чего нарушается согласованность в выработке фоллитропина и лютропина. А в результате изменяется функциональное состояние яичников, матки. При этом, как правило, функционирующие фолликулы выявляются, но происходят ановуляторные циклы. Синдром истощенных яичников характеризуется исчерпанием запаса примордиальных фолликулов к 37-38-летнему возрасту, вместо 51 года. Он проявляется симптомами, сходными с постменопаузальным периодом. Ими могут быть приливы крови к голове, потливость, раздражительность, депрессия, аменорея, бесплодие. Этот синдром может быть следствием перенесенных инфекций, аутоиммунных поражений гонад, пернициозной анемии и т.д. Реже встречается первичная аменорея, вызванная генетически детерминированным недоразвитием половых органов, которые могут быть резистентными к гонадотропным воздействиям. Так с частотой 1/30000 женщин встречается синдром 45х0. Яичники представлены тяжами соединительной ткани, внутренние гениталии рудиментарны, развитие вторичных половых признаков задержано. Аменорея сопряжена гипоэстрогенной ановуляцией. Первичная врожденная овариальная недостаточность с аменореей характерна и для некоторых наследственных эффектов стероидогенеза в связи с дефицитом 17--монооксигеназы или 17, 20-лиазы (см. рис. 6.9). Избыток альдостерона в этом случае ведет к гипертензии, недостаток эстрогенов характеризуется половым инфантилизмом с аменореей. Одной из форм первичной овариальной недостаточности является синдром поликистоза яичников. При этом вследствие врожденной недостаточности ферментов, катализирующих превращения андрогенов в эстрогены (рис. 9.4), возникает избыток андросендиона, тестостерона. Это препятствует созреванию фолликулов. Яичники увеличиваются в размерах. Их капсула утолщается. В них появляются множественные мелкие фолликулярные кисты. Синдром изначально был описан как сочетание хронической ановуляции и гиперандрогенизма. Гипергонадизм может проявляться преждевременным половым созреванием, когда полный набор его признаков появляется у девочек восьми лет и младше. Оно может быть связано со стимуляцией продукции гонадотропинов или пониженной секрецией, но повышенном уровне половых гормонов яичников или надпочечников, где они также могут синтезироваться. Причиной гиперпродукции гонадотропинов бывают опухоли, другие очаговые процессы, энцефалиты, менингиты с вовлечением гипоталамуса, гипофиза. Эстрогенообразующие опухоли овариального и надпочечникового происхождения служат причинами избытка эстрогенов в организме. Прогестерон – реально значимый представитель группы прогестинов (С21-стероид) является важным промежуточным продуктом синтеза стероидных гормонов (рис. 2.6). Как собственно гормон он синтезируется в клетках теки (theca interna) фолликула и особенно в желтом теле, формирующимся внутри яичника из остатков фолликула в лютеиновую фазу. Он вырабатывается и в плаценте в случае наступления беременности (см. табл. 2.3). Его концентрация в плазме крови достигает максимума (40 50 нмоль/л) во второй половине менструальной стадии полового цикла. Затем она снижается, если не происходит оплодотворения. Прогестерон транспортируется в крови в комплексе с альбуминами и белком α1-глобулиновой фракции транспортином. Концентрация этого белка в крови увеличивается во время беременности. В связанной с белками форме прогестерон оказывается водорастворимым и биологически негативным. В плазме крови он связывается также с α1-(кислотным) гликопротеином. Его еще называют орозомукоидом. В свободном состоянии находится только 1 2% молекул прогестерона. Именно эти молекулы реализуют свои гормональные сигналы. Во время беременности они запускают все ее программы. Действуя через цитозольные рецепторы (рис. 4.15), они инициируют комплекс изменений в матке, кторые нужны для имплантации оплодотворенной яйцеклетки, активируют секрецию желез эндометрия, подавляют его сокращения, тормозят в нейрогипофизе секрецию окситоцина, способствует гиперфункции железистых клеток в грудных железах. Обладая иммуносупресорным эффектом, прогестерон ускоряет дифференцировку тимоцитов в вилочковой железе. Он также усиливает выработку в печени некоторых белков острой фазы. Этот гормон способствует повышению температуры тела на 0,3˚С в лютеиновую фазу овариальноменструального цикла. Период полужизни прогестерона (Т1/2) в крови составляет 5 минут. Катаболизм прогестерона в печени включает превращение его в неактивный принандиол. Конъюгирование последнего с УДФТК и выделение с мочой в виде эфира с глюкуроновой кислотой (рис. 9.4). Задание 9.1. 1. Назовите органы и ткани, формирующие репродуктивную систему человека, и обсудите роль каждого из них в ее «работе». 2. Напишите реакции, катализируемые ароматазным комплексом и 5αстероидредуктазой. 3. Ответьте на вопросы: Чем отличаются мужской и женский типы выработки гонадотропинов и половых гормонов? Какие клетки являются мишенями для фоллитропина и лютропина в мужских и женских половых железах? В чем заключается основная роль клеток Лейдига, Сертоли в семенниках, а также клеток theca granulose («гранулеза») и theca interna («тека») в яичниках? Что происходит в случае секреции клетками Сертоли яичек плода гликопротеинового фактора роста «тормозной мюллеровой субстанции»? Где и когда вырабатывается прогестерон? Его биологическая роль и метаболическая судьба? Какие метаболические эффекты характерны для андрогенов? Почему с наступлением менопаузы у женщин исчезает относительная защита от угрозы атеросклероза, остеопороза, но снижается опасность возникновения желчно-каменной болезни, тромбофлебита? Как происходит катаболизм андрогенов, эстрогенов, прогестинов? Что характерно для основных видов патологии гонадной оси у мужчин и женщин? Задание 9.2. Решите тесты: Выработку фоллитропина в аденогипофизе подавляет продукт клеток Сертоли: А. Трансферрин Б. Активатор плазминогена В. Андроген-связывающий белок Г. Ингибин Д. Активин Клетки Лейдига: А. Имеют рецепторы лютропина. Б. Имеют рецепторы фоллитропина. В. Вырабатывают эстрогены, тестостерона. Г. Выполняют трофическую функцию. Д. Вырабатывают фоллитропин. Андрогены стимулируют: А. Развитие вторичных половых органов. Б. Биосинтез белков в тканях и органах. В. Липолиз в жировой ткани. Г. Образование ингибитора остеоиндукции в костной ткани. Д. Биосинтез глицерофосфолипидов участвующих в биомембран. построении Последовательность образования метаболитов при биосинтезе эстрогенов: А. Прегненолон Б. Прогестерон В. Эстриол Г. Тестостерон Д. Эстрон Указанным гормонам характерны эффекты: 1. Тестостерон А. По механизму положительной 2. Эстрадиол связи с аденогипофизом стимулирует 3. Активин секрецию фоллитропина. 4. Прогестерон Б. Служит субстратом биосинтеза эстрадиола. В. Способствует поддержанию низких значений коэффициента и индекса атерогенности крови. Г. Инициирует комплекс изменений в матке, необходимых для имплантации оплодотворенной яйцеклетки. Д. По механизму отрицательной обратной связи подавляют выработку фоллитропина. Задание 9.3. Решите задачу: У 19-летней девушки в течение девяти месяцев отсутствуют менструации. До этого они были с 11-летнего возраста. В 16 лет девушка стала активно заниматься легкой атлетикой. Во время тренировок она пробегала от 6 до 10 км. Вскоре менструации прекратились и возникали только зимой, когда спортсменка бегала реже. Каждую весну она возобновляла занятия бегом. Менструации прекращались. Беременности не было. Половую жизнь она не ведет. Поставьте диагноз.