Моделирование распространения эпидемий
реклама

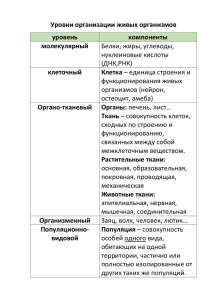
Моделирование распространения эпидемий Куравский Михаил Львович; 10 класс МОУ гимназия №1 г. Жуковский Московской обл.; [email protected] 1. Введение Эпидемией называют широкое распространение инфекционной болезни, значительно превышающее уровень заболеваемости, обычно регистрируемый на данной территории (спорадическая заболеваемость). При благоприятных условиях эпидемия может распространяться и охватывать новые районы. На распространении эпидемии сказываются такие факторы, как интенсивность контактов особей друг с другом, наличие источников заболевания, недостаточные профилактические меры и другие. Знание закономерностей возникновения и распространения эпидемий в популяции живых организмов помогает вовремя локализовать или предотвратить их [1]. В этой работе рассматриваются две различные модели распространения эпидемий: клеточные автоматы и дифференциальные уравнения [2]. Они позволили исследовать динамику развития эпидемии, а также зависимость ее продолжительности, количества переболевших особей и других показателей от параметров популяции, характеризующих использование профилактических мер и интенсивность контактов особей друг с другом. Было показано, что результаты различных способов моделирования близки друг к другу. 2. Моделирование с помощью клеточных автоматов 2.1. Описание модели Клеточные автоматы представляют собой системы, состоящие из дискретных клеток, или ячеек. Клетки могут располагаться на одномерной прямой, плоскости или в многомерном пространстве. Каждая клетка имеет заданное количество «соседей», определяемых постановкой задачи, и может находиться в одном из нескольких состояний. Соседи устанавливаются или по наличию общих границ у клеток, или с помощью графа. Время в такой системе изменяется дискретно, такт за тактом. Состояние клетки в следующий момент времени задается как функция от ее собственного состояния и состояний соседей в текущий момент времени. Вид этой функции определяет поведение клеточного автомата. Клеточные автоматы дают полезные модели для многих исследований в естественных науках [3, 4]. В данной работе был использован двумерный клеточный автомат, состоящий из квадратных клеток, непрерывно заполняющих рабочее поле размером 150х150. Каждая клетка представляла особь биологической популяции, состоящей из 22500 элементов, и могла находиться в одном из следующих четырех состояний: 1) клетка здорова и не имеет иммунитета, 2) клетка заражена и находится в инкубационном периоде болезни, 3) клетка больна, 4) клетка переболела и имеет иммунитет. Клетка считается больной, если находится в состояниях 2 или 3, и здоровой, если находится в состояниях 1 или 4. Количество соседей клетки (n), влияющих на ее состояние на следующем такте времени, задается в пределах от 1 до 8; для каждой клетки эти соседи случайным образом выбираются из 8-ми смежных клеток, имеющих с данной клеткой общие стороны или вершины. Переход из состояния в состояние определяется по следующим правилам: 1) здоровая клетка без иммунитета заболевает с заданной вероятностью (p), если у нее есть больные соседи; 2) болезнь продолжается в течение двух тактов: первый – инкубационный период болезни, второй – собственно болезнь; переболевшая клетка выздоравливает и приобретает иммунитет; 3) клетка, имеющая иммунитет, не болеет и не теряет его. Вероятность инфицирования характеризует использование лекарств, направленных на профилактику заболевания (принимает наибольшие значения при наименьших профилактических мерах) Правила работы автомата представлены в виде таблицы: Номер текущего состояния Наличие больных соседей Номер следующего состояния 1 Есть 2 2 Есть 3 3 Есть 4 4 Есть 4 1 Нет 1 2 Нет 3 3 Нет 4 4 Нет 4 Для исследования влияния количества привитых клеток (i) на эпидемию в рабочее поле клеточного автомата помещалось определенное количество клеток с иммунитетом (в состоянии 4). Таким образом, рассмотренная клеточная модель позволяет оценивать эффект влияния следующих параметров: 1) количества соседей каждой клетки (n), 2) процента начально инфицированных (s), 3) вероятности инфицирования (p), 4) количества привитых клеток (i). 2.2. Результаты применения Представленный клеточный автомат был программно реализован в среде Borland Delphi (рис. 1) и использовался для исследования влияния параметров популяции на продолжительность болезни в тактах (K), количество переболевших (N) и наибольшее количество болеющих одновременно (M). В ходе вычислительных экспериментов указанные характеристики эпидемии оценивались при различных параметрах популяции. Перед расчетом на рабочее поле случайным образом наносилось некоторое количество больных клеток, находящихся в состоянии 2. Затем вводились параметры n, i и p, после чего проводилось пошаговое вычисление последующих состояний клеточного автомата до тех пор, пока на поле не оставалось ни одной больной клетки (то есть до состояния, когда популяция в основном переболела и приобрела иммунитет). Результаты проведенных 43-х экспериментов представлены в табл. 1-5. Основные зависимости показаны в виде графиков на рис. 2-4. Для выявления динамики развития эпидемии проводилось измерение количеств клеток в каждом из состояний с заданным шагом (табл. 6). Полученная зависимость показана на рис. 5. 2.3. Обсуждение результатов 2.3.1. Исследование влияния на развитие эпидемии вероятности инфицирования и количества привитых клеток. 1. При исследованных значениях параметров популяции наиболее значимое влияние на развитие эпидемии оказывают вероятность инфицирования и процент привитых клеток. 2. При вероятности инфицирования, равной 0,25, продолжительность эпидемии достигает наибольших значений, оказываясь в несколько раз большей, чем в случае вероятности инфицирования в диапазоне от 0,40 до 0,80 (рис. 2). Таким образом, меры, способствующие снижению вероятности инфицирования, не всегда приводят к уменьшению ущерба, вызываемого эпидемией, если ущерб оценивается ее продолжительностью. 3. Количество переболевших особей быстро возрастает при увеличении вероятности инфицирования от 0,10 до 0,30 и стабилизируется на одном уровне при p > 0,.30 (рис. 3). 4. При p < 0,10 количество переболевших особей не превышает 0,10 от численности популяции (рис. 3). Таким образом, можно говорить о вероятности инфицирования, безопасной с точки зрения превышения эпидемиологического порога. 5. Количество переболевших клеток резко уменьшается при увеличении количества привитых клеток до 55% и стабилизируется на низком уровне при больших процентах привитых клеток (рис. 4). 6. Максимальное количество болеющих одновременно уменьшается при увеличении количества привитых клеток до 30% и стабилизируется на постоянно низком уровне при больших процентах привитых клеток (рис. 4). 2.3.2. Исследование влияния на развитие эпидемии остальных параметров популяции. 1. Наибольшая продолжительность эпидемии наблюдается при наименьших количествах начально инфицированных и небольших значениях интенсивностей контактов (табл. 1, 2). 2. Наибольший процент болеющих одновременно возрастает при увеличении количества начально инфицированных особей (табл. 1), количества соседей каждой клетки (табл. 2), вероятности инфицирования (рис. 3) и уменьшении количества привитых клеток (рис. 4). 2.3.3. Исследование динамики развития эпидемии. Динамика развития эпидемии, определенная путем вычислительного эксперимента, качественно соответствует результатам наблюдений (рис. 6). 3. Модели, описываемые дифференциальными уравнениями 3.1. Описание модели Дифференциальное уравнение, использованное для исследования развития эпидемий, описывает зависимость между количеством заболевших особей x(t) (суммой числа переболевших и болеющих на данный момент особей), количеством переболевших особей y(t) и скоростью изменения количества заболевших особей: x(t ) kx(t ) y(t )c x(t ) , где c – количество особей в популяции, k – числовой коэффициент, характеризующий вероятность заражения (коэффициент инфицирования). Уравнение отражает тот факт, что скорость распространения эпидемии пропорциональна количеству контактов между болеющими и неболевшими особями (x(t)-y(t) – количество болеющих особей в момент времени t, c-x(t) – количество здоровых особей без иммунитета). Коэффициент инфицирования k можно представить в виде следующего произведения: k λpn , где p – вероятность инфицирования, n – показатель интенсивности контактов (см. раздел 2.1), - числовой коэффициент. Количество особей, выздоравливающих в момент времени t, равно количеству особей, заболевших в момент (t-), где - средняя продолжительность болезни: y(t) x(t τ) . Следовательно, дифференциальное уравнение, описывающее развитие эпидемии, имеет вид: x(t ) kx(t ) x(t )c x(t ) Моделируемая с помощью уравнения популяция может быть замкнутой или незамкнутой. В незамкнутой популяции возможно заражение при контактах с особями других популяций. При этом полагается, что количество зараженных таким образом особей (t) является случайной величиной. Поскольку на эту величину влияет большое количество различных факторов, ни один из которых не преобладает, можно полагать, что ее распределение приблизительно нормально. Для учета заражения извне к x(t) следует добавлять поправку (t). Используемая процедура вычисления свободных параметров системы состоит из двух этапов. На первом этапе с помощью электронной таблицы Microsoft Excel для указанной системы уравнений кодируется численная схема интегрирования, позволяющая вычислять функции x(t) и y(t). Эти функции вычисляются с некоторым заданным временным шагом h. Для решения использовался модифицированный метод Эйлера 2-го порядка, обеспечивавший приемлемую точность. Большое значение имеет то, что электронная таблица Excel поддерживает динамические связи между содержимым ячеек. Если поместить свободные параметры системы и временной шаг h в отдельные ячейки, на которые ссылаются ячейки, содержащие формулы, то все решение будет автоматически модифицироваться по мере изменения значений ячеек со свободными параметрами и временным шагом. На втором этапе запускается процедура оптимизации, вычисляющая искомые значения свободных параметров, а именно: коэффициента инфицирования, количества начально инфицированных, характеристик заражения извне, - при которых полученный прогноз в наибольшей степени соответствует наблюдениям. Указанные параметры выбраны свободными, поскольку нельзя (или сложно) заранее оценить их значения. Задача решается методом наименьших квадратов: определяется решение, при котором сумма квадратов разностей наблюдаемых и прогнозируемых количеств заболевших в контрольных точках является наименьшей. Полученные значения свободных параметров рассматриваются как параметры популяции, выявленные в результате наблюдений [5]. 3.2. Результаты применения и их обсуждение С помощью представленной дифференциальной модели исследовалась зависимость x(t) и y(t) от размера популяции и продолжительности болезни. Вычислительные эксперименты, проведенные при типовых параметрах популяции, показали, что при увеличении размера популяции увеличивается и процент переболевших особей. Возможно, это обусловлено увеличением количества контактов особей друг с другом. Для сравнения было проведено несколько просчетов с помощью клеточного автомата, которые дали такой же результат. Количество переболевших особей в проведенных расчетах росло с увеличением продолжительности болезни. Возможно, это связано с тем, что при большей продолжительности болезни особь успевает заразить большее количество других особей. Рассмотренная модель применялась для анализа развития эпидемии гриппа в г. Жуковском в 1999-2002 годах (использовались данные городской санитарной эпидемиологической станции). Данные, представленные в табл. 7, показывают, что наибольшее заражение приходилось на конец декабря – начало января (новогодние праздники). По-видимому, это связано с увеличением количества контактов в этот период. При использовании данных о количестве заболевших только в течение декабря (4 недели), был получен прогноз, почти полностью совпадающий с результатами наблюдений (рис. 7, 8). Это свидетельствует о том, что рассмотренная выше модель достаточно надежна и может быть использована для прогнозирования. 3.3. Сопоставление результатов моделирования Для сопоставления результатов, полученных с помощью клеточной и дифференциальной моделей, параметры дифференциального уравнения идентифицировались по результатам прогнозирования с помощью клеточного автомата (табл. 6). Свободным параметром являлся коэффициент инфицирования. Были подобраны такие значения этого коэффициента, при которых график изменения количества заболевших почти полностью совпал с результатами работы клеточного автомата (рис. 9). Это позволяет говорить о корректности использования обеих моделей. 4. Выводы 1. 2. 3. 4. 5. 6. 7. 8. Вычислительные эксперименты показали, что: При исследованных значениях параметров популяции наиболее значимое влияние на развитие эпидемии оказывают вероятность инфицирования и процент привитых особей. Наибольшая продолжительность эпидемии наблюдается при наименьших количествах начально инфицированных и малых интенсивностях контактов. Увеличение размера популяции приводит к увеличению процента переболевших особей. Количество переболевших особей растет с увеличением продолжительности болезни. Меры, способствующие снижению вероятности инфицирования, не всегда приводят к уменьшению ущерба, вызываемого эпидемией, если ущерб оценивается ее продолжительностью. Существует вероятность инфицирования, безопасная с точки зрения превышения эпидемиологического порога. Дифференциальная модель обеспечила согласование прогноза с данными о развитии реальных эпидемий инфекционных заболеваний. Сопоставимость результатов прогнозирования с помощью клеточной и дифференциальной моделей подтверждает корректность их использования. 5. Используемая литература 1. 2. 3. 4. 5. 6. Краткая Медицинская Энциклопедия [Отв. ред. А.Н.Шабанов] Т.3. М.: «Советская энциклопедия», 1974. Куравский М.Л. Моделирование распространения эпидемий. – Экологические системы и приборы, 2003, №2, стр. 49 – 54. Современный компьютер: Сб. науч. - попул. статей; Пер. с англ. [Ред. В.М.Курочкин] – М.: «Мир», 1986. http://graphics.cs.msu.su/courses/cg2000b/hw1/hw-1.htm (URL). Куравский Л.С., Баранов С.Н., Малых С.Б. Нейронные сети в задачах прогнозирования, диагностики и анализа данных. – М.: РУСАВИА, 2003. http://www.medvestnik.ru/Gazeta/2001/030/p11.html (URL). 6. Приложения Таблица 1. Зависимость характеристик эпидемии от количества начально инфицированных (при n=4 и p=50). Максимальное Процент начально Продолжительность Количество количество болеющих инфицированных (в тактах) переболевших (%) одновременно (%) 0.1 80 97.5 6.5 0.5 50 98 12.5 1 30 97.5 17.5 Таблица 2. Зависимость характеристик эпидемии от количества соседей каждой клетки (при s=3 и p=50). Максимальное Продолжительность Количество Количество соседей количество болеющих (в тактах) переболевших (%) одновременно (%) 2 30 96.5 22.5% 4 25 97.5 25.0% 6 20 97.5 27.5% 8 20 97.5 28.0% Таблица 3. Зависимость характеристик эпидемии от вероятности инфицирования (при s=3 и n=4). Максимальное Вероятность Продолжительность Количество количество болеющих инфицирования (в тактах) переболевших (%) одновременно (%) 6 15 6.0% 3.5% 12 25 12.5% 3.5% 17 45 36.0% 5.0% 18 50 54.0% 7.5% 21 55 60.0% 7.5% 25 60 77.5% 10.5% 31 35 90.0% 16.0% 37 25 94.0% 22.0% 50 25 97.5% 25.0% 75 20 99.5% 34.5% 100 20 100% 41.0% Таблица 4. Зависимость характеристик эпидемии от вероятности инфицирования (при s=0.5 и n=4). Максимальное Вероятность Продолжительность Количество количество болеющих инфицирования (в тактах) переболевших (%) одновременно (%) 6 10 1.0% 0.5% 12 40 3.0% 0.5% 17 65 9.5% 1.0% 21 95 37.5% 2.0% 25 105 71.5% 2.5% 31 70 89.0% 8.5% 37 45 93.5% 9.5% 50 40 97.5% 12.5% 75 35 99.5% 17.0% № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 № 1 2 4 6 8 10 12 14 16 18 20 25 30 35 40 45 Таблица 5. Зависимость характеристик болезни от количества привитых клеток (при n=4 и p=50). Максимальное Количество Продолжительность Количество количество привитых клеток болезни (в тактах) переболевших (%) болеющих (%) одновременно (%) 0 47 90 11 1 52 88 11 5 52 83 9 10 61 73 8 15 72 61 5 20 81 49 4 25 97 38 4 30 48 24 3 35 33 15 2 40 36 10 2 45 24 8 2 50 21 6 2 55 19 3 2 60 16 2 1 70 13 2 1 90 8 1 1 Таблица 6. Динамика развития эпидемии (при n=4, p=50 и s=1). Состояние #1 (%) Состояние #2 (%) Состояние #3 (%) 97.67 1.33 1.00 95.39 2.27 1.33 87.71 3.42 2.73 82.79 4.46 4.15 79.83 5.27 4.82 60.02 5.2 5.34 50.05 4.85 5.12 40.91 4.41 4.73 32.93 3.78 4.2 26.47 3.07 3.39 21.58 2.31 2.58 14.58 0.83 1.11 12.26 0.28 0.31 11.51 0.08 0.12 11.3 0.02 0.03 11.29 0.00 0.00 Состояние #4 (%) 0.00 1.01 6.14 8.6 10.08 29.44 39.98 49.95 59.09 67.07 73.53 83.48 87.15 88.29 88.65 88.71 Таблица 7. Развитие эпидемии гриппа в г. Жуковском зимой 1999-2000гг. и 2000-2001гг. Количество заразившихся (тыс. чел.) № Месяц Развитие эпидемии 1999-2000гг. Развитие эпидемии 2000-2001гг. 1 ноябрь 0.009 2 0.018 3 0.028 4 0.058 5 декабрь 0.03 0.082 6 0.048 0.111 7 0.083 1.49 8 0.168 0.16 9 0.39 0.178 10 январь 0.683 0.194 11 1.096 0.234 12 1.503 0.295 13 1.925 0.492 14 февраль 2.307 0.689 15 2.501 0.947 16 2.598 1.501 17 2.598 2.104 18 март 2.671 2.762 19 2.719 3.368 20 2.76 3.809 21 2.784 4.07 22 2.815 4.216 Рисунок 1. Окно программы, использованной для моделирования поведения клеточного автомата. Зависимость продолжительности болезни от вероятности инфицирования 120.00 Придолжительность, такты 100.00 80.00 При s=3 60.00 При s=0.5 40.00 20.00 0.00 0.00 20.00 40.00 60.00 80.00 100.00 Вероятность инфицирования, % Рисунок 2. Зависимость продолжительности эпидемии от вероятности инфицирования. Зависимость количества переболевших и максимального количества болеющих одновременно от вероятности инфицирования Количество переболевших (n) и максимальное количество болеющих одновременно (m), % 120.00 100.00 80.00 n1 (при s=3) m1 (при s=3) n2 (при s=0.5) 60.00 m2 (при m=0.5) 40.00 20.00 0.00 0.00 20.00 40.00 60.00 80.00 100.00 Вероятность инфицирования, % Рисунок 3. Зависимость количества переболевших и максимального количества болеющих одновременно от вероятности инфицирования Продолжительность (K, такты), количество переболевших и максимальное количество болеющих одновременно (N, M, %) Зависимость характеристик эпидемии от количества привитых клеток 120 100 80 K N 60 M 40 20 0 0 10 20 30 40 50 60 70 80 90 100 Количество привитых клеток, % Рисунок 4. Зависимость характеристик эпидемии от количества привитых клеток. Динамика изменения количества больных клеток 12 10 Количество, % 8 6 4 2 0 0 5 10 15 20 25 30 35 40 Такт Рисунок 5. Динамика изменения количества больных клеток 45 50 Рисунок 6. Типовая динамика развития инфекционного заболевания (ОРВИ) [6]. 26 – 32 недели (июнь – август) 33 – 39 недели (август – сентябрь) 40 – 45 недели (октябрь – ноябрь) 46 – 04 недели (ноябрь – январь) 05 – 14 недели (февраль – март) 15 – 20 недели (март – май) 21 – 25 недели (май – июнь) Динамика развития эпидемии гриппа 1999-2000 гг. 3 2.5 Переболевшие 2 Болеющие 1.5 Болевшие 0 Наблюдения 1 Контрорльные наблюдения 0.5 0 0 0.5 1 1.5 2 2.5 3 3.5 4 Рисунок 7. Динамика развития эпидемии гриппа в г. Жуковском в 1999-2000 гг. Динамика развития эпидемии гриппа 2000-2001 гг. 5 Переболевшие особи 4.5 Болеющие особи 4 Болевшие особи Наблюдения 3.5 Контрольные наблюдения 3 2.5 2 1.5 1 0.5 0 0 1 2 3 4 5 Рисунок 8. Динамика развития эпидемии гриппа в г. Жуковском в 2000-2001 гг. Динамика развития эпидемии - моделирование по результатам работы клеточного автомата 25 20 15 Переболевшие Болеющие 10 Заболевшие Наблюдения 5 0 0 0.2 0.4 0.6 0.8 1 1.2 1.4 Рисунок 9. Решение дифференциального уравнения, идентифицированное по результатам работы клеточного автомата (табл. 6).