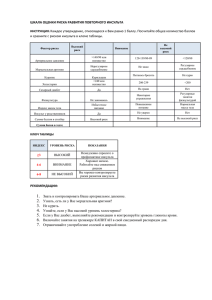
1. Факторы риска ИИ у молодых - Учебно
реклама

1 МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН ТАШКЕНТСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ «СОГЛАСОВАНО» Начальник отдела по координации научно-исследовательской деятельности МЗ РУз _____________Даминов Б.Т. «____»______________2010 г. «УТВЕРЖДАЮ» Начальник Главного Управления науки и учебных заведений МЗ РУз, _____________Атаханов Ш.Э. «____»______________2010 г. ФАКТОРЫ РИСКА И ПРОГНОЗИРОВАНИЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА У ЛИЦ МОЛОДОГО ВОЗРАСТА (методические рекомендации) Ташкент – 2010 2 Учреждение–разработчик: Кафедра нервных болезней Ташкентской Медицинской Академии Авторы: Маджидова Ё.Н., Сагатов Д.Р., Расулова Х.А. Рецензенты: Халимова Х.М. – д.м.н., профессор кафедры нервных болезней ТМА Аликулова Н.А. – д.м.н., профессор кафедры нервных болезней ТашИУВ Методические рекомендации рассмотрены и утверждены на Проблемной комиссии ТМА Протокол № от «____»_____________2010 г. Ученом Совете ТМА Протокол № от «____»_______________2010 г. Ученый Секретарь _____________________ Рахимбаева Г.С. В методических рекомендациях приведены причины и факторы риска инсультов, значения относительного риска факторов, оказывающих наибольшее влияние на развитие ишемического инсульта в молодом возрасте, вопросы прогнозирования и рекомендации по профилактике ишемического инсульта у лиц молодого возраста. Методические рекомендации предназначены для неврологов, терапевтов, кардиологов, педиатров, врачей общей практики, студентов старших курсов, резидентов магистратуры и преподавателей медицинских ВУЗов. 3 ПРЕДИСЛОВИЕ Так уже повелось, что инсульт традиционно считается заболеванием лиц старшего возраста. И действительно, атеросклероз, артериальная гипертония, нарушения ритма сердца и другие, то есть основные заболевания, приводящие к инсульту, поражают, как правило, больных старше 45-50 лет. Однако, последние десятилетия ознаменованы ростом числа инсультов также у лиц в более ранней возрастной группе. Все чаще и чаще к неврологам обращаются молодые, трудоспособные пациенты. Развитие острой сосудистой мозговой симптоматики у таких больных подчас вызывает недоумение у врачей, которые «привыкли» к инсульту в группе пожилых лиц, что иногда приводит к недостаточному и неполноценному диагностическому поиску, а, следовательно, и к не всегда адекватному лечению этих пациентов. По данным большинства эпидемиологических исследований, в отличие от пожилых пациентов, у молодых лиц наиболее часто встречается геморрагический инсульт. Однако, исследований, посвященных проблеме ишемического инсульта в молодом возрасте, практически мало, а причины отличаются от таковых при геморрагическом инсульте. Часто ишемические инсульты у молодых принимают за рассеянный склероз, инфекции нервной системы, а порой и за функциональные расстройства, то есть не обусловленные органическим поражением нервной системы, а носящие психогенный характер. Известные трудности в диагностике инсультов у молодых лиц связаны с особым спектром причин и состояний, приводящих к инсультам у этого контингента больных. В связи с этим, мы поставили перед собой цель изучить и выявить основные причины и факторы развития ишемического инсульта у лиц молодого возраста с последующим прогнозированием риска заболевания у данного контингента больных. 4 Принимая эффективные меры профилактики артериальной гипертонии, атеросклероза, сердечно-сосудистой и цереброваскулярной патологии, устранения модифицируемых факторов риска и своевременной диагностики и лечения заболеваний, приводящих к инсульту, удастся решить проблему роста заболеваемости инсультом, особенно у молодых лиц. Данные методические рекомендации знакомят неврологов, терапевтов, кардиологов, врачей общей практики с современными представлениями о факторах риска инсульта с учетом его характера и возраста больных. ЭПИДЕМИОЛОГИЯ, ПРИЧИНЫ И ФАКТОРЫ РИСКА ИНСУЛЬТОВ У ЛИЦ МОЛОДОГО ВОЗРАСТА Острые нарушения мозгового кровообращения были и остаются ведущей причиной смертности и стойкой утраты трудоспособности в большинстве стран мира. Актуальность и сложность проблемы инсультов у молодых пациентов обусловлены недостаточной изученностью данного вопроса, сложностью медицинских и диагностических аспектов, отличием причин инсультов от таковых в старших возрастных группах, а также социально-экономическими факторами, связанными с работоспособным возрастом больных. Эпидемиология Согласно классификации ВОЗ (1992), молодому возрасту относятся лица от 25 до 44 лет, среднему – от 45 до 59 лет, пожилому – от 60 до 74 лет, более старшие возрастные группы – это лица старческого возраста. Распределение пациентов с инсультом по возрасту изучалось в исследовании STEPS (2007), результаты которого продемонстрировали высокий процент лиц в возрасте до 44 лет среди пациентов с инсультом – 11% (рис. 1). 5 Результаты эпидемиологического исследования Westover A. et al. (2007) показали, что в структуре инсультов у пациентов в возрасте от 20 до 44 лет преобладают геморрагические инсульты (отмечаются в 55% случаев); на долю ишемического инсульта приходится 45%. Среди пациентов старше 44 лет, напротив, преобладают ишемические инсульты – 80% случаев. Популяционные исследования, проведенные в последние годы в различных странах Европы и Америки (Kristensen B. et al., 2007; Halvor Naess et al., 2006; Nightingale A. et al., 2004; Lipska K. et al., 2007), показали, что частота ишемического инсульта у молодых пациентов составляет 6,7-17,1 случая на 100 тыс. населения в год. Выявлены различия частоты заболеваемости ишемическим инсультом в зависимости от пола и возраста. Так, частота его у лиц в возрасте от 18 до 24 лет в общей популяции составляет 2,5 случая на 100 тыс. населения, а в возрастной группе 35-44 лет этот показатель достигает 22,9 случая на 100 тыс. Кроме того, заболеваемость у мужчин и женщин до 35 лет не имела статистически достоверных различий, тогда как после 35 лет частота ишемического инсульта у лиц женского пола превышала таковой показатель у лиц мужского пола на 32%. 6 Как отмечают некоторые исследователи, в отличие от инфаркта миокарда и случаев внезапной смерти, при которых соотношение числа мужчин и женщин в возрасте до 45 лет составляет соответственно 19:1 и 12:1, при мозговом инсульте у молодых лиц половые различия в заболеваемости и летальности не столь значительны (Деев А.С., Захарушкина И.В., 1998; Гусев Е.И. и др., 2003; Шальнова С.А. и др., 2005). По некоторым эпидемиологическим данным, в зависимости от возраста происходит увеличение процента инфарктов мозга по отношению к общему количеству мозговых инсультов: до 14% у лиц в молодом возрасте (16-45 лет) и до 80% у более пожилых больных. При этом соотношение геморрагического и ишемического инсульта у молодых достигает от 1:1 до 1,5:1, что указывает на более высокую частоту геморрагического инсульта (55% случаев), чем в старших возрастных группах, а на долю ишемического приходится 45% случаев (Калашникова Л.А. и др., 2006; Cмирнова И.Н. и др., 2006; Зиновьева О.Е. и др., 2007; Westover A. et al., 2007). По данным Яшниковой М.В. (2009), в городе Иркутске инсульт в молодом возрасте чаще развивался у мужчин, чем у женщин, соотношение мужчин и женщин среди пациентов молодого возраста составило 1,2 : 1, в то время как у пациентов среднего возраста это соотношение составило 1,6 : 1 соответственно, что свидетельствовало о значительном преобладании мужчин. Среди пациентов пожилого возраста преобладали женщины, соотношение мужчин и женщин составило 1 : 1,15. На сегодняшний день Узбекистан не отстает от других стран по частоте встречаемости острой цереброваскулярной патологии. По данным Гафурова Б.Г. (2009), в последние годы в стране отмечается более 40 тыс. инсультов в год. При этом летальность составляет 44,6%, из них при ранней госпитализации (в первые 6 часов) – 5,1%, что почти втрое меньше, чем при госпитализации в более поздние сроки (14,7%). К трудовой деятельности возвращаются не более 10,2% больных, а 42,2% остаются инвалидами. Ряд 7 отечественных исследователей (Гафуров Б.Г. и др., 2004; Асадуллаев М.М. и др., 2002, 2003; Ахмедов О.Т. и др., 2002; Ажиева З.Б., Ажиев А.Б., 2008, Расулов Т.Б., 2008) проследили характерные эпидемиологические особенности инсульта также среди сельской местности страны, летальность от которых составила 44-63,7%, из них 48,3% среди мужчин, 51,7% среди женщин: при этом 87,4% больных умирали вне стационара, а 12,8% в стационаре. По данным Ажиевой З.Б. (2008), к 2010 году прогнозировалось увеличение случаев инсульта как среди всего населения, так среди мужчин и женщин в отдельности, составив соответственно 2,09; 1,95 и 3,15 на 1000 населения. Как отмечают Маджидова Ё.Н. с соавт. (2008), за последнее время отмечается увеличение частоты ишемического инсульта среди молодой популяции. Данная ситуация, прежде всего, связана с прогрессирующим ростом факторов риска, «омоложением» артериальной гипертензии, атеросклероза, сахарного диабета, слабой профилактической работой, несвоевременной и неправильной диагностикой и лечением заболеваний, приводящих к инсульту. Все это приводит к очень печальной статистике, принося тяжелые моральные, экономические и психологические последствия. ЭТИОЛОГИЯ И ФАКТОРЫ РИСКА РАЗВИТИЯ ИНСУЛЬТА В МОЛОДОМ ВОЗРАСТЕ Чтобы ответить на сложный вопрос «какие состояния могут привести к инсультам у молодых больных», следует, в первую очередь, напомнить, что различают инсульты геморрагические и ишемические. Термин «геморрагия» в переводе с греческого обозначает кровотечение. К геморрагическим инсультам относят паренхиматозное, субарахноидальное, вентрикулярное кровоизлияния и их сочетания 8 (паренхиматозно-субарахноидальное, паренхиматозно-вентрикулярное, субарахноидально-паренхиматозное). Ишемический инсульт возникает, как правило, за счет закупорки, а, следовательно, прекращения кровотока по сосудам, питающим головной мозг. Возникающий при этом недостаток кислорода приводит к необратимой гибели нервных клеток в ядерной зоне ишемического очага в головном мозге. Закупорка сосудов происходит за счет тромбов, либо образовавшихся в месте атеросклеротической бляшки, либо принесенных током крови из сердца или аорты и ее крупных ветвей. Тромбы также могут образоваться в связи с нарушением свертывающей системы крови или, наоборот, пониженным содержанием ее противосвертывающих компонентов. Теперь рассмотрим причины возникновения геморрагических и ишемических инсультов у молодых больных. В настоящее время раскрыты более 150 причин развития нарушений мозгового кровообращения. Одной из основных причин ишемического инсульта в более старшем возрасте обычно являются атеросклеротические или атеротромботические стенозы крупных сосудов шеи и головы, артериоартериальные эмболии из атеротромботичских наслоений. Другими причинами являются системные кардиогенные эмболии (искусственные клапаны, мерцательная постинфарктный аритмия, кардиосклероз, дилятационная кардиомиопатия, внутрисердечные шунты, кардиоцеребральный синдром), ангиопатии (липогиалиноз мелких сосудов, диабетические), васкулиты (аллергические, ревматические, облитерирующий тромбангиит, болезнь Такаясу), болезни крови (коагулопатии, полицитемия, апластическая анемия, эритремия, лейкозы, эссенциальная тромбоцитопения, тромбоцитопеническая пурпура, ДВС-синдром), нейросифилис, нейроспид, шейный остеохондроз с компрессией сосудов, травмы крупных артерий шеи, острые инфекции, сепсис, опухоли, гипергомоцистеинемия, прием оральных контрацептивов, употребление кокаина, мигренозный статус в анамнезе, 9 антифосфолипидный синдром, венозный тромбоз, фибромускулярная дисплазия, наследственные артериопатии, расслоение прецеребральных и церебральных артерий, гнойный менингит и многие другие. Наиболее частыми субарахноидальных причинами кровоизлияний у кровоизлияний молодых в пациентов мозг и являются врожденные изменения сосудистой системы мозга. При этом образуются аневризмы – специфические мешковидные выпячивания стенки внутримозговых артерий. Несколько реже встречаются артерио-венозные мальформации. Стенки аневризмы и сосудов артерио-венозной мальформации очень тонкие и ломкие, поэтому физиологическое повышение артериального давления (при стрессе, сильных эмоциональных и физических нагрузках) может привести к их разрыву и истечению крови в вещество головного мозга (при внутримозговом кровоизлиянии) или, что чаще, под оболочки мозга (при субарахноидальном кровоизлиянии). Клинически это выражается в появлении резко возникшей нестерпимой головной боли, светобоязни, нарушений сознания, очаговой неврологической симптоматики (параличи, расстройства речи и т.д.). Данная ситуация требует немедленного обращения за медицинской помощью, поскольку своевременное и квалифицированное лечение не только облегчает страдания больного, но и подчас спасает ему жизнь. К сожалению, аневризмы и мальформации мозга долгие годы могут протекать бессимптомно и не беспокоить больных. Лишь у некоторых пациентов возникают эпизоды головных болей, шума и пульсации в голове, что может насторожить невролога. Существующие методы инструментальной диагностики, а именно компьютерная рентгеновская и магнитно-резонансная томография, а по показаниям и ангиография, позволяют с высокой степенью точности диагностировать эту угрожающую жизни патологию. Подчеркнем, что как направление на эти исследования, так 10 и тактика лечения таких пациентов – прерогатива неврологов и нейрохирургов. Следует также отметить, что в структуре причин инсульта, как геморрагического, так ишемического, одной из наиболее значимых является артериальная гипертензия, встречающаяся у 50-97% больных инсультом. Тесная связь между уровнем артериального давления и частотой развития инсульта показана в многочисленных крупномасштабных исследованиях: BBB, MIDAS, STONE, VHAS, ELSA, STOP-Hypertension-2, PROGRESS, ASCOT, LIFE и др. У большинства лиц с АГ в популяции уровень АД 140/90180/105 мм рт. ст. Однако следует учитывать, что термин «мягкая АГ» не имеет прямого отношения к прогнозу заболевания и не означает, что болезнь будет протекать без тяжелых осложнений со стороны сердечно-сосудистой системы. Многочисленные исследования выявили, что наличие заболеваний сердца увеличивает риск инсульта вдвое. По данным Карповой И.С. (2005), Е.Н. Пономаревой и др. (2005), M.M. Kaarisalo et al. (1997), половина всех случаев кардиоэмболического инсульта связана с мерцательной аритмией, заболеваемость которой увеличивается с возрастом. Сахарный диабет является независимым фактором риска сердечнососудистых заболеваний, включая инсульт, и, как отмечают Александров А.А. (2001), Karapanayiotides T. et al. (2004), он встречается при ишемическом инсульте в 15-33% случаев. Гиперхолестеринемия является фактором риска ишемической болезни как сердца, так мозга, роль которой изучена во многих исследованиях: 4S, CARE, LIPID, WOSCOPS, MIRACL, ACAPS, HPS, PLAC-II и др. Показано также, что наличие в анамнезе транзиторной ишемической атаки и малого инсульта приводит к ишемическому инсульту у 40% больных в течение 5 лет (у 20% в течение 1-го месяца, у 50% – первого года). 11 В последнем обзоре факторов риска цереброваскулярных заболеваний Расуловой Х.А (2010) показано, что из более 200 факторов риска, только 50 имеют тесную связь с инсультом и ишемической болезнью сердца. Не подлежит сомнению значение курения и алкоголя на риск развития инсульта. Риск, связанный с курением относится к пациентам всех возрастов, обоих полов (у женщин инсульт развивается в 2 раза чаще, у мужчин в 1,5 раза, чем у некурящих), и ко всем этническим группам. Данные о влиянии алкоголя противоречивы. Во многих исследованиях продемонстрирована зависимость между приемом алкоголя и ишемическим инсультом, с протективным эффектом у лиц, употребляющих небольшие или средние количества и повышением риска инсульта при злоупотреблении алкоголем. Проведенные под руководством Пономаревой Л.А. и др. (2006) исследования в выявлении относительного риска сосудистой патологии в городе Ташкенте, показали, что одним из наиболее значимых факторов риска являются работа, связанная с высоким нервно-психическим напряжением (стресс), отсутствием летнего отпуска, а также выраженная бессонница и курение, особенно с юного возраста (у мужчин). Вопреки ожиданию, потребление жирной пищи и умеренное потребление алкогольных напитков оказались менее значимыми, чем другие факторы риска. Реально на организм человека одновременно воздействует не один, а различные комбинации многих факторов риска. Авторы предлагают использовать прогностические таблицы для оценки степени риска возникновения острых сосудистых нарушений. Помимо всего прочего, на риск развития инсульта влияют качество атмосферного воздуха, экологические факторы (например, проблема Приаралья). В рекомендациях ВОЗ определена формула соотношения вклада в нарушение здоровья таких обобщенных факторов, как генетика (около 20%), экология (около 20%), образ жизни (около 50%) и система здравоохранения (менее 10%). 12 По данным мультивариантного регрессионного анализа, у молодых пациентов (Lee T.H., 2002) были установлены следующие значения относительного риска для факторов, оказывающих наиболее выраженное влияние на развитие ишемического инсульта: аномалии цереброваскулярной системы – 25,44; диссекция – 21,46; кардиальная патология – 11,15; атеросклероз – 7,39; гипертензия – 5,69; мигрень – 3,59; дефекты коагуляции – 2,61; табакокурение – 2,16; интракраниальные опухоли – 1,82. В отчете Barkly L. (2009) приводятся данные о смертности и прогностических факторах ишемического инсульта у молодых по данным Хельсинкского университета Центральной больницы, Финляндия. Согласно этим данным, в развитии ишемического инсульта и ухудшении прогноза решающую роль играют пьянство, сердечная недостаточность, рак, диабет 1 типа и различные инфекции. Тем не менее, практически во всех исследованиях отмечено, что уточнение причины инсульта у молодых пациентов связано с определенными трудностями. Например, в исследовании Kristensen B. et al. (2007) вероятная причина инсульта дополнительной оставалась необъяснимой диагностической в 21% информации случаев. Без (трансэзофагеальная эхокардиография) количество неидентифицированных случаев увеличилось до 37,7%. А теперь более подробно рассмотрим наиболее частые причины и факторы риска ишемического инсульта у молодых лиц. Генетические факторы риска Ишемический инсульт – сложная многофакторная патология, частота которой возрастает при увеличении количества факторов риска, включая артериальную гипертензию, курение и сахарный диабет. Однако, приблизительно в половине случаев инсульт не может быть объяснен наличием факторов риска. Несмотря на то, что классическое менделевское наследование определяется менее чем в 1% случаев, исследования 13 близнецов, семейных случаев ишемического инсульта, а также данные экспериментальных исследований на животных свидетельствуют о том, что некоторые генетические особенности являются дополнительными факторами риска развития инсульта. Вероятно, генетическая предрасположенность к ишемии головного мозга реализуется в результате аддитивного эффекта нескольких генов (gene-dose эффект). Кроме того, повышенный риск инсульта является результатом взаимодействий генотипа с внешними воздействующими или динамическими факторами. Наконец, генетическое влияние на риск развития инсульта зависит от возраста – при этом оно более значительно при развитии болезни в молодом возрасте, ввиду отсутствия достаточного количества времени для существенного изменения фенотипа под влиянием внешних воздействующих и динамических факторов. Представляют интерес исследования Pezzini A. et al. (2005), которые изучали взаимодействие генетического полиморфизма – 20210A вариант гена протромбина, 1691A вариант гена V фактора свертывания, генотип TT677 метилентетрагидрофолатредуктазы, ген аполипопротеина E (генетический балл степени риска пациента вычислялся по количеству этих маркеров) – с модифицируемыми факторами риска. Результаты Grassi M. et al. (2007) также доказывают дозозависимый эффект изучаемого генного полиморфизма на риск ишемического инсульта у молодых и свидетельствуют о наличии биологического взаимодействия между врожденными генетическими особенностями и модифицируемыми факторами риска, что позволяет обосновать гипотезу о синергической комбинации факторов риска. Более высокий риск развития заболевания был связан с более высоким генетическим баллом: в частности риск болезни повышался в присутствии одного из генетических маркеров, был более выражен при наличии более 2 маркеров и достоверно увеличивался в подгруппе индивидуумов, которые были курильщиками или страдали артериальной гипертонией. Таким образом, несмотря на то, что была установлена взаимосвязь между наличием 14 генетических факторов риска и развитием ишемического инсульта, прямой независимый эффект генетического полиморфизма на риск ишемии головного мозга ограничен и приобретает ведущее значение лишь в комбинации с дополнительными факторами, что явилось основой для создания концепции context dependency (ситуационная зависимость) у молодых пациентов. Понятие «context dependency» общепринято, но лишь в недавних исследованиях доказано у молодых пациентов. Доказано, что устранение модифицируемых факторов риска (нормализация артериального давления, отказ от курения) позволяет снизить риск развития инсульта даже при наличии генетических факторов риска (рис. 2). Подобное исследование было проведено Zotto E. et al. (2004) – в нем было изучено синергическое взаимодействие полиморфизма гена аполипопротеина Е и табакокурения на риск развития ишемического инсульта у молодых. Установлено, что распространенность е4 аллеля и е34 15 генотипа была слегка более высока в случаях, чем в контроле (0,125 в сравнении с 0,071 и 0,242 в сравнении с 0,136 соответственно). У носителей е34 генотипа и е4 аллеля был отмечен повышенный риск инсульта при многомерном анализе. Риск инсульта составил 2,99 (95% CI, 1,64-5,45) для курильщиков с е33 генотипом, 2,69 (95% CI, 1,25-5,77) для некурящих с е34 генотипом, 5,39 (95% CI, 1,59-18,30) для курильщиков с е34 генотипом, по сравнению с 2,27 (95% CI, 1,13-4,56) для некурящих с е33 генотипом. Подобные результаты были получены, когда е4 носители и не-е4 носители были сравнены в той же модели взаимодействия. Никакого существенного взаимодействия между APOE и повышенным АД не было найдено. Таким образом, у молодых аллели APOE 4 и курение имеют синергическое взаимодействие, увеличивая склонность индивидуума к развитию ишемического инсульта. Экспрессия генов изменяется на протяжении жизни, специфические генные комбинации могут определять разный фенотип в различные периоды жизни. У молодых генетические факторы более выражены (так как семейный анамнез встречается достоверно чаще), внешние факторы менее выражены и их воздействие продолжается более короткое время. Кардиальные причины инсульта и тактика ведения пациентов Одной из основных причин инсульта у молодых пациентов является патология сердца. Согласно классификации Hanna J.P. и Furlan A.J. (1995) основными источниками кардиоэмболического инсульта являются патология камер или клапанов сердца, парадоксальная кардиальная эмболия. В последние годы все больший интерес исследователей вызывает проблема парадоксальной эмболии как причины ишемического инсульта. В целом парадоксальная эмболия рассматривается как один из источников кардиогенной эмболии наряду с патологией клапанов и камер сердца (Desai A.J. et al., 2006). Парадоксальная кардиальная эмболия может быть обусловлена наличием открытого овального окна, дефектом 16 межжелудочковой перегородки, дефектом межпредсердной перегородки. Среди ишемических нарушений мозгового кровообращения частота кардиоэмболического инсульта составляет около 20-30%, а у больных молодого возраста она может достигать 40%, что подчеркивает значимость идентификации конкретной причины развития мозговой катастрофы с целью вторичной профилактики. Особое внимание привлекает открытое овальное окно как основной путь реализации парадоксальной эмболии (Глебов М.В. и др., 2007). По данным различных исследователей, его выявляют у 27-35% населения во всех возрастных группах (Онищенко Е.Ф., 2005; Marco R. et al., 2007). При этом у лиц в возрасте до 55 лет с криптогенным инсультом открытое овальное окно обнаруживают в 46-47% случаев (Sacco R., 2007). Более высокая распространенность открытого овального окна отмечена в семьях молодых пациентов с криптогенным инсультом (Arquizan C. et al., 2001). Одно из первых документированных указаний на возможность парадоксальной эмболии можно отнести к 1877 г., когда Cohenheim J. при вскрытии молодой женщины, умершей от инсульта, обнаружил открытое овальное окно и сделал предположение о проникновении через него тромбов из венозной системы в церебральные артерии. Несмотря на накопленные данные, в настоящее время отсутствует единая точка зрения на открытое овальное окно как самостоятельную причину инсульта, прежде всего из-за казуистичности развития подобного церебрального поражения. Например, одним из условий парадоксальной эмболии является повышение давления в правом предсердии, вследствие чего возникает шунтирующий кровоток справа налево. Кроме того, не всегда у данной категории больных выявляются венозные тромбозы, считающиеся основным субстратом парадоксальной эмболии (Глебов М.В. и др., 2007). По данным одного из исследований (Marco R. et al, 2007) по изучению наличия незаращенного открытого овального окна и риска ишемического инсульта в 17 мультиэтнической популяции было установлено, что изолированное открытое овальное окно не вызывало увеличения частоты инсульта независимо от пола и возраста. В популяционном исследовании Meissner I. et al. (2006) также не было выявлено значимой связи между данной патологией и инсультом. В ряде других исследований была выявлена связь между наличием открытого овального окна и криптогенным инсультом (Handke M. et al. 2007; Overell J.R., 2000). Одной из кардиоцеребральной патологий, которая может быть эмболии, является аневризма источником межпредсердной перегородки. Это подтверждается исследованиями Mas J.L. et al. (2001), установившими, что больных с изолированным открытым овальным окном общий риск развития инсульта низкий, однако при сочетании его с аневризмой межпредсердной перегородки, Евстахиевым клапаном, сетью Киари, или с инсультом в анамнезе риск повторного инсульта является высоким. Установлено, что наличие как открытого овального окна, так и аневризмы межпредсердной перегородки были в значительной степени ассоциированы с криптогенным инсультом. При этом риск цереброваскулярных событий у пациентов с их сочетанием был в 33 раза выше, чем у больных с инсультом без данных кардиальных аномалий. На основании проведенных исследований можно сделать вывод, что вероятность того, что открытое овальное окно является причиной ишемического инсульта, возрастает, если оно большое, сочетается с аневризмой межпредсердной перегородки, а также, если определяется высокая степень шунтирования крови. Венозные тромбозы обнаруживают нечасто, что не позволяет говорить о парадоксальной эмболии как о ведущем механизме развития инсульта, ассоциированного с открытое овальное окно. Таким образом, больным с криптогенным ишемическим инсультом необходимо проводить трансэзофагеальной кардиографии определения 18 наличия открытого овального окна и аневризмы межпредсердной перегородки. Очень важную роль в изучении проблемы парадоксальной эмболии играет прижизненная диагностика открытого овального окна. В настоящее время наибольшее значение в клинической практике имеет трансторакальная и чреспищеводная эхокардиография с контрастированием или без, а также транскраниальная допплерография с внутривенным контрастированием и эмболодетекцией (Кузнецов А.Н., 2004; Глебов М.В. и др., 2007; Jauss M., 2000). Известно, что риск развития повторного инсульта у больных с открытым овальным окном, применяющих антитромботическую терапию, составляет в год от 4% и выше (Bogousslavsky J., 1996). В то же время риск развития инсульта у пациентов, подвергшихся операции по его закрытию, составляет менее 4% (Bridges N.D., 1992). По данным Wahl A. et al. (2005), у пациентов с открытым овальным окном может выполняться его эндоваскулярное закрытие, что снижает риск повторного инсульта по сравнению с консервативной терапией. Что касается консервативной терапии, в исследовании Cujec B. et al. (1999) показано, что в группе пациентов, получавших ацетилсалициловую кислоту или не получавших никакой терапии, риск повторного инсульта был втрое выше по сравнению с пациентами, применявшими варфарин. В пользу применения антиагрегантов и антикоагулянтов высказывались Tong D.C. и Becker K.J. (2004). По их мнению, не все пациенты с открытым овальным окном, перенесшие инсульт, должны подвергаться хирургическому лечению. Это связано с тем, что окончательно не доказана связь криптогенного инсульта с его наличием. Помимо этого, даже если есть подозрение на парадоксальную эмболию как на причину инсульта, к настоящему времени нет исследований, сравнивающих эффективность консервативной терапии и хирургического вмешательства. Как считают Landzberg M.J. et al. (2004), к закрытию 19 открытого овального окна следует прибегать в следующих случаях: при наличии ассоциированных гиперкоагуляционных состояний и при состоявшемся, несмотря на применение антикоагулянтов или антиагрегантов, повторном криптогенном инсульте. Согласно требованиям Американского колледжа торакальных хирургов этим больным рекомендована терапия антиагрегантами. В случае его сочетания с аневризмой межпредсердной перегородки и/или гиперкоагуляционными состояниями необходимо рекомендовать терапию антикоагулянтами, а при непереносимости или наличии противопоказаний к их применению – антиагрегантами. При выявлении, помимо всего вышеперечисленного, тромбозов глубоких вен рекомендуется длительная терапия антиагрегантами после проведения курса лечения варфарином. Более того, авторы отдают предпочтение длительной терапии варфарином у пациентов с венозными тромбоэмболиями, гиперкоагуляционными состояниями, а также у лиц с высоким риском повторного инсульта (аневризма межпредсердной перегородки, шунт больших размеров, множественные инфаркты мозга, предшествующие инсульту ситуации, аналогичные пробе Вальсальвы). Что же касается хирургического лечения, то в США чрескожному закрытию открытого овального окна подвергаются только пациенты с повторным инсультом, возникшим на фоне применения адекватной антитромботической терапии. Однако существующих данных недостаточно для создания рекомендаций относительно закрытия открытого овального окна у пациентов с первым инсультом (Глебов М.В. и др., 2007). Для окончательного решения вопроса о принципах лечения таких пациентов необходимо проведение крупных рандомизированных исследований. Диссекция цервикальных артерий Спонтанная диссекция цервикальных артерий выявляется, по данным зарубежных исследователей, в 10-20% случаев инсульта у больных молодого 20 возраста, а методики консервативного и хирургического лечения позволяют добиваться хороших функциональных исходов инсультов, что особенно важно для работоспособного контингента (Lucas C. еt al., 2004). В крупных популяционных исследованиях показано, что диссекция сонных артерий диагностируется с частотой 1,7-2,6, а позвоночных – в 1-1,5 случая на 100 тыс. населения в год (Dittrich еt al. R., 2006). Риск повторного расслаивания сонных артерий, подтвержденного при ангиографии, составляет около 2% в первый месяц, а в течение года возникает еще у 1% пациентов (Bassi P. еt al., 2003). Артериальная диссекция является результатом продольного надрыва сосудистой стенки с образованием интрамуральной гематомы в зоне комплекса интима-медиа. По литературным данным, диссекция чаще наблюдается в экстракраниальных сосудах – 88% случаев (каротидная – 58%, вертебральная – 30%). В интракраниальных сосудах она встречается у 12% пациентов, причем у этих больных в 19% случаев наблюдалась множественная артериальная диссекция. Возраст больных с диссекцией внутренней сонной и позвоночной артерий колеблется от 16 до 82 лет, составляя в среднем 46,7 года по данным одних авторов, по другим данным – 50,5 года (Baumgartner R.W. еt al., 2007). Однако имеются описания диссекции цервикальных артерий с исходом в тяжелые инфаркты мозга у детей. Клинические проявления цервикальной и церебральной артериальной диссекции весьма вариабельны. Основными нозологическими формами диссекции цервикальных артерий считаются транзиторные ишемические атаки, инфаркты мозга, субарахноидальные кровоизлияния. ТИА диагностируются у 15-20,6% больных с диссекции цервикальных артерий при практически равной частоте в каротидном и вертебробазилярном бассейнах (Барабанова Э.В. и др., 2008). Инфаркт мозга описан у 62,3-84% пациентов, реже наблюдаются ишемическая нейропатия зрительного нерва (4%), транзиторная монокулярная слепота (3%), инфаркты сетчатки (1%) 21 (Beletsky V., 2004). Важнейшим механизмом развития инфаркта мозга при диссекции экстракраниальных артерий является артериальная эмболия из зоны повреждения сосуда, и лишь у незначительного числа больных диагностируется гемодинамический вариант инфаркта мозга. Особенность интрацеребральной диссекции – присоединение геморрагического компонента и более частое (до 23%) развитие субарахноидальных кровоизлияний вследствие разрыва расслаивающих аневризм (Калашникова Л.А. и др., 2006). Типичные проявления артериальной диссекции – боли в области передней или задней поверхности шеи, лица, головы на стороне поражения, которые наблюдаются у 64-74% больных, неполный синдром Горнера – у 28-41%; пульсирующий шум в ушах, парезы черепных нервов и другие локальные неврологические симптомы отмечены в 8-30,6% случаев. Среди черепных нервов наиболее часто поражаются IX-XII пары, однако описаны парезы глазодвигательного и лицевого нерва. В целом церебральные ишемические симптомы выявляются в 83,6% случаев. Полный или частичный синдром Горнера длительное время может быть единственным проявлением начинающейся диссекции церебральных артерий (Барабанова Э.В. и др., 2008). Болевой синдром может дебютировать одновременно с неврологической симптоматикой, однако известны случаи появления головной боли за несколько дней и даже недель до возникновения очаговых симптомов. Наличие при артериальной диссекции очагов внутрисосудистого тромбообразования в зоне разрыва интимы и участков дилатации с формированием псевдоаневризмы с патологически измененной стенкой обусловливает возможность развития у больного клиники инфаркта мозга и внутримозгового кровоизлияния в любой последовательности. К редким неврологическим проявлениям диссекции цервикальных артерий относятся поражение периферической нервной системы на шейном уровне (радикулопатии), тригеминальная невралгия, мигренеподобные приступы. 22 Наиболее распространенным методом диагностики артериальной диссекции является стандартная церебральная ангиография. В последние годы широкое распространение получили магнитно-резонансная ангиография и компьютерная томографическая ангиография. Прямой признак диссекции – обнаружение интрамуральной гематомы в стенке сосуда при стенозе/окклюзии расслоившейся артерии. Ангиографические изменения сосуда при диссекции представлены неравномерностью его просвета (в 38% случаев), стенозом по типу «крысиного хвоста» (28%), полной окклюзией сосуда (28%), образованием псевдоаневризмы или расслаивающей аневризмы (5%). Типичен ложный («двойной») просвет сосуда в области стеноза. Ультразвуковое исследование фиксирует неспецифические нарушения стенки сосуда и кровотока, требующие дальнейшей верификации. В 12,8% случаев ультразвуковая сонография дает ложноотрицательные результаты при диссекции (Dzievas R. еt al., 2003). Ультразвуковые методы идеальны для текущего контроля развития заболевания. Частота спонтанного излечения при артериальной диссекции достаточно высока: степень реканализации может достигать 85-92% в течение 3 месяцев. В отчете многоцентрового исследования отмечено, что у 28,5% больных с диссекцией внутренней сонной и позвоночной артерии наблюдалось полное выздоровление, еще у 26,5% имелся хороший функциональный исход (Beletsky V. еt al., 2004). При инфарктах мозга исход заболевания больше зависит от локализации очага инфаркта и наличия хорошего коллатерального кровообращения, нежели от характера поражения артерии, хотя некоторые авторы подчеркивают роль окклюзии цервикальной артерии при ее диссекции как независимого фактора, связанного с плохим функциональным исходом (Fukuda M. еt al., 2004). Этиология диссекции церебральных артерий не изучена. Травматизация внутренней сонной артерии возможна при ее растяжении на поперечных отростках С2-С3 во время максимального разгибания и 23 отведения головы в сторону либо при сдавлении сосуда указанными костными структурами и углом нижней челюсти при сгибании шеи. Более четкая связь спонтанной артериальной диссекции прослеживается с проведением мануальной терапии на шейном уровне, особенно при возникновении двусторонней диссекции позвоночных артерий (Барабанова Э.В. и др., 2008). Временной интервал между манипуляцией или воздействием указанных провоцирующих факторов и началом заболевания может составлять от нескольких минут до нескольких дней. Этиологию спонтанной диссекции нередко связывают с предшествующей бессимптомной системной патологией сосудистой стенки. Выдвинута гипотеза, основанная на том, что нарушается функция эндотелия и соотношение вазодилатации. интима-медиа. Это Предрасполагающими сопровождается факторами нарушениями могут быть фибромускулярная дисплазия, наследственное поражение соединительной ткани (синдромы Элерса-Данлоса и Марфана), артерииты, ангиолипоматоз, костная патология в шейном отделе позвоночника (синдром КлиппеляФейля) (Kremer C. еt al., 2003; Baumgartner R.W. еt al., 2007). Доказано, что у больных со спонтанной диссекцией артерий в 3 раза чаще, чем в контроле, выявлялись острые инфекции в течение 1 месяца до сосудистого заболевания; эта связь еще более тесная у пациентов с множественной диссекцией, у которых отношение рисков составляет 6,4. Таким образом, перенесенная незадолго до сосудистого заболевания инфекция является фактором риска и может быть пусковым механизмом артериальной диссекции. Проводятся генетические исследования у больных с диссекцией по выявлению мутаций генов, ответственных за патологию соединительной ткани (Nadgir R.N. еt al., 2003). Большое количество исследований (Каримов Ш.И. и др., 2007; Покровский А.В. и др.; 2005; Baumgartner R.W. еt al., 2005) посвящено хирургическим технологиям экстренной реконструктивной ангиопластики, 24 эндоваскулярным методам лечения расслаивающих аневризм посредством стентирования, обсуждаются показания для окклюзии поврежденных сосудов, условия проведения эндоваскулярного тромболизиса. С учетом наиболее распространенной в настоящее время «сосудистой» теории развития артериальной диссекции в литературе имеются рекомендации по исключению воздействия факторов, способствующих дилатации сосудов (алкоголь, чрезмерное снижение артериального давления). Патология крови и аутоимунные механизмы развития инсульта в молодом возрасте Одной из частых причин ишемического инсульта у молодых, являются гематологические нарушения. К ним относятся заболевания, для которых характерна гиперкоагуляция: · первичные: недостаточность антитромбина III, нарушение фибриногена, резистентность к активированному фибринолитической волчаночных системы, антикоагулянтов протеину гомоцистинурия, или С, нарушение наличие антикардиолипиновых в крови антител, недостаточность протеина C и S; · вторичные: беременность и послеродовый период, прием оральных контрацептивов, синдром гиперстимуляции яичников, нефропатический синдром и другие заболевания. Антифосфолипидный синдром представляет собой аутоиммунное невоспалительное заболевание, антифосфолипидных волчаночные антител антикоагулянты), при котором отмечается (антикардиолипиновые сопровождающаяся выработка антитела и коагуляционными нарушениями (иммунологически опосредованная коагулопатия) и рядом клинических проявлений, основные из которых – артериальные и венозные тромбозы, спонтанные аборты и внутриутробная гибель плода у женщин, обусловленные тромбозом артерий плаценты. Антифосфолипидные антитела представляют собой гетерогенную группу антител, определяемых 25 иммуноферментным и радиоиммунным методами. Еще одним методом определения антифосфолипидных антител является коагуляционный. Он основан на способности антифосфолипидных антител вмешиваться в фосфолипидзависимые коагуляционные реакции, что in vitro вызывает увеличение времени свертывания крови, которое не корригируется смешиванием с равным количеством плазмы донора. Выявляемые таким образом антитела получили название «волчаночный антикоагулянт», так как впервые были обнаружены при системной красной волчанке. Развитие тромбозов обусловлено способностью антифосфолипидных антител реагировать с компонентами коагуляционного каскада, фосфолипидами мембран эндотелия сосудов и тромбоцитов, что определяет склонность к гиперкоагуляции за счет снижения выработки простациклина, снижения активации естественного антикоагулянта, протеина С, угнетения фибринолитической системы, ингибирования антитромбина ІІІ, изменения функции тромбоцитов. Дополнительные клинические и лабораторные проявления, имеющиеся у части больных, но не входящие в международные диагностические критерии антифосфолипидного синдрома, включают цитопению, ливедо, почечный синдром, поражение клапанов сердца, хронические язвы ног (Калашникова Л.А., 2008). Различают первичный антифосфолипидный синдром, который не сочетается с какими-либо известными аутоиммунными заболеваниями, и вторичный, чаще всего развивающийся при системной красной волчанке. При последнем именно коагулопатии, а не васкулит являются основной причиной ишемического инсульта. Нарушения мозгового кровообращения при синдроме, как правило, связаны с антифосфолипидном расстройством артериального кровообращения, обычно имеют ишемический характер, хотя описаны единичные случаи геморрагического инсульта, обусловленные 26 предположительно «ломкостью» сосудов и дисфункцией тромбоцитов. Повторные транзиторные ишемические атаки и ишемические инсульты могут сочетаться с нарушением кровообращения в артериях глаза, головными болями, эпилептическим синдромом, хореей, энцефалопатией. У больных молодого возраста с криптогенным ишемическим инсультом антифосфолипидные антитела определялись по данным разных авторов с частотой от 2,4 до 46% случаев (Miyakis S., 2006). Инсульты при антифосфолипидном синдроме имеют ряд характерных особенностей: – более частое развитие у женщин; – поражение интрацеребральных, а не магистральных артерий головы; – хороший регресс симптоматики; – склонность к рецидивам при отсутствии вторичной профилактики (3570%). Повторные инсульты сопровождаются развитием более крупных инфарктов мозга. Следует подчеркнуть, что диагностика антифосфолипидного синдрома как причины ишемического инсульта у молодых пациентов невозможна без обнаружения высоких или умеренно повышенных титров антител к кардиолипину изотипа G и/или волчаночного антикоагулянта умеренной или высокой активности (Александрова Е.Н., 2004; Устюжанина М.К., 2007). Профилактика повторных нарушений мозгового кровообращения при антифосфолипидном синдроме включает постоянный прием непрямых антикоагулянтов и антиагрегантов (Калашникова Л.А., 2008). Гипергомоцистеинемия и инсульт С увеличением риска развития инсульта ассоциирован высокий уровень гомоцистеина в крови (JAMA, 2002). При этом степень риска напрямую связана с уровнем гомоцистеинемии (Nigel Choon-Kiat Tan, 2002). Наибольшая взаимосвязь выявлена для инсультов в бассейне крупных артерий. Мета-анализ выявил, что дополнительное употребление в пищу фолиевой кислоты может снижать риск инсульта (Мирджураев и др., 2009; 27 Yang Q. et al., 2006; Wang X. et al., 2007). Более выраженное снижение риска наблюдалось при более длительном периоде назначения фолиевой кислоты или более выраженном снижении уровня гомоцистеина. По данным ряда исследователей (Nigel Choon-Kiat Tan), изучавших уровень гомоцистеина, витамина В12 и фолата в крови молодых пациентов, впервые перенесших ИИ, установлено, что уровень гомоцистеина в плазме натощак был достоверно выше (13,7 ммоль/л) у больных, перенесших инсульт, по сравнению с лицами контрольной группы (10,8 ммоль/л, р<0,001), а уровень витамина В12, наоборот, был ниже. Для фолатов достоверные отличия не выявлены. Было установлено, что при инсультах в бассейнах крупных артерий выявлялся более высокий уровень гомоцистеина в крови. Повышенные уровни гомоцистеина в крови ассоциировались с увеличением относительного риска развития ишемического инсульта (он составил 4,3), а также инсульта в бассейне крупных артерий (25,3). Использование регрессионной модели анализа данных позволило установить, что возрастание уровня гомоцистеина в крови на каждый 1 ммоль/л приводило к увеличению относительного риска развития инсульта на 5,17. Таким образом, авторы сделали вывод, что гипергомоцистеинемия является независимым фактором риска развития ишемического инсульта у молодых пациентов; при этом между уровнем гомоцистеина в крови и риском инсульта существует прямая сильная взаимосвязь. Взаимосвязь гипергомоцистеинемии с инсультами в бассейне крупных артерий, вероятно, свидетельствует об увеличении риска, реализующегося посредством проатерогенного эффекта. Однако механизмы, приводящие к тромбогенезу при гипергомоцистеинемии, до конца не изучены. Васкулиты как причина ишемического инсульта Причиной ишемического инсульта в молодом возрасте могут быть васкулиты, возникающие при инфекционных заболеваниях: менингите 28 (бактериальном, грибковом, туберкулезном, сифилитическом, паразитарном), аспергиллезе, мукомикозе, герпетических поражениях, риккетсиозах, шистосомозах, болезни Лайма). Васкулиты также отмечаются при системных заболеваниях: системной красной волчанке, неспецифическом язвенном колите, ревматоидном периартериите, артрите, склеродермии, синдроме болезни Шегрена, Такаясу, узелковом болезни Бехчета, гранулематозе Вегенера, саркоидозе. Идентификация причины ишемического инсульта в таких случаях связана с диагностикой церебральной основного ангиографии заболевания. возможно обнаружение При проведении локальных или распространенных сужений интрацеребральных артерий, чередующихся с участками расширения. При поражении артерий небольшого диаметра изменения могут не обнаруживаться. Причиной ишемического инсульта при васкулитах служит воспалительными окклюзирующий изменениями процесс, в стенке артерии обусловленный с сопутствующим тромбозом (Bhayani N., 2008). Течение ишемического инсульта при васкулитах имеет отличительные особенности: температуры частое тела, рецидивирование, высокая СОЭ, необъяснимое многоочаговая повышение неврологическая симптоматика, наличие эпиприпадков, нарушение когнитивных функций, поражения кожи и других органов. Редкие наследственные синдромы, сопровождающиеся развитием инсульта Одной из причин ишемического инсульта у молодых пациентов являются наследственные заболевания, являющиеся малоизвестной и плохо диагностируемой патологией. Синдром MELAS включает такие патологические проявления, как митохондриальная эпизоды. энцефаломиопатия, Заболевание относится лактоацидоз, к инсультоподобные митохондриальным болезням, 29 отличительной чертой которых является нарушение энергопродукции. Причиной этих изменений являются разнообразные мутации ДНК, наиболее часто в нуклеотиде 3243 транспортной ДНК (А3243G мутация) (Hirano M., 1994). Основные критерии диагноза: инсультоподобные эпизоды в возрасте до 40 лет, энцефалопатия, характеризуемая наличием эпиприпадков, деменцией или обоими этими состояниями, митохондриальная миопатия с лактоацидозом, феноменом «рваных красных волокон» при исследовании биоптатов скелетных мышц либо обоими этими признаками. Дополнительно для подтверждения диагноза должны присутствовать как минимум два фактора из нижеследующих: нормальное развитие ранее, повторные головные боли или повторная рвота. Характерной чертой ишемического инсульта при синдроме MELAS являются локализация в теменно-височнозатылочной области, чаще слева, склонность к рецидивированию, регрессу очагов с течением времени (Смирнова инсультоподобных эпизодов основное И.Н., 2006). В патогенезе значение имеет нарушение окислительного фосфорилирования в мозге, вследствие чего развивается вазогенный отек, гиперперфузия и нейрональное повреждение (Ito H., 2008). Кроме того, определенное значение придается ишемии мозга, обусловленной митохондриальной ангиопатией, вторичной по отношению к дисфункции митохондрий, в артериях мозга небольшого калибра (Gilchrist J.M., 1996). Лечение при синдроме MELAS направлено на улучшение энергетического метаболизма клетки и включает назначение коэнзима Q, препаратов янтарной кислоты, рибофлавина, L-карнитина, антиоксидантов, а также коррекцию лактат-ацидоза (Калашникова Л.А., 2008). Необходимо избегать приема препаратов, угнетающих функцию митохондрий (барбитураты, вальпроаты, глюкокортикостероиды, статины) (Иллариошкин С.Н., 2007). Синдром CADASIL – церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией. 30 Критерии диагноза: повторные субкортикальные ишемические инсульты, появляющиеся в среднем возрасте (50-60 лет) и характеризующиеся прогрессированием псевдобульбарного паралича и деменции (полностью отсутствуют традиционные цереброваскулярные факторы риска). В клинической картине могут отмечаться психоорганические расстройства и мигренеподобные атаки. По данным магнитно-резонансной томографии определяется наличие малых глубоких инфарктов и лейкоэнцефалопатии. Обязателен анализ семейного анамнеза в нескольких поколениях. Лизосомальные болезни накопления представляют собой группу из более 45 установленных генетических нарушений, каждое из которых приводит к специфическому дефекту функции лизосом. Эти дефекты приводят к прогрессивному накоплению внутри клетки субстрата, который в норме распадается. Разрыв простого метаболического пути может привести к большому количеству патологических состояний в зависимости от того, на каком этапе метаболизма образовался дефект. Лизосомальные болезни накопления обычно классифицируют в соответствии с типом вещества, которое накапливается (например, мукополисахаридозы, гликопротеинозы, сфинголипидозы), хотя при многих из этих состояний отмечается сходная клиническая картина. Общие особенности большинства лизосомальных болезней накопления включают костные аномалии, органомегалию, нарушения центральной нервной системы, грубые особенности волос и лица. Большинство лизосомальных болезней накопления наследуются по аутосомно рецессивному типу, кроме болезни Фабри, болезни Данона и синдрома Хантера (мукополисахаридоз ІІ типа), которые сцеплены с Ххромосомой. В целом частота данной группы заболеваний составляет 1 на 4-8 тыс. новорожденных, однако каждое заболевание имеет свою частоту, которая значительно варьирует в различных популяциях. Лизосомальные болезни накопления характеризуются прогрессирующим течением с высокой инвалидизацией и смертностью пациентов. Лечение описанных нарушений в 31 основном симптоматическое. Эффективность трансплантации костного мозга исследуется, пересадка стволовых клеток должна быть эффективна для продукции дефицитарных ферментов в различных тканях организма, однако результаты такой терапии противоречивы. Другие виды терапии включают максимально возможное уменьшение поступления субстрата и генную инженерию. В настоящее время наиболее успешно лечение путем введения недостающего фермента. К сожалению, заместительная терапия доступна только при болезни Гоше, болезни Фабри, мукополисахаридозах І, ІІ IV типа и болезни Помпе (Schiffmann R., 2006). Некоторые из лизосомальных болезней накопления манифестируют проявлениями со стороны ЦНС, а именно – развитием инсульта и транзиторных ишемических атак. Наиболее характерно это для болезни Фабри, при которой острые цереброваскулярные инциденты отмечаются в 27% случаев. По данным исследований Mehta and Ginsberg (2005), наиболее ранние транзиторно-ишемические атаки были зафиксированы у пациента в возрасте 12 лет. Средний возраст развития цереброваскулярной патологии при болезни Фабри составляет 33,8 года у мужчин и 40,3 – у женщин. Частота летальных исходов у этих пациентов достигает 55%. Группой исследователей (Arndt Rolfs et al., 2005) был проведен скрининг 721 пациента от 18 до 55 лет, страдающих от криптогенного инсульта, на наличие болезни Фабри (оценивалась активность a-галактозидазы, а также наличие мутации гена a-GAL). Болезнь Фабри была диагностирована у 4,9% мужчин и 2,4% женщин. Наиболее часто инфаркты мозга локализовались в вертебробазилярном бассейне и коррелировали с сосудистыми изменениями (долихоэктатическая патология выявлена у 42,9%). Таким образом, болезнь Фабри должна обязательно исключаться во всех случаях необъяснимого инсульта у молодых пациентов, особенно при комбинации инфаркта в вертебробазилярном бассейне и протеинурии (Michael Beck, 2007). 32 Инсульт при данной патологии, вероятно, вызван прогрессивным накоплением глоботриаозилцерамида (globotriaosylceramide, Gb3) в мозговых сосудах, изменениями локального паттерна мозгового кровотока, нарушением сосудистой функции и развитием эндотелиальной васкулопатии (Ginsberg et al., 2006). При исследовании головного мозга обнаруживается сосудистое поражение – сосуды становятся расширенными и извитыми. Больше всего поражаются сосуды задней циркуляции, в зоне их кровоснабжения отмечается гиперперфузия (Sodi A., 2006). При МРТ обнаруживаются очаги инфарктов и геморрагий, неспецифическое поражение белого и серого вещества, сосудистые поражения (особенно специфична долихоэктазия), характерные включения в заднем таламусе (рис. 3). Инсульт у пациентов с мигренью и наркозависимых Мигрень является нечастой причиной ишемического инсульта у больных молодого возраста, чаще – женщин. Ишемический инсульт развивается на фоне затянувшегося приступа, как правило, в бассейне задней мозговой артерии. По данным исследований Kruit M.C. et al. (2006), у страдающих мигренью значительно повышен риск развития инфарктов мозжечка и супратенториальных поражений белого вещества. У таких пациентов достоверно чаще обнаруживаются очаги повышенной плотности в 33 стволе мозга и мозжечке по сравнению с контрольной группой (в исследование включались больные, страдающие мигренью с аурой и без ауры). В последние годы среди молодых больных увеличилось количество пациентов с зависимостью от различных наркотических веществ. Наибольший прирост продемонстрирован для зависимости от амфетаминов и кокаина, характерной особенностью также является прирост злоупотребления амфетаминами в сельской местности, кокаином – в крупных городах. Также отмечается рост частоты зависимости от алкоголя, каннабиоидов, опиоидов, галлюциногенов. По данным ряда авторов, частота мозгового инсульта у молодых людей, злоупотребляющих наркотиками, достоверно выше (особенно при употреблении амфетамина). Установлено, что как при геморрагическом, так и при ишемическом инсульте в 14,4% случаев причиной заболевания является злоупотребление наркотиками. Так, прием амфетамина ассоциируется с высокой частотой развития геморрагического инсульта и с более высоким риском смерти от этой патологии. Прием кокаина повышает риск возникновения как ишемического, так и геморрагического исследовании инсульта инсультов у с молодых одинаковой пациентов, вероятностью. В злоупотребляющих амфетаминами или кокаином, проведенном Arthur N. et al. в 2007 г., установлено, что сила корреляции зависимости от амфетамина с геморрагическим инсультом была в два раза выше, чем при кокаиновой и никотиновой зависимости, но ниже, чем сосудистых аномалий, опухолей головного мозга геморрагическим стационаре и артериальной инсультом явились гипертензии. независимыми коагулопатии, Среди пациентов предикторами артериальная смерти гипертензия с в и злоупотребление амфетамином. Важнейшим предиктором ишемического инсульта, по данным этих исследователей, явились кардиальная патология (фибрилляция предсердий, новообразования сердца, дефект клапанов, 34 протезированные клапаны, дефект межпредсердной перегородки) и злоупотребление кокаином. Доинсультные цереброваскулярные заболевания Клиническое течение начальных проявлений недостаточности кровоснабжения головного мозга у молодых весьма стертое, диагностика этих состояний остается на низком уровне. Глубокое исследование состояния церебрального кровотока на ранних стадиях цереброваскулярных заболеваний, оценка психоэмоциональных расстройств на поликлиническом этапе отсутствуют. Чаще всего плохо диагностируют артериальную гипертонию, выставляется диагноз вегетососудистой дистонии или нейроциркуляторной дистонии по гипертоническому или смешанному типу. Необходимо отметить, уже на данном этапе у молодых пациентов можно выявить также патологию магистральных сосудов головы. За последние десятилетия отмечается значительное увеличение сочетания начальных форм цереброваскулярных заболеваний со стойким повышением цифр артериального давления уже в молодом возрасте. На практике у таких больных возможности компенсации внутричерепной гемодинамики чрезвычайно малы из-за смещения границ ауторегуляции. При значительных колебаниях артериального давления создаются условия, когда мозговое кровообращение начинает прямо зависеть от системной гемодинамики. Вместе с тем, имеются лишь единичные работы, в которых анализируется характер изменений церебрального кровотока в подростковом и молодом возрасте при первичной артериальной гипертонии, а также способы коррекции этих изменений. Клинико-неврологическая картина начальных проявлений недостаточности кровоснабжения головного мозга у молодых неспецифична, однако изменения церебральной гемодинамики, обуславливающие прогрессирование этой патологии, в той или иной степени всегда имеют 35 место. В этой связи исследования состояния мозгового кровотока являются актуальной задачей неврологии по профилактике инсульта. Таким образом, тщательное обследование пациентов от 15 до 25 лет с артериальной гипертонией и начальными проявлениями недостаточности кровоснабжения головного мозга, с оценкой состояния их церебрального кровотока позволит разработать новые подходы к ранней диагностике доинсультных цереброваскулярных заболеваний и значительно снизить частоту и тяжесть острых нарушений мозгового кровообращения в молодом возрасте. Таким образом, инсульт у молодых пациентов требует мультидисциплинарного подхода к ранней диагностике, своевременного (в рамках терапевтического окна) назначения терапии и комплексной медицинской и социальной реабилитации. Несмотря на существенное многообразие этиологических причин ишемического инсульта, патогенетические звенья заболевания у молодых и пожилых пациентов остаются схожими. Вместе с тем, представляется вероятным, что у пациентов с различными механизмами развития инсульта имеется различный риск возникновения повторного заболевания, что требует индивидуального и дифференцированного подхода к вторичной профилактике инсульта. Недостаточная изученность и сложность медико-диагностических, лечебно-реабилитационных аспектов ишемического инсульта у молодых пациентов, отличия причин инсультов от таковых в старших возрастных группах, а также социально-экономические факторы, связанные с работоспособным возрастом этих больных, делают данную проблему весьма актуальной и требуют более углубленного изучения причин и факторов риска ишемического инсульта у молодых лиц с целью первичной и вторичной профилактики, а также оптимизации диагностики и лечения. 36 РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ Инсульт у лиц молодого возраста является междисциплинарной проблемой и проявляется клинической манифестацией различных патологических состояний. Проводимые в последующем параклинические исследования выявляют фоновое заболевание, послужившее причиной сосудисто-мозговой катастрофы. В этой связи для выявления характера и клиники инсульта имеют значение анамнестические данные и факторы риска. Наиболее частыми факторами риска ишемического инсульта в среднем и пожилом возрасте, как известно, являются атеросклероз сосудов мозга и артериальная гипертензия. Причины же инсульта у молодых пациентов значительно отличаются от этиологии ишемического инсульта у больных в пожилом возрасте, более многообразны и, как правило, связаны с относительно редкими заболеваниями и состояниями, что требует проведения квалифицированного диагностического поиска, оценки прогноза заболевания и дифференцированной терапии. В наших исследованиях были изучены и проанализированы анамнестические, клинико-неврологические, лабораторно-инструментальные данные 220 больных ишемическим инсультом в острейшем и остром периоде, находившихся на стационарном лечении в неврологическом и реанимационном отделении РНЦЭМП в период с 2004 по 2009 гг. Согласно классификации ВОЗ (1992), молодому возрасту (до 44 лет) отнесены 150 больных (1-я группа), среднему (от 45 до 59 лет) – 24 пациента, а пожилому и старческому (60 и старше лет) – 46 больных (2-я группа). На основании данных тщательного клинико-неврологического анализа, контроля динамики заболевания, лабораторных и нейровизуализационных данных, проведено изучение течения ишемического инсульта у лиц молодого возраста в сравнительном аспекте с больными более старшего возраста. Тип инсульта определялся на основании клинической картины, данных анамнеза. 37 Верификация диагноза ишемического инсульта подтверждалась нейровизуализационными методами исследования: у 120 пациентов с помощью КТ, у 50 больных – МРТ-диагностики головного мозга. Относительный риск развития ишемического инсульта у молодых пациентов определялся в сравнительном аспекте с лицами более старшего возраста, согласно таблице pхc, разработанной профессором ЛаМортом (Бостонский университет, Школа Общественного Здравоохранения). Как показал анализ распределения мужчин и женщин по возрастным группам, в возрасте до 29 лет соотношение мужчин и женщин статистически значимо не отличалось. В возрастной группе 30-45 лет инсульт на 2,3% чаще встречался у мужчин, в 40-44 лет – на 8,2% чаще у женщин (р>0,02). В возрастной группе 45-59 лет больше преобладала доля мужчин (р=0,02), а среди больных старше 60 лет церебральный инсульт статистически значимо (р>0,001) чаще возникал у женщин (на 8,6%) (таблица 1). Таблица 1 Распределение мужчин и женщин ишемическим инсультом по возрасту, M±m Женщины (n=122) Мужчины (n=98) Всего (n=220) Возраст n % n % n % До 29 лет 3 1,4±0,36 6 2,7±0,32 9 4,1±0,1 30-39 24 10,9±0,06 29 13,2±0,04 53 24,1±0,02 40-44 53 24,1±0,04* 35 15,9±0,04 88 40,0±0,02 45-59 12 5,4±0,08 17 7,8±0,08 29 13,2±0,04 60 и старше 30 13,6±0,04* 11 5,0±0,14 41 18,6±0,04 Примечание: * - статистически значимая разница (р>0,05) в возрастных группах среди обоих полов. 38 Из таблицы 1 видно, что наибольшее число случаев ишемического инсульта среди молодых лиц отмечалось в возрасте 30-39 и 40-44 лет (24,1 и 40% соответственно). Следующей по частоте встречаемости была возрастная категория от 60 лет и старше, в которой число случаев составило 18,6%. Наименьшее число инсульта отмечалось в возрасте до 29 лет (4,1%). Возраст больных составил от 34 до 94 лет. Средний возраст составил 60,160,71 года (мужчин - 58,670,93 года, женщин - 62,171,16 года). Интересные данные получены нами при анализе частоты встречаемости ишемического инсульта в зависимости от пола. Наибольшая частота всех случаев острой ишемии мозга отмечена у женщин (n=122; 55,4%) во всех исследуемых группах. Однако, среди молодых лиц до 39 лет ишемический инсульт чаще поражал мужчин (35,7%), а на возрастной промежуток 40-44 лет наибольшая частота его установлена у женщин (43,4%). Иные результаты получены нами при анализе данных показателей в возрастной группе 45-59 лет, в которой наибольшее число инсульта отмечено у мужчин (17,3%). С увеличением возраста (60 лет и старше) пик ишемического инсульта приходился на женскую половину больных, составив 24,6% случаев. Таким образом, исследование показало различную частоту встречаемости ишемического инсульта в зависимости от возраста и пола. Наиболее частая его встречаемость среди лиц молодого возраста отмечена в возрасте от 30 до 45 лет, затем максимальный пик заболевания установлен в возрасте 60 лет и старше, а наибольшая частота установлена у женщин, чем у мужчин. Сравнительный анализ по полу и возрасту показал, что в более молодом возрасте ишемический инсульт чаще возникал у мужчин, а с увеличением возраста он превалировал у женщин в каждой группе больных. В зависимости от локализации очага, у 202 больных (91,8%) инфаркт развился в каротидном бассейне. Лишь у 18 больных (8,2%) очаг 39 локализовался в вертебробазилярном бассейне, из которых 6% пациенты молодого возраста (n=9) и 12,9% пожилого возраста (n=9) из общего числа обследованных больных. У больных с полушарным ишемическим инсультом (n=202), в зависимости от латерализации очага, инфаркт развился в левом полушарии у 52,4% (n=106), у 47,5% больных (n=96) он наблюдался в правой гемисфере. Частота левополушарных инфарктов преобладала у женщин (р>0,001), а у мужчин ишемический инсульт почти одинаково встречался как в левом, так и в правом полушариях патологического очага (р=0,25). в левом Среди пациентов полушарии с локализацией статистически значимо преобладали женщины (на 8%; р=0,001), в то время как наличие очага в правом полушарии среди мужчин и женщин статистически значимо не отличалось (р=0,25) (таблица 2). Таблица 2 Структура полушарных ишемических инсультов у мужчин и женщин в зависимости от латерализации очага, M±m Женщины (n=110) Мужчины (n=92) Всего (n=202) Гемисфера n % n % n % Левая 61 30,2±0,04* 45 22,2±0,04 106 52,4±0,01 Правая 49 24,2±0,03 47 23,3±0,04 96 47,5±0,02 Примечание: * - достоверно значимая разница (р>0,05) в зависимости от локализации очага при сравнении пациентов одного пола. При анализе результатов локализации полушарного инфаркта в зависимости от возраста больных было выявлено, что во всех возрастных группах патологический процесс затрагивал больше левое полушарие (в 40 целом у 56,3% больных): в I группе у 58%, во II группе у 52,8% пациентов (таблица 3). Таблица 3 Частота встречаемости полушарных ишемических инсультов среди молодых и пожилых больных в зависимости от локализации очага, M±m I группа (n=141) II группа (n=61) Всего (n=202) Гемисфера n % n % n % Левая 87 58,0±0,02* 37 52,8±0,08* 124 56,3±0,01* Правая 63 42,0±0,02 33 47,1±0,08 96 43,6±0,02 Примечание: * - достоверность различий р<0,05 между правой и левой гемисферой в одной группе. Факторы риска и значения относительного риска ишемического инсульта у молодых лиц Для создания группы риска развития ишемического инсульта у молодых необходимо тщательно анализировать факторы риска. В связи с этим, нами были сопоставлены основные факторы риска развития инсульта у молодых и пожилых лиц. Установлено, что основными причинами развития ишемического инсульта в группе молодых лиц были изолированная артериальная гипертензия – у 39 (26%) больных, стенозирующее поражение магистральных артерий головы – у 12 (18%), их сочетание – у 50 (33,3%), патология сердца – у 35 (23,3%), ревмоваскулит головного мозга (32,7%; n=49). У 7 женщин имело место постоянное применение гормональных контрацептивов, у 12 пациентов – указания в анамнезе на систематическое употребление алкоголя (таблица 4). Практически в половине случаев отмечено сочетание не более 2 факторов риска, что затрудняло выделение ведущего. У 24 (16%) пациентов установить механизм развития инсульта не представлялось возможным. 41 Таблица 4 Сравнительная характеристика факторов риска и сопутствующих заболеваний при ишемическом инсульте в молодом и пожилом возрасте, % Факторы I группа II группа ОР1 (n=150) (n=70) Этиологические факторы Атеросклероз 12 (18) 22,9 (16) Артериальная гипертензия 26 (39) 18,6 (13) Атеросклероз + Артериальная 33,3 (50) 71,4 (50) гипертензия Атеросклероз + Артериальная 4 (6) 18,6 (13) гипертензия + Сахарный диабет Патология сердца 23,3 (35) 60 (42) Ревмоваскулит 32,7 (49) 8,6 (6) Неуточненный фактор 16 (24) Сопутствующие заболевания Патология нервной системы: Нейроциркуляторная дистония 66 (99) Судорожный синдром 2,7 (4)* Мигрень 2,7 (4)* Остеохондроз 26,7 (40)* 32,8 (23) Патология дыхательной системы 20 (30)* 17,1 (12) Патология пищеварительной 10 (15) 8,6 (6) системы Патология обмена веществ: Сахарный диабет 4 (6) 18,6 (13) Ожирение 24,7 (37) 58,6 (41) Заболевания щитовидной железы 23,3 (35) 2,9 (2) Патология мочеполовой системы 30 (45) 35,7 (25) Болезни крови 1,3 (3) 1,4 (1) Факторы риска: Наследственная отягощенность 28 (42) 18,6 (13) Индекс массы тела > 30 кг/м 24,7 (37) 58,6 (41) Хронический алкоголизм 8 (12) 2,8 (2) Табакокурение 32 (48) 22,8 (16) Стресс 63,3 (95) 68,6 (48) Длительное использование 4,7 (7) 1,4 (1) контрацептивов ОР2 1 1,4 1,92 1 1 2,14 1 4,65 1 3,8 - 2,60 1 - 1 1,2 1,2 1 1,1 1 1 1 8,3 1 1,4 4,65 2,36 1 1,2 1 1,5 1 2,76 1,4 1 1 2,36 1 1 1,1 3,36 1 Примечание: в скобках указано число больных; ОР – относительный риск развития ишемического инсульта 42 Интересно отметить, что артериальная гипертензия была одним из основных предрасполагающих факторов развития инсульта как у молодых, так и старшего возраста. Так, в группе молодых лиц она встречалась у 63,3%, а в группе старшего возраста – у 65,7% больных (таблица 4). Вместе с тем, у лиц молодого возраста достоверно в 1,61 раза чаще встречались тяжелые формы гипертензии (50% – в I-й, 31% – вo II-й группе). С другой стороны, если в старшей возрастной группе все пациенты знали о наличии у них гипертензии и получали соответствующую терапию, то среди молодых более половины до развития инсульта не измеряли артериального давления и не получали антигипертензивной терапии. Важно отметить, что развитие ишемического инсульта у 66% молодых больных проходило на фоне длительного эмоционального напряжения и артериальной гипертензии в рамках нейроциркуляторной дистонии. Определенное влияние на появление характерных клинических симптомов (головная боль, головокружение и др.) оказывали и другие факторы риска (гиподинамия, напряженный умственный труд, шейный остеохондроз). У 1/3 женщин имелась патология половых органов (воспалительные заболевания, эндоцервицит, миома матки). Несмотря на вышеперечисленные факторы, в 16% случаев (n=24) точную идентификацию этиологических факторов выявить не удалось. Ишемическая болезнь сердца достоверно преобладала в группе лиц старшего возраста (60% – в I-й, 22% – во II-й группах), при этом перенесенный инфаркт миокарда встречался у них в 4 раза чаще, чем у молодых больных. В то же время врожденные и приобретенные пороки сердца, как причины инсульта, в I-й группе встречались в 5 раз чаще, чем во II-й. Необходимо отметить, что частота такого тяжелого осложнения поражения миокарда, как мерцательная аритмия, оказалась идентичной (12 и 16%, соответственно). 43 Кроме того, у части больных I-й группы выявлен сахарный диабет І типа в 2,7% случаев (n=4) и ІІ типа в 1,3% случаев (n=2), а также ожирение (24,7%; n=37), остеохондроз (26,7%; n=40), артериальная гипотония (7,3%; n=11), токсический (алкогольный) эндартериит (8%; n=12), мигрень (2,7%, n=4), заболевания щитовидной железы (23,3%; n=35), врожденные аномалии цереброваскулярной системы (2%; n=3), судорожный синдром (2,7%, n=4). У более чем половины пациентов одним из важных факторов риска ишемического инсульта оказался стресс (63,3%; n=95). Табакокурение и хронический алкоголизм, как фактор риска в группах определялся с равной частотой, однако интенсивность (32 и 8%) его оказалось большей у молодых пациентов, что соответствует данным ряда зарубежных авторов (Bonita R. et al., 1999; You R.X. et al., 1999; Klatsky A.L. et al., 2001). Наследственная отягощенность по сердечно-сосудистым заболеваниям достоверно чаще встречались у больных молодого возраста. У молодых больных наиболее часто наблюдалась отягощенность анамнеза сразу по обеим линиям, а также имелись указания на перенесенные инсульты у родных братьев или сестер. Изучение анамнеза показало, что у больных молодого возраста развитию инсульта относительно реже предшествовали транзиторные ишемические атаки – у 2 (3%), тогда как в группе старшего возраста они встречались чаще – 6 (10,1%). Из представленной таблицы 4 видно, что во II-й группе (n=70) доминировали соматические заболевания, связанные с возрастом, такие как атеросклероз (у 94,3% пациентов; n=66), ишемическая болезнь сердца (у 60% больных; n=42), артериальная гипертензия (у 90%; n=63). У 18,6% больных этой группы выявлен сахарный диабет ІІ типа (n=13), у 18,6% - ожирение (n=41). Следует отметить, что, наряду с представленной в таблице соматической патологией, к наиболее значимым факторам риска развития ишемического инсульта относится также пожилой и старческий возраст, т.е. возраст старше 60 лет (65,7%; n=46). 44 В наших исследованиях для установления степени связи между фактором риска и развитием ишемического инсульта в разных возрастных группах мы определили относительный риск, согласно таблице pхc, разработанной профессором ЛаМортом (Бостонский университет, Школа Общественного Здравоохранения). С помощью таблицы pхc с применением контрольной группы вместе с кумулятивной заболеваемостью можно сравнивать более двух групп. Группа, наименее подверженная действию фактора, используется в качестве контрольной группы. Чтобы рассчитать относительный риск, группы, подверженные сильному действию фактора, сравниваются с общей контрольной группой. Например, определение относительного риска развития ишемического инсульта у лиц молодого и старшего возраста при сочетании стенозирующего поражения магистральных артерий головы и артериальной гипертензией (таблица 5). Таблица 5 Расчет относительного риска в развитии ишемического инсульта у лиц молодого и старшего возраста по pхc, разработанной профессором ЛаМортом Группы Нет Относительный АТЗ+АГ Всего Заболеваемость больных АТЗ+АГ риск Лица молодого 50 100 150 50/150=0,333 0,333/0,333=1,00 возраста Лица старшего 50 20 70 50/70=0,714 0,714/0,333=2,14 возраста Примечание: АТЗ – атеросклероз, АГ – артериальная гипертензия Как видно из таблицы 5, по сравнению с лицами молодого возраста, у которых есть сочетание стенозирующего поражения магистральных артерий головы и артериальной гипертензии, риск заболеть ишемическим инсультом лицами старшего возраста был в 2,14 раза выше (71,4%). Результаты определения относительного риска при сочетании стенозирующего 45 поражения магистральных артерий головы, артериальной гипертензии и сахарного диабета показали, что риск развития ишемического инсульта во IIой группе повышается почти в 2 раза, чем в I-й, и был выше в 4,65 раза группы лиц молодого возраста (таблица 4). В то же время риск развития инсульта на фоне не диагностированной изолированной артериальной гипертензии оказался в 1,4 раза выше у лиц молодого возраста. В группе лиц старшего возраста относительный риск при патологии сердца был выше в 2,6 раза, чем у лиц молодого возраста. Следует отметить, что одной из особенностей развития ишемического инсульта у лиц молодого возраста явилось развитие данной патологии при ревмоваскулите. Так, риск развития ишемического инсульта на фоне ревмоваскулита у лиц молодого возраста был в 3,8 раза выше группы старшего возраста. Что же касается относительного риска развития ишемического инсульта на фоне таких факторов, как наследственная отягощенность, хронический алкоголизм, табакокурение, длительный прием контрацептивов, они были выше в группе молодых лиц в 1,5; 2,76; 1,4 и 3,36 раза соответственно (таблица 6). Таблица 6 Значения относительного риска развития ишемического инсульта в зависимости от возраста (pхc) ОР развития ИИ у лиц ОР развития ИИ у лиц Факторы риска молодого возраста старшего возраста АТЗ 1,0 1,92 АГ 1,4 1,00 АТЗ+АГ 1,0 2,14 АТЗ+АГ+СД 1,0 4,65 Патология сердца 1,0 2,60 Ревмоваскулит 3,8 1,00 Сахарный диабет 1,0 4,65 Ожирение 1,0 2,36 Заболевания 8,3 1,00 щитовидной железы Наследственная 1,50 1,00 46 отягощенность Хронический алкоголизм Табакокурение Длительное использование контрацептивов 2,76 1,00 1,4 1,00 3,36 1,00 Примечание: ИИ – ишемический инсульт, ОР – относительный риск, АТЗ – атеросклероз, АГ – артериальная гипертензия, СД – сахарный диабет. Таким образом, результаты проведенных исследований показали, что среди факторов риска развития ишемического инсульта среди лиц молодого возраста часто встречаются выраженная артериальная гипертензия, врожденные и приобретенные пороки сердца, ревмоваскулит, выкуривание более 20 сигарет в день. У половины молодых больных с инсультом имелось сочетание не более двух факторов риска. Относительно реже в этой группе встречались указания на перенесенный инфаркт миокарда. У большинства этих больных острый ишемический инсульт явился первым клиническим проявлением цереброваскулярной патологии, что отличает их от пациентов старшей возрастной группы, у которых ранее имелись эпизоды острой церебральной ишемии, подтвержденной данными нейровизуализирующего исследования. Одной из особенностей популяции лиц молодого возраста с наличием в семейном анамнезе расстройств мозгового кровообращения и ишемической болезни сердца является низкая готовность к устранению модифицируемых факторов риска, таких как курение, гиподинамия, антиатерогенная диета и прочие, что значительно затрудняет проведения профилактической работы. В полной мере это относится наблюдавшимся нами больным, у большей части которых имелись устранимые факторы риска – злоупотребление алкоголем, табакокурение, артериальная гипертензия, избыточная масса тела. Вместе с тем, учитывая вероятность повторных инсультов у лиц молодого возраста, практические клиницисты должны быть ориентированы как на 47 целенаправленное выявление факторов развития инсульта, так и на уточнение механизмов его развития. Таким образом, расчеты показали, что риск развития ишемического инсульта в молодом возрасте выше в 1,4 раза на фоне недиагностированной и нелеченной изолированной артериальной гипертензии, в 3,8 раза – на фоне ревмоваскулита, чем в более старшем возрасте. Относительный риск развития ишемического инсульта у молодых на фоне наследственной отягощенности, хронического алкоголизма, табакокурения, длительного приема контрацептивов был соответственно в 1,5; 2,76; 1,4 и 3,36 раза выше, чем у пожилых больных. На основании полученных данных нами разработана прогностическая таблица развития ишемического инсульта у молодых лиц (таблица 7). Таблица 7 Прогностическая таблица развития ишемического инсульта у молодых ОР развития ИИ у лиц ОР развития ИИ у лиц Факторы риска молодого возраста старшего возраста Артериальная 1,4 1,00 гипертензия Ревмоваскулит 3,8 1,00 Заболевания 8,3 1,00 щитовидной железы Наследственная 1,50 1,00 отягощенность Хронический 2,76 1,00 алкоголизм Табакокурение 1,4 1,00 Длительное использо3,36 1,00 вание контрацептивов Примечание: ИИ – ишемический инсульт, ОР – относительный риск. В результате проведенных исследований можно сделать заключение, что ишемические инсульты у молодых лиц не представляют редкости, и в более молодом возрасте встречаются чаще у мужчин, а с увеличением возраста – чаще у женщин. Отличительной чертой ишемического инсульта в молодом возрасте, по сравнению с геморрагическим и инсультом у пожилых, 48 является многообразие причин, что требует детальной диагностики для определения непосредственного фактора его развития. ВЫВОДЫ И ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. У лиц молодого возраста такие факторы, как артериальная гипертензия, наследственный фактор, ревмоваскулит, патология щитовидной железы, хронический алкоголизм, табакокурение и длительное использование контрацептивов играют более важную роль, увеличивая склонность индивидуума к развитию ишемического инсульта. 2. Относительный риск развития ишемического инсульта у лиц молодого возраста значительно меньше такового, чем у лиц пожилого возраста, при наличии сочетания ишемического факторов инсульта в риска. молодом Отличительной возрасте, геморрагическим инсультом, а также инсультом по особенностью сравнению с у пожилых, является многообразие причин его развития. В 16% случаев применение стандартных диагностических методов не позволяет установить причину его развития, что требует более тщательного диагностического поиска. 3. Разработанная прогностическая таблица факторов риска ишемического инсульта у молодых лиц позволит в амбулаторных условиях, при наличии этих факторов, взять на учет больных молодого возраста и проводить профилактические мероприятия и диспансерное наблюдение. 4. Полученные данные подчеркивают возможность выделения группы риска молодых лиц для более эффективного проведения диагностики различных патологических состояний и первичной профилактики инсульта, направленной на коррекцию модифицируемых факторов риска. Рекомендуется вести более активную борьбу с курением, алкоголизмом, изменение образа жизни, агрессивное лечение артериальной гипертензии у больных с генетической предрасположенностью, активный поиск и лечение 49 фоновой и сопутствующей патологии, при наличии показаний проводить инвазивное вмешательство. 5. Практическое применение полученных результатов позволит значительно снизить частоту ишемического инсульта у лиц молодого возраста. Коррекция факторов риска должна быть максимально ранней, полной и длительной (пожизненной), патогенетические звенья заболевания. с воздействием на все 50 СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ 1. Ажиева З.Б. Динамика и прогноз заболеваемости мозговыми инсультами по данным регистра г.Нукуса // Неврология. – 2008. – №3-4: Матер. IV съезда неврологов Узбекистана. – С. 44. 2. Ажиева З.Б., Ажиев А.Б. Показатели смертности и летальности от острого мозгового инсульта по регистру г. Нукуса // Неврология. – 2008. – №3-4: Матер. IV съезда неврологов Узбекистана. – С. 44. 3. Александров А.А. Сахарный диабет: болезнь «взрывающихся» бляшек // Сons. Med. – 2001. – №10 (3). – С. 464-468. 4. Асадуллаев М.М., Ильхамов Ф.О., Джахонгиров А.Х. Эпидемиология мозгового инсульта и этапность оказания медицинской помощи // Неврология. – 2002. – №4 (16). – С. 14-15. 5. Асадуллаев М.М., Полвонов А.Ж. Эпидемиологические аспекты острых нарушений мозгового кровообращения в Фергане // Журн. неврол. и психиатр. им. С.С. Корсакова.– 2003. – №9. – С.143. – Приложение «Инсульт». 6. Ахмедов О.Т., Холмирзаев П.Х., Анваров А.А., Султанов Б.Р. Структура заболеваемости острым нарушением мозгового кровообращения // Неврология. – 2002. – №4 (16). – С. 33. 7. Барабанова Э.В., Пономарева Е.Н., Булаев И.В. Роль диссекции сонных и позвоночных артерий в развитии цереброваскулярных нарушений (обзор литературы и клиническое наблюдение) // Медицинские новости. – 2008. – №1. – С. 19-22. 8. Гафуров Б.Г. Клинико-эпидемиологическая характеристика мозговых инсультов в Узбекистане // Актуал. пробл. неврологии и психиатрии: Матер. Респ. науч.-практ. конф. – Андижан, 2004. – С. 82-83. 51 9. Гафуров Б.Г. Распространенность и клиническая структура мозговых инсультов в Узбекистане по данным госпитального регистра // Актуал. пробл. хирургии: Докл. Респ. науч. конф., 6-7 окт. 2009. – Т., 2009. 10. Гузева В. И., Чухловина М. Л., Чухловин А.А. Ишемический инсульт у лиц молодого возраста // Клиническая медицина. – 2006. – №4 (84). – С. 8-12. 11. Гусев Е.И., Виленский Б.С., Скоромец А.А. и др. Основные факторы, влияющие на исход инсультов // Журн. неврол. и психиатр. им. С.С. Корсакова. – 1995. –Т.95, №5. – С. 4-7. 12. Гусев Е.И., Скворцова В.И., Стаховская Л.В. Эпидемиология инсульта в России // Журн. неврол. и психиатр. им. С.С. Корсакова. – 2003. – №9. – С. 4-9. – Приложение «Инсульт». 13. Деев А.С., Захарушкина И.В. Церебральные инсульты у мужчин и женщин молодого возраста: Метод. рекомендации. – Рязань,1998. – 42 с. 14. Дзяк Л.А., Цуркаленко Е.С. Инсульт у молодых пациентов // Здоров’я Украiни. – 2009. - №5 (1). – С. 12-15. 15. Зиновьева О.Е. и др. Ишемический инсульт в молодом возрасте на фоне комбинированного тромбофилического состояния // Неврологический журнал. – 2007. – №5. – С. 30-35. 16. Зыков В.П., Васильев С.А., Комарова И.Б., Чучин М.Ю. и др. Ишемический инсульт в детском возрасте // Лечебное дело. – 2009. – №2. – С. 12-20. 17. Каримов Ш.И., Асадуллаев М.М., Турсунов Б.З., Суннатов Р.Д. и др. Современные методы диагностики окклюзионных поражений брахиоцефальных артерий // Неврология. – 2007. – №2 (34). – С. 47-51. 18. Карпова И.С. Факторы риска и подходы к реабилитации кардиоэмболического инфаркта мозга // Актуал. пробл. медико-социальной экспертизы и реабилитации: Тез. докл. науч.-практ. конф. – Минск, 2005. – С. 92-93. 52 19. Маджидов Н.М. Организация первичной и вторичной профилактики мозговых инсультов // Мед. журн. Узбекистана. – 1995. – №5. – С. 57-60. 20. Маджидов Н.М., Трошин В.Д. Современные концепции превентивной неврологии // Неврология. – 2002. – №4. – С. 12-13. 21. Маджидова Ё.Н., Расулова Х.А. Клинико-биохимические аспекты острых ишемических инсультов // Клиническая неврология. – М., 2009. – №2. – С. 5-10. 22. Маджидова Ё.Н., Сагатов Д.Р. Сравнительная оценка эффективности применения церебролизина и эмоксипина при ишемическом инсульте у лиц молодого возраста // Неврология. – 2008. – №3-4: Матер. IV съезда неврологов Узбекистана. – С. 64-65. 23. Николаева Т.Я., Егорова Р.Н., Кузьмина З.М. Повторный ишемический инсульт в молодом возрасте, обусловленный тромбоэндокардитом // Якутский мед. журнал. – 2009. – №3. – С. 137-139. 24. Покровский А.В. Возможности сосудистой хирургии в предотвращении ишемического инсульта мозга // Вестн. РАМН. – 2003. – №11. – С. 34-38. 25. Покровский А.В., Шубин А.А., Кунцевич Г.И. и др. // Ангиология и сосудистая хирургия. – 2005. – Т.11, №4. – С. 130-140. 26. Пономарева Е.Н. Кардиогенные инфаркты мозга // Мед. новости. – 2005. – №10. – С. 4-8. 27. Пономарева Л.А., Шарипова С.А., Казаков Э.К., Расулова Х. Гигиенические и некоторые биологические факторы риска сосудистой патологии у городских жителей // Патология. – 2006. – №2. – С. 85-88. 28. Расулов Т.Б. Клиническая структура мозговых инсультов в городской и сельской местности Кашкадарьинской области // Неврология. – Т., 2008. – №3-4: Матер. IV Съезда неврологов Узбекистана. – С. 73-74. 29. Расулова Х.А. Мета-анализ факторов риска цереброваскулярных заболеваний // Неврология. – Т., 2010. – №1 (45) – С. 49-53. 53 30. Сагатов Д.Р., Маджидова Ё.Н. Окислительный стресс при ишемическом инсульте у лиц молодого возраста и антиоксидантная терапия // Клиническая неврология. – М., 2009. – №2. – С. 43-44. 31. Cмирнова И.Н., Чечеткин А.О., Кистенев Б.А., Кротенкова М.В., Коновалов Р.Н. Инсульт в молодом возрасте, обусловленный диссекцией позвоночных артерий с окклюзией основной артерии // Атмосфера. Нервные болезни. – 2006. – №3. – С. 19-21. 32. Фонякин А.В., Гераскина Л.А., Суслина З.А. Профилактика повторного инсульта. Практические рекомендации. – М., 2007. – 48 с. 33. Халилова З.Ю. Структура и сезонность мозговых инсультов в условиях г. Ташкента // Мед. журн. Узбекистана. – 1993. – №6. – С. 50. 34. Хохлова О.И. Особенности течения ишемических инсультов у лиц молодого возраста в зависимости от уровня гомоцистеина // Политравма. – 2006. – №2. – С. 19-21. 35. Шальнова С.А., Деев А.Д., Оганов Р.Г. Факторы, влияющие на смертность от сердечно-сосудистых заболеваний в российской популяции // Кардиоваскулярная терапия и профилактика. – 2005. – №1 (5). – С. 4-9. 36. Яшникова М.В. Факторы риска развития инсульта по данным регистра крупного промышленного города Западной Сибири: Автореф. дис. … канд. мед. наук. – Иркутск: ГОУ ВПО Нижегородская ГМА Росздрава, 2009. – 23 с. 37. Antiphospholipid Antibodies and Subsequent Thrombo-occlusive Events in Patients With Ischemic Stroke // JAMA. – 2004. – Vol. 291 (5). – P. 576-584. 38. Becker K., Skalabrin E., Hallam D., Gill E. Ischemic Stroke During Sexual Intercourse: A Report of 4 Cases in Persons With Patent Foramen Ovale // Arch Neurol. – 2004. – Vol. 61 (7). – P. 1114-1116. 39. Berthet K., Lavergne T., Cohen A. et al. Significant association of atrial vulnerability with atrial septal abnormalities in young patients with ischemic stroke of unknown cause // Stroke. – 2000. – Vol. 31. – P. 398-403. 54 40. Boysen G., Brander T., Christensen H. et al. Homocysteine and Risk of Recurrent Stroke // Stroke. – 2003. – Vol. 34 (5). – P. 1258-1261. 41. Brass L.M., Alberts M.J. The genetics of cerebrovascular disease // Baillieres. Clin. Neu. – 1995. – Vol. 4, №2. – P. 221-245. 42. Brey R.L., Abbott R.D., Curb J.D. et al. b(2)-glycoprotein 1-dependent anticardiolipin antibodies and risk of ischemic stroke and myocardial infarction: the Honolulu Heart Program // Stroke. – 2001. – Vol. 32. – P. 1701-1706. 43. Brey R.L., Chapman J., Levine S.R. et al. Stroke and the antiphospholipid syndrome: consensus meeting Taormina 2002. 44. Bushnell C.D., Goldstein L.B. Diagnostic testing for coagulopathies in patients with ischemic stroke // Stroke. – 2000. – Vol. 31. – P. 3067-3078. 45. Jacobs B.S., Boden-Albala B., Sacco R.L. et al. Stroke in the Young in the Northern Manhattan Stroke Study // Stroke. – 2002. – Vol. 33. – P. 2789. 46. Kaarisalo M.M., Immonen-Raiha P., Marttila R.J. et al. Atrial fibrillation and stroke // Stroke. – 1997. – №2. – P. 311-314. 47. Karapanayiotides T., Piechowski-Jozwiak B. et al. Stroke patterns, etiology, and prognosis in patients with diabetes mellitus // Neurology. – 2004. – №62. – Р. 1558-1562. 48. Klatsky A.L., Armstrong M.A., Friedman G.D., Sidney S. Alcohol drinking and risk of hospitalization for ischemic stroke // Am. J. Cardiol. – 2001. – №88. – Р. 703-706. 49. Publlicino P., Greenberg S., Trevisan M. Genetic stroke risk factors // Current opinion in neurology. – 1997. – №10. – P. 58-63. 50. Westover A.N., McBride S., Haley R.W. et al. Stroke in Young Adults Who Abuse Amphetamines or Cocaine. A Population-Based Study of Hospitalized Patients // Arch Gen Psychiatry. – 2007. – Vol. 64 (4). – P. 495-502. 51. You R.X., Thrift A.G., McNeil J.J. et al.Ischemic stroke risk and passive exposure to spouses’ cigarette smoking: Melbourne Stroke Risk Factor Study (MERFS) Group // Am. J. Public Health. – 1999. – №89. – Р. 572-575.