Типичные ошибки при работе с геманализатором
advertisement
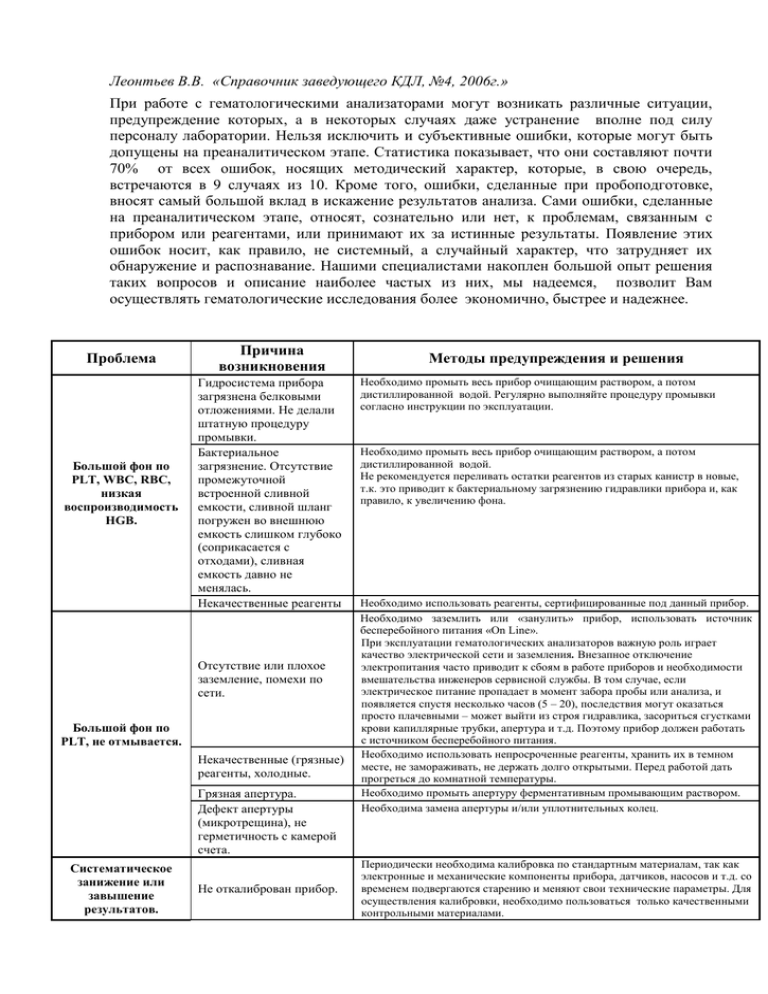
Леонтьев В.В. «Справочник заведующего КДЛ, №4, 2006г.» При работе с гематологическими анализаторами могут возникать различные ситуации, предупреждение которых, а в некоторых случаях даже устранение вполне под силу персоналу лаборатории. Нельзя исключить и субъективные ошибки, которые могут быть допущены на преаналитическом этапе. Статистика показывает, что они составляют почти 70% от всех ошибок, носящих методический характер, которые, в свою очередь, встречаются в 9 случаях из 10. Кроме того, ошибки, сделанные при пробоподготовке, вносят самый большой вклад в искажение результатов анализа. Сами ошибки, сделанные на преаналитическом этапе, относят, сознательно или нет, к проблемам, связанным с прибором или реагентами, или принимают их за истинные результаты. Появление этих ошибок носит, как правило, не системный, а случайный характер, что затрудняет их обнаружение и распознавание. Нашими специалистами накоплен большой опыт решения таких вопросов и описание наиболее частых из них, мы надеемся, позволит Вам осуществлять гематологические исследования более экономично, быстрее и надежнее. Проблема Причина возникновения Большой фон по PLT, WBC, RBC, низкая воспроизводимость HGB. Гидросистема прибора загрязнена белковыми отложениями. Не делали штатную процедуру промывки. Бактериальное загрязнение. Отсутствие промежуточной встроенной сливной емкости, сливной шланг погружен во внешнюю емкость слишком глубоко (соприкасается с отходами), сливная емкость давно не менялась. Некачественные реагенты Отсутствие или плохое заземление, помехи по сети. Большой фон по PLT, не отмывается. Некачественные (грязные) реагенты, холодные. Грязная апертура. Дефект апертуры (микротрещина), не герметичность с камерой счета. Систематическое занижение или завышение результатов. Не откалиброван прибор. Методы предупреждения и решения Необходимо промыть весь прибор очищающим раствором, а потом дистиллированной водой. Регулярно выполняйте процедуру промывки согласно инструкции по эксплуатации. Необходимо промыть весь прибор очищающим раствором, а потом дистиллированной водой. Не рекомендуется переливать остатки реагентов из старых канистр в новые, т.к. это приводит к бактериальному загрязнению гидравлики прибора и, как правило, к увеличению фона. Необходимо использовать реагенты, сертифицированные под данный прибор. Необходимо заземлить или «занулить» прибор, использовать источник бесперебойного питания «On Line». При эксплуатации гематологических анализаторов важную роль играет качество электрической сети и заземления. Внезапное отключение электропитания часто приводит к сбоям в работе приборов и необходимости вмешательства инженеров сервисной службы. В том случае, если электрическое питание пропадает в момент забора пробы или анализа, и появляется спустя несколько часов (5 – 20), последствия могут оказаться просто плачевными – может выйти из строя гидравлика, засориться сгустками крови капиллярные трубки, апертура и т.д. Поэтому прибор должен работать с источником бесперебойного питания. Необходимо использовать непросроченные реагенты, хранить их в темном месте, не замораживать, не держать долго открытыми. Перед работой дать прогреться до комнатной температуры. Необходимо промыть апертуру ферментативным промывающим раствором. Необходима замена апертуры и/или уплотнительных колец. Периодически необходима калибровка по стандартным материалам, так как электронные и механические компоненты прибора, датчиков, насосов и т.д. со временем подвергаются старению и меняют свои технические параметры. Для осуществления калибровки, необходимо пользоваться только качественными контрольными материалами. Не отрегулирован дилютер (для полуавтоматов). Занижение результатов, частые засоры. Наличие сгустков в пробах. Занижение PLT. Агрегация PLT. Занижение RBC, завышение PLT. Лизис RBC. Занижение RBC, завышение MPV и PLT. Частые засоры, плохая воспроизводимость HGB. Занижение RBC, частые засоры. Низкая воспроизводимость. Разбухание и лизис RBC. Посторонние частицы в пробе. Плохо перемешена проба. Грязная апертура Микросгустки в пробе Старая кровь. Несоответствие реагентов прибору, просроченные реагенты. Плохая WBC формула. Неправильный объем и/или время лизирования (для полуавтоматов). Физиология данного пациента. Необходима настройка дилютера с помощью аналитических весов. При выполнении анализа на гематологическом анализаторе предпочтительно использовать венозную кровь. Забор венозной крови лучше осуществлять, применяя специальные одноразовые системы с ЭДТА - «МОНОВЕТ». Это гарантирует отсутствие в образце посторонних примесей, а наличие антикоагулянта в оптимальной концентрации предотвращает образование фибриновых сгустков и агрегацию тромбоцитов. При заборе капиллярной крови оптимально использовать пробирки с ЭДТА – «МИКРОВЕТ». Нанесенный на внутреннюю поверхность пробирки мелкодисперсный порошок ЭДТА быстро растворяется в крови и надежно блокирует процессы свертывания крови и активации тромбоцитов. При работе с разведенной кровью (режим предилюции) нужно использовать индивидуальные пипетки Сали. Цепочка «Капилляр Панченкова + стекло+ пипетка Сали» приводит к увеличению агрегации тромбоцитов, т.к. увеличивается время пробоподготовки, а также стекло само по себе является катализатором агрегации. Не следует использовать пробирки с выпаренным раствором ЭДТА. При испарении раствора на дне пробирки образуются крупные кристаллы ЭДТА, которые очень медленно растворяются в крови. Это может приводить к образованию фибриновых нитей в верхней части пробы крови. Это связано, как правило, с забором крови или с физиологией данного пациента. Не сдавливайте палец пациента при заборе капиллярной крови и не накладывайте жгут, либо ослабляйте его сразу же после прокола вены при заборе венозной крови. При работе в режиме предилюции следует учитывать, что образование пузырьков при разведении крови с использованием дилютера может приводить к лизису клеток крови и, как следствие, являться причиной завышения результатов подсчета тромбоцитов. Поэтому необходимо следить, чтобы жидкость стекала по стенке стаканчика без образования пузырьков. Старая кровь. Необходимо использовать пластиковые одноразовые пробирки, обработанные ЭДТА. Измерить пробу в течение 8 часов для цельной крови, 1 – 2 часов для разведенной крови. Для дезинфекции подушечки пальца перед забором крови и высушивания носика пробирки следует использовать специальные безворсовые салфетки. Помните, что применение ватных тампонов и других волокнистых материалов подобного рода приводит к засорению волокнами датчика подсчета клеток и гемоглобиновой камеры (для этого достаточно даже одного волокна!). В результате точность и воспроизводимость измерения концентрации HGB резко падает. Извлечение посторонних частиц из камеры требует повышенного расхода промывающего раствора, а в ряде случаев, даже частичной разборки прибора. Цельная кровь имеет высокую вязкость и поэтому трудно перемешивается. Перед началом измерения цельную кровь следует перемешивать плавным переворачиванием и вращением пробирки в течение не менее 2 минут. Для этих целей лучше всего использовать специальный гематологический шейкер. При ручном перемешивании цельной крови недопустимы резкие встряхивающие движения, так как они приводят к механическому лизису эритроцитов. У прибора отсутствует автоматическая промывка после каждой пробы. Это, как правило, связано с пробоподготовкой (качеством ЭДТА или перемешиванием). Для хорошей дифференциации лейкоцитов необходимо провести измерение в течение 2 – 3 часов для цельной крови и 5 – 30 минут для разведенной. Во избежание случаев несовместимости реагентов следует использовать изотонический и лизирующий растворы от одного изготовителя и сертифицированные для данного прибора. При смене реагентов одного производителя на реагенты другого производителя обязательно консультируйтесь с инженерно-сервисной службой. Желательно использовать лизирующий раствор, расфасованный в капельницы, для удобства дозирования. Для большинства приборов нужно 2 – 4 капли на одну пробу. Оптимальное время лизирования 20 – 60 секунд. По статистике: венозная кровь, оптимальный вариант - из 100 здоровых пациентов у ~5 прибор не дает формулу или показывает патологию; Цельная капиллярная кровь – у ~10; Разведенная капиллярная – у ~20. Плохая точность при высоких значениях WBC и PLT. Большой объем забора крови. Значения анализа выходят за пределы границ линейности прибора. Необходимо разведение пробы и пересчет ее с учетом коэффициента разведения. Оптимально, когда прибор имеет возможность автоматического разведения и пересчета патологической пробы. Зависит от конструкции данного прибора, метода дозирования (шприцом или поворотным клапаном). Не принципиально, сколько забирает прибор - 20, 32, 50, 10, 12 или 9.8 мкл. Это коммерческая уловка, необоснованная реклама. Для правильного подсчета пробы мы должны соблюдать соотношение разведения крови и ЭДТА, так при работе с капиллярной кровью и микроветами мы должны взять у пациента 200 мкл крови, и не принципиально, сколько от туда возьмет прибор. Для улучшения воспроизводимости соотношения проба/изотоник, а соответственно и точности анализа, даже лучше, когда прибор забирает больше крови. Для неонатальных проб (в родильных домах) важна минимизация забора крови у пациента, а не прибором из пробирки, в таких случаях нужна возможность работы с предилюцией (20 мкл крови от пациента – пипетка Сали, капилляр «End-to-end»), что обеспечивает не каждый прибор.