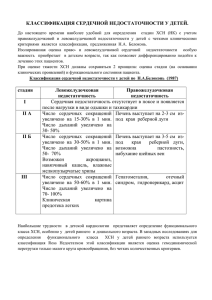
Электрокардиостимуляция в коррекции хронической сердечной недостаточности: клинико-инструментальная оценка эффективности, качества жизни, стратификации
реклама

На правах рукописи ЯКОБ Ольга Владимировна Электрокардиостимуляция в коррекции хронической сердечной недостаточности: клинико-инструментальная оценка эффективности, качества жизни, стратификации осложнений и исходов по данным 5 летнего проспективного исследования. 14.00.06 – кардиология АВТОРЕФЕРАТ диссертации на соискание ученой степени доктора медицинских наук Москва - 2007 Работа выполнена в Главном военном клиническом госпитале имени академика Н.Н.Бурденко и Государственном институте усовершенствования врачей МО РФ Научный консультант: доктор медицинских наук, профессор АРДАШЕВ Вячеслав Николаевич Официальные оппоненты: Член-корреспондент РАМН, доктор медицинских наук, профессор СИМОНЕНКО Владимир Борисович доктор медицинских наук, профессор БОЙЦОВ Сергей Анатольевич доктор медицинских наук, профессор ЧЕРНЕЦОВ Владимир Александрович Ведущая организация: ФГОУ Военно-медицинская академия. Защита состоится «31» октября 2007 г. в 14.00 часов на заседании диссертационного совета Д.215.008.01 при Главном военном клиническом госпитале имени академика Н.Н.Бурденко по адресу: 105229, г.Москва, Госпитальная пл. д.3 С диссертацией можно ознакомиться в библиотеке Главного военного клинического госпиталя имени академика Н.Н.Бурденко. Автореферат разослан «___»________________2007 г. Ученый секретарь диссертационного совета доктор медицинских наук Скворцов С.В. Введение Актуальность исследования. Декомпенсация хронической сердечной недостаточности (ХСН), несмотря на определенные успехи медикаментозной терапии, является одной из самых частых причин госпитализации лиц, достигших 65 лет, занимая во всем мире третье место среди причин госпитализаций. (Gottdiener J.S. et al., 2000; McMurray J.J., Stewart S., 2000; Байдина О.И., 2002). В популяции старше 45 лет число случаев ХСН удваивается через каждые последующие10 лет. (Мареев В.Ю., 2007). Нарастание ХСН сопровождается значительным ухудшением качества жизни больных, она является одной из основных причин смерти в популяции. В первую очередь это касается случаев с высокими градациями функционального класса по NYHA и при возникновении резистентности к медикаментозной терапии. В 2002 г. в РФ насчитывалось 8,1 млн. человек с достоверными признаками хронической сердечной недостаточности, из которых 3,4 млн. имели III – IV ФК заболевания. В России ежегодно от ХСН умирает от 880 до 986 тысяч больных. (Даниелян М.О. 2001 Ольбинская Л.И., Сизова Ж.М., 2001; McCullough P.A. et al., 2002; Ansari M., Massie B.M., 2003; Levy D. et al., 2004). Дисфункция миокарда с его структурным ремоделированием является ключевым звеном в развитии и прогрессировании сердечной недостаточности (Braunwald E., 1997; Сидоренко Б.А., Преображенский Д.В., 2004). Выявление дисфункции миокарда является обязательным условием диагностики ХСН.(Мареев В.Ю. Беленков Ю.Н.2002, Бойцов С.А. 2005, Мареев В. Ю. 2007) Перспективным методом изучения функции сердечной мышцы является эхокардиография с использование допплерографии в том числе тканевой допплерографии миокарда (Павлюкова Е.Н. с соавт., 2003; Алехин М.Н., 2005). Однако, возможности применения тканевой допплерографии у больных ХСН изучены недостаточно, а данные исследований носят противоречивый характер. В России ХСН в 4/5 случаев ассоциирована с артериальной гипертензией (АГ), и в 2/5 с ишемической болезнью сердца (ИБС).(Агеев Ф.Т. Даниелян М.О. 2004). Снижение коронарного кровотока сопровождается изменением метаболизма и уменьшением перфузии миокарда, а следовательно развитием гибернированного миокарда, что приводит к прогрессированию систолической и диастолической дисфункции миокарда. (Шумаков В.И. с соавт., 2003; Шляхто Е.В. с соавт. 2005, Schulz R., Heusch G., 2000; Саидова М.А., 2005). В большинстве случаев течение ХСН сопровождается развитием нарушений ритма и проводимости. Возникновение аритмий существенно ухудшает течение заболевания и способствует быстрому прогрессированию ХСН. (Шляхто Е.В., Новикова И.В. 2001). Частота возникновения аритмий у больных с ИБС чрезвычайно высока. Так суправентрикулярная экстрасистолия встречается в 4050% случаев, желудочковая экстрасистолия в 80-90% случаев, нарушения внутрижелудочковой проводимости выявляются в 80% случаев. Суправентрикулярная и желудочковая экстрасистолия, фибрилляция предсердий, устойчивые и неустойчивые желудочковые тахиаритмии могут осложнять течение ХСН. При тяжелой ХСН внезапная смерть может возникать и на фоне брадиаритмий. (Shauerte P., Sherlag B.J et. Al 1998, Eckardt L.,Haverkamp W., et al.2000). Поэтому одним из направлений лечения ХСН является лечение нарушений ритма и проводимости. Терапия ХСН с использованием комбинации ингибиторов АПФ и бета – адрено блокаторов, а также применение других медикаментозных средств имеет пределы своих возможностей и на определенном этапе становится неэффективной. (Feldman A., 2001). В связи с этим в последние десятилетия большие надежды в коррекции нарушений при ХСН связывают с применением постоянной электрокардиостимуляции как с использованием традиционной однокамерной или двухкамерной стимуляции, так и с применением современного метода – ресинхронизации работы сердца (РРС) с помощью бивентрикулярной электрокардиостимуляции. Основные усилия в лечении ХСН должны быть направлены на восстановление способности сердца наполняться кровью в период диастолы, сокращаться в период систолы, максимально приближаясь к режиму работы здорового миокарда. (Новиков В.И., Самойлович Т.М., 2001; Обрезан А.Г., Вологдина И.В., 2002). Использование методов электрокардиостимуляции позволяет не только восстановить нарушения ритма и проводимости, но и улучшить систолическую и диастолическую функции миокарда. Установка искусственного водителя ритма не останавливает прогрессирования ИБС, но клиническая картина ИБС у этих пациентов меняется. (Kolletis T., Kremastinos D., et. al. 1995, Barold S.S.,Stroobandt R.X., 2004). Использование электрокардиографических методик для выявления прогрессирования коронарной недостаточности у пациентов с желудочковой стимуляцией дает чрезвычайно мало информации. Поэтому особую значимость у этой категории больных приобретают методы, позволяющие визуализировать миокард, в частности эхокардиография и ее модификация стресс-эхокардиография. До настоящего времени в большинстве случаев при подборе параметров стимуляции используются стандартные усредненные значения параметров стимуляции. Использование электрокардиостимуляции у больных с хронической сердечной недостаточностью, особенно в случаях, когда причиной является ИБС, требует индивидуального подхода в подборе параметров стимуляции. (Рыбкина Т.В. 1996, Юзвинкевич С.А., 1998, Barold S.S., 2004, Искендеров Б.Г. 2005). Работы, посвященные этой проблеме малочисленны, отсутствуют длительные наблюдения за параметрами гемодинамики, качеством жизни и выживаемости при различных методах подбора параметров и режима стимуляции. Пристальное внимание в последние годы уделяется нарушениям координированной работы отдельных участков миокарда, объединяемым термином внутрисердечный асинхронизм (Марцинкевич Г.И., Соколов А.А., 2005). Многие пациенты с ХСН имеют асинхронную электрическую активацию желудочков. Основным маркером электрического асинхронизма является уширение комплекса QRS > 120 мс. По данным Никифорова В.С. (2006) ухудшение систолической и диастолической функции, а также прогрессирование ХСН сопровождается нарастанием внутрисердечного асинхронизма. Выделение этой категории больных в особую группу имеет практическое значение, поскольку наличие внутрисердечного асинхронизма приводит к достоверному повышению вероятности внезапной сердечной смерти и укорочению периода жизни. Медикаментозная терапия оказывается малоэффективной, как в восстановлении синхронизма, так и в предотвращении прогрессирования ХСН. Сравнительно недавно в арсенале лечения сердечной недостаточности появился современный электрофизиологический метод – ресинхронизация работы сердца (РРС). С помощью бивентрикулярной электрокардиостимуляции происходит синхронизация электрической активности правого и левого желудочков, что приводит к улучшению сократимости сердца. (Хирманов В.Н. с соавт., 2001; Abraham W.T., 2003; Кузнецов В.А. с соавт., 2005). Однако, имеются данные о низкой эффективности РРС у 30% лиц с признаками электрического асинхронизма (Reuter S. et al., 2002; Kass D.A., 2003). Поэтому чрезвычайно важной задачей является выявления дополнительных маркеров внутрисердечного асинхронизма, на основании которых возможен оптимальный подход к применению сердечной ресинхронизирующей терапии. Кроме того, существует необходимость подбора параметров бивентрикулярной электрокардиостимуляции в процессе наблюдения за этими пациентами.(Lane R.E. et al., 2004). Цель исследования. Изучить возможности электрокардиостимуляции в коррекции дисфункции миокарда при ХСН с использованием различных режимов и методов подбора параметров стимуляции путем пятилетнего ретроспективного анализа эффективности лечения, качества жизни, осложнений и исходов заболевания. Задачи исследования. 1. Оценить влияние однокамерной типа VVI и двухкамерной типа DDD электрокардиостимуляции у больных ХСН, с установленными показаниями к имплантации искусственного водителя ритма, на динамику заболевания. 2. Сравнить влияние однокамерной и двухкамерной электрокардиостимуляции на течение ХСН в зависимости от способа подбора параметров стимуляции - эмпирический метод подбора и подбор параметров стимуляции с использованием стресс-эхокардиографии с последовательным увеличением частоты стимуляции установленного электрокардиостимулятора. 3. Изучить изменение клинической картины ИБС у больных с искусственным водителем ритма при различных режимах стимуляции и различных методах подбора параметров стимуляции. 4. Изучить влияние внутрисердечного асинхронизма на течение хронической сердечной недостаточности. 5. Определить эффективность коррекции внутрисердечного асинхронизма с использованием медикаментозного лечения и сердечной ресинхронизирующей терапии с использованием бивентрикулярной электрокардиостимуляции, оценив динамику заболевания, качество жизни и выживаемости у больных с ХСН. 6. Определить дополнительные критерии для отбора больных, страдащих ХСН, на кардиоресинхронную терапию, а так же параметры и способ подбора режима бивентрикулярной электрокардиостимуляции. Научная новизна. 1. Доказано что имплантация однокамерного электрокардиостимулятора (ЭКС) сопровождается выраженным прогрессированием ХСН. Через год показатели тяжести ХСН достоверно ниже исходных значений. Эффективность медикаментозной терапии достоверно выше этого режима стимуляции. 2. Впервые у больных с ХСН с установленными показаниями к имплантации ЭКС проведен пятилетний анализ динамики заболевания в зависимости от режима стимуляции и способа подбора параметров стимуляции. Установлено, что использование стресс-эхокардиографии с перепрограммированием частоты имплантируемого ЭКС, как метода индивидуального подбора параметров стимуляции, позволяет достоверно улучшить течение ХСН, параметры качества жизни, что сопровождается снижением смертности от сердечно-сосудистых причин и повышением выживаемости, независимо от режима стимуляции. Также снижается обращаемость за медицинской помощью, частота госпитализаций и потребность в перепрограммировании ЭКС. 3. Впервые у больных с синдромом ЭКС проведено исследование на выявление прогрессирования коронарной недостаточности с использованием стресс-эхокардиографии. Выявлено, что синдром ЭКС маскирует прогрессирование коронарной недостаточности. Проведен анализ частоты возникновения ультразвуковых ишемических маркеров в зависимости от тяжести синдрома ЭКС. Установлено, что достоверно чаще ультразвуковые маркеры ишемии регистрировались у пациентов со средней степенью тяжести синдрома ЭКС. 4. Выявлено, что имплантация искусственного водителя ритма у больных с ИБС приводит к изменению характера болевого синдрома. Использование стрессэхокардиографии путем перепрограммирования частоты стимуляции ЭКС позволяет выявлять прогрессирование коронарной недостаточности и подбирать адекватную антиишемическую терапию, что приводит к снижению смерти от инфаркта миокарда. 5. Изучено влияние внутрисердечного асинхронизма на динамику ХСН, качество жизни и выживаемость за 3 года наблюдения. Доказано, что у пациентов с электрическим асинхронизмом достоверно чаще выявляются маркеры электромеханического асинхронизма, такие как внутрижелудочковый и межжелудочковый асинхронизм. Показано, что наличие внутрижелудочкового асинхронизма в целом и электрического в частности приводит к прогрессированию ХСН, снижению качества жизни и выживаемости. Доказано, что электромеханический асинхронизм в большей мере, чем электрический снижает выживаемость среди пациентов с ХСН. Впервые предложен алгоритм выявления асинхронизма у больных с ХСН. 6. Проведен анализ влияния медикаментозного лечения и сердечной ресинхронизирующей терапии (СРТ) с использованием бивентрикулярной электрокардиостимуляции, на внутрисердечный асинхронизм у больных ХСН. Доказано, что использование СРТ достоверно улучшает и/или восстанавливает внутрисердечный синхронизм, что сопровождается длительной (в течение 3 лет) положительной динамикой ХСН, улучшением параметров качества жизни, снижением частоты госпитализаций и повышением выживаемости. 7. Выявлено, что эффективность СРТ в большей мере связана с восстановлением параметров электромеханического синхронизма, чем только электрического. Установлено, что для отбора пациентов для проведения СРТ необходимо исследовать не только величину комплекса QRS как маркера электрического асинхронизма, но и такие показатели как механическая межжелудочковая задержка и индекс внутрижелудочкового асинхронизма (по данным эхокардиографии с использованием импульсной допплерографии и тканевой допплерографии). Показана возможность эхокардиографических методик с использованием импульсно-волновой допплерографии и тканевой допплерографии миокарда в подборе параметров атриовентрикулярной и межжелудочковой задержки у больных с СРТ с использованием бивентрикулярного электрокардиостимулятора Практическая значимость. 1. Установлено, что использование однокамерной стимуляции типа VVI у больных с ХСН, с выявленными показаниями к установке искусственного водителя ритма приводит к прогрессированию ХСН, через год показатели тяжести ХСН достоверно ниже исходных значений, что свидетельствует о нецелесообразности использования этого режима стимуляции у больных с ХСН. 2. В клиническую практику внедрен метод стресс-эхокардиографии с перепрограммированием частоты имплантированного ЭКС. Подбор индивидуальных параметров стимуляции с использованием этого метода приводит к положительной динамике ХСН, улучшению параметров качества жизни, снижению частоты госпитализаций, обращаемости за медицинской помощью и необходимости перепрограммирования ЭКС, а так же повышению выживаемости. Положительный ответ на стимуляцию с использованием индивидуальных параметров, определенных с помощью стресс-эхокардиографии не зависит от режима стимуляции. 3. Характер болевого синдрома у больных с установленным ЭКС изменяется, использование эхокардиографии становится основным методом выявления прогрессирования ИБС. Предложенный метод стресс-эхокардиографии с перепрограммированием частоты стимуляции установленного искусственного водителя ритма, позволяет на ранних этапах выявлять признаки коронарной недостаточности. Больным со средней степенью тяжести синдрома ЭКС показано проведение исследования для выявления прогрессирования ИБС. 4. Внутрисердечный электромеханический асинхронизм приводит к прогрессированию ХСН. Определение электромеханического асинхронизма имеет важное прогностическое значение и требует раннего активного выявления его признаков для своевременного направления больных на лечение с использованием сердечной ресинхронной терапии. Разработан и апробирован диагностический алгоритм выявления внутрисердечного асинхронизма у больных с ХСН. 5. Сердечная ресинхронизирующая терапия с использованием бивентрикулярной электрокардиостимуляции восстанавливает внутрижелудочковый синхронизм, что сопровождается длительной (в течение 3 лет) положительной динамикой ХСН, снижением частоты госпитализаций и обращаемости за медицинской помощью, улучшением качества жизни, и повышением выживаемости по сравнению с медикаментозным лечением. 6. При отборе пациентов для проведения СРТ необходимо уделять внимание таким параметрам электромеханического асинхронизма как механическая межжелудочковая задержка и индекс внутрижелудочкового асинхронизма (по данным эхокардиографии с использованием импульсной допплерографии и тканевой допплерографии), а не только ширине комплекса QRS. При подборе параметров атриовентрикулярной и межжелудочковой задержки у больных с СРТ с использованием бивентрикулярного электрокардиостимулятора необходимо использовать эхокардиографию с импульсно-волновой тканевую допплерографию миокарда. допплерографией и Реализация и внедрение полученных результатов Результаты исследования используются в научной и клинической деятельности кафедр терапии и кардиологии Государственного института усовершенствования врачей Министерства Обороны Российской Федерации, в кардиологических отделениях Главного военного клинического госпиталя им. акад. Н.Н. Бурденко и Центрального военного госпиталя им. акад. А.А. Вишневского. Апробация работы. Основные положения работы были представлены в виде докладов и обсуждены на Всеармейской конференции по эффективности лечения и улучшению качества жизни больных с сердечно-сосудистыми заболеваниями (Москва. 2005), Московском обществе терапевтов (Москва, 2007), на Всероссийской образовательной Интернет-программе для врачей «Проблемы интерниста» (2007). По результатам работы изданы: «Методические рекомендации по диагностике и лечению хронической сердечной недостаточности», «Сборник методических рекомендаций по кардиологии» «Указания по диагностике и лечению больных с ишемической болезнью сердца», «Учебно-методическое пособие по диагностике и лечению диастолической функции ЛЖ» По теме диссертации опубликовано 20 печатных работ. Объем и структура работы. Диссертация изложена на 290 страницах машинописного текста, состоит из введения, 7 глав, выводов, практических рекомендаций, приложений и указателя литературы, включающего 348 источников, в том числе 116 отечественных и 232 зарубежных. Текст иллюстрирован 86 таблицами, 40 рисунками. Основные положения, выносимые на защиту. 1. У больных с ХСН использование однокамерной электрокардиостимуляции типа VVI приводит к дальнейшему прогрессированию заболевания. Через год показатели тяжести ХСН достоверно ниже исходных значений. Эффективность этого режима достоверно ниже, по сравнению с медикаментозной терапией. 2. Использование стресс-эхокардиографии с перепрограммированием частоты стимуляции установленного ЭКС в подборе параметров стимуляции у больных с ХСН оказывает длительное позитивное воздействие на течение ХСН не зависимо от режима стимуляции. Это сопровождается улучшением гемодинамических показателей, качества жизни и повышением выживаемости. 3. Имплантация искусственного водителя ритма у больных с ИБС приводит к изменению характера болевого синдрома. Использование стрессэхокардиографии путем перепрограммирования частоты стимуляции ЭКС позволяет выявлять прогрессирование коронарной недостаточности. Синдром ЭКС маскирует прогрессирование коронарной недостаточности, достоверно чаще ультразвуковые маркеры ишемии регистрируются у пациентов со средней степенью тяжести синдрома ЭКС. 4. Наличие внутрисердечного асинхронизма у больных с ХСН сопровождается прогрессирование заболевания, снижением качества жизни, прогрессированием дисфункции миокарда и снижением выживаемости. 5. Выявление увеличения внутрижелудочковой механической задержки свыше 100 мс в М-режиме при транторакальной эхокардиографии в покое является показанием к проведению тканевой допплерографии миокарда для своевременного выявления внутрисердечного асинхронизма. 6. Сердечная ресинхронизирующая терапия с использованием бивентрикулярной электрокардиостимуляции по сравнению с медикаментозным лечением восстанавливает внутрижелудочковый синхронизм, что сопровождается длительной (в течение 3 лет) положительной динамикой ХСН, снижением частоты госпитализаций и обращаемости за медицинской помощью, улучшением качества жизни, и повышением выживаемости. 7. Выявление параметров электромеханического асинхронизма, таких как механическая межжелудочковая задержка и индекс внутрижелудочкового асинхронизма, а не только ширина комплекса QRS, при отборе пациентов на кардиоресинхронную терапию позволяет повысить эффективность СРТ. При подборе параметров атриовентрикулярной и межжелудочковой задержки у больных с СРТ с использованием бивентрикулярного электрокардиостимулятора необходимо использовать скоростные параметры трансаортального и трансмитрального потоков, а так же систолическую и диастолическую скорость движения фиброзного кольца МК, используя импульсно-волновую допплерографию и тканевую допплерографию миокарда. СОДЕРЖАНИЕ ДИССЕРТАЦИОННОГО ИССЛЕДОВАНИЯ 1. Материалы и методы исследования Исследование выполнено на базе Главного военного клинического госпиталя им. акад. Н.Н.Бурденко и кафедры терапии Государственного института усовершенствования врачей Министерства обороны Российской Федерации. 1.1. Клиническая характеристика обследованных больных Среди всех обследованных больных, вошедших в выборку, основную группу составили 315 человек. На этой группе были выработаны основные диагностические и прогностические подходы, использованные в работе. Исследуемая группа состояла из 315 человек в возрасте 45-89 лет, средний возраст 64,716,4. Из них 276 мужчин средний возраст 63,98,5 лет и 39 женщин, средний возраст 65,87,4 лет. Наличие ХСН было подтверждено результатами стационарного обследования пациентов в соответствии с Национальными рекомендациями по диагностике и лечению ХСН (Беленков Ю.Н. с соавт., 2003). Для оценки выраженности клинических проявлений ХСН использовали разделение по функциональным классам на основании критериев, предложенных Нью-Йоркской ассоциацией кардиологов (NYHA, 1964) в модификации Российского общества специалистов сердечной недостаточности (ОССН, 2002). В основном группа была представлена пациентами с III ФК ХСН, в целом по группе их доля составила 60,0%, пациенты с ХСН I-II ФК составляли 18,1%, а тяжелая ХСН IV ФК встречалась в 15,9% случаев. Различий по тяжести ХСН в зависимости от пола и возраста выявлено не было, это дало нам возможность в дальнейшем не выделять отдельных групп по полу и возрасту. Диагнозы основных нозологических форм устанавливались в стационаре на основании общепринятых критериев. В исследование не включались больные ХСН на фоне активного воспалительного процесса в сердце (миокардит, ревмокардит, инфекционный эндокардит, перикардит), с гемодинамически значимым первичным клапанным поражением (ревматизм, инфекционный эндокардит, склеродегенеративные изменения), а также с сопутствующей патологией внутренних органов, которая могла существенным образом повлиять на прогноз пациентов (онкологические заболевания, тяжелая почечная недостаточность, декомпенсированный сахарный диабет и др.). Основной причиной ХСН в исследуемой группе была ИБС – 284 человека (91,2%), у 31 человека (9,8%) ХСН развилась на фоне постмиокардитического кардиосклероза – 22 человека (6,9%) и дилатационной кардиомиопатии (ДКМП) – 9 человек.(2,9%). Стенокардия напряжения встречалась у 249 человек (79,0%), стенокардия I ФК у 15 человек (4,8%), II ФК у 156 человек (49,5%), III ФК у 78 человек (24,8%). Инфаркт миокарда (ИМ) в анамнезе был зарегистрирован у 120 человек (38,1%), один ИМ - у 60 человек (19,0%), два ИМ- у 45 человек (14,3%), 3 ИМ - у 15 человек (4,8%). Наиболее часто среди сопутствующих нарушений ритма были зарегистрированы: желудочковая экстрасистолия в 51,7% случаев, предсердная экстрасистолия составляла 25,4% случаев, атриовентрикулярная блокада была выявлена в 27,9% случаев. Фибрилляция предсердий встречалась в 29,8% случаев, суправентрикулярная тахикардия – в 20,6% случаев. Синдром слабости синусового узла был установлен у 90 человек (28,6%). Артериальной гипертензией 243 человека (77,1%), указания в анамнезе на перенесенные инсульты имели 37 человек (11,7%).Сахарный диабет встречался у 59 человек (18,7%), был представлен типом II, у всех пациентов находился в фазе компенсации и/или субкомпенсации. В соответствии с задачами исследования были сформированы группы больных ХСН, получавших тот или иной вид лечения (табл. 1). Таблица 1 Группы больных ХСН по проводимому лечению Проводимое лечение у больных с ХСН Колво чел. 120 1 группа Медикаментозная терапия ХСН + ЭКС, типа VVI или DDD. 2 группа Медикаментозная терапия ХСН + ЭКС, типа VVI или DDD. Подбор параметров стимуляции с использованием стресс-эхокардиографии Больные ХСН, получающие только медикаментозную терапию 90 Подгруппа с широким комплексом QRS>120 мс 30 Подгруппа с узким комплексом QRS<120 мс 35 Медикаментозная терапия ХСН + сердечная ресинхронная терапия 40 3 группа 4 группа 65 В первую группу вошли 120 больных ХСН (100 мужчин и 20 женщин), сопоставимые по возрасту, полу и функциональному классу ХСН, которые получали стандартную медикаментозную терапию по поводу ХСН и по показаниям которым были имплантированы искусственные водители ритма типа VVI или DDD, подбор параметров стимуляции осуществлялся по стандартной методике. Вторая группа состояла из 90 чел. (80 мужчин и 10 женщин) в возрасте 63,66,2 лет больных ХСН, получающих адекватную современную терапию по коррекции ХСН, которым по показаниям были имплантированы искусственные водители ритма типа VVI или DDD. Подбор параметров стимуляции осуществлялся с использованием стресс эхокардиографии. В течении 5-ти лет оценивалась динамика ХСН, эхокардиографические параметры систолической и диастолической функций, оценка локальной сократимости, качество жизни и выживаемость больных. В течение первого года определялась частота обращаемости за медицинской помощью (частота госпитализации, частота амбулаторного обращения, частота вызова неотложной помощи, а так же частота необходимости перепрограммирования ЭКС). Проведен анализ осложнений и причин смерти в группе больных в зависимости от режима стимуляции. Проанализировано течение ИБС у пациентов с установленными ЭКС. Выделена группа пациентов с синдромом ЭКС различной степени тяжести и проанализированы эхокардиографические изменения, возникающие у этих пациентов. Проведен сравнительный анализ подбора параметров А-В задержки – стандартизированный подбор, подбор оптимальной А-В задержки с использованием допплерографии и формулы Риттера, и подбор оптимальной А-В задержки на фоне нагрузочного тестирования. Третью группу составили 65 человек, получающих только медикаментозную терапию, среди них были выделены две подгруппы в зависимости от ширины комплекса QRS. Наличие широкого комплекса QRS> 120 мс является маркером электрического асинхронизма. В подгруппах с широким и узким комплексом QRS проведена сравнительная оценка динамики ХСН, эхокардиографических параметров систолической и диастолической функций, локальной сократимости, качества жизни больных и выживаемости больных. В течение первого года определялась частота обращаемости за медицинской помощью (частота госпитализации, частота амбулаторного обращения, частота вызова неотложной помощи). Проведен анализ частоты встречаемости различных видов желудочкового асинхронизма в зависимости от величины внутрижелудочковой задержки измеренной в М-режиме при проведении трансторакальной Эхо-Кг. Для изучения клинических и гемодинамических эффектов сердечной ресинхронизирующей терапии была создана четвертая группа, состоящая из 40 мужчин с ХСН III-IV ФК в возрасте 66,711,9 лет с рефрактерной к медикаментозной терапии ХСН. Всем пациентам в центре интравеционной кардиологии ГВКГ им. акад. Н.Н.Бурденко имплантированы устройства для бивентрикулярной стимуляции, у 12 человек (30,0%) с постоянной фибрилляцией предсердий использованы двухэлектродные системы типа VVIDBiv (правый – левый желудочек), у 28 больных (70,0%) с синусовым ритмом – трехэлектродные системы типа DDDBiV. Использованы следующие виды кардиоресинхронных устройств (КРСУ) Biotronik Triplos в 9 случаях, Stratos в 19 случаях, Axios – в 8 случаях Medtronic InSync Protect, обладающий функцией кардиовертерадефибриллятора – в 3 случаях, отечественный ЭКС -530 с использованием Y-образного переходника в 1 случае. В течение трех лет оценивалась динамика сердечной недостаточности эхокардиографические параметры систолической и диастолической функций, оценка локальной сократимости, качество жизни больных и выживаемость больных. В течение первого года определялась частота обращаемости за медицинской помощью (частота госпитализации, частота амбулаторного обращения, частота вызова неотложной помощи). Проанализировано влияние СРТ на изменение параметров асинхронизма. Контрольную группу составили 30 человек 25 мужчин и 5 женщин в возрасте от 42 до 64 лет (средний возраст 568,4), которые были однородны по возрасту и полу, без признаков хронической сердечной недостаточности или с минимальными ее проявлениями ФК не более I. Проведение клинического исследования одобрено Комитетом по вопросам этики при Главном военном клиническом госпитале им. акад. Н.Н.Бурденко. 1.2. Методы исследования Клинические методы исследования. Исходно при поступлении в клинику выполнялось комплексное обследование, включавшее оценку клинических данных и факторов сердечно-сосудистого риска, лабораторные и инструментальные исследования. Результаты вносились в разработанную автором формализованную историю болезни. Клиническое состояние пациентов оценивалось по балльной шкале (ШОКС по В.Ю.Марееву, 2000). Толерантность к физической нагрузке по 6ти минутному тесту. Лабораторные методы исследования. Количественные характеристики состава крови оценивались на основании результатов общеклинического анализа по стандартной методике. Биохимические исследования крови осуществляли с помощью биохимического анализатора фирмы «Spectrum», США. Кроме того, унифицированными методами оценивался белковый и липидный состав крови. Все исследования проводились в лабораториях ГВКГ им. акад. Н.Н.Бурденко. Методика проведения стресс-эхокардиографии у больных с имплантированным водителем ритма типа VVI или DDD. У больных, в первые три месяца после установки ЭКС выполнялась ЭхоКг покоя с оценкой локальной и глобальной сократимости, затем была проведена нагрузочная Эхо-Кг с перепрограммированием частоты электрокардиостимуляции. Длительность каждой ступени 2 минуты. Начальная частота стимуляции – 100 имп/мин, затем частота увеличивалась на 10 имп. в минуту до достижения субмаксимальной частоты для данного пола и возраста. В конце второй минуты каждой ступени нагрузки оценивалась локальная сократимость миокарда по данным ЭхоКг и ЭКГ показатели. Визуализация сердца проводилась из стандартных для проведения стрессэхокардиографии доступов и позиций Анализ нарушений регионарной сократимости основывался на условном разделении ЛЖ на 16 сегментов. В нашем исследовании использовалась схема типа «мишень», в которой интегрально представлены все сегменты и отделы ЛЖ, верхушка расположена в центре, базальный отдел снаружи (Седов В.П., Алехин М.Н., Корнеев Н.В. 2000) При поэтапном увеличении частоты стимуляции определяется пороговая частота стимуляции, на которой возникают классические клинические и/или ультразвуковые маркеры ишемической болезни сердца. Проба считается положительной при появлении новых нарушений локальной сократимости или усугублении уже имеющихся нарушений сократимости не менее чем в двух сегментах. Болевой синдром, не сопровождающийся объективными признаками ишемии миокарда, не может служить критерием положительной пробы. При наличии признаков коронарной недостаточности пациент сублингвально принимал таблетки нитроглицерина, исчезновение клинических и/или эхокардиографических изменений подтверждало ишемический генез их происхождения. Частота, на которой возникает ишемический ответ, является пороговой частотой стимуляции. Максимальная частота стимуляции в последующем программируется на 5-10 импульсов в минуту ниже пороговой частоты. Восстановительный период после завершения исследования составлял не менее 10 минут. С учетом показателей фракции выброса и ударного объема программируются базовая и минимальная частота стимуляции. На этом этапе подбор параметров для однокамерного ЭКС окончен. Для физиологического ЭКС возможно программирование АВ-задержки. На максимальной частоте определяется АВ-задержка по соотношению пиков трансмитрального потока, близкому к таковому у здоровых пациентов. Это значение АВ-задержки оптимально для максимальной частоты. По окончании восстановительного периода с учетом показателей трансмитрального потока определяется АВ-задержка на базовой частоте стимуляции. Если значение установленной АВ-задержки на базовой частоте стимуляции больше, чем значение АВ-задержки определенное на максимальной частоте стимуляции, то программируется более короткое ее значение. Полученные значения параметров стимуляции, определенные с помощью объективной инструментальной методики, являются оптимальными для данного пациента. Эхокардиография и тканевая допплерография миокарда. Одним из основных методов, использовавшихся в работе, была эхокардиография (ЭхоКГ). ЭхоКГ выполнялись с помощью эхокардиографического комплекса «Vivid 3» (GE Medical Systems) со специальной программой обработки изображений (EchoPAC), «Vivid 5» (GE Medical Systems) со специальной программой обработки изображений (EchoPAC), а также прибора «Sequoia 512» (Acuson-Siemens, США). Все ультразвуковые изображения были синхронизированы с ЭКГ. Определяли размеры камер сердца, рассчитывали конечный диастолический объем левого желудочка, фракцию выброса левого желудочка (ФВЛЖ) по методу Симпсона (Шиллер Н.Б., Осипов М.А., 2005). На основании имеющихся рекомендаций (Васюк Ю.А., 2003) рассчитывали диастолический индекс сферичности (ИСд). Нарушения локальной сократимости миокарда оценивали в соответствии с общепринятой методикой в 16 сегментах ЛЖ по степени их выраженности в баллах с последующим расчетом индекса нарушений локальной сократимости (ИНЛС) по формуле: ИНЛС = сумма нарушений локальной сократимости /16. На основании допплерографии трансмитрального кровотока оценивались следующие параметры диастолической функции левого желудочка: максимальные скорости пиков раннего (E) и позднего (A) диастолического наполнения и их соотношение (E/A), время замедления кровотока раннего наполнения (DT) и время изоволюмического расслабления (IVRT). С целью унификации данных, показатели трансмитрального кровотока определялись во время выдоха. Выраженность митральной регургитации оценивали с использованием индекса митральной недостаточности (ИМН) (Шиллер Н.Б., Осипов М.А., 2005) ИМН = сумма баллов/число исследованных параметров При наличии митрально регургитации рассчитывался показатель общей сократимости левого желудочка dP/dt – скорость увеличения давления в левом желудочке в начале периода изгнания, в норме показатель не менее 1350 мм рт ст/сек. Степень тяжести трикуспидальной недостаточности оценивали по шире перешейка, тяжелой считалась регургитация при ширине перешейка более 7 мм. (Шиллер Н.Б., Осипов М.А., 2005). Оценку легочной гипертензии проводили по общепринятым эхокардиографическим канонам. Рассчитывали систолическое и среднее давление в легочной артерии. Для оценки среднего давления использовали формулу Китабатаке и/или Добестани. При проведении тканевой допплерографии (ТД) миокарда в импульсноволновом режиме анализировали скорости движения продольных волокон миокарда. Глобальные систолическая и диастолическая функции продольных волокон миокарда оценивались путем анализа скоростей движения в области фиброзных колец атриовентрикулярных клапанов по 3 ультразвуковым сечениям из апикального доступа (четырехкамерного, двухкамерного и сечения по длинной оси левого желудочка), с последующим расчетом средних значений для левого и правого желудочков. Для оценки диастолической функции оценивали показатель Vp – диастолическое продвижение потока в ЛЖ . В норме этот показатель более 50 см/сек, при псевдонормальном и рестриктивном типах нарушения диастолической функции, этот показатель снижается менее 45 см/сек. Соотношение показателей Е/е скорости раннего диастолического трансмитрального потока (Е) и максимальной скорости фиброзного кольца митрального клапана в раннюю диастолу (е) отражает конечно диастолическое давление в ЛЖ. В норме этот соотношение составляет 5-10, при значениях более 10 конечно диастолическое давление в ЛЖ превышает 15 мм рт ст. Используя эти показатели возможно рассчитать и давление заклинивания в легочной артерии ДЗЛА (Никитин Н.П., Киланд Д.Ф. 2002). ДЗЛАср. = 1,24 Е/е + 1,9 Оценка электромеханического асинхронизма работы сердца. С помощью одномерной эхокардиографии измеряли внутрижелудочковую механическую задержку систолического сокращения задней стенки левого желудочка по отношению к межжелудочковой перегородке (ВЖМЗЗС-МЖП) (Yu C.M., Zhang O. et al. 2003, 2005; Schuster P. et al. 2005) . С помощью импульсно-волновой допплерографии оценивали межжелудочковую механическую задержку (МЖМЗ), как разницу между пресистолическими интервалами от зубца Q до начала потоков в легочной артерии и аорте (Lane R.E. et al., 2004). С помощью ТД миокарда по 12 сегментам левого желудочка – 6 базальным и 6 средним, оценивалась электромеханическая задержка (ЭМЗ), как интервал от зубца Q ЭКГ до пиковой систолической скорости движения исследуемого участка миокарда. Далее рассчитывали миокардиальную межжелудочковую механическую задержку (МЖМЗТДМ) по разнице ЭМЗ базальных сегментов правого и левого желудочков, индекс внутрижелудочкового асинхронизма (ИВЖА), как стандартное отклонение ЭМЗ по 6 базальным и 6 средним сегментам левого желудочка. (Bax J.J. et al., 2003). Методики оптимизации программирования бивентрикулярного электрокардиостимулятора. Оптимизацию предсердно-желудочковой (AV) и межжелудочковой (VV) задержки выполняли с помощью программаторов под эхокардиографическим контролем. Оптимизацию VV задержки проводили путем допплерографической оценки максимального значения интеграла скоростей аортального кровотока во времени – velocity time integral или VTI (Lane R.E. et al., 2004). Оптимизацию AV задержки проводили с помощью допплерографии трансмитрального кровотока по методике P.Ritter (1999). Электрокардиографические методики. Всем обследуемым регистрировали ЭКГ покоя по обычной методике с помощью 12-канального электрокардиографа MAC 1200 ST («GE Medical Systems»). Суточное мониторирование ЭКГ выполняли с помощью программно-аппаратных комплексов «CardioSoft Holter» («GE Medical Systems»). По электрокардиографическим данным оценивались признаки ишемии миокарда, нарушения ритма и проводимости. Методика исследования качества жизни. Исследование качества жизни выполнялось в соответствии с имеющимися рекомендациями по изучению качества жизни в медицине (Новик А.А., Ионова Т.И., 2002). Использовался общий адаптированный опросник «Medical Outcomes Study 36-Item Short Form Health Survey» (SF-36). 1.3.Методы статистической обработки материала Статистическая обработка результатов исследования проводилась на персональном компьютере с применением пакета прикладных программ «Statistica for Windows» в соответствии с имеющимися рекомендациями (Реброва О.Ю., 2003). Определялись: средние значения, стандартная ошибка, среднее квадратичное отклонение, вариационный размах, максимальные и минимальные значения. Достоверность различия среди значений показателей определялась с помощью tкритерия Стьюдента, а в малых выборках с помощью непараметрического критерия Вилкоксона. Из методов многомерного статистического анализа использовались корреляционный, дискриминантный и дисперсионный виды анализа. Применялся анализ выживаемости по методу множительных оценок Каплана-Мейера с использованием таблицы распределения времен жизни. Учитывались существующие рекомендации по статистической обработке данных клинических и лабораторных исследований (Юнкеров В.И. с соавт., 2000). РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ 2. Динамика тяжести СН у пациентов с имплантированными ЭКС в зависимости от режима и способа подбора параметров стимуляции. В нашем исследовании у 210 пациентов (180 мужчин и 30 женщин) были выявлены показания для установки искусственного водителя ритма. Из них было сформировано 2 группы. В первую вошли 120 человек ,100 мужчин средний возраст 64,97,9 лет и 20 женщин – средний возраст 64,27,6 года, которым были установлены электрокардиостимуляторы однокамерные типа VVI у 64 человек и двухкамерные типа DDD у 56 человек. Параметры стимуляции устанавливались по стандартным методикам. Вторую группу составили 90 человек, 80 мужчин – средний возраст 60,46,7 лет и 10 женщин – средний возраст 66,45,2 года, у которых для подбора параметров стимуляции использовалась стрессэхокардиографии с перепрограммированием частоты стимуляции установленного ЭКС. По тяжести сердечной недостаточности группы не различались, так клинически выраженная ХСН III и IV ФК в первой группе составляла 75%, а во второй – 84,5%. В течение 5 лет проводилась оценка динамики тяжести ХСН, качества жизни и выживаемости. 2.1 Динамика тяжести СН у пациентов с имплантированными ЭКС типа DDD в зависимости от способа подбора параметров стимуляции. Таблица 2 Сравнительная характеристика тяжести СН у пациентов с имплантированными ЭКС типа DDD в первой и второй группах за 5 лет. ФК СН До имплантации ЭКС DDD через 1год DDD года через 3 DDD через 5 лет I гр. II гр. I гр. II гр. I гр. II гр. I гр. II гр. I ФК (%) 3,6% 2,5% 7,0% 15,8%* 23,9% 27,0%* 27,9% 28,6%* II ФК (%) 10,7% 12,5% 45,3% 42,1% 52,2% 51,4% 53,5% 57,1%** III ФК (%) 71,4% 70,0% 30,2% 34,2% 19,6% 18,9% 18,6% 14,3%** IV ФК (%) 14,3% Среднее 2,91 значение ФК +0,23 15,0% 7,5% 7,9% 4,3% 2,7%** 2,90 + 2,34 + 2,08 + 2,01 + 1,92 + 1,86 + 1,80 0,28 0,16 0,21* 0,12 0,10* 0,16 0,12 Тест 6-ти минутной ходьбы , м ШОКС, баллы 220 + 28 220 24 8,7 + 0,6 8,7+ 0,6 + + 276 + 24 310 + 20 326 + 20 364 + 16* 352+ 22 398+ 16 7,6 + 0,7 7,0 + 0,4* 6,9 + 0,6 5,9+ 0,3** 6,0 + 0,7 5,0+ 0,7** Примечание: * - р<0,05, ** - р<0,01, сравнение групп по годам При анализе данных таблицы 2 видно, что исходно среди пациентов, которым имплантировался ЭКС типа DDD, в группах не было различия по тяжести сердечной недостаточности. Больные с клинически выраженной и значимой сердечной недостаточностью составили 48 человек (85,7%) в первой группе и 34 человека (85,0%) во второй группе. Среднее значение ФК сердечной недостаточности составило2,910,23 и 2,90 + 0,28 соответственно. Через год после установки физиологического электрокардиостимулятора отмечалась положительная реакция, так среднее значение ФК сердечной недостаточности во второй группе достоверно снизилось и составило 2,08 + 0,21 (р <0,005). Достоверно возросла доля пациентов во второй группе с I ФК – 15,8% (р <0,05). Доля пациентов с клинически выраженной и значимой сердечной недостаточностью составила 40,0% во второй группе и 37,7% в первой группе. Данный показатель уменьшился по сравнению с исходным на 45% во второй группе и на 48% в первой группе. Различия в группах не носили достоверного характера Спустя 5 лет у пациентов с установленным ЭКС типа DDD продолжала сохраняться положительная динамика. Происходил дальнейший рост доли пациентов с I ФК и II ФК 28,6% и 57,1% соответственно, эти показатели достоверно выше, чем в первой группе ,где эти значения соответственно были равны 27,9% и 53,5%. Доля пациентов с клинически выраженной и значимой сердечной недостаточностью была достоверно ниже во второй группе и составила 14,3% по сравнению с 18,6% в первой группе и была представлена в обеих группах только пациентами с III ФК. Среднее значение ФК сердечной недостаточности через 5 лет составило 1.80 + 0,12 во второй группе и 1,86 0,12 в первой группе различия не носят достоверный характер. Направление динамики тяжести хронической сердечной недостаточности во второй группе больных с установленным ЭКС типа DDD существенно не отличалось от пациентов первой группы. Так же происходило со временем увеличение доли больных с ХСН I и II ФК, доля же пациентов с клинически выраженной сердечной недостаточностью снижалась и к пятому году была представлена только лицами с III ФК. Однако во второй группе пациентов показатель ШОКС был достоверно выше уже через год после установки электрокардиостимулятора и составляет соответственно 7,0 + 0,4 по сравнению с 7,6 + 0,7 баллов в первой группе (р<0,01). Через пять лет продолжало сохраняться достоверное отличие в пользу пациентов второй группы. Тест 6-ти минутной ходьбы достоверно был выше в группе пациентов второй группы лишь через 3 года после установки ЭКС и составлял соответственно 364 + 16 и 316 + 20 м (р<0,01). К пятому году достоверного различия в этом тесте нет. Таким образом, использование стресс-эхокардиографии в подборе параметров стимуляции приводит к увеличению доли пациентов с ХСН I и II ФК, что сопровождается уменьшением показателей по шкале ШОКС и снижением среднего значения ФК хронической сердечной недостаточности. 2.2 Динамика тяжести СН у пациентов с имплантированными ЭКС типа VVI в зависимости от способа подбора параметров стимуляции. Таблица 3 Сравнительная характеристика тяжести СН у пациентов с имплантированными ЭКС типа VVI в первой и второй группах за 5 лет. До имплантации ЭКС VVI через год VVI через 3 года VVI через 5лет I гр. II гр. I гр. II гр. I гр. II гр. I гр. II гр. I ФК (%) II ФК (%) 6,3% 9,3% 4,0% 12,0% 9,3% 4,4% 17,8%* 5,3% 3,1% 12,1%* III ФК (%) 73,4% 72,0% 77,7% 66,7%* 79,0% 81,3% 75,7%* IV ФК (%) 11,0% 12,0% 13,0% 11,1%** 15,7% 18,9% * 70,3% * 10,8% * 15,6% 12,1%* Среднее значение ФК 2,84+ 0,18 2,86+ 0,21 2,98+ 0,20 2.78+ 0,18** 2,84+ 0,16* 3,12+ 0,16 2,96+ 0,13* ФК СН 3,03+ 0,12 Тест 6-ти минутной ходьбы , м ШОКС, баллы 242+28 220+24 226+24 280+28 ** 202+ 26 220+ 26* 180+ 28 198+ 28* 7,9+0,8 8,4+0,6 8,2+0,6 6,0+0,6 ** 10,5+ 0,6 8,0+ 0,6** 12,6+ 0,8 9,6+ 0,8** Примечание: * - р<0,05, ** - р<0,01, сравнение групп по годам При анализе данных таблицы 3 видно, что исходно среди пациентов, которым имплантировался ЭКС типа VVI, в группах не было различия по тяжести сердечной недостаточности (таб. 3). Больные с клинически выраженной и значимой сердечной недостаточностью составили 54 человека (84,4%) в первой группе и 42 человека (84,0%) во второй группе. Среднее значение ФК сердечной недостаточности составило 2,840,18 и 2,86 + 0,21 соответственно. Через год после имплантации ЭКС в исследуемой группе пациенты с сердечной недостаточностью I ФК составили 4,4% (2 человека), II ФК имели 17,8% пациентов (8 человек), больных с III ФК и IV ФК было 66,7% (30 человек) и 11,1% (5 человек) соответственно. В отличие от первой группы появились пациенты с I ФК, возросла доля пациентов со II ФК 17,8% по сравнению с 9,3% в первой группе. Группа пациентов с клинически выраженной и значимой сердечной недостаточностью составила 77,8% (35 человек), что на 12,9% меньше чем в первой группе пациентов. Среднее значение ФК сердечной недостаточности во второй группе было достоверно ниже и составило 2,78 + 0,21 против 2,98 + 0,2 в первой группе. Через 5 лет в распределении тяжести сердечной недостаточности иных тенденций не выявлялось, так число лиц со II ФК составляло 12,1% (4 человека), по сравнению с 3,1% в первой группе, число больных с III ФК составило 75,7% (25 человек) по сравнению с 81,3% в первой группе, а с IV ФК – 12,1% (4 человека) по сравнению с 15,6% в первой группе. Таким образом, через 5 лет доля пациентов с клинически выраженной и значимой сердечной недостаточностью была равна 87,9% (29 человек), что на 9,0% меньше чем в первой группе. Среднее значение ФК сердечной недостаточности через 5 лет во второй группе составило 2,96 + 0,13 по сравнению с первой группой, где это значение составило 3,12 + 0,16. Однако, если проанализировать динамику сердечной недостаточности во второй группе, то обращает на себя внимание тот факт, что позитивное влияние отчетливо проявляется лишь через год после установки ЭКС, к третьему году показатели возвращаются к исходным данным, где доля пациентов с клинически выраженной сердечной недостаточностью составила 81,1% (30 человек), исходно этот показатель был равен 84,0%. Среднее значение ФК сердечной недостаточности так же не отличается от исходного значения, и составляют 2,84 + 0,16 и 2,86 + 0,21 соответственно. Через 5 лет во второй группе увеличивается доля пациентов с III ФК по сравнению с исходными данными 75,7% и 72,0% соответственно, доля пациентов с II ФК и IV ФК не отличаются от исходных значений. Доля пациентов с клинически значимой сердечной недостаточностью среди пациентов 2-й группы составляет 87,9% (29 человек), исходно доля этих пациентов составляла 84,0%. Среднее значение ФК сердечной недостаточности через 5 лет 2,96 + 0,13 по сравнению с исходным значением 2,86 + 0,21. Мы сравнили через год после начала лечения эффективность медикаментозной терапии и однокамерной стимуляции типа VVI в коррекции ХСН. В качестве группы сравнения, получающей медикаментозную терапию, мы исследовали показатели у пациентов третьей группы с «узким» комплексом QRS. При однокамерной электрокардиостимуляции через год показатели фракции выброса были достоверно ниже, чем в группе с «узким» комплексом QRS и составляли соответственно 44,3±3,7 и 49,3±2,8 . Среди пациентов с однокамерной электрокардиостимуляцией через год отмечалось достоверное увеличение индекса нарушения локальной сократимости до 1,6±0,1 по сравнению с 1,3±0,2 в группе пациентов, получающих медикаментозную терапию. Это очевидно свидетельствует о прогрессировании коронарной недостаточности у пациентов, с установленным однокамерным ЭКС типа VVI. Через год на фоне проводимой терапии в группе пациентов с «узким» комплексом QRS исчезли пациенты с IV ФК, а в группе пациентов с однокамерной стимуляцией напротив исчезли пациенты с I ФК. Совокупно доля пациентов с клинически значимой и выраженной ХСН среди пациентов с электрокардиостимуляцией типа VVI составила 90,7%, а среди пациентов получающих только медикаментозную терапию – 74,1%. Среднее значение ФК в группах соответственно составило 2,98 + 0,20 и 2,4 + 0,4. Толерантность к физической нагрузке по данным 6-ти минутного теста также была достоверно выше у пациентов, получающих только медикаментозную терапию и составила 365 + 28 м, по сравнению с пациентами с однокамерной электрокардиостимуляцией, где этот показатель был равен 226 + 24 м. Бальная оценка клинического состояния по шкале ШОКС была достоверно выше у пациентов с «узким» комплексом QRS и составляла 6,6 + 0,8 баллов по сравнению с 8,2 + 0,6 баллами у пациентов с электрокардиостимуляцией типа VVI . Установка однокамерного ЭКС у больных с ХСН нецелесообразна, поскольку уже через год отмечается прогрессирование сердечной недостаточности, увеличивается функциональный класс ХСН, число баллов по шкале клинического состояния и снижается толерантность к нагрузке. Эффективность медикаментозной терапии достоверно выше, чем данный режим стимуляции. Использование стресс-эхокардиографии в подборе индивидуальных параметров ЭКС типа VVI оказывает позитивное влияние на течение сердечной недостаточности, однако, начиная с третьего года наблюдения позитивное влияние снижается и отмечается прогрессирование признаков сердечной недостаточности, хотя эти показатели достоверно ниже, чем показатели в первой группе. 2.3 Сравнительная характеристика обращаемости за медицинской помощью и необходимости перепрограммирования ЭКС в первой и второй группах Нами изучена частота обращаемости за медицинской помощью в зависимости от различных методов подбора параметров стимуляции, а так же отдельно проанализирована частота подбора и/или изменения параметров стимуляции. Анализ проведен за первый год наблюдения после установки ЭКС Использование стресс-эхокардиографии для подбора режима стимуляции различных видов ЭКС оказывало позитивное влияние на течение заболевания в целом по группе больных. Так частота обращаемости за медицинской помощью по поводу сердечно-сосудистой патологии была достоверно ниже во второй группе, где она составляет 2,9±0,2 раз в год по сравнению с первой группой, где это значение составляло 4,3±0,3. Так же достоверно ниже была обращаемость по поводу хронической сердечной недостаточности во второй группе по сравнению с первой, где эти значения соответственно составляли 2,1±0,3 и 4,6±0,4 раз в год. Число вызовов неотложной медицинской помощи так же было достоверно ниже во второй группе. Особого внимания заслуживает факт снижения во второй группе необходимости перепрограммирования ЭКС, так во второй группе этот показатель составил 0,6±0,2 раз в год, а в первой группе 2,5±0,3 раз в год, иными словами практически в четыре раза реже возникала необходимость перепрограммирования электрокардиостимулятора. Это, безусловно, будет сопровождаться более адекватным ответом со стороны гемодинамики на стимуляцию, а во вторых лучшей переносимостью стимуляции и более длительным периодом службы ЭКС. 2.4 Сравнительная характеристика осложнений, возникающих при установке различных видов ЭКС в зависимости от способа подбора параметров стимуляции Таблица 4 Сравнительная характеристика осложнений после установки различных видов ЭКС у пациентов первой и второй групп. Осложнения VVI Итого DDD I гр. N=64 45,3% II гр. N=50 22,0%* I гр. N=56 17,9% II гр. N=40 10,0%* I гр. N=120 32,5% II гр. N=90 16,7%* Развитие хронической формы ФП Прогрессирование ИБС 32,8% 26,0%* 12,5% 7,5%* 23,3% 17,8%* 21,9% 12,0%* 17,9% 10,0%* 20,0% 11,1%* Тромбоэмболические осложнения и инсульты Прогрессирование СН 15,6% 12,0% 5,4% 2,5% 10,8% 7,8% 54,7% 40,0%* 28,6% 15,0%* 42,5% 28,9%* Синдром ЭКС Примечание: * - р<0,05, ** - р<0,01, сравнение между группами При анализе данных таблицы 4 выявлено, что установка ЭКС с использованием стресс-эхокардиографии приводило к позитивным результатам, что сопровождалось снижением осложнений. Признаки синдрома ЭКС во второй группе выявлялись в 16,7% случаев, что на 15,8% меньше (р<0,05), чем в первой группе Прогрессирование ишемической болезни на 9% было ниже во второй группе, чем в первой (р<0,05). Прогрессирование сердечной недостаточности на 13,6% было ниже во второй группе, чем в первой (р<0,05). Развитие хронической формы ФП так же было достоверно ниже во второй группе. Развитие тромбоэмболических осложнений и инсультов было так же ниже во второй группе, чем в первой, но эта разница не была достоверной. На наш взгляд наиболее интересна динамика осложнений среди пациентов с однокамерной стимуляцией типа VVI. При стандартном подборе параметров стимуляции частота осложнений высока, так синдром ЭКС встречался в 45,3% случаев, развитие хронической формы ФП в 32,8%, прогрессирование ИБС в 21,9%, тромбоэмболические осложнения и инсульты в 15,6%, прогрессирование ХСН в 54,7%. Использование стресс-эхокардиографии достоверно снижало частоту этих осложнений. Использование физиологического двухкамерного электрокардиостимулятора приводило к достоверному снижению частоты осложнений, как в первой, так и во второй группе. Использование стресс-эхокардиограии в подборе параметров стимуляции сопровождалось более выраженным, статистически достоверным снижением осложнений. Так по данным таблицы 5 синдром ЭКС во второй группе встречался лишь в 10% случаев, хроническая форма ФП развивалась в 7,5% случаев, прогрессирование ИБС – в 10%, прогрессирование ХСН в 15,0%. 2.5 Течение ишемической болезни сердца у больных с различными видами установленных ЭКС В обеих группах основную долю пациентов составляли пациенты с ИБС, суммарно их число составило 196 человек, из них 110 человек в 1-ой группе и 86 человек во 2-й группе. После установки искусственного водителя ритма необходимо оценивать динамику и/или прогрессирование коронарной недостаточности. Мы изучили клиническую картину, результаты традиционных инструментальных методов диагностики. В клинической картине исследовали характер болевого синдрома. Методики функциональной диагностики с регистрацией ЭКГ (ЭКГ покоя, ЭКГ при нагрузке, холтеровское мониторирование ЭКГ) у пациентов с желудочковой стимуляцией оказались малоинформативными, поэтому для оценки степени выраженности коронарной недостаточности использовались ультразвуковые методы исследования сердца Эхо-КГ покоя и стресс- Эхо-КГ. Типичный болевой синдром встречается лишь в 22,7% в целом по группе. У больных с установленным ЭКС типа VVI в 25,0% случаев, а среди пациентов с ЭКС типа DDD – в 20,0% случаев. Атипичные боли в целом по группе составляли 68,2%, а оставшиеся 9,1% случаев ИБС протекали без болевого синдрома. Наиболее часто среди жалоб у больных встречались повышенная утомляемость - 63,5%, неприятные ощущения в грудной клетке, проявляющиеся, покалыванием, тяжестью, пощипыванием, жжением и пр. – 62,4%. Пульсация грудной клетки составляла – 52,9%, головокружение 44,7%, боли в спине, в эпигастрии, в брюшной полости суммарно встречались в 71,7% случаев. У 31,7% больных присутствовали жалобы на отечность нижних конечностей, а 21,2% отмечают пульсацию в области шеи. Проанализировав характер этих жалоб, становилось очевидным, что они отчасти совпадают с жалобами, которые регистрируются при синдроме ЭКС, поэтому стало очевидным провести исследование на выявление и/или прогрессирование ИБС именно у этой категории больных. 2.5.1. Сравнительная характеристика выявления признаков ИБС у пациентов первой и второй группы с синдромом ЭКС. Принимая во внимание тот факт, что ишемическая болезнь у пациентов с имплантированным ЭКС протекает атипично, а жалобы сходны с таковыми при синдроме ЭКС всем пациентам с установленным диагнозом синдром ЭКС мы проводили эхокардиографическое исследование, которое состояло из трансторакальной эхокардиографии в покое и/или стресс-эхокардиографии. При проведении трансторакальной эхокардиографии в 7,7% случаев в первой группе были выявлены признаки коронарной недостаточности среди пациентов с синдромом ЭКС, во второй группе таких пациентов выявлено не было. В целом, в группе пациентов с имплантированными искусственными водителями ритма, эхокардиография покоя у больных с синдромом ЭКС выявляла коронарную недостаточность в 5,5% случаев. При проведении стресс-эхокардиографии в 35,9% случаев в первой группе и в 26,6% во второй группе были выявлены признаки коронарной недостаточности среди пациентов с синдромом ЭКС. В целом, в группе пациентов с имплантированными искусственными водителями ритма, стрессэхокардиография у больных с синдромом ЭКС выявляла коронарную недостаточность в 33,3% случаев. Суммарно ультразвуковые методы исследования сердца выявляли коронарную недостаточность у 38,9% пациентов с синдромом ЭКС. Обращает на себя внимание тот факт, что у пациентов 2-й группы, которым изначально проводилась стресс-эхокардиография для установки оптимального режима работы ЭКС и подбиралась адекватная медикаментозная терапия, эхокардиография в покое не выявляла коронарной недостаточности. Положительный результат стресс-эхокардиографии у этой категории пациентов, очевидно, свидетельствовал о прогрессировании ИБС. Наиболее часто в 81,1% случаев коронарная недостаточность у пациентов с синдромом ЭКС была выявлена при средней степени тяжести этого синдрома. Использование стресс-эхокардиографии позволяет выявлять прогрессирование ИБС у пациентов с имплантируемыми электрокардиостимуляторами. 2.6 Сравнительная характеристика причин летальных исходов среди пациентов первой и второй группы. Нами проведен сравнительный анализ причин смерти у пациентов первой и второй группы с различными видами имплантированных электрокардиостимуляторов в зависимости от метода подбора параметров стимуляции. Смертность во второй группе была достоверно ниже, чем в первой и составляла совокупно по группам 26,6% во второй группе по сравнению с 37,2% в первой группе (р<0,05). Достоверно ниже причиной смерти был инфаркт миокарда 2,2% в целом во второй группе и 4,2% в первой. Прогрессирование сердечной недостаточности как причина смерти чаще встречалось в первой группе, чем во второй, составляя 11,7% и 7,8% соответственно. Внезапная сердечная смерть так же чаще была зарегистрирована в первой группе по сравнению со второй группой пациентов, эти значения для первой группы – 3,3%, для второй – 2,2%. Тромбоэмболические осложнения и/или инсульты в целом по группе во второй группе встречались в 3,3%, а в первой 5,0%, что достоверно выше. Аналогичная тенденция прослеживается и среди прочих причин смерти в целом по группе. При анализе первой и второй группы пациентов с установленным ЭКС типа VVI и типа DDD прослеживалась та же закономерность. У пациентов второй группы достоверно реже встречались все причины летального исхода, составляя во второй группе с ЭКС типа VVI - инфаркт миокарда 6,3%, прогрессирование ХСН 12,0%, внезапная сердечная смерть – 4,0%, тромбоэмболические осложнения – 6,0%, прочие причины – 10,0% по сравнению с пациентами первой группы, где эти показатели составляют 6,3%; 15,6; 6,3%; 7,9% и 14,0% соответственно. При установке двухкамерного электрокардиостимулятора типа DDD обращает на себя внимание тот факт, что в обеих группах не были зарегистрированы случаи внезапной сердечной смерти. Во второй группе инфаркт миокарда и тромбоэмболические осложнения не были зарегистрированы как причины смерти. Среди прочих причин смерти не было различий между первой и второй группой Использование стресс-эхокардиографии в подборе параметров стимуляции оказывает позитивное влияние на частоту и структуру летальности. Происходит снижение, как общей летальности, так и летальности от сердечно-сосудистых причин. Использованием стресс эхокардиографии очевидно позволяет на ранних этапах выявлять пациентов со скрытой коронарной недостаточностью. Подбор адекватной стимуляции и медикаментозной терапии позволил во первых замедлить прогрессирование ишемической болезни сердца, а во вторых уменьшить проявление сердечной недостаточности. 2.7. Динамика качества жизни в зависимости от способа подбора параметров стимуляции Имплантация двухкамерного электрокардиостимулятора типа DDD, как в первой, так и во второй группе, через год приводила к улучшению параметров качества жизни по всем шкалам, позитивное влияние сохранялось через 3 и 5 лет. Это сопровождалось повышение физической активности, уменьшением болевых проявлений, повышением настроения, стремлением к общению с коллегами, родными и близкими. Имплантация этого вида ЭКС давала возможность возвратиться к работе, занимать в обществе активную жизненную позицию. Использование стресс-эхокардиографии позволяло достичь достоверно более высоких результатов в параметрах качества жизни по сравнению с пациентами первой группы, позитивность этих результатов прослеживалась уже через год после установки ЭКС и сохранялась спустя 5 лет. При имплантации однокамерного ЭКС через год было достоверно выше качество жизни у пациентов второй группы, где подбор параметров осуществлялся с использованием стресс-эхокардиографии, по всем критериям качества жизни. Так пациенты второй группы достоверно в большем объеме выполняли повседневную нагрузку, и состояние здоровья ограничивающее их активность в меньшей степени влияло на физическую активность. Использование стресс-эхокардиографии оказывало позитивное влияние на показатели качества жизни по сравнению с показателями первой группы, где подбор параметров стимуляции осуществлялся традиционным способом. Через 5 лет наблюдения во второй группе показатели качества жизни практически не отличались от исходных значений. В таких шкалах как, роль физических нагрузок, жизненная сила и психическое здоровье показатели оказались достоверно ниже, чем до имплантации ЭКС. Поэтому имплантация однокамерного электрокардиостимулятора типа VVI не оказывало длительного позитивного влияния, использование стрессэхокардиографии при подборе параметров стимуляции лишь замедляло снижение качества жизни в этой группе пациентов. 2.8 Сравнительный анализ выживаемости пациентов в первой и второй группах в зависимости от способа подбора параметров стимуляции Выживаемость среди пациентов обоих групп с установленным ЭКС типа VVI была достоверно ниже, чем среди пациентов, у которых установлены физиологические двухкамерные ЭКС типа DDD. Так пятилетняя выживаемость среди пациентов с однокамерной стимуляцией в первой группе составляла 42%, а среди пациентов, которым подбор параметров проводился с использованием стрессэхокардиографии - 62,1%. Среди больных с установленными ЭКС типа DDD пятилетняя выживаемость составляла соответственно 69,0% и 84,0%. Подбор параметров ЭКС с использованием стресс эхокардиографии повышает выживаемость больных не зависимо от режима электрокардиостимуляции. 3.0 Влияние электромеханического асинхронизма на течение хронической сердечной недостаточности. Многие пациенты с ХСН имеют асинхронную электрическую активацию желудочков, маркером электрического асинхронизма является уширение комплекса QRS > 120 мс. Мы исследовали течение ХСН у пациентов с электрическим асинхронизмом. Для этого в группе пациентов, получающих только медикаментозную терапию мы выделили две подгруппы 30 человек с широким комплексом QRS> 120 мс и 35 человек с «узким» комплексом QRS < 120 мс. В группе с QRS >120 мс стенокардия III ФК встречалась достоверно чаще и составила 10,5%, по сравнению с 5,7% в группе с «узким» комплексом QRS. Сердечная недостаточность I - II ФК достоверно чаще встречалась в группе с QRS <120 мс, ее частота составила 34,3%, по сравнению с 3,3% в группе с QRS >120 мс. Клинически значимая ХСН III и IV ФК достоверно чаще встречалась в группе с QRS >120 мс этот показатель составлял 66,6% и 30,0% соответственно. В группе с QRS <120 мс клинически значимая ХСН III ФК встречалась в 60,0% и IVФК в 20,0% случаев. Желудочковая экстрасистолия в подгруппе с QRS >120 мс была зарегистрирована достоверно чаще, чем в подгруппе с QRS <120 мс и составила соответственно 66,7% и 51,4%. Фибрилляция предсердий достоверно чаще (р<0,05) встречалась в подгруппе с широким комплексом QRS и составляла 40,0% (12 человек), причем пароксизмальная форма встречалась у 4 человек (13.3%), а постоянная форма у 8 человек (26,7%). Нарушение АВ проводимости так же достоверно чаще встречались в подгруппе с широким комплексом QRS и составляли соответственно 36,7% (11 человек) по сравнению с 17,1% (6 человек) в группе с «узким» комплексом QRS. В группе пациентов с ХСН, получающих медикаментозную терапию встречались пароксизмы желудочковой тахикардии, в подгруппе с QRS >120 мс эта форма нарушения ритма встречалась достоверно чаще, чем в подгруппе с QRS <120 мс и составляла соответственно 50% (15 человек) и 20% (7 человек) соответственно. Из проведенного анализа следует, что подгруппа с широким комплексом QRS клинически более тяжелая, в ней было достоверно выше число пациентов с клинически выраженной СН, составляя 96,6%. Нарушения ритма встречались в целом чаще, чем в подгруппе с «узким» комплексом QRS, т.е., внутрисердечный асинхронизм у больных ХСН способствовал повышению аритмогенности миокарда. 3.1 Динамика тяжести ХСН и качества жизни в зависимости от ширины комплекса QRS. Таблица 5 Динамика тяжести СН у пациентов третьей группы в зависимости от ширины комплекса QRS ФК сердечной недостаточности До лечения (N=65) Через 1год (N=50) Через 3 года (N=24) QRS>120 N=30 QRS<120 N=35 QRS>120 N=23 QRS<120 N=27 QRS>120 N=8 I-II ФК 1(3,3%)* 12(34,3%) 1(4,3%) 7(26,0%)* III ФК 20(66,6%) 21(60,0%) 17(74,0%) 20(74,0%) 2(25,0%) 13(81,3%) IV ФК Среднее значение ФК 9(30,0%) 3,2±0,4 2(5,7%)* 2,6±0,3* 5(21,7%)* 3,1+0,2 2,4±0,4* 6(75,0%) 3,5+0,5 2(12,5%)* 2,8±0,2* QRS<120 N=16 1(6,2%)* Тест 6-ти мин. 190±32,2 ходьбы , м 308±24,8* 198±28,6 365,4± 26,7* 120,9 25,2 260,6± 35,2* ШОКС, баллы 7,7±0,6* 6,6±0,8* 14,10,6 9,6±0,8* 12,5±0,7 10,3+0,2 Примечание: значимые различия между группами исходно и по годам* p<0,05, ** - p<0,01. При анализе данных таблицы 5 видно, что у больных ХСН с электрическим асинхронизмом исходно отмечались более высокий функциональный класс сердечной недостаточности и индекс ШОКС, более низкая толерантность к физической нагрузке по результатам теста 6-ти минутной ходьбы. Через 1 год после проводимой адекватной терапии появилась позитивная динамика в течении ХСН, наиболее четко она была выражена в группе больных с «узким» комплексом QRS. Так в этой группе не было пациентов с IV ФК, в группе больных с широким комплексом QRS их число уменьшилось и составило 21,7% по сравнению с исходным значением 30,0% (p<0,01). В группе с QRS<120 мс через год после лечения доля пациентов I-II ФК составляла 26,0%, но 5 человек из нее имели I ФК, что достоверно выше по сравнению с группой пациентов с QRS>120 мс. Положительный ответ на проводимую терапию в группе пациентов с «узким» комплексом QRS сопровождался достоверным снижение функционального класса ХСН где он составлял 2,4±0,4, увеличением толерантности к нагрузке по данным шестиминутного теста - 365,4±26,7 м и снижением баллов по шкале ШОКС до 6,6±0,8. Среди пациентов с широким комплексом QRS снизилась доля пациентов с IV ФК, но увеличилась доля пациентов с III ФК, совокупно доля пациентов с клинически выраженной СН осталась практически неизменной. Через три года наблюдения в группе больных с «узким» комплексом QRS число больных с I-II ФК уменьшилось до 6,2%, возросла доля пациентов с III ФК до 81,3%, доля пациентов с IV ФК составила 12,5%. По сравнению с группой с широким комплексом QRS достоверно более высокими были показатели толерантности к нагрузкам – шестиминутный тест был равен 260,6±35,2 м (p<0,05), более низким ФК ХСН - 2,8±0,2 (p<0,05) и более низким значением по ШОКС 9,6±0,8 (p<0,05). В группе больных с широким комплексом QRS через три года не было больных с I-II ФК, значительно возросла доля пациентов с IV ФК ХСН, она составила 75,0%. Это сопровождалось увеличением ФК ХСН до 3,5+0,5, ухудшением клинического состояния больных по ШОКС до 14,10,6 и снижением толерантности к нагрузкам – шести минутный тест составил 120,925,2 м. Современная медикаментозная терапия не оказывала длительного позитивного воздействия на течение ХСН, лишь среди пациентов с отсутствием электрического асинхронизма через год выявлялся достоверный положительный ответ на проводимое медикаментозное лечение. Число госпитализаций как маркер эффективности лечения ХСН в течение года по поводу ХСН достоверно было выше в группе с широким комплексом QRS >120 мс этот показатель составил 1,3±0,1раз/год по сравнению с группой QRS <120 мс - 0,8 ±0,1 (р<0,01). Больные в подгруппе с QRS >120 мс обращались за амбулаторной помощью по поводу ХСН достоверно чаще 7,4±0,6 раз/год по сравнению с 3,9±0,2 раз/год в подгруппе с «узким» комплексом QRS (р<0,01). Число вызовов неотложной помощи достоверно было больше в подгруппе с широким комплексом QRS и составило соответственно 5,7±0,7 раз/год и 4,2±0,5 раз/год (р<0,05). Поводом для госпитализации, обращением за амбулаторной помощью и вызовом неотложной медицинской помощи в подгруппе с широким комплексом QRS было прогрессирование ХСН. Наличие широкого комплекса QRS у больных ХСН сопровождалось снижением качества жизни по большинству шкал опросника SF-36. Показатели качества жизни улучшались через 2 месяца после начала адекватной современной терапии ХСН. Уже через год они становились достоверно ниже исходных значений. Полученные данные свидетельствуют о более низком качестве жизни у больных ХСН с внутрисердечным электрическим асинхронизмом. Индивидуально подобранная, адекватная современная терапия ХСН оказывала позитивное воздействие на качество жизни в первый год от начала лечения в группе пациентов с QRS < 120 мс, в последующем происходило прогрессивное снижение параметров качества жизни. 3.2. Ультразвуковые методы в оценка внутрисердечного асинхронизма у больных ХСН. Таблица 6 Показатели асинхронизма у больных ХСН в зависимости от ширины комплекса QRS Показатели QRS, мс ВЖМЗЗС-МЖП, мс МЖМЗ, мс МЖМЗТДМ, мс Δ ЭМЗЛЖ, мс ИВЖА, мс Контроль 1 108,2±6,1 78,3±20,8 30,6±6,2 36,9±7,3 70,2±10,6 21,7±5,1 QRS <120 мс 2 118,9±2,7 98,4±24,6 47,2±6,2 54,6±8,4 92,3±8,9 37,6±6,8 QRS >120 мс 3 156,9±5,4 128,4±18,6 83,2±4,8 82,8±8,2 135,4±9,2 48,3±4,2 P1-2 >0,05 >0,05 >0,01 >0,01 >0,01 >0,01 P2-3 <0,01 >0,05 <0,05 <0,05 <0,01 <0,05 P1-3 <0,01 >0,05 <0,01 <0,01 <0,01 <0,01 В таблице 6 представлена частота встречаемости маркеров внутрижелудочкового асинхронизма в зависимости от ширины комплекса QRS. У лиц с электрическим внутрисердечным асинхронизмом (QRS > 120 мс) отмечается выраженное увеличение дисперсии электромеханической задержки ЛЖ, так Δ ЭМЗЛЖ составляет 135,4±9,2 мс, а в подгруппе с узким комплексом QRS - 92,3±8,9 мс (p<0,01). Индекс внутрижелудочкового асинхронизма среди пациентов с широким комплексом QRS был достоверно выше и составлял 48,3±4,2 , в подгруппе с QRS < 120 мс - 37,6±6,8 (p<0,05). Показатели межжелудочковой механической задержки, определяемые как методом импульсной, так и тканевой допплерографии, были достоверно выше среди пациентов с широким комплексом QRS. В группе с узким комплексом QRS достоверных различий с контрольной группой не было выявлено. Обращает на себя внимание тот факт, что значения внутрижелудочковой механической задержки определяемые при проведении трансторакальной Эхо-Кг в М-режиме (ВЖМЗЗС-МЖП) имели недостоверный характер. Возможно, это свидетельствовает о низкой информативности данного показателя. Однако, среди предложенных маркеров асинхронизма, этот является наиболее простым и доступным в получении, поэтому следующим этапом в нашей работе мы определяли частоту встречаемости других маркеров асинхронизма в зависимости от величины ВЖМЗЗС-МЖП Для достижения поставленной цели мы разделили группу наших пациентов в зависимости от величины ВЖМЗЗС-МЖП на три подгруппы: в первую вошли пациенты, у которых ВЖМЗЗС-МЖП была > 130 мс, во вторую , где этот показатель составлял 100-130 мс, и в третью с величиной ВЖМЗЗС-МЖП < 100 мс. Полученные данные позволяют говорить, что значения ВЖМЗЗС-МЖП более 130 мс, определяемые с использованием трансторакальной Эхо-Кг, сопровождались наиболее часто и другими маркерами асинхронизма, причем встречаемость маркеров получаемых при тканевой допплерографии была достоверно выше. Так частота межжелудочковой механической задержки (МЖМЗТДМ ) составляла 96,3%, а частота увеличения индекса внутрижелудочкового асинхронизма (ИВЖА) – 97,2%. Если же значение ВЖМЗЗС-МЖП менее 100 мс, то частота встречаемости других маркеров асинхронизма была невелика, так наиболее часто встречалось увеличение индекса внутрижелудочкового асинхронизма, составляя 23,8%. Наиболее интересной на наш взгляд, представляется группа пациентов со значениями ВЖМЗЗС-МЖП от 100 до 130 мс, практически в 70,0% случаев регистрировались маркеры асинхронизма, определяемые при использовании тканевой допплерографии. Наиболее часто встречалось увеличение индекса внутрижелудочкового асинхронизма, составляя 79,4%. Показатели электрического асинхронизма, проявляющиеся увеличением ширины комплекса QRS не зависят от величины ВЖМЗЗС-МЖП. Все вышеизложенное позволило нам предложить некий алгоритм выявления маркеров внутрижелудочкового асинхронизма. При проведении трансторакальной Эхо-Кг выявления внутрижелудочкового асинхронизма в М-режиме величиной от 100 до 130 мс обязательно требует проведения дальнейшего исследования с использованием тканевой и импульсной допплерографии. При получении данных ВЖМЗЗС-МЖП более 130 мс проведение исследования с использованием тканевой и импульсной допплерографии возможно для подтверждения имеющихся данных об асинхронии. Если данные ВЖМЗЗС-МЖП менее 100 мс, то выявление признаков электромеханического асинхронизма с использованием тканевой допплерографии миокарда может быть оправданно при прогрессировании ХСН, отсутствии ответа на адекватную терапию и пр. 3.3 Выживаемость больных c внутрижелудочковым асинхронизмом. Нами выполнен анализ выживаемости за 3 года в зависимости от ширины комплекса QRS. Начиная с 12 месяцев, кривые выживаемости начинали расходиться. К 18 месяцам различия в выживаемости по подгруппам становились достоверными, в группе с широким комплексом QRS выживаемость составляла 56%, а подгруппе с «узким» комплексом QRS 64% (р<0,05). К концу третьего года в подгруппе с QRS <120 мс выживаемость была достоверно выше и составила 45% а в подгруппе с QRS >120 мс - 25% (р<0,05). Среди этих же пациентов мы выделили группу пациентов в электромеханическим асинхронизмом. В основу этого деления легла величина ИВЖА, величина большая 41 мс свидетельствовала о наличии электромеханического асинхронизма. Так же был выполнен анализ выживаемости в зависимости от величины индекса внутрижелудочкового асинхронизма. Для этого группа пациентов была разделена на подгруппы по значению ИВЖА >41 мс и ИВЖА <41 мс. Кривые выживаемости среди этих подгрупп стали расходится уже к 12 месяцам. В этот период достоверно ниже была выживаемость в подгруппе с высоким показателем ИВЖА >41 мс, она составляла 68,0%, по сравнению с подгруппой ИВЖА <41 мс, где этот показатель был равен 78,0% (р <0,05). К концу третьего года выживаемость больных ХСН с внутрижелудочковым асинхронизмом составила 26%, в то время как у лиц с меньшими значениями ИВЖА выживаемость была достоверно выше - 45% (p<0,05). Полученные данные говорят о неблагоприятном влиянии на прогноз как электрического, так и электромеханического асинхронизма левого желудочка. Индекс внутрижелудочкового асинхронизма, оцененный с помощью тканевой допплерографии миокарда, может быть использован для оценки прогноза больных тяжелой ХСН. 4. Влияние сердечной ресинхронизирующей терапии на динамику ХСН, качество жизни и летальность у больных с хронической сердечной недостаточностью. Группа пациентов, которым проводилась сердечная ресинхронизирующая терапия состояла из 40 пациентов с ХСН III-IV ФК, резистентных к проводимой адекватной современной терапии ХСН. Группа была представлена мужчинами, средний возраст 66,7+11,9 лет. В 12 случаях (30,0%) у больных с постоянной фибрилляцией предсердий был использован режим бивентрикулярной электрокардиостимуляции типа VVIDBiV, у оставшихся 28 человек (70,0%) – типа DDDBiV. Сердечная ресинхронизирующая терапия сочеталась с современной медикаментозной терапией ХСН. Эффективность проводимой СРТ мы сравнивали с медикаментозной терапией в целом и с медикаментозной терапией у пациентов с электрическим асинхронизмом (широкий комплекс QRS).. 4.1. Сравнительная характеристика влияния медикаментозной и сердечной ресинхронизирующей терапии на внутрисердечный асинхронизм У больных ХСН, которым проводилась СРТ, имелось увеличение средних значений показателей внутри- и межжелудочкового асинхронизма. Нами был проведен анализ этих значений и оценены их показатели за 3 года наблюдения. Было проведено сравнение показателей асинхронизма у лиц, получающих только медикаментозную и сердечную ресинхронную терапию. Полученные данные представлены в таблице 7 и 8. Таблица 7 Влияние медикаментозной терапии на показатели асинхронизма Исходно 1 137,2±6,4 QRS, мс ВЖМЗЗС-МЖП 113,4±20,5 МЖМЗ, мс 65,2±7,2 МЖМЗТДМ, мс 68,7±6,6 Примечание: значимые различия между p<0,01. Через 12 мес Через 36 мес 2 3 138,1±5,6 126,24,3* 112,5±21,7 115,4±22,1 72,2±5,7** 76,4±7,5** 70,2±5,7 76,1±6,4** группами 1-2 и 1-3 * – p<0,05; **– Таблица 8 Влияние СРТ на показатели асинхронизма QRS, мс Исходно Через 12 мес Через 36 мес 1 152,24,3 2 114,1±4,6* 3 118,24,7* ВЖМЗЗС-МЖП 128,5±21,7 86,4±22,1* 92,6±23,4* МЖМЗ, мс 76,6±8,2 46,4±7,5** 41,3±7,8* МЖМЗТДМ, мс 92,8±6,5 47,1±6,4* 46,86,8* Примечание: значимые различия между группами 1-2 и 1-3 * – p<0,05; **– p<0,01. Данные таблиц 7 и 8 показывают, что среди пациентов, получающих медикаментозную терапию исходно величина комплекса QRS составляла 137,2±6,4 мс, на фоне терапии через 12 месяцев - 126,24,3 мс, а через 36 месяцев - 138,1±5,6 мс. Медикаментозная терапия в целом по группе достоверно не влияла на величину комплекса QRS, прослеживалась лишь тенденция к его уменьшению, так через 12 месяцев эта разница составила 11 мс, а через 36 месяцев произошло увеличение на 0,9 мс по сравнению с исходным значением. При использовании КРСУ отмечалось позитивное влияние на величину комплекса QRS в целом по группе, так спустя 12 месяцев этот показатель снизился на 38,1±0,3мс (p<0,05), а через 36 месяцев он был меньше исходного на 34,0±0,4 мс (p<0,05). В группе пациентов с установленным КРСУ отмечалось отчетливое уменьшение внутри- и межжелудочкового асинхронизма. Так спустя 12 месяцев величина внутрижелудочкового асинхронизма уменьшилась до 86,4±22,1 мс, а через 36 месяцев эта величина составляла 92,6±23,4 мс. Что было достоверно ниже исходного значения 128,5±21,7 мс (p<0,05). Аналогичная картина просматривалась и в показателях межжелудочкового асинхронизма. При оценке межжелудочкового асинхронизма методом импульсной допплерографии через 12 месяцев эта величина составляла 46,4±7,5 мс, через 36 месяцев - 41,3±7,8 мс. По сравнению с исходным значением 76,6±8,2 мс имеет место достоверное снижение показателя (p<0,05). Оценка межжелудочкового асинхронизма проводилась, кроме того, с использованием тканевой импульсно-волновой допплерографии миокарда. Данная методика подтвердила полученные результаты и ее показатели соответственно составили 47,1±6,4 мс через 12 месяцев и 46,86,8 мс – через 36 месяцев, исходное значение - 92,8±6,5. Разница между показателями была так же достоверной (p<0,05). Использование медикаментозной терапии не оказывало существенного влияния на показатели внутрисердечного асинхронизма. Однако, через 36 месяцев отмечалось достоверное увеличение механической межжелудочковой задержки, определяемой как при традиционной эхокардиографии, так и при использовании тканевой допплерографии. Так данные межжелудочковой задержки через три года составляли МЖМЗ - 76,4±7,5 мс, МЖМЗТДМ - 76,1±6,4 мс, при исходных значениях МЖМЗ- 65,2±7,2 мс и МЖМЗТДМ- 68,7±6,6мс. 4.2 Сравнительная характеристика тяжести ХСН среди пациентов получающих только медикаментозную терапию и кардиоресинхронную терапию. Восстановление внутрижелудочкового синхронизма при использовании кардиоресинхронной электростимуляции приводило к улучшению клинического течения и тяжести ХСН по сравнению с группой, получающей только медикаментозную терапию. На фоне установки кардиоресинхронного устройства (КРСУ) происходило достоверное снижение функционального класса ХСН, так через 3 года среднее значение ФК составило 2,3±0,4, в группе медикаментозной терапии 2,8±0,3 (р <0,01). Данные клинического состояния (в баллах) с использованием ШОКС так же достоверно снизились и составили в группе больных с КРСУ – 7,2 ±0,5, а в группе больных с медикаментозной терапией - 8,6±0,8 (р <0,05). Тест 6-ти минутной ходьбы был достоверно выше в подгруппе с установленным кардиоресинхронизирующим электрокардиостимулятором и составляет 382 ±24 м по сравнению с другой группой 315 3,4±52 м. Группа пациентов с широким комплексом QRS является наиболее прогностически неблагоприятной в течении ХСН и развитии осложнений. Поэтому становится целесообразным сравнить показатели тяжести ХСН в подгруппе больных с QRS > 120 мс на фоне медикаментозной терапии с группой больных, где проводилась сердечная ресинхронизирующая терапия. На фоне проводимой терапии с использованием КРСУ отмечалось достоверное снижение функционального класса ХСН до 2,4±0,4 (p<0,05) по сравнению с 3,0±0,3 в подгруппе с широким комплексом QRS, где проводилась только медикаментозная терапия. Достоверно ниже и количество баллов по шкале ШОКС в группе с установленным КРСУ 7,2±0,5 по сравнению с 11,2±0,8 (p<0,05) в группе с широким комплексом QRS. Тест 6-ти минутной ходьбы показывал достоверное увеличение переносимости физической нагрузки так через 3 года после установки КРСУ проходимое расстояние увеличилось до 356 ±24 м по сравнению с группой, получающей только медикаментозную терапию, где эта дистанция составляла 204±22 м (p<0,05). На фоне СРТ было отмечено достоверное улучшение функционального класса ХСН, толерантности к физической нагрузке по результатам теста 6-ти минутной ходьбы и балльной оценки по шкале клинического состояния. Наблюдалось уменьшение выраженности таких симптомов сердечной недостаточности как, периферические отеки, влажные хрипы в легких, гепатомегалия (т.е. прежде всего, связанных с застоем жидкости в организме). Очевидно, что установка кардиоресинхронизирующего устройства приводила к достоверно лучшему течению хронической сердечной недостаточности по сравнению с использованием только медикаментозной терапии как в целом по группе, так и в подгруппе пациентов с широким комплексом QRS. Причем достоверность различий отмечалась уже спустя 1 год после начатого лечения. Следует отметить, что более выраженное улучшение гемодинамических параметров у больных с сердечной ресинхронизирующей терапией отмечалось у пациентов с более широким комплексом QRS и более выраженным внутри- и межжелудочковым асинхронизмом до кардиостимуляции. Мы проанализировали частоту госпитализаций, частоту амбулаторных обращений и частоту вызова неотложной помощи у пациентов с установленным КРСУ в течение первого года наблюдения, причинами которых стало прогрессирование ХСН. Затем сравнили эти показатели с данными группы пациентов в целом, получающих только медикаментозную терапию, и имеющих широкий комплекс QRS и получающих только медикаментозную терапию. Число госпитализаций в группе с установленным КРСУ стало меньше на 36,4% по сравнению с общей группой, получавшей медикаментозную терапию. По сравнению с подгруппой, лечившейся медикаментозно и имеющей широкий комплекс QRS, это снижение составило 46,2%. Число амбулаторных обращений снизилось на 35,5% по сравнению с общей группой использующих в своем лечении только медикаментозную терапию и на 46,6% по сравнению с подгруппой с широким комплексом QRS. Число вызовов неотложной помощи в подгруппе с КРСУ снизилось на 68,3% по сравнению с группой получающей медикаментозную терапию и на 74,2% среди пациентов с электрическим асинхронизмом. Использование бивентрикулярной стимуляции, приводящее к восстановлению внутрижелудочкового синхронизма сопровождается снижением частоты обращаемости за медицинской помощью по сравнению с медикаментозной терапией как в целом по группе, так и среди пациентов с электрически асинхронизмом. При проведении сердечной ресинхронизирующей терапии с использованием бивентрикулярной стимуляции, восстановление внутрисердечного синхронизма сопровождалось улучшением систолической и диастолической функции миокарда. Так совокупный показатель систолической функции ФВ достоверно был выше через год в группе с установленным КРСУ, составляя 43,4% по сравнению с 30,3% в группе пациентов с широким комплексом QRS, получающих только медикаментозную терапию. Индекс сферичности (ИС) как маркер ремоделирования, также на фоне СРТ претерпевал обратное развитие, составляя 0,720,15 по сравнению с исходным значением 0.810,1. В группе больных с широким комплексом QRS через год ИС увеличился до 0,890,1 по сравнению с исходным значением – 0,760,15, это свидетельствует о том, что форма ЛЖ приближалась к форме шара. Показатель соотношения скорости раннего пика (Е) диастолического трансмитрального потока и скорости диастолического движения фиброзного кольца митрального клапана (em) E/em на прямую отражает конечно диастолическое давление в левом желудочке и является маркером диастолической функции ЛЖ. При использовании СРТ этот показатель снижается, достигая через год 8,81,4, по сравнению с исходным значением 13,81,2. В группе пациентов с широким комплексом QRS, получающих медикаментозную терапию значение этого показателя остается высоким 10,71,1, исходно его величина составляла 12,31,6. 4.3. Качество жизни больных кардиоресинхронным устройством с ХСН с установленным Через два месяца после установки кардиоресинхронизирующего устройства у пациентов достоверно увеличились показатели параметров качества жизни во всех шкалах, соответствующих как физическим, так и эмоциональным компонентам качества жизни (p<0,01). Через 12 месяцев показатели качества жизни снизились по всем шкалам, характеризующих как физическое, так и эмоциональное состояние больных, но были достоверно выше как исходных показателей (p<0,05), так и показателей, полученных спустя 2- месяца после установки кардиоресинхронизирующего устройства. Через 36 месяцев (3 года), показатели качества жизни оставались достоверно более высокими по сравнению с исходными значениями. 4.4 Корреляционный анализ гемодинамических показателей внутрисердечного асинхронизма при использовании СРТ у больных ХСН. и Для определения дополнительных критериев при отборе пациентов для проведения СРТ мы провели корреляционный анализ гемодинамических показателей и показателей внутрисердечного асинхронизма у больных ХСН, которым в качестве метода лечения проводилась сердечная ресинхронизирующая терапия. Sm 0,78 ВЖА -0,72 МЖМЗ (тд) -0,76 Фракция выброса ВЖМЗ (М- режим)- 0,465 КДР -0,623 МЖМЗ (ид) -0,56 QRS - 0,422 Рис. 1 Корреляционные асинхронизма связи фракции выброса ЛЖ и показателей Основным показателем, отражающим состояние гемодинамики, мы выбрали величину фракции выброса, рассчитанную методом Симпсона. Снижение фракции выброса имло сильную отрицательную связь с коэффициентом более 0,7 с такими показателями асинхронизма как межжелудочковая механическая задержка (метод тканевой допплерографии), внутрижелудочковая диссинхрония (метод тканевой допплерографии), а так же сильную положительную связь с показателем, отражающим систолическую скорость движения продольных волокон миокарда левого желудочка (метод тканевой допплерографии). Средняя, устойчивая отрицательная связь показателя фракции выброса с коэффициентом корреляции больше 0,5 отмечена с показателями межжелудочковой механической задержки, определяемыми при обычной импульсной допплерографии, а так же величиной конечно-диастолического размера ЛЖ. Средняя отрицательная связь выявлена с межжелудочковой механической задержкой (М-режим ЭхоКг) - коэффициент 0,465 и комплексом QRS - коэффициент 0,422. Корреляционный анализ – это всего лишь математическая модель. Выявляемые при его проведении связи между показателями формальны и интерпретация полученных результатов носит дискуссионный характер. Тем не менее, этот метод статистической обработки позволил нам предположить относительную силу этих взаимоотношений. Так при проведении анализа полученные данные могут свидетельствовать о важности оценки указанных показателей внутрисердечного асинхронизма для отбора больных ХСН на СРТ. Причем совершенно очевидно, что приоритет следует отдать параметрам, которые определяются с использованием тканевой допплерографии. Выполненный дискриминантный анализ зависимости прироста ФВЛЖ у больных ХСН на фоне КРСУ от исходных значений внутрисердечного асинхронизма позволил уточнить показатели асинхронизма и их значения, при которых целесообразна коррекция с помощью бивентрикулярной электрокардиостимуляции. С этой целью пациенты были классифицированы на 2 группы: с более высоким увеличением сократимости ЛЖ и с менее высоким (p<0,01). В результате были получены критические значения для каждого из показателей: межжелудочковая механическая задержка по разнице потоков в легочной артерии и аорте – 40 мс, межжелудочковая механическая задержка по сумме систолических скоростей движения миокарда базальных сегментов правого и левого желудочков – более 100 мс. 4.4. Выбор режима и определение параметров ресинхронизирующей электрокардиостимуляции у больных хронической сердечной недостаточностью с помощью эхокардиографических методик. В процессе наблюдения за больными с имплантированными электрокардиостимуляторами необходим подбор оптимальных параметров стимуляции. Современные устройства для кардиоресинхронной терапии позволяют подбирать предсердно-желудочковую и межжелудочковую задержки. В первом случае создают оптимальные условия для диастолического наполнения ЛЖ, а во втором – для сердечного выброса. Неадекватный подбор параметров стимуляции может привести к прогрессированию как СДЛЖ, так и ДДЛЖ, что будет сопровождаться нарастанием явлений ХСН. При оптимизации АВ-задержки мы стремились достичь временных параметров, позволяющих максимально наполнить левый желудочек, обеспечить сокращение желудочков сразу после сокращения предсердий. Подбор АВ-задержки осуществлялся с использованием формулы Риттера, оценки трансмитрального потока и определению времени наполнения левого желудочка. Оптимальной считалась АВ-задержка при которой соотношение пиков трансмитрального потока приближалось к физиологическому, а время наполнения левого желудочка не превышало 40% от всего сердечного цикла. Подбор AV-задержки позволил увеличить ФВЛЖ на 15,2%, а диастолическую скорость движения фиброзного кольца МК (Em) на 37,2%. Проведенное исследование доказывает тот факт, что оптимизация АВ-задержки в большей степени влияет на диастолическую дисфункцию, чем на систолическую. Проведенный нами корреляционный анализ позволил выявить связи оптимальной предсердно-желудочковой задержки, определенной по методу Риттера, с другими ультразвуковыми показателями. Сильные прямые связи с коэффициентом корреляции 0,84 были выявлены с интегралом линейной скорости трансмитрального потока (VTI ТМК) и диастолической скоростью движения продольных волокон миокарда левого желудочка Em с коэффициентом – 0,74. Систолические показатели не обладали значимыми корреляционными связями с оптимальной AV задержкой. Подбор межжелудочковой задержки осуществлялся методом вычисления разницы интервалов от начала комплекса QRS до начала потока в аорте и легочной артерии – не более 40 мс и задержки движения латеральной стенки левого желудочка относительно межжелудочковой перегородки - не более 40 мс. Оптимизация VV-задержки позволила увеличить ФВЛЖ на 20,8%, а систолическую скорость движения волокон миокарда ЛЖ Sm на 47,3%. Корреляционные связи оптимальной межжелудочковой задержки с другими ультразвуковыми показателями выглядили следующим образом: сильная связь с систолической скоростью движения продольных волокон миокарда левого желудочка (Sm) и ФВ левого желудочка, коэффициент корреляции 0,78 и 0,76 соответственно. Связь с диастолической скоростью движения продольных волокон миокарда левого желудочка Em слабая , коэффициент корреляции 0,26. Показатели корреляционного анализа могут свидетельствовать о возможности применения показателей VTI ТМК и Em для оптимизации AV задержки, а Sm и ФВЛЖ – для оптимизации VV задержки. У пациентов с хронической формой фибрилляции предсердий подбор АВзадержки невозможен. Подбор межжелудочковой ресинхронизации не отличается от такового в группе пациентов с синусовым ритмом. 4.5 Летальность в группе пациентов с сердечной ресинхронизирующей терапией. Предложенный нами отбор пациентов для проведения сердечной ресинхронизирующей терапии и подбор оптимальных параметров стимуляции привел к тому, что за 3 года наблюдения летальность составила 10,0%. За время наблюдения в группе больных с установленным КРСУ умерло 4 человека (10%). Смерти произошли через 1, 4, 5 и 11 месяцев после имплантации кардиостимулятора. У трех пациентов была выявлена фибрилляция желудочков (ФЖ) и смерть расценивалась как внезапная. У 1 пациента развился повторный крупноочаговый инфаркт миокарда. По данным многоцентровых исследований годичная выживаемость составляет 70,0-75,0%. Использование сердечной ресинхронизирующей терапии с помощью бивентрикулярной электрокардиостимуляции, в дополнение к медикаментозной терапии, положительно влияет на клинику, течение и прогноз хронической сердечной недостаточности за счет комплексного воздействия на внутрисердечный асинхронизм, систолическую и диастолическую функции левого желудочка. Она расширяет возможности современного лечения больных ХСН. ВЫВОДЫ 1. У больных хронической сердечной недостаточностью, с установленными показаниями для имплантации искусственного водителя ритма, возможна установка только физиологического двухкамерного электрокардиостимулятора. Использование однокамерной желудочковой стимуляции приводит к прогрессированию ХСН уже через год после имплантации. Эффективность медикаментозной терпи достоверно выше, чем данный режим стимуляции. 2. Использование стресс-эхокардиографии с последовательным увеличением частоты стимуляции установленного электрокардиостимулятора для подбора параметров стимуляции приводит к улучшению динамики ХСН. Это сопровождается улучшением качества жизни, уменьшением частоты госпитализаций, обращаемости за медицинской помощью и потребности перепрограммировании ЭКС, снижением смертность от сердечно-сосудистых причин и увеличением выживаемости не зависимо от режима стимуляции. 3. У больных с ИБС после имплантации искусственного водителя ритма изменяется клиническое проявление болезни, типичный болевой синдром встречается в 22,7% случаев. Использование стресс-эхокардиографии позволяет на ранних этапах выявить прогрессирование коронарной недостаточности, подобрать адекватный режим стимуляции и терапии. У пациентов с синдромом ЭКС в 38% случаев за клинической картиной синдрома скрывается прогрессирование и развитие ИБС.. 4. Наличие внутрисердечного асинхронизма у больных с ХСН приводит к прогрессированию заболевания, снижению качества жизни и выживаемости. 5. Выявление увеличения внутрижелудочковой механической задержки свыше 100 мс в М-режиме при транторакальной эхокардиографии в покое является показанием к проведению тканевой допплерографии миокарда для своевременного выявления внутрисердечного асинхронизма. 6. Сердечная ресинхронизирующая терапия с использованием бивентрикулярной электрокардиостимуляции по сравнению с медикаментозным лечением восстанавливает внутрижелудочковый синхронизм, что сопровождается длительной (в течение 3 лет) положительной динамикой ХСН, снижением частоты госпитализаций и обращаемости за медицинской помощью, улучшением качества жизни, и повышением выживаемости. 7. Использование сердечной ресинхронизирующей терапии приводит к улучшению и/или восстановлению параметров внутрисердечного асинхронизма. Параметры электромеханического внутрисердечного асинхронизма, определяемые с использованием эхокардиографии такие как механическая межжелудочковая задержка (по данным импульсной и тканевой допплерографии) и индекс внутрижелудочкового асинхронизма в большей степени связаны с эффективностью ресинхронизирующей терапии, чем ширина комплекса QRS. 8. Использование импульсной и тканевой допплерографии миокарда с оценкой скоростных и временных показателей трансмитрального, трансаортального потока и движения фиброзного кольца митрального клапана позволяет подобрать оптимальные параметры стимуляции при проведении сердечной ресинхронизирующей терапии. Практические рекомендации. 1. Использование однокамерной стимуляции типа VVI у больных с ХСН, с выявленными показаниями к установке искусственного водителя ритма приводит к прогрессированию ХСН, через год показатели тяжести ХСН достоверно ниже исходных значений, что свидетельствует о нецелесообразности использования этого режима стимуляции у больных с ХСН. 2. Для подбора индивидуальных параметров стимуляции необходимо использовать метод стресс-эхокардиографии с перепрограммированием частоты имплантированного ЭКС. Использование этого метода приводит к положительной динамике ХСН, улучшению параметров качества жизни, снижению частоты госпитализаций, обращаемости за медицинской помощью и необходимости перепрограммирования ЭКС, а так же повышению выживаемости. Положительный ответ на стимуляцию с использованием индивидуальных параметров, определенных с помощью стресс-эхокардиографии не зависит от режима стимуляции. 3. При подозрении на прогрессирование ИБС у больных с установленным искусственным водителем ритма необходимо проведение эхокардиографии. Характер болевого синдрома у больных с установленным ЭКС изменяется, использование эхокардиографии становится основным методом выявления прогрессирования ИБС. Предложенный метод стресс-эхокардиографии с перепрограммированием частоты стимуляции установленного ЭКС позволяет на ранних этапах выявлять признаки коронарной недостаточности. Больным со средней степенью тяжести синдрома ЭКС показано проведение исследования для выявления прогрессирования ИБС. 4. Внутрисердечный электромеханический асинхронизм приводит к прогрессированию ХСН. Определение электромеханического асинхронизма имеет важное прогностическое значение и требует раннего активного выявления его признаков для своевременного направления больных на лечение с использованием сердечной ресинхронной терапии. 5. При выявлении внутрижелудочковой механической задержки, с использованием М-режима трансторакальной эхокардиографии в покое, в пределах от 100 до 130 мс необходимо проведение тканевой импульсно-волновой допплерографии миокарда с целью раннего выявления маркеров внутрисердечного асинхронизма и определения показаний для проведения СРТ. 6. Использование сердечной ресинхронизирующей терапии с использованием бивентрикулярной электрокардиостимуляции восстанавливает внутрижелудочковый синхронизм, приводя к длительной (в течение 3 лет) положительной динамике ХСН, снижению частоты госпитализаций и обращаемости за медицинской помощью, улучшению качества жизни, и повышению выживаемости по сравнению с медикаментозным лечением. При отборе пациентов для проведения СРТ необходимо оценивать таким параметры электромеханического асинхронизма как механическая межжелудочковая задержка и индекс внутрижелудочкового асинхронизма (по данным эхокардиографии с использованием импульсной допплерографии и тканевой допплерографии), а не только ширину комплекса QRS. При подборе параметров атриовентрикулярной и межжелудочковой задержки у больных с СРТ с 7. использованием бивентрикулярного электрокардиостимулятора необходимо использовать эхокардиографию с импульсно-волновой допплерографией и тканевую допплерографию миокарда. Список работ, опубликованных по теме диссертации 1. Диагностика и лечение хронической сердечной недостаточности (в соавт. с Григорьевым Ю.В.)// Методические рекомендации ГВМУ МО РФ, ГИУВ МО РФ. М. 2002, 20 с. 2. Диастолическая дисфункция левого желудочка. Диагностика .Лечение// Методические рекомендации, ГИУВ МО РФ. М. 2002, 62 с. 3. Стресс-эхокардиография в подборе параметров электрокардиостимуляции.(в соавт. с Капитоновым К.И. , Макаренко А.С)//Тез. докл. Международного славянского конгресса по электрокардиостимуляции и клинической электрофизиологии сердца «Кардиостим»: СПб. 2002.- с. 134 4. Стресс-эхокардиография в верификации поражения коронарных артерий// Учебно-методическое пособие, ГИУВ МО РФ. М. 2003, 54 с. 5. Сборник методических рекомендация по кардиологии (в соавт. Коломойцем Н.М.)// М.- 2005, 168 с. 6. Возможности повышения эффективности выявления ишемии у больных гипертонической болезнью при использовании в эхо-стресс-тестах доплеровских методик ( в соавт. С Туркиным А.С., Крюковым Е.В., Черепановым А.В.)// Воен.-мед. журн. – 2005.-№ 1.- с. 55 7. Проблемы ранней диагностики ишемической болезни сердца у военнослужащих, проходящих военную службу по контракту, выбор тактики лечения, принципы динамического диспансерного наблюдения (в соавт. с Резваном В.В., Раковым А.Л.)// Воен.-мед. журн. – 2006.-№ 2.- с. 24-29 8. Роль отделения функциональной диагностики гарнизонного госпиталя в верификации ишемической болезни сердца у военнослужащих//Организация работы гарнизонного госпиталя: Тезисы материалов научно практической конференции ГИУВ МО РФ: М. 2006, с. 37-39 9. Динамика сердечной недостаточности у больных с имплантированным электрокардиостимулятором (ЭКС) типа VVI и DDD в зависимости от метода подбора параметров стимуляции.// Современные аспекты патогенеза, диагностики и лечения суправентрикулярных тахиаритмий. Тезисы материалов III Международного симпозиума по интервенционной аритмологии совместно с учебным семинаром Европейского аритмологического общества (ECAS): М. 2007.С. 45-46 10. Динамика сердечной недостаточности у больных с имплантированным электрокардиостимулятором (ЭКС) типа VVI и DDD.// Там же. С- 34 11. Частота выявления и степень тяжести синдрома электрокардиостимулятора (ЭКС) в зависимости от метода подбора параметров стимуляции.// Там же. – С. 48 12. Что скрывается за синдромом электрокардиостимулятора (ЭКС)? .// Там же. – С. 49 13. Динамика тяжести сердечной недостаточности у пациентов получающих медикаментозную терапию в зависимости от ширины комплекса QRS. .// Там же. – С. 67 14. Изменение эхокардиографических показателей гемодинамики у пациентов с хронической сердечной недостаточностью, получающих медикаментозную терапию в зависимости от ширины комплекса QRS. .// Там же. – С. 69-70 15. Динамика тяжести сердечной недостаточности у пациентов с кардиоресинхронной терапией и получающих медикаментозную терапию. .// Там же. – С. 88-89 16. Влияние медикаментозной и сердечной ресинхронизирующей терапии на внутрисердечный асинхронизм. .// Там же. – С. 87 17. Частота госпитализаций среди пациентов хронической сердечной недостаточностью, получающих только медикаментозную и сердечно ресинхронизирующую терапию. .// Там же. – С. 82 18. Течение ишемической болезни сердца (ИБС) у больных с установленными электрокардиостимуляторами (ЭКС).// Воен.-мед. журн. – 2007.-№ 6.- с. 71 19. Указания по диагностике и лечению ишемической болезни сердца ( в соавт. с Резваном В.В., Григорьевым Ю.В.)// ГВМУ МО РФ, ГИУВ МО РФ. М. 2007, 48 с. 20. Сравнительная характеристика обращаемости за медицинской помощью и необходимость перепрограммировании электрокардиостимулятора в зависимости от метода подбора параметров стимуляции.// Воен.-мед. журн. – 2007.№ 6.- с. 74