Экологическая химия
реклама

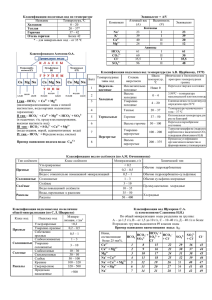
ЗАДАНИЕ № 4 Физико-химические процессы в гидросфере: состав и классификация природных вод 1 КЛАССИФИКАЦИЯ ПРИРОДНЫХ ВОД 1.1 Классификация природных вод по значению минерализации Один из самых распространенных способов классификации основан на различиях в общем количестве неорганических и частично растворенных органических веществ, содержащихся в природных водах. Общее количество растворенных веществ – минерализацию воды – принято определять по массе сухого остатка предварительно отфильтрованной и выпаренной пробы после высушивания до постоянной массы при температуре 105°С. В настоящее время по величине минерализации природные воды принято делить на восемь видов или классов (таблица 1). Качественная питьевая вода содержит не более 0,5 г/л солей. Ультрапресные воды обладают способностью выводить соединения кальция из организма человек, поэтому к их использованию для питья следует подходить с осторожностью. Таблица 1 – Классификация природных вод по значению минерализации [1] Минерализация, г/л 1 Менее 0,2 0,2-0,5 0,5-1,0 1-3 3-10 10-35 35-50 50-100 Наименование вод 2 Ультрапресные Пресные С относительно повышенной минерализацией Солоноватые Соленые С повышенной соленостью Переходные к рассолам Рассолы 1.2 Классификация Алекина А.О. На различии преобладающих анионов и катионов основана классификация природных вод, предложенная О.А. Алекиным и названая его именем. В соответствии с этой классификацией все воды делятся по преобладающему аниону на три больших класса: карбонатные; сульфатные; хлоридные (рис.). Класс гидрокарбонатных вод объединяет пресные и ультрапресные воды рек, озер и включает значительное количество подземных вод. Класс хлоридных вод объединяет воды морей, лиманов и подземные воды 1 солончаковых районов. Сульфатные воды по распространению и минерализации занимают промежуточное положение между хлоридными и карбонатными водами. Рис. – Классификация природных вод по О. А. Алекину [1] Каждый класс подразделяют на три группы по преобладающему катиону (кальциевая, магниевая и натриевая группы). Группы в свою очередь делятся на типы в соответствии с количественными характеристиками ионов и катионов. Так, к первому типу относятся воды, в которых концентрация ионов НСО3 , выраженная в ммоль-экв./л, больше, чем суммарная концентрация катионов кальция и магния: [НСО3-] > [Са2+] + [Мg2+]. Воды этого типа слабо минерализованы, для них характерен избыток гидрокарбонат-ионов. Воды второго типа характеризуются более высокой суммарной концентрацией гидрокарбонат- и сульфат-ионов, превышающей суммарную концентрацию катионов кальция и магния, которая в то же время является более высокой, чем концентрация одного гидрокарбонат-иона: [НСO3-] + [SO42-] > [Са2+] + [Мg2+] > [НСО3-]. К этому типу вод относятся подземные воды, а также воды рек и озер малой и средней минерализации. Для воды третьего типа характерна более высокая концентрац ия ионов хлора по сравнению с ионами натрия и, следовательно, суммарная концентрация катионов кальция и магния, превышающая суммарную концентрацию гидрокарбонат- и сульфат-ионов: 2 [Сl- ] > [Nа + ] или [Са2+ ] + [Мg2+ ] > [НСО 3- ] + [SO42- ]. Воды этого типа обычно сильно минерализованы. Четвертый тип вод характеризуется отсутствием гидрокарбонат ионов. Воды этого типа являются кислыми и имеются только в классах хлоридных и сульфатных вод. Классификация О.А. Алекина, хотя и получила распространение, является далеко не единственной системой, учитывающей химический состав природных растворов, и не лишена существенных недостатков. Так, например, в ней не учитывается присутствие в природных водах растворимых органических соединений, общая концентрация которых в воде рек и озер иногда достигает 100 мг/л. Рассмотренная выше классификация не учитывает также присутствия растворенных газов. Количество и природа растворенного газа оказывают существенное влияние на физико-химические процессы, протекающие в природных водоемах. 1.3 Классификация природных вод по величине жесткости Одной из важнейших характеристик природных вод, во многом определяющей возможности их использования человеком. Является жесткость воды. Жесткостью воды называется свойство воды. обусловленное содержанием в ней ионов кальция и магния. Единицей Жесткость измеряется в моль-экв./м3 (моль/м3) или ммоль-экв./л (ммоль/ л). Величину жесткости рассчитывают по уравнению: Ж = С(Са2+)/МЭ(Са2+) + С(Mg2+)/МЭ(Mg2+); Ж = С(Са2+)/[М(Са2+)∙f(Са2+)] + С(Mg2+)/[М(Mg2+)∙f(Mg2+)]; где Ж – жесткость воды, ммоль/л; С(Са2+), С(Mg2+) – концентрации ионов Са 2+ и Mg2+, выраженные в мг/л; МЭ(Са2+) и МЭ(Mg2+) – молярные массы эквивалентов ионов Са2+ и Mg2+; М(Са2+) и М(Mg2+) – молярные массы ионов Са2+ и Mg2+; f(Са2+), f(Mg2+) – факторы эквивалентности ионов Са 2+ и Mg2+; f(Са2+) = f(Mg2+) = ½ ; Молярные массы ионов Са2+ и Mg2+ равны: М(Са2+) = 40,08 г/моль (мг/ммоль); М(Mg2+) = 24,32 г/моль(мг/ммоль) Следовательно, молярные массы эквивалентов ионов Са2+ и Mg2+ равны: МЭ(Са2+) = 20,04 г/моль (мг/ммоль); М Э(Mg2+) = 12,16 г/моль(мг/ммоль). Тогда Ж = С(Са2+)/20,04 + С(Mg2+)/12,16. Определяемую таким образом жесткость называют общей жесткостью воды. По величине общей жесткости природные воды принято делить на ряд групп (таблица 2). Среди природных вод наиболее мягкими являются дождевые воды, жесткость которых составляет примерно 0,070–0,1 моль/м3. Жесткость 3 подземных вод меняется в широких пределах от 0,7 моль/м 3 (грунтовые воды Карелии) до 18–20 моль/м3 (грунтовые воды Донбасса) и зависит от состава контактирующих с ними горных пород. Жесткость речных вод зависит не только от состава горных пород, контактирующих с питающими реку водами, но и от климатических факторов. Таблица 2 – Классификация природных вод по величине жесткости [1] Жесткость, моль/м3 <1,5 1,5-3,0 3,0-5,4 5,4-10,7 >10,7 Группа воды Очень мягкая Мягкая Средней жесткости Жесткая Очень жесткая 1.4 Формула Курлова Для удобства представления химического состава природных вод принято использовать запись не в виде таблиц, а виде формулы Курлова. Например: 1) М (24,0/419) Cl 99 HCO31 рН 7,7 (Na+K) 76 Ca16 Mg8 Вода хлоридно-натриевая. 2) М (0,7/10,5) HCO3 88 Cl 11 SO41 рН 7,9 Ca48 Mg29 (Na+K)23 Вода гидрокарбонатно-кальциевая. При этом состав воды записывают в виде дроби. В числителе дроби в порядке уменьшения концентрации записывают химические формулы всех анионов, в знаменателе – всех катионов. В формулу вносятся лишь те катионы и анионы, содержание которых превышает 1 %-экв. Вслед за химической формулой иона цифрами записывают его концентрацию, выраженную в проценто-эквивалентах. Слева перед дробью в виде химической формулы и числа, характеризующего концентрацию в мг/л, записывают содержание в воде растворимых примесей, а затем микроэлементов, если они представляют геохимический интерес. Далее указывают округленную величину общей минерализации воды (М), выраженную в г/л и деленную на сумму ммоль-экв анионов в растворе. Справа от формулы принято записывать показатели, характеризующие рН и окислительно-восстановительный потенциал воды (мВ), если они известны. 4 2 ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 1. Представьте в виде формулы Курлова состав минеральной воды «Усполонь», содержащей следующие катионы и анионы (мг/дм3): Ca2+ – 275; Mg2+ – 150; Na+ + K+ – 400; НСО3- – 120; SO42- – 250; Cl- – 1300. Решение. Для решения задачи следует определить концентрации ионов в %-экв. и записать состав воды в виде дроби в соответствии с принятыми правилами. Поскольку %-экв. определяют долю концентрации соответствующего иона, выраженной в моль-экв./л (ммоль-экв./л) от общей концентрации всех катионов и анионов, присутствующих в данном раствор, то прежде всего необходимо выразить концентрации катионов и анионов в моль-экв./л (ммольэкв./л) и найти их суммы. Для этого массовую концентрацию каждого иона делят на молярную массу его эквивалента. М(Э)иона = f иона∙Миона, где Миона– молярная масса иона, г/моль; f иона– фактор эквивалентности иона; f иона = 1/zиона (zиона– заряд иона). Поэтому молярные массы эквивалентов однозарядных ионов равны их молярным массам, двухзарядных ионов – молярным массам, деленным на 2. Далее определяют суммарные концентрации анионов и катионов в мольэкв./л и процентное содержание концентрации каждого иона от соответствующей суммы. Скат = С(Са2+)/20,04 + С(Mg2+)/12,16 + С(Na+ + K+) = 275/20,04 + 150/12,16 + 400/23,0 = 13,72 + 12,34 + 17,39 = 43,45 ммоль-экв./л. Сан = С(HCO3-)/61,02 + С(SO42-)/49,04 + С(Cl-)/35,45 = 120/61,02 + 250/49,04 + 1300/35,45 = 1,97 + 5,10 + 36,67 = 43,74 ммоль-экв./л. %-экв.(Са2+) = (13,72/43,45) ∙100% = 31,58%; %-экв.(Mg2+) = (12,34/43,45) ∙100% = 28,40%; %-экв.( Na+ + K+) = (17,39/43,45) ∙100% = 40,02%, что в сумме составляет 100%-экв. %-экв.(HCO3-) = (1,97/43,74) ∙100% = 4,5%; %-экв.(SO42-) = (5,10/43,74) ∙100% = 11,66%; %-экв.(Сl-) = (36,67/43,74) ∙100% = 83,84%, что в сумме составляет 100%экв. Полученные значения представляют собой концентрации, выраженные в %-экв. Если концентрация иона меньше 1%-экв., то ион в формулу не записывают. Сумма масс катионов и анионов равна минерализации природной воды 5 М = 275 + 150 + 400 +120 + 250 + 1300 = 2495 мг/л = 2,5 г/л. Значение минерализации относят к сумме масс анионов в мг/л, которая равна 1670. Справа от дроби записывают значение pH. Результаты вычислений для минеральной воды «Усполонь» представлены в таблице. Таблица 3 – Составление формулы Курлова Компонент 2+ Молярная масса эквивалента, мг/моль Ca Mg2+ Na+ + K+ Cумма катионов 20,04 12,16 23,0 НСО3SO42ClCумма анионов Минерализация 61,02 49,04 35,45 М (2,5/1670) Содержание в минеральной воде мг/л ммоль%-экв экв./л Катионы: 275 150 400 825 Анионы: 120 250 1300 1670 2490 13,72 12,34 17,39 43,45 31,58 28,40 40,02 100,0 1,97 5,10 36,67 43,74 4,50 11,66 83,84 100,0 Cl 84 SO412 HCO3 5 рН 7,5 (Na+K) 40 Ca32 Mg28 Таким образом, вода «Усполонь» относится к классу хлоридных вод, к натриевой группе, к третьему типу, поскольку справедливы неравенства для концентраций ионов, выраженных в %-экв. [Сl- ] > [Nа + ] (36,67 > 17,39) и [Са2+ ] + [Мg2+ ] > [НСО3- ] + [SO42- ].(13,72 + 12,34) > (1,97 + 5,10) 3 ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Составить формулу Курлова по результатам химических анализов природной воды (см. таблицу) 2. Классифицировать природную воду по значению минерализации, по преобладающим анионам и катионам, по величине общей жесткости. 6 Таблица вариантов [2-4] № п/п 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Наименование источника Р. Волхов (1938) Р. Нева (1946) Р. Белая (1940) Р. Иртыш (1940) Оз. Иссык-Куль (1946) Оз. Байкал (1925) Оз. Балхаш (1946) Р. Амазонка Р. Темза Р. Нил (Каир) Дождевая вода над поверхностью Тихого океана Дождевая вода над поверхностью Индийского океана Живоносный источник Источник в долине р. Псижа Родники Ильменского глинта Родник у д. Перетерки Родник Параскевы Пятницы Родник Леохновского монастыря Муравьевский фонтан HCO3 80,4 27,5 272,1 79,3 240 58,6 443,8 18,1 214,0 84,6 0,53 - 2- SO4 13,3 4,5 166,9 15,3 2115 4,4 843 0,8 39,1 46,7 4,4 Содержание главных ионов, мг/л ClCa2+ Mg2+ 38,4 27,4 5,8 3,8 8,0 1,2 18,0 114,0 25,0 3,4 24,5 4,7 1585 114 294 2,0 15,2 4,4 574 25,7 164 2,6 5,4 0,5 12,2 75,9 4,8 3,4 15,8 8,8 5,73 – – рН + + Na 20,8* 3,8* 17,0* 0,1* 1475* 4,9* 694* 3,3* 12,3* 9,4* 11,0 K – – – – – – – – – – 0,4 – – – – – – – – – – – 0,164 4,2 8,46 – – 4,0 1,5 – 540 163 567 1,0 52 3,0 19 11344 131 87 1049 116 37 371 41 47* 5530* 90* – – – 7,6 7,3 7,8 391 257 569 3,0 3,0 2,0 28 30 40 80 70 123 23 19 22 32* 2* 58* – – – 7,9 8,0 7,5 150 52 14747 1344 381 7373* – 7,7 7 20 21 22 23 24 25 26 27 28 Источник в долине р. Порусья «На Богомольной горе», г. Валдай Источник« Живоносный» г. Валдай Родник Пятницкий Родник в д. Большое Городно Родник в д. Едно Родник Варницкий-1 Родник «Текунок» в д. Борисово Родник «Соколовские ключи» в д. Долгие Бороды 478 3,0 37 90 31 50* – 7,9 284 12 31 76 12 22,77* – 7,9 346 27 27,94 70 13 55,89* – 7,2 133 208 4,0 285 1,42 0,99 44 84 2,0 6,0 9,20* 108,10* – – 7,9 7,9 232 323 124 5,0 23 2,0 71 328 2,0 104 120 40 2,0 37 5,0 14,26* 138,23* 12,65* – – – 7,0 7,7 7,2 153 7,0 24 48 1,0 15,73* – 7,3 * В случаях, отмеченных звездочкой, определена суммарная концентрация ионов Na+ + К+. Поскольку концентрация ионов калия значительно меньше, чем ионов натрия, концентрацию в %-экв. вычисляют только для натрия (суммарную массовую концентрацию ионов натрия и калия делят на молярную массу эквивалента иона натрия). Литература: 1. Тарасова Н.П., Кузнецов В.А., Сметанников Ю.В. и др. Задачи и вопросы по химии окружающей среды. М.: Мир, 2002. – 368с. 2. Алекин О. А. Основы гидрохимии.– Л.: Гидрометеоиздат, 1970.– 404 с. 3. Летенкова И.В., Литвинов В.Ф. Оценка качества родниковых вод Старорусского района Новгородской области: Тезисы докладов XIV Международной конференции «Образование в интересах устойчивого развития», г. Великий Новгород, 1-3 июля 2008 г. Российский Зелёный крест, 2008, с. 309-311. 4. Летенкова И.В., Матюнина А.С. Изучение качества родниковых вод Валдайского национального парка: Природный, культурно-исторический и туристический потенциал Валдайской возвышенности, его охрана и использование; Матер. межрегион. научно-практ. конф., г. Валдай. 14-17 апр. 2010г. – с.115-120. 8