Словарь по неорганической химии
реклама
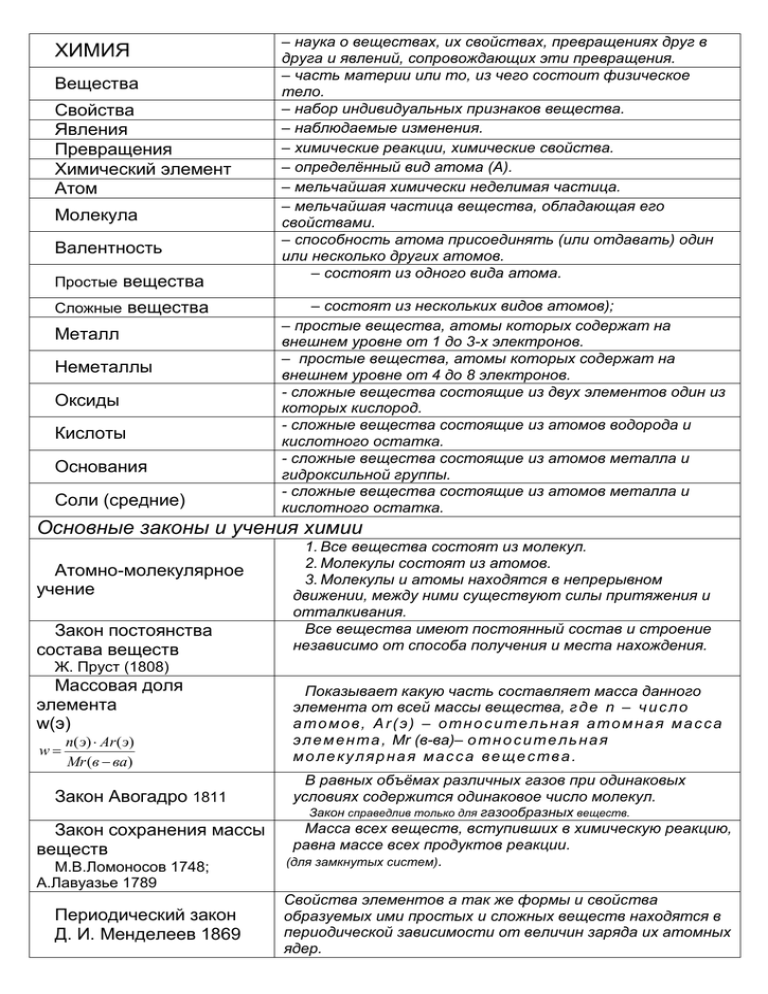
ХИМИЯ Вещества Свойства Явления Превращения Химический элемент Атом Молекула Валентность Простые вещества Сложные вещества Металл Неметаллы Оксиды Кислоты Основания Соли (средние) – наука о веществах, их свойствах, превращениях друг в друга и явлений, сопровождающих эти превращения. – часть материи или то, из чего состоит физическое тело. – набор индивидуальных признаков вещества. – наблюдаемые изменения. – химические реакции, химические свойства. – определённый вид атома (А). – мельчайшая химически неделимая частица. – мельчайшая частица вещества, обладающая его свойствами. – способность атома присоединять (или отдавать) один или несколько других атомов. – состоят из одного вида атома. – состоят из нескольких видов атомов); – простые вещества, атомы которых содержат на внешнем уровне от 1 до 3-х электронов. – простые вещества, атомы которых содержат на внешнем уровне от 4 до 8 электронов. - сложные вещества состоящие из двух элементов один из которых кислород. - сложные вещества состоящие из атомов водорода и кислотного остатка. - сложные вещества состоящие из атомов металла и гидроксильной группы. - сложные вещества состоящие из атомов металла и кислотного остатка. Основные законы и учения химии Атомно-молекулярное учение Закон постоянства состава веществ 1. Все вещества состоят из молекул. 2. Молекулы состоят из атомов. 3. Молекулы и атомы находятся в непрерывном движении, между ними существуют силы притяжения и отталкивания. Все вещества имеют постоянный состав и строение независимо от способа получения и места нахождения. Ж. Пруст (1808) Массовая доля элемента w(э) w n( э) Ar ( э) Mr (в ва) Закон Авогадро 1811 Закон сохранения массы веществ М.В.Ломоносов 1748; А.Лавуазье 1789 Периодический закон Д. И. Менделеев 1869 Показывает какую часть составляет масса данного элемента от всей массы вещества, г д е n – ч и с л о атомов, Аr(э) – относительная атомная масса э л е м е н т а , Мr (в-ва)– о т н о с и т е л ь н а я молекулярная масса вещества. В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул. Закон справедлив только для газообразных веществ. Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. (для замкнутых систем). Свойства элементов а так же формы и свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от величин заряда их атомных ядер. – горизонтальный ряд элементов с одинаковым числом электронных слоёв (уровней), равным номеру периода. Период Малый период Большой период Группа Главная подгруппа Побочная подгруппа ЭЛЕКТРООТРИЦАТЕЛЬНОС ТЬ (ЭО) КОВАЛЕНТНАЯ связь Неполярная ковалентная связь Полярная ковалентная связь Донорно-акцепторная связь ИОННАЯ связь МЕТАЛЛИЧЕСКАЯ связь ВОДОРОДНАЯ связь Степень окисления СТРУКТУРНЫЕ ФОРМУЛЫ Малые Большие 1, 2, 3 4, 5, 6, 7 - состоит из одного ряда. - состоит из нескольких рядов. – вертикальный столбец элементов с одинаковым числом валентных электронов равным номеру группы. - содержит элементы малых и больших периодов. - содержит элементы только больших периодов. - относительная способность атомных ядер притягивать к себе электроны, образующие химическую связь. – связь, образованная двумя или несколькими атомами неметаллов за счёт образования общих электронных пар ( н е М е н е М е ). – образуется между атомами элементов неметалла с одинаковыми значениями электроотрицательности ( н е М е н е М е ; э о = э о ). – образуется между атомами элементов неметалла с различными значениями электроотрицательности (( н е М е н е М е ; эо<э о ) . – разновидность ковалентной связи, образующаяся за счёт образования общих электронных пар. – образуется при помощи электрического притяжения ионов металлов и неметаллов ( М е + н е М е –). – образуется между нейтральными атомами, положительными ионами металлов и свободно движущихся электронов. – связь, возникающая между ионами водорода одной молекулы и сильно электроотрицательными атомами другой молекулы. - условный заряд атома в молекуле. - изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками. Например, структурные формулы: Cl - Cl (молекула CaCl2), O = С= O (молекула СО2) и т.д. – численно равна номеру группы, в которой расположен данный элемент. Высшая валентность элемента Валентность = степень окисления Реакция СОЕДИНЕНИЯ Реакция РАЗЛОЖЕНИЯ Реакция ЗАМЕЩЕНИЯ – химическая реакция, когда из нескольких простых или сложных веществ, образуется одно вещество. 2 Са + О2 → СаО – химическая реакция, когда из одного сложного вещества образуется несколько простых или менее сложных. 2 HgO → 2 Hg + O2 – химическая реакция взаимодействия простых и сложных веществ с образованием новых простых и сложных веществ. Zn + 2 HCl → ZnCl2 + H2 Реакция ОБМЕНА ГОМОГЕННЫЕ реакции ГЕТЕРОГЕННЫЕ реакции ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ ЭКЗОТЕРМИЧЕСКИЕ реакции ЭНДОТЕРМИЧЕСКИЕ реакции ОБРАТИМЫЕ реакции НЕОБРАТИМЫЕ реакции КАТАЛИЗАТОРЫ КАТАЛИТИЧЕСКИЕ реакции НЕКАТАЛИТИЧЕСКИЕ реакции ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ реакции НЕОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ реакции Реакционного ионного обмена (обратимая) Реакционного ионного обмена (необратимая) Электролиты Неэлектролиты РАСТВОРЫ Ионы (И) Катионы (kt+) Анионы (an-) – химическая реакция взаимодействия двух сложных веществ с образованием нескольких сложных веществ. Ba(OH)2 + Na2SO4 → 2 NaOH + BaSO4 – химическая реакция, где все вещества находятся в одинаковом агрегатном состоянии. N2 + 3 H2 → 2 NH3 – химическая реакция, где вещества находятся в разных агрегатных состояниях. - теплота, выделенная или поглощенная при протекании химической реакции. Обычно обозначается – Q/ – химическая реакция, протекающая с выделением теплоты. С + О2 → СО2 + 112 кДж – химическая реакция, протекающая с поглощением теплоты. СаСО3 → СаО + СО2 – 180 кДж – химическая реакция, идущая в двух взаимопротивоположных направлениях. Н2О + СО2 ↔ Н2СО3 – химическая реакция, идущая в одном направлении. Na2CО3 + 2 HCl → 2 NaCl + CO2 + H2O - вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными. – химическая реакция с участием катализатора. 2 Al + 3 I2 → 2 AlI3 – химическая реакция без катализатора. 2 Na + 2 H2O → 2 NaOH + H2 – химическая реакция с изменением степени окисления. 2 N a 0 + S 0 = N a 2 + 1 S –2 – химическая реакция без изменения степени окисления. Са+2О-2 + С+4О3-2 – химическая реакция между ионами в водных растворах веществас образованием веществ растворимых в воде. 2 КNO3 + H2SO4 →K2SO4 + 2HNO3 – химическая реакция между ионами в водных растворах вещества, кода один из продуктов реакции(газ, осадок или вода). 2 КОН + H2SO4 →K2SO4 + H2O – вещества в водных растворах или расплавах распадающиеся на ионы и проводящие электрический ток (молекулы с ионной или ковалентной полярной связью). – вещества в водных растворах или расплавах не распадаются на ионы и не проводят электрический ток (молекулы с ковалентной неполярной связью). однородные молекулярные смеси из двух или более веществ. - положительно и отрицательно заряженные частицы. - положительно заряженные частицы. - отрицательно заряженные частицы. Анод (А+) Катод (К-) Диссоциация Электролитическая диссоциация (ЭД) Кислоты Основания Средние соли Кислые соли Степень ЭД α =n/N или α =n .100%/N Сильные электролиты Средние электролиты Слабые электролиты Гидролиз солей Реакция среды раствора ИНДИКАТОРЫ (кислотно-основные) ВОССТАНОВЛЕНИЕ ОКИСЛИТЕЛЬ ОКИСЛЕНИЕ ВОССТАНОВИТЕЛЬ - положительно заряженный электрод. - отрицательно заряженный электрод. - распад. - распад электролитов на ионы при расплавлении в воде и расплавлении. – электролиты, которые в водном растворе диссоциируют на катионы водорода и анионы кислотных остатков. – электролиты, которые в водном растворе диссоциируют на катионы металла и гидроксид-анион. – электролиты, которые в водном растворе диссоциируют на катионы металла и анионы кислотного остатка. – электролиты, в результате диссоциации которых помимо катионов металла и анионов кислотного остатка образуются катионы водорода. - показывает отношение числа распавшихся на ионы молекул к общему числу молекул с растворе. - электролиты α > 30% - электролиты 3% < α < 30% - электролиты α < 3% - взаимодействие ионов соли с водой в результате которого образуется малодиссоциирующее вещество и изменяется реакция среды раствора. - вещества сложного строения, имеющие разную окраску в растворах кислот и оснований. Бывают индикаторы и для других веществ (не кислотноосновные). Например, крахмал - индикатор на появление в растворе иода (дает синюю окраску). - химическая реакция, при которой электроны передаются данному веществу. - вещество, способное отнимать электроны у другого вещества (восстановителя). - химическая реакция, при которой электроны отбираются у данного вещества окислителем. -вещество, способное отдавать электроны другому веществу (окислителю).