Вирусные болезни птиц.
реклама
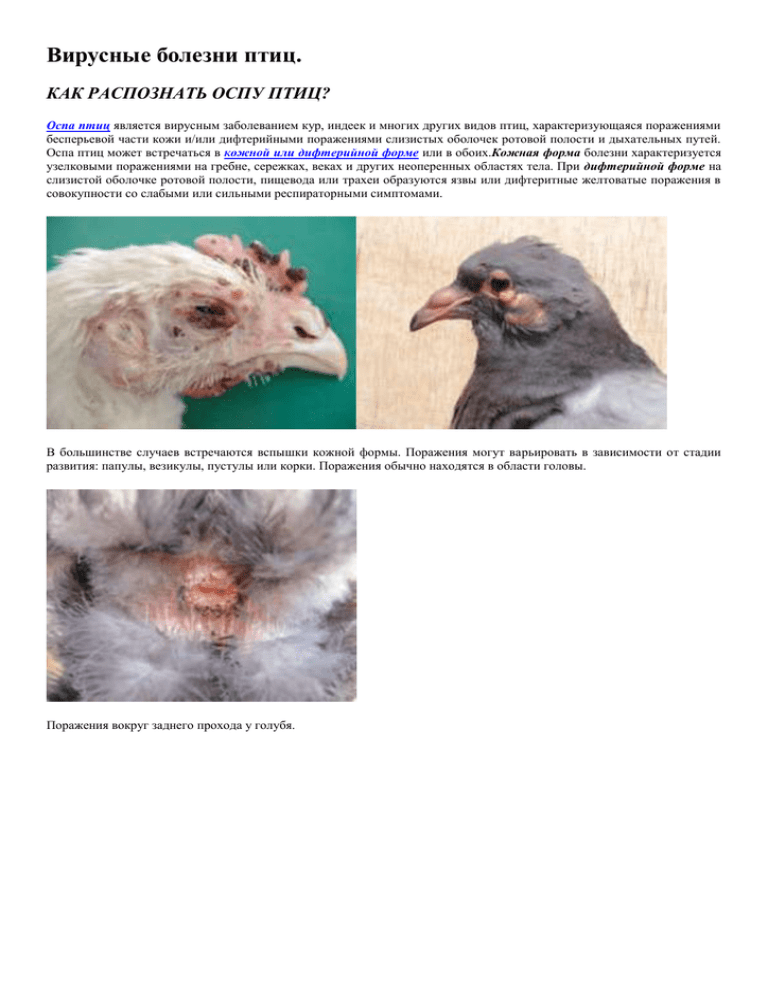
Вирусные болезни птиц. КАК РАСПОЗНАТЬ ОСПУ ПТИЦ? Оспа птиц является вирусным заболеванием кур, индеек и многих других видов птиц, характеризующаяся поражениями бесперьевой части кожи и/или дифтерийными поражениями слизистых оболочек ротовой полости и дыхательных путей. Оспа птиц может встречаться в кожной или дифтерийной форме или в обоих.Кожная форма болезни характеризуется узелковыми поражениями на гребне, сережках, веках и других неоперенных областях тела. При дифтерийной форме на слизистой оболочке ротовой полости, пищевода или трахеи образуются язвы или дифтеритные желтоватые поражения в совокупности со слабыми или сильными респираторными симптомами. В большинстве случаев встречаются вспышки кожной формы. Поражения могут варьировать в зависимости от стадии развития: папулы, везикулы, пустулы или корки. Поражения обычно находятся в области головы. Поражения вокруг заднего прохода у голубя. Часто, конъюнктивы слизистой оболочки, пораженные вирусом оспы, являются входными воротами для других болезнетворных агентов (Е. Coli, бактерии рода стафилококки. др.) и развития осложнений. Инфекция распространяется механически через шелушение корок кожи, которые содержат его. Некоторые комары и кровососущие членистоногие могут также распространять вирус оспы. Комары сохраняют свои инфекционные свойства в течение нескольких недель. Инкубационный период составляет от 4 до 10 дней. Болезнь распространяется медленно и может пройти много недель между его возникновением и тяжелыми вспышками. Дифтерийные поражения выглядят в виде беловатых или желтоватых бляшек на слизистых оболочках ротовой и носовой полостей, пазух, гортани, глотки, трахеи или пищевода (стрелки). Диагностика осуществляется на основании типичных кожных и дифтерийных поражений. Предупреждение оспы птиц осуществляется путем прививок, которых можно сделать в любом возрасте при необходимости. БОЛЕЗНЬ НЬЮКАСТЛА- КОНТРОЛЬ И ПРОФИЛАКТИКА ПРЕДОТВРАЩЕНИЕ И КОНТРОЛЬ. Вне зависимости от уровня контроля (международный, национальный или на уровне отдельного хозяйства), его целью является либо предотвращение инфицирования чувствительных птиц, либо снижения количества восприимчивых кур путем вакцинации. При руководстве первой стратегией необходимо учитывать все методы распространения заболевания для его предотвращения. Профилактика ОРВИ 3 приема против гриппа и простуды. Защитите себя и свою семью с Викс Актив! vicks.ru Есть противопоказания. Посоветуйтесь с врачом. Стратегия контроля на международном уровне. В настоящее время расширение промышленного птицеводства и торговля его продукцией организуются уже на международной основе. Часто это делается под управлением многонациональных компаний. Кроме того, существует тенденция торговли одновременно как продукцией птицеводства, так и генетическим запасом. Однако сильно сдерживающим фактором такой торговли является угроза ньюкастлской болезни. Всемирный контроль за ньюкастлской болезнью будет установлен лишь в том случае, если все страны будут сообщать о вспышках заболевания внутри своих границ в международные органы. Принятие международных соглашений по этому и другим вопросам не простое дело, если учесть огромное различие в мерах контроля заболевания различных стран. Предпосылкой формирования политики контроля, особенно международного, должно стать соглашение о порядке выявления заболевания и политики в отношении контроля вируса. Некоторые страны не применяют вакцинацию и не хотят, чтобы вирус ньюкастлской болезни был внесен в их стаи в какой бы то ни было форме. Другие страны разрешают только определенные живые вакцины, а некоторые из вакцин считают неприемлемо вирулентными. Кроме того, в некоторых странах постоянно циркулируют высоковирулентные вирусы, которые вследствие вакцинации не выглядят как очевидное заболевание. Бенджейн предложил о любой инфекции, вызванной вирусом с показателем вирулентности выше 0.7, сообщать как о вспышке ньюкастлской болезни. Это было бы приемлемо для тех стран, где используются только вакцины на основе лентогенных и инактивированных вирусов. Но абсолютно не подходит для стран, использующих вакцины на основе мезогенных вирусов или там, где существуют энзоотические мезогенные вирусы. Тем не менее, такое определение принято странами Европейского Союза для применения в качестве меры контроля. Стратегия контроля на национальном уровне. На национальном уровне политика контроля направлена на предотвращение внесения вируса и предотвращение его распространения внутри страны. Чтобы не допустить внесения вируса ньюкастлской болезни, большинство стран устанавливают ограничения на торговлю продукцией птицеводства, яйцами и живой домашней птицей. Но эти ограничения значительно варьируются. Из-за связи содержащихся в клетках экзотических птиц с распространением ньюкастлской болезни во время панзоотии 1970—1974 годов и известной способности птиц семейства попугаев к выделению вируса НБ в течение многих недель после инфицирования, большинство импортирующих стран установили для импортируемых птиц карантинные меры. Панзоотия ньюкастлской болезни (PMV-1) 1980 годов среди спортивных голубей создала уникальную по возможности распространения заболевания на домашних птиц ситуацию. Каждый год проводится большое количество международных соревнований по скоростному полету среди голубей. Из-за этого в некоторых странах были приняты меры, включающие запрет на такие соревнования, внесены ограничения в эти соревнования или принудительную вакцинацию участвующих в них голубей. Во многих странах существуют законы по контролю возможных вспышек ньюкастлской болезни. Некоторые страны проводят политику искоренения инфекции с принудительным умерщвлением инфицированных, контактировавших с ними птиц и их продуктов. Такая политика обычно включает ввод ограничений на перемещение или торговлю птицами в пределах определенных карантинных зон вокруг мест со вспышками заболевания. Другие требуют проведения профилактической вакцинации птиц, даже при отсутствии вспышек заболевания, а третьи проводят политику «круговой вакцинации» вокруг мест со вспышками заболевания для создания буферной зоны. Меры контроля и предотвращения заболевания на уровне отдельного хозяйства. Возможно, наиболее важными элементами предотвращения внесения вируса ньюкастлской болезни и его распространения во время вспышек заболевания являются условия содержания птиц и степень биозащиты, применяемой в хозяйстве. Меры контроля пневмовирусов птиц. Ринотрахеит индеек значительно обостряется при неправильном содержании, а именно неправильной вентиляции, перенаселенности, плохой подстилке, плохой гигиене и смешении птиц разных возрастов. Вызвать обострение болезни и усилить клинические симптомы или привести к смерти может также удаление клюва или вакцинация живыми вирусами НБ, если эти процедуры проводятся в критический момент. Эндрел с коллегами указал на трудность ликвидации ринотрахеита индеек в местах содержания птиц разных возрастов и там, где невозможно провести полную очистку и дезинфекцию. Попытки лечения ринотрахеита индеек и синдрома «опухшей головы» антибиотиками имели переменный успех. Вакцинация против ньюкастлской болезни. В идеальном случае вакцинация против НБ должна приводить к развитию иммунитета против инфекции и репликации вируса. В действительности же вакцинация против НБ обычно защищает птиц от более тяжелых последствий заболевания, но репликация и распространение может продолжаться, хотя и на более низком уровне. Необходимо иметь в виду, что ни при каких обстоятельствах вакцинация не может быть альтернативой хорошему ведению хозяйства, биозащите или обеспечению достаточных мер гигиены в местах содержания домашних птиц. ИСТОРИЧЕСКИЕ АСПЕКТЫ ВАКЦИНАЦИИ. Ранние исследования показали, что инактивированные инфекционные материалы обеспечивали защиту инокулированных кур. Однако проблемы с изготовлением и стандартизацией вакцин не позволяли использовать их широко. Исследования аттенуации (ослабления) вирулентных штаммов вируса ньюкастлской болезни, проведенные в 1930 годах Йером и Добсоном, привели к созданию мезогенных вакцинных штаммов, которые до сих пор еще применяются в некоторых странах. Инактивированные вакцины, в которых в основном применяются вирусы, адсорбированные на гидроокиси алюминия, чаще других применялись в Европе вплоть до панзоотии 1970—1974 годов. Однако из-за низкой эффективности в большинстве стран были заменены живыми вакцинами, основанными на штаммах В1 и La Sota. Эта панзоотия дала также толчок к созданию современных инактивированных вакцин на основе масляных эмульсий, показавших свою высокую эффективность. ПРАКТИКА ВАКЦИНАЦИИ. В некоторых странах выпущены законы, касающиеся использования и контроля качества вакцин. Отношение к этому в значительной мере зависит от наличия панзоотии осознания угрозы ньюкастлской болезни. Некоторые страны, такие как Дания, запрещают использование любых вакцин, в то время как другие, например, Нидерланды, проводят принудительную вакцинацию всех домашних птиц. В странах Европейского Союза выпущены законы, касающиеся определения патогенности вирусов. По результатам проверок будет даваться разрешение на их использование в качестве вакцин государствами-членами Союза. Эталонный посевной материал живых вакцин должен быть проверен, иметь строго установленную дозу и значение индекса внутримозговой вирулентности ниже 0,4. В то же время эталонный посевной материал вирусов инактивированных вакцин должен иметь значение этого индекса ниже 0,7. ЖИВЫЕ ВАКЦИНЫ Штаммы вирусов. Живые вакцины против ВНБ удобно разделить на две группы: лентогенные и мезогенные. Мезогенные вакцины подходят только для вторичной вакцинации птиц, так как высоко вирулентны. Однако даже внутри лентогенной группы имеются значительные вариации по вирулентности. Иммунная реакция усиливается при повышении патогенности живых вакцин. Поэтому для получения требуемого уровня защиты без нежелательных реакций необходимо включать в программу вакцинации последовательное применение все более вирулентных вирусов или применение живых вирусов вслед за инактивированными вакцинами. Применение живых вакцин. Цель применения живых вакцин заключается в том, чтобы вызвать развитие инфекции среди птиц, желательно во всей стае. Индивидуальное применение вакцин, такое как внутриназальное введение, закапывание в глаза, погружение клюва, чаще всего применяются для лентогенных вакцин. Мезогенные вакцины обычно требуют инокуляции укалыванием в перепонку крыла или внутримышечного введения. Основным достоинством живых вакцин является возможность применения без использования дорогостоящих методик. Чаще всего живые вакцины применяются в питьевой воде. Для этого птицам в течение нескольких часов не дают пить. После этого вакцину добавляют в свежую питьевую воду, доводя до точно вычисленной концентрации, обеспечивающей получение каждой птицей достаточной дозы. Кроме этого, успешно применяется добавление вакцины в резервуар для подачи воды самотеком. Применение питьевой воды надо тщательно контролировать, так как вирусы могут инактивироваться при чрезмерном нагреве воды, ее загрязнении и даже в зависимости от вида трубопровода или сосудов, используемых для ее распределения. В некоторой степени жизнеспособность вируса можно повысить добавлением в питьевую воду сухих сливок. Очень популярным стало применение живых вакцин разбрызгиванием и с помощью аэрозолей. Это обусловлено легкостью вакцинации большого числа птиц за короткое время. Важным при таком применении является достижение правильного размера частиц. Для этого надо контролировать условия производства аэрозоля. Аэрозоли обычно применяются только для вторичной вакцинации, во избежание сильных реакций на вакцину. Разбрызгивание крупной водяной пыли вызывает меньшую реакцию. Это обусловлено тем, что большие частицы не проникают глубоко в дыхательные пути птиц. Поэтому такое применение больше подходит для массовой вакцинации молодых птиц. Обрызгивание крупными каплями однодневных цыплят может привести к развитию в стаде инфекции, вызванной вакцинными вирусами, несмотря на иммунитет, полученный молодыми птицами от матери. Преимущества и недостатки живых вирусных вакцин. Живые вакцины обычно продаются в виде лиофилизированной аллантоисной жидкости из инфицированных оплодотворенных яиц. Они относительно дешевы и легки в применении, а также подходят для массового использования. Инфекции, вызванные живыми вирусами, стимулируют местный иммунитет и при их применении защита создается очень быстро. Вакцинные вирусы могут распространяться между птицами, в результате чего происходит успешная вакцинация всех птиц. Но живые вирусные вакцины имеют и ряд недостатков. Главный из них заключается в способности вызывать развитие заболевания при определенных внешних условиях и наличии осложняющих инфекций. Поэтому очень важно при первой вакцинации использовать очень слабые вирусы, что требует многократного применения вакцины. Иммунитет, полученный от матери, может свести на нет первую вакцинацию живым вирусом. Хотя способность вакцинных вирусов распространяться в стае может быть преимуществом, но у восприимчивых птиц может привести к тяжелому заболеванию, особенно в случае двойных инфекций в результате действия микроорганизмов, обостряющих болезнь. Живые вакцины можно легко инактивировать химическими веществами и нагревом, но при отсутствии надлежащего контроля при изготовлении они могут оказаться зараженными другими вирусами. ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ Методы производства. Инактивированные вакцины обычно изготавливаются из инфекционной аллантоисной жидкости, обработанной (3-пропиолактоном или формалином для инактивации вируса и смешиваются с адьювантом носителя вируса. Раньше для инактивированных вакцин использовались адьюванты из гидроксида алюминия, но затем были созданы вакцины на основе масляной эмульсии. Такие вакцины разнообразны по составу эмульсионной основы, антигенам и соотношению воды и масла. В настоящее время в основном применяются минеральные масла. Для изготовления вакцин на масляно-эмульсионной основе применяются вирусы Ulster 2С, В1, La Sota, Roakin и еще несколько вирулентных вирусов. Критерием выбора вакцины является количество антигена, производимого при выращивании вируса в оплодотворенных яйцах. В состав эмульсии с вирусом ньюкастлской болезни могут быть включены несколько других антигенов, так бивалентные и поливалентные вакцины могут включать вирусы инфекционного бронхита, инфекционного бурсита, синдрома снижения яйценоскости, а также реовирусы. Применение инактивированных вакцин. Инактивированные вакцины применяются в виде внутримышечных или внутривенных инъекций. Преимущества и недостатки инактивированных вакцин. Инактивированные вакцины намного легче хранить, чем живые, но они дороже в производстве и применении из-за больших трудовых затрат. Трудовые затраты можно частично компенсировать применением поливалентных вакцин. На Инактивированные масляно-эмульсионные вакцины не влияет материнский иммунитет, что обычно происходит при использовании живых вакцин. Именно поэтому их можно применять для вакцинации однодневных цыплят. Основными особенностями инактивированных вакцин являются очень низкий уровень нежелательных реакций у вакцинированных птиц, возможность использования их в ситуациях, где применение живых вакцин неприемлемо, особенно в присутствии патогенных микроорганизмов. Еще одним преимуществом инактивированных вакцин является получение чрезвычайно высоких уровней защитных антител, сохраняющихся долгое время. ПРОГРАММЫ ВАКЦИНАЦИИ. Программы вакцинации и вакцины могут контролироваться правительственными органами. Программы должны быть подготовлены с учетом ситуации, складывающейся с преобладающим заболеванием, и других факторов. К таким факторам относятся пригодность вакцин, материнский иммунитет, использование других вакцин, присутствие других микроорганизмов, размер стаи, предполагаемая продолжительность жизни стаи, возможные трудовые затраты, климатические условия, история последней вакцинации и стоимость. Выбор времени вакцинации бройлерных кур может оказаться особенно трудной задачей, обусловленной присутствием материнских антител. Вследствие малой продолжительности жизни бройлеров вакцинацию таких кур иногда производят в странах с незначительным риском ньюкастлской болезни. Вакцинация несущихся кур требует более одной дозы для поддержания иммунитета в течение жизни. ИНТЕРПРЕТАЦИЯ ВАКЦИННОЙ РЕАКЦИИ. Иммунная реакция на вирус ньюкастлской болезни обычно оценивается титрами торможения гемагглютинации (ТГ). Одноразовая вакцинация живым патогенным вирусом вызывает у восприимчивых кур реакцию с титрами от 2,4 до 2,6. Однако при выполнении программы вакцинации с применением вакцин на масляно-эмульсионной основе титры ТГ могут достигать 2,11 и выше. ВАКЦИНАЦИЯ ДРУГИХ ДОМАШНИХ птиц. Вакцины разработаны в основном для защиты кур. Но они могут успешно использоваться и для других птиц, хотя при этом возможны и некоторые отличия в иммунной реакции. Например, индейки дают более слабую реакцию, в результате чего в первый раз их часто вакцинируют штаммом La Sota вслед за масляно-эмульсионной вакциной. Однако есть данные, что вирус La Sota может вызвать нежелательные реакции в дыхательных путях, и аэрозольная вакцинация лентогенными вирусами вызывает патологические поражения в трахее. С помощью вакцин на основе вируса La Sota и масляно-эмульсионных вакцин успешно вакцинируются цесарки и куропатки. В связи с панзоотией 1980 годов среди голубей были проведены большие исследовательские работы по наиболее подходящим для них вакцинам и порядку их применения. ВАКЦИНАЦИЯ ПРОТИВ ПНЕВМОВИРУСОВ ПТИЦ. В настоящее время доступны как живые аттенуированные, так и инактивированные вакцины. Проблемы с воспроизведением заболевания в лабораторных условиях делают работу по ослаблению вирусов очень трудной. Живые инактивированные вакцины на основе вируса ринотрахеита индеек используются как для индеек, так и для кур. Однако результаты исследований в полевых условиях не отличаются постоянством. В настоящее время остается пока неясным, связано ли это с антигенными изменениями, отмеченными у пневмовирусов птиц, интерференцией действующих одновременно инфекций (возможно, иммуносупрессивных) или какими-либо другими причинами. Болезнь Ньюкастла- как распознать? Вирус ньюкастлской болезни (ВНБ) парамиксовирус (PMV-1) является для домашних птиц опасным патогеном. Представители семейства Раramyxoviridae относятся к РНК-содержащим вирусам, имеющим нуклеокапсид спиральной симметрии. Геном представлен единой односпиральной линейной молекулой минус (-) РНК. Вирусы покрыты оболочкой, которая формируется из модифицированных участков клеточной мембраны при почковании вируса от поверхности клетки после образования в цитоплазме капсидного комплекса. Результатом действия вируса ньюкастлской болезни является очень сильно меняющееся по виду и тяжести заболевание. В связи с этим часто возникают проблемы номенклатуры. Обычно это происходит в случае, если заболевание впервые обнаружено в стране. В результате этого у ньюкастлской болезни имеется множество других названий: псевдочума птиц, нетипичная чума птиц, псевдочума домашних птиц, чума птиц, болезнь Ранихета, болезнь Тетело, корейская чума птиц и пневмоэнцефалит птиц. Особенностью ньюкастлской болезни, осложняющей ее лечение, является то, что различные изоляты и штаммы вируса вызывают заболевания самой разной тяжести, даже у одного носителя, например, кур. Для решения номенклатурных проблем Берд и Хенсон предложили следующее деление по формам болезни, основанное на клинических симптомах у кур. 1. Форма Доила. Характеризуется острым течением, высокой смертностью, подверженностью заболеванию кур всех возрастов, присутствием геморрагических поражений пищеварительного тракта. Эта форма болезни называется велогенной висцеротропной ньюкастлской болезнью (ВВНБ). 2. Форма Бича. Она характеризуется острым течением, часто с летальным исходом. При этой форме заболевания у пораженных птиц обычно наблюдаются респираторные и неврологические симптомы. Вследствие этого она называется велогенной нейротропной ньюкастлской болезнью (ВННБ). 3. Форма Бодетта. Является менее патогенной, чем велогенная нейротропная нью-кастлская болезнь, а гибели от нее подвержены только молодые птицы. Вирусы, вызывающие эту форму заболевания, обладают средней вирулентностью и могут использоваться в качестве вторичной живой вакцины. 4. Форма Хитчнера. Она представлена слабыми или бессимптомными респираторными инфекциями, вызываемыми вирусами пониженной вирулентности, которые обычно применяют в качестве живых вакцин. 5. Бессимптомная кишечная форма. Она включает, главным образом, кишечные инфекции, вызываемые вирусами со сниженной вирулентностью. При этой форме заболевание протекает скрытно. Клинические заболевания кур, являющиеся следствием инфицирования пневмовирусом птиц, называются синдромом «опухшей головы» (СОГ), а у индеек — ринотрахеитом индеек (РТИ). Симптомы этих заболеваний присущи не только инфекциям, вызываемым пневмовирусом птиц. Поэтому их можно спутать у индеек с заболеваниями, вызванными инфицированием такими микроорганизмами, как Bordetella avium. Тем не менее состояния, имеющие отношениє к ринотрахеиту индеек или синдрому «опухшей головы», могут появляться в результате инфицирования одними и теми же пневмовирусами. Более тяжелые формы сопутствующих заболеваний, возможно, происходят от двойных или вторичных инфекций, вызванных другими микроорганизмами. Болезнь Ньюкасла является оодной из самых заразных болезней у многих видов домашних, экзотических и диких птиц, которая характеризуется выраженными различиями по заболеваемости, смертности, симптомам и поражениям. Клиникоморфологические признаки имеют явный висцеротропный или нейротропный характер. В висцеротропной форме наблюдаются геморрагические дифтерийные поражения всего пищеварительного тракта от клюва до заднего прохода. Характерными являются кровоизлияния эпителия мускульного желудка. Слизистая оболочка отечная, покрыта густой слизью и испещрена от одного до многочисленных кровоизлияний, иногда локализуясь на границе между мускульным желудком и пищеводом. Типичными для этой формы являются гемаррогические некрозы и дифтероидные поражения слизистой оболочки бокаловидного расширения, желудка и кишечника. Болезнь, как правило, распространена среди кур, реже у индеек, экзотических и диких птиц. Болезнь поражает птицу в любом возрасте. В зависимости от патогенности многочисленные известные штаммы парамиксовируса классифицируются как со сниженной (лентогеной), средней (мезогенной) и высокой (велогенной) вирулентностью. Вакцины созданные на основе штаммов со сниженной вирулентностью провоцируют краткосрочный иммунитет, который требует ревакцинации. Вакцины на основе мезогенных штаммов вызывают прочный, долгосрочный иммунитет, но могут спровоцировать и смертельный исход, особенно у птиц без первичного иммунитета на основе вакцинных штаммов со сниженной вирулентностью. Часто может наблюдаться расширение и кровоизлияния в слепой кишке и геморрагический клоацит. Как правило, эти поражения начинаются с лимфоидной ткани слизистой оболочки. Инфекция может передаваться либо при вдыхании зараженного воздуха, либо при заглатывании вирусов и при этом зависит от наличия у вирусов инфекционных форм. Конечно, инфекционные вирусы могут присутствовать в аэрозолях. При этом птицы, находящиеся в атмосфере, содержащей такие аэрозоли, становятся инфицированными. Это является основой для применения живых вакцин, распыляемых с помощью пульверизаторов или генераторов аэрозолей. При естественном распространении инфекций в природе, большие и маленькие капли, содержащие вирусы, высвобождаются из инфицированных птиц в результате репликации в дыхательных путях. Передача вируса может происходить пылью и другими частицами, включая испражнения. Эти частицы, содержащие вирус, вдыхаются птицами или попадают на слизистые оболочки и приводят к инфицированию. Однако способность таких аэрозолей формировать или поддерживать инфекционные вирусы в течение времени, достаточного для передачи, зависит от многих факторов окружающей среды. Источником инфекции являются вирус-содержащие экскременты инфицированной птицы, которые загрязняют корма, воду и окружающую среду. Вирус, содержащийся в инкубационных яиц, приводит к смерти эмбриона. Важным фактором в переносе высоковирулентного вируса могут быть экзотические птицы и бойцовые петухи. Смертность может достичь 70−100%. Нейротропная форма заболевания клинически проявляется как атаксия, опистотонус, парез и паралич ног. Эта форма часто сопровождается респираторными симптомами. Поражения, вызываемые парамиксовирусом у голубей, полностью идентичны. На основе истории и клиникоморфологических признаков может быть поставлен предварительный диагноз, но его лабораторное подтверждение является обязательным. БН следует отличить от птичьего гриппа, птичьей холеры. Синдром снижения яйценоскости (ССЯ −76) С момента первоначального описания в 1976 году синдром снижения яйценоскости (ССЯ-76) стал основной причиной снижения производства яиц по всему миру. Ответственен за развитие этого синдрома аденовирус группы III. Вероятно, он попадает к курам с вакциной. Синдром снижения яйценоскости ССЯ-76 характеризуется тем, что здоровые птицы несут яйца с тонкой скорлупой или вообще без скорлупы. Горизонтальная передача вируса при клеточном содержании птицы происходит медленно, при напольном содержании — значительно быстрее. Первым признаком является потеря пигментации яйца, за которой быстро следует появление яиц с мягкой и деформированной скорлупой. Если отбросить дефектные яйца, то остальные оплодотворяются и инкубируются без проблем. Падение яйценоскости может быть внезапным или длительным. Как правило, она длится 4−10 недель, а производство яиц снижается примерно на 40%. Кроме неактивных яичников и атрофии яйцеводов других повреждений не обнаружено. Репликация вируса в эпителиальных клетках яйцевода приводит к тяжелым воспалительным и дистрофическим изменениям в слизистой оболочке. Появление яиц с нарушениями качества и снижение яйценоскости указывают на появление в хозяйстве вируса ССЯ 76. Диагноз подтверждается серологическими исследованиями и подтверждается после выделения и идентификации вируса. Во многих случаях в зараженных стадах не обнаруживаются специфические антитела, пока производство яиц не приблизится к уровню между 50% и пиком производства. Если вирус синдрома снижения яйценоскости появился в хозяйствах, занимающихся разведением птиц, это чаще всего проявляется в невозможности достичь целевых показателей производства, тогда как изменения в скорлупе яиц менее очевидны, хотя и присутствуют. Со времени первого описания синдрома стало очевидно, что спорадические вспышки ССЯ-76 случаются в результате того, что птицы заражаются за счет прямого или косвенного контакта с инфицированными дикими или домашними водоплавающими птицами. Этот вирус воздействует только на птиц и не имеет значения для общественного здравоохранения. Как распознать инфекционную бурсальную болезнь (Гамбора)? Инфекционная бурсальная болезнь (ИББ, Гамборо) является острой, очень заразной вирусной инфекцией кур, проявляющейся воспалением и последующей атрофией бурсы Фабрициева, различных степеней нефрозо-нефрита и иммуносупрессии. Клинически заболевание проявляется только у кур старше 3-х недель. Перья вокруг заднего прохода обычно слиплись и окрашены в белый цвет из за большого количества уратов. Период наивысшей смертности — возраст 3 — 6 недель, но может наблюдаться и до 16 недель. В возрасте до 3 недель ИББ может протекать субклинически, но приводит к подавлению иммуной системы. Кроме того могут наблюдаться диарея, анорексия, депрессия, взъерошенные перья, особенно в области головы и шеи. Естественное заражение ИББ в основном наблюдается у кур. У индеек и уток она может протекать субклинически, без иммуносупрессии. В помещениях, где один раз регистрировался ИББ, болезнь имеет тенденцию повторяться, как правило, в субклинической форме. Трупы обезвожены, часто с кровоизлияниями в грудной, бедреной и мышцах живота. Вирус ИББ принадлежит к семейству Birnaviridae РНК-содержащих вирусов. Существуют два серотипа вируса, но только серотип 1 является патогенным. Вирус очень устойчив к большинству дезинфицирующих средств. В загрязненных помещениях он может сохраняться в течение месяцев, а в воде, корме и фекалиях — несколько недель. Инкубационный период короткий, а первые симптомы появляются уже через 2−3 дня после заражения. Поражения прежде всего касаются Фабрициевой сумки, в начале, сумка увеличивается, становится отечной. Вирус ИББ имеет лимфоцидный эффект и травмируются прежде всего лимфатические фолликулы бурсы. Поражения ИББ проходят различные стадии от отдельных кровоизлияний до тяжелых геморрагических воспалений. Заболеваемость очень высокая и может достигать 100%, в то время как смертность:20 — 30%. Заболевание протекает за 5−7 дней и пик смертности наступает в середине этого периода. В некоторых случаях, сумка наполняется свернувшимся фибринозным экссудатом, который обычно имеет форму слепок по форме складок слизистой оболочки. У птиц, выживших в острой стадии заболевания, сумки постепенно атрофируются. Почки сильно страдают от тяжелых диатезов, вызванных отложением уратов. Применение живой вакцины у кур является ключевым моментом в профилактике ИББ. Вакцинируют все поголовье птицы в возрасте 10 дней. Дифференциальная диагностика и вакцинация против болезни Марека Выделение вируса. Несмотря на то, что обычные методы выделения вируса малоэффективны при постановке диагноза БМ, они ценны при исследовании эпизоотологических и других характеристик вируса. Для титрования ВБМ и связанных с ним вакцинных вирусов применяются родственные методы. Вирус болезни Марека можно выделить спустя всего лишь один или два дня после инокуляции, либо через 5 дней после контактного воздействия и в течение всей жизни кур. Предпочтительна инокуляция неповрежденных жизнеспособных клеток, так как в большинстве случаев инфекционность связана с клетками. В то же время вирус могут содержать бесклеточные препараты кожи, перхоти или кончиков перьев инфицированных кур. Вирус болезни Марека был выделен с помощью прямого культивирования почечных клеток от инфицированных кур. Для доказательства наличия вируса особенно полезно применение экспресс-метода с использованием лимфоцитных культур после реакции флюоресцирующих антител. Этот метод может также применяться для выделения вируса в том случае, если выращенные антиген-положительные культуры лимфоцитов переносятся на чувствительные однослойные культуры. Дифференциальная диагностика. Несмотря на имеющиеся методические указания, клиническая диагностика БМ на практике сталкивается с определенными трудностями. Это, вероятно, связано с тем, что патогномоничное макроскопическое поражение отсутствует, а поражения, наблюдаемые при БМ, могут быть сильно похожи на поражения при лимфоидном лейкозе (ЛЛ), распространенного до сих пор, или на поражения при ретикулоэндотелиозе (РЭ), который в последнее время широко распространился в странах Среднего Востока. Вирус ретикулоэндотелиоза (ВРЭ) широко распространен в США и может вызывать экспериментальные поражения (гипертрофия нервов и лимфомы). Они похожи на поражения БМ даже в большей степени, чем поражения, вызванные вирусом лейкоза птиц (ВЛП). МАКРОСКОПИЧЕСКАЯ ПАТОЛОГИЯ. Несмотря на то что увеличенные периферические нервы и висцеральные лимфомы обычны при развитии БМ, ни одно из поражений не проявляется в обязательном порядке и не является патогномоничным. Таким образом, при посмертной постановке диагноза БМ надо рассматривать другие критерии, например, возраст и распространение поражений. Гистологически куры положительно диагностировались на БМ на основании макроскопической патологии и возраста в том случае, если встретилось по крайней мере одно из следующих состояний: 1) лейкозная гипертрофия периферических нервов; 2) лимфоидные опухоли в различных тканях (печени, сердца, гонаде, коже, мышцах, железистом желудке) у птиц, возраст которых менее 16 недель; 3) висцеральные лимфоидные опухоли у птиц в возрасте 16 недель и старше, у которых не было неопластических образований в фабрициевой сумке; 4) обесцвечивание радужной оболочки и нарушение формы зрачка, подобные показанным на фото. Определяющими для постановки диагноза предположениями являются отсутствие опухолей фабрициевой сумки в случаях БМ у птиц старше 16 недель, устойчивое присутствие больших опухолей фабрициевой сумки в случаях лимфоидного лейкоза или других не связанных опухолей только у птиц старше 16 недель. Еще одно предположение заключается в том, что если в патологический процесс не вовлечена фабрициевая сумка, инфицирование ВРЭ только в редких случаях вызывает у разводимых коммерческим способом кур увеличение нервов или лимфомы. Несмотря на то, что эти допущения не могут быть неизменно верными, диагностические ошибки и будут нечасты, если аутопсия выполняется очень внимательно и проводится обследование сразу нескольких птиц. Обследование фабрициевой сумки особенно важно и требует разрезания органа с внимательным осмотром поверхности эпителиальной ткани. Однако, если диагноз базируется только на макроскопической патологии, он не может рассматриваться в качестве окончательного. ДИФФЕРЕНЦИАЦИЯ ОТ ДРУГИХ БОЛЕЗНЕЙ. Лимфоидный лейкоз — еще одно заболевание, которое нужно иметь в виду при проведении дифференциальной диагностики болезни Марека. Однако лимфоидный лейкоз можно в обычных случаях отличить от болезни Марека по характерному для ЛЛ вовлечению в паталогический процесс фабрициевой сумки, присутствием маркёров В-клеток, наличием геномов или антигенов вируса лейкоза птиц. Другими болезнями, макроскопические поражения или паралитические признаки которых можно спутать с БМ, являются миелобластоз, эритробластоз, карцинома яичников, другие неоплазмы, недостаточность рибофлавина, туберкулез, гистоманоз, генетический серый глаз, ньюкастлская болезнь, энцефаломиелит птиц, а также совместные инфекции или повреждения. ЛЕЧЕНИЕ. В настоящее время не существует эффективного лечения БМ в стаях или у отдельных кур. Однако у некоторых птиц, имеющих клинические признаки БМ, при определенных обстоятельствах наблюдается регресс поражений, и они выздоравливают. ПРОФИЛАКТИКА И КОНТРОЛЬ. Разработка хороших вакцин для борьбы с болезнью Марека — значительное достижение в сельском хозяйстве (т. к. до начала применения вакцин БМ была самым «дорогим» заболеванием домашних птиц) и одновременно основа в исследованиях рака (потому что это неопластическое заболевание стало первым, попытки контроля которого были сделаны у всех видов птиц). Вакцинация есть и будет центральной стратегией профилактики и контроля БМ. Однако важными дополнениями к вакцинации являются генетическая устойчивость и биологическая безопасность. ВАКЦИНАЦИЯ. Защитить кур от БМ способны вакцины на основе трех вирусных серотипов, смесях серотипов и рекомбинантные вакцины. Моновалентные вакцины созданы на основе аттенуированного вируса БМ серотипа 1 и ВГИ. Для получения эффекта синергии, которая описана для вирусов серотипов 2 и 3, обычно комбинируют натуральные вирулентные изоляты серотипа 2 с ВГИ. Помимо этого, используется много других комбинаций. Были разработаны экспериментальные вакцины, основанные на технологии рекомбинантных ДНК, но они еще не лицензированы для использования. Несмотря на то, что защитными являются все виды вакцин, чаще применяются вакцины на основе ВГИ. Это связано с их большей экономичностью с точки зрения производства, а также с тем, что выделенный из инфицированных клеток клеточно-свободный вирус может быть подвергнут лиофилизации для удобства хранения и работы с ним. Кроме того, широкое применение нашла клеточно-ассоциированная форма ВГИ, хранимая в жидком азоте. Обширность применения такой вакцины, вероятно, определяется более высокой по сравнению с вакциной на основе клеточно-свободного вируса эффективностью в присутствии полученных от матери антител. В настоящее время в распоряжении имеются клеточно-ассоциированные вакцины серотипов 1 и 2. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ЭФФЕКТИВНОСТЬ ВАКЦИН. Обычно вакцины применяются при выведении цыплят. Клеточно-ассоциированные и клеточно-свободные вакцины применяются посредством парентеральной инокуляции. Обычно доза превышает 1000 бляшкообразующих единиц (БОЕ) на цыпленка. Внутримышечный маршрут введения может оказаться немного эффективнее, однако ни одним из исследователей это преимущество не наблюдалось. Установлено, что вакцинация 18-дневных эмбрионов сокращает сроки развития защитного иммунитета на несколько дней. Исследователи предложили использовать такую методику для борьбы с негативными последствиями раннего воздействия вирулентного ВБМ. Эта процедура была автоматизирована и в настоящее время используется для вакцинации более 50% выращиваемых на коммерческой основе бройлеров в США. Вакцинация эмбрионов позволила уменьшить трудовые затраты и обеспечить точное введение вакцин. Тем не менее в полевых условиях в противоположность лабораторным данным методика не привела к значительному сокращению потерь от болезни Марека. Надо отметить, что при вакцинации степень защиты тем хуже, чем короче интервал между вакцинацией и воздействием вирулентного полевого вируса. Одной из серьезных причин появления большого количества случаев БМ в вакцинированных стаях является раннее воздействие с помощью вируса, так как для установления прочного иммунитета требуется до 7 дней, а воздействия ВБМ в полевых условиях обычно сказывается вскоре после размещения цыплят. Значительные потери от болезни Марека связаны с наличием среди несушек особей самых разных возрастов, что не дает возможности предотвратить раннее воздействие вируса. Важным фактором в формировании вакцинного иммунитета против БМ является также порода кур. Установлено, что вакцина на основе ВГИ у генетически резистентных кур обеспечивает лучший иммунитет, чем бивалентная вакцина (ВГИ + SB1) у восприимчивых кур. Для повышения эффективности вакцинации делались попытки увеличения дозы вакцин или проведение двойной вакцинации, которые имели небольшой успех или вообще не имели такового. Тем не менее, реагируя на возрастающий спрос, производители вакцин продолжали увеличивать рекомендованные дозы. Это привело к тому, что в настоящее время куры-несушки и племенные птицы получают при выведении цыплят до 10 000 БОЕ ВГИ. В Европе стала популярной двойная вакцинация. Она используется иногда и в Соединенных Штатах. Тем не менее убедительные доказательства эффективности такого подхода отсутствуют. Полагают, что поддержанию вакцинного иммунитета мешает стресс. Важным является правильное обращение с вакциной во время оттаивания и восстановления. СТРАТЕГИЯ ПРОВЕДЕНИЯ ВАКЦИНАЦИИ. Вакцины против болезни Марека очень эффективны. Чаще всего их применение в коммерческих стаях дает уровень защиты свыше 90%. Однако можно наблюдать увеличение стай, в которых имеются чрезмерные потери от БМ. С помощью ретроспективного анализа трудно объяснить причины таких «неудач вакцинирования», хотя важную роль здесь может играть раннее воздействие ВБМ и появление новых штаммов этого вируса с повышенной вирулентностью. Появление более вирулентных вирусных штаммов в совокупности с очевидным уменьшением эффективности вакцин в последние 20 лет вызвало оправданное беспокойство и одновременно интерес к этому вопросу. Сказанное дает основание предполагать, что вакцинация сама по себе не обеспечивает полное искоренение БМ и наверняка окончательно не решает пролему болезни Марека. Для успешной реализации программ вакцинации очень важно точно соблюдать процедуры биологической безопасности для снижения вероятности раннего заражения. Кроме того, существенным моментом является наличие генетической резистентности (см. следующие разделы). Генетическая резистентность. Генетически контролируемые различия в восприимчивости к БМ среди разных линий кур описаны в работе Калнека. С помощью селекции были отобраны линии кур с генетической резистентностью, которые затем поддерживались экспериментально. Резистентность к болезни Марека, по-видимому, не зависит от генетических факторов, которые определяют особенности воспроизводства. МЕТОДЫ СЕЛЕКЦИИ. Программы селекции по резистентности исторически базировались на исследованиях потомства или воспроизводстве от выживших после перенесенного заболевания особей племенных стай. Отбор, основанный на определении группы крови, предполагал тесную взаимосвязь между устойчивостью против БМ и аллелями области B-F главного комплекса гистосовместимости (ГКГ), особенно В 21, так как другие В-аллели связаны с восприимчивостью или с резистентностью, но в меньшей степени. Такой способ отбора может упростить выращивание устойчивых птиц в популяциях, содержащих специфичный аллель, отвечающий за резистентность. Но при этом необходимо проверять возможность негативной взаимосвязи с признаками продуктивности. Спенсер и коллеги установили, что генетически резистентные куры при вакцинации оказались защищены в большей степени, чем более восприимчивые особи. Именно поэтому при реализации программы борьбы с болезнью Марека получение генетической резистентности рассматривается как ценное дополнение иммунизации. Кроме того, генетическая резистентность может уменьшить потребность в бивалентной вакцине и вакцине на основе серотипа 1, используемых в настоящее время для борьбы против заражения сильно вирулентными штаммами. Однако резистентность как вакцинированных, так и невакцинированных кур может иногда изменяться . Это позволяет говорить о необходимости селекции в вакцинированных стаях. Биологическая безопасность. Основным методом борьбы с болезнью Марека является изолирование пораженных особей и санитарная обработка окружающей среды. Этот метод приносит успех и широко применяется для тех стай, в которых отсутствует специфичный патогенный микроорганизм. К тому же в большинстве случаев используется фильтрованный воздух и помещения с искусственно повышенным давлением. Для снижения риска раннего воздействия ВБМ применяются методы строгой биологической безопасности, которые непрактичны при использовании в качестве основных приемов. Они являются важным и экономически эффективным дополнением к вакцинации. К сожалению, современные приемы содержания и разведения домашней птицы допускают совместное размещение особей различных возрастов рядом друг с другом и повторное использование подстилки от предыдущих бройлерных стай. Невозможность предотвращения раннего заражения, возможно, является одной из самых важных причин неудач вакцинации. При предотвращении потерь от БМ в вакцинированных стаях ключевую роль играет гигиена. Кроме того, усилия, приложенные в этом направлении, являются экономически эффективными. Как распознать болезнь Марека? Болезнь Марека (БМ) является самым распространенным лимфопролиферативным заболеванием кур. Поэтому в двух последующих статьях будут изложены история болезни, основные признаки заболевания, диагностика и существующие методы лечения и профилактики. Причиной болезни Марека является герпесвирус. Болезнь контагиозна. Она отличается по этиологии от других лимфоидных опухолей птиц. Раньше существовала определенная путаница с терминологией. Воспалительный характер некоторых поражений периферических нервов был определен названием полиневрит. Впоследствии стали применять синонимы этого названия, такие как неврит, нейролимфоматоз птиц и птичий паралич. Инфильтрация одноядерных клеток в радужной оболочке вызывает различные изменения, от депигментации до помутнения. На этой основе появилось много терминов, таких как слепота, серый глаз, ирит, увеит и глазной лимфоматоз. Лейкозные поражения внутренних органов и мышц часто называют просто висцеральным лимфоматозом, а поражения кожных покровов — кожным лейкозом. Термин болезнь Марека используется с 1961 года, чтобы провести четкое различие между этим состоянием и другими этиологически отличными лимфопролиферативными заболеваниями. До начала использования вакцин болезнь Марека представляла серьезную угрозу для промышленного птицеводства из-за больших ежегодных потерь. Однако вакцины не смогли обеспечить 100-процентную защиту. Поэтому потери продолжаются, но они перестали быть серьезной проблемой. Подсчитано, что в 1984 году в США потери от смертности и выбраковки из-за болезни Марека составили около $12 млн. Однако, если приплюсовать к этой цифре расходы на вакцину и потери от снижения производства яиц, общая сумма потерь составила бы $169 млн в США и $943 млн в других странах мира.Всесторонний анализ литературы, связанной с болезнью Марека и моментами, касающимися здоровья человека, подтверждают выводы об отсутствии этиологической взаимосвязи между вирусом, вызывающим болезнь Марека (ВБМ), или любым из вирусов вакцин против БМ и раком человека. ИСТОРИЯ. Появившееся в 1907 году сообщение венгерского ветеринарного патолога Марека о парезе у петухов вследствие инфильтрации одноядерных клеток в периферических нервах и корешках спинных нервов стало вероятно первым отчетом об этом заболевании. Вспышки так называемой острой формы болезни Марека с очень высоким уровнем смертности и наличием преимущественно висцеральных лимфом наблюдались по крайней мере с 1949 года. С 1960 по 1970 годы область распространения болезни увеличивалась. В 1967 году почти одновременно, но независимо друг от друга, британские и американские исследователи открыли этиологическтй агент БМ. Им оказался герпесвирус. Этот результат был получен при успешном размножении в клеточных культурах. Возможно, наиболее важным практическим аспектом работы оказалась аттенуация вируса и его успешное применение в качестве вакцины против болезни Марека. Несмотря на то, что впоследствии эта вакцина была заменена другими вакцинами, она оказалась первой эффективной вакциной против рака у самых разных видов. Это было одним из самых важных шагов в ветеринарной науке. ЗАБОЛЕВАЕМОСТЬ И РАСПРОСТРАНЕНИЕ. Болезнь Марека распространена во всех странах, где существует промышленное птицеводство. Вполне вероятно, что любая стая кур в областях с преобладанием птицеводства несет определенные потери из-за болезни Марека. Имеется несколько сообщений, на основании которых можно предположить существование в некоторых местах исключительно вирулентных штаммов вируса болезни Марека. В стаях бройлеров присутствует сезонность заболевания. В зимние месяцы потери выше, чем в летние. Есть предположение, что это связано со снижением циркуляции воздуха. ЭТИОЛОГИЯ. Вирус, вызывающий болезнь Марека — это герпесвирус, связанный с клеткам. Его лимфотропные свойства подобны свойствам гамма-герпесвирусов. А вот молекулярная структура и геномная организация такие же, как у альфа-герпесвирусов. Вирус болезни Марека является прототипным вирусом группы ВБМ и обозначается как серотип 1. Неонкогенные штаммы кур обозначаются как ВБМ серотипа 2. А герпесвирусы индеек, названные ВГИ на основе ранее принятой терминологии, обозначаются как вирусы серотипа 3. Если не оговорено иным образом, под термином ВБМ понимаются вирусы серотипа 1. ПАТОГЕНЕЗ И ЭПИЗООТОЛОГИЯ. Безусловно, куры являются самыми важными природными носителями для БМ. У других видов эта болезнь встречается очень редко и не имеет такой значимости. Возможным исключением является обыкновенный перепел. Для воспроизводства БМ у перепелов и кур применялись вирусы болезни Марека, выделенные от кур или японского перепела. Однако ВБМ, полученный от перепела, вероятно, имеет большую патогенность для перепелов, чем выделенный от кур. Кроме того, патогенез инфекции немного различался, а вакцина против БМ на основе герпесвируса индеек не защищала перепелов против воздействия ВБМ. Поуэл и Ренни установили, что гибриды, полученные от скрещивания кур и перепелов, чувствительны к БМ. Для некоторых родов отряда Galliformes (курообразные) (особенно Gallus), в том числе джунглевой курицы и цейлонской джунглевой курицы, имеется вирусологическое или серологическое свидетельство инфицирования ВБМ. Однако у нескольких других видов птиц поражения, относящиеся к БМ, не подтверждаются этиологической взаимосвязью. Есть сообщения об экспериментальном заражении БМ фазанов. При этом попугаи оказались невосприимчивыми к инфекции, а утки инфицировались, но после инокуляции ВБМ болезнь у них не развилась. Многие виды млекопитающих, в том числе хомяки, крысы, игрункообразные и обезьяны (макаки-резус, индийский макак и другие), оказались невосприимчивыми к инфицированию вирулентным ВБМ. Передача. Распространение вируса происходит при прямом или непрямом контакте между птицами. Очевидно, это происходит воздушно-капельным путем. Зараженная пыль птичников остается инфекционной в течение, по крайней мере, нескольких месяцев при температуре 20−25 °С и в течение нескольких лет при температуре 4 °С. Многие здоровые на вид птицы являются носителями, способными передавать инфекцию. Инфекция сохраняется, вероятно, неограниченно долго. Постоянное распространение инфицированными птицами и стойкость вируса объясняют широкую распространенность инфекции. Вертикальная передача ВБМ отсутствует. Кроме того, передача вируса от матери потомству в результате наружного заражения яиц также маловероятна из-за плохой выживаемости вируса при температуре и влажности выведения цыплят. Инкубационный период. Цыплята, зараженные в однодневном возрасте, начинают выделять вирус приблизительно через две недели после инокуляции. При этом максимум распространения приходится на период между третьей и пятой неделями. В случае цито-литических инфекций на 3−5 день после инокуляции развиваются дегенеративные поражения лимфоидных органов между 6 и 8 днем после заражения. Спустя приблизительно 2 недели после инокуляции в нервных тканях и других органах можно обнаружить инфильтрации одноядерных клеток. Однако клинические признаки и макроскопические поражения не появляются, как правило, ранее 3−4 недель. Представленные выше цифры характеризуют наиболее короткий инкубационный период. На практике указанные значения могут значительно отличаться. К факторам, оказывающим влияние на уровень заболеваемости и инкубационный период, относятся штамм вируса, доза, состояние полученного от матери антитела, маршрут инфицирования, а также возраст, генетическая наследственность и пол носителя. Полагают, что появление опухолей на 10−14 день после инокуляции является реакцией на трансплантацию, хотя смерть от «синдрома ранней смертности» может наступить ранее 8−12 дня после заражения. А вот в полевых условиях инкубационный период определить гораздо сложнее. В то время как вспышки заболевания иногда случаются у птиц ранее 3−4-недельного возраста, самые серьезные случаи встречаются с возраста восемь или девять недель. При этом обычно отсутствует возможность определить время и условия заражения. Пешее отмечает, что клинические признаки в яйценосной стае часто проявляются лишь спустя 16−20 недель, а иногда через 24−30 недель. Николе в своей работе описывает одну вспышку БМ, признаки которой проявились лишь через 60 недель. Случающийся иногда у птиц при этой болезни временный паралич наступает примерно на 6−10 неделе. Симптомы. В целом симптомы связаны с асимметричным прогрессирующим парезом, переходящим в полный паралич конечностей. В зависимости от того, подвергаются поражению один или несколько нервов, симптомы болезни могут проявиться у разных птиц по-разному. Патологический процесс в крыльях приводит к тому, что они повисают. Если поражаются нервы, контролирующие шейные мышцы, у птицы наблюдается опущенная голова и искривление шеи. При поражении блуждающего нерва возможен паралич с расширением зоба и/или затрудненностью дыхания. Первым признаком заболевания может быть беспорядочное перемещение или неестественная походка. Характерным для птицы является положение, при котором одна лапа вытянута вперед, а другая — назад. Это связано с односторонним парезом или параличом конечности. При острых вспышках БМ синдром имеет в большей степени взрывной характер и характеризуется изначально большой долей птиц с сильной депрессией. Через несколько дней у некоторых птиц развивается атаксия с последующим одно или двусторонним параличом конечностей. Некоторые птицы умирают, так и не проявив обширного клинического заболевания. У многих происходит обезвоживание и истощение организма вплоть до коматозного состояния. При развитии патологии в радужной оболочке глаза возможна слепота. Глаз теряет способность адаптироваться к интенсивности света. При этом с помощью клинического обследования обнаруживаются изменения, начиная от концентрической кольцеобразной или пятнистой депигментации или побледнения до рассеянного помутнения радужной оболочки (фото). Вначале зрачок приобретает неправильную форму, а затем от него остается лишь небольшое отверстие. Могут наблюдаться также необязательно встречающиеся признаки, например, потеря веса, бледность, отсутствие аппетита и диарея. Смерть зачастую является следствием голодания и обезвоживания птиц, неспособных добраться до корма и воды. При этом часто таких птиц затаптывают сородичи. Заболеваемость и смертность. Лишь небольшое количество птиц, у которых проявились признаки болезни, избегают клинического заболевания. Как правило, уровень смертности очень близок к уровню заболеваемости. До начала применения вакцин потери в пораженных болезнью Марека стадах составляли от нескольких особей до 25−30% птиц. Иногда эта цифра доходила до 60%. В настоящее время от 95 до 100% кур, несущих яйца, прививаются против БМ, что помогло снизить потери в большинстве стран до уровня менее 5%. Стаи бройлеров, вакцинированных в большинстве стран, могут терять от 0,1 до 0,5%, а отбраковка может составлять 0,2% и более. В то же время в США средний уровень отбраковки в 1994 году составил менее 0,04%. После появления болезни смертность постепенно возрастает и, как правило, сохраняется в течение 4−10 недель. На уровень потерь в пораженных стаях оказывает влияние ряд факторов, связанных с инфекционным агентом или носителем. Это штамм вируса, доза и маршрут воздействия. В естественных условиях фактором, влияющим на ход болезни, может оказаться доза. Факторы, связанные с носителем, включают в себя пол, пассивное антитело, генетическую конституцию и возраст. На уровень заболеваемости БМ оказывают влияние условия окружающей среды, сопутствующие инфекции и другие факторы, такие как сильный стресс. Лимфоматозные поражения можно обнаружить в половых железах (особенно яичнике), легких, сердце, брыжейке, почках, печени, селезенке, сумке Фабрициуса, тимусе, надпочечниках, поджелудочной железе, железистом желудке, кишечнике, радужной оболочке глаз, скелетных мышцах и кожных покровах. Вероятно, нет места, которое не могло бы оказаться вовлеченным в патологический процесс. При поражении легких происходит отвердение (фото). Диффузная инфильтрация печени приводит к потере нормальной формы долей и часто придает поверхности грубый зернистый вид. В печени также могут наблюдаться узелковые опухоли. Наблюдаемые в непродуктивном яичнике поражения выглядят как небольшие или средних размеров серые полупрозрачные области. При развитии крупных опухолей яичник теряет свой нормальный листообразный вид. Однако зрелые яичники могут сохранять свою функцию даже при опухании некоторых фолликул. На вовлечение яичников в патологический процесс указывает похожий на цветную капусту вид этого органа. Железистый желудок утолщается и твердеет. Это происходит из-за появления лейкозных областей. Эти области можно наблюдать сквозь поверхность серозной оболочки или на срезе. Пораженное сердце бледнеет от диффузной инфильтрации. Кроме того, могут наблюдаться одиночные или множественные узелковые опухоли в миокарде, или точечные очаги в эпикарде. Кожные поражения обычно связаны с перьевыми фолликулами и могут срастаться. Заметные беловатые узелки (фото), могут приобрести вид струпьев. Чаще всего поражения встречаются в грудных мышцах. Размеры изменений могут варьироваться от небольших беловатых полосок до узелковых опухолей. Пораженные области приобретают матовый беловато-серый или желтооранжевый цвет (что вероятно связано с некрозом). ПОДАВЛЕНИЕ ИММУНИТЕТА. Болезнь Марека может приводить к подавлению как гуморального, так и клеточноопосредованного иммунитета. При этом происходит снижение реакции антител на различные антигены, а также изменение функций Т-клеток. Инфекция, вызванная вирусом болезни Марека, может увеличит, восприимчивость к первичному и вторичному инфицированию кокцидиями. Чем опасен инфекционный бронхит и меры его предупреждения Инфекционный бронхит (ИБ) является острым инфекционным заболеванием кур. Он характеризуется трахеальными хрипами, кашлем и чиханием. Кроме того, при этом заболевании могут поражаться почки, поэтому куры хуже несутся, а качество яиц ухудшается. Попадание этой инфекции в легкие или почки маленьких цыплят может привести к смертельному исходу. Экономическая значимость и опасность для человека. Это заболевание оказывает определенное экономическое действие, так как вызывает плохое усвоение корма и, как следствие, замедление набора веса у бройлеров, а также уменьшение количества и качества яиц у несушек. Экономические потери от этого обычно значительно выше, чем от смертности. Высокая инфекционность болезни и множественность серотипов инфекционного бронхита значительно усложняют и удорожают попытки предотвратить это заболевание посредством иммунизации. Для человека инфекционный бронхит не заразен. Инфекционный бронхит распространен по всему миру. Классификация. Вирус инфекционного бронхита относится к семейству Coronaviridae, которое включает в себя два рода: коронавирус и торовирус. ПАТОГЕНЕЗ И ЭПИЗООТОЛОГИЯ Cчитается, что только куры заражаются вирусом инфекционного бронхита естественным образом и только у них этот вирус вызывает заболевание. Тем не менее вирус был выделен у фазанов, у которых наблюдались признаки респираторных расстройств и связанное с этим снижение яйценоскости и качества яиц. У молодых птиц имелись значительные респираторные расстройства. Источником вируса, возможно, были находящиеся поблизости хозяйства, разводящие кур. Экспериментальная аэрозольная инокуляция индеек вирусом инфекционного бронхита не вызвала у них никакой реакции. Но при внутривенной инокуляции наблюдалась виремия, длящаяся до 48 часов. Обыкновенный фазан и скворцы оказались невосприимчивы к вирусу инфекционного бронхита, инокулированному внутрь трахеи. У перепела, инокулированного аналогичным образом, были слышны бронхиальные хрипы, но вирус не выделен. Коронавирусы, как правило, вызывают клиническое заболевание только у тех видов, у которых они выделены. Кроме того, вирусы инфекционного бронхита развиваются преимущественно в культурах, полученных от этих носителей. ВОЗРАСТ НОСИТЕЛЕЙ, ПРИ КОТОРОМ ОНИ ОБЫЧНО ПОРАЖАЮТСЯ БОЛЕЗНЬЮ. Восприимчивость к заболеванию во всех возрастных группах примерно одинакова, но тяжелее всего болезнь протекает у только что вылупившихся птенцов. В некоторых случаях она даже приводит к смерти. По мере взросления растет сопротивляемость птенцов нефрогенному воздействию, поражению яйцевода и к смерти. Передача и носители. Вирус инфекционного бронхита активно распространяется в скоплениях кур. У восприимчивых птиц, находящихся в одном помещении с инфицированными курами, симптомы болезни обычно развиваются в течение 48 часов. У кур, которые являлись вирусонегативными в течение нескольких недель после выздоровления от болезни, вызванной инокуляцией в однодневном возрасте, отмечалось также повторное выделение вируса. Природа живучести инфекции, вызванной ВИБ, пока неизвестна. Имеющиеся данные дают основание предположить, что существует риск передачи инфекции между стаями кур через загрязненный персонал или оборудование. Характер распространения вируса инфекционного бронхита воздушным путем неизвестен, но есть косвенные данные о том, что ВИБ может переноситься на расстояние до 1100 метров). При этом переносчики не являются фактором распространения вируса. Инкубационный период. Инкубационный период инфекционного бронхита составляет 18−36 часов, в зависимости от дозы и пути заражения. У цыплят, регулярно подвергающихся действию неразбавленной инфекционной жидкости из яиц, через 24 часа появляются хрипы в трахее. Естественное распространение требует длительности инкубационного периода от 36 часов и более. Симптомы. Характерными респираторными симптомами при инфекционном бронхите являются затрудненное дыхание, кашель, чихание, трахеальные хрипы и выделения. Могут наблюдаться мокрые глаза, а у цыплят иногда — опухшие пазухи. При этом цыплята вялые, стараются прижаться к источнику тепла, мало едят и сильно отстают в наборе веса. У цыплят, возраст которых превышает шесть недель, а также у взрослых птиц симптомы сходны с теми, что наблюдаются у маленьких цыплят. Но при этом у них реже встречаются носовые выделения, а болезнь может пройти незамеченной, если только куры не тщательно проверяются обслуживающим персоналом или к ним не прислушиваются ночью, когда птицы обычно спокойны. Бройлерные куры, инфицированные одним из нефропатогенных вирусов, могут казаться выздоровевшими после обычной респираторной фазы, а затем демонстрировать симптомы подавленности, иметь взъерошенные перья, жидкий помет и повышенное потребление воды. Если мочекаменная болезнь кур-несушек связана с инфекционным бронхитом, может наблюдаться повышенный уровень смертности. В противном случае куры выглядят здоровыми. Одновременно с респираторными симптомами у кур снижается количество и качество снесенных яиц. Степень снижения яйценоскости у кур-несушек меняется в зависимости от периода несения яиц и вида вызвавшего это снижение штамма ВИБ. До того как производство яиц достигнет прединфекционного уровня, может пройти от шести до восьми недель. В дополнение к снижению яйценоскости при инфицировании ВИБ происходит увеличение количества яиц, непригодных для высиживания, уменьшается количество вылупившихся цыплят, а сами яйца имеют мягкую, деформированную и шершавую скорлупу (фото). Внутреннее качество яиц, разбитых для обследования на ровной поверхности, может быть плохим. Слой белка — тонким и водянистым без четкого разграничения между густым и более жидким белком, как у обычного свежего яйца (фото). Заражение однодневного цыпленка вирусом инфекционного бронхита может вызвать стойкое поражение, приводящее к снижению яйценоскости и ухудшению качества яиц у взрослых кур. При инфицировании более взрослых кур степень поражения яйцевода была меньше. В то же время некоторые серотипы вообще не вызывали никаких патологических изменений даже при инфицировании однодневных цыплят. Заболеваемость и смертность. Все птицы в стаях инфицируются, но уровень смертности при этом различен и зависит от следующих факторов: вирулентности инфицирующего серотипа; состояния иммунитета (пассивный он или активный); а также стрессов, таких как холод или вторичные бактериальные инфекции. Умеренный уровень смертности отмечен при инфицировании некоторыми респираторными и нефропатогенными штаммами ВИБ, такими как Delaware 072 и австралийским штаммом Т, соответственно. Дополнительными факторами, влияющими на тяжесть поражения почек, являются пол, порода и корм. У цыплят в возрасте до шести недель смертность может достигать 25% и более. У взрослых цыплят она, как правило, незначительна. Смертность при мочекаменной болезни колеблется в пределах от 0.5 до 1% в неделю. Макроскопические поражения. У кур, инфицированных вирусом инфекционного бронхита, присутствует серозный, катаральный или казеозный экссудат в трахее, носовых проходах и пазухах. Воздушные мешочки затемняются или могут содержать желтый творожистый экссудат. В нижней части трахеи или бронхах умерших цыплят можно обнаружить казеозные пробки. В области главных бронхов возможны небольшие зоны пневмонии. Под действием нефропатичных инфекций почки опухают и бледнеют, а канальца и мочеточники часто наполняются уратами. В грудобрюшной полости несущихся кур можно обнаружить жидкий желточный материал, что также возможно и при других заболеваниях, снижающих яйценоскость. Поражения яйцевода также, могут быть следствием заражения однодневных цыплят вирусом инфекционного бронхита. При этом наиболее серьезные поражения наблюдаются в средней части яйцевода, но они могут быть не явными. Иммунитет Генетическая резистентность к вирусу инфекционного бронхита зависит как от породы кур, так и от штамма вируса. Респираторная защита обычно оценивается через 3−4 недели после заражения вирусом инфекционного бронхита или после вакцинации. Делается это по нескольким различным направлениям. В большинстве случаев контрольное заражение вирусом инфекционного бронхита выполняется через дыхательные пути. Единственным критерием установившегося иммунитета может оказаться невозможность выделения ВИБ из трахеи спустя 4−5 дней после контрольного заражения. Обобщенная оценка на основе различных критериев дает определение степени защиты от полной до частичной или полном ее отсутствии. Альтернативным подходом является оценка вакцинированных кур по защите их от летального исхода при контрольном заражении смесью вируса инфекционного бронхита и Е. coli. Этот метод показывает, что перекрестная защита при вакцинации сильнее, чем обнаруженная при оценке трахеального иммунитета. Вакцинация однодневных цыплят с материнским иммунитетом обычно выполняется без видимого вмешательства материнских антител в развитие активного иммунитета, по крайней мере, в дыхательных путях. Материнские антитела обеспечивают защиту при контрольном заражении в однодневном и недельном, но не двухнедельном возрасте. ДИАГНОСТИКА. Диагностика ВИБ основывается на клинической истории болезни, видах поражений, сероконверсии или росте титров антител ВИБ, определении антигена ВИБ с помощью тестов на основе антител (описаны ниже), выделения вируса, а с недавних пор и на основе определения РНК-вируса инфекционного бронхита. По возможности необходимо определять серотип ВИБ. Это связано с большим количеством антигенных изменений, представленных вирусом инфекционного бронхита и наличием вакцин, созданных для различных серотипов. Для этой же цели можно применять последовательность генов в белках шипов, т.е. серотип. ВЫДЕЛЕНИЕ ВИРУСА. Предпочтительным местом забора образцов является трахея, как главная область действия ВИБ. Однако в тех случаях, когда с начала инфекции прошло больше одной недели, при патологоанатомических исследованиях особенно ценными могут оказаться образцы лимфоидной ткани слепой кишки. Объясняется это тем, что вирус обычно быстрее выводится из трахеи, чем из тканей кишечника. В зависимости от клинической истории болезни также должны учитываться образцы из легких, почек и яйцевода. Проблемой может оказаться забор образцов из больших хозяйств. Если взятие образцов прямыми методами не приносит нужных результатов, в хозяйства подсаживают чувствительных кур-часовых. Их забирают через одну неделю для непосредственного получения образцов. Образцы для выделения вируса инокулируют в оплодотворенные куриные яйца или трахеальные органные культуры. Жидкость от каждой культуры должна собираться через 48−72 часа для слепого пассажа в другой набор культур. %D Что такое птичий грипп и насколько он опасен для человека? Грипп — это заболевание, вызываемое любым вирусом гриппа типа А, членом семейства Orthomyxoviridae. Вирусы гриппа А несут ответственность за серьезные проблемы у птиц, а также у человека и низших млекопитающих. От домашних животных и диких видов птиц по всему миру были выделены тысячи вирусов, принадлежащих самым разным антигенным серотипам, классифицируемым по поверхностным антигенам, гемаглютинине (ГА) и нейраминидазе (НА). Инфекции среди домашних птиц или птиц, содержащихся в клетках, были связаны с множеством синдромов, от субклинического или легкого заболевания верхних дыхательных путей до полного прекращения производства яиц и острой генерализованной болезни с летальным исходом. У домашних видов птиц вирусы гриппа приводят к значительным экономическим потерям. Экономические потери не ограничиваются только курами. Эта проблема в течение нескольких сот лет в различных странах Европы, в Соединенных Штатах Америки и Израиле коснулась и производителей индеек. В большинстве случаев невозможно предсказать масштаб потерь при вспышках гриппа, так как это требует учета многих факторов. К ним относятся изменения биологических характеристик вируса, сопутствующая инфекция, стрессовые факторы окружающей среды, возраст и пол птиц и так далее. В результате уровень заболеваемости и смертности колеблется от 0 до 100%. Любая оценка экономического воздействия должна учитывать все факторы, которые оказывают влияние на себестоимость производства, например, лечение, дополнительный корм, дополнительный уход, карантин, вакцины, пониженное качество тушек, чистку и санитарную обработку, а также потери местной и международной торговли. В отличие от домашних и птиц, содержащихся в неволе, свободные птицы обычно не испытывают значительных проблем от болезни, вызванной вирусами гриппа, хотя эти инфекции распространены у многих из пернатых. Вирусы гриппа можно легко выделить в любом уголке Земли от мигрирующих водоплавающих птиц, особенно уток. Существует предположение о значительной эпизоотологической значимости этого огромного резервуара вирусов в мире птиц. Он может служить источником вирусов как для человека, так и для низших млекопитающих и птиц. К тому же высокий уровень инфицирования позволяет поддерживать и производить новые и потенциально более патогенные штаммы путем мутации и / или генетической рекомбинации. В выживании вирусов гриппа птиц важную роль может играть их генетическое разнообразие в резервуарах живой природы. ИСТОРИЯ. Чума птиц, которая, как стало известно позже, вызывается сильно патогенными штаммами вирусов гриппа птиц, была описана Перрончито как серьезная болезнь кур в Италии в 1878 году. Однако лишь в 1955 году было доказано, что вирусы чумы птиц — это фактически вирусы гриппа типа А. Вирусы, связанные с исходными изолятами «чумы птиц» (поверхностные антигены H7N1 и H7N7) вызывали высокую смертность среди кур, индеек и других видов. ЗАБОЛЕВАЕМОСТЬ И РАСПРОСТРАНЕНИЕ. Вирусы гриппа птиц распространены по всему миру среди многих домашних птиц, включая индеек, цесарок, кекликов, перепелок, фазанов, гусей и уток, а также среди диких птиц, в том числе у гусей, уток, песочников, песчанок, обыкновенных камнешарок, крачек, лебедей, буревестников, цапель, чистиков, тупиков и чаек. На распространение вируса гриппа птиц влияет его наличие как среди домашних, так и среди диких видов птиц, район расположения птицеводческого хозяйства, маршруты миграции, сезон и системы отчетности о болезни. Наблюдение за перелетными водоплавающими птицами в Северной Америке показало, что в местах скопления перед началом миграции могут оказаться инфицированными до 60% молодых птиц. После начала миграции степень выделения вируса резко падает. Кроме того, было доказано, что утки выделяют вирус до 30 дней. Это значит, что для сохранения вирусов требуется несколько циклов передачи. В популяции диких уток вирусы, возможно, держатся переходами к чувствительным птицам, даже на низком уровне, в течение всего года, до тех пор, пока следующий период размножения не приведет к появлению новой группы чувствительных молодых птиц. Передача вируса может легко происходить за счет выделения большого количества вирусов в помете, приводящей к заражению воды в озерах или прудах. ЭТИОЛОГИЯ Классификация. Вирусы гриппа птиц вместе с другими вирусами гриппа составляют семейство Orthomyxoviridae и представляют собой вирусы со средними по размеру плеоморфными РНК. Существует три типа вирусов гриппа, различающихся антигенностью: А, В и С. Специфичность типа определяется антигенной природой антигенов нуклеопротеина (НП) и матрикса (М), которые тесно связаны у всех вирусов гриппа А. Типы В и С обычно встречаются только у млекопитающих. Вирусы гриппа А встречаются у человека, свиней, лошадей, иногда у других млекопитающих, таких как норки, тюлени и киты, а также у многих видов птиц. КЛАССИФИКАЦИЯ по ПАТОГЕННОСТИ. Термин чума птиц часто использовался для обозначения клинической болезни или вируса, ставшего причиной высокой смертности. Стало ясно, что определение чумы птиц по антигенным характеристикам (присутствии Н7) непригодно потому что от птиц выделяли вирусы сходной, если не одинаковой антигенности, и они были авирулентными. Поэтому родилась необходимость разработки единой терминологии для высокопатогенных вирусов гриппа птиц, особенно чумы птиц. К сожалению, большинство методов контроля чумы птиц были ориентированы на наличие поверхностного антигена Н7. Новые рекомендации по определению высокой патогенности вируса гриппа звучат следующим образом. 1. Любой вирус гриппа, приводящий к гибели шести, семи и восьми из восьми 4−6-недельных чувствительных кур в течение 10 дней после внутривенной инокуляции 0.2 мл разбавленной 1:10 безбактериальной, инфекционной аллантоисной жидкости. 2.Любой вирус Н5 или Н7, не отвечающий критерию в пункте 1, но имеющий аминокислотную последовательность по месту расщепления гемагглютинина, которая совместима с высокопатогенными вирусами гриппа птиц. 3. Любой вирус гриппа, который не принадлежит к подтипу Н5 или Н7, но вызывающий гибель одной из пяти кур и растущий в клеточной культуре в отсутствие трипсина. ПАТОГЕНЕЗ И ЭПИЗООТОЛОГИЯ Вирусы гриппа А, теснее всего связанные в антигенном и генетическом отношении с вирусами птиц, были выделены в США при двух вспышках болезни у обыкновенных тюленей (Phoca vitulina). Вирусы H1N1 обычно обнаруживают у свиней. Однако в последнее десятилетие они также были выявлены у индеек. При проведении антигенных и генетических сравнительных исследований было установлено, что вирусы индеек очень тесно связаны с вирусами, постоянно циркулирующими у свиней, следовательно, они произошли от свиней. Было выдвинуто предположение, что вирусы от свиней были внесены при прямом или косвенном контакте со свиньями или человеком, инфицированными этими вирусами. Вирусы гриппа ответственны также за вспышки болезни у норок. Экспериментально вирусами гриппа птичьего происхождения можно инфицировать свиней, африканских хорьков, кошек, норку, обезьян и человека. Передача и носители. Инфицированные птицы выделяют вирус из верхних дыхательных путей, конъюнктивы и помета. Таким образом, вероятная модель передачи вируса включает как прямой, так и косвенный контакт между инфицированными и чувствительными птицами. Непрямой контакт включает аэрозольное (капельное) заражение или инфицирование через зараженные вирусом предметы. Так как птицы могут выделять в помете большое количество вирусов, распространение легко осуществляется практически всем, что заражено фекальным материалом, например, птицами и млекопитающими, кормом, водой, оборудованием, клетками, одеждой, транспортными средствами и насекомыми. Следовательно, вирусы легко доставляются в другие места людьми и оборудованием, занятыми в производстве, перевозимыми или продаваемыми живыми птицами. Симптомы. Симптомы болезни чрезвычайно разнообразны и зависят от вида птицы, возраста, пола, сопутствующих инфекций, вируса, факторов окружающей среды и так далее. Симптомы могут отражать нарушения в органах дыхания, кишечном, репродуктивном тракте или нервной системе. Наиболее распространенными симптомами являются резко выраженная депрессия и пониженная активность, пониженное потребление корма и истощение, повышенный инстинкт насиживания у куриц и пониженное производство яиц, респираторные признаки от слабых до тяжелых (кашель, чиханье, хрипы и чрезмерное слезотечение), взъерошенные перья, отек на головной и лицевой областях, цианоз неоперенной части кожи, нервные расстройства и диарея. Любой из этих признаков может встречаться отдельно или в различных комбинациях. В некоторых случаях болезнь прогрессирует очень быстро, и птиц находят мертвыми без каких-либо предварительных симптомов. При проведении экспериментов некоторые вирусы вызывают тяжелую болезнь у одного вида птиц и неочевидные инфекции у других. Подобно этому, те вирусы, которые являются антигенноидентичными, могут довольно сильно различаться биологическими характеристиками. Недавно у индеек и уток в Ирландии наблюдалась инфекция, вызванная вирусами H5N8, во время которой у индеек проблемы были значительными, а у уток — ни одной. При действии вируса гриппа наблюдалась массовая гибель обыкновенных крачек без каких бы то ни было признаков болезни. Заболеваемость и смертность. Уровни заболеваемости и смертности также многообразны, как и симптомы. Они зависят от видов птицы и вируса, возраста, внешних условий и сопутствующих инфекций. Чаще всего наблюдается высокая заболеваемость и низкая смертность. Уровни заболеваемости обычно определяются плохо. Это связано в основном с тем, что болезнь охватывает стаи очень больших размеров и с тем, что при многих вспышках признаки болезни выявляются плохо. С другой стороны, в случае высокопатогенных вирусов заболеваемость и смертность могут достигать 100%. Макроскопические поражения. В случае высокопатогенных вирусов заметные поражения могут отсутствовать. Это связано с тем, что при инфицировании такими вирусами птицы погибают очень быстро, до того, как смогут появиться макроскопические поражения. Однако при поражении высокопатогенными вирусами наблюдается множество застойных, геморрагических, транссудативных изменений (фото). При воздействии этих вирусов начальные изменения могут включать отек головы с опуханием синусов, а также синюшные, наполненные кровью и геморрагические сережки и гребень. Застой и кровотечение могут также наблюдаться на ногах. При прогрессировании болезни внутренние поражения могут быть очень значительными. В печени, селезенке, почках и легких кур, экспериментально зараженных вирусом чумы птиц, могут также наблюдаться некротические очаги. Не все патогенны е штаммы вызывают одни и те же макроскоп ические поражения. Причина различий между этими вирусами остается неизвестной. При обследовании птиц на макроскопические поражения важно, что в инфекцию, вызванную вирусом гриппа, могут вовлекаться бактерии, поэтому поражения могут отражать действие как вирусов, так и бактерий. ДИАГНОСТИКА. Постановка диагноза инфекции, вызванной вирусом гриппа А, окончательно подтверждается выделением и идентификацией вируса. Однако в качестве непрямого диагностического средства очень полезным является определение антител на вирус. Вследствие того, что клинические признаки могут меняться очень сильно, клинический диагноз рассматривается в качестве предположительного, за исключением случаев постановки диагноза при эпизоотии. Выделение и идентификация возбудителя заболевания. Обычно вирусы выделяют из трахеи и / или клоаки живых или мертвых птиц. Это связано с тем, что вирусы, как правило, размножаются в верхних дыхательных путях и / или кишечном тракте. Для выделения вируса подходят ткани, секреты или выделения из этих зон. В случае системных инфекций, вызванных высокопатогенными вирусами, фактически каждый орган может быть местом выделения возбудителя заболевания из-за высоких уровней вирусемии. Если образцы для выделения вируса есть возможность исследовать в течение 48 часов после сбора, они хранятся при температуре 4 °С. Однако в том случае, если Образцы будут обследоваться не сразу, рекомендуется хранить их при температуре −70 °С. Замораживание до −20 °С обычно не рекомендуется, но подходит хранение в жидком азоте или с использованием сухого льда. Перед обработкой тканей можно приготовить их в виде 10-процентной суспензии в транспортной среде и очистить с помощью низкоскоростного центрифугирования. Методы выделения и идентификации вирусов гриппа описаны подробно в работах. Чаще всего для выделения вируса используются куриные яйца с эмбрионами, так как в них вирусы гриппа растут очень хорошо. Куриные 10−11-дневные эмбрионы инокулируются через аллантоисную полость, для чего применяется приблизительно 0,1−0,2 мл образца. Чтобы увеличить вероятность роста вируса на одном и том же яйце, могут использоваться одновременно аллантоисный и амниотический маршруты заражения. Гибель эмбрионов в течение 24 часов после инокулирования обычно вызывается бактериальным заражением, поэтому от таких яиц надо избавляться. Небольшое количество вирусов может быстро вырасти и убить эмбрионы к 48 часу. Однако в большинстве случаев эмбрионы не погибают. Спустя 48 часов или после гибели эмбрионов надо удалить яйца из инкубатора, охладить и собрать аллантоисную жидкость. Репликация вируса доказывается проявлением гемагглютинирующей активности куриных эритроцитов в аллантоисной жидкости. Обычно в том случае, если в образцах присутствует вирус, при первом пассаже будет отмечен значительный рост, приводящий к гемаглютинации. Если гемагглютинирующая активность отсутствует, образец из собранной из яиц жидкости можно ввести в яйца (второй пассаж) и повторить описанную процедуру. Однако повторный пассаж утомителен, к тому же повышается риск заражения лаборатории. Это надо иметь в виду при необходимости множественного пассажа. Долговременное хранение вирусов проводится при температуре −70 °С. Кроме этого, подходит также лиофилизация вирусов, однако для того чтобы гарантировать инфективность, полученные таким образом запасы надо периодически проверять. В случае домашней птицы определение антител на нуклеопротеин, ГА или НА вируса гриппа птиц рассматривается в качестве показателя недавнего инфицирования. Чтобы доказать действие вируса гриппа, очень важно собрать сыворотку в острый период болезни и период выздоровления. Первый из указанных образцов берется у инфицированных птиц как можно быстрее, а сыворотку этапа выздоровления надо собирать через 14−28 дней после начала болезни. ЛЕЧЕНИЕ. В настоящее время отсутствуют способы специфического практического лечения инфекций, вызванных вирусами гриппа. Для профилактики инфекций гриппа человека эффективны такие средства, как амантадин гидрохлорид и риамантадин гидрохлорид. Кроме того, риамантадин показан для эффективной борьбы с инфекциями, вызванными вирусом гриппа А у перепелов, индюков и кур. Риналди использовал риамантадин для лечения инфекции большой стаи японских перепелов в Италии, при этом уровень смертности снизился приблизительно на 50%. Однако на уровень инфицирования такое лечение не повлияло. В настоящее время этот лекарственный препарат не рекомендуется для лечения птиц. Все другие виды лечения были поддерживающими, помогающими пережить напряжение функций дыхания. Для снижения степени воздействия сопутствующих инфекций, вызванных микоплазмами и бактериями, применялось лечение антибиотиками. ПРОФИЛАКТИКА И КОНТРОЛЬ. Методы профилактики и контроля инфекции, вызванной вирусами гриппа, в основном связаны предотвращением первоначального внесения вируса и контролем распространения, если оно все же произошло. Одним из критических моментов в предотвращении и контроле гриппа является информирование персонала птицеводческих хозяйств о том, какими путями вирусы попадают в стаи птиц, как они распространяются и как это можно предотвратить. Профилактика. Наиболее вероятным источником вируса для птиц являются другие инфицированные птицы, поэтому основными средствами профилактики инфицирования домашней птицы вирусами гриппа являются отделение чувствительных птиц от инфицированных особей, а также их секреций и выделений. «Биобезопасность», если это можно так назвать, должна стать первой линией обороны. Передача вируса возможна и в том случае, если чувствительные и инфицированные птицы находятся в тесном контакте или инфекционный материал от инфицированных птиц попадает в среду чувствительных птиц. В качестве возможного источника вирусов для домашних птиц необходимо учитывать резервуар вирусов гриппа у диких птиц. Особенно надо обращать на это внимание, если птицы находятся на открытом выгоне. Поэтому очень важно уменьшить контакт между этими двумя группами. Источником вируса для индеек могут быть свиньи, при этом вирус передается механически, либо инфицированными людьми или свиньями. Контроль. При вспышке гриппа у птиц от воздействия вирусов низкой и высокой патогенности основные усилия сосредотачиваются на ограничении первоначального распространения болезни. Профилактика и контроль вспышек слабых форм заболевания — самые важные шаги в предотвращении вспышек гриппа, вызванных высокопатогенными вирусами. Все методы контроля распространения инфекции основываются на предотвращении заражения и контроле перемещения людей и оборудования. Люди, непосредственно контактирующие с птицами или их пометом, являются причиной попадания инфекции в другие помещения и сооружения. Оборудование, находившееся в непосредственном контакте с птицами или пометом, нельзя брать на другую ферму. Помимо этого, нельзя допускать выбрасывания помета на дорогу возле курятника. ВАКЦИНЫ. У многих видов птиц применялись вакцины на основе инактивированного вируса гриппа. Эффективность этих вакцин в ослаблении клинических признаков и смертности подтверждена документами. Птицы чувствительны к инфицированию вирусами гриппа, принадлежащими к любому из 15 подтипов ГА. Поэтому невозможно предсказать, каким из них будут заражены птицы, и вакцинация против всех возможных подтипов на практике не применяется. С другой стороны, если вспышка болезни является уже свершившимся фактом и определен подтип вируса, вакцинация может оказаться полезной. В результате проведения множества экспериментальных исследований было установлено, что способны вызывать появление антител и обеспечивать защиту инактивированные моновалентные и поливалентные вакцины с адьювантами. В результате их применения снижается заболеваемость, смертность, а снижения производства яиц не происходит. Было отмечено, что при контрольном заражении вакцинированные птицы часто становятся инфицированными и выделяют вирус, хотя симптомы болезни при этом не проявляются. Такие вакцины могут уменьшить тяжесть заболевания и распространение вируса в полевых условиях, но вирус устранен из популяции не будет. По этой причине, а также по причине того, что основной целью является искоренение высокопатогенного вируса гриппа птиц, вакцинация в Соединенных Штатах Америки запрещена. В настоящее время рассматриваются и другие, не связанные с вакцинами методы по борьбе с гриппом. Так, один из них заключается в применении методов генной инженерии для выделения генов ГА, особенно Н5 и Н7, и помещении их в вирусные векторы, например, в вирус оспы птиц, вакцинный вирус, бакуловирус и ретровирус. Еще один метод заключается во внесении ДНК непосредственно в организм кур. Эти разнообразные подходы с успехом применялись для иммунизации и защиты кур. Таким образом, возможности разработки множества эффективных вакцин, несомненно, существуют. Тем не менее, для вирусов гриппа было найдено интересное применение. Их используют в качестве доноров генов для изготовления живых ослабленных вакцин, которые потенциально могут быть применимы для человека. Однако пока неизвестно, будут ли эти вакцины применяться. Ясно одно. Благодаря наличию у птиц множества видов вирусов гриппа А можно сказать наверняка, что в ближайшем будущем проблемы, связанные с вирусами гриппа, останутся. РОЛЬ ПТИЦ В ЗАБОЛЕВАНИИ ГРИППОМ У МЛЕКОПИТАЮЩИХ. Вирусы гриппа птиц могут играть определенную роль в эволюции человеческих штаммов за счет внесения в штаммы человека вирусных генов путем генетической рекомбинации. Антигенные и генетические данные подтверждают предположение, что ген ГА в вирусе, ответственном за пандемию 1968 года у людей, произошел от вируса, циркулировавшего у уток. Непосредственной передачи вирусов между птицами и людьми обычно не происходит. Однако пример изолята вируса обыкновенного тюленя, вызвавшего конъюнктивит у работников лаборатории, показал, что вирус, схожий с вирусами птиц, оказался инфекционным для млекопитающих, в том числе для человека. Более того, существует свидетельство, позволяющее говорить о возможном вовлечении в межвидовую передачу вирусов H1N1, встречающихся у свиней, индеек и уток. Поэтому связь «свинья-птица-человек» может потенциально иметь большое значение для общественного здравоохранения. При проведении экспериментального инфицирования людей было установлено, что некоторые вирусы гриппа птиц могут быть ограниченно способными к репликации. Помимо этого, существует доказательство, позволяющее говорить о том, что вирусы гриппа птиц могут инфицировать млекопитающих, в том числе человека. лечение дисплазии у собак Хотя, с другой стороны, сообщения о вирусах птиц, вызывающих у человека вспышки заболевания, отсутствуют. Поэтому беспокойство в отношении потенциальной опасности для общественного здравоохранения базируется в основном на косвенных и случайных, а не фактических свидетельствах. И тем не менее, несмотря на то, что межвидовой обмен этими вирусами может быть нечастым событием, возможность межвидовой передачи вируса нельзя исключить. Оспа птиц Оспа представляет собой распространенное вирусное заболевание домашних птиц (кур, индеек, голубей и канареек) и более 60 видов диких птиц, представляющих 20 семейств. Это медленно распространяющаяся болезнь. Она характеризуется развитием обособленных узелковых, пролиферативных кожных поражений на неоперенных частях тела (кожная форма) или поражений на слизистой оболочке верхних дыхательных путей, ротовой полости и пищевода (дифтерийная форма). При слабой кожной форме болезни смертность в стае обычно находится на низком уровне. Однако она может быть высокой при генерализованной инфекции. Это случается при дифтерийной форме, в плохих условиях окружающей среды или когда болезнь осложнена другими инфекциями. Оспа птиц не имеет значимости для общественного здравоохранения. Она обычно не оказывает никакого влияния на млекопитающих. Вирусы оспы птиц инфицируют птиц обоих полов, всех возрастов и пород. Болезнь распространена по всему миру Передача оспы. Инфекция, вызванная вирусом оспы, распространяется за счет механической передачи возбудителя заболевания в раны на коже. При обращении с птицами во время вакцинации люди могут переносить на руках и одежде вирус, который затем может попасть в глаза восприимчивых птиц. Насекомые также могут быть механическими носителями вируса и приводить к окулярному инфицированию птиц. Симптомы оспы. Кожная форма болезни характеризуется узелковыми поражениями на гребне, сережках, веках и других неоперенных областях тела. При дифтерийной форме на слизистой оболочке ротовой полости, пищевода или трахеи образуются язвы или дифтеритные желтоватые поражения в совокупности со слабыми или сильными респираторными симптомами. Заболеваемость и смертность. Уровень заболеваемости оспой у кур и индеек колеблется от нескольких птиц в стае до всей стаи при действии сильно вирулентного вируса и пренебрежении мерами контроля. При инфицировании птиц кожной формой болезни у них больше шансов выздороветь, чем при заражении дифтерийной формой с вовлечением верхних дыхательных путей. Влияние оспы на кур обычно проявляется в истощении и плохом наборе веса. При инфицировании несушек у них задерживается время начало несения яиц. Болезнь длится приблизительно 3−4 недели, но при наличии осложняющих факторов срок может быть гораздо длиннее. При коммерческом разведении индеек задержка роста имеет большую финансовую значимость, чем смертность. Большая часть потерь связана со слепотой из-за кожных глазных поражений и голоданием. Если оспа поражает птиц маточных стай, может наблюдаться снижение яйценоскости и нарушение фертильности. При неосложненной слабой инфекции болезнь в стае может длиться 2−3 недели. Сильные вспышки часто длятся 6, 7 и даже 8 недель. Смертность в стаях кур и индеек обычно низкая. Однако в тяжелых случаях она может быть выше 50%. Заболеваемость и смертность от оспы среди голубей и попугаев примерно такие же, как у кур. У канареек оспа может вызывать смертность на уровне 80−100%. Значительная смертность наблюдается также у перепелов при инфицировании их вирусом оспы перепелов. Первыми из наблюдаемых признаков оспы у индеек являются небольшие желтоватые высыпания на сережках и других частях головы. Они мягкие и легко удаляются в пустулезной стадии. На их месте остаются воспаленные области, покрытые липким серозным экссудатом. Поражению обычно подвергаются уголки рта, глаз и щечно-глоточная перепонка. Далее поражения увеличиваются и покрываются сухим струпом либо желтовато-красной или бурой массой, похожей на бородавку. У маленьких индюшат голова и лапы могут покрываться поражениями полностью. Болезнь может распространяться даже на оперенные части тела. При необычных вспышках оспы птиц в маточных стаях индеек могут наблюдаться пролиферативные поражения в яйцеводе, клоаке и на коже вокруг анального отверстия. Диагноз. <>, типичные для оспы птиц, необходимо подтвердить с помощью гистопатологии (присутствие цитоплазматических включений) или выделением вируса. Дифтерийную форму болезни у кур, связанную с респираторными симптомами, надо отличать от инфекционного ларинготрахеита и инфекции, вызванной вирусом герпеса. Поражения, вызванные у маленьких цыплят дефицитом пантотеновой кислоты или биотина, либо токсином Т-2, можно ошибочно принять за оспенные поражения. Вакцина против оспы кур . Вакцина «на основе куриного эмбриона» содержит живой, неослабленный вирус оспы кур, способный вызвать серьезное заболевание у кур при неправильном использовании. Она вводится в перепонку крыла четырехнедельным цыплятам и молодкам примерно за 1−2 месяца до ожидаемого начала яйценоскости. Вакцинировать кур можно и в суточном возрасте. Одна вакцинация обеспечивает защиту на всю жизнь. Вакцина против оспы голубей . Вакцина против оспы голубей содержит живой, неослабленный, естественно встречающийся у голубей вирус. При неправильном использовании такой вакцины она может вызвать у этих птиц сильную реакцию. Вирус является менее патогенным для кур и индеек. Она может вводиться в перепонку крыла и ее можно использовать для кур любого возраста. Индеек можно вакцинировать в любом возрасте в перепонку крыла или голень. При необходимости можно вакцинировать и однодневных индюшат, но для установления лучшего иммунитета правильнее подождать до 8 недели. Рекомендуется повторная вакцинация в период роста. И обязательно надо проводить повторную вакцинацию индеек, оставленных в качестве производителей. Вакцина против оспы перепелов Для иммунизации перепелов, кур и индеек имеется живая вакцина на основе вируса оспы перепелов. Но она не обеспечивает надлежащую защиту от инфицирования вирусом оспы кур Результаты вакцинации По прошествии 7−10 дней после вакцинации надо обследовать стаю на результаты. Результатом может считаться опухоль на коже или корка в месте проведения вакцинации. Это свидетельство успешной вакцинации. Иммунитет обычно развивается спустя 10−14 дней после вакцинации. При правильном применении вакцины большинство чувствительных птиц должны иметь такие результаты. На наличие подобных свидетельств вакцинации должна осматриваться большая часть из по крайней мере 10% птиц. Отсутствие признаков вакцинации говорит о том, что птица уже привита либо ей вводилась плохая вакцина (с истекшим сроком применения или подвергшаяся вредному воздействию) или она вводилась неправильно. Вакцинация показана при следующих условиях : 1) если стая в птичнике была инфицирована в предыдущий год; обязательной вакцинации против оспы кур должны подвергаться все молодые птицы, уже находящиеся в птичнике или попавшие туда из других мест; 2) если оспа была в прошлом году и для иммунизации применялась вакцина против оспы голубей, необходимо повторно привить птиц с помощью вакцины против оспы кур; это связано с небольшой длительностью действия иммунитета, полученного при использовании вакцины против оспы голубей; 3) для защиты от инфицирования из расположенных по соседству птичников в местностях с преобладанием оспы надо применять вакцину против оспы кур.