Оксиды Оксидами называются сложные вещества, состоящие из
advertisement
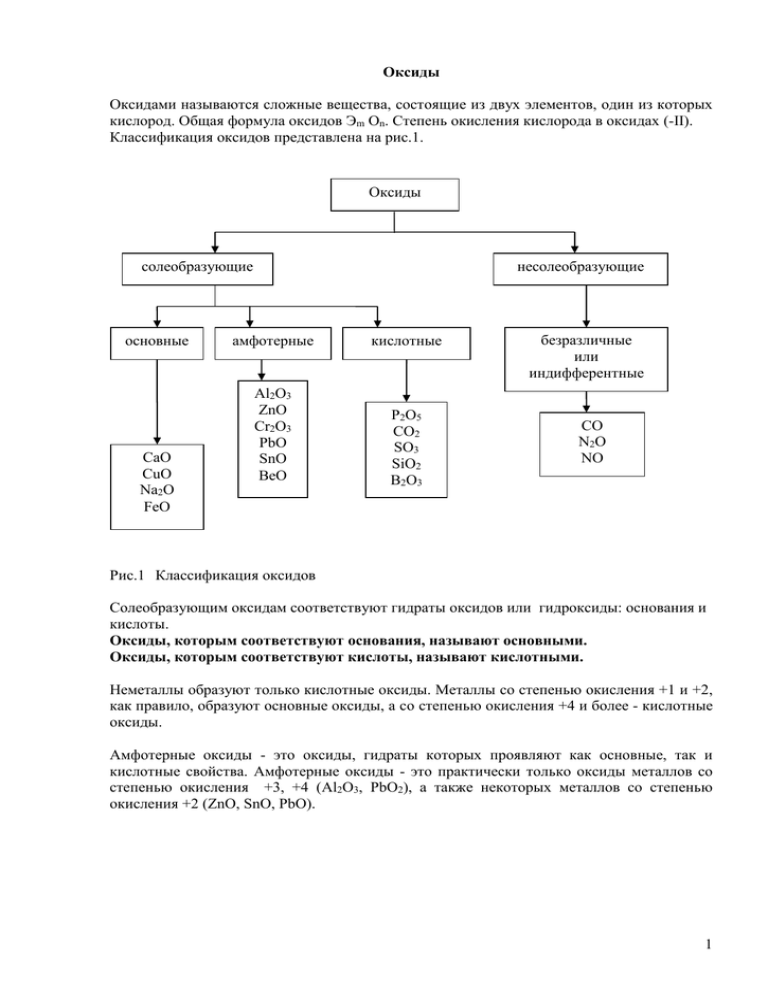
Оксиды Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород. Общая формула оксидов Эm Оn. Степень окисления кислорода в оксидах (-II). Классификация оксидов представлена на рис.1. Оксиды солеобразующие основные СаО СuO Na2O FeO несолеобразующие амфотерные кислотные Al2O3 ZnO Cr2O3 PbO SnO BeO P2O5 СО2 SO3 SiO2 B2O3 безразличные или индифферентные CO N2O NO Рис.1 Классификация оксидов Солеобразующим оксидам соответствуют гидраты оксидов или гидроксиды: основания и кислоты. Оксиды, которым соответствуют основания, называют основными. Оксиды, которым соответствуют кислоты, называют кислотными. Неметаллы образуют только кислотные оксиды. Металлы со степенью окисления +1 и +2, как правило, образуют основные оксиды, а со степенью окисления +4 и более - кислотные оксиды. Амфотерные оксиды - это оксиды, гидраты которых проявляют как основные, так и кислотные свойства. Амфотерные оксиды - это практически только оксиды металлов со степенью окисления +3, +4 (Al2O3, PbO2), а также некоторых металлов со степенью окисления +2 (ZnO, SnO, PbO). 1 Таблица 1 Формулы и названия некоторых оксидов Формула оксида Название оксида Формулы соответствующих гидроксидов Na2O K2O CaO CuO CrO MnO FeO Основные оксиды Оксид натрия Оксид калия Оксид кальция Оксид меди (II) Оксид хрома(II) Оксид марганца(II) Оксид железа (II) Основания NaOH KOH Ca(OH)2 Cu(OH)2 Cr(OH)2 Mn(OH)2 Fe(OH)2 SO2 SO3 CrO3 P2O5 Mn2O7 Кислотные оксиды Оксид серы (IV) Оксид серы (VI) Оксид хрома (VI) Оксид фосфора (V) Оксид марганца (VII) Кислоты H2SO3 H2SO4 H2CrO4 HPO3 и H3PO4 HMnO4 Al2O3 ZnO Амфотерные оксиды Оксид алюминия Оксид цинка Амфотерные гидроксиды Al(OH)3 или H3AlO3 (HAlO2) Zn(OH)2 или H2ZnO2 Химические формулы часто изображают в виде структурных формул. Например, химическая формула оксида углерода (IV) СО2. Чтобы наглядно показать валентность (химические связи), химическую формулу этого вещества можно изобразить так: О=С=О. В таком изображении каждая черточка показывает единицу валентности, и можно отметить, что углерод четырехвалентен, а кислород двухвалентен. Номенклатура оксидов. Названия оксидов, в состав которых входят химические элементы с постоянной степенью окисления, даются без упоминания о степени окисления. Например, MgO - оксид магния. Если же они образованы химическими элементами с переменной степенью окисления, то рядом с названием оксида ставится степень окисления. Например: SO2 - оксид серы (IV), SO3 - оксид серы (VI). Названия некоторых оксидов и формулы соответствующих им оснований и кислот приведены в таблице 1. Способы получения оксидов. Оксиды образуются: 1) при горении простых и сложных веществ; 2) при разложении сложных веществ: а) нерастворимых оснований; б) кислот; в) солей. (см. рис.2) 2 Общие способы получения оксидов Разложение сложных веществ Горение веществ простых сложных нерастворимых оснований 4Р+5О2→ →2Р2О5 2С2Н2+ +5О2→ 4СО2+2Н2О Рис.2 Общие способы получения оксидов tо 2Fe(OH)3→ →Fe2O3+ +3H2O кислот tо H2SiO3→ →SiO2+ +H2O солей tо CaCO3→ →CaO+ +CO2↑ Физические свойства. Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например: оксид меди (II) CuO черного цвета, оксид кальция СаО белого цвета - твердые вещества. Оксид серы (VI) SO3 - бесцветная летучая жидкость, а оксид углерода (IV) СО2 - бесцветный газ при обычных условиях. Химические свойства. Кислотные и основные оксиды обладают разными свойствами. Таблица 2. Химические свойства оксидов Свойства основных оксидов 1.Взаимодействуют с кислотами, получаются соль и вода: tо CuO+H2SO4→CuSO4+H2O Свойства кислотных оксидов 1.Взаимодействуют с растворимыми основаниями (щелочами), получаются соль и вода: СО2+Са(ОН)2→СаСО3↓+Н2О 2. Оксиды активных металлов 2. Большинство кислотных оксидов взаимодействуют с водой с образованием взаимодействуют с водой с образованием щелочи: кислоты: tо Li2O+H2O→2LiOH Р2О5+3Н2О → 2Н3РО4 3. Основные и кислотные оксиды взаимодействуют между собой с образованием соли: CaO+CO2→CaCO3 4. Менее летучие кислотные оксиды вытесняют более летучие из их солей: tо СаСО3+SiO2→CaSiO3+CO2↑ 3 Вопросы и упражнения для самоконтроля: 1. Что такое оксиды и как их классифицируют? 2. Составьте уравнения реакций, схемы которых даны ниже: Li+...→Li2O Ca+...→CaO C+...→CO2 Al+...→Al2O3 PH3+...→P2O5+H2O Li2O+...→LiNO3+H2O CuO+...→CuCl2+H2O Li2O+...→LiOH P2O5+...→H3PO4 SO3+...→Na2SO4+... 3. Составьте уравнения реакций, при помощи которых можно получить следующие оксиды: CO2, Al2O3, Li2O, CaO, MgO, P2O5, CuO. 4. Какие из перечисленных оксидов реагируют с водой: BaO, Li 2O, CuO, SO3, CaO, SiO2, P2O5, Fe2O3, Al2O3, Na2O, Mn2O7? Напишите уравнения реакциий. 5. Напишите формулы оксидов, гидратами которых являются следующие кислоты: H2SO4, H2SO3, H2SiO3, HMnO4, H3BO3. 6. Напишите уравнения химических реакций, схемы которых даны ниже: Ca→CaO→Ca (OH)2 Cu→CuO→CuSO4 P→P2O5→H3PO4 SO3+…→K2SO4+… N2O5+LiOH→… t P2O5+...→Ca3 (PO4)2+… 7. Запишите формулы высших оксидов и гидроксидов указанных элементов: хрома, серы, вольфрама, олова, кальция, хлора, меди, фосфора, учитывая их положение в периодической системе. 8. Запишите формулы оксидов, соответствующих гидроксидам: H2WO4, H2Cr2O7, H3BO3, Fe(OH)3, Fe(OH)2, Ni(OH)3, H2MnO4. 4