Обмен нуклеиновых кислот О значении нуклеопротеидов и
реклама
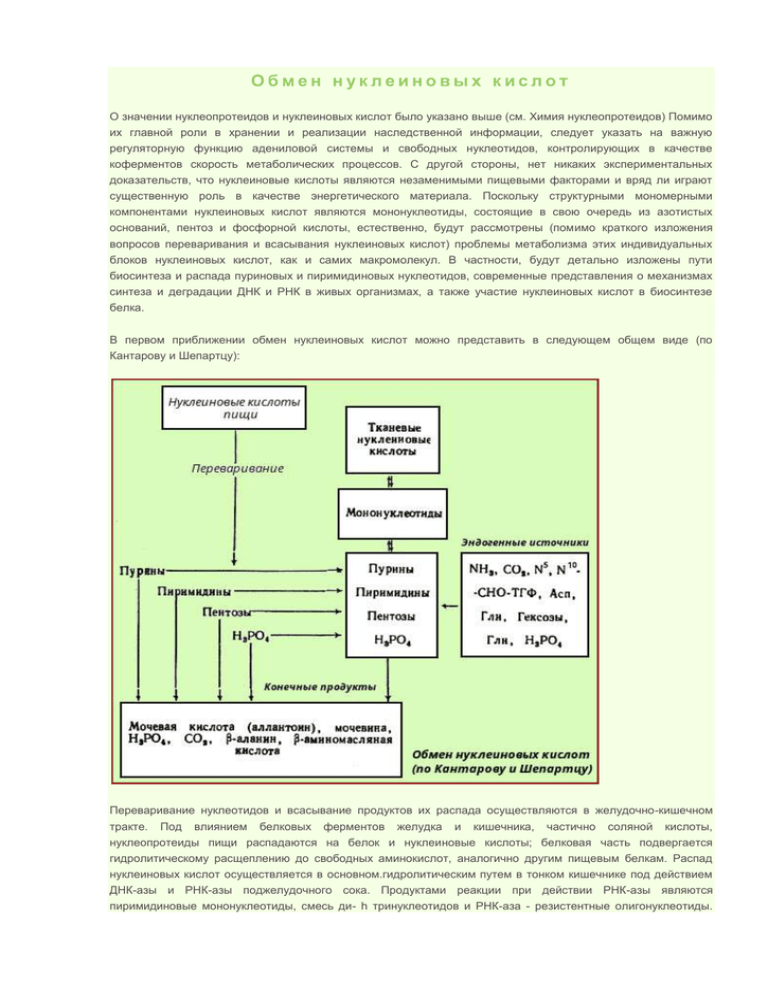
Обмен нуклеиновых кислот О значении нуклеопротеидов и нуклеиновых кислот было указано выше (см. Химия нуклеопротеидов) Помимо их главной роли в хранении и реализации наследственной информации, следует указать на важную регуляторную функцию адениловой системы и свободных нуклеотидов, контролирующих в качестве коферментов скорость метаболических процессов. С другой стороны, нет никаких экспериментальных доказательств, что нуклеиновые кислоты являются незаменимыми пищевыми факторами и вряд ли играют существенную роль в качестве энергетического материала. Поскольку структурными мономерными компонентами нуклеиновых кислот являются мононуклеотиды, состоящие в свою очередь из азотистых оснований, пентоз и фосфорной кислоты, естественно, будут рассмотрены (помимо краткого изложения вопросов переваривания и всасывания нуклеиновых кислот) проблемы метаболизма этих индивидуальных блоков нуклеиновых кислот, как и самих макромолекул. В частности, будут детально изложены пути биосинтеза и распада пуриновых и пиримидиновых нуклеотидов, современные представления о механизмах синтеза и деградации ДНК и РНК в живых организмах, а также участие нуклеиновых кислот в биосинтезе белка. В первом приближении обмен нуклеиновых кислот можно представить в следующем общем виде (по Кантарову и Шепартцу): Переваривание нуклеотидов и всасывание продуктов их распада осуществляются в желудочно-кишечном тракте. Под влиянием белковых ферментов желудка и кишечника, частично соляной кислоты, нуклеопротеиды пищи распадаются на белок и нуклеиновые кислоты; белковая часть подвергается гидролитическому расщеплению до свободных аминокислот, аналогично другим пищевым белкам. Распад нуклеиновых кислот осуществляется в основном.гидролитическим путем в тонком кишечнике под действием ДНК-азы и РНК-азы поджелудочного сока. Продуктами реакции при действии РНК-азы являются пиримидиновые мононуклеотиды, смесь ди- h тринуклеотидов и РНК-аза - резистентные олигонуклеотиды. Под действием ДНК-азы образуются в основном динуклеотиды, олигонуклеотиды и небольшое количество мононуклеотидов. Полный гидролиз нуклеиновых кислот до стадии мононуклеотидов осуществляется, очевидно, другими менее изученными ферментами (фосфодиэс-теразами) слизистой оболочки кишечника. В отношении дальнейшей судьбы мононуклеотидов сушествует два предположения. Мононуклеотиды в кишечнике расщепляются под действием неспецифических фосфатаз (кислой и щелочной), которые гидролизуют сахарофосфатную связь мононуклеотида ("нуклеотидазное" действие), с образованием нуклеозидов и фосфорной кислоты и в таком виде всасываются. Второе предположение заключается в том, что мононуклеотиды всасываются и распад их осуществляется в клетках слизистой оболочки кишечника. Имеются также доказательства существования в стенке кишечника нуклеотидаз, катализирующих гидролитический распад мононуклеотидов. Дальнейший распад образовавшихся нуклеозидов осуществляется внутри клеток слизистой преимущественно фосфоролитическим, а не гидролитическим путемКак будет показано ниже, в животных тканях открыты специфические нуклеозидфосфорилазы, действующие на нуклеозиды. Всасываются преимущественно нуклеозиды, и в таком виде часть азотистых оснований может быть использована для синтеза нуклеиновых кислот организма. Если же происходит дальнейший распад нуклеозидов до свободных пуриновых и пиримидиновых оснований, то гуанин не используется для синтетических целей. Что касается других оснований, то, как показывают опыты с меченным по азоту аденином и урацилом, в тканях они могут включаться в состав нуклеиновых кислот. Однако экспериментальные данные свидетельствуют о том, что биосинтез азотистых оснований, входящих в состав нуклеиновых кислот органов и тканей, протекает преимущественно, если не целиком, de novo из низкомолекулярных азотистых и безазотистых предшественников. Таким образом, синтез нуклеиновых кислот, мономерными молекулами которых являются мононуклеотиды, будет определяться скоростью синтеза пуриновых и пиримидиновых нуклеотидов; синтез последних в свою очередь зависит от наличия всех трех компонентов, составляющих их. Источником рибозы и дезоксирибозы является глюкоза или ее метаболиты в пентозофосфатном пути; пока не получены доказательства существенности пищевых пентоз в синтезе нуклеиновых кислот. Фосфорная кислота также не является лимитирующим фактором, поскольку она поступает в достаточном количестве с пищей. Следовательно, биосинтез нуклеиновых кислот берет свое начало с синтеза азотистых оснований (точнее, мономерных молекул - мононуклеотидов). Биосинтез пуриновых нуклеотидов Предыдущая: Обмен нуклеиновых кислот Экспериментальные данные свидетельствуют о том, что для синтеза пуриновых нуклеотидов в организме животных готовые пуриновые основания, образующиеся в процессе переваривания нуклеиновых кислот в кишечнике, не используются. Их синтез осуществляется из низкомолекулярных предшественников, продуктов обмена углеводов и белков. Впервые в лаборатории Бьюкенена экспериментально доказано включение ряда меченых атомов, в частности l5N- и l4N-глицина, l5N-аспартата, l5N-глутамина и др., в пуриновое кольцо мочевой кислоты. Скармливая птицам эти и другие меченые соединения, он анализировал места включения метки в пуриновое кольцо. Полученные Бьюкененом данные были в дальнейшем уточнены, подтверждены рядом других авторов и представлены в схеме: Из схемы видно, что 4-й и 5-й атомы углерода и 7-й атом азота в ядре имеют своим источником глицин. Два атома азота (N3 и N9) происходят из амидной группы глутамина, один атом азота (Nl) - из азота аспарагиновой кислоты; углеродный атом (С2) происходит из углерода N10)- формил-тетрагидрофолиевой кислоты, атом углерода в 8-м положении - из N5, N10-метенил-тетрагидрофолиевой кислоты и, наконец, углерод С6 имеет своим источником СO2. В настоящее время благодаря исследованиям Бьюкенена, Гринберга, Корнберга и их сотрудников полностью расшифрована последовательность включения перечисленных выше веществ в пуриновое кольцо, установлена природа всех промежуточных соединений и ферментных систем, катализирующих химические реакции. Интересным оказался факт почти полного совпадения путей синтеза пуриновых оснований в печени животных и у микроорганизмов, в частности у Е. coli и Neurospora crassa. Следует, однако, отметить, что конечным результатом синтеза оказалось не свободное пуриновое основание, а рибонуклеотид - инозиновая кислота, из которой далее синтезируются адениловая и гуаниловая кислоты. В схеме представлена последовательность всех 11 химических реакций этого синтеза с указанием ферментных систем, коферментов, источников энергии и других известных к настоящему времени кофакторов. Как видно из приведенной схемы, синтез инозиновой кислоты начинается с D-рибозо-6-фосфата, который, как известно, является продуктом пентозофосфатного цикла и на который переносится в необычной реакции пирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофосфат (в дальнейшем будет обозначаться ФРПФ) взаимодействует с глутамином, который является донатором NH 2-группы, и образуется β-5-фосфорибозил-амин, причем в процессе реакции наряду с освобождением пирофосфата и свободной глутаминовой кислоты имеет место изменение конфигурации (из α- в β-). Таким образом, данная стадия становится ключевой реакцией в синтезе пуринов. В следующей стадии присоединяется вся молекула глицина к свободной NH2-группы β-5-фосфорибозиламина (реакция нуждается в доставке энергии АТФ) с образованием глицина-мидрибонуклеотида. Цепь в следующей стадии удлиняется за счет присоединения формильной группы из N5, N10-метенил-тетрагидрофолиевой кислоты с образованием формилглицинамидрибонуклеотида. На формильную группу последнего переносится далее амидная группа глутамина и синтезируется формилглицинамидинрибонуклеотид (реакция также идет с потреблением энергии АТФ). В следующей стадии замыкается пятичленное имидазольное кольцо и образуется 5аминоимидазолрибонуклеотид, который способен акцептировать СO2 с образованием рибонуклеотида 5аминоимидазол-4-карбоновой кислоты. В последующем двухступенчатом процессе, в котором участвуют аспарагиновая кислота и АТФ, образуется 5аминоимидазол-4-карбоксиамидрибонуклеотид и освобождается фумаровая кислота. В этих реакциях азот аспарагиновой кислоты включается в первое положение будущего пуринового ядра. Последний углеродный атом пиримидинового остатка кольца пурина вводится в виде формильного остатка (источник N 10-формилтетрагидрофолиевая кислота), которая присоединяется к 5-NH2-группе. После этого отщепляется молекула воды и второе кольцо замыкается. В результате образуется первый пуриновый нуклеотид - инозиновая кислота (ИМФ), которая является предшественником пуриновых нуклеотидов в составе нуклеиновых кислот. Биосинтез адениловой и гуаниловой кислот. Образование пуриновых нуклеотидов (адениловой и гуаниловой кислот, АМФ и ГМФ) осуществляется из инозиновой кислоты (ИМФ). Причем в синтезе обоих мононуклеотидов участвуют по два фермента, отличных по своему механизму действия. Образование ГМФ из ИМФ катализируют ИМФ-дегидрогеназа и ГМФ-синтетаза, а образование АМФ из того же предшественника катализируется последовательным действием аденилосукцинатсинтетазы и аденилосукцинатлиазы. Обозначив остаток рибозы-5-фосфата Риб-Ф, названия аминокислот - сокращенными символами, механизм двухэтапного синтеза АМФ и ГМФ можно представить следующими химическими реакциями: Видно, что в ферментативном синтезе АМФ из инозиновой кислоты специфическое участие принимает аспарагиновая кислота, являющейся донатором NH2-группе, и ГТФ в качестве источника энергии; промежуточным продуктом реакции является аденилоянтарная кислота. Биосинтез ГМФ, напротив, начинается с дегидрогеназной реакции ИМФ с образованием ксантозиловой кислоты; в аминировании последней используется только амидный азот глутамина. Превращение АМФ и ГМФ в соответствующие нуклеозидди- и трифосфаты также протекает в две стадии при участии специфических нуклеозидмонофосфат- и нуклеозиддифосфаткиназ по уравнению: ГМФ + АТФ <--> ГДФ + АДФ ГДФ + АТФ <--> ГТФ + АДФ Следует, однако, напомнить, что основным механизмом синтеза АТФ из АДФ и неорганического фосфата живых организмов является окислительное фосфорилирование. Следует указать, что быстрорастущие ткани (эмбриональная, опухолевая, регенерирующая) используют также резервные (запасные) пути синтеза пуриновых нуклеотидов из свободных азотистых оснований: аденина, гуанина и гипоксантина. Ферменты, катализирующие синтез нуклеотидов, требуют наличия 5фосфорибозил-1-пирофосфата (ФРПФ). В общей форме реакции протекают следующим образом: Следует указать на существование в клетках весьма тонкого механизма регуляции синтеза пуриновых нуклеотидов. Синтез их тормозится конечными продуктами по принципу обратной связи, т. е. ингибированием первой стадии переноса аминогруппы глутамина на ФРПФ. Фермент, катализирующий эту стадию, оказался аллостерическим регуляторным ферментом. Второй механизм регуляции заключается в том, что избыток ГМФ в клетках оказывает аллостерическое торможение на свой собственный синтез, не влияя на синтез АМФ, и, наоборот, накопление АМФ подавляет свой синтез, не ингибируя синтез ГМФ. Биосинтез нуклеиновых кислот Предыдущая: Биосинтез пиримидиновых нуклеотидов Требования и условия биосинтеза нуклеиновых кислот в бесклеточной системе: Наличие энергии [показать] Наличие специфических ферментов [показать] Наличие белковых факторов, проявляющих каталитические свойства ферментов[показать] Биосинтез ДНК (общий механизм) Основываясь на данных биспиральной антипараллельной структуры и химического состава ДНК (см. Химия нуклеиновых кислот), а также на данных о значении "активированной" формы энергии для биосинтеза полимерных молекул, А. Корнберг еще в 1955 г. впервые указал на возможность синтеза энзиматическим путем ДНК в бесклеточной системе в присутствии изолированной из Е. coli ДНК-полимеразы и предшественников дезоксирибонуклеозидтрифосфатов; реакция сводится к синтезу новой молекулы ДНК: Сущность реакции сводится к присоединению мононуклеотидных единиц к свободному 3'-гидроксильному концу ДНК и образованию новой полинуклеотидной цепи в направлении 5'-> 3'; схематически она может быть представлена в виде: Реакция требует присутствия одноцепочечной ДНК или в крайнем случае небольших фрагментов полинуклеотидов. Пока еще нет полной ясности о значении предобразованной ДНК в действии ДНКполимераз. Более вероятно мнение, что ДНК служит матрицей, на которой фермент комплементарно и антипараллельно синтезирует новую цепь ДНК. Это можно представить в виде схемы: Как видно из схемы, последовательность вновь синтезируемого полинуклеотида отражает первичную структуру, и обе цепи по отношению друг к другу являются антипараллельными. Следует указать, что ДНК-полимераза I оказалась наиболее активной в тех случаях, когда добавленная в качестве матрицы молекула ДНК была предварительно денатурирована. В этих случаях соблюдалась не только точная последовательность оснований, но и ряд физических свойств исходной ДНК. Напротив, если в опытах in vitro была добавлена нативная двухцепочечная ДНК, то вновь синтезированный полинуклеотид значительно отличался от ДНК и, в частности, не обладал свойственной ДНК биологической активностью. Были предприняты другие подходы к выяснению механизма полимеразной реакции. В лаборатории Корнберга был открыт фаг (ФХ174), содержащий одноцепочечную кольцевую ДНК; когда эта молекула была использована в качестве матрицы в ДНК-полимеразной реакции, то в этих условиях была получена биологически активная ДНК фага. В этой работе важную роль сыграл другой фермент, названный ДНКлигазой, обладающий способностью катализировать репарацию ДНК, соединение концов разрывов в молекуле ДНК. Было показано, что в процессе репликации одноцепочечная ДНК фага ФХ174 проходит стадию образования двухцепочечной кольцевой ДНК. Применив ряд остроумных подходов, Корнберг и сотр. в опытах in vitro создали искусственную молекулу фага ФХ174, обладающую способностью поражать (инфицировать) Е. coli, вызывая лизис бактерии. Последовательность событий в этой работе может быть представлена в следующей схеме, где исходную молекулу кольцевой ДНК фага ФХ174 пометим плюсом (+), а вновь синтезируемую молекулу-минусом (-) (рис. 106). В исследованиях Меселсона и Сталя получила подтверждение гипотеза полуконсервативного механизма синтеза ДНК в клетках, означающего наличие в каждой из двух дочерних молекул одной из родительских цепей ДНК (рис. 107). Репликация ДНК, как правило, начинается с какой-нибудь одной точки на обеих цепях, и направление роста каждой цепи также идет в одном направлении. Кроме того, как было указано выше, ДНК-полимераза I не реплицирует нативную двухцепочечную ДНК и осуществляет синтез только в одном направлении, а именно в направлении 5'->3'. Была предложена интересная гипотеза, объясняющая репликацию обеих цепей нативной молекулы ДНК. Этот механизм требует наличия трех ферментов: ДНК-полимеразы, ДНК-лигазы и эндонуклеазы. Репликация начинается с разрыва в одной из двух цепей под действием эндонуклеазы. Затем к этому месту присоединяется ДНК-полимераза и начинается непрерывный синтез нового олигонуклеотида на одной из двух родительских цепей в направлении 5'->3', обратный направлению исходной цепи ДНК. Из второй цепи родительской ДНК идет синтез прерывистый, сопровождающийся образованием фрагментов ДНК, также в направлении 5'->3' с последующим объединением фрагментов ДНК при участии ДНК-лигаз в единую полинуклеотидную молекулу. Подобный механизм челночного синтеза ДНК легко объясняет фактические данные накопления коротких фрагментов ДНК у Е. coli во время репликации ДНК. Совсем недавно было показано, что инициация биосинтеза дочерних цепей ДНК требует предварительного синтеза на материнской ДНК необычного затравочного олигорибонуклеотида, названного праймером, со свободной гидроксильной группой, у 3'-углеродного атома рибозы. Этот олигорибонуклеотид, содержащий около 50 нуклеотидных остатков, синтезируется комплементарно на матрице ДНК при участии особого фермента - РНК-полимеразы (см. ниже). Предполагается, что именно с этой точки концевого 3'-гидроксила рибозы праймера начинается истинный синтез дочерней цепи ДНК, комплементарной родительской. В дальнейшем этот фрагмент РНК, ковалентно присоединенный к новообразованной цепи ДНК, разрушается под действием нуклеаз и возникшая брешь застраивается олигодезоксирибонуклеотидом при помощи той же ДНК-полимеразы. Вполне допустимо предположение, что синтез праймера изолигорибонуклеотида имеет биологический смысл, поскольку в этом случае могут устраняться ошибки, неизбежно возникающие при инициации репликации ДНК. Этапы биосинтеза ДНК. Предложен ряд моделей механизма биосинтеза ДНК с участием указанных выше ферментов и белковых факторов, однако детали некоторых этапов этого синтеза еще не выяснены. Предполагается, что условно механизм синтеза может быть подразделен на три этапа: инициацию, т. е. сигнализацию, элонгацию, т. е. продолжение, и терминацию, т. е. завершение (прекращение) синтеза. 1. Первый этап - инициация биосинтеза ДНК - является началом синтеза дочерних нуклеотидных цепей на материнских и сводится, как указано выше, к биосинтезу на материнской ДНК необычного затравочного олигорибонуклеотида (праймера) со свободной гидроксильной группой у 3'-углеродного атома рибозы. Олигорибонуклеотид синтезируется при участии особого фермента - РНКполимеразы. При инициации к ДНК последовательно присоединяются ДНК-связывающий и ДНКраскручивающий белок, а затем комплексы ДНК-полимераз и ДНК-зависимая РНК-полимераза 2. (последняя обеспечивает синтез праймера) и ряд других белковых факторов. Второй этап, получивший название элонгации синтеза ДНК, включает стадию репликации участников материнских цепей ДНК и стадию связывания друг с другом фрагментов новообразуемых цепей ДНК. Первая стадия осуществляется при помощи ДНК-полимеразы, причем синтез идет не непрерывно, а фрагментарно. Японский биохимик Оказаки как будто получил доказательства челночного механизма синтеза ДНК; фермент может вести синтез только в одном направлении 5'->3' сначала на одной цепи материнской ДНК, а затем в том же направлении 5'-->3', но передвигаясь в обратную сторону по другой цепи ДНК. В дальнейшем оказалось, что фрагменты всякий раз синтезируются раздельно, начиная с праймера, который может переноситься с готового фрагмента при помощи одного из белковых факторов репликации в точку старта биосинтеза последующего фрагмента, направленных противоположно по биспиральной молекуле ДНК. Стадия завершается отделением олигорибонуклеотидных праймеров, объединением отдельных фрагментов ДНК при помощи ДНК- 3. лигаз и формированием дочерней цепи ДНК. Терминация синтеза ДНК наступает скорее всего вследствие исчерпания ДНК-матрицы и обрыва трансферазной реакции. Точность репликации ДНК чрезвычайно высока: может быть одна ошибка на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов репарации. Синтез ДНК на матрице РНК. Выдающимся достижением биохимии нуклеиновых кислот является открытие сначала в составе онковирусов (Раушера и саркомы Рауса) фермента обратной транскриптазы, или ревертазы (или РНК-зависимая ДНК-полимераза), катализирующего биосинтез молекулы ДНК на матрице РНК. Д. Балтимор и Г. Темин, впервые обнаружившие этот фермент, были удостоены Нобелевской премии в 1974 г. Накоплены данные, показывающие, что многие РНК-содержащие онкогенные вирусы (получившие наименование онкорнавирусов) содержат ревертазу в составе покровных белков. Фермент открыт также во многих клетках прокариотов и эукариотов, в частности в лейкозных клетках, в пролиферирующих тканях, включая эмбриональные ткани. Известно, что ревертаза онкорнавирусов содержит Zn 2+ и активируется катионами Мn2+ и Mg2+. Предполагается, что механизм синтеза ДНК на матрице РНК включает три стадии. На первом этапе фермент ревертаза синтезирует на матрице вирусной РНК комплементарную цепь ДНК, что приводит к формированию гибридной молекулы РНК~ДНК. На втором этапе имеет место разрушение исходной вирусной РНК из комплекса гибридной молекулы под действием РНК-азы. Наконец, на третьем этапе на матрице оставшейся цепи ДНК комплементарно синтезируются новые цепи ДНК. Укажем также, что ревертазной активностью обладают и ДНК-полимеразы. В частности, фермент из Е. coli обладает способностью катализировать синтез ДНК на матрице рРНК. Значение открытия обратной транскриптазы огромно. Оно имеет существенное значение не только для выяснения закономерностей процесса малигнизации, но и для всей науки о живом, поскольку указывает на возможность передачи наследственной информации от РНК на ДНК, не подчиняясь основному постулату центральной догмы (поток информации идет только в одном направлении: ДНК --> РНК --> Белок В настоящее время мы вправе дополнить основную схему передачи генетической информации в живой клетке ДНК--> РНК-->белок и представить ее в более полной форме: На схеме стрелки вокруг ДНК и РНК указывают на возможность копирования себя в живых системах при участии соответствующих ферментов. Как знать, не станем ли мы свидетелями поворота стрелки и на следующей стадии центральной догмы - от белка на РНК, что в принципе могло бы существовать на земле при зарождении первичных живых существ. Исследования обратной транскрипции при участии ревертазы проводятся в широких масштабах в области генной инженерии. Биосинтез РНК Современным представлениям о механизме синтеза РНК в клетках мы в значительной степени обязаны открытию в 1960 г. в двух лабораториях США (Гурвич и Вейс) особого фермента - РНК-полимеразы, катализирующего синтез рибонуклеиновой кислоты из свободных нуклеозидтрифосфатов. Фермент требует наличия ионов Mg2+ или Мn2+ и одновременного присутствия всех четырех типов рибонуклеозидтрифосфатов. Самым удивительным свойством фермента оказался факт, что включение нуклеотидов в РНК требовало обязательного присутствия предобразованной ДНК. Позже были открыты также ферменты (преимущественно в составе оболочек фагов и у ряда бактерий), катализирующие синтез РНК на матрица РНК (см. ниже). При тщательном изучении механизма синтеза РНК при участии РНК-полимераз, обозначаемой также ДНКзависимая РНК-полимераза (или транскриптаза), было установлено, что молекула предобразованной ДНК необходима не только для реакции полимеризации, но что она всецело определяет последовательность рибонуклеотидов во вновь синтезированной молекуле РНК. Другими словами, на матрице ДНК комплементарно строится полирибонуклеотид, являющийся копией первичной структуры ДНК, с той только разницей, что против тимидилового нуклеотида ДНК в РНК включается уридиловый нуклеотид. Реакция синтеза РНК в общем виде может быть представлена: В синтезированной молекуле РНК отдельные мононуклеотиды, как и в ДНК, связаны между собой 3'-5'фосфодиэфирными мостиками. Как можно видеть из этой схемы, механизм действия РНК-полимераз во многом совпадает с таковым у ДНК-полимераз. Синтез также идет в направлении 5'-->3'. Цепь РНК имеет противоположную полярность цепи предобраэованной ДНК. Однако имеются и существенные различия. РНКполимераза Е. coli предпочтительнее функционирует в присутствии нативной двухцепочечной ДНК и, что самое интересное, в опытах in vitro обе цепи ДНК копируются РНК-полимеразой; in vivo транскрибируется, вероятнее всего, только одна цепь ДНК. Предполагается, что РНК-полимераза связывается с одной цепью нативной ДНК в определенной точке, вызывая расплетение биспиральной структуры на ограниченном участке, где и происходит синтез РНК. Фермент как будто бы не нуждается в присутствии праймера, как ДНКполимераза. Накопленные данные свидетельствуют о том, что у Е. coli скорее всего имеется единственная ДНК-зависимая РНК-полимераза, которая синтезирует все типы клеточных РНК. Имеются доказательства синтеза РНК-предшественников (например, 45S РНК, считающаяся предшественником рРНК или про-мРНК; последняя является предшественником матричной мРНК), которые подвергаются постсинтетическим превращениям (процессингу), включающим не только гидролиз и отщепление неинформативной или, точнее, регуляторной части предшественника, но и различные химические модификации (аденилирование, метилирование и др.) оставшейся информативной части РНК. РНК-полимераза Е. coli изучена наиболее подробно. Это олигомерный фермент, состоящий из двух α- и по одной β1, β2- и σ-субъединице, с общей молекулярной массой около 500 000. Считается, что σ-субъединица, называемая σ-фактором, обладает функцией узнавания некоего участка на матрице ДНК, названного промотором, куда присоединяется РНК-полимераза. Другим субъединицам фермента приписывают функции инициации биосинтеза РНК (α-), связывания субстратов и элонгации синтеза (β-субъединицы). Следует указать также на открытие ряда белков, принимающих участие в механизме синтеза РНК в клетке, в частности исследуется природа репрессорных белков и белка-терминатора (ρ-фактора). Последний обладает способностью обратимо связываться с терминирующим участком ДНК, включая действие РНК-полимеразы. В отсутствие этого белка образуются исключительно длинные цепи ДНК. Менее полно изучены РНК-полимеразы эукариотов. Из клеток животных выделены три группы РНКполимераз: А, В и С, принимающие участие в синтезе соответственно рРНК, мРНК и тРНК. Современные представления о механизме и регуляции синтеза РНК предусматривают роль, помимо указанного выше участка ДНК промотора, также участка оператора, обратимо связывающегося с белкомрепрессором, участком цистрона и терминатора, а также низкомолекулярных веществ. Ведущая роль в дерепрессии оператора придается гормонам. Синтез РНК при участии ДНК-зависимой РНК-полимеразы специфически тормозится также антибиотиком актиномицином D, который обладает способностью связываться водородными связями с ДНК по месту остатков гуанина. Актиномицин тормозит синтез РНК и в интактных клетках. Он нашел широкое примейение при определении процессов, зависящих от транскрипции ДНК. Синтез РНК на матрице РНК Следует указать, что ДНК-зависимая РНК-полимераза может осуществлять транскрипцию ДНК нормальных клеток и ДНК-вирусов. Как же осуществляется синтез РНК у тех вирусов, которые в геноме вместо ДНК содержат РНК? Оказывается, в этих случаях вирусная РНК индуцирует образование в клетках хозяина (например, у Е. coli) РНК-зависимой РНК-полимеразы, которая участвует в репликации вирусной РНК (отсюда второе название фермента - РНК-репликаза). Фермент также использует нуклеозидтрифосфаты для синтеза одноцепочечной вирусной РНК. Этот синтез должен пройти через стадию образования репликативной формы. Следовательно, в первой стадии РНК-репликаза на матрице РНК-вируса специфически строит комплементарную с противоположной полярностью цепь РНК. Последняя во второй стадии служит матрицей для синтеза РНК, совершенно однотипной исходной вирусной РНК, хотя обе стадии катализируются одним и тем же ферментом; в каждой из них действуют различные белковые факторы. Следует особо подчеркнуть, что, поскольку РНК-репликаза имеет отношение только к вирусам, очевидно, на этом основании могут быть разработаны эффективные антивирусные лекарственные препараты. Синтез РНК из нуклеозиддифосфатов. Выше было указано об открытии М. Грюнберг-Монаго и С. Очоа в 1955 г. в клетках E. coli особого фермента - полинуклеотидфосфорилазы, наделенной не только РНК-азной активностью, но и способностью синтеза полимерной молекулы РНК. Фермент требует наличия однотипных или разных рибонуклеозиддифосфатов. Рибонуклеозидтрифосфаты и дезоксирибонуклеозиддифосфаты не оказались субстратами фермента. Хотя фермент не нуждается в матрице, все же для синтеза требуется затравочная цепь РНК со свободной 3'-гидроксильной группой, к которой присоединяются остатки мононуклеотидов. Образовавшаяся полимерная молекула РНК не имеет заданной специфической последовательности мононуклеотидов, но содержит 3'->-5'-фосфодиэфирные связи, легко разрываемые рибонуклеазой. Относительно биологической роли этого фермента у бактерий имеющиеся данные свидетельствуют, вероятнее всего, о его катаболическом фосфоролизе мРНК, характеризующемся коротким периодом жизни. Подтверждением этого положения являются данные по физиологической концентрации фосфата в клетках. Следует указать, что полученные в последние годы в лаборатории С. С. Дебова данные свидетельствуют прежде всего о более широком распространении полирибонуклеотидфосфорилазы в живых организмах, чем это признавалось ранее. Фермент открыт также в клетках животных. Кроме того, получены экспериментальные доказательства синтетической функции полинуклеотидфосфорилазы. Вполне правомерно допущение, что этот фермент может принимать участие в синтезе коротких полирибонуклеотидов в клетках эукариотов в норме и при некоторых экстремальных условиях. О значении фермента в образовании синтетических мРНК, сыгравших огромную роль в расшифровке триплетного нуклеотидного кода, было указано выше. Основные направления современной генной инженерии В заключение обсудим вкратце основные направления современной генной инженерии. Как известно, конечной целью генной инженерии является получение организмов (животных и растений) с новыми наследственными свойствами c помощью чисто лабораторных приемов. Для достижения этой пока еще отдаленной цели необходимо ввести в организм соответствующий ген или гены (такого рода операция получила наименование трансгеноза). Ген, как было указано выше, представленный определенным участком ДНК и соответствующий определенному белку, можно или выделить из другого организма или синтезировать химическим или биологическим путем. Впервые в 1969 г. из Е. coli был выделен участок ДНК с геном, ответственным за синтез фермента, катализирующего усвоение молочного сахара (лактозы), - так называемый лактозный оперон. Но таких примеров немного. Химический синтез генов аланиновой тРНК впервые осуществил выдающийся индийский ученый - Хар Гобинд Хорана. Состоящий из 77 нуклеотидов, этот ген, однако, in vitro был лишен функциональной активности. Были получены сведения, что тРНК на гене синтезируется в клетках не в готовом виде, а в форме предшественников. Эти данные послужили для Хорана основой синтеза предшественника гена тирозиновой тРНК (из 126 нуклеотидов), хотя сама тирозиновая тРНК состоит из 85 нуклеотидов. Ввиду громоздкости, а также недостаточной эффективности химического синтеза в последние годы все большее место занимают биологические методы синтеза генов при помощи обратной транскриптазы (ревертазы). Для этого необходимо иметь в руках мРНК, с помощью которой можно воспроизвести соответствующий ген. С 1972 г. этим путем синтезированы ДНК-копии на мРНК кодирующие синтез белка глобина (человека, кролика, мыши, голубя, утки), иммуноглобулина и белка хрусталика глаза. Однако на этом пути синтеза генов встречаются большие трудности, связанные с выделением из огромного разнообразия клеточных мРНК нужного для синтеза гена. Второй этап генной инженерии - перенос генов в клетку (трансгеноз)-осуществляется тремя путями: трансформацией (перенос генов посредством выделенного из клеток и освобожденного от примесей ДНК), трансдукцией (перенос генов посредством вирусов), гибридизацией клеток, полученных из разных организмов (высших животных, микроорганизмов и др.) (рис. 108, 109). Заключительный этап генной инженерии сводится к адаптации введенного гена в организме хозяина и почти не зависит от искусства экспериментатора. Таким образом, исследования в области генной инженерии могут служить основой для решения ряда практических задач здравоохранения и сельского хозяйства. В частности, полученные в лаборатории гены, помимо широкого использования в микробиологической промышленности для приготовления лекарственных препаратов белковой природы - гормонов, ферментов и др., будут применяться в качестве лечебных препаратов при лечении многих наследственных заболеваний (их насчитывается более 2000), генетический дефект которых известен только у небольшого числа (не более 50) болезней. Первые попытки применения лактозного оперона при галактоземии (наследственном заболевании, связанном с непереносимостью галактозы из-за отсутствия фермента галактозо-1-фосфат-уридилилтрансферазы) вселяют надежду на реальные практические возможности генной инженерии, хотя вполне обоснованны тревога и опасения, связанные с вмешательством человека в сферу тончайших биологических процессов целостного организма. Распад нуклеиновых кислот Предыдущая: Биосинтез нуклеиновых кислот Полимерные молекулы нуклеиновых кислот расщепляются в тканях преимущественно гидролитическим путем при участии специфических ферментов, относящихся к нуклеазам. В зависимости от характера действия на фосфодиэфирные связи и локализации остатка фосфата различают 3'-нуклеазы, расщепляющие сложноэфирные связи межнуклеозидного фосфата с С 5', и 5'-нуклеазы, гидролизующие связи c С3'. Кроме того, различают эндонуклеазы, разрывающие внутренние межнуклеотидные связи в молекуле ДНК и РНК, вызывающие деполимеризацию нуклеиновых кислот и образование олигонуклеотидов, и экзонуклеазы, катализирующие гидролитическое отщепление концевых мононуклеотидов от ДНК и РНК или от олигонуклеотидов. Помимо гидролитических нуклеаз, имеются ферменты, катализирующие распад нуклеиновых кислот, в частности посредством трансферазной реакции. Они катализируют перенос остатка фосфорной кислоты от 5го углеродного атома рибозы одного мононуклеотида ко 2-му углеродному атому соседнего мононуклеотида, сопровождающийся разрывом межнуклеотидной связи и образованием фосфодиэфирной связи между 2-м и 3-м углеродным атомами рибозы одного и того же мононуклеотида. К настоящему времени открыты следующие группы нуклеаз, катализирующие распад ДНК и РНК. Дезоксирибонуклеазы I катализируют разрыв внутренних фосфодиэфирных связей в одной из двух цепей молекулы ДНК между 3'-м углеродным остатком дезоксирибозы и остатком фосфата с образованием низкомолекулярных олигодезоксирибонуклеотидов: ДНК + (n - 1) Н2O --> n Олигодезоксирибонуклеотиды Среди продуктов реакции открываются также моно- и динуклеотиды. Типичными представителями этих ферментов являются ДНК-азы поджелудочной железы. Одна из них была получена в чистом виде, расшифрована последовательность всех ее 257 аминокислот. Фермент наиболее активен при pH 6,8-8,0, активируется дивалентными ионами Mg2+ и Мn2+ и ингибируется конечными продуктами ферментативной реакции - олигонуклеотидами. Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов. Представителем их является ДНКаза II, выделенная из селезенки, имеющая молекулярную массу 38 000 дальтон и состоящая из 343 аминокислот. В составе этой ДНК-азы открыт глюкозамин. Фермент также активируется ионами металлов, ингибируется анионами; его оптимум pH колеблется между 4,5 и 5,5. Помимо этих ферментов, открыты (преимущественно у микроорганизмов) еще экзодезоксирибонуклеазы, гидролизующие фосфодиэфирные связи молекулы ДНК с отщеплением концевых 5'дезоксирибонуклеотидов; в частности, экзодезоксирибонуклеазами I, II, III и IV. из Е. coli выделено 4 таких фермента, обозначаемых Рестриктазы - ферменты ДНК-азного действия, катализируют распад чужеродной (в основном фаговой) ДНК в строго определенных зонах молекулы, имеющих структуру палиндромов. Из Е. coli выделены и охарактеризованы две такие рестриктазы, обозначаемые EcoRI и EcoRII соответственно. Поскольку рестриктазы действуют на строго определенные участки молекулы, они используются для расшифровки последовательности нуклеотидных остатков в ДНК фагов и вирусов. Более того, это уникальное свойство рестриктаз находит все большее практическое применение в генной инженерии по "вырезанию" определенных фрагментов ДНК и "встраиванию" их в геном бактериальной ДНК, способствуя тем самым передаче клетке ряда не свойственных ей прежде наследственных свойств. Теоретическое и главным образом практическое значение подобных исследований трудно переоценить. Этим объясняется пристальное внимание многих ученых к разработке проблем генной инженерии. Свидетельством огромного интереса к подобным исследованиям является создание в рамках АН СССР и стран - участниц СЭВ комплексной программы - проекта "Рестриктазы". Из ферментов, катализирующих гидролитический распад РНК, наиболее изученными являются рибонуклеазы I. Они гидролизуют фосфодиэфирные связи внутри молекулы РНК. К настоящему времени выделена РНК-аза из поджелудочной железы многих животных. Она состоит из 124 аминокислот во всех РНК-азах, хотя последние несколько различаются по последовательности аминокислотных остатков; выяснена также третичная структура ряда РНК-аз. Получен в гомогенном состоянии из плесневого гриба аспергилла другой фермент - гуанилорибонуклеаза, катализирующая деполимеризацию РНК с образованием гуанозин-3-фосфата и олигонуклеотидов. Из ферментов, осуществляющих распад ДНК и РНК не по гидролитическому пути, следует назвать полинуклеотидфосфорилазу и группу ДНК-гликозидаз. Первая открыта в лаборатории С. Очоа еще в 1955 г. В настоящее время подробно изучены физико-химические свойства и биологическая роль микробной полинуклеотидфосфорилазы в лаборатории С. С. Дебова; в той же лаборатории фермент открыт в животных тканях. Механизм действия фермента сводится к переносу нуклеотидных остатков с РНК на неорганический фосфат: Предполагают, что in vivo фермент катализирует распад клеточных РНК, предпочтительнее мРНК, до нуклеозиддифосфатов, участвуя тем самым в регуляции концентрации клеточного неорганического фосфата. Следует указать еще на одну не менее важную уникальную функцию полинуклеотидфосфорилазы способность фермента катализировать в опытах in vitro синтез из свободных нуклеозиддифосфатов полирибонуклеотидов с заданной последовательностью. Эта функция фермента сыграла выдающуюся роль в расшифровке кода белкового синтеза (см. ниже) в лабораториях лауреатов Нобелевской премии С. Очоа и М. Ниренберга. Группа ДНК-гликозидаз участвует в акциях отщепления модифицированных пуриновых и пиримидиновых оснований (например, урацила, образовавшегося при дезаминировании остатка цитозина в одной из цепей ДНК). В серии последующих реакций при участии ДНК-полимеразы и ДНК-лигазы брешь восполняется включением соответствующего и отсутствующего мононуклеотида. Таким образом, ДНК-гликозидазы выполняют важную функцию в процессах репарации (восстановления структуры) молекулы ДНК. В результате последовательного действия разнообразных клеточных экзо- и эндонуклеаз нуклеиновые кислоты подвергаются распаду до стадии рибо- и дезоксирибонуклеозид-3'- и 5'-фосфатов. Дальнейший распад образовавшихся продуктов связан с ферментативными превращениями мононуклеотидов и нуклеозидов, далее свободных азотистых оснований. Известно, что адениловая кислота, кроме того, подвергается в животных тканях обратимому дезаминированию в инозиновую кислоту. На первом этапе гидролиза действуют 3'- или 5'-нуклеотидазы, катализирующие гидролитический распад мононуклеотидов по уравнению: На втором этапе распада имеет место перенос остатка рибозы от нуклеозида на свободную фосфорную кислоту с образованием рибозо-1-фосфата и свободного азотистого основания. По этому пути окисляются преимущественно пиримидиновые нуклеотиды (см. ниже). Распад пиримидиновых нуклеозидов Распад пуриновых нуклеозидов Последовательность ферментативных реакций гидролиза Последовательность пиримидиновых нуклеозидов представленной схемы: можно видеть ферментативных реакций из гидролиза пуриновых нуклеозидов можно видеть из представленной схемы: видно Как видно из приведенной схемы, начальные этапы Как образовавшиеся реакции распада пиримидиновых нуклеотидов катализируются специфическими ферментами; конечными мононуклеозиды из приведенной схемы, при гидролизе пуриновые аденозин и гуанозин продуктами реакции являются СO2, NH3, мочевина, β- подвергаются ферментативному (см. ниже) аланин и β-аминоизомасляная кислота. Следует указать, распаду в организме животных вплоть до что гидролитический путь распада пиримидинов является, образования конечного продукта очевидно, главным путем образования β-аланина, который кислоты, которая выводится с - мочевой мочой из может служить источником для синтеза ансерина и организма. карнозина (см. Биохимия мышц), а также для образования коэнзима А. Известно, кроме того, что β-аланин в У человека, приматов, большинства животных, у животных тканях подвергается дальнейшему распаду. В птиц и некоторых рептилий мочевая кислота конечным продуктом пуринового частности, в тканях животных открыта специфическая является трансаминаза, катализирующая трансаминирование обмена; у других рептилий и млекопитающих В мочевая кислота расщепляется до аллантоина, а процессе этой обратимой реакции синтезируются β- у рыб - до аллантоиновой кислоты и мочевины. аланин и формилацетат (полуальдегид малоновой Последовательность всех этих превращений катализируется специфическими ферментами, кислоты): между β-аланином и пировиноградной кислотой. указанными на схеме. Образовавшийся формилацетат далее подвергается окислительному декарбоксилированию с образованием углекислоты и ацетил-КоА: Обмен хромопротеидов Предыдущая: Распад нуклеиновых кислот Проблемы синтеза и распада хромопротеидов привлекают внимание как исследователей, так и практических врачей по двум основным причинам. Во-первых, вследствие широкого разнообразия биологически важных функций гемоглобина, хлорофилла и цитохромов (от фотосинтетических до тканевого дыхания), в которых центральную роль играет ядро порфирина (см. Химия сложных белков), обладающего способностью координационно связываться с ионами металлов. Во-вторых, потому, что изменения синтеза или распада порфиринов и соответственно их комплексов с белками приводят к нарушению жизненно важных функций и к развитию болезней у человека и животных. В данном разделе рассмотрены современные представления о синтезе и распаде железопорфиринов и, в частности, гемоглобина, наиболее важного для человека хромопротеида. В организме человека содержится около 4,5-5,0 г железа. На долю гемоглобина крови из этого количества (если взять за 100% все железо в организме) приходится 60-70%, на долю многлобина -3-5%, ферритина 20% (от 17 до 23%), трансферрина - около 0,18%, функционального железа тканей - до 5%. Содержание железа в организме человека и животных регулируется главным образом интенсивностью всасывания пищевого железа в кишечнике. Избыток его просто не всасывается. Потребность в железе резко возрастает при анемиях различного происхождения. Данные о месте всасывания пищевого железа, механизме его транспорта, отложения и мобилизации из депо можно представить в виде следующей модифицированной таблицы, заимствованной у Кантарова и Шепарц (табл. 41). Пищевое железо всасывается в кишечнике в виде неорганического двухвалентного железа (Fe 2+) после освобождения его из комплексов с белками. В клетках слизистой оболочки кишечника железо уже в трехвалентной форме (Fe3+ соединяется с белком апоферритином с образованием стабильного комплекса ферритина. Дальнейший транспорт железа к местам кроветворения осуществляется в комплексе с β 1глобулинами сыворотки крови (комплекс получил название трансферрина) или железо соединяется с апоферритином тканей и в виде ферритина депонируется (см. табл. 41). При некоторых заболеваниях (в частности, при гемохроматозе) избыток железа откладывается в клетках ретикулоэндотелиальиой системы в виде гемосидерина, метаболически инертного соединения железа с белком. Источниками железа для синтетических целей являются пищевые продукты, а также железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезенки (около 25 мг Fe за сутки). Что касается железа пищевых хромопротеидов (гемоглобина, миоглобина и др., включая хлорофиллпротеиды), то имеющиеся данные свидетельствуют о том, что простетические группы этих соединений не используются для синтеза железопротеидов организма, поскольку после переваривания небелковый компонент - гем - подвергается окислению в гематин, который, так же как и хлорофилл, не всасывается в кишечнике. Обычно эти пигменты выделяются с калом в неизмененной форме или в виде продуктов распада под действием кишечных бактерий. Следовательно, синтез сложного пиррольного комплекса в организме протекает из низкомолекулярных предшественников de novo, а не путем обращения химических реакций распада гемсодержащих соединений. Биосинтез гемоглобина Предыдущая: Обмен хромопротеидов Учитывая химический состав гемоглобина, проблему его биосинтеза можно свести к синтезу его простетической группы, в частности к синтезу тетрапиррольного соединения - гема. К настоящему времени почти полностью выяснены основные пути образования порфиринов и протопорфиринов, т. е. тетрапирролов (см. Химия сложных белков), являющихся непосредственными предшественниками гема и хлорофилла. Благодаря исследованиям Шемина и др. выяснены основные пути синтеза гема. С помощью меченых предшественников было показано, что в синтезе гема в бесклеточных экстрактах эритроцитов птиц специфическое участие принимают глицин, уксусная и янтарная кислоты. Источником всех 4 атомов азота и 8 атомов углерода тетрапиррольного кольца является глицин. Источником остальных 26 из 34 атомов углерода является янтарная кислота, точнее ее производное - сукцинил-КоА. Последовательность химических реакций синтеза тетрапирролов в организме животных можно условно разделить на следующие стадии. В первой стадии, протекающей в два этапа, сукцинил-КоА взаимодействует с глицином с образованием δаминолевулиновой кислоты (δ-АЛК): Эту стадию катализирует специфический пиридоксальфосфатзависимый фермент δ-аминолевулинатсинтаза - ключевой, аллостерический фермент синтеза тетрапирролов во всех живых организмах. Впервые эта синтаза была обнаружена в эндоплазматической сети клеток печени. Фермент индуцируется стероидами и другими факторами и ингибируется гемом. Во второй стадии имеет место конденсация 2 молекул δ-аминолевулиновой кислоты с образованием первого монопиррольного соединения - порфобилиногена (ПБГ): Фермент, катализирующий эту стадию, порфобилиногенсинтаза, также является регуляторным ферментом, ингибируемым конечными продуктами синтеза. Предполагается, что механизм этой сложной реакции дегидратации включает образование ке-тиминной связи (шиффово основание) между кетогруппой одной молекулы δ-аминолевулиновой кислоты и ε-аминогруппой лизина молекулы фермента. В следующей многоступенчатой стадии, катализируемой ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется тетрапиррольный комплекс протопорфирин IX, являющийся непосредственным предшественником гема. Некоторые этапы этого сложного пути синтеза окончательного не установлены. В заключительной стадии протопорфирин IX присоединяет молекулу железа при участии гемсинтетазы (или феррохелатазы) и образуется гем. Последний используется для биосинтеза всех гемсодержащих хромопротеидов. Источником железа для этой реакции является ферритин, который считается резервным гемопротеидом, откладывающимся в клетках костного мозга, печени и селезенки. Имеются указания, что, помимо железа, в синтезе гема участвуют некоторые кофакторы, в частности витамин В 12, тетрагидрофолат, ионы меди и др. Таким образом, весь путь синтеза гема может быть представлен в следующей схеме, в которой даны полные и сокращенные обозначения промежуточных метаболитов и ферментов: Распад гемоглобина в тканях (образование желчных пигментов) Предыдущая: Биосинтез гемоглобина Продолжительность жизни эритроцитов, как известно, составляет 120 дней; после этого происходит их разрушение и освобождение гемоглобина. Главными органами, в которых осуществляется разрушение эритроцитов и распад гемоглобина, являются печень, селезенка и костный мозг, хотя в принципе оба процесса могут происходить и в клетках других органов. Распад гемоглобина в печени начинается с разрыва α-метиновой связи между I и II кольцами порфиринового кольца. Этот процесс катализируется НАДФ-содержащей оксидазой и приводит к образованию зеленого пигмента вердоглобина (холеглобина) по уравнению: В приведенных структурных формулах здесь и ниже в желчных пигментах: М — это СН3, В = —СН=СН2, П = —СН2—СН2—СООН. Как видно из приведенных формул, в молекуле вердоглобина еще сохраняются как атoм железа, так и белковый компонент. Имеются экспериментальные доказательства, что в этом окислительном превращении гемоглобина принимают участие витамин С, ионы двухвалентного железа и другие кофакторы. Дальнейший распад холеглобина, вероятнее всего, происходит спонтанно с освобождением железа, белкаглобина и образованием одного из желчных пигментов — биливердина. Спонтанный распад сопровождается перераспределением двойных связей и атомов водорода в пиррольных кольцах и метиновых мостиках. Образовавшийся биливердин ферментативным путем восстанавливается в печени в билирубин, являющийся основным желчным пигментом у человека и плотоядных животных: Основным местом образования билирубина являются печень, селезенка и, по-видимому, эритроциты (при распаде которых иногда разрывается одна из метиновых связей в протопорфирине). Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе с желчью изливается в желчный пузырь. Билирубин, образовавшийся в клетках ретикулоэндотелия, имеет название свободного, или «непрямого», билирубина, поскольку из-за плохой растворимости в воде он легко адсорбируется на белках плазмы крови, и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин вступает во взаимодействие с диазореактивом Эрлиха. В крови взрослого здорового человека содержится относительно постоянное количество билирубина — от 2,5 до 12 мг/л, в среднем 8 мг/л. Около 75% этого количества приходится на долю «непрямого» т. е. свободного, билирубина. Повышение его концентрации в крови до 20 мг/л приводит к развитию желтухи. Более высокий уровень билирубина в крови вызывает явления тяжелого отравления. Свободный билирубин, поступая с током крови в печень, подвергается обезвреживанию путем связывания с глюкуроновой кислотой. В этом процессе принимает участие особый фермент УДФ-глюкуронилтрансфераза, и УДФ-глюкуроновая кислота, являющаяся донатором глюкуроновой кислоты. В этой реакции к билирубину присоединяется два остатка глюкуроновой кислоты с образованием сравнительно индифферентного комплекса — билирубиндиглюкуронида, хорошо растворимого в воде и дающего прямую реакцию с диазореактивом. В желчи всегда присутствует «прямой» билирубин. В крови количество и соотношение между «прямым» и «непрямым» билирубином резко меняются при поражениях печени, селезенки, костного мозга, болезнях крови и т. д., поэтому определение обеих форм билирубина в крови имеет существенное значение в клинике при дифференциальной диагностике различных форм желтухи. При желчнокаменной болезни в составе желчных камней наряду с основным их компонентом — холестерином — всегда обнаруживается свободный билирубин. Из-за плохой растворимости в воде он выпадает в осадок в желчном пузыре в виде билирубината кальция, участвующего в формировании камней. Дальнейшая судьба желчных пигментов, точнее билирубина, связана с их превращениями в кишечнике под действием бактерий. Сначала глюкуроновая кислота отщепляется от комплекса с билирубином, и освободившейся билирубин подвергается восстановлению в стеркобилиноген, который и выводится с калом. В сутки человек выделяет около 300 мг стеркобилиногена. Стеркобилиноген легко окисляется под действием света и воздуха в стеркобилин. Механизм бактериальных превращений билирубина до стеркобилиногена во многих отношениях еще не расшифрован. Имеются данные, свидетельствующие о том, что промежуточными продуктами восстановления являются последовательно мезобилирубин и затем мезобилиноген (уробилиноген). После всасывания небольшая часть мезобилиногена поступает через воротную вену в печень, где подвергается разрушению с образованием моно- и дипиррольных соединений. Кроме того, очень небольшая часть стеркобилиногена после всасывания через систему геморроидальных вен попадает в большой круг кровообращения, минуя печень, и в таком виде выводится почками с мочой. Однако называть его уробилиногеном не совсем точно. Суточное содержание стеркобилиногена в моче составляет около 4 мг, и, пожалуй, именно стеркобилиноген является нормальной органической составной частью мочи. Если же с мочой выделяется повышенное содержание уробилиногена (точнее, мезобилиногена), то это является свидетельством недостаточности, функции печени, например при паренхиматозных или гемолитических желтухах, когда печень частично теряет способность извлекать этот пигмент из крови воротной вены. Однако химически уробилиноген (мезобилиноген) не является идентичным стеркобилиногену (уробилиногену) мочи. Исчезновение стеркобилиногена (уробилиногена) из мочи при наличии билирубина и биливердина является свидетельством полного прекращения поступления желчи в кишечник. Такое состояние часто наблюдается при закупорке или протока желчного пузыря (желчнокаменная болезнь) или общего желчного протока (желчнокаменная болезнь, раковые поражения поджелудочной железы человека и др.). Таким образом, количественный и качественный анализ желчных пигментов в моче может представлять большой клинический интерес.