Лабораторная работа №8 - Чувашский государственный
реклама

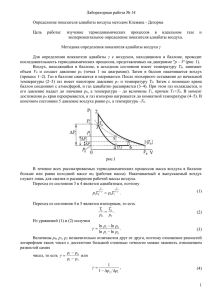
Лабораторная работа №3 ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ МОЛЯРНЫХ ТЕПЛОЕМКОСТЕЙ СР/СV ДЛЯ ВОЗДУХА Цель работы. экспериментальное определение показателя адиабаты = Ср/Сv для воздуха. Теоретические основы работы Адиабатным (адиабатическим) называют термодинамический процесс, происходящий в термодинамической системе без подвода теплоты. Первое начало термодинамики для произвольного термодинамического процесса имеет вид Q = dU + А. (1) Здесь Q - бесконечно малое количество теплоты, подводимое к термодинамической системе; dU - бесконечно малое изменение внутренней энергии системы; А - бесконечно малая работа, совершаемая термодинамической системой в результате данного процесса. Для адиабатного процесса соотношение (1) принимает вид dU + А = 0 (2) для одного моля идеального газа имеем dU = СvdT; (3) = рdV. (4) Здесь Сv - молярная теплоемкость при постоянном объеме газа; р - давление; dV и dT - бесконечно малые изменения температуры и объема соответственно. Подставляя (3) и (4) в (2), получим CvdT + рdV = 0 (5) Для одного моля идеального газа запишем уравнение Клайперона pV = RT. Дифференцируя его, найдем связь между параметрами dp, dV и dT: рdV + Vd p = RdT. (6) Из (6) получим 1 (7) dT pdV Vd p R Подставляя (7) в (5), получим дифференциальное уравнение, связывающее объем и давление идеального газа в адиабатном процессе (Сv + R)pdV + Сvdp = 0 (8) Учитывая, что СV + R = Ср - молярная теплоемкость идеального газа при постоянном давлении, и вводя обозначение Сp СV , (9) из (8) получим dV d p (10) 0 V p Известно, что для идеального газа молярные теплоемкости Ср и Сv не зависят от температуры: i2 Cр R; 2 (11) i CV R 2 (здесь i - число степеней свободы молекулы идеального газа). Считая воздух при атмосферном давлении идеальным газом, получаем, что показатель постоянная для данного газа величина. В этом случае решение дифференциального уравнения (10) имеет вид рV = const (12) (в этом можно убедиться непосредственной подстановкой). Уравнение (12) называют уравнением адиабаты (уравнением Пуассона), а показатель - показателем адиабаты (показателем Пуассона). Описание установки. Вывод расчетных формул Экспериментальная установка (рис. 1) состоит из стеклянного баллона 1, наполненного воздухом. Баллон соединен с манометром 2 и насосом 3. на рис.1 обозначены также кран 4 и кран 5, с помощью которого баллон может быть соединен с атмосферой. Поперечное сечение крана 5 достаточно велико. процесс установления атмосферного давления в сосуде происходит достаточно быстро. 5 3 2 насос 4 Рис. 1. Схема экспериментальной установки Н 1 Быстрое изменение давления в сосуде происходит практически без теплообмена с окружающей средой, поэтому процесс, происходящий при открывании кран 5, с достаточной точностью можно считать адиабатным. Пусть с помощью насоса 3 в баллон накачали воздух, затем закрыли кран 4. Через несколько минут температура воздуха в баллоне станет равной температуре в лаборатории. Обозначим эту температуру Т1. Давление воздуха в баллоне р1 при этом равно р1 = р0 + р'. (13) здесь р0 - атмосферное давление; р' - избыточное давление воздуха, которое можно определить по показаниям манометра. Выберем мысленно в сосуде объем V (рис.1) вдали от клапана. будем считать, что число молекул в этом "объеме" неизменно. Начальное состояние воздуха в объеме характеризуется параметрами р1, Т1, V1 . Если открыть на короткое время кран 5, то часть воздуха выйдет из сосуда, давление в сосуде станет равным р2 = р0, выбранный нами "объем" увеличится до значения V2. Температура воздуха понизится, так как при вытекании из сосуда воздух совершает работу против давления окружающего баллон воздуха. Итак, Т2<Т1. В тот момент времени, когда кран закрывают, состояние "объема" характеризуется параметрами р2, Т2, V2. Считая переход из состояния 1 в состояние 2 адиабатным процессом, из (12) получим р1 V1 = р2 V2. (14) После того как кран 5 закрыли, происходит изохорный процесс теплообмена с окружающей средой; температура воздуха приближается к температуре в лаборатории Т1, давление воздуха по окончании этого процесса р3 = р0 + р", (15) где р" измеряется по манометру. Параметры воздуха после окончания изохорного процесса р3, Т1, V3, причем V3= V2. Так как температуры воздуха в первом и третьем состоянии одинаковы, а число молекул в выбранном нами "объеме" постоянно (объем V выбран вдали от крана), то для состояний 1 и 3 можно применить закон БойляМариотта р1V1=р3V3=р3V2. (16) Решая систему уравнений (14), (16), получим р3 р 2 . р1 р1 Прологарифмировав это соотношение, найдем p ln 1 p2 . p1 ln p3 Используя соотношения (13) и (15), получим p' ln 1 p0 . (17) p" ln 1 p0 Так как избыточные давления р' и р" весьма малы по сравнению с атмосферным давлением р0, можно использовать разложение функции типа ln(1+х) в ряд, ограничившись первым членом разложения (при х « 1): ln(1+х) х. Отсюда из (17) получаем р . (18) p p Избыточное давление, определяемое по манометру, можно выразить соотношением р = h, (19) где h - разность уровней жидкости в манометре; - постоянный для данного манометра коэффициент, зависящий от плотности жидкости. Из (18) и (19) получаем 1 . (20) 1 h0 / H Здесь Н и h0 - разности уровней жидкости в манометре в первом и третьем состояниях. Отметим, что значение h0 соответствует условию, что кран 5 закрыли точно в момент окончания адиабатного процесса. Если закрыть кран 5 раньше (до выравнивания давлений) или спустя некоторое время после адиабатного процесса, то результат вычислений по формуле (20) даст в первом случае завышенное, во втором случае - заниженное значение . Для получения наиболее точного экспериментального значения необходимо закрыть клапан точно в момент окончания адиабатного процесса. Так как мы не знаем времени протекания адиабатного процесса, значение разности уровней определяют косвенным графическим методом. Р 1 Р1 V1 Т1 Рис.2. Процессы, происходящие в опыте 3 2 5 4 V Пусть кран 5 остается открытым в течение некоторого времени . В этом случае процессы, происходящие в объеме V, можно условно изобразить графически (рис. 2). Примечание. Процессы, происходящие в сосуде, не являются квазиравновесными, поэтому графики, строго говоря, строить нельзя (в случае неравновесного процесса нельзя говорить о давлении и температуре газа, так как в разных частях баллона эти величины могут иметь различные значения). На рис.2, обозначены: 1-2 - адиабатный процесс, 2-4 - изобарный процесс, процесс протекающий в баллоне при открытом клапане после завершения адиабатного расширения, 4-5 - изохорный процесс, протекающий после закрытия клапана. Точки 1,3,5 лежат на изотерме, соответствующей температуре Т1. Очевидно, что с ростом разность уровней жидкости в манометре h будет уменьшаться, соответственно уменьшается и (p5-p4). При получим h0, при 0 (длительность адиабатного расширения весьма мала) получим hh0. Измеряя h при различных значениях и строя график зависимости ln(h/H)=f(), можно найти значение h0 экстраполяцией экспериментальной прямой (рис.3). Порядок выполнения работы 1. Выписать данные спецификации измерительных приборов, данные установки, условия опыта. 2. Насосом 3 (рис.1) накачать в баллон 1 воздух так, чтобы разность уровней жидкости в манометре стала равной 25-30 см. Закрыть кран 4, выждать 24 минуты до тех пор, пока температура воздуха в баллоне не станет равной температуре окружающего воздуха (уровни жидкости в манометре стабилизируются). Провести дополнительную регулировку разностей уровней (в дальнейших опытах начальную разность уровней нужно будет поддерживать постоянной). По верхнему и нижнему уровням мениска определить уровни жидкости L1 и L2 в коленах манометра; записать разность уровней жидкости, H = L1 - L2 в таблицу 1. 3. Резко открыть кран 5, соединив баллон с атмосферой. Одновременно включить секундомер, выдержать кран открытым в течение заданного времени ; после этого закрыть кран. Через 3-4 минуты (после того, как уровни жидкости в манометре стабилизируются), определить уровни L1() и L2(), записать значения L1(), L2(), h= L1() - L2() в таблицу 2. 4. Повторить опыты (пункты 2-3) не менее пяти раз для разных значений . Рекомендуемые значения : 3; 6; 9; 12; 15 секунд. Следить за тем, чтобы начальная разностей уровней Н была постоянной. Примечание. Накачивать воздух в баллон целесообразно медленно (чтобы избежать значительного повышения температуры воздуха в баллоне) и осторожно (чтобы нижний уровень жидкости не достиг колена манометра). Данные установки и таблица результатов измерений Температура воздуха Т1 = ; Т1 = ; атмосферное давление р0 = , р0 = . Погрешности измерения разностей уровней Н = h принять равными h = 2 мм. Таблица 1 № L1, см L2, см H=L1-L2, см опыта , с № опыта L1(), см L2(), см Таблица 2 h=L1()-L2(), см Обработка результатов измерений h 1. Рассчитать значения ln τ для всех значений . H 2. Нанести полученные экспериментальные точки на график (рис.3), где по h оси абсцисс отложено время , по оси ординат - значения ln τ . H h ln τ H 0 ln h0 H , c Рис.3. Графическая обработка экспериментальных данных Примечание. Масштаб графика согласовать с преподавателем. 3. Аппроксимировать полученную зависимость прямой линией, экстраполировав ее до пересечения с осью ординат. Точка пересечения имеет координату ln(h0/H). 4. Определить значение h0/H. 5. По формуле (20) определить экспериментальное значение . 6. Для оценки погрешности необходимо сделать следующее: для каждой экспериментальной точки вверх и вниз отложить на графике значения h h h h ln τ и ln τ . Полученные таким образом точки образуют H H полосу. Обозначим через у0 расстояние между точками пересечения прямых, ограничивающих полосу с осью ординат. Тогда 1 δh h h h h — 0 ln 0 . (21) ln 0 ln 1 δh H H 0 0 Учитывая, что δ h 1, разложим (21) в ряд Маклорена, ограничив0 шись первыми двумя членами разложения. Отсюда получим y — 0 2δ h ; δ h 0 . Таким образом, δ h y0 2 . 2 Окончательно получаем соотношение для погрешности косвенного измерения : y δ δ 2 h δ 2 H 0 . 2 7. Записать результат с учетом погрешности измерения. 8. Сравнить экспериментальное значение с теоретическим значением (воздух считать двухатомным идеальным газом). 0 0 0 0 Контрольные вопросы и задания 1. Дайте определения адиабатного, изохорного, изобарного и изотермического термодинамических процессов. 2. Какую величину называют показателем адиабаты (показателем Пуассона)? От каких факторов зависит значение показателя адиабаты для идеального газа? 3. Рассчитайте теоретическое значение показателя адиабаты для одноатомного и трехатомного идеальных газов. 4. Дайте определение квазистатического термодинамического процесса. 5. Какие процессы осуществляются в данной лабораторной работе? Расскажите о них. 6. Изобразите на графиках адиабатный, изохорный, изобарный и изотермический квазистатические процессы. Объясните, почему, строго говоря, нельзя графически изобразить быстро протекающие процессы. Литература 1. Савельев И.В. Общий курс физики. Т.1. Механика. Молекулярная физика. М.: Наука, 1986, с.277-282. 2. Сивухин Д.В. Общий курс физики. Т.2. Термодинамика и молекулярная физика. М.: Наука, 1979, с. 67-68, 75-78, 82-83. 3. Механика и молекулярная физика. /Канасков Д.Р., Вентцель Л.И., Федорова И.П. М.: Москэнергет ин-т, 1976, с.160-166. МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное образовательное учреждение высшего профессионального образования «Чувашский государственный университет им. И.Н. Ульянова» Кафедра общей физики ЛАБОРАТОРНАЯ РАБОТА № 3 ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ МОЛЯРНЫХ ТЕПЛОЕМКОСТЕЙ Ср/Сv ДЛЯ ВОЗДУХА