Фундаментальные основы пластичности нервной системы
реклама
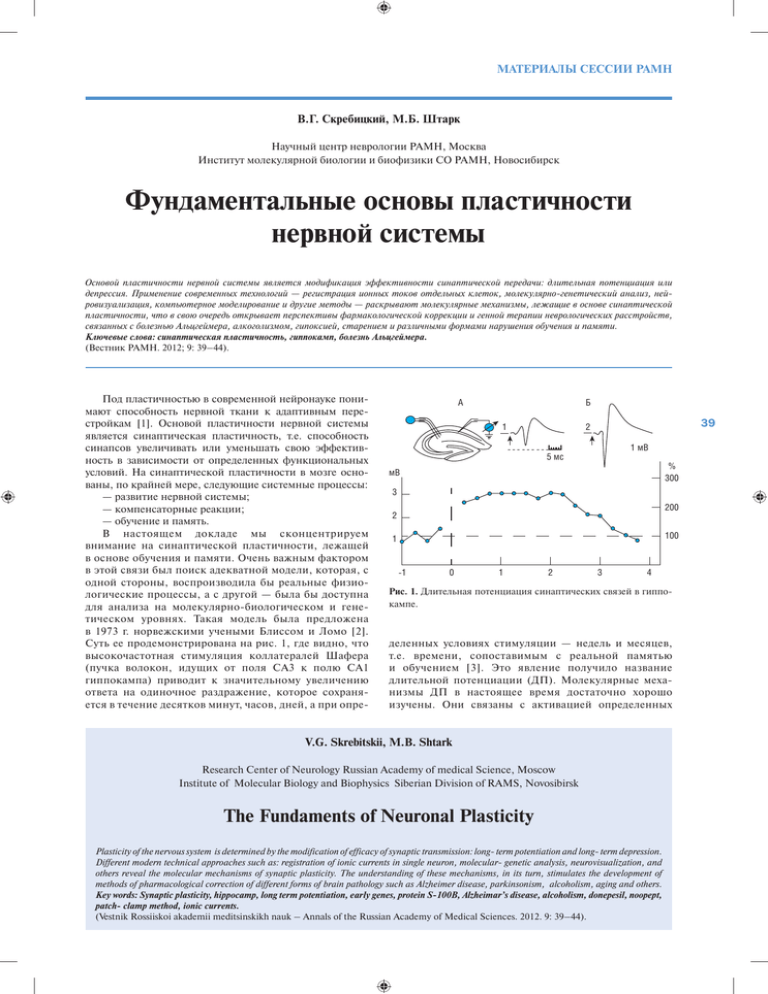
МАТЕРИАЛЫ СЕССИИ РАМН В.Г. Скребицкий, М.Б. Штарк Научный центр неврологии РАМН, Москва Институт молекулярной биологии и биофизики СО РАМН, Новосибирск Фундаментальные основы пластичности нервной системы Основой пластичности нервной системы является модификация эффективности синаптической передачи: длительная потенциация или депрессия. Применение современных технологий — регистрация ионных токов отдельных клеток, молекулярно-генетический анализ, нейровизуализация, компьютерное моделирование и другие методы — раскрывают молекулярные механизмы, лежащие в основе синаптической пластичности, что в свою очередь открывает перспективы фармакологической коррекции и генной терапии неврологических расстройств, связанных с болезнью Альцгеймера, алкоголизмом, гипоксией, старением и различными формами нарушения обучения и памяти. Ключевые слова: синаптическая пластичность, гиппокамп, болезнь Альцгеймера. (Вестник РАМН. 2012; 9: 39–44). Под пластичностью в современной нейронауке понимают способность нервной ткани к адаптивным перестройкам [1]. Основой пластичности нервной системы является синаптическая пластичность, т.е. способность синапсов увеличивать или уменьшать свою эффективность в зависимости от определенных функциональных условий. На синаптической пластичности в мозге основаны, по крайней мере, следующие системные процессы: — развитие нервной системы; — компенсаторные реакции; — обучение и память. В настоящем докладе мы сконцентрируем внимание на синаптической пластичности, лежащей в основе обучения и памяти. Очень важным фактором в этой связи был поиск адекватной модели, которая, с одной стороны, воспроизводила бы реальные физиологические процессы, а с другой — была бы доступна для анализа на молекулярно-биологическом и генетическом уровнях. Такая модель была предложена в 1973 г. норвежскими учеными Блиссом и Ломо [2]. Суть ее продемонстрирована на рис. 1, где видно, что высокочастотная стимуляция коллатералей Шафера (пучка волокон, идущих от поля СА3 к полю СА1 гиппокампа) приводит к значительному увеличению ответа на одиночное раздражение, которое сохраняется в течение десятков минут, часов, дней, а при опре- А Б 1 39 2 1 мВ 5 мс % 300 мВ 3 200 2 100 1 -1 0 1 2 3 4 Рис. 1. Длительная потенциация синаптических связей в гиппокампе. деленных условиях стимуляции — недель и месяцев, т.е. времени, сопоставимым с реальной памятью и обучением [3]. Это явление получило название длительной потенциации (ДП). Молекулярные механизмы ДП в настоящее время достаточно хорошо изучены. Они связаны с активацией определенных V.G. Skrebitskii, M.B. Shtark Research Center of Neurology Russian Academy of medical Science, Moscow Institute of Molecular Biology and Biophysics Siberian Division of RAMS, Novosibirsk The Fundaments of Neuronal Plasticity Plasticity of the nervous system is determined by the modification of efficacy of synaptic transmission: long- term potentiation and long- term depression. Different modern technical approaches such as: registration of ionic currents in single neuron, molecular- genetic analysis, neurovisualization, and others reveal the molecular mechanisms of synaptic plasticity. The understanding of these mechanisms, in its turn, stimulates the development of methods of pharmacological correction of different forms of brain pathology such as Alzheimer disease, parkinsonism, alcoholism, aging and others. Key words: Synaptic plasticity, hippocamp, long term potentiation, early genes, protein S-100B, Alzheimar’s disease, alcoholism, donepesil, noopept, patch- clamp method, ionic currents. (Vestnik Rossiiskoi akademii meditsinskikh nauk – Annals of the Russian Academy of Medical Sciences. 2012. 9: 39–44). ВЕСТНИК РАМН /2012/ № 9 подтипов глутаматных рецепторов, входом в клетку ионов кальция, запуском внутриклеточных биохимических каскадов, транслокацией циклического аденозинмонофосфата (цАМФ) в ядро клетки, акти- вацией ранних генов, и, в конечном счете, изменением конформации рецепторного белка и его чувствительности к глутамату, а также образованием новых синапсов (рис. 2). Nucleus CRE CRE CREB-1 p p МАР Kinase cAMP kinase R(AB) 40 CA3 CA1 NMDA receptor Adenylyl cyclase CA2+ CA2+/ саlmodulin Glu hansed nsmitter ease P AMPA reseptor ? CA2+/ саlmodulin kinase РКС New AMPA reseptor Early LTP Glu Tyrosine kinase (Fyn) Effector (tPA, BDNF) Retrograde signal generator P Retrograde messenger NO? cAMP NMDA receptor AMPA receptor Рис. 2. Молекулярные механизмы длительной потенциации. Regular (C/EBPB) МАТЕРИАЛЫ СЕССИИ РАМН egr1 3 2 * ** 3 ** 1 0 cjun 2 1 30 60 120 0 2 1 30 60 cfos 3 * 120 0 * * 30 60 120 мин Рис. 3. Динамика содержания мРНК egr-1, c-jun, c-fos при длительной потенции в поле CA1 гиппокампа крысы. Примечание. По оси абсцисс — время после тетанизации, по оси ординат — кратность увеличения экспрессии относительно контроля (нететанизированные срезы). * — р<0,05; ** — р<0,01. Поскольку активация ранних генов является одним из ключевых звеньев в этой цепочке процессов, мы задались целью изучить динамику содержания матричной рибонуклеиновой кислоты (мРНК) для трех ранних генов во время развития ДП. С использованием метода цепной полимеразной реакции (ПЦР) нами было показано, что содержание, по крайней мере, двух из них (erg-1 c-jun) растет параллельно с развитием ДП [4] (рис. 3). На рис. 4 в виде схемы представлены основные процессы, происходящие в шипике дендрита во время ДП. Упомянутая выше активация ранних генов приводит к транскрипции мРНК, которая транспортируется в шипик a Basal state дендрита и там под влиянием выделяющегося медиатора запускает цепь биохимических процессов, приводящих к реструктуризации формы шипика, увеличению постсинаптического уплотнения (т.е. числа постсинаптических рецепторов) и, в конечном счете, увеличению синаптической эффективности [5]. Необходимо также отметить, что помимо возрастания содержания мРНК белков, определяющих эффективность синаптической передачи, нами было обнаружено увеличение содержания мРНК белка S-100B, представленного в основном в глиальных клетках, что поднимает важный вопрос об участии астроглии в регуляции эффективности синаптической передачи [6] (рис. 5). Далее будет рассмотрен вопрос о возможности использования ДП в гиппокампе для анализа различных форм мозговой патологии, связанной с нарушением синаптической пластичности, и путей их фармакологической коррекции. К изучаемым формам патологической пластичности относятся, по крайней мере, следующие: — действие амилоидного пептида (болезнь Альцгеймера); — алкоголизм; — гипоксия; — старение; — «генетические нокауты». Мы остановимся более подробно на изучении двух первых форм нарушений синаптической пластичности. b Translation activation Presynaptic cell Synaptic activation c Arc-dependent consolidadion Retrograde signalling P P Translation activation Postsynaptic cell Sustaned Arc translation Arc transcription F-actin New F-actin NMDA receptor New Arc mRNA AMP receptor Glutamate BDNF Arc PSD Cofilin TrkB RNA – containing granule P Phosphate Stored mRNA (αCaMKll) Рис. 4. Синаптическая стимуляция приводит к активации синтеза белков в шипике: увеличению числа актиновых нитей и постсинаптических рецепторов. 41 ВЕСТНИК РАМН /2012/ № 9 S100B ** 3 * 2 1 0 30 60 120 Рис. 5. Динамика содержания мРНК S100B при длительной потенции в поле CA1 гиппокампа крысы. Примечание. По оси абсцисс — время после тетанизации, по оси ординат — кратность увеличения экспрессии относительно контроля (нететанизированные срезы). * — р<0,05; ** — р<0,01. (a) Abeta 200 nM + donepezil (μM) 200 Pop-spike (% of baseline) Control 1 μM 0.1 μM 150 100 50 0 0 10 40 30 20 50 60 Time (min) HFS (b) 1 2 1 2 1 2 Abeta 200 nM Control 0.1 μM 1 2 0.5 μM 2 mV 1 2 5 ms 1 μM Abeta 200 nM + donepezil (μM) Рис. 6. Донепезил восстанавливает длительную потенциацию, нарушенную амилоидным пептидом (Abeta). a CA3 cells) dal mi yra регистрирующий электрод CA1 Mossy fibres Schaffer collateral– commissuar fibres Dentate gyrus (Granule cells ) 200 150 150 Perforant path Lateral 100 Medial f c % 200 мин 100 2mB 50 30 15 % b % стимулирующий электрод (P 42 0.5 μM Хорошо известно, что болезнь Альцгеймера, являющаяся тяжелым нарушением когнитивных способностей, связана с образованием в мозговой ткани бляшек, образованных β-амилоидным пептидом (Abeta). Механизмы повреждающего действия Abeta на синаптическую пластичность изучены далеко не полно. Мы провели исследование, в котором показали, что введение пептида в проточную жидкость, в которой находится срез гиппокампа, до начала высокочастотной стимуляции приводит к полному подавлению индукции ДП [7]. В то же время введение в проток вместе с Abeta донепезила (препарата, используемого для лечения болезни Альцгеймера) устраняет повреждающее действие пептида дозозависимым способом (рис. 6). Более детально механизмы этого эффекта еще предстоит выяснить. Другой моделью патологического нарушения когнитивных способностей является подавление ДП при введении в проточную жидкость этилового спирта, который помимо прочих его эффектов является блокатором НМДА (N-метил-D-аспартат) подтипа глутаматных рецепторов, что, видимо, определяет его повреждающее действие на ДП. Нами было исследовано действие на синаптические процессы ряда коротких пептидов, обладающих ноотропной активностью и синтезированных в НИИ фармакологии РАМН [8]. Один из них, синтезированный на основе пролина и получивший название Ноопепт, используется в клинической практике и продается в аптеках. Нами было обнаружено, что Ноопепт (наряду с другим пептидом — пироглютамиласпарагином) обладает способностью восстанавливать ДП, нарушенную алкоголем [8] (рис. 7). Для более детального исследования препарата, мы проанализировали механизм его действия на ионные токи в отдельных пирамидных клетках поля СА1 срезов гиппокампа. На рис. 8 показаны пирамидные клетки в слое stratum pyramidalis (слева) и отдельная клетка с регистрирующим микроэлектродом (справа); внизу приведены спонтанные тормозные токи, зарегистрированные 5ms 0 15 30 45 60 d % 2mB 50 30 15 % 250 200 200 150 150 200 100 150 мин 5ms 0 15 30 45 60 e ** * 100 50 30 15 0 15 30 45 60 50 30 15 100 0 15 30 45 60 контроль этанол + Ноопепт + АВП Рис. 7. Нарушение длительной потенциации в гиппокампе под действием этанола и ее восстановление при совместной аппликации этанола с Ноопептом и АВП(4-9). МАТЕРИАЛЫ СЕССИИ РАМН Пирамидные клетки в поле СА1 гиппокампа в этой клетке. На рис. 9 представлен типичный пример увеличения ноопептом амплитуды (А–E) и частоты (F) спонтанных тормозных токов. Усиление тонического торможения нейронов гиппокампа, очевидно, лежит в основе анксиолитического действия препарата, возможно, в какой-то степени опосредующего его ноотропную активность. Другая, мнемотропная сторона его действия, возможно, связана с модуляцией глутаматергической передачи, что является дальнейшей задачей нашего исследования. Path-clamp регистрация ΔT 100 pA 100 (ms) f (Hz) = 1000/Δ T (ms) Рис. 8. 43 А B E Noopept (n=307) Control (n=231) Wash (n=215) 100 pa 75 control 50 10 pA 25 20 msec 0 F D 125 2.0 0.8 100 1.5 0.6 75 Control Noopept Wash 0.4 0.2 0.0 0 50 100 pA 150 200 Hz 1.0 n Cumulative probability Noopept 400 pA 100 ms C 50 Control Noopept 25 0 Control Noopept Wash * * * 1.0 0.5 Noopept 0.0 0 50 100150200250300350400 -2 -1 0 1 2 3 4 5 6 7 8 9 101112 pA min Рис. 9. Действие Ноопепта на амплитуду и частоту спонтанных ТПСТ в пирамидных нейронах поля CA1. ЛИТЕРАТУРА 1. 2. 3. 4. 5. Kandel E.R., Schwartz J.H., and Jessell T.M. Principles of Neuronal Science. McGrow-Hill. 2000. Bliss T.V.P., Lomo T. Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. J Physiol. 1973; 232: 331–336. Скребицкий В.Г. Влияние нейрорегуляторов на синаптическую активность гиппокампа. Успехи физиологичеких наук. 1985; 4: 35-48. Соколова О.О., Штарк М.Б., Лисачев П.Д., Пустыльняк В.О., Эпштейн О.И. Динамика экспрессии ранних генов при долговременной посттетанической потенциации в поле СА1 гиппокампа крыс. БЭБиМ. 2009; 147: 227–229. Bramham C.R., Wells D.C. Dendritic mRNA: transport and function. Nature Publishing Group. 2007; 8: 776–789. 6. 7. 8. Lisachev P.D., Shtark М.B., Sokolova O.O., Pustylnyak V.O., Salakhutdinova M.Yu., Epstein O.I. A Comparison of the Dynamics of S100B, S100A1, and S100A6 mRNA Expression in Hippocampal CA1 Area of Rats during Long-TermPotentiation and after LowFrequency Stimulation. Cardiovascular Psychiatry and Neurology. 2010; Article ID 720958: 1–6. Kapai N.A., Bukanova Yu.V., Solntseva E.I., Skrebitsky V.G. Donepezil in a narrow concentration range augments control and impaired by beta-amiloid peptide hippocampal LTP in NMDA- independent manner. Cell. Molec. Neurobiol. 2012; 32: 219–226. Гудашева Т.А., Островская Р.У., Трофимов С.С. Пептидные аналоги пирацетама как лиганды предполагаемых ноотропных рецепторов. Хим. Фарм. Журн. 1985; 11: 1322–1328. ВЕСТНИК РАМН /2012/ № 9 8. Капай Н.А, Чепкова А.Н., Гудашева Т.А., Морозова А.А., Скребицкий В.Г. Амид пироглютамиласпарагина нормализует развитие длительной потенциации в срезах гиппокампа крыс. Бюл. Эксп. Биол и мед. 2004; 8: 176–179. 9. Kondratenko R.V., Derevyagin V.I., Skrebitsky V.G. Novel nootropic dipeptide Noopept increases inhibitory synaptic transmission in CA1 pyramidal cells. Neuroscience Letters. 2010; 476: 70–73. КОНТАКТНАЯ ИНФОРМАЦИЯ Скребицкий Владимир Георгиевич, доктор биологических наук, профессор, член-корр. РАН и РАМН, заведующий лабораторией функциональной синаптологии отдела исследований мозга ФГБУ «НЦН» РАМН Адрес: 125319, Москва, ул. Черняховского, д. 4/7 Тел./факс: (495) 917-23-82 E-mail: [email protected] Штарк Марк Борисович, доктор биологических наук , профессор, академик РАМН, руководитель отдела физики и биоинженерии Института молекулярной биологии и биофизики Адрес: 630117, Новосибирск, ул. Тимакова, д. 2 Тел./факс: (383)335-98-47 E-mail: mark@soramn 44




