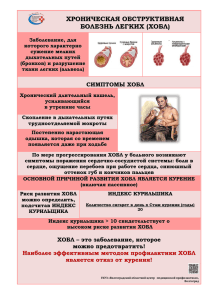
Изменение показателей гуморального иммунитета у пациентов
реклама
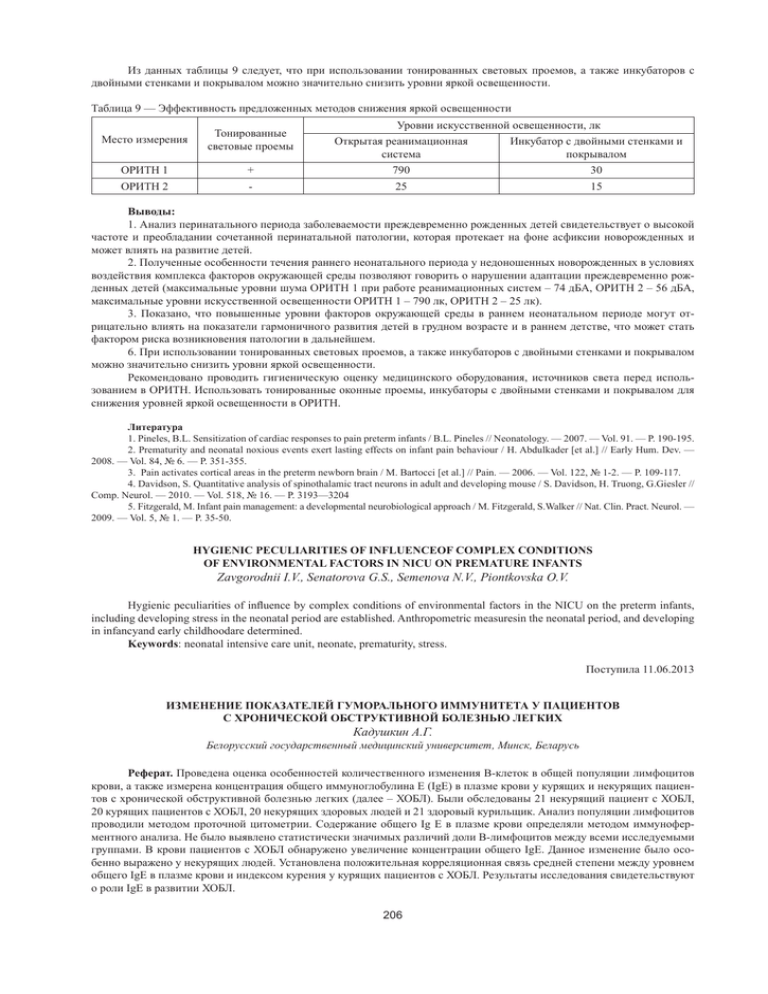
Из данных таблицы 9 следует, что при использовании тонированных световых проемов, а также инкубаторов с двойными стенками и покрывалом можно значительно снизить уровни яркой освещенности. Таблица 9 — Эффективность предложенных методов снижения яркой освещенности Место измерения Тонированные световые проемы ОРИТН 1 ОРИТН 2 Уровни искусственной освещенности, лк Открытая реанимационная система Инкубатор с двойными стенками и покрывалом + 790 30 - 25 15 Выводы: 1. Анализ перинатального периода заболеваемости преждевременно рожденных детей свидетельствует о высокой частоте и преобладании сочетанной перинатальной патологии, которая протекает на фоне асфиксии новорожденных и может влиять на развитие детей. 2. Полученные особенности течения раннего неонатального периода у недоношенных новорожденных в условиях воздействия комплекса факторов окружающей среды позволяют говорить о нарушении адаптации преждевременно рожденных детей (максимальные уровни шума ОРИТН 1 при работе реанимационных систем – 74 дБА, ОРИТН 2 – 56 дБА, максимальные уровни искусственной освещенности ОРИТН 1 – 790 лк, ОРИТН 2 – 25 лк). 3. Показано, что повышенные уровни факторов окружающей среды в раннем неонатальном периоде могут отрицательно влиять на показатели гармоничного развития детей в грудном возрасте и в раннем детстве, что может стать фактором риска возникновения патологии в дальнейшем. 6. При использовании тонированных световых проемов, а также инкубаторов с двойными стенками и покрывалом можно значительно снизить уровни яркой освещенности. Рекомендовано проводить гигиеническую оценку медицинского оборудования, источников света перед использованием в ОРИТН. Использовать тонированные оконные проемы, инкубаторы с двойными стенками и покрывалом для снижения уровней яркой освещенности в ОРИТН. Литература 1. Pineles, B.L. Sensitization of cardiac responses to pain preterm infants / B.L. Pineles // Neonatology. — 2007. — Vol. 91. — P. 190-195. 2. Prematurity and neonatal noxious events exert lasting effects on infant pain behaviour / Н. Abdulkader [et al.] // Early Hum. Dev. — 2008. — Vol. 84, № 6. — Р. 351-355. 3. Pain activates cortical areas in the preterm newborn brain / M. Bartocci [et al.] // Pain. — 2006. — Vol. 122, № 1-2. — P. 109-117. 4. Davidson, S. Quantitative analysis of spinothalamic tract neurons in adult and developing mouse / S. Davidson, H. Truong, G.Giesler // Comp. Neurol. — 2010. — Vol. 518, № 16. — P. 3193—3204 5. Fitzgerald, M. Infant pain management: a developmental neurobiological approach / M. Fitzgerald, S.Walker // Nat. Clin. Pract. Neurol. — 2009. — Vol. 5, № 1. — P. 35-50. HYGIENIC PECULIARITIES OF INFLUENCEOF COMPLEX CONDITIONS OF ENVIRONMENTAL FACTORS IN NICU ON PREMATURE INFANTS Zavgorodnii I.V., Senatorova G.S., Semenova N.V., Piontkovskа O.V. Hygienic peculiarities of influence by complex conditions of environmental factors in the NICU on the preterm infants, including developing stress in the neonatal period are established. Anthropometric measuresin the neonatal period, and developing in infancyand early childhoodare determined. Keywords: neonatal intensive care unit, neonate, prematurity, stress. Поступила 11.06.2013 ИЗМЕНЕНИЕ ПОКАЗАТЕЛЕЙ ГУМОРАЛЬНОГО ИММУНИТЕТА У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНЬЮ ЛЕГКИХ Кадушкин А.Г. Белорусский государственный медицинский университет, Минск, Беларусь Реферат. Проведена оценка особенностей количественного изменения В-клеток в общей популяции лимфоцитов крови, а также измерена концентрация общего иммуноглобулина Е (IgE) в плазме крови у курящих и некурящих пациентов с хронической обструктивной болезнью легких (далее – ХОБЛ). Были обследованы 21 некурящий пациент с ХОБЛ, 20 курящих пациентов с ХОБЛ, 20 некурящих здоровых людей и 21 здоровый курильщик. Анализ популяции лимфоцитов проводили методом проточной цитометрии. Cодержание общего Ig E в плазме крови определяли методом иммуноферментного анализа. Не было выявлено статистически значимых различий доли В-лимфоцитов между всеми исследуемыми группами. В крови пациентов с ХОБЛ обнаружено увеличение концентрации общего IgE. Данное изменение было особенно выражено у некурящих людей. Установлена положительная корреляционная связь средней степени между уровнем общего IgЕ в плазме крови и индексом курения у курящих пациентов с ХОБЛ. Результаты исследования свидетельствуют о роли IgE в развитии ХОБЛ. 206 Ключевые слова: хроническая обструктивная болезнь легких, проточная цитометрия, В-лимфоциты, общий иммуноглобулин E, некурящие люди. Введение. ХОБЛ входит в группу ведущих причин заболеваемости и смертности взрослого населения во всем мире. В нашей стране насчитывается около 60 тыс. пациентов с ХОБЛ. Курение признается главным фактором риска развития ХОБЛ. Однако результаты обследований населения в разных странах мира показали, что до 68,6% пациентов, страдающих ХОБЛ, никогда не курили. Значительная доля случаев заболевания обусловлена длительным контактом с производственной пылью и химикатами, перенесенной в раннем детстве тяжелой респираторной инфекцией, вдыханием дыма биоорганического топлива. Одной из проблем ХОБЛ являются трудности лечения. Постепенное ухудшение функции легких и развитие сопутствующих заболеваний можно ожидать даже на фоне оптимальной терапии ХОБЛ. Поэтому продолжают изучаться механизмы развития этого заболевания. Несмотря на значительные успехи в изучении Т-клеточного иммунного ответа при ХОБЛ, практически не изучено состояние гуморального звена иммунитета. Популяцией лимфоцитов, отвечающей за гуморальный иммунитет, являются В-клетки. Их фенотипирование основано на определении В-клеточного рецепторного комплекса (В-клеточный рецептор, BCR), который принимает участие в распознавании антигена. В его состав входят мембранные маркеры и иммуноглобулины. Одним из мембранных маркеров BCR является интегральный негликозилированный белок CD20. Он представляет собой Ca2+ канал и участвует в активации и пролиферации В-клеток. Молекула CD20 присутствует на всех нормальных В-лимфоцитах периферической крови, но отсутствует на плазматических клетках. Имеющиеся в литературе сведения об относительном количестве В-лимфоцитов в крови при ХОБЛ противоречивы. По некоторым данным, доля В-клеток у курильщиков с ХОБЛ ниже, чем у здоровых людей (курильщиков и некурящих) [5]. В другом исследовании не было выявлено статистически значимых различий процента В-лимфоцитов у пациентов с ХОБЛ (курильщиков и некурящих) по сравнению с соответствующей группой здоровых людей [3]. Плазматические клетки, которые являются конечным этапом дифференцировки B-лимфоцита, синтезируют белки иммуноглобулины (Ig). В организме они выполняют функцию антител. Различают несколько классов Ig – A, D, E, G, M. Особое место среди них занимают IgE. Они осуществляют защиту слизистых оболочек верхних и нижних дыхательных путей от инфекционных агентов и чужеродных веществ. Поэтому определение их концентрации при ХОБЛ приобретает патогенетическое значение. Роль курения и заболевания в изменении содержания общего IgE в крови при ХОБЛ остается невыясненной. Показано повышение концентрации общего IgE у курящих пациентов с ХОБЛ по сравнению с некурящими здоровыми людьми [9]. По другим данным, не было выявлено различий концентрации IgE у курящих пациентов с ХОБЛ по сравнению с курящими без данной патологии [4, 8]. Целью настоящего исследования явилась оценка доли В-лимфоцитов в общей популяции лимфоцитов крови и определение концентрации общего иммуноглобулина Е в плазме крови у курящих и некурящих пациентов с ХОБЛ. Материал и методы. Обследованы 21 некурящий пациент с ХОБЛ, 20 курящих пациентов с ХОБЛ, 20 некурящих здоровых людей и 21 здоровый курильщик. Характеристика участников исследования представлена в табл. 1. К некурящим мы относили, согласно определению ВОЗ, людей, которые выкурили менее 100 сигарет за жизнь. Все курящие пациенты с ХОБЛ и здоровые курильщики имели индекс курения более 10 пачек/лет. Индекс курения рассчитывали по формуле: (стаж курения (годы) × количество выкуриваемых сигарет в день) / 20. Таблица 1 — Характеристика участников исследования Показатель n Возраст, годы Пол, м/ж Статус курения (курящие/бывшие курильщики) Индекс курения, пачек/лет Некурящие пациенты с ХОБЛ 21 64,0 (61,0–68,0) Курящие пациенты с ХОБЛ 20 64,5 (62,0–67,0) Некурящие здоровые Курящие здоровые 20 62,0 (59,0–64,5) 21 61,0 (59,0–63,0) 12/9 18/2 3/17 14/7 – 12/8 – 13/8 0 43,2 (21,3–50,3) 0 29,0 (20,0–37,5) Индекс массы тела, кг/м2 30,8 (26,0–35,3) 25,4 (23,2–27,7) 27,0 (23,8–31,2) 28,7 (26,1–31,1) ОФВ1, % от должного 54,0 (41,0–61,0) 49,5 (35,5–65,5) 101,0 (92,0–110,0) 96,0 (88,0–106,0) 62,0 (56,0–65,0) 56,5 (51,0–65,0) 87,5 (82,0–94,0) 85,0 (80,0–89,0) 5,0 (3,0–6,0) 4,5 (3,0–6,0) – – ОФВ1/ФЖЕЛ, % Прирост ОФВ1 бронхолитика, % после ингаляции Критерием включения в исследование было отсутствие симптомов обострения ХОБЛ в течение последних 2 мес. до взятия крови. Из исследования были исключены пациенты с наличием в анамнезе бронхиальной астмы, атопии, аллергического ринита, принимавшие системные глюкокортикостероиды как минимум за 2 мес. до настоящего исследования, лица, неспособные правильно выполнить дыхательный маневр при тестировании функции внешнего дыхания. Диагностика ХОБЛ, включая оценку ее степени тяжести, осуществлялась на основании критериев GOLD 2011. Преобладали пациенты со среднетяжелой и тяжелой степенью ХОБЛ. В контрольные группы вошли условно здоровые 207 добровольцы с нормальным уровнем объема форсированного выдоха за первую секунду (далее – ОФВ1) и отношением объема форсированного выдоха за первую секунду к форсированной жизненной емкости легких (ОФВ1/ФЖЕЛ), не имевшие в анамнезе патологии бронхолегочной системы и других хронических заболеваний. Все испытуемые дали письменное добровольное согласие на участие в исследовании. Спирометрия проводилась по стандартной методике на аппарате SpiroUSB с использованием программного обеспечения Spida 5 (Micro Medical Limited, Англия) в соответствии с объединенными рекомендациями Американского торакального и Европейского респираторного сообществ. Венозную кровь у обследуемых забирали рано утром натощак в объеме 3–5 мл в пробирку, содержащую этилендиаминтетраацетат калия в качестве антикоагулянта. В пробирки помещали 100 мкл крови, добавляли по 10 мкл моноклональных антител к CD20, меченных флюоресцеинизотиоцианатом («R&D Systems», США). Образцы тщательно перемешивали и инкубировали в темноте при комнатной температуре в течение 30 мин. После инкубации эритроциты лизировали путем добавления 2 мл лизирующего раствора FACS Lysing Solution (BD, США). Затем образцы тщательно перемешивали и инкубировали в течение 5–7 мин в темноте. Клетки осаждали центрифугированием (2200 об/мин, 3 мин), надосадочную жидкость сливали, а осадок встряхивали. Добавляли фосфатно-солевой буфер PBS Cell Wash («BD», США), процедуру отмывки повторяли два раза. После этого к суспензии клеток добавляли 300 мкл 1 %-го раствора параформальдегида. Анализ популяций лимфоцитов проводили на 5-канальном проточном цитометре Cytomics FC500 с использованием программного обеспечения CXP (Beckman Coulter, США). Для каждой пробы учитывали не менее 50 000 клеток. По показателям прямого (FSC) и бокового (SSC) светорассеивания выделяли регион лимфоцитов. В пределах этого региона по маркеру СD20 рассчитывали процент В-клеток в общей популяции лимфоцитов (рисунок 1). Рисунок 1 — Анализ В-лимфоцитов в периферической крови: А. Выделение региона лимфоцитов среди клеток крови. Б. Определение популяции В-лимфоцитов по маркеру CD20 У всех пациентов также определяли содержание общего IgE в плазме крови методом иммуноферментного анализа на иммуноферментом анализаторе «Stat Fax 3200» (Awareness Technology, США). Статистическую обработку проводили с помощью пакета прикладных программ Statistica 8.0. Для всех имеющихся выборок данных проверяли гипотезу нормальности распределения по критерию Колмогорова–Смирнова. Поскольку полученные нами данные не подчинялись нормальному распределению, анализ проводили методами непараметрической статистики. Рассчитывались медиана и интерквартильный размах. Для сравнения данных между группами использовался U-критерий Манна-Уитни. Оценка взаимосвязи двух исследуемых групп проводилась вычислением коэффициента корреляции по Спирмену (Spearman R). Достоверными считались различия при уровне значимости p менее 0,05. Результаты и их обсуждение. В результате проведенных исследований нам не удалось зафиксировать статистически значимых отличий содержания CD20+ В-клеток (%) у некурящих пациентов с ХОБЛ по сравнению с некурящими здоровыми людьми, а также у курильщиков с ХОБЛ по сравнению с курильщиками без патологии (табл. 2). Эти результаты соответствуют данным, полученным в других лабораториях [3, 8]. Таблица 2 — Показатели гуморального иммунитета в периферической крови у пациентов с ХОБЛ и контрольных групп Некурящие Курящие Исследуемый показатель ХОБЛ контроль ХОБЛ контроль 10,9 15,2 11,8 11,1 CD20+ лимфоциты, % (7,1–15,5) (8,6–19,7) (10,1–16,6) (6,6–16,7) 820,0 420,0 780,0 370,0 IgE, МЕ/мл (635,0–980,0)* (200,0–735,0) (307,5–980,0) (285,0–980,0) Примечания: Данные представлены как медиана и 50%-й интерквартильный размах – между 25 и 75-й процентилями. * p<0,05 по сравнению со здоровыми некурящими людьми. 208 По данным нашего исследования, не было выявлено статистистически значимых различий доли лимфоцитов, содержащих В-клеточный рецепторный комплекс, у курящих и некурящих пациентов с ХОБЛ, а также у здоровых курильщиков и здоровых некурящих людей. В другом исследовании наблюдали снижение В-лимфоцитов у курильщиков с ХОБЛ по сравнению с некурящими пациентами с ХОБЛ [8]. Однако в изучавшуюся там группу некурящих пациентов с ХОБЛ включались экс-курильщики с длительным стажем курения. Вместе с тем, согласно определению ВОЗ, к некурящим принято относить тех, кто выкурил менее 100 сигарет за жизнь. Повышенные значения количества В-лимфоцитов в субэпителиальном слое бронхов при ХОБЛ наблюдали в другой лаборатории [6]. Можно было бы предполагать усиленное перемещение В-лимфоцитов из кровотока в легкие при ХОБЛ, однако полученные нами результаты не позволяют подтвердить данную гипотезу. Исследование общего IgЕ в плазме крови выявило достоверное увеличение концентрации этого показателя в группе некурящих пациентов с ХОБЛ по сравнению с некурящими здоровыми людьми (табл. 2). О возможности повышения содержания общего IgЕ у некурящих людей, контактировавших с производственными вредностями, свидетельствуют результаты исследования T. Sapigni et al. [10]. У курящих пациентов нам удалось выявить только тенденцию к повышению концентрации IgЕ. Другие исследователи также сообщали о ярко выраженной тенденции к повышению концентрации общего IgE в крови у курящих пациентов с ХОБЛ по сравнению с курящими без таковой [4]. Из представленных данных о концентрации IgE у курящих пациентов с ХОБЛ видно, что отсутствие статистически достоверных отличий от значения этого показателя у курящих здоровых людей обусловлено чрезвычайно высокой вариабельностью результатов в сравниваемых группах, хотя медиана значений при ХОБЛ значительно выше. Принимая во внимание данное обстоятельство, можно заключить, что полученные нами результаты совпадают с данными других исследователей об увеличении концентрации общего IgЕ у пациентов с ХОБЛ по сравнению со здоровыми людьми [1]. Повышение общего IgЕ у лиц с этой патологией связывают с формированием сенсибилизации в результате воздействия химических веществ, компонентов табачного дыма, производственных аэрополлютантов и инфекционных агентов [1]. При проведении корреляционного анализа у курящих пациентов с ХОБЛ обнаружена положительная корреляционная связь средней силы между уровнем общего IgЕ в плазме крови и индексом курения (рисунок 2). Аналогичные данные были получены другими исследователями [7]. Наличие обнаруженной взаимосвязи предполагает, что у курящих пациентов с ХОБЛ с увеличением стажа и интенсивности курения происходит нарастание в крови уровня общего IgE. Это косвенно указывает на то, что у пациентов с ХОБЛ курение усиливает секрецию IgE плазматическими клетками. Рисунок 2 — Зависимость концентрации общего Ig E в плазме крови от индекса курения у курящих пациентов с ХОБЛ (R=0,49, p<0,05) Взаимодействие антиген-специфического иммуноглобулина Е с антигеном происходит посредством высокоаффинного FcεRI-рецептора на мембранах тучных клеток и базофилов. Такое лиганд-рецепторное связывание является одним из способов активации этих клеток. Результатом активации является секреция биологически активных медиаторов и цитокинов. В частности, тучные клетки и базофилы могут продуцировать ФНО α (фактор некроза опухоли α), интерлейкин 4 (IL-4), IL-6, IL-8, IL-10, IL-13, CCL3 и VEGF (англ. vascular-endothelial growth factor). Выявленное повышение общего IgE в крови пациентов с ХОБЛ опосредованно способствует продукции патогенетически значимых цитокинов. Значение их в патогенезе ХОБЛ было продемонстрировано ранее [2]. Кроме того, медиаторы тучных клеток гистамин и лейкотриены могут активировать легочные макрофаги, что приводит к синтезу ими лизосомальных ферментов и провоспалительных цитокинов, которые самостоятельно могут влиять на течение ХОБЛ. 209 Заключение. Не выявлено значимых различий относительного (%) содержания В-лимфоцитов в периферической крови у пациентов с ХОБЛ и здоровых людей, а также у курящих и некурящих пациентов с этой патологией. В плазме крови пациентов с ХОБЛ увеличена концентрация общего IgЕ. Данное изменение особенно выражено у некурящих людей. Установлена положительная корреляционная связь средней силы между уровнем общего IgЕ в плазме крови и индексом курения у курящих пациентов с ХОБЛ. Литература 1. Брыляева, Е. В. Иммунологические аспекты при патологии легких / Е. В. Брыляева, Н. Н. Крюков, А. В. Жестков // Молодой ученый. – 2011. – № 1. – С. 243–244. 2. Barnes, P. J. The cytokine network in chronic obstructive pulmonary disease / P. J. Barnes // Am. J. Respir. Cell Mol. Biol. – 2009. – Vol. 41. – P. 631–638. 3. CD4+/CD25+ cells in systemic inflammation in COPD / J. Domagała-Kulawik [et al.] // Scand. J. Immunol. – 2011. – Vol. 73, № 1. – P. 59–65. 4. Comparison of induced sputum with bronchial wash, bronchoalveolar lavage and bronchial biopsies in COPD / S. R. Rutgers [et al.] // Eur. Respir. J. – 2000. – Vol. 15. – P. 109–115. 5. Increased levels of (class switched) memory B cells in peripheral blood of current smokers / C. A. Brandsma [et al.] // Respir. Res. – 2009. – Vol. 10. – P. 108. 6. Increased number of B-cells in bronchial biopsies in COPD / M. M. E. Gosman [et al.] // Eur. Respir. J. – 2006. – Vol. 27. – P. 60–64. 7. Inflammatory cells and mediators in bronchial lavage of patients with chronic obstructive pulmonary disease / A. Pesci [et al.] // Eur. Respir. J. – 1998. – Vol. 12. – P. 380–386. 8. Peripheral blood lymphocyte cell subsets in subjects with chronic obstructive pulmonary disease: association with smoking, IgE and lung function / J. W. de Jong [et al.] // Respir. Med. – 1997. – Vol. 91, № 2. – P. 67–76. 9. Singh, B. Association of severity of COPD with IgE and interleukin-1 beta. Monaldi Arch. / B. Singh, S. Arora, V. Khanna // Chest Dis. – 2010. – Vol. 73, № 2. – P. 86–87. 10. The Po River Delta Respiratory Epidemiological Survey: an analysis of factors related tolevel of total serum IgE / T. Sapigni [et al.] // Eur. Respir. J. – 1998. – Vol. 11. – P. 278–283. CHANGES IN PARAMETERS OF HUMORAL IMMUNITY IN PATIENTS WITH CHRONIC OBSTRUCTIVE PULMONARY DISEASE Kadushkin A.H. Belarusian State Medical University, Minsk, Belarus The study has been carried out to investigate the changes in the percentage of B-lymphocytes and concentration of total immunoglobulin E (Ig E) in peripheral blood of never smoking patients with chronic obstuctive pulmonary disease (COPD) and COPD smokers. 21 non-smokers with COPD, 20 smokers with COPD, 20 healthy non-smokers and 21 healthy smokers have been examined. The analysis of B-lymphocytes subtype was performed with flow cytometry method. Total plasma IgE concentration was measured by enzyme linked immunosorbent assay. No differences were found in the proportion of B-lymphocytes between all groups. Total plasma Ig E was significantly higher in COPD patients when compared to healthy controls. Moreover, this change was especially seen in non-smokers. A significant positive correlation of total plasma Ig E level and the number of pack-years (R=0,49, p<0,05) in smoking COPD subjects was observed. The results of this study support the possible role of Ig E in the systemic inflammation in COPD. Keywords: chronic obstructive pulmonary disease, flow cytometry, B-lymphocytes, total Ig E, non-smokers. Поступила 16.04.2013 ГИГИЕНИЧЕСКАЯ ОЦЕНКА АРХИТЕКТУРНО-ПЛАНИРОВОЧНЫХ РЕШЕНИЙ СОВРЕМЕННЫХ ДЕТСКО-ЮНОШЕСКИХ СПОРТИВНЫХ ШКОЛ Калиниченко И.А., Скиба О.А. Сумский государственный педагогический университет им. А.С. Макаренко, Институт физической культуры, Сумы, Украина Реферат. Установлено, что большая часть обследованных детско-юношеских спортивных школ (68,75%), была расположена в приспособленных к учебно-тренировочной работе зданиях и функционировала в условиях полного или частичного отсутствия специализированных спортивных сооружений. Определено, что архитектурно-планировочные особенности специализированной зоны по видам спорта для технической и тактической подготовки с группами вспомогательных помещений в большинстве обследованных детскоюношеских спортивных школ по показателям набора, площади помещений не отвечали требованиям действующих нормативных гигиенических документов, что может негативно отражаться на физической подготовленности спортсменов и влиять на эффективность учебно-тренировочного процесса. Ключевые слова: архитектурно-планировочные решения, детско-юношеские спортивные школы, санитарногигиеническое обеспечение. Введение. В настоящее время приоритетное направление государственной политики в сфере физической культуры и спорта занимает разработка и внедрение мероприятий, которые направлены на укрепление и сохранение здоровья подрастающего поколения и привлечение детей и молодежи к систематическим занятиям физической культурой и спортом. 210