Практические работы по химии
реклама
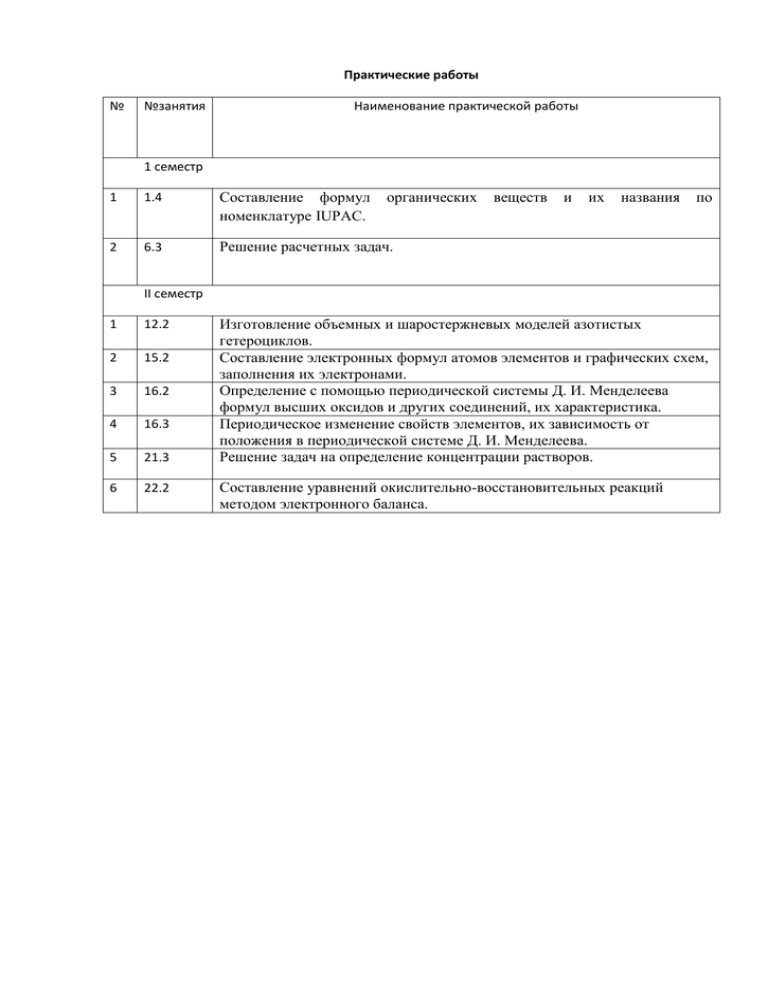
Практические работы № №занятия Наименование практической работы 1 семестр 1 1.4 Составление формул номенклатуре IUPAC. органических 2 6.3 Решение расчетных задач. веществ и их названия по II семестр 1 12.2 2 15.2 3 16.2 4 16.3 5 21.3 6 22.2 Изготовление объемных и шаростержневых моделей азотистых гетероциклов. Составление электронных формул атомов элементов и графических схем, заполнения их электронами. Определение с помощью периодической системы Д. И. Менделеева формул высших оксидов и других соединений, их характеристика. Периодическое изменение свойств элементов, их зависимость от положения в периодической системе Д. И. Менделеева. Решение задач на определение концентрации растворов. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. I семестр Практическая работа № 1 «Составление формул органических веществ и их названия по номенклатуре IUPAC» Вариант 1 1.Приведите названия алканов 1)СН3-СН-СН-СН3 2)СН3-СН2-СН2-СН3 | | СН3 СН3 2. Приведите названия алкенов 1)СН2=СН-СН3 2)СН3-СН=СН-СН2-СН3 3. Приведите названия алкинов 1)СН≡С-СН2-СН2-СН2 - СН3 2)СН3-СН2-С≡СН | СН3 4. Приведите названия алкадиенов 1)СН2=С=С- СН3 2)СН3-СН2-СН=С=СН2 | СН3 5. Приведите названия спиртов 1)СН3-СН2-СН-ОН 2)СН3-ОН | CH3 6. Приведите названия альдегидов 1)СН3-С=0 2) СН3-СН2-СН2-СН2-С=О | | Н Н 7. Приведите названия кислот 1)СН3-С=0 2) СН3-СН2–СН2-СН2-С=О | | ОН ОН 8.Ищобразите структурные формулы 1) 2-метилпентана 2)2-метилбутен-2 3)бутин-2 4)пентадиен-2,3 5)этанола 6)пропаналя 7)метановой кислоты Практическая работа № 1 «Составление формул органических веществ и их названия по номенклатуре IUPAC» Вариант 2 1.Приведите названия алканов 1)СН3-СН-СН-СН2- СН3 | | СН3 СН3 2. Приведите названия алкенов 1)СН2=СН-СН2-СН3 2)СН3- СН2-СН3 2)СН3-СН2-СН=СН-СН2-СН3 3. Приведите названия алкинов 1)СН≡С-СН-СН2 -СН3 2)СН3-СН2-С≡С-СН3 | СН3 4. Приведите названия алкадиенов 1)СН2=С=С -СН2-СН3 2)СН3-СН2-СН=С=СН-СН3 | СН3 5. Приведите названия спиртов 1)СН3-СН2-СН-СН2 -ОН 2)СН3-СН2-СН2 -ОН | CH3 6. Приведите названия альдегидов 1)СН3-СН2- С=0 2) СН3- СН2 -СН2-С=О | | Н Н 7. Приведите названия кислот 1)СН3- СН2-С=0 2) СН3-СН2-СН2-СН2-С=О | | ОН ОН 8.Ищобразите структурные формулы 1) 3-метилгексана 2)2-метилбутен-1 3)пентин-2 4)гексадиен-2,3 5)пропанола-2 6)бутаналя 7)метановой кислоты Практическая работа № 1 «Составление формул органических веществ и их названия по номенклатуре IUPAC» Вариант 3 1.Приведите названия алканов 1)СН3-СН - СН - СН-СН2 -СН3 2)СН3-СН2-СН2- СН2-СН2 -СН3 | | | СН3 СН3 СН3 2. Приведите названия алкенов 1)СН2=СН- СН2-СН -СН3 2)СН3-С=СН-СН2-СН3 | | СН3 СН3 3. Приведите названия алкинов 1)СН≡С-СН2-СН-СН2 - СН3 2)СН3-СН-С≡С-СН-СН3 | | | СН3 СН3 СН3 4. Приведите названия алкадиенов 1)СН2=С=С- СН3 2)СН3-СН-СН=С=СН- СН –СН - СН-СН3 | | | | | СН3 СН3 СН3 СН3 СН3 5. Приведите названия спиртов 1)СН3-СН2-СН-ОН 2)СН3-СН – СН - СН-СН2 -ОН | | | | CH3 СН3 СН3 СН3 6. Приведите названия альдегидов 1)СН3- СН2-СН2- СН2-СН2 -С=О 2) СН3-СН2-СН2- СН2- СН2-СН2 -СН2-С=О | | Н Н 7. Приведите названия кислот 1)СН3-С=0 2) СН3-СН–СН2-СН2-С=О | | | ОН СН3 ОН 8.Ищобразите структурные формулы 1) 2,2-диметилгептана 2)2,3,4-триметилоктен-2 3)2-метилбутин-2 4)2,4-диметилпентадиен-2,3 5)2-метилбутанола-1 6)2-метилпропаналя 7)пропановой кислоты Практическая работа № 1 «Составление формул органических веществ и их названия по номенклатуре IUPAC» Вариант 4 1.Приведите названия алканов 1)СН3-СН - СН – СН - СН -СН3 2)СН3-СН- СН2-СН-СН3 | | | | | | СН3 СН3 СН3 СН3 СН3 СН3 2. Приведите названия алкенов 1)СН2=СН -СН -СН3 2)СН3-С=СН - СН3 | | СН3 СН3 3. Приведите названия алкинов 1)СН≡С-СН2-СН-СН2 - СН3 2)СН3-СН-С≡С-СН-СН2-СН2-СН2-СН2-СН3 | | | | СН3 СН3 СН3 СН3 4. Приведите названия алкадиенов 1)СН2=С=С-СН2-СН3 2)СН3-СН-СН=С=СН- СН –СН – СН2 -СН3 | | | | СН3 СН3 СН3 СН3 5. Приведите названия спиртов 1)СН3-СН2-СН-ОН 2)СН3-СН – СН - СН-СН2-СН2-СН2 -ОН | | | | | СН3 CH3 СН3 СН3 СН3 6. Приведите названия альдегидов 1)СН3- СН-СН2- СН2-СН2 -С=О 2) СН3-СН2-СН2 - СН2 -СН2-С=О | | | СН3 Н Н 7. Приведите названия кислот 1)СН3-СН2-СН-СН2- С=0 2) СН3-СН–СН2-СН2-С=О | | | | СН3 Н СН3 ОН 8.Ищобразите структурные формулы 1) 2,2,3,3-тетраметилгептана 2)2,3,4-триметилоктен-1 3)3-метилпентин-1 4)4,4-диметилпентадиен-1,2 5)3-метилпентанола-3 6)2,2-диметилпропаналя 7)2,2-диметилбутановой кислоты Практическая работа № 2 «Решение расчетных задач» Вариант 1 1.Определите название и структурную формулу алкана, молекулярная масса которого 16 г/моль. 2.Определите название и структурную формулу алкена, если относительная плотность алкена по водороду равна 14. 3.Определите структурную формулу алкина, если процентное содержание водорода равно 7,69% и углерода равно 92,31%, а молекулярная масса 26 г/моль. 4.Определите название и структурную формулу алкена, если плотность углеводорода при нормальных условиях равна 1,875 г/л. 5*.При сжигании 8,6 г углеводорода получили 26, 4 г СО2 и 12, 6 г Н2О. Найдите молекулярную формулу этого углеводорода, если его относительная плотность по воздуху равна 2, 966. Практическая работа № 2 «Решение расчетных задач» Вариант 2 1.Определите название и структурную формулу арена, молекулярная масса которого 78 г/моль. 2.Определите название и структурную формулу алкана, если относительная плотность алкана по водороду равна 15. 3.Определите структурную формулу алкена, если процентное содержание водорода равно 14,29% и углерода равно 85,71%, а молекулярная масса 28 г/моль. 4.Определите название и структурную формулу алкана, если плотность углеводорода при нормальных условиях равна 1,3393 г/л. 5*.При сжигании 7,8 г углеводорода получили 26, 4 г СО2 и 5,4 г Н2О. Найдите молекулярную формулу этого углеводорода, если его относительная плотность по воздуху равна 2,6896. Практическая работа № 2 «Решение расчетных задач» Вариант 3 1.Определите название и структурную формулу алкена, молекулярная масса которого 28 г/моль. 2.Определите название и структурную формулу алкина, если относительная плотность алкина по водороду равна30 г/моль. 3.Определите структурную формулу алкана, если процентное содержание водорода равно 17,24% и углерода равно 82,76%, а молекулярная масса 58 г/моль. 4.Определите название и структурную формулу алкена, если плотность углеводорода при нормальных условиях равна 2,5 г/л. 5*.При сжигании 7,0 г углеводорода получили 6,0 г СО2 и 9,0 г Н2О. Найдите молекулярную формулу этого углеводорода, если его относительная плотность по воздуху равна 2, 4138. Практическая работа № 2 «Решение расчетных задач» Вариант 4 1.Определите название и структурную формулу алкина, молекулярная масса которого 26 г/моль. 2.Определите название и структурную формулу алкана, если относительная плотность алкана по водороду равна 29 г/моль. 3.Определите структурную формулу алкена, если процентное содержание водорода равно 14,29% и углерода равно 85,71%, а молекулярная масса 42 г/моль. 4.Определите название и структурную формулу алкана, если плотность углеводорода при нормальных условиях равна 2,5893 г/л. 5*.При сжигании 3,2 г углеводорода получили 8,8 г СО2 и 2,4 г Н2О. Найдите молекулярную формулу этого углеводорода, если его относительная плотность по воздуху равна 0,5515. II семестр Практическая работа № 1 «Изготовление объемных и шаросержневых моделей азотистых гетероциклов» Цель работы: -дать представление о шаростержневых и объемных моделях азотистых гетероциклов; -научить моделировать молекулы азотистых гетероциклов на компьютере, используя обучающий диск «Виртуальная лаборатория 8-11 класс», -закрепить умения, подтверждающие теоретические знания по темам «Теория строения органических соединений А.М.Бутлерова» и «Нуклеиновые кислоты», моделированием на компьютере органические соединения. Оборудование: компьютер, проектор, экран, обучающий диск «Виртуальная лаборатория 8-11 класс». Задание. Изготовление шаростержневых и объемных моделей молекул азотистых гетероциклов: тимина, цитозина, аденина, гуанина и их радикалов. Смоделируйте по желанию одну молекулу гетероцикла на компьютере. Обратите внимание на пространственные формы, на цвет и размер атомов водорода, углерода, кислорода и азота, на образование σ- и π-связи между атомами, их длину и угол связи С-С, вид гибридизации атома углерода. Ответьте на вопросы: 1.Приведите определение «гетероциклические соединения» и составьте по выбору одну структурную формулу, назовите ее. 2.Какиеми свойствами кислотными или основными они обладают и почему? 3.В чем заключается сущность комплементарности? 4.Какие пары гетероциклов комплементарны? 5.Какой химической связью связаны между собой комплементарные основания? 6.В состав каких кислот входят гетероциклические соединения? 7.Объясните биологическое значение нуклеиновых кислот. Практическая работа №2 «Составление электронных формул атомов элементов периодической системы и их графических схем» ВАРИАНТ 1 Инструкция: выберите один правильный ответ 1.Химическому элементу 3-го периода VА-группы соответствует схема распределения электронов по слоям: 1) 2, 8, 5 2) 2, 8, 3 3) 2,5 4) 2, 3 2.Порядковый номер химического элемента в периодической системе Д.И. Менделеева соответствует: 1) заряду ядра в атоме 2) значению высшей валентности элемента по кислороду 3) числу электронов, недостающих до завершения внешнего слоя 4) числу электронных слоев в атоме 3. Определите положение элемента в периодической системе (период, группа, подгруппа) по электронной формуле и назовите его: 1S22S22P63S23P4 4. Составьте графическую формулу элемента с электронной формулой 1S22S22P63S23P4 и покажите все валентные состояния данного элемента. 5. Номер группы в Периодической системе Д.И.Менделеева соответствует: 1) числу электронов в атоме 2) значению высшей валентности элемента по кислороду (только для главных подгрупп) 3) числу электронов, недостающих для завершения внешнего электронного слоя 4) числу электронных слоев в атоме. 6. Номер периода в Периодической системе Д.И.Менделеева соответствует: 1) электронов в атоме 2) электронов во внешнем слое атомов 3) числу электронов, недостающих до завершения внешнего слоя 4) числу заполняемых электронных слоев 7. В периоде с увеличением порядкового номера химического элемента происходит: 1) уменьшение заряда ядра 2) усиление металлических свойств 3) уменьшение атомного радиуса 4) уменьшение числа валентных электронов 8. Радиус атомов увеличивается в ряду элементов: 1) H-Li-Na 2) K-Na-Li 3) Na-Mg-AI 4) Be-Ca-Mg Практическая работа №2 «Составление электронных формул атомов элементов периодической системы и их графических схем» ВАРИАНТ 2 Инструкция: выберите один правильный ответ 1.Химическому элементу 2-го периода IIIА-группы соответствует схема распределения электронов по слоям: 1) 2, 1, 1 2) 2, 1, 2 3) 2, 2, 1 4) 2, 2, 2 2.Порядковый номер химического элемента в периодической системе Д.И. Менделеева соответствует: 1) заряду ядра в атоме 2) значению высшей валентности элемента по кислороду 3) числу электронов, недостающих до завершения внешнего слоя 4) числу электронных слоев в атоме 3. Определите положение элемента в периодической системе (период, группа, подгруппа) по электронной формуле и назовите его: 1s22s22p63s23p6 4. Составьте графическую формулу элемента с электронной формулой 1s22s22p63s23p5 и покажите все валентные состояния данного элемента. 5. Номер группы в Периодической системе Д.И.Менделеева соответствует: 1)числу электронов в атоме 2) значению высшей валентности элемента по кислороду (только для главных подгрупп) 3) числу электронов, недостающих для завершения внешнего электронного слоя 4) числу электронных слоев в атоме. 6. Номер периода в Периодической системе Д.И.Менделеева соответствует: 1) электронов в атоме 2) электронов во внешнем слое атомов 3) числу электронов, недостающих до завершения внешнего слоя 4) числу заполняемых электронных слоев 7. В периоде с увеличением порядкового номера химического элемента происходит: 1) уменьшение заряда ядра 2) усиление металлических свойств 3) уменьшение атомного радиуса 4) уменьшение числа валентных электронов 8. Радиус атомов увеличивается в ряду элементов: 1) S-P-Si 2) I-F-Br 3) O-S-Se 4) Si-P-S Практическая работа №2 «Составление электронных формул атомов элементов периодической системы и их графических схем» ВАРИАНТ 3 Инструкция: выберите один правильный ответ 1.Химическому элементу 4-го периода VА группы соответствует схема распределения электронов по слоям: 1) 2, 2, 6, 2, 6, 3, 2 2) 2, 2, 6, 2, 6, 2, 3 3) 2, 2, 6, 2, 6, 2, 8 2.Порядковый номер химического элемента в периодической системе Д.И. Менделеева соответствует: 1) заряду ядра в атоме 2) значению высшей валентности элемента по кислороду 3) числу электронов, недостающих до завершения внешнего слоя 4) числу электронных слоев в атоме 3. Определите положение элемента в периодической системе (период, группа, подгруппа) по электронной формуле и назовите его: 1s22s22p63s23p64s23d104p6 4. Составьте графическую формулу элемента с электронной формулой 1s22s22p63s23p64s23d104p5 и покажите все валентные состояния данного элемента. 5. Номер группы в Периодической системе Д.И.Менделеева соответствует: 1)числу электронов в атоме 2) значению высшей валентности элемента по кислороду (только для главных подгрупп) 3) числу электронов, недостающих для завершения внешнего электронного слоя 4) числу электронных слоев в атоме. 6. Номер периода в Периодической системе Д.И.Менделеева соответствует: 1) электронов в атоме 2) электронов во внешнем слое атомов 3) числу электронов, недостающих до завершения внешнего слоя 4) числу заполняемых электронных слоев 7. В периоде с увеличением порядкового номера химического элемента происходит: 1) уменьшение заряда ядра 2) усиление металлических свойств 3) уменьшение атомного радиуса 4) уменьшение числа валентных электронов 8. Радиус атомов увеличивается в ряду элементов: 1) Be-Mg- Ca 2) Mg-AI-Si 3) O-N-C 4) V-Cr-Mn Практическая работа №2 «Составление электронных формул атомов элементов периодической системы и их графических схем» ВАРИАНТ 4 Инструкция: выберите один правильный ответ 1.Химическому элементу 4-го периода IIА-группы соответствует схема распределения электронов по слоям: 1) 2, 2, 6, 2, 6, 2, 1 2) 2, 2, 6, 2, 6, 2, 4 3) 2, 2, 6, 2, 6, 2, 5 4) 2, 2, 6, 2, 6, 2.Порядковый номер химического элемента в периодической системе Д.И. Менделеева соответствует: 1) заряду ядра в атоме 2) значению высшей валентности элемента по кислороду 3) числу электронов, недостающих до завершения внешнего слоя 4) числу электронных слоев в атоме 3. Определите положение элемента в периодической системе (период, группа, подгруппа) по электронной формуле и назовите его 1s22s22p63s23p64s23d104p1 4. Составьте графическую формулу элемента с электронной формулой 1s22s22p63s23p64s23d104p1 и покажите все валентные состояния данного элемента. 5. Номер группы в Периодической системе Д.И.Менделеева соответствует: 1)числу электронов в атоме 2) значению высшей валентности элемента по кислороду (только для главных подгрупп) 3) числу электронов, недостающих для завершения внешнего электронного слоя 4) числу электронных слоев в атоме. 6. Номер периода в Периодической системе Д.И.Менделеева соответствует: 1) электронов в атоме 2) электронов во внешнем слое атомов 3) числу электронов, недостающих до завершения внешнего слоя 4) числу заполняемых электронных слоев 7. В периоде с увеличением порядкового номера химического элемента происходит: 1) уменьшение заряда ядра 2) усиление металлических свойств 3) уменьшение атомного радиуса 4) уменьшение числа валентных электронов 8. Радиус атомов увеличивается в ряду элементов: 1) Na-Mg-AI 2) Ca- Mg-Be 3) Mg-Ca-Ba 4) CI-Br-I Практическая работа №3 «Определение с помощью периодической системы химических элементов Д.И.Менделеева формул высших оксидов и их характеристик» Вариант 1 1.Определите валентность элементов в следующих соединениях: H2O, Cu2O, N2O3, CaO, AI2O3, K2O, SO3, SO2, SiO2, MgO. 2.Определите нижние индексы в следующих соединениях: Se Fen IIIOIIm, S nVIOIIm, Hn IOm II . n IV Om II , 3.Составьте молекулярные формулы соединений хрома с кислородом, в котором хром проявляет валентность II, III, VI. 4.Что такое валентность элемента? Чему равна валентность элементов первой группы главной подгруппы? Приведите примеры. 5.Как меняется характер химических свойств высших оксидов и высших гидроксидов в периодах слева направо? Приведите соответствующие примеры. Практическая работа №3 «Определение с помощью периодической системы химических элементов Д.И.Менделеева формул высших оксидов и их характеристик» Вариант 2 1.Определите валентность элементов в следующих соединениях: AsH3, ZnO, N2O5, CaBr2, AICI3, SF6 , K2S, SiO2, Mg3N2 , CuO. 2.Определите нижние индексы в следующих соединениях: Hm ISenII, PmIIICInI, PbmIVOnII , OmIIFnI. 3.Составьте молекулярные формулы соединений серы с кислородом, в которых сера проявляет валентность II, IV. VI. 4.Что такое валентность элемента? Чему равна валентность элементов второй группы главной подгруппы? Приведите примеры. 5.Как меняется характер химических свойств высших оксидов и высших гидроксидов в главных подгруппах сверху вниз? Приведите соответствующие примеры. Практическая работа №3 «Определение с помощью периодической системы химических элементов Д.И.Менделеева формул высших оксидов и их характеристик» Вариант 3 1.Определите валентность элементов в следующих соединениях: Na2O, P2O5 , N2O3 , BaO, CO2, HgO, CCI4, Ca3N2. B2O3, MnO2. 2.Определите нижние индексы в следующих соединениях: MgmIISinIV, SrmIIOnII , CImIOnII, AsmVOnII. 3.Составьте молекулярные формулы соединений марганца с кислородом, в которых марганец проявляет валентность II, IV, V, VI, VII. 4.Что такое валентность элемента? Чему равна валентность элементов третьей группы главной подгруппы? Приведите примеры. 5.Как меняется характер химических свойств высших оксидов и высших гидроксидов в главных подгруппах снизу вверх? Приведите соответствующие примеры. Практическая работа №3 «Определение с помощью периодической системы химических элементов Д.И.Менделеева формул высших оксидов и их характеристик» Вариант 4 1.Определите валентность элементов в следующих соединениях: AI2S3, Na2Se, FeO, Mn2O7, PH3, CrO, H2S, Ag2O, SnO2, CdO. 2.Определите нижние индексы в следующих соединениях: CImVIIOnII, CrmVIOnII, KmIBrnI, AsmIIIHnI. 3.Составьте молекулярные формулы соединений азота с кислородом, в которых азот проявляет валентность I, II, III, IV, V. 4.Что такое валентность элемента? Чему равна валентность элементов четвертой группы главной подгруппы? Приведите примеры. 5.Как меняется характер химических свойств высших оксидов и высших гидроксидов в периодах справа налево? Приведите соответствующие примеры. Практическая работа №4 «Периодическое изменение свойств элементов, их зависимость от положения в периодической системе Д.И.Менделеева» Вариант 1 1.У какого элемента больше выражены неметаллические свойства: а) у кислорода или углерода: б) у фосфора или мышьяка? Дайте обоснованный ответ на основании положения элементов в периодической системе Д.И.Менделеева. 2.Как и почему изменяются свойства химических элементов в периодах? Покажите это на примере элементов 3-ого периода. 3.Дайте характеристику элемента №* по плану: 1) положение в периодической системе 2)металл или неметалл 3)строение атома (определить число протонов, нейтронов и электронов) 4)электронная формула 5)графическая электронная формула (квантовые ячейки) 6)число электронов на наружном энергетическом уровне и является ли он завершенным 7)число неспаренных электронов на наружном энергетическом уровне в возбужденном состоянии 8)формула высшего оксида и его характер (основный, амфотерный, кислотный) 9)формула или гидроксида, или кислоты 10)образует ли элемент летучее соединение с водородом, если образует, то какая его химическая формула. 4.Как меняется характер химических свойств высших оксидов и высших гидроксидов в главных подгруппах сверху вниз? Приведите соответствующие примеры. 5.Приведите современную формулировку Периодического закона. Практическая работа №4 «Периодическое изменение свойств элементов, их зависимость от положения в периодической системе Д.И.Менделеева» Вариант 2 1.У какого элемента больше выражены неметаллические свойства: а) у лития или рубидия; б) у калия или скандия? Дайте обоснованный ответ на основании положения элементов в периодической системе Д.И.Менделеева. 2.Как изменяются свойства химических элементов в главных подгруппах? Покажите это на примере элементов главной подгруппы III группы. 3.Дайте характеристику элемента №* по плану: 1) положение в периодической системе 2)металл или неметалл 3)строение атома (определить число протонов, нейтронов и электронов) 4)электронная формула 5)графическая электронная формула (квантовые ячейки) 6)число электронов на наружном энергетическом уровне и является ли он завершенным 7)число неспаренных электронов на наружном энергетическом уровне в возбужденном состоянии 8)формула высшего оксида и его характер (основный, амфотерный, кислотный) 9)формула или гидроксида, или кислоты 10)образует ли элемент летучее соединение с водородом, если образует, то какая его химическая формула. 4.Как меняется характер химических свойств высших оксидов и высших гидроксидов в периодах слева направо? Приведите соответствующие примеры. 5.Приведите современную формулировку Периодического закона. Практическая работа №4 «Периодическое изменение свойств элементов, их зависимость от положения в периодической системе Д.И.Менделеева» Вариант 3 1.У какого элемента больше выражены неметаллические свойства: а) у хлора или йода; б)у серы или кремния? Дайте обоснованный ответ на основании положения элементов в периодической системе Д.И.Менделеева. 2.Какие общие свойства проявляют элементы одних и тех же подгрупп? Покажите это на примере элементов главной подгруппы I группы. 3.Дайте характеристику элемента №* по плану: 1) положение в периодической системе 2)металл или неметалл 3)строение атома (определить число протонов, нейтронов и электронов) 4)электронная формула 5)графическая электронная формула (квантовые ячейки) 6)число электронов на наружном энергетическом уровне и является ли он завершенным 7)число неспаренных электронов на наружном энергетическом уровне в возбужденном состоянии 8)формула высшего оксида и его характер (основный, амфотерный, кислотный) 9)формула или гидроксида, или кислоты 10)образует ли элемент летучее соединение с водородом, если образует, то какая его химическая формула. 4.Как меняется характер химических свойств высших оксидов и высших гидроксидов в главных подгруппах снизу вверх? Приведите соответствующие примеры. 5.Приведите современную формулировку Периодического закона. Практическая работа №4 «Периодическое изменение свойств элементов, их зависимость от положения в периодической системе Д.И.Менделеева» Вариант 4 1.У какого элемента больше выражены неметаллические свойства: а) у бериллия или стронция; б)у натрия или алюминия? Дайте обоснованный ответ на основании положения элементов в периодической системе Д.И.Менделеева. 2.Что общего и каковы различия в строении малых и больших периодов? Покажите это на примере 3-его и 4-его периодов. 3.Дайте характеристику элемента №* по плану: 1) положение в периодической системе 2)металл или неметалл 3)строение атома (определить число протонов, нейтронов и электронов) 4)электронная формула 5)графическая электронная формула (квантовые ячейки) 6)число электронов на наружном энергетическом уровне и является ли он завершенным 7)число неспаренных электронов на наружном энергетическом уровне в возбужденном состоянии 8)формула высшего оксида и его характер (основный, амфотерный, кислотный) 9)формула или гидроксида, или кислоты 10)образует ли элемент летучее соединение с водородом, если образует, то какая его химическая формула. 4.Как меняется характер химических свойств высших оксидов и высших гидроксидов в периодах справа налево? Приведите соответствующие примеры. 5.Приведите современную формулировку Периодического закона. Практическая работа № 5 «Решение задач на определение концентрации растворов» Вариант 1 1.Определить весовую концентрацию раствора хлорида натрия, если масса соли равна 7 г, а масса раствора 250 г. 2.Определить весовую концентрацию раствора бромида калия, если масса соли равна 12 г, а масса воды 300г. 3.Рассчитайте массу воды и соли, необходимые для приготовления 200 г раствора с массовой долей соли 0, 25. 4.Какие массы 30%-го и 3%-ого растворов фосфорной кислоты потребуется для приготовления 900 г 6%-огораствора? 5.Определите молярную концентрацию раствора хлорида натрия объемом 300 мл, массой соли 2,5 г 6*.Определите молярную концентрацию раствора хлорида натрия, если весовая концентрация соли 2%, объем раствора 350 мл, плотность раствора 1,01 г/мл 7*.Определите весовую концентрацию раствора бромида калия, если молярная концентрация раствора равна 0,1 моль/л, объем раствора 250 мл, плотность раствора 1, 02 г/мл Практическая работа № 5 «Решение задач на определение концентрации растворов» Вариант 2 1.Определить весовую концентрацию раствора хлорида натрия, если масса соли равна 25 г, а масса раствора 220 г. 2.Определить весовую концентрацию раствора бромида калия, если масса соли равна 30 г, а масса воды 200г. 3.Рассчитайте массу воды и соли, необходимые для приготовления 400 г раствора с массовой долей соли 0, 15. 4.Какие массы 30%-ого и 3%-ого растворов щелочи потребуется для приготовления 300 г 15%-ого раствора? 5.Определите молярную концентрацию раствора хлорида натрия объемом 150 мл, массой соли 4,5 г, плотностью раствора 1,01 г/мл 6*.Определите молярную концентрацию раствора фосфата калия, если весовая концентрация соли 7%, объем раствора 250 мл, плотность раствора 1,02 г/мл 7*.Определите весовую концентрацию раствора силиката натрия, если молярная концентрация раствора равна 0,2 моль/л, объем раствора 350 мл, плотность раствора 1, 03 г/мл Практическое занятие № 5 «Решение задач на определение концентрации растворов» Вариант 3 1.Определить весовую концентрацию раствора хлорида натрия, если масса соли равна 7 г, а масса раствора 250 г. 2.Определить весовую концентрацию раствора бромида калия, если масса соли равна 12 г, а масса воды 300г. 3.Рассчитайте массу воды и соли, необходимые для приготовления 200 г раствора с массовой долей соли 0, 25. 4.Какие массы 30%-ого и 3%-ого растворов азотной кислоты потребуется для приготовления 150 г 27%-ого раствора? 5.Определите молярную концентрацию раствора хлорида натрия объемом 300 мл, массой соли 2,5 г, плотностью раствора 1,01 г/мл. 6*.Определите молярную концентрацию раствора карбоната натрия, если весовая концентрация соли 2%, объем раствора 350 мл, плотность раствора 1,02 г/мл 7*.Определите весовую концентрацию раствора сульфата натрия, если молярная концентрация раствора равна 0,25моль/л, объем раствора 450 мл, плотность раствора 1, 02 г/мл Практическое занятие № 5 «Решение задач на определение концентрации растворов» Вариант 4 1.Определить весовую концентрацию раствора хлорида натрия, если масса соли равна 15 г, а масса раствора 350 г. 2.Определить весовую концентрацию раствора бромида калия, если масса соли равна 18 г, а масса воды 400г. 3.Рассчитайте массу воды и соли, необходимые для приготовления 120 г раствора с массовой долей соли 0, 2. 4.Какие массы 30%-ого и 3%-ого растворов серной кислоты потребуется для приготовления 100 г 20%-ого раствора? 5.Определите молярную концентрацию раствора хлорида натрия объемом 330 мл, массой соли 3,5 г, плотностью раствора 1,01 г/мл. 6*.Определите молярную концентрацию раствора ацетата натрия, если весовая концентрация соли 6%, объем раствора 330 мл, плотность раствора 1,02 г/мл 7*.Определите весовую концентрацию раствора сульфида натрия, если молярная концентрация раствора равна 0,15моль/л, объем раствора 450 мл, плотность раствора 1, 02 г/мл Практическая работа № 6 «Составление уравнений окислительно-восстановительных реакций методом электронного баланса» Вариант 1 Расставьте коэффициенты в следующих уравнениях методом электронного баланса и укажите окислитель и восстановитель: 1. Na+CI2→NaCI 2. Na+HCI→NaCI+H2 3. Fe+CuSO4→FeSO4+Cu 4. FeCI3+KI→I2+FeCI2+KCI 5. Cu+HNO3(разбавл) →NO+Cu(NO3)2+H2O Практическая работа № 6 «Составление уравнений окислительно-восстановительных реакций методом электронного баланса» Вариант 2 Расставьте коэффициенты в следующих уравнениях методом электронного баланса и укажите окислитель и восстановитель: 1. H2+N2→NH3 2. Zn+HCI→ZnCI2+H2 3. S+O2→SO3 4. CuSO4+ KI→I2+CuI+K2SO4 5. Pb(NO3)2→PbO+NO2+O2 Практическая работа № 6 «Составление уравнений окислительно-восстановительных реакций методом электронного баланса» Вариант 3 Расставьте коэффициенты в следующих уравнениях методом электронного баланса и укажите окислитель и восстановитель: 1. Mg+O2→MgO 2. Fe+H2SO4→FeSO4+H2 3. Na+H2O→NaOH+H2 4. KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O 5. KNO3→KNO2+O2 Практическая работа № 6 «Составление уравнений окислительно-восстановительных реакций методом электронного баланса» Вариант 4 Расставьте коэффициенты в следующих уравнениях методом электронного баланса и укажите окислитель и восстановитель: 1. Fe+CI2→FeCI3 2. Ca+Si→Ca2Si 3. Ca+H2O→Ca(OH)2+H2 4. K2Cr2O7+H2SO4+KI→I2+Cr2(SO4)3+K2SO4+H2O 5. NH3+O2→N2+H2O