Календарно-тематическое планирование по химии 8 класс 68 часов (2 часа в неделю)
реклама

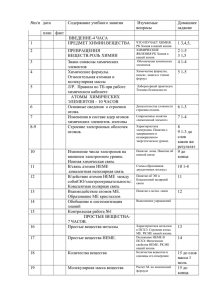
Календарно-тематическое планирование по химии 8 класс 68 часов (2 часа в неделю) (базовый уровень) №п\п Тема 1 I 1 2 Введение (4часа) Предмет химии. Вещества. 2. 3. 4. Периодическая таблица химических элементов Д.И.Менделеева. Химические формулы. Расчёты по химическим формулам. II 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Атомы химических элементов (10часов). Основные сведения о строении атомов. Изотопы. Строение электронных оболочек атомов. Строение атомов. Ионная химическая связь. Ковалентная неполярная связь. Ковалентная полярная связь. Металлическая связь. Обобщение и систематизация знаний по теме «Атомы химических элементов» Контрольная работа №1 по теме ««Атомы химических элементов» III Простые вещества (8 часов). 15. 16. 17. 18. 19. 20. 21. 22. Простые вещества – металлы. Неметаллы. Количество вещества. Молярная масса вещества. Молярный объём газов. Решение задач на вычисление количества вещества. Обобщение материала по теме: «Простые вещества». Контрольная работа №2 «Простые вещества» IV 23. 24. 25. 26. 27-28 29. 30. 31. 32. 33. 34 -35 Соединения химических элементов(13ч.) Степень окисления. Оксиды. Летучие водородные соединения. Основания. Кислоты. Соли. Повторение темы « Соединения химических элементов». Контрольная работа № 3 по теме «Соединения химических элементов». Кристаллические решётки. Чистые вещества и смеси. Массовая и объёмная доля компонентов смеси. Расчёты, связанные с понятием «доля». 36 V. 37. Контрольная работа№3 по теме «Соединения химических элементов Изменения происходящие веществами (7 ч) Физические явления. 38. 39 - 40. 41 . 42. 43. 44. 45. Химические реакции. Закон сохранения массы веществ. Химические уравнения. Расчёт по химическим уравнениям. Реакции разложения и соединения. Реакции замещения. Реакции обмена. Обобщение темы «Изменения происходящие с веществами». Дата 3 46. Контрольная работа №4 по теме « Изменения происходящие с веществами». VI 47. « Простейшие операции с веществом. Химический практикум» (3 часа) Правила работы в химическом кабинете. Горение свечи. 48. Получение водорода и его свойства. 49. Получение кислорода и его свойства. VII 51. 52. Скорость химической реакции(2) Понятие о скорости химической реакции. Обратимые и необратимые химические реакции. Факторы влияющие на химическое равновесие. VIII 53. 54. 55 –56. 57. 58. 59 –60. 61. 62. 63–64. 65. 66. Растворение. Растворы. Свойства электролитов.(14) Растворение как физико-химический процесс. Теория ТЭД. Кислоты в свете ТЭД. Основания в свете ТЭД. Оксиды. Соли в свете ТЭД. Генетическая связь между классами неорганических соединений. Контрольная работа №5 «Растворы. ТЭД». Окислительно-восстановительные реакции. Простые вещества в свете ОВР. Сложные вещества в свете ОВР. IХ 67. Свойства электролитов (2часа) Ионные реакции 68. «Свойства классов неорганических в-в». Решение экспериментальных задач. Требования и результаты усвоения учебного материала по неорганической химии8 класс. Учащиеся должны знать: основные формы существования химического элемента (свободные атомы, простые и сложные вещества); основные сведения о строении атомов элементов малых периодов; основные виды химических связей; типы кристаллических решёток; факторы, определяющие скорость химических реакций и состояние химического равновесия; типологию химических реакций и состояние химического равновесия; типологию химических реакций по различным признакам; сущность электролитической диссоциации; названия, состав, классификацию и свойства важнейших классов неорганических соединений в свете теории электролитической диссоциации и с позиций окисления – восстановления. Учащиеся должны уметь: а) применять следующие понятия: химический элемент, атом, изотоп, ионы, молекулы; простое и сложное вещество; аллотропия; относительная атомная и молекулярная массы, количество вещества, молярная масса, молярный объём, число Авогадро; электроотрицательность, степень окисления, окислительно-восстановительный процесс; химическая связь, её виды и разновидности; химическая реакция и её классификации; скорость химической реакции и факторы её зависимости; обратимость химических реакций, химическое равновесие и условия его смещения; электролитическая диссоциация, гидратация молекул и ионов; ионы, их классификация и свойства; электрохимический ряд напряжения металлов; б) разъяснять смысл химических формул и уравнений; объяснять действие изученных закономерностей ( сохранение массы веществ при химических реакциях); определять степень окисления атомов химических элементов по формулам их соединений; составлять уравнения реакций, определять по составу (химическим формулам) принадлежность веществ к различным классам соединений и характеризовать их химические свойства, в том числе и в свете теории электролитической диссоциации; устанавливать генетическую связь между классами неорганических соединений и зависимость между составом вещества и его свойствами. в) обращаться с лабораторным оборудованием; соблюдать правила техники безопасности; проводить простые химические опыты; наблюдать за химическими процессами и оформлять результаты наблюдений; г) производить расчёты по химическим формулам и уравнениям с использованием изученных понятий.