Анальгетическая активность Мидокалма дополняет воздействие
реклама

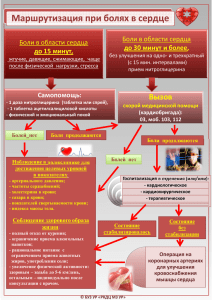
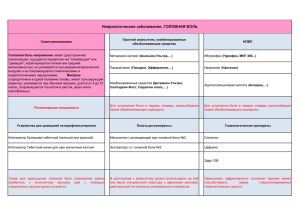
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ Аналгетическая активность Мидокалма дополняет воздействие на мышечный спазм Szolcsanyi J. (факультет общей медицины РТЕ) PTE B University of Pecs, Hungary prof. Janos Szolcsanyi / Янош Солчани B директор Института фармакологии и фармакотерапии при Печском университете, Венгрия Farkas S (Gedeon Richter Corp.) Шандор Фаркаш B профессор, Директор Отдела исследований эффективности и безопасности лекарственных средств, А.О. ГЕДЕОН РИХТЕР, Будапешт, Венгрия Walter Zieglgansberger ! Институт психиатрии им. Макса Планка, Мюнхен, Германия Herman Locher B ортопед и специалист по лечению боли, Тетнанг, Германия G. Fels B Университет Падеборна, Германия M. Feher, P. Geher ! Национальный институт медицинской реабилитации, Будапешт, Венгрия H. Kokemohr B частнопрактикующий врач, Хилден, Германия Боль является наиболее распространенным симптомом, причиняющим страдания миллионам людей во всем мире. По оценкам экспертов, боль < спутник 70<90 % всех известных заболеваний, а распространенность хронических болевых синдромов составля< ет 45<68 %. Одной из ведущих причин хронизации болевых синдромов является неадекватная терапия пациентов с острой болью (Gatchel et al., 1995), поэтому для предотвращения развития хронических болевых синдромов каждый больной с острой болью нуж< дается в адекватном лечении, основанном на четком понимании этиопатогенеза испытываемых им болей. К настоящему времени накоплен значительный экспериментальный и клинический материал по изучению механизмов боли. По< лучены данные о роли свободных нервных окончаний в восприятии повреждающих стимулов, об участии Aδ< и С<афферентных во< локон в проведении болевых сигналов, прослежены основные восходящие пути и нервные структуры спинного мозга, ствола мозга, таламуса и коры больших полушарий, осуществляющие передачу и обработку болевой информации. Выделены нейромедиаторы, опосредующие болевые реакции. Установлены структуры спинного и головного мозга, химические вещества и их рецепторы, обес< печивающие подавление болевого ощущения. Показаны тонкие механизмы межнейронального взаимодействия в изменении болевой чувствительности при воспалении, травме, ишемии, при повреждении нервных структур. Доказано изменение фенотипа перифе< рических и центральных нейрональных образований в динамике развития болевого синдрома. На каждом уровне обработки болевой информации происходят пластические изменения межнейрональных связей и активируют свои механизмы регуляции болевой чув< ствительности. Понимание механизмов нейрональной пластичности легло в основу концепции предупреждающей аналгезии, реали< зация которой уже дала важные клинические результаты: появляются новые препараты и новые схемы их применения для меди< каментозной профилактики долгосрочных изменений в ЦНС, вызываемых постоянной болевой стимуляцией. При повреждении тканей порог активации болевых рецепторов, как правило, снижается в результате действия алгогенов (хи< мических веществ, возбуждающих болевые рецепторы) и изменения соотношения натриевых каналов разных типов на мембране но< цицепторов, что приводит к повышению возбудимости и реактивности болевых рецепторов к внешним стимулам и развитию в зо< не повреждения первичной гипералгезии. Важность этих структурных изменений в периферическом нерве для формирования гипер< алгезии позволяет предположить, что при разработке новых анальгетиков особое внимание должно быть сосредоточено на способ< ности этих препаратов блокировать натриевые каналы ноцицепторов. Реакция ноцицептивных структур ЦНС при активации болевых рецепторов усиливается в результате сенситизации ноцицеп< тивных нейронов, что клинически проявляется появлением зон вторичной гипералгезии и аллодинии. Центральная сенситизация обусловлена выделением в дорзальных рогах спинного мозга L<глутамата и вещества Р<нейропептида, который давно рассматри< вается как центральный нейромедиатор боли. Развившаяся вследствие повреждения тканей сенситизация ноцицептивных нейро< нов закрепляется механизмами нейропластичности. L<глутамат и нейрокинины усиливают поступление в нейроны ионов Са2+ че< рез NMDA<регулируемые каналы, что, в свою очередь, активирует гены раннего реагирования (immediate<early genes), такие как c< fos, c<jun, junB и др. Они кодируют факторы транскрипции, изменяющие экспрессию и трансляцию структурных генов, обеспечи< вающих синтез ферментов, рецепторов и нейромедиаторов, поддерживающих длительную гипервозбудимость нейронов. Актива< ция генов раннего реагирования наблюдается уже через 15 мин. после повреждения тканей. Активация описанного выше каскада процессов сенситизации ноцицептивных нейронов в ЦНС может быть предотвращена ли< бо путем ослабления входящей импульсации в спинной мозг, например путем блокады натриевых каналов, либо путем угнетения возбуждения нейронов спинного мозга. Разнообразие изменений, происходящих при формировании хронической боли, предоставляет новые мишени для проведения селективной лекарственной терапии. В конце прошлого века, 4 октября 1999 г., в Будапеште состоялся симпозиум по Мидокалму (толперизона гидрохлорид), на ко< тором обсуждались вопросы возможного применения блокаторов натриевых каналов для лечения боли. Учитывая новые теории о механизмах развития боли, возникает вопрос: может ли Мидокалм, являющийся миорелаксантом со свойствами блокатора на< триевых каналов, также обладать обезболивающим действием? В данной публикации приведены новые теоретические представ< ления о механизмах развития боли, о роли блокаторов натриевых каналов в лечении боли. КАЧЕСТВЕННАЯ КЛИНИЧЕСКАЯ ПРАКТИКА №1, 2003 83 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ Механизмы развития острой и хронической боли Боль – важная адаптационная реакция организма, имеющая значение сигнала при повреждении тканей. Однако когда интенсивность боли велика и она соB храняется продолжительное время, боль теряет свое физиологическое значение и может считаться патоB логией. Острая боль появляется при воздействии инB тенсивного механического, термического или химиB ческого стимула. Ощущение острой боли длится коB роткое время, четко локализуется, и характер боли заB висит от типа активированных нервных волокон. АδB волокна опосредуют формирование эпикритической боли, СBафференты – протопатической. НепрерывB ная стимуляция болевых рецепторов (ноцицепторов) в условиях повреждения тканей со временем привоB дит к снижению порога их возбудимости (сенситизаB ции), и неболевые стимулы тоже начинают вызывать болевые ощущения. Это явление называют аллодини< ей, а повышенную чувствительность к болевым стиB мулам B гипералгезией. Развитие первичной гипералге< зии связывают с тем, что при повреждении клеток тканей из них выделяются вещества (алгогены), поB вышающие чувствительность болевых рецепторов к внешним и внутренним стимулам. Повышение чувстB вительности болевых рецепторов (сенситизация) обусловлена активацией внутриклеточных протеинB киназ, фосфорилирующих белки ионных каналов. В результате этого фосфорилирования даже при воздейB ствии слабого механического, термического или хиB мического стимула формируется потенциал действия. Гиперчувствительность ноцицепторов также может быть вызвана нарушением баланса экспрессии генов, кодирующих белки различных натриевых каналов, что может приводить к изменению электрогенеза и повыB шению амплитуды потенциалов действия. Патофизиологической основой вторичной гиперB алгезии или повышения болевой чувствительности вне зоны повреждения тканей является сенситизация ноB цицептивных нейронов центральной нервной систеB мы. Длительная болевая афферентация, распространяB ющаяся по СBволокнам, стимулирует в дорзальных роB гах спинного мозга секрецию различных возбуждаюB щих нейромедиаторов (вещество Р, нейрокинин А, кальцитонинBгенBродственный пептид, глутаминовая кислота), которые связываются с соответствующими рецепторами (NMDA, NK1, NK2) на постсинаптичесB кой мембране ноцицептивных нейронов и запускают каскад реакций (через вторичные мессенджеры B ионы Са2+, третичные мессенджеры B гены раннего реагироB вания и т.д.), в результате которых повышается чувстB вительность нейронов, снижается порог их возбуждеB ния и даже формируется спонтанная спайковая активB ность. Данные изменения в активности ноцицептивB ных нейронов дорзальных рогов спинного мозга иниB циируют повышение возбудимости ноцицептивных нейронов и в вышележащих центрах, включая ядра таB 84 №1, 2003 ламуса и соматосенсорную кору больших полушарий. Посредством механизмов нейропластичности улучшаB ется эффективность синаптической передачи, способB ствующая развитию «болевой памяти». Боль становитB ся длительной. Восстановление и устранение этих изB менений требует активной патогенетической терапии. Для лечения острой мышечной боли и профилактиB ки хронизации этого процесса исключительно важное значение имеет ослабление импульсации, поступаюB щей к нейронам задних рогов спинного мозга. ЧастичB ная блокада натриевых каналов способствует ослаблеB нию болевой импульсации, поступающей к нейронам задних рогов спинного мозга. Благодаря этому уменьB шается выброс возбуждающих нейромедиаторов и нормализуется активность ноцицептивных нейронов в ЦНС. При длительном поддержании этого состояния могут наблюдаться восстановление структурных измеB нений в нейронах и предотвращение развития хрониB ческой боли. Роль натриевых каналов сенсорных нейронов в восприятии боли В физиологических условиях система восприятия боли активируется при стимуляции болевых рецептоB ров. Формирующиеся в болевых рецепторах потенциаB лы действия передаются в ЦНС по немиелинизированB ным СBволокнам или тонким миелинизированным AδB волокнам. В проведении импульса по аксону большую роль играет активация натриевых каналов, которая моB жет быть подавлена местными анестетиками. Недавно было установлено, что натриевые каналы можно раздеB лить на несколько подтипов, имеющих различные фарB макологические и функциональные свойства. Так назыB ваемые быстрые каналы (быстро открывающиеся и быB стро закрывающиеся) селективно блокируются тетроB дотоксином, поэтому их иногда называют тетродоксинB чувствительными каналами (ТЧК). Эти каналы присутB ствуют во всех типах сенсорных нейронов. Натриевые каналы, нечувствительные к тетродотоксину (ТНЧК), инактивируются значительно медленнее и поэтому дольше остаются открытыми. Эти каналы присутствуют в нейронах, играющих ключевую роль в активации ноB цицептивных капсаицинBчувствительных нейронов, отB ветственных за восприятие боли. Капсаицин B жгучий компонент красного перца B вызывает ощущение боли благодаря тому, что открывает натриевые каналы, актиB вируемые также термическим воздействием. Данные каналы отсутствуют в сенсорных нейронах, чувствиB тельных к механическому воздействию или холоду. Роль натриевых каналов в формировании хронической боли Известно, что в участках повреждения периферичеB ского нервного волокна плотность натриевых каналов увеличивается и это приводит к генерации эктопичесB КАЧЕСТВЕННАЯ КЛИНИЧЕСКАЯ ПРАКТИКА ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ кой импульсации (потенциалов действия большой амплитуды). Одновременно активируются ранее заB крытые каналы и наблюдается аномальная экспрессия белков натриевых каналов B увеличивается количество ТЧК и снижается ТНЧК. Доказано также, что при восB палении тканей на мембране ноцицепторов происхоB дит изменение фенотипа натриевых каналов, способB ствующее поддержанию патологической боли. ПоэтоB му использование в клинической практике ингибитоB ров натриевых каналов позволяет эффективно боротьB ся с болью. Новые перспективы в лечении боли Появившиеся в последнее время новые представB ления о роли ионных каналов в развитии боли стимуB лировали исследования по поиску потенциально перспективных анальгетиков, которые действовали бы путем селективной блокады ионных каналов боB левых рецепторов и связанных с ними аксонов. В наB стоящее время идентифицированы различные подтиB пы натриевых каналов, выделен «тепловой рецептор» капсаицина, в результате чего была инициирована серия очень эффективных исследований по разраB ботке анальгетиков, селективно воздействующих на болевые рецепторы. Параллельно с этим происходиB ла переоценка возможного анальгетического дейстB вия уже применяющихся препаратов. Например, изучалась возможность обезболивающего действия противоаритмических препаратов, обладающих свойствами блокаторов натриевых каналов (мексилеB тина и токаинида). Хотя эти исследования пока не привели к прорыву в этом направлении, теоретичесB кие рассуждения и клинические данные указывают на необходимость изучения анальгетических свойств у других препаратов, которые, судя по их химической структуре, могут влиять на аномальную активность натриевых каналов в патологических условиях. соким сродством к ионным каналам клеточных мембB ран нейронов. Толперизон дозозависимо подавляет активность натриевых каналов мембран нейронов. Мидокалм и лидокаин имеют в своей структуре липоB и гидрофильB ные части, способные связываться с различными комB понентами ионных каналов. В обоих веществах имеются третичный атом азота (который может связыB вать водород) и карбонильная группа. Эти группы свяB зываются с натриевыми каналами водородными связяB ми. Связывающие участки каналов пока еще точно не установлены, но они активно изучаются (рис. 2). В соB ответствии с этой мембраностабилизирующей (лидоB каинBподобной) активностью, толперизон снижает чаB стоту формирования потенциалов действия в ноциB цептивных периферических нервных волокнах, тормоB зит повышенную моноB и полисинаптическую рефлекB торную активность в спинном мозге и подавляет патоB логически усиленную импульсацию из ретикулярной формации ствола мозга. При применении толперизона отсутствует мышечB ная слабость, обычно наблюдаемая при приеме других миорелаксантов. Это может быть связано с исключиB тельно слабым сродством толперизона к двигательным нервным волокнам. После перорального применения толперизон полB ностью (100%) всасывается и накапливается в наиB больших концентрациях в стволе мозга, спинном мозB ге и периферической нервной системе. Максимальная концентрация в плазме крови достигается примерно Рис. 1 Структура толперизона гидрохлорида (1) и лидокаина (2) О CH3 CH3 NH N О CH3 CH3 CH3 Мидокалм – миорелаксант, обладающий свойствами блокатора натриевых каналов Мидокалм (толперизона гидрохлорид), синтезироB ванный J.Porszasz и K.Nador, в течение многих лет приB меняется как миорелаксант центрального действия для терапии болезненного мышечного спазма при дегенеB ративных и воспалительных заболеваниях нервной сиB стемы. Важными преимуществами Мидокалма, выдеB ляющими его в группе центральных миорелаксантов, является отсутствие седативного действия и отсутствие привыкания. Структура толперизона (Мидокалма), который, с химической точки зрения, является бетаBаминокетоB ном, близка к структуре местных анестетиков, осоB бенно лидокаина (рис. 1). Как и лидокаин, толпериB зон является амфотерной молекулой, имеет в своем составе гидроB и липофильную части и обладает выB КАЧЕСТВЕННАЯ КЛИНИЧЕСКАЯ ПРАКТИКА 1 CH3 2 Рис. 2 Предполагаемая схема связывания миорелаксантов N H N CH3 №1, 2003 H 85 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ через 1,5 ч после приема препарата. После первого прохождения через печень в крови остается 20% исB ходной дозы препарата. Толперизон и его метаболиты (которых к настоящему времени обнаружено 11) выB водятся через почки с периодом полувыведения приB мерно 2,5 ч. Следует подчеркнуть, что толперизон (Мидокалм) B высокобезопасный препарат с широким терапевтичесB ким диапазоном. Он не накапливается в организме и не вызывает зависимости. До настоящего времени не выявлено лекарственного взаимодействия с алкоголем или седативными препаратами. Обезболивающее действие Мидокалма ранее свяB зывали только с торможением проведения болевых реB флексов в спинном мозге. Современные исследования доказали, что эффекты Мидокалма реализуются также на более высоких уровнях (в первую очередь, в стволе мозга), где препарат влияет на активность нисходящих экстрапирамидных двигательных путей и таким обраB зом подавляет процесс генерализации судорог. Кроме того, Мидокалм угнетает формирование афферентных импульсов непосредственно в ноцицептивных волокB нах (рис. 3). Эти свойства Мидокалма позволяют отнести его как к группе центральноBактивных миорелаксантов, так и к группе блокаторов натриевых каналов. ПрепаB рат селективно ослабляет патологический спазм мышц, не влияя в терапевтических дозах на нормальB ные сенсорные и двигательные функции ЦНС (мыB шечный тонус, произвольные движения, координацию движений) и не вызывая седативного эффекта, мыB шечной слабости и атаксии. Обширные электрофизиологические исследоваB ния показали, что механизм вызываемого МидокалB мом торможения проведения рефлексов в спинном мозге связан с подавлением секреции глутаминовой кислоты из центральных терминалей первичных афB ферентных волокон за счет блокады натриевых и чаB Рис. 3 Участки действия МИДОКАЛМа в нервной системе МИДОКАЛМ Супраспинальные структуры Сенсорные рецепторы Мышцы 86 АфферентB ные волокна Рефлекторный аппарат спинного мозга Эфферентные волокна №1, 2003 стично кальциевых каналов. Помимо этого, МидоB калм угнетает возбудимость ноцицептивных нейроB нов и мотонейронов (рис. 4). Совокупность предB ставленных данных свидетельствует о том, что МидоB калм может быть использован не только для лечения острой боли, но и для профилактики развития хроB нических болевых синдромов. Теоретические представления и клинические реB зультаты открывают перед этим препаратом новые перспективы. Лечение острой и хронической боли в пояснице Поясничные боли являются наиболее распростраB ненной формой болевых синдромов и наиболее частой причиной нетрудоспособности. В большинстве случаB ев при поясничной боли наблюдается повышение тоB нуса паравертебральных мышц. Вместе с тем для наB значения обоснованного лечения болей в пояснице необходимо провести тщательный анализ характера боли, установить их причину и выяснить механизмы, лежащие в основе данного симптомокомплекса. С точB ки зрения патогенетических процессов, боль может быть обусловлена: B нейрогенным воспалением, возникающим при секреB ции алгогенов (вещество Р, нейрокинин А, кальциB тонинBгенBродственный пептид) из периферичесB ких терминалей СBафферентов в области повреждеB ния тканей. Эти алгогены вызывают расширение сосудов и увеличивают их проницаемость. Кроме этого, они способствуют высвобождению из тучных клеток и лейкоцитов простагландинов, цитокинов и биогенных аминов, которые повышают возбудиB мость болевых рецепторов. Такую боль можно леB чить ингибиторами циклооксигеназы; B повреждением нервных структур и возникновением нейропатической боли. Такую боль можно лечить толперизоном (Мидокалм) или другими блокатораB ми натриевых каналов; B активацией альфа! и гамма!мотонейронов передних рогов спинного мозга вследствие раздражения болеB вых рецепторов в тканях. Классическими примераB ми такой боли являются болезненное повышение тонуса мышц, эпикондилит и распространенный тендомиозит. Эти состояния B основные показания к применению толперизона (Мидокалма); B активацией симпатической системы, приводящей к усилению нейрогенного воспаления, сенситизации ноцицепторов и развитию первичной гипералгезии. Необходимо также помнить, что хронизации поясB ничной боли способствуют психогенные и социальные факторы. При анализе болей в спине помимо выяснения жаB лоб больного важно установить характер морфологиB ческих изменений позвоночника и наличие сопутствуB ющих заболеваний со стороны внутренних органов и психоBэмоциональной сферы пациента. Этот метод КАЧЕСТВЕННАЯ КЛИНИЧЕСКАЯ ПРАКТИКА ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ Рис. 4 Механизм вызываемого торможения проведения рефлексов в спинном мозге МИДОКАЛМ Формирование спайков МИДОКАЛМ NaB NaB Ca2B Первичное нервное волокно диагностики позволяет дифференцированно назнаB чать различные комбинированные схемы лечения. ТеB рапия включает различные лечебные мероприятия: консервативное ортопедическое лечение, психотераB пию, физиоB и бальнеотерапию, медикаментозное леB чение. В последнее время для медикаментозной тераB пии все шире применяется Мидокалм. Опыт применения Мидокалма в ревматологии, неврологии и реабилитации больных В соответствии с фармакологическим действием, Мидокалм назначают в случаях патологического поB вышения мышечного тонуса. В частности, препарат показан при спастическом синдроме, вызванном пораB жением нисходящих двигательных путей головного и спинного мозга, а также при мышечных спазмах, выB званных заболеваниями суставов. Особо следует выдеB лить эффективность препарата при введении его в комплексную терапию в случаях длительной реабилиB тации больных. В рандомизированных двойных слепых плацебоB контролируемых клинических исследованиях, в котоB рых участвовали более 1000 неврологических больных, была доказана высокая терапевтическая эффективB ность Мидокалма. Для проверки эффективности препарата в ревмаB тологии было проведено 25 клинических исследоваB ний, в которых участвовали почти 3000 больных. ПоB следнее по времени двойное слепое плацебо контроB лируемое исследование методов, проведенное в соотB ветствии с требованиями качественной клинической практики (GCP), было выполнено Pratzel H.G. с соB авт. В этом исследовании авторы показали высокую эффективность Мидокалма при лечении больных с остеоартритом и спондилезом. Основное преимущество Мидокалма перед другиB ми миорелаксантами центрального действия заключаB ется в очень малом количестве побочных эффектов даB же при длительном применении. Ретроспективный анализ побочных эффектов препарата у 66 больных, принимавших Мидокалм в дозе 450 мг/сут в среднем в течение 428 дней, не выявил ни одного случая серьезB Вызываемый глутаматом ВПСП Мотонейрон ного побочного эффекта, который потребовал бы отB мены лечения. Мидокалм как компонент комплексной программы лечения хронического болевого синдрома опорноGдвигательного аппарата Боль, связанная с патологией опорноBдвигательноB го аппарата, составляет 20 B 30% жалоб, предъявляемых клиентами частной медицинской практики. Хотя симптомы боли у разных больных очень похожи, при хронизации процесса они у каждого больного станоB вятся уникальными. Помимо боли, пациенты часто страдают различными вегетативными и психическими симптомами, из которых наиболее частыми являются депрессия и синдром хронической усталости. Лечение таких больных должно быть комплексным. В отличие от других областей медицины, в этих случаях редко моB жет быть применен классический научный подход, и схема лечения чаще подбирается эмпирически, исходя из оценок и больного, и врача. Соответственно, эфB фективность лечения контролируется главным обраB зом по ощущениям и впечатлениям. Чтобы составить собственное общее впечатление об эффективности Мидокалма при лечении боли, осоB бенно хронического болевого синдрома, был проведен ретроспективный анализ результатов лечения 100 больных, обратившихся в частную медицинскую пракB тику с жалобами на боль двигательного аппарата. УдеB ляя особое внимание показателям «боль» и «депресB сия», проводили анализ для получения ответа на следуB ющие вопросы: 1. Можно ли выделить группу больных, у которых включение толперизона в схему лечения дополниB тельно дает выраженный эффект? 2. При каком типе болевого синдрома применение толперизона обеспечивает наилучшие быстрые реB зультаты? 3. Улучшает ли толперизон без применения антидеB прессантов психические и/или вегетативные симпB томы, сопровождающие подострую или хроничесB кую боль? Полученные результаты позволяют сделать следуюB КАЧЕСТВЕННАЯ КЛИНИЧЕСКАЯ ПРАКТИКА №1, 2003 87 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ щие выводы, характеризующие эффективность МидоB калма при его применении: 1. В высокой (не менее 450 мг) суточной дозе на отноB сительно ранней стадии развития острой боли преB парат эффективен, даже если первоначально исB пользованные анестетики, иглорефлексотерапия и мануальная терапия не давали положительных реB зультатов. 2. При клинически выраженном обострении ранее лаB тентной хронической боли в значительном числе случаев монотерапия толперизоном была эффекB тивна. 3. При хронической боли толперизон целесообразен как основной препарат, в том числе если боль соB четается с психическими и вегетативными симпB томами. В соответствии с наблюдениями авторов исследования, эффективность толперизона при лечеB нии острой и хронической боли возрастает, если он применяется: • Как можно раньше. • В дозах, достаточных для полного подавления симпB томов (в большинстве случаев это 450 мг в сутки). • В течение всего индивидуально необходимого конB кретному больному срока лечения. Добавление Мидокалма в схемы комбинированной терапии повышает их эффективность. Отсутствие побочных эффектов делает препарат пригодным для длительного лечения хронической боB ли, особенно благодаря тому, что он позволяет снизить дозы или даже совсем отменить нестероидные протиB вовоспалительные средства и таким образом уменьB шить частоту тяжелых побочных эффектов этих препаB ратов. Abstract October 4, 1999, in Budapest the symposium on Mydocalm (Tolperison hydrochloride) was performed, on which the prob6 lems of possible application of sodium channels blockers for pain treatment were discussed. Taking into account the new theories about mechanisms of development of a pain, there is a problem: whether Mydocalm being a relaxant with properties of sodium channels blockers, also can to have anesthetizing action? In the given publication the new theoretical representa6 tions on mechanisms of development of pain and a role of sodi6 um channels blockers in treatment of pain are reviewed. ЛИТЕРАТУРА 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Dubner R., Gold M. The neurobiology of pain // Proc. Natl. Acad. Sci. USA. Vol. 96. P. 7627B7630. Farkas S. et al. – Comparative characterisation of the centrally acting relaxant RGH:5002 and tolperisone and of lidocaine based on their effects on rat spinal cord in vitro: Neurobiology 5(1), pp. 57B58, 1997 Farkas S. et al. – Studies on the mechanism of action of RGH:5002, a centrally acting muscle relaxant, using whole cell patch clamp technique: Neurobiology 5(1), pp. 43B45, 1997 Fels G. – Tolperisone: evaluation of the lidocainBlike activity by molecular modeling: Arch. Pharm. Med. Chem. 329, pp. 171B178, 1996; RGD:48682/E Furst Zsuzsanna (editor): Pharmacology B Medicina publishers Bp., 1998 Gatchel R.J, Polatin P.B, Mayer T.G. The dominant role of psychosocial risk factors in the development of chronic low back pain disability // Spine. B 1995. B № 20. BР. 2702B2709 Gold M.S., Levine J.D., Correa A.M. – Modulation of TTXBR I Na by PKC and PKA and their role in PGE2Binduced densitization of rat sensory neurons in vitro: J. of Neurosci. 18 (24), pp. 10345B10355, 1998 Gold M.S. – TetrodotoxinBresistant Na+ currents and inflammatory hyperalgesia: Proc. Natl. Acad. Sci. USA, Vol. 96, pp. 7645B7649, July 1999 Gould III. H.J. et al. – Development of inflammatory hypersensivity and augmentation of sodium channels in rat dorsal root ganglia: Brain Res., 824, pp. 296B299, 1999 Hirade M. et al. – TetrodotoxinBresistant sodium channels of dorsal root ganglion neurons are readily activated in diabetic rats: Neuroscience, Vol. 90, pp. 933B939, 1999 Novakovic S.D. et al. – Distribution of the tetrodotoxinBresistant sodium channel PN3 in rat sensory neurons in notmal and neuropathic conditions: J. of Neurosci. 18 (6), pp. 2174B2187, 1998 Pratzel H.G., Alken R.G., Ramm S. – Efficacy and tolerance of repeated oral doses of tolperisone hydrochloride in the treatment of painful reflex muscle spasm: results of prospective placeboBconB trolled doubleBblind trial: Pain, 67, pp. 417B425, 1996 Strathmann AG B Anwendugsbeobachtung MYDOCALM (The study performed in Germany investigating the efficacy and tolerability of MYDOCALM (tolperisone) on 5130 patients suffering in painful muscle spasm, author of the report KohneBVolland R., Metronomia GmbH): RGD:53669/G Tony L. Yaksh – Spinal system and pain proceeding, development of novel analgesic drugs with mechanistically defined models: Trends in Pharmacological Sciences, Vol. 20, pp. 329B337, August 1999 Vizi E. Szilveszter (editor): Pharmacology B Medicina publishers Bp., 1997 Waxman S.G. et al. – Sodium channels and pain: Proc. Natl. Acad. Sci. USA, Vol. 96, pp. 7635B7639, July 1999 Waxman S.G. – The molecular pathophysiology of pain, abnormal expression of sodium channel genes and its contributions to hyperexcitability of primary sensory neurons: Pain supp., 6, s133B s140, 1999 MEDI.RU Подробно о лекарствах в сети Интернет 88 №1, 2003 КАЧЕСТВЕННАЯ КЛИНИЧЕСКАЯ ПРАКТИКА