главных подгруппах
реклама

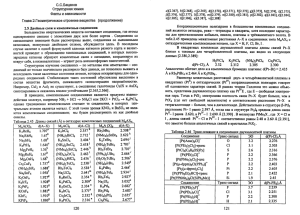
Зависимость свойств элементов от периодического изменения строения атомов. Рассмотрим зависимость некоторых свойств атомов от строения их электронных оболочек. Остановимся, прежде всего, на закономерностях изменения атомных и ионных радиусов. Электронные облака не имеют резко очерченных границ. Поэтому понятие о размере атома не является строгим. Но если представить себе атомы в кристаллах простого вещества в виде соприкасающихся друг с другом шаров, то расстояние между центрами соседних шаров (т. е. между ядрами соседних атомов) можно принять равным удвоенному радиусу атома. Зависимость атомных радиусов от заряда ядра атома Z имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атома, что особенно четко наблюдается в коротких периодах (радиусы атомов приведены в нм): Это объясняется увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда. С началом застройки нового электронного слоя, более удаленного от ядра, т. е. при переходе к следующему периоду, атомные радиусы возрастают (сравните, например, радиусы атомов фтора и натрия). В результате в пределах подгруппы с возрастанием заряда ядра размеры атомов увеличиваются. Приведем в качестве примера значения атомных радиусов (в нм) элементов некоторых главных подгрупп: Электроны наружного слоя, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот, атомы, присоединившие к себе лишние электроны, заряжаются отрицательно. Образующиеся заряженные частицы называются ионами. Ионы обозначают теми же символами, что и атомы, указывая справа вверху их заряд: например, положительный трехзарядный ион алюминия обозначают Al+3, отрицательный однозарядный ион хлора Cl - . Потеря атомов электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов — к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного нона (аниона) всегда больше радиуса соответствующего электронейтрального атома. Так, радиус атома калия составляет , а радиус иона радиусы атома хлора и иона соответственно равны 0,099 и . При этом радиус иона тем сильней отличается от радиуса атома, чем больше заряд иона. Например, радиусы атома хрома и ионов и составляют соответственно 0,127 и 0,083. В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Это иллюстрируется следующими примерами (радиусы ионов даны в нм): Такая закономерность объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра. Силы электростатического взаимодействия зависят от формы и размеров наэлектризованных тел, а также от характера распределения заряда на этих телах. В некоторых случаях можно пренебречь формой и размерами заряженных тел и считать, что каждый заряд сосредоточен в одной точке. Точечный заряд – это электрический заряд, когда размер тела, на котором этот заряд сосредоточен, намного меньше расстояния между заряженными телами. Закон Кулона описывает количественно силы взаимодействия заряженных тел. Сформулирован он для неподвижных точечных зарядов расположенных в вакууме. Это фундаментальный закон то есть он не следует, из какого либо другого закона, а установлен из эксперимента. Взаимодействие двух покоящихся точечных зарядов определяет основной закон электростатики – закон Кулона. Этот закон экспериментально установил в 1785 году французский физик Шарль Огюстен Кулон (1736 – 1806). Формулировка закона Кулона следующая: Силы взаимодействия между неподвижными зарядами прямо пропорциональна произведению модулей этих зарядов о также обратно пропорциональна расстоянию в квадрате между этими зарядами. Столь сложный для понимания учащимися 8-9 классов материал необходимо эффективно и безболезненно донести через наглядную модель «Снеговик» (см. Приложение ). Эта модель соединяет в себе визуальнопространственное («картинное») и абстрактно-символическое («знаковое») представление о силах, действующих в атомном микромире, а также о следствии действия этих сил на величины радиусов. С увеличением зарядов ядер атомов в периодах притяжение ядром электронных оболочек усиливаетсяпроисходит своеобразное «сжатие» их, и радиус атома уменьшается. («морковка снеговика»).Электроны последнего уровня удерживаются прочнее элементами с малыми радиусами атомов – неметаллами, расположенными в конце каждого периода. Атомы же металлов имеют большие радиусы, располагаясь в начале периода, поэтому легко отдают валентные электроны с последнего уровня. Схема позволяет легко осуществить переход к формированию у учащихся понятия – электроотрицательность химического элемента как способности атома притягивать (и удерживать на последнем электронном уровне) к себе электроны в соединении. В главных подгруппах наблюдается увеличение радиусов сверху вниз(«туловище снеговика»).Это объясняется увеличением числа электронных слоев в атомах. Поэтому легкость отдачи электронов увеличивается, а электроотрицательность уменьшается. Следовательно, усиливаются металлические свойства элементов. Модель «Снеговик» позволяет наглядно установить обратную зависимость между понятиями « величина радиуса атома» и «электроотрицательность» у элементов, расположенных как в одном периоде, так и в главных подгруппах: чем меньше радиус, тем больше электроотрицательность элемента. Данный методический прием визуализации учебного материала позволяет учащимся с легкостью выполнять задания на сравнение элекроотрицательности элементов в периодах и в группах даже при отсутствии глубоких научных знаний по теме.