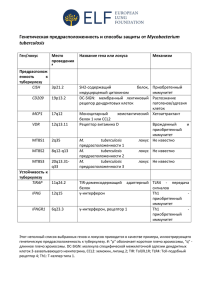
Plus) ELISA - QuantiFERON
реклама

Инструкция-вкладыш QuantiFERON®-TB Gold Plus (QFT®-Plus) ELISA 2 x 96 Тест для определения клеточного ответа на пептидные антигены ESAT-6 и CFP-10 по уровню IFN- в цельной крови человека Для диагностики in vitro 622120 QIAGEN GmbH QIAGEN Strasse 1 40724 Hilden ГЕРМАНИЯ Тел.: +49-2103-29-0 1083163RU ред. 02 www.QuantiFERON.com www.QuantiFERON.com Содержание Назначение 4 Общие сведения о тесте 4 Принципы анализа 6 Продолжительность теста 7 Реагенты и условия хранения 8 Необходимые материалы, не входящие в комплект набора 9 Хранение и обращение 9 Пробирки для забора крови Реагенты для ELISA Восстановленные и неиспользованные реагенты Предупреждения и меры предосторожности 9 9 9 10 Для диагностики in vitro 10 Предупреждения 10 Меры предосторожности 11 Характеристика опасности Характеристика мер предосторожности Отбор и обработка образцов 11 12 14 Инструкция по применению 16 Этап 1. Инкубирование крови и отбор плазмы Материалы, входящие в комплект поставки Необходимые материалы, не входящие в комплект набора Порядок работы Этап 2. ELISA для выявления IFN- Материалы, входящие в комплект поставки Необходимые материалы, не входящие в комплект набора Порядок работы Расчеты и интерпретация результатов теста Получение стандартной кривой 16 16 16 16 17 17 17 17 21 21 (В случае если программное обеспечение QFT-Plus Analysis Software не используется) Контроль качества теста 22 Интерпретация результатов 22 21 Ограничения 24 Рабочие характеристики 25 Клинические исследования 25 Специфичность Чувствительность при активном туберкулезе Наблюдавшееся распределение ответов — стратификация по степени риска Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 25 26 27 3 Аналитические характеристики Диагноз ЛТБИ Техническая информация 30 32 35 Сомнительные результаты 35 Образование сгустков в плазме крови 35 Руководство по поиску и устранению неполадок 36 Литература 38 Условные обозначения 42 Контактная информация 42 Краткое описание теста 43 Этап 1. Инкубирование образца крови Этап 2. ELISA для выявления IFN- 43 43 Назначение QuantiFERON-TB Gold Plus (QFT-Plus) — диагностическая тест-система для использования in vitro, принцип которой состоит в использовании пептидной смеси, имитирующей протеины ESAT-6 и CFP-10, для стимулирования клеток в гепаринизированной цельной крови. Обнаружение гамма-интерферонов (IFN-) путем твердофазного гетерогенного иммуноферментного анализа (ELISA) проводится с целью определения in vitro клеточного ответа на эти пептидные антигены, ассоциирующиеся с инфекцией Mycobacterium tuberculosis. QFT-Plus является непрямым тестом на инфекцию M. tuberculosis (включая саму болезнь). Проведение теста должно сопровождаться оценкой риска, радиографическими и другими медицинскими диагностическими обследованиями. Общие сведения о тесте Туберкулез — передающаяся контактным путем болезнь, вызываемая инфицированием сложными организмами M. tuberculosis (MTB) (M. tuberculosis, M. bovis, M. africanum). Заражение, как правило, распространяется воздушно-капельным путем от больного, страдающего туберкулезом дыхательных путей. Инфицированный может заболеть туберкулезом в течение периода от нескольких недель до нескольких месяцев, но большинство инфицированных не заболевает. Латентная туберкулезная инфекция (ЛТБИ), заболевание, не передающееся контактным путем и протекающее асимптоматически, присутствует у некоторых индивидуумов, у которых туберкулез может развиться позже, в течение месяцев и лет. Основная цель диагностирования ЛТБИ — назначение медицинского лечения для предотвращения заболевания туберкулезом. До недавнего времени туберкулиновая кожная проба была единственным доступным методом диагностирования ЛТБИ. Чувствительность кожного покрова к туберкулину развивается в течение 2–10 недель после заражения. Тем не менее, у некоторых инфицированных реакция на туберкулин не выявляется. К этой группе относятся больные с нарушенной иммунной функцией по причине ряда заболеваний, 4 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 а также другие инфицированные, не имеющие каких-либо заболеваний. С другой стороны, у некоторых лиц, которые скорее всего не являются инфицированными M. tuberculosis, выявляется чувствительность к туберкулину и положительная реакция на туберкулиновую кожную пробу после вакцинации бациллой Calmette-Guérin (BCG), после инфицирования микобактерией, отличной от комплекса M. tuberculosis, или же в силу других неопределенных факторов. Следует отличать ЛТБИ от туберкулеза, болезни, поражающей легкие и нижние дыхательные пути, болезни, подлежащей регистрации. Иногда поражаются и другие системы органов. Туберкулез диагностируется на основании физических, радиологических, гистологических и микобактериологических данных и данных истории болезней. Тест QFT-Plus является тестом, выявляющим клеточный иммунный ответ на пептидные антигены, симулирующие микобактериальные протеины. Эти протеины ESAT-6 и CFP-10 отсутствуют во всех штаммах BCG и в большинстве нетуберкулезных микобактерий, за исключением M. kansasii, M. szulgai и M. marinum (1). В крови лиц, инфицированных сложными организмами MTB, как правило, содержатся лимфоциты, которые распознают те или иные микобактериальные антигены. Этот процесс распознавания влечет за собой продуцирование и секрецию цитокина, IFN-. Данный тест основан на обнаружении и последующем количественном анализе IFN-. Антигены, используемые в QFT-Plus, представляют собой пептидную смесь, имитирующую протеины ESAT-6 и CFP-10. Многочисленные исследования показали, что эти пептидные антигены стимулируют образование IFN- в Т-клетках инфицированных M. tuberculosis лиц. Такого, как правило, не происходит у неинфицированных лиц или лиц, прошедших BCG-вакцинацию, не страдающих туберкулезом или не входящих в группу риска по ЛТБИ (1–32). Тем не менее, медицинское лечение или какие-либо заболевания, ослабляющие защитные механизмы иммунной системы, потенциально могут ослабить иммунный клеточный ответ IFN-. Организм пациентов, имеющих другие микобактериальные инфекции, может также давать ответную реакцию на протеины ESAT-6 и CFP-10, так как гены, в которых закодированы эти протеины, присутствуют в M. kansasii, в M. szulgai и в M. marinum (1, 23). QFT-Plus используется как для выявления ЛТБИ, так и для диагностирования инфекций комплекса M. tuberculosis у больных пациентов. Положительный результат теста — одно из доказательств наличия туберкулезной болезни, тем не менее, инфекции могут быть вызваны и другими микобактериями (например, M. kansasii), что также приведет к положительному результату. Поэтому необходимы другие медицинские обследования, чтобы подтвердить или исключить наличие туберкулезной болезни. В состав QFT-Plus входят две разных пробирки с антигенами туберкулина: пробирка с антигеном туберкулина 1 (TB1) и пробирка с антигеном туберкулина 2 (TB2). Обе пробирки содержат пептидные антигены из антигенов микобактерий туберкулезного комплекса, ESAT-6 и CFP-10. Пробирка TB1 содержит пептиды из ESAT-6 и CFP-10, которые служат для стимулирования иммунного ответа Т-лимфоцитов CD4+, а пробирка TB2 содержит дополнительный набор пептидов, предназначенных для индукции иммунного ответа цитотоксических Т-лимфоцитов CD8+. В естественном развитии инфекции МБТ Т-клетки CD4+ играют критическую роль в иммунологическом контроле благодаря секреции ими цитокина, IFN-. В настоящее время получены доказательства участия Т-клеток CD8+ в защите организма-хозяина от МБТ путем секреции IFN- и других растворимых факторов, которые активируют макрофаги, подавляющие рост МБТ, уничтожают инфицированные клетки или осуществляют лизис МБТ непосред- Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 5 ственно в клетке (33–35). МБТ-специфичные клетки CD8+ были обнаружены у больных с ЛТБИ и с активной формой туберкулеза, когда высока вероятность обнаружения (36–38) клеток CD8+, продуцирующих IFN-. Кроме того, было установлено, что специфичные к ESAT-6 и CFP-10 Т-лимфоциты CD8+ чаще обнаруживаются у больных с активным ТБ, чем с ЛТБИ, и это может быть связано с недавним воздействием МБТ (39–41). МБТ-специфичные Т-клетки CD8+, продуцирующие IFN-, были также обнаружены у больных с активным ТБ, одновременно инфицированных ВИЧ (42, 43), и у детей младшего возраста, больных ТБ (44). Принципы анализа Система QFT-Plus представляет собой специальные пробирки для забора крови, предназначенные для забора образцов цельной крови. Последующее инкубирование пробирок с образцами крови длится 16–24 ч, после чего плазма изымается и исследуется на наличие в ней IFN-, образующегося в качестве иммунного ответа на пептидные антигены. Тест QFT-Plus выполняется в два этапа. На первом этапе производится забор проб цельной крови в каждую из пробирок для забора крови QFT-Plus, а именно в нулевую контрольную пробирку, пробирки с антигеном туберкулина TB1 и TB2 и пробирку с митогеном. Также можно собрать кровь в отдельную пробирку, содержащую литийгепарин в качестве антикоагулянта, а затем перенести ее в пробирки QFT-Plus. При проведении теста набором QFT-Plus пробирка с митогеном может использоваться в качестве положительного контроля. Это может быть важно в том случае, когда есть сомнения относительно иммунного статуса пациента. Кроме того, пробирка с митогеном служит для контроля правильного обращения с пробой крови и ее надлежащей инкубации. Пробирки QFT-Plus следует в кратчайшие сроки (в течение 16 часов после отбора крови) инкубировать при температуре 37 °C. После 16–24х-часовой инкубации пробирки центрифугируют, изымают плазму и посредством метода твердофазного гетерогенного иммуноферментного анализа ELISA в ней определяется количество IFN- (в МЕ/мл). Результат теста QFT-Plus считается положительным, если IFN- ответ в любой пробирке с антигеном туберкулина значительно превышает значение IFN- (в МЕ/мл) в нулевой контрольной пробирке. В случае пробирки с митогеном проба плазмы, стимулированная митогеном, является положительным контролем IFN- для каждой из тестируемых проб. Слабый ответ на митоген (< 0,5 МЕ/мл) указывает на сомнительный результат, когда образец крови также имеет отрицательный ответ на антиген туберкулина. Такой вариант может возникнуть при недостатке лимфоцитов, снижении активности лимфоцитов из-за неправильной обработки образца, неправильного заполнения/перемешивания пробирки с митогеном или невозможности лимфоцитов пациента продуцировать IFN-. Нулевая контрольная пробирка используется для коррекции фоновых реакций (например, избыточных уровней циркулирующего IFN- или наличия гетерофильных антител). Значение IFN- для нулевой пробирки отнимается от значения IFN- для пробирок с антигеном туберкулина и пробирки с митогеном. 6 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Продолжительность теста Ниже приведены данные по примерной продолжительности теста QFT-Plus ELISA, а также время, необходимое при одновременном тестировании большого количества проб. Инкубирование пробирок с кровью при температуре 37 °C: от 16 до 24 часов ELISA: прибл. 3 часа на каждый планшет ELISA (22 тестируемых) < 1 часа рабочего времени добавить 10–15 мин. на каждый дополнительный планшет Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 7 Реагенты и условия хранения Пробирки для забора крови * 200 шт. Набор для одного пациента № по каталогу 622526 622222 50 10 Nil 50 шт. 10 шт. QuantiFERON TB1 Tube (пробирка QuantiFERON с антигеном туберкулина TB1) (зеленая крышка, белое кольцо) TB1 50 шт. 10 шт. QuantiFERON TB2 Tube (пробирка QuantiFERON с антигеном туберкулина TB2) (желтая крышка, белое кольцо) TB2 50 шт. 10 шт. Mitogen 50 шт. 10 шт. 1 1 Число тестов/упаковка QuantiFERON Nil Tube (нулевая контрольная пробирка QuantiFERON) (серая крышка, белое кольцо) QuantiFERON Mitogen Tube (пробирка QuantiFERON с митогеном) (сиреневая крышка, белое кольцо) Инструкция-вкладыш пробирок для забора крови QFT-Plus Компоненты для ELISA † № по каталогу 622120 Cтрипы для микропланшетов (12 x 8 лунок), покрытые моноклональными антителами мыши против IFN- человека IFN- Standard, lyophilized (стандарт IFN-, лиофилизат) (содержит рекомбинант человеческого IFN-, коровьего казеина и 0,01 % тимерозала) Green Diluent (растворитель зеленого цвета) (содержит коровий казеин, нормальную мышиную сыворотку и 0,01 % тимерозала) Conjugate 100x Concentrate (концентрат конъюгата (100-кратная концентрация), лиофилизированный) (конъюгат антител мыши против IFN- человека с пероксидазой хрена, содержит 0,01 % тимерозала) † 8 2 набора из 12 x 8-луночных планшетов 1 флакон (8 МЕ/мл восстановленного вещества) 1 x 30 мл 1 x 0,3 мл (восстановленного вещества) Wash Buffer 20x Concentrate (промывочный буферный концентрат (20-кратная концентрация) (pH 7,2, содержит 0,05 % ProClin® 300) 1 x 100 мл Enzyme Substrate Solution (раствор ферментного субстрата) (содержит H2O2, 3,3’, 5,5’ тетраметилбензидин) 1 x 30 мл Enzyme Stopping Solution (стоп-реагент, содержащий ферменты) (содержит 0,5 M H2SO4) 1 x 15 мл Инструкция-вкладыш QFT-Plus ELISA * Набор из двух планшетов ELISA 1 Все конфигурации изделия доступны не во всех странах. За дополнительной информацией о доступных для заказа конфигурациях обращайтесь в отдел по работе с клиентами компании QIAGEN (подробная информация на сайте www.qiagen.com). Меры предосторожности и указания об опасностях см. на стр. 10. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Необходимые материалы, не входящие в комплект набора Инкубатор * с температурой 37 ± 1 °C. CO2 не требуется. Градуированные пипетки * переменного объема для дозирования от 10 до 1000 мкл с одноразовыми наконечниками. Калиброванная многоканальная пипетка *, способная дозировать от 50 до 100 мкл, со сменными наконечниками. Шейкер для микропланшетов *. Деионизированная или дистиллированная вода, 2 литра. Промыватель микропланшетов (рекомендуется автоматический промыватель). Считывающее устройство для микропланшет *, оснащенное фильтром 450 нм и эталонным фильтром от 620 нм до 650 нм. Хранение и обращение Пробирки для забора крови Пробирки для забора крови хранить при температуре от 4 до 25 °C. Реагенты для ELISA Набор хранить при температуре от 2 до 8 °C. Не подвергать раствор ферментного субстрата воздействию прямых солнечных лучей. Восстановленные и неиспользованные реагенты Инструкции по восстановлению реагентов представлены на стр. 17. Восстановленный стандартный раствор может храниться до трех месяцев при температуре от 2 до 8 °C. Запишите дату восстановления стандартного раствора. Неиспользованный после восстановления концентрат конъюгата (100x) хранить при температуре от 2 до 8 °C и использовать в течение трех месяцев. Запишите дату восстановления конъюгата. Рабочий конъюгат использовать в течение шести часов с момента приготовления. Рабочий промывочный раствор хранить при комнатной температуре не более двух недель. * Убедитесь, что приборы были проверены и откалиброваны в соответствии с рекомендациями производителя. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 9 Предупреждения и меры предосторожности Для диагностики in vitro Предупреждения Отрицательный результат QFT-Plus не исключает наличия инфекции M. tuberculosis или туберкулеза; ложноотрицательные результаты могут быть обусловлены стадией заражения (например, если образец крови был взят до того, как развилась клеточная иммунная реакция), нарушениями иммунной функции, вызванными другими заболеваниями, ненадлежащим обращением с пробирками после забора крови, несоблюдением инструкции по проведению теста или иными иммунологическими переменными факторами. Положительный результат QFT-Plus не должен являться единственным основанием для вывода о наличии инфекции M. tuberculosis. Несоблюдение инструкции по выполнению теста может привести к ложноположительным результатам. Положительный результат QFT-Plus должен быть подтвержден дальнейшими медицинскими диагностическими исследованиями. Только так можно выявить активный туберкулез (например, исследование мокроты на кислотоустойчивые бактерии и бактериологическое (культуральное) исследование, рентгеновское обследование грудной клетки). Протеины ESAT-6 и CFP-10 отсутствуют во всех штаммах BCG и в большинстве известных нетуберкулезных микобактериях, однако положительный результат QFT-Plus может быть обусловлен и наличием инфекции M. kansasii, M. szulgai или M. marinum. Если есть подозрение на наличие таких инфекций, необходимы альтернативные диагностические исследования. 10 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Меры предосторожности Только для диагностики in vitro. При работе с химическими веществами обязательно надевайте соответствующие халат, одноразовые перчатки и защитные очки. Дополнительную информацию см. в соответствующих паспортах безопасности (ПБ). Для каждого набора QIAGEN и каждого компонента набора их можно найти, просмотреть и распечатать в интернете по адресу www.qiagen.com/safety, где они размещены в удобном и компактном формате PDF. ВНИМАНИЕ. С человеческой кровью и плазмой следует обращаться как с потенциально инфицированными материалами. Соблюдайте соответствующие инструкции по правилам работы с кровью и ее продуктами. Утилизировать образцы и материалы, находившиеся в контакте с кровью или ее продуктами, следует в соответствии с местным, региональным и федеральным законодательством. Следующая характеристика опасности и характеристика мер предосторожности относится к компонентам набора QuantiFERON-TB Gold Plus ELISA. Характеристика опасности QuantiFERON Conjugate (конъюгат QuantiFERON) Содержит борную кислоту. Опасно! Может нанести вред фертильности или нерожденному ребенку. Утилизацию содержимого/контейнера осуществлять на утвержденном предприятии по переработке отходов. В случае воздействия или подозрения на воздействие: обратиться за медицинской помощью. Перед использованием получить специальные инструкции. Хранить под замком. Надевайте соответствующую защитную одежду, перчатки и защиту для глаз/лица. QuantiFERON Enzyme Stopping Solution (стоп-раствор QuantiFERON с ферментами) Содержит серную кислоту. Опасно! Вызывает тяжелые ожоги кожи и повреждения глаз. Может оказывать корродирующее действие на металлы. Утилизацию содержимого/контейнера осуществлять на утвержденном предприятии по переработке отходов. ПРИ ПОПАДАНИИ В ГЛАЗА: промывать проточной водой в течение нескольких минут. Снять контактные линзы, если они имеются и если это легко сделать. ПРИ ПОПАДАНИИ НА КОЖУ (или волосы): снять немедленно всю загрязненную одежду. Промыть кожу водой/под душем. Немедленно обратиться в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР или к врачу. Хранить под замком. Надевайте соответствующую защитную одежду, перчатки и защиту для глаз/лица. QuantiFERON Enzyme Substrate Solution (раствор ферментного субстрата QuantiFERON) Внимание! Вызывает слабое раздражение кожи. Если наблюдается раздражение кожи: обратиться за медицинской помощью. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 11 QuantiFERON Green Diluent (зеленый разбавитель QuantiFERON) Содержит: тринатрия 5-гидрокси-1-(4-сульфофенил)-4-(4-сульфофенилазо) пиразол-3-карбоксилат. Внимание! Может вызывать кожные аллергические реакции. Утилизацию содержимого/контейнера осуществлять на утвержденном предприятии по переработке отходов. Снять загрязненную одежду и выстирать ее перед последующим использованием. Если наблюдается раздражение кожи или сыпь: обратиться за медицинской помощью. Надевайте соответствующую защитную одежду, перчатки и защиту для глаз/лица. QuantiFERON IFN- Standard (стандартный QuantiFERON IFN-) Содержит борную кислоту. Опасно! Может нанести вред фертильности или нерожденному ребенку. Утилизацию содержимого/контейнера осуществлять на утвержденном предприятии по переработке отходов. В случае воздействия или подозрения на воздействие: обратиться за медицинской помощью. Перед использованием получить специальные инструкции. Хранить под замком. Надевайте соответствующую защитную одежду, перчатки и защиту для глаз/лица. QuantiFERON Wash Buffer 20x Concentrate (20-кратный концентрат промывочного буфера QuantiFERON) Содержит смесь: 5-хлор-2-метил-4-изотиазолин-3-он и 2-метил-2Низотиазол-3-он (3:1). Внимание! Может вызывать кожные аллергические реакции. Надевайте соответствующую защитную одежду, перчатки и защиту для глаз/лица. Характеристика мер предосторожности Перед использованием получить специальные инструкции. Надевайте соответствующую защитную одежду, перчатки и защиту для глаз/лица. ПРИ ПОПАДАНИИ НА КОЖУ (или волосы): снять немедленно всю загрязненную одежду. Промыть кожу водой/под душем. ПРИ ПОПАДАНИИ В ГЛАЗА: промывать проточной водой в течение нескольких минут. Снять контактные линзы, если они имеются и если это легко сделать. В случае воздействия или подозрения на воздействие: обратиться за медицинской помощью. Немедленно обратиться в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР или к врачу. Если наблюдается раздражение кожи или сыпь: обратиться за медицинской помощью. Снять загрязненную одежду и выстирать ее перед последующим использованием. Хранить под замком. Утилизацию содержимого/контейнера осуществлять на утвержденном предприятии по переработке отходов. Дополнительная информация Паспорта безопасности: www.qiagen.com/safety Несоблюдение инструкций, приведенных на инструкции-вкладыше QuantiFERON-TB Gold Plus (QFT-Plus) ELISA, может привести к ложным результатам. Перед использованием внимательно прочитайте инструкции. Не используйте набор, если перед использованием на какой-либо бутыли с реагентом обнаружены признаки повреждения или утечки. 12 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Не смешивать и не использовать стрипы для микропланшетов, стандарт IFN-, растворитель зеленого цвета или концентрат конъюгата (100x) с другими QFT-Plusнаборами. Другие реагенты (промывочный буферный концентрат (20-кратная концентрация), раствор ферментного субстрата и стоп-реагент, содержащий ферменты) взаимозаменяемы при условии соблюдения сроков годности и записи информации о партии. Утилизировать неиспользованные реагенты и биологические образцы в соответствии с местным, региональным и федеральным законодательством. Не использовать пробирки для забора крови QFT-Plus или наборы для ELISA после истечения срока годности. Убедитесь в том, что лабораторное оборудование откалибровано/разрешено к применению. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 13 Отбор и обработка образцов В наборах QFT-Plus используются следующие пробирки для забора крови. 1. QuantiFERON Nil Tubes (нулевые контрольные пробирки QuantiFERON) (серая крышка с белым кольцом) 2. QuantiFERON TB1 Tubes (пробирки QuantiFERON с антигеном туберкулина TB1) (зеленая крышка с белым кольцом) 3. QuantiFERON TB2 Tubes (пробирки QuantiFERON с антигеном туберкулина TB2) (желтая крышка с белым кольцом) 4. QuantiFERON Mitogen Tubes (пробирки QuantiFERON с митогеном) (сиреневая крышка с белым кольцом) Следуйте приведенным ниже указаниям для пробирок с литий-гепарином. На внутренней стенке пробирки для сбора крови содержатся высушенные антигены, поэтому важно тщательно перемешать ее содержимое. Затем пробирки QFT-Plus следует как можно скорее (в течение 16 часов после забора крови) переместить в инкубатор с температурой 37 °C. Для достижения оптимального результата необходимо соблюдать следующие процедуры 1. Промаркируйте пробирки. Убедитесь в том, что при снятом колпачке каждую пробирку (Nil, TB1, TB2 и Mitogen) можно идентифицировать по этикетке или другим признакам. 2. Методом венепункции соберите по 1 мл крови каждого пациента для каждой из пробирок QFT-Plus. Данная процедура должна проводиться квалифицированным флеботомистом. Важное примечание. Температура пробирок во время сбора крови должна составлять 17–25 °C. Пробирки QFT-Plus для забора крови могут использоваться на высотах до 810 м над уровнем моря. Кровь набирается в пробирку объемом 1 мл относительно медленно, поэтому, как только пробирка будет заполнена, подержите ее на игле 2–3 секунды. Это обеспечит забор нужного объема крови. Черная метка на стенке пробирки обозначает проверенный диапазон 0,8–1,2 мл. Если уровень крови в какой-либо пробирке выходит за пределы этого диапазона, необходимо получить еще одну пробу крови. Если при заборе крови используется катетер типа «бабочка», необходимо использовать «пробную» пробирку, чтобы убедиться в наполнении трубки кровью, прежде чем использовать пробирку для забора крови для теста QFT-Plus. Если пробирки QFT-Plus используются на высоте более 810 метров или требуется малый объем крови, можно собрать ее с помощью шприца и сразу перенести по 1 мл в каждую из четырех пробирок. Из соображений безопасности лучше всего придерживаться следующей процедуры: снять со шприца иглу, соблюдая соответствующие правила техники безопасности, снять колпачки с четырех пробирок QFT-Plus и добавить по 1 мл крови в каждую из них (до середины черной метки со 14 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 стороны наклейки на пробирке). Затем необходимо закрыть пробирки колпачками и перемешать их содержимое, как описано ниже. Также можно собрать кровь в отдельную пробирку, содержащую литий-гепарин в качестве антикоагулянта, а затем перенести ее в пробирки QFT-Plus. Используйте в качестве антикоагулянта крови только литий-гепарин, так как другие вещества оказывают влияние на результаты анализа. Заполните пробирки для забора крови (минимальный объем — 5 мл) и осторожно перемешайте содержимое, перевернув пробирку несколько раз, чтобы растворить гепарин. Пробирки QFT-Plus должны быть помещены в инкубатор как можно скорее (не позднее 16 часов с момента забора крови). Перед инкубацией пробирки должны находиться при комнатной температуре (22 ± 5 °C). Если кровь была собрана в пробирку с литий-гепарином, перед перенесением в пробирки QFT-Plus образцы необходимо перемешать, осторожно переворачивая пробирку. При дозировании крови необходимо соблюдать правила асептики (следуя соответствующим нормам техники безопасности). Снимите колпачки с четырех пробирок QFT-Plus, добавьте по 1 мл крови в каждую из них (до середины черной метки со стороны наклейки на пробирке). Затем плотно закройте пробирки колпачками и перемешайте их содержимое, как описано ниже. 3. Сразу после наполнения пробирок встряхните их десять (10) раз так, чтобы вся их внутренняя поверхность покрылась кровью. Это растворит антиген, находящийся на стенках пробирки. Важное примечание. Температура пробирок во время встряхивания должна находиться в пределах 17–25 °C. При слишком сильном встряхивании гель может разрушиться, что может привести к получению неверных результатов. 4. После маркировки, заполнения и встряхивания как можно скорее (в течение 16 часов после сбора крови) поместите пробирки в инкубатор с температурой 37 ± 1 °C. Перед инкубацией пробирки должны находиться при комнатной температуре (22 ± 5 °C). Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 15 Инструкция по применению Этап 1. Инкубирование крови и отбор плазмы Материалы, входящие в комплект поставки Пробирки для забора крови QFT-Plus (см. раздел 3). Необходимые материалы, не входящие в комплект набора См. раздел 3. Порядок работы 1. 2. 3. 4. 5. Если инкубирование производится не сразу после забора крови, встряхните пробирки 10 раз непосредственно перед помещением в инкубатор. Инкубируйте пробирки В ВЕРТИКАЛЬНОМ ПОЛОЖЕНИИ при температуре 37 ± 1 °C в течение 16–24 часов. Инкубатор не требует использования CO2 или увлажнения. После инкубации при температуре 37 °C перед центрифугированием пробирки для забора крови можно хранить при температуре от 4 до 27 °C в течение трех дней. После инкубации пробирок при температуре 37 °C их в течение 15 минут центрифугируют при 2000–3000 x g ОСЦ (g). Гелевая пробка отделит клетки от плазмы. Если этого не произойдет, необходимо центрифугировать пробирки повторно. Можно собирать плазму без центрифугирования, но требуется особая осторожность, чтобы удалить плазму, не взбалтывая клетки. Собирайте образцы плазмы с помощью пипетки. Важное примечание. После центрифугирования перед сбором плазмы избегайте ее пипетирования или перемешивания. Необходимо проявлять осторожность, чтобы не взболтать материал на поверхности геля. После центрифугирования образцы плазмы из пробирок для сбора крови можно загружать непосредственно на планшет QFT-Plus ELISA, в том числе при использовании автоматизированных рабочих станций ELISA. Образцы плазмы можно хранить до 28 дней при температуре от 2 до 8 °C или, если плазма уже отобрана, в течение более продолжительного времени при температуре ниже –20 °C. Для получения необходимого количества образца для теста нужно собрать хотя бы 150 мкл плазмы. 16 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Этап 2. ELISA для выявления IFN- Материалы, входящие в комплект поставки Набор реагентов для QFT-Plus ELISA (см. раздел 3). Необходимые материалы, не входящие в комплект набора См. раздел 3. Порядок работы 1. 2. 3. Перед проведением анализа все образцы плазмы и реагенты, кроме 100-кратного концентрата конъюгата, должны быть доведены до комнатной температуры (22 ± 5 °C). На выравнивание температур выделите по меньшей мере 60 минут. Снимите ненужные стрипы с рамки, запечатайте обратно в пакет из фольги и верните в холодильник для хранения, пока не потребуются. Приготовьте хотя бы один стрип для стандартных растворов QFT-Plus и достаточное количество стрипов для исследуемых проб пациентов (см. рис. 2). После использования сохраните рамку и крышку для оставшихся неиспользованных стрипов. Восстановите стандартный образец FN- указанным на этикетке флакона объемом деионизированной или дистиллированной воды. Аккуратно перемешайте содержимое, избегая образования пены, и убедитесь в том, что лиофилизат полностью растворился. При разведении лиофилизата указанным объемом получается раствор, концентрация которого составляет 8,0 МE/мл. Важное примечание. Объем разводимого стандарта зависит от партии набора. Используйте восстановленный стандарт набора для получения серии разведений 1 к 2, а затем 1 к 4 IFN- в растворителе зеленого цвета (GD) (см. рис. 1). S1 (стандарт 1) содержит 4,0 МE/мл, S2 (стандарт 2) содержит 1,0 МE/мл, S3 (стандарт 3) содержит 0,25 МЕ/мл и S4 (стандарт 4) содержит 0 МE/мл (чистый GD). Необходимо использовать в тесте хотя бы две серии разведений стандарта. Готовьте свежие рабочие стандартные разведения для каждого цикла ELISA. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 17 Последовательность, рекомендуемая при двойной серии стандартов а. Пометьте четыре пробирки «S1», «S2», «S3», «S4». б. Внесите 150 мкл растворителя зеленого цвета (GD) в S1, S2, S3, S4. в. Добавьте 150 мкл разведенного стандарта в S1 и тщательно перемешайте. г. Перенесите 50 мкл из S1 в S2 и тщательно перемешайте. д. Перенесите 50 мкл из S2 в S3 и тщательно перемешайте. е. Чистый растворитель зеленого цвета (GD) служит нулевым стандартом (S4). 150 мкл 50 мкл Восстановленный стандартный образец 50 мкл Стандарт 1 Стандарт 2 Стандарт 3 4,0 МЕ/мл 1,0 МЕ/мл 0,25 МЕ/мл Стандарт 4 0 МЕ/мл (Green Diluent — растворитель зеленого цвета) Рисунок 1. Приготовление серии рабочих стандартных разведений. 4. 18 Восстановите лиофилизированный 100-кратный концентрат конъюгата в 0,3 мл деионизированной или дистиллированной воды. Аккуратно перемешайте содержимое флакона, избегая образования пены, и убедитесь в том, что лиофилизат полностью растворился. Рабочий раствор конъюгата получается путем разбавления необходимого количества восстановленного 100-кратного концентрата конъюгата в растворителе зеленого цвета (таблица 1 «Приготовление конъюгата»). Весь неиспользованный 100-кратный концентрат конъюгата сразу же после использования верните на хранение при температуре от 2 до 8 °C. Используйте только Green Diluent (растворитель зеленого цвета). Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Таблица 1. Приготовление конъюгата Количество стрипов Объем 100-кратного концентрата конъюгата Объем растворителя зеленого цвета 2 10 мкл 1,0 мл 3 15 мкл 1,5 мл 4 20 мкл 2,0 мл 5 25 мкл 2,5 мл 6 30 мкл 3,0 мл 7 35 мкл 3,5 мл 8 40 мкл 4,0 мл 9 45 мкл 4,5 мл 10 50 мкл 5,0 мл 11 55 мкл 5,5 мл 12 60 мкл 6,0 мл 5. Образцы плазмы, отобранные из пробирок для забора крови, а затем хранившиеся или замороженные, должны быть тщательно смешаны перед их внесением в лунки планшета для ELISA. Важное примечание. Если образцы плазмы добавляются непосредственно из отцентрифугованных QFT-Plus пробирок, необходимо избегать любого перемешивания плазмы. Необходимо проявлять осторожность, чтобы не взболтать материал на поверхности геля. 6. С помощью многоканальной пипетки внесите 50 мкл свежеприготовленного рабочего раствора конъюгата в соответствующие лунки планшета для ELISA. С помощью многоканальной пипетки внесите 50 мкл каждого исследуемого образца плазмы в соответствующие лунки планшета (см. рекомендуемую схему расположения на планшете на рис. 2). В последнюю очередь внесите в соответствующие лунки 50 мкл каждого стандартного раствора 1–4. 7. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 19 1 2 3 4 5 6 7 8 9 10 11 12 3N 5N 7N 9N S1 S1 13 N 15 N 17 N 19 N 21 N Б 1 TB1 3 TB1 5 TB1 7 TB1 9 TB1 S2 S2 13 TB1 15 TB1 17 TB1 19 TB1 21 TB1 В 1 TB2 3 TB2 5 TB2 7 TB2 9 TB2 S3 S3 13 TB2 15 TB2 17 TB2 19 TB2 21 TB2 Г А 1N 1M 3M 5M 7M 9M S4 S4 13 M 15 M 17 M 19 M 21 M Д 2N 4N 6N 8N 10 N 11 N 12 N 14 N 16 N 18 N 20 N 22 N Е 2 TB2 4 TB1 6 TB1 8 TB1 10 TB1 11 TB1 12 TB1 14 TB1 16 TB1 18 TB1 20 TB1 22 TB1 Ж 2 TB2 4 TB2 6 TB2 8 TB2 10 TB2 11 TB2 12 TB2 14 TB2 16 TB2 18 TB2 20 TB2 22 TB2 З 12 M 14 M 16 M 18 M 20 M 22 M 2M 4M 6M 8M 10 M 11 M Рисунок 2. Рекомендуемая схема расположения образцов (22 теста на планшете). S1 (стандарт 1), S2 (стандарт 2), S3 (стандарт 3), S4 (стандарт 4). 1 N (образец 1, нулевая контрольная плазма), 1 TB1 (образец 1, ТВ1 плазма), 1 TB2 (образец 1, ТВ2 плазма), 1 М (образец 1, плазма с митогеном). 8. 9. Каждый планшет закройте крышкой и на шейкере для микропланшетов тщательно перемешайте конъюгат и образцы плазмы/стандарты в течение одной минуты. Избегайте расплескивания. Каждый планшет накройте крышкой и инкубируйте при комнатной температуре (22 ± 5 °C) в течение 120 ± 5 минут. Во время инкубации планшеты не должны подвергаться воздействию прямых солнечных лучей. 10. Во время инкубации разведите одну часть 20-кратного буферного промывочного концентрата 19 частями деионизированной или дистиллированной воды и тщательно перемешайте. Количества 20-кратного буферного промывочного концентрата, входящего в объем поставки, достаточно для приготовления двух литров готового к использованию буферного промывочного раствора. Не менее шести раз промойте каждую лунку 400 мкл подготовленного к работе промывочного буферного раствора. Рекомендуется использовать автоматическую мойку для планшетов. Для проведения анализа очень важна тщательная промывка. Проследите, чтобы во время каждого цикла промывки каждая лунка была до краев заполнена промывочным буфером. Между промывочными циклами рекомендуется выдерживать не менее пяти секунд для замачивания. Для обеззараживания потенциально инфекционных материалов в резервуар для отходов необходимо добавлять стандартное лабораторное дезинфицирующее средство и выполнять общепринятые процедуры. 11. Для удаления остатков промывочного буфера положите планшеты вверх дном на фильтровальную бумагу. Затем внесите 100 мкл раствора ферментного субстрата в каждую лунку, каждый планшет накройте крышкой и перемешайте на шейкере для микропланшетов. 20 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 12. Каждый планшет закройте крышкой и инкубируйте 30 минут при комнатной температуре (22 ± 5 °C). Во время инкубации планшеты не должны подвергаться воздействию прямых солнечных лучей. 13. После 30-минутной инкубации в каждую лунку добавьте по 50 мкл стопраствора и перемешайте. Стоп-реагент нужно вносить в лунки в той же последовательности и примерно в том же темпе, что и раствор ферментного субстрата (см. шаг 11). 14. Измерьте оптическую плотность (ОП) каждой лунки планшета в течение пяти минут после добавления стоп-реагента, для измерения используйте считывающее устройство для микропланшет с фильтром 450 нм и референсным фильтром 620–650 нм. Значения оптической плотности необходимы для расчета результатов. Расчеты и интерпретация результатов теста Для анализа полученных данных и расчета результатов теста может применяться программное обеспечение QFT-Plus Analysis Software. Получить его можно по адресу www.QuantiFERON.com. Убедитесь, что Вы используете самую последнюю версию программного обеспечения QFT-Plus Analysis Software. Программное обеспечение выполняет оценку контроля качества теста, выстраивает стандартную кривую и обеспечивает результат каждого пациента, как указано в разделе «Интерпретация результатов». В качестве альтернативы использованию программного обеспечения для анализа QFT-Plus Analysis Software результаты могут быть определены в соответствии со следующим методом. Получение стандартной кривой (В случае если программное обеспечение QFT-Plus Analysis Software не используется) Определите среднее значение оптической плотности дубликатов рабочих стандартов на каждом планшете. Постройте стандартную кривую log(e)–log(e), по оси y нанося log(e) средних ОП, а по оси x — log(e) концентрации IFN- в стандартах в МЕ/мл, исключив из этих расчетов нулевой стандарт. Методом регрессионного анализа рассчитайте максимально соответствующую стандартной кривой линию. С помощью стандартной кривой для каждого исследуемого образца плазмы теста определите концентрацию IFN- (в МЕ/мл), используя значение ОП для каждого образца. Эти расчеты можно выполнить с использованием программных пакетов, доступных со считывающими устройствами для микропланшетов, и с помощью стандартных электронных таблиц или статистического программного обеспечения (например, Microsoft® Excel®). Такие пакеты рекомендуется использовать для выполнения Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 21 регрессионного анализа, расчета коэффициента вариации (%CV) для стандартов и коэффициента корреляции (r) стандартной кривой. Контроль качества теста Точность результатов теста зависит от получения точной стандартной кривой. Таким образом, прежде чем можно будет интерпретировать результаты анализа образцов, необходимо проверить результаты, полученные на стандартах. Полученные методом ELISA результаты считаются действительными, если: среднее значение оптической плотности (ОП) для стандарта 1 составляет ≥ 0,600; репликатные значения ОП для стандарта 3 и стандарта 4 варьируют не более, чем на 0,040 единицы ОП от среднего значения; коэффициент корреляции (r), рассчитанный из среднего значения спектральной поглощательной способности стандартов, составляет ≥ 0,98. коэффициент вариации (CV%) репликатных значений ОП для стандартов 1 и 2 ≤ 15 %; Программное обеспечение QFT-Plus Analysis Software, проводящее анализ, просчитывает и выдает информацию о параметрах контроля качества. Если указанные выше условия не соблюдаются, анализ является недействительным и должен быть повторен. Среднее значение ОП для нулевой контрольной пробирки (растворитель зеленого цвета) должно составлять ≤ 0,150. Если этот показатель > 0,150, то необходимо проверить проведение процедуры промывки. Интерпретация результатов Результаты тестирования, полученные с помощью тест-системы QFT-Plus, могут быть интерпретированы на основании следующих критериев. Важное примечание. Для подтверждения или исключения туберкулезной болезни, как и для оценки вероятности ЛТБИ, необходима комбинация эпидемиологических, медицинских, диагностических данных и данных истории болезней, которые должны учитываться при интерпретации результатов, полученных с помощью тест-системы QFT-Plus (таблица 2). 22 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Таблица 2. Интерпретация результатов теста QFT-Plus Нулевой TB1 минус контроль нулевой (МЕ/мл) контроль (МЕ/мл) ≥ 0,35 и ≥ 25% нулевого контроля ≤ 8,0 TB2 минус нулевой контроль (МЕ/мл) Любой показатель ≥ 0,35 и Любой ≥ 25% показатель нулевого контроля < 0,35 Любой показатель ≥ 0,5 ИЛИ ≥ 0,35 и < 25% нулевого контроля > 8,0§ Митоген минус нулевой контроль (МЕ/мл) * Результат QFT-Plus Результат/ интерпретация Положительный † Инфекция M. tuberculosis вероятна Отрицательный Вероятность инфекции M. tuberculosis ОТСУТСТВУЕТ Сомнительный ‡ Вероятность инфекции M. tuberculosis не может быть установлена < 0,5 Любой показатель Значение ответа на положительный контроль митоген, а иногда и антигены туберкулина часто может лежать вне рабочего диапазона считывающего устройства для микропланшет. Это не оказывает влияния на результаты теста. † В данном случае подозрения на инфекцию M. tuberculosis нет, изначально положительный результат может быть подтвержден повторным тестирование оригинальных проб плазмы в дубликате с помощью QFT-Plus ELISA. Если повторный тест одного или обоих репликатов окажется положительным, тестируемого следует считать инфицированным. ‡ Возможные причины см. в разделе «Поиск и устранение неисправностей». § В клинических исследованиях менее чем 0,25 % испытуемых имели уровень IFN- > 8,0 МЕ/мл при нулевом контроле. Величина замеренного уровня IFN- не может быть скоррелирована со стадией и степенью инфицирования, уровнем иммунной реактивности или вероятностью прогрессирования болезни к активной стадии. Положительная туберкулиновая реакция у лиц с отрицательным ответом на митоген редко, но отмечалась у больных туберкулезом. Это свидетельствует о том, что ответ IFN- на туберкулиновый антиген выше, чем на митоген, что возможно, так как уровень митогена недостаточен для максимальной стимуляции продуцирования IFN- лимфоцитами. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 23 * Чтобы результаты TB1 минус нулевая проба или TB2 минус нулевая проба были достоверными, ≥ 25 % знач. нулевой пробы в МЕ/мл должно быть получено в той же пробирке, что и исходный результат ≥ 0,35 МЕ/мл. Рисунок 3. Блок-схема интерпретации результатов, полученных при помощи тест-системы QFT-Plus. Ограничения Результаты, полученные с помощью системы QFT-Plus, должны учитываться вместе с индивидуальной эпидемиологической историей, текущим медицинским статусом и другими диагностическими результатами. Лица с нулевым контрольным значением выше 8,0 МЕ/мл классифицируются как «сомнительные», так как результат реакции на антиген туберкулина, превышающий 25 % значения нулевого контроля, может находиться вне зоны измерения, проводимого тест-системой. Недостоверность или сомнительность результатов может возникнуть по следующим причинам: отклонение от процедуры, описанной в настоящей инструкции-вкладыше; чрезмерно высокий уровень IFN- или присутствие гетерофильных антител; 24 с момента забора образца крови до его инкубации при температуре 37 °C прошло более 16 часов. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Рабочие характеристики Клинические исследования В силу отсутствия определенного стандарта для ЛТБИ чувствительность и специфичность тест-системы QFT-Plus не может быть определена практически. Специфичность системы QFT-Plus была примерно выражена посредством оценки ложноположительных показателей у лиц с низким уровнем риска (с отсутствием известных факторов риска) инфицирования туберкулезом. Чувствительность получила свое примерное выражение через оценку групп пациентов с подтвержденным диагнозом туберкулезной болезни в активной стадии культуральным методом. Специфичность Было проведено исследование по оценке специфичности QFT-Plus у 409 участников. Демографические данные и информация по факторам риска туберкулеза были определены на основании стандартизированного обследования, проведенного в период тестирования. По результатам, полученным в 2 группах пациентов с низким риском (отсутствуют известные факторы риска) туберкулезной инфекции специфичность QFT-Plus составила 97,6 % (399/409) (таблицы 3 и 4). Таблица 3. Результаты исследования специфичности, полученные при помощи тест-системы QFT-Plus, сгруппированные по исследовательским центрам Исследование Положительный Отрицательный Сомнительный Специфичность (95 % доверит. интервал) Япония 4 203 0 98 % (95–100) Австралия 6 196 0 97 % (94–99) Таблица 4. Результаты исследования специфичности, полученные при помощи тест-системы QFT-Plus, сгруппированные по пробиркам с туберкулиновым антигеном TB1 TB2 QFT-Plus Положительный 5 10 10 Отрицательный 404 399 399 Сомнительный 0 0 0 98,8 % (97,2–99,6) 97,6 % (95,6–98,8) 97,6 % (95,6–98,8) Специфичность (95 % доверит. интервал) Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 25 Чувствительность при активном туберкулезе В силу отсутствия определенного стандартного теста для выявления ЛТБИ подходящим суррогатом стала микробиологическая культура M. tuberculosis, так как принимающие участие в тесте по определению являются инфицированными. Пациенты из 4 исследовательских центров в Австралии и Японии с подозрением на туберкулез, у которых позднее методом культивирования подтвердилось наличие инфекции M. tuberculosis, были протестированы для определения чувствительности тест-системы QFT-Plus (таблицы 5 и 6). До забора образцов крови на тестирование системой QFT-Plus пациенты проходили курс терапии продолжительностью менее 14 дней. По результатам, полученным в 4 группах пациентов с положительной реакцией при культуральном исследовании на M. tuberculosis общая чувствительность QFT-Plus к активному туберкулезу составила 95,3 % (164/172). В этих 4 группах у 159 пациентов отмечена положительная реакция по обеим пробиркам TB1 и TB2, у 1 пациента — положительная реакция только по пробирке ТВ1 и у 4 пациентов — положительная реакция только по пробирке ТВ2. В 1,1 % случаев (2/174) реакция была сомнительной. По результатам теста в пробирке ТВ2 был правильно идентифицирован 1 случай, подтвержденный культивированием, который по результатам теста только в ТВ1 был охарактеризован как сомнительный (низкий показатель митогена) (см. таблицы 5 и 6). Таблица 5. Результаты исследования чувствительности QFT-Plus, сгруппированные по исследовательским центрам Положительный Отрицательный Сомнительный Чувствительность QFT-Plus * (95 % доверит. интервал) Япония, центр 1 36 7 0 84 % (69–93) Япония, центр 2 53 1 2 98 % (90–100) Япония, центр 3 54 0 0 100 % (93–100) Австралия 21 0 0 100 % (84–100) Исследовательские центры * Чувствительность определена на основании общего числа достоверных тестов, с исключением сомнительных результатов. Таблица 6. Результаты исследования чувствительности QFT-Plus, сгруппированные по пробиркам с туберкулиновым антигеном TB1 TB2 QFT-Plus Положительный 160 163 164 Отрицательный 11 9 8 Сомнительный 3 2 2 93,6 % (88,8–96,7) 94,8 % (90,3–97,6) 95,3 % (90,9–97,9) Чувствительность † (95 % доверит. интервал) † Чувствительность определена на основании общего числа достоверных тестов, с исключением сомнительных результатов. 26 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Наблюдавшееся распределение ответов — стратификация по степени риска В клинических исследованиях наблюдался диапазон ответов IFN- для пробирок TB1, TB2 и контроля, стратифицированным по степени риска инфекции M. tuberculosis (рисунки 4–7). Группа смешанного риска состоит из участников, представляющих общую популяцию исследования, которая включает лиц с факторами риска воздействия ТБ и без них и лиц, у которых маловероятна активная форма ТБ (т.е. ЛТБИ). А Число участников IFN- (МЕ/мл) Б Число участников В Число участников IFN- (МЕ/мл) IFN- (МЕ/мл) Рисунок 4. Распределение результатов для пробирки нулевого контроля. А. Распределение результатов для пробирки нулевого контроля в популяции с низким риском (n = 409). Б. Распределение результатов для пробирки нулевого контроля в популяции со смешанным риском (n = 194). В. Распределение результатов для пробирки нулевого контроля в популяции с подтвержденной культивированием инфекцией M. tuberculosis (n = 174). Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 27 А Число участников IFN- (МЕ/мл) Б Число участников IFN- (МЕ/мл) В Число участников IFN- (МЕ/мл) Рисунок 5. Распределение результатов для пробирок TB и TB2 (за вычетом результатов для пробирки нулевого контроля). А. Распределение результатов для пробирок TB и TB2 (за вычетом результатов для пробирки нулевого контроля) в популяции с низким риском (n = 409). Б. Распределение результатов для пробирок TB и TB2 (за вычетом результатов для пробирки нулевого контроля) в популяции со смешанным риском (n = 194). В. Распределение результатов для пробирок TB и TB2 (за вычетом результатов для пробирки нулевого контроля) в популяции с подтвержденной культивированием инфекцией M. tuberculosis (n = 174). 28 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 А Число участников IFN- (МЕ/мл) Б Число участников IFN- (МЕ/мл) В Число участников IFN- (МЕ/мл) Рисунок 6. Распределение показателя митогена (за вычетом результатов для пробирки нулевого контроля). А. Распределение показателя митогена (за вычетом результатов для пробирки нулевого контроля) в популяции с низким риском (n = 409). Б. Распределение показателя митогена (за вычетом результатов для пробирки нулевого контроля) в популяции со смешанным риском (n = 194). В. Распределение показателя митогена (за вычетом результатов для пробирки нулевого контроля) в популяции с подтвержденной культивированием инфекцией M. tuberculosis (n = 169). Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 29 IFN- (МЕ/мл) Низкий риск Смешанный риск Риск инфекции МБТ Активный ТБ Рисунок 7. Наблюдавшаяся разница между величинами для ТВ1 и ТВ2 (за вычетом результатов для пробирки нулевого контроля), стратифицированная по степени риска. Популяция низкого риска (n = 409), популяция смешанного риска (n = 189) и популяция с подтвержденной культивированием инфекцией M. tuberculosis (n = 141). Значения для ТВ1 вычтены из значений для ТВ2. Участники, у которых значения для ТВ1 или ТВ2 были > 10,0 МЕ/мл, были исключены, так как эти значения находятся вне диапазона линейности данного метода анализа. Аналитические характеристики Линейность метода QFT-Plus ELISA была подтверждена путем анализа 5 параллельных проб 11 пулов плазмы с известными концентрациями IFN- и случайным размещением этих проб на планшете для ELISA. Линия по модели линейной регрессии имеет наклон 1,002 ± 0,011 и коэффициент корреляции 0,99 (рисунок 8). Предел обнаружения метода QFT-Plus ELISA составляет 0,05 ME/мл; не обнаружено признаков хук-эффекта для высоких концентраций (прозоны) при концентрации IFN- до 10 000 МЕ/мл. 30 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Определенный уровень IFN- (МЕ/мл) Ожидаемый уровень IFN- (МЕ/мл) Рисунок 8. Профиль линейности метода QFT-Plus ELISA. Погрешность результатов метода QFT-Plus ELISA внутри серии опытов и между сериями опытов (% CV) определялась путем тестирования 20 образцов плазмы с различными концентрациями IFN- по три повтора в трех лабораториях в течение трех непоследовательных дней тремя разными операторами. Таким образом, каждый образец подвергался тестированию 27 раз в 9 независимых сериях испытаний. Один образец выступал как нулевой контрольный образец с рассчитанной концентрацией IFN- 0,08 МЕ/мл (95 % ДИ: 0,07–0,09). В остальных 19 образцах плазмы концентрация находилась в диапазоне от 0,33 (95 % ДИ: 0,31–0,34) до 7,7 МЕ/мл (95 % ДИ: 7,48–7,92). Погрешность результатов внутри серии оценивалась путем усреднения значений % CV для каждой тестируемой плазмы, содержащей IFN-, из измерения для каждого планшета (n = 9), и лежала в диапазоне от 4,1 до 9,1 %CV. Среднее значение коэффициента вариации внутри серии (±95 % ДИ) составило 6,6 ± 0,6 %. Среднее значение CV для плазмы с нулевой концентрацией IFN- составило 14,1 %. Общая погрешность или погрешность между сериями анализов определялась путем сравнения 27 рассчитанных концентраций IFN- для каждого образца плазмы. Погрешность результатов между сериями находилась в диапазоне от 6,6 до 12,3 %CV. Общее среднее %CV (±95 % ДИ) составило 8,7 ± 0,7 %. Нулевая IFN- плазма в среднем 26,1 %CV. Такой уровень вариации является ожидаемым, поскольку расчетная концентрация IFN- является низкой, и вариации при низкой оценке концентрации будут большими, чем при более высоких концентрациях. Воспроизводимость теста QFT-Plus определяли с использованием образцов крови 102 участников из группы смешанного риска инфицирования M. tuberculosis. Оценивали результаты, полученные тремя различными операторами в трех различных лабораторных условиях. Для каждого участника было выполнено 3 диагностических определения, всего 306 определений для всех участников. В целом, диагностическая воспроизводимость составила 99 % (95 % ДИ: 97,2–99,7), при этом результат диагностического определения был согласованным для 303 из 306 определений. Результаты для 3 участников были близки к границе отсечения, принятой для всех отклонений. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 31 Диагноз ЛТБИ В ряде публикаций сообщается об эффективности тест-системы QFT, предшественника QFT-Plus, в различных группах с риском инфицирования МБТ. Основные данные некоторых исследований собраны в таблице 7. Таблица 7. Выборка из опубликованных исследований по использованию QFT Популяция/ заболевание Данные и результаты Общее число опубликованных исследований 152 Пациенты детского возраста Доказана эффективность у детей, включая детей младше 5 лет (45–46), причем точность была выше, чем у метода IGRA на основе ELISpot (8). Самое крупное на настоящий момент исследование по сравнению QFT и TST у детей, проводимое во Вьетнаме, на Филиппинах и в Мексике, поддерживает предпочтительность использования QFT по сравнению с TST для тестирования рожденных за границей детей на ЛТБИ (46). Исследование с ограниченными контактами показало лучшее прогностическое значение по сравнению с TST у детей (47) и в 8 раз более высокий риск прогрессирования туберкулеза в течение двух лет у лиц с положительным результатом QFT-теста по сравнению с лицами с отрицательным результатом (48). Отрицательный результат по QFT в сочетании с положительным результатов TST часто наблюдается у детей, вакцинированных БЦЖ (46, 49), однако влияние на показатель митогена у детей младше 5 лет не обнаружено (49). При рутинном скрининге у детей иммигрантов частота сомнительных результатов была низкой (46). Беременность В условиях с низкой нагрузкой QFT одинаково хорошо работает в каждом триместре беременности и дает сравнимые результаты с данными для небеременных женщин, является гораздо более специфичным, как минимум таким же чувствительным и может быть лучшим прогностическим средством прогрессирования заболевания, чем TST (50). В условиях с высокой нагрузкой QFT был более стабилен в течение всей беременности и более точно оценивал фоновое преобладание ЛТБИ в сравнении с TST, хотя авторы пришли к выводу, что беременность влияет на результаты как QFT, так и TST (51). 6 ВИЧ/СПИД Инфицирование ВИЧ влияет как на результаты IGRA, так и на результаты TST, и множество фактов подтверждает, что интерпретировать результаты при количестве CD4+ < 200 следует с осторожностью (52). Было показано, что QFT менее подвержен влиянию, чем IGRA на основе ELISpot и TST (53–55). Тесты IGRA с однократным визитом предпочтительнее TST ввиду низкой частоты повторных визитов в данной популяции (53). 101 32 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Популяция/ заболевание Данные и результаты Общее число опубликованных исследований Иммуносупрессивная терапия QFT менее подвержен влиянию иммуносупрессивной терапии, чем TST, и лучше коррелирует с факторами риска ТБ (23, 27). QFT обладает высокой чувствительностью у пациентов с ревматической болезнью (23, 56, 57) и более высокой специфичностью, чем TST, что минимизирует число ложно-положительных результатов и снижает частоту получения ненужного лечения, что возможно при использовании TST (23, 57, 58). 112 Медицинские работники Было показано, что данная тест-система дает меньше ложно-положительных результатов и более экономически эффективна, чем TST (59–62). Вариабельность около порогового значения является ожидаемым результатом при серийном тестировании вследствие дихотомичности точки отсечения и присущей биологическому тесту вариабельности (63). В исследованиях обнаружена более высокая частота конверсии/реверсии, чем у TST в серийных тестах у медицинских работников с низкой степенью риска (64, 65). US CDC признает, что мягкий критерий для определения конверсии IGRA может дать более высокую степень конверсии, чем наблюдаемая с более строгим количественным критерием для TST, и была продемонстрирована эффективность стратегий повторного тестирования с целью контроля явления конверсии/реверсии (65–68). 111 Контакт с больными туберкулезом Более высокие положительное и отрицательное прогностические значения по сравнению с TST (47), удобство однократного визита для тех, кто вряд ли выполнит повторный визит (63), и лучшая корреляция с воздействием (69), что особенно часто отмечается у вакцинированных БЦЖ лиц и в странах, где проводится вакцинация БЦЖ (70, 71). 89 Трансплантация Было показано, что QFT как минимум так же эффективен, как TST, но менее подвержен влиянию конечной стадии заболевания органа, чем TST (22). 23 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 33 Популяция/ заболевание Данные и результаты Общее число опубликованных исследований Диабет Имеются противоречивые данные, полученные в небольшом количестве работ у ограниченного числа больных. В исследовании в области с низкой нагрузкой установлено, что чувствительность QFT у пациентов с туберкулезом не снижается при наличии диабета (72). По результатам проводившегося в Танзании исследовании в условиях высокой нагрузки было выдвинуто предположение о негативном влиянии диабета на продуцирование IFN-, которое оказалось несостоятельным, так как не были учтены искажающие результаты факторы, такие как ВИЧ-инфекция и инфицирование гельминтами (73). В проводившихся во Вьетнаме исследованиях у 838 пациентов, которые сообщили о наличии у них диабета и у которых был заподозрен туберкулез по отклонениям на рентгенограмме грудной клетки или подтвержден активный ТБ культуральным методом (n = 128), доля положительных результатов QFT была равна или превышала таковую по точкам отсечения для TST в 10 и 15 мм (74). 9 Заболевание почек в конечно стадии Положительные результаты QFT лучше коррелировали с факторами риска ТБ, чем результаты TST, и были в меньшей степени связаны с БЦЖ (75). 45 Мигранты Исследования показали, что на результаты QFT не влияет вакцинация БЦЖ и возраст, в отличие от TST (74). Было показано, что QFT экономически более эффективен, чем TST (76). В условиях низкой нагрузки большинство случаев заболевания туберкулезом — это заболевание у рожденных в других странах и реактивация латентной формы туберкулеза после прибытия (77). Самое крупное на настоящий момент исследование по сравнению QFT и TST у детей иммигрантов поддерживает предпочтительность использования QFT по сравнению с TST для тестирования рожденных за границей детей на латентную туберкулезную инфекцию (46). 29 34 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Техническая информация Сомнительные результаты Получение сомнительных результатов — явление редкое, но возможное по причине особенностей иммунного статуса исследуемого, а также в силу ряда технических факторов, если не соблюдаются приведенные выше инструкции. Если причиной сомнительных результатов могли стать неправильное хранение реактивов, неправильный забор образцов крови либо ненадлежащее с ними обращение, повторите весь тест QFT-Plus с новыми образцами крови. В случае некачественной промывки или других отклонений при проведении ELISA, анализ необходимо повторить снова. Сомнительные результаты теста, причиной которых являются низкий показатель митогена или высокий показатель нулевого стандарта, не должны быть другими на дубликате, если только не имела место какая-либо ошибка в проведении ELISA. Сомнительные результаты должны регистрироваться как таковые. Врач может принять решение либо в пользу забора нового образца крови, либо в пользу проведения других надлежащих мероприятий. Образование сгустков в плазме крови В случае образования фибриновых сгустков в плазме крови образцов, подлежащих продолжительному хранению, необходимо отцентрифуговать плазму, при этом сгустки превратятся в осадок, что обеспечит свободное пипетирование плазмы. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 35 Руководство по поиску и устранению неполадок Данное руководство по устранению неполадок может быть полезным в решении любых проблем, которые могут возникнуть. Дополнительную информацию см. также в технической информации по адресу www.QuantiFERON.com. Контактную информацию см. на задней обложке. Поиск и устранение неполадок при выполнении метода ELISA Неспецифическое окрашивание Возможная причина Решение а) Неполное промывание планшета Промойте планшет как минимум шесть раз промывочным буфером из расчета 400 мкл на каждую лунку. В зависимости от типа промывочной жидкости может понадобиться большее количество промывочных циклов. Время замачивания между промывочными циклами должно составлять не менее пяти секунд. б) Перекрестное загрязнение лунок при проведении ELISA Соблюдайте осторожность при пипетировании и перемешивании компонентов, чтобы свести риск загрязнения к минимуму. в) Истечение срока годности компонентов Используйте набор до истечения срока годности. Используйте стандартный раствор и 100-кратный концентрат конъюгата в течение трех месяцев с момента разведения. г) Загрязнение раствора ферментного субстрата Утилизируйте субстрат при окрашивании в синий цвет. Используйте чистые емкости для реагента. д) Смешивание плазмы в пробирках QFT-Plus до отбора После центрифугирования перед сбором плазмы избегайте ее пипетирования или перемешивания. Необходимо проявлять осторожность, чтобы не взболтать материал на поверхности геля. Низкие показатели оптической плотности рабочих стандартов Возможная причина Решение а) Ошибка в приготовлении рабочих стандартных разведений Обеспечьте правильное приготовление стандартных разведений согласно настоящей инструкции-вкладыша. б) Ошибка при пипетировании Убедитесь, что пипетки откалиброваны и используются в соответствии с инструкциями производителя. в) Слишком низкая температура инкубации Инкубирование при проведении ELISA должно проходить при комнатной температуре (22 ± 5 °C). г) Слишком короткое время инкубации Инкубирование планшета с конъюгатом, стандартными разведениями и пробами должно проводиться в течение 120 ± 5 мин. Инкубирование планшета с раствором ферментного субстрата проводится в течение 30 мин. д) Использование неподходящего фильтра считывающего устройства Луночный планшет должен анализироваться при 450 нм с помощью референсного фильтра, установленного на длину волн между 620 и 650 нм. 36 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Поиск и устранение неполадок при выполнении метода ELISA е) Слишком холодные реагенты Перед проведением анализа все реагенты, за исключением 100-кратного концентрата конъюгата, необходимо довести до комнатной температуры. Для этого достаточно одного часа. ж) Истечение срока годности компонентов Используйте набор до истечения срока годности. Используйте стандартный раствор и 100-кратный концентрат конъюгата в течение трех месяцев с момента разведения. Высокий фон Возможная причина Решение а) Неполное промывание планшета Промойте планшет как минимум шесть раз промывочным буфером из расчета 400 мкл на каждую лунку. В зависимости от типа промывочной жидкости может понадобиться большее количество промывочных циклов. Время замачивания между промывочными циклами должно составлять не менее пяти секунд. б) Слишком высокая температура инкубации Инкубирование при проведении ELISA должно проходить при комнатной температуре (22 ± 5 °C). в) Истечение срока годности компонентов Используйте набор до истечения срока годности. Используйте стандартный раствор и 100-кратный концентрат конъюгата в течение трех месяцев с момента разведения. г) Загрязнение раствора ферментного субстрата Утилизируйте субстрат при окрашивании в синий цвет. Используйте чистые емкости для реагента. Отсутствие линейности в стандартной кривой, вариабельность дубликатов Возможная причина Решение а) Неполное промывание планшета Промойте планшет как минимум шесть раз промывочным буфером из расчета 400 мкл на каждую лунку. В зависимости от типа промывочной жидкости может понадобиться большее количество промывочных циклов. Время замачивания между промывочными циклами должно составлять не менее пяти секунд. б) Ошибка в приготовлении рабочего стандартного разведения Обеспечьте правильное приготовление стандартного разведения согласно настоящей инструкции-вкладыша. в) Плохое смешивание Тщательно смешайте реагенты путем перевертывания, или используя вортекс перед внесением на планшет. г) Непоследовательная техника пипетирования или приостановка во время начальной стадии теста Внесение образцов и стандартных разведений должно производиться непрерывно. Все реагенты должны быть подготовлены к началу проведения теста. Информация о продукте и технические руководства по эксплуатации продукта предоставляется компанией QIAGEN бесплатно. Их можно также заказать через вашего дистрибьютера или получить по адресу www.QuantiFERON.com. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 37 Литература Полный перечень литературы по QFT-Plus и QFT можно найти через Gnowee — справочную библиотеку QuantiFERON по адресу www.gnowee.net. 1. Andersen, P. et al. (2000) Specific immune-based diagnosis of tuberculosis. Lancet 356, 1099. 2. Balcells, M.E. et al. (2008) A comparative study of two different methods for the detection of latent tuberculosis in HIV-positive individuals in Chile. Int. J. Infect. Dis. 12, 645. 3. Bartalesi, F. et al. (2009) QuantiFERON-TB Gold and TST are both useful for latent TB screening in autoimmune diseases. Eur. Respir. J. 33, 586. 4. Bocchino, M. et al. (2008) Performance of two commercial blood IFN-gamma release assays for the detection of Mycobacterium tuberculosis infection in patient candidates for anti-TNF-alpha treatment. Eur. J. Clin. Microbiol. Infect. Dis. 27,907. 5. Brock, I. et al. (2006) Latent tuberculosis in HIV positive, diagnosed by the M. tuberculosis specific interferon-gamma test. Respir. Res. 7, 56. 6. Chun, J.K. et al. (2008) The role of a whole blood interferon gamma assay for the detection of latent tuberculosis infection in bacille Calmette-Guerin vaccinated children. Diagn. Microbiol. Infect. Dis. 62, 389. 7. Connell, T.G. et al. (2008) A three-way comparison of tuberculin skin testing, QuantiFERON-TB gold and T-SPOT.TB in children. PLoS ONE 3, e2624. doi: 10.1371/journal.pone.0002624. 8. Detjen, A.K. et al. (2007) Interferon-gamma release assays improve the diagnosis of tuberculosis and nontuberculous mycobacterial disease in children in a country with a low incidence of tuberculosis. Clin. Infect. Dis. 45, 322. 9. Diel, R. et al. (2009) Comparative performance of tuberculin skin test, QuantiFERON-TB-Gold In-Tube assay, and T-Spot.TB test in contact investigations for tuberculosis. Chest 135, 1010. 10. Diel, R. et al. (2008) Predictive value of a whole-blood IFN-γ assay for the development of active TB disease. Am. J. Respir. Crit. Care Med. 177, 1164. 11. Diel, R. et al. (2006) Tuberculosis contact investigation with a new, specific blood test in a lowincidence population containing a high proportion of BCG-vaccinated persons. Respir. Res. 7, 77. 12. Dogra, S. et al. (2007) Comparison of a whole blood interferon-gamma assay with tuberculin skin testing for the detection of tuberculosis infection in hospitalized children in rural India. J. Infect. 54, 267. 13. Drobniewski, F. et al. (2007) Rates of latent tuberculosis in health care staff in Russia. PLoS Med. 4, e55. 14. Gerogianni, I. et al. (2008) Whole-blood interferon-gamma assay for the diagnosis of tuberculosis infection in an unselected Greek population. Respirology 13, 270. 15. Harada, N. et al. (2008) Comparison of the sensitivity and specificity of two whole blood interferon-gamma assays for M. tuberculosis infection. J. Infect. 56, 348. 16. Higuchi, K. et al. (2009) Comparison of performance in two diagnostic methods for tuberculosis infection. Med. Microbiol. Immunol. 198, 33. 17. Kang, Y.A. et al. (2005) Discrepancy between the tuberculin skin test and the whole-blood interferon gamma assay for the diagnosis of latent tuberculosis infection in an intermediate tuberculosis-burden country. JAMA 293, 2756. 18. Katiyar, S.K. et al. (2008) Use of the QuantiFERON-TB Gold In-Tube test to monitor treatment efficacy in active pulmonary tuberculosis. Int. J. Tuberc. Lung Dis. 12, 1146. 38 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 19. Kipfer, B. et al. (2008) Tuberculosis in a Swiss army training camp: contact investigation using an Interferon gamma release assay. Swiss. Med. Wkly. 138, 267. 20. Luetkemeyer, A. et al. (2007) Comparison of an interferon-gamma release assay with tuberculin skin testing in HIV-infected individuals. Am. J. Respir. Crit. Care Med. 175, 737. 21. Mackensen, F. et al. (2008) QuantiFERON TB-Gold - A new test strengthening long-suspected tuberculous involvement in serpiginous-like choroiditis. Am. J. Ophthalmol. 146, 761. 22. Manuel, O. et al. (2007) Comparison of Quantiferon-TB Gold with tuberculin skin test for detecting latent tuberculosis infection prior to liver transplantation. Am. J. Transplant. 7, 2797. 23. Matulis, G. et al. (2007) Detection of latent tuberculosis in immunosuppressed patients with autoimmune diseases performance of a Mycobacterium tuberculosis antigen specific IFN-gamma assay. Ann. Rheum. Dis. 67, 84. 24. Mirtskhulava, V. et al. (2008) Prevalence and risk factors for latent tuberculosis infection among health care workers in Georgia. Int. J. Tuberc. Lung Dis. 12, 513. 25. Nakaoka, H. et al. (2006) Risk for tuberculosis among children. Emerging Infect. Dis. 12, 1383. 26. Pai, M. et al. (2005) Mycobacterium tuberculosis infection in health care workers in rural India: comparison of a whole-blood, interferon-g assay with tuberculin skin testing. JAMA 293, 2746. 27. Ponce de Leon, D. et al. (2008) Comparison of an interferon-gamma assay with tuberculin skin testing for detection of tuberculosis (TB) infection in patients with rheumatoid arthritis in a TB-endemic population. J Rheumatol. 35, 776. 28. Richeldi, L. et al. (2008) Prior tuberculin skin testing does not boost QuantiFERON-TB results in paediatric contacts. Eur. Respir. J. 32, 524. 29. Rothel, J.S. and Andersen, P. (2005) Diagnosis of latent Mycobacterium tuberculosis infection: is the demise of the Mantoux test imminent? Expert Rev. Anti Infect. Ther. 3, 981. 30. Schoepfer, A.M. et al. (2008) Comparison of interferon-gamma release assay versus tuberculin skin test for tuberculosis screening in inflammatory bowel disease. Am. J. Gastroenterol. 103, 2799. 31. Silverman, M.S. et al. (2007) Use of an interferon-gamma based assay to assess bladder cancer patients treated with intravesical BCG and exposed to tuberculosis. Clin. Biochem. 40, 913. 32. Stebler, A. et al. (2008) Whole-blood interferon-gamma release assay for baseline tuberculosis screening of healthcare workers at a Swiss university hospital. Infect. Control Hosp. Epidemiol. 29, 681. 33. Turner, J. et al. (1996) Stimulation of human peripheral blood mononuclear cells with live Mycobacterium bovis BCG activates cytolytic CD8+ T cells in vitro. Immunology 87, 339. 34. Brookes, R.H. et al. (2003) CD8+ T cell-mediated suppression of intracellular Mycobacterium tuberculosis growth in activated human microphages. Eur. J. Immunol. 33, 3293. 35. Stenger, S. et al. (1998) An antimicrobial activity of cytolytic T cells mediated by granulysin. Science 282, 121. 36. Lalvani, A. et al. (1998) Human cytolytic and interferon gamma-secreting CD8+ T lymphocytes specific for Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U.S.A. 95, 270. 37. Lewinsohn, D.M. et al. (2001) Classically restricted human CD8+ T lymphocytes derived from Mycobacterium tuberculosis-infected cells: definition of antigenic specificity. J. Immunol. 166, 439. 38. Lewinsohn, D.A. et al. (2007) Immunodominant tuberculosis CD8 antigens preferentially restricted by HLA-B. PLoS Pathol. 3, 1240. 39. Day, C.L. et al. (2011) Functional capacity of Mycobacterium tuberculosis-specific T cell responses in humans is associated with mycobacterial load. J. Immunol. 187, 2222. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 39 40. Rozot, V. et al. (2013) Mycobacterium tuberculosis-specific CD8+ T cells are functionally and phenotypically different between latent infection and active disease. Eur. J. Immunol. 43, 1568. 41. Nikolova, M. et al. (2013) Antigen-specific CD4- and CD8-positive signatures in different phases of Mycobacterium tuberculosis infection. Diagn. Microbiol. Infect. Dis. 75, 277. 42. Chicchio, T. et al. (2014) Polyfunctional T-cells and effector memory phenotype are associated with active TB in HIV-infected patients. J. Infect. doi: 10.1016/j.jinf.2014.06.009. Epub. 43. Ongaya, A. et al. (2013) Mycobacterium tuberculosis-specific CD8+ T cell recall in convalescing TB subjects with HIV co-infection. Tuberculosis 93, S60. 44. Lanicioni, C. et al. (2012) CD8+ T cells provide an immunologic signature of tuberculosis in young children. Am. J. Respir. Crit. Care Med. 185, 206. 45. Long, G., Ji-Chun, M., Min, Jin-Long, L., Jin-Hui, T. (2014) Interferon- release assay for the diagnosis of latent Mycobacterium tuberculosis infection in children younger than 5 years: a meta-analysis. Clin. Pediatr. 46. Howley, M.M. et al. (2014) Evaluation of QuantiFERON-TB Gold In-Tube and tuberculin skin tests among immigrant children being screened for latent tuberculosis infection. Ped. Infect. Dis. 47. Diel, R., Loddenkember, R., Niemann, S., Meywald-Walter, K., and Nienhaus, A. (2011) Negative and positive predictive value of a whole-blood interferon- release assay for developing active tuberculosis. Am. J. Respir. Crit. Care Med. 183, 88. 48. Machingadaize, S. et al. (2012) Predictive value of recent QuantiFERON conversion for tuberculosis disease in adolescents. Am. J. Respir. Crit. Care Med. 186, 1051. 49. Riazi, S. et al. (2012) Rapid diagnosis of Mycobacterium tuberculosis infection in children using interferon-gamma release assays (IGRAs). Allergy Asthma Proc. 33, 217. 50. Lighter-Fisher, J. and Surette, A-M. (2012) Performance of an interferon-gamma release assay to diagnose latent tuberculosis infection during pregnancy. Obstet. Gynecol. 119, 1088. 51. Mathud, J.S. et al. (2014) Pregnancy differentially impacts performance of latent tuberculosis diagnostics in a high-burden setting. PLoS ONE 9, e92308. 52. Hoffman, M. and Ravn, P. (2010) The use of interferon-gamma release assays in HIV-positive individuals. Eur. Infect. Dis. 4, 23. 53. Cheallaigh, C.N. et al. (2013) Interferon gamma release assays for the diagnosis of latent TB infection in HIV-infected individuals in a low TB burden country. PLoS ONE 8, e53330. 54. Ramos, J. M. et al. (2012) Contribution of interferon gamma release assays testing to the diagnosis of latent tuberculosis infection in HIV-infected patients: A comparison of QuantiFERON-TB gold in tube, T-SPOT.TB and tuberculin skin test. BMC Infect. Dis. 12, 169. 55. Wolf, T. et al. (2013) Tuberculosis skin test, but not interferon- releasing assays is affected by BCG vaccination in HIV patients. J. Infect. 66, 376. 56. Hsia, E.C. et al. (2012) Interferon- release assay versus tuberculin skin test prior to treatment with golimumab, a human anti-tumor necrosis factor antibody, in patients with rheumatoid arthritis, psoriatic arthritis, or ankylosing spondylitis. Arthritis Rheum. 64, 2068. 57. Garcovich, S. et al. (2011) Clinical applicability of QuantiFERON-TB-Gold testing in psoriasis patients during long-term anti-TNF-alpha treatment: a prospective, observational study. J. Eur. Acad. Dermatol. Ven. 58. Kwakernaak, A.J. et al. (2011) A comparison of an interferon-gamma release assay and tuberculin skin test in refractory inflammatory disease patients screened for latent tuberculosis prior to the initiation of a first tumor necrosis factor inhibitor. Clin. Rheumatol. 30, 505. 40 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 59. Vinton, P. et al. (2009) Comparison of QuantiFERON-TB Gold In-Tube test and tuberculin skin test for identification of latent Mycobacterium tuberculosis infection in healthcare staff and association between positive test results and known risk factors for infection. Infect. Control Hosp. Epidemiol. 30, 215. 60. de Perio, M.A., Tsevat, J., Roselle, G.A., Kralovic, S.M., and Eckman, M.H. (2009) Cost-effectiveness of interferon gamma release assays vs tuberculin skin tests in health care workers. Arch. Intern. Med. 169, 179. 61. Nienhaus, A. et al. (2008) Evaluation of the interferon- release assay in healthcare workers. Int. Arch. Occup. Environ. Health 81, 295. 62. Nienhaus, A. et al. (2011) Systematic review of cost and cost-effectiveness of different TB-screening strategies. BMC Health Serv. Res. 11, 247. 63. Centers for Disease Control and Prevention (2010) Updated guidelines for using interferongamma release assays to detect Mycobacterium tuberculosis infection — United States, 2010. MMWR Recomm. Rep. 59 (RR-5), 1. 64. Dorman, S.E. et al. (2014) Interferon- release assays and tuberculin skin testing for diagnosis of latent tuberculosis infection in healthcare workers in the United States. Am. J. Respir. Crit. Care Med. 189, 77. 65. Fong, K.S. et al. (2012) Challenges of interferon-gamma release assay conversions in serial testing of health care workers in a tuberculosis control program. Chest 142, 55. 66. Thanassi, W., Noda, A., Hernandez, B., Newell, J., Terpeluk, P., Marder, D. and Yesavage, J.A. (2012) Delineating a retesting zone using receiver operating characteristic analysis on serial QuantiFERON tuberculosis test results in US healthcare workers. Pulm. Med. doi: 10.1155/2012/291294. Epub. 67. Behrman, A. et al. (2013) Protecting Health Care Workers from Tuberculosis, 2013: ACOEM Medical Center Occupational Hatlh Section Task Force on Tuberculosis and Health Care Workers. J. Occup. Environ. Med. 55, 985. 68. Nienhaus, A., Ringshausen, F.C., Costa, J.T., Schablon, A., and Tripodi, D. (2013) IFN- release assay versus tuberculin skin test for monitoring TB infection in healthcare workers. Expert Rev. Anti Infect. Ther. 11, 37. 69. Arend S.M. et al. (2007) Comparison of two interferon-gamma assays and tuberculin skin test for tracing TB contact. Amer. J. Respir. Crit. Care Med. 175, 618. 70. Mandalakas, A.M., Detjen, A.K., Hesseling, A.C., Benedetti, A., and Menzies, D. (2011) Interferon-gamma release assays and childhood tuberculosis: systematic review and meta-analysis. Int. J. Tuberc. Lung Dis. 15, 1018. 71. Grinsdale, J.A., Ho, C.S., Banouvong, H., Kwamura, L.M. (2011) Programmatic impact of using QuantiFERON-TB Gold in routine contact investigation activities. Int. J. Tuberc. Lung Dis. 15, 1614. 72. Walsh, M.C. et al. (2011) Sensitivity of interferon- release assays is not compromised in tuberculosis patients with diabetes. Int. J. Tuberc. Lung Dis. 15, 179. 73. Faurholt-Jespen, D. et al. (2014) Diabetes is associated with lower tuberculosis antigen-specific interferon gamma release in Tanzanian tuberculosis patients and non-tuberculosis controls. Scand. J. Infect. Dis. 46, 384. 74. Painter, J.A. et al. (2013) Tuberculosis screening by tuberculosis skin test or QuantiFERON-TB Gold In-Tube Assay among an immigrant population with a high prevalence of tuberculosis and BCG vaccination. PLoS ONE 8, e82727. 75. Rogerson, T.E. et al. (2012) Tests for latent tuberculosis in people with ESRD: a systematic review. Amer. J. Kidney Dis. 61, 33. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 41 76. Pareek, M. et al. (2013) Community-based evaluation of immigrant tuberculosis screening using interferon release assays and tuberculin skin testing: observational study and economic analysis. Thorax. 68, 230. 77. WHO Global Tuberculosis Report, 2013. http://www/who.int.iris/handle/10665/91355 на 14 июля 2013 г. Условные обозначения 2 x 96 Достаточно для приготовления 2 х 96 образцов Законный производитель Символ обозначения CE-IVD IVD Для диагностики in vitro LOT Код серии REF Номер по каталогу GTIN Глобальный торговый номер единицы Срок годности Ограничение по температуре Изучите инструкции по использованию Не использовать повторно Хранить вдали от прямого солнечного света Контактная информация По вопросам технической поддержки и для получения дополнительной информации звоните по бесплатному телефону 00800-22-44-6000, посетите нашу страницу Центра технической поддержки по адресу www.qiagen.com/contact или обратитесь в одно из подразделений технической поддержки QIAGEN (см. адреса на обратной стороне обложки или на веб-сайте www.qiagen.com). 42 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Краткое описание теста Этап 1. Инкубирование образца крови 1. Взять у пациента пробу крови в вакуумные пробирки для забора крови и тщательно перемешать ее, встряхивая десять (10) раз так, чтобы можно было убедиться, что вся внутренняя поверхность пробирки покрыта кровью. Это растворит антиген, находящийся на стенках пробирки. 2. Инкубировать пробирки в вертикальном положении в течение 16–24 часов при температуре 37 ± 1 °C. 3. После инкубирования пробирки центрифугируют в течение 15 минут при 2000–3000 x g ОСЦ (g), для того чтобы отделить плазму от эритроцитов. 4. После центрифугирования перед отбором плазмы не допускать набора и выпуска плазмы пипеткой или смешивания плазмы до ее отбора. Всегда будьте осторожны, чтобы не взболтать материал на поверхности геля. Этап 2. ELISA для выявления IFN- 1. Все компоненты для ELISA (кроме 100-кратного концентрата конъюгата) выдержать при комнатной температуре (22 ± 5 °C) как минимум в течение 60 минут. 2. Развести стандарт деионизированной или дистиллированной водой до концентрации 8,0 МE/мл. Приготовить четыре (4) рабочих стандартных разведения. 3. Развести 100-кратный лиофилизированный концентрат конъюгата деионизированной или дистиллированной водой. 4. Развести конъюгат растворителем зеленого цвета и внести по 50 мкл во все лунки. 5. Внести 50 мкл каждой пробы плазмы и 50 мкл каждого стандартного раствора в соответствующие лунки. Перемешать на шейкере. 6. Инкубировать при комнатной температуре в течение 120 ± 5 мин. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 43 7. Не менее 6 раз промыть лунки промывочным буферным раствором (400 мкл на каждую лунку). 8. Внести по 100 мкл раствора ферментного субстрата в каждую лунку. Перемешать на шейкере. 9. Инкубировать 30 минут при комнатной температуре. 10. В каждую лунку внести по 50 мкл стоп-реагента. Перемешать на шейкере. 11. Измерить результат реакции, используя фильтр на 450 нм и референсный фильтр 620–650 нм. 12. Проанализировать результаты. 44 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Эта страница оставлена пустой намеренно. 46 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Эта страница оставлена пустой намеренно. Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 47 Эта страница оставлена пустой намеренно. 48 Инструкция-вкладыш QuantiFERON-TB Gold Plus (QFT-Plus) ELISA 02/2015 Товарные знаки: QIAGEN®, QFT®, QuantiFERON® (группа QIAGEN); Microsoft®, Excel® (Microsoft); ProClin® (Rohm and Haas Co.). Ограниченное лицензионное соглашение для QuantiFERON-TB Gold Plus (QFT-Plus) ELISA Использование настоящего продукта означает согласие всех покупателей или пользователей продукта со следующими условиями. 1. Продукт может использоваться исключительно в соответствии с протоколами, прилагаемыми к продукту, и настоящей инструкцией-вкладышем, а также исключительно с компонентами, содержащимися в наборе. Компания QIAGEN не предоставляет лицензии в рамках своей интеллектуальной собственности использовать или объединять прилагаемые компоненты настоящего набора с любыми компонентами, не входящими в настоящий набор, за исключением случаев, описанных в протоколах, поставляемых вместе с продуктом и настоящей инструкцией-вкладышем. 2. Кроме оговоренных лицензий, компания QIAGEN не предоставляет каких-либо гарантий, что данный набор и (или) его использование(я) не нарушает(ют) права третьих лиц. 3. Данный набор и его компоненты лицензированы для одноразового использования и не могут быть использованы повторно, переделаны или перепроданы, если иное не указано компанией QIAGEN. 4. Компания QIAGEN отказывается от любых прочих лицензий, выраженных явно или подразумеваемых, кроме тех, о которых заявлено прямо. 5. Покупатель и пользователь данного набора соглашается не предпринимать или не разрешать кому-либо предпринимать какие-либо меры, которые могут привести или способствовать любым действиям, запрещенным выше. Компания QIAGEN может требовать исполнения требований настоящего ограниченного лицензионного соглашения в судебном порядке в любом суде и получать возмещения всех своих следственных и судебных издержек, включая стоимость юридических услуг, за любые действия, направленные на исполнение требований настоящего ограниченного лицензионного соглашения или любого из своих прав на интеллектуальную собственность, связанных с набором и (или) его компонентами. Актуальные условия лицензии см. на сайте по адресу www.qiagen.com. © QIAGEN, 2014–2015. Все права защищены. www.QuantiFERON.com