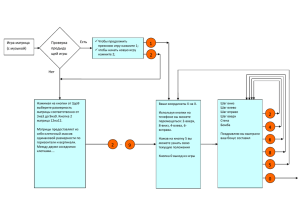
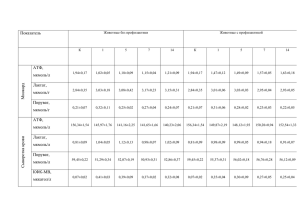
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ «РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ НАУЧНЫЙ ЦЕНТР ИМЕНИ Н.Н.БЛОХИНА»
реклама

ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ «РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ НАУЧНЫЙ ЦЕНТР ИМЕНИ Н.Н.БЛОХИНА» РОССИЙСКОЙ АКАДЕМИИ МЕДИЦИНСКИХ НАУК На правах рукописи СТРИЖЕВСКАЯ Александра Михайловна ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ И ТОКСИКОКИНЕТИКА ВЫСОКИХ ДОЗ МЕТОТРЕКСАТА ПРИ ОСТЕОСАРКОМЕ У ДЕТЕЙ 14.01.12 - Онкология ДИССЕРТАЦИЯ на соискание ученой степени кандидата биологических наук Научный руководитель: доктор биологических наук, профессор Байкова В.Н. Москва - 2014 г. 2 Оглавление СПИСОК СОКРАЩЕНИЙ .................................................................................................................... 4 ВВЕДЕНИЕ ................................................................................................................................................ 6 ЗАДАЧИ ИССЛЕДОВАНИЯ: ..........................................................................................................................8 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ ...................................................................................................... 10 1.1. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТОТРЕКСАТА................................................................................10 1.1.1. МЕТАБОЛИЗМ МЕТОТРЕКСАТА ..................................................................................................... 11 1.1.2. МЕХАНИЗМ ДЕЙСТВИЯ МЕТОТРЕКСАТА .......................................................................................... 12 1.2. ТЕРАПИЯ ВЫСОКИМИ ДОЗАМИ МЕТОТРЕКСАТА ........................................................................14 1.2.1. ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ МЕТОТРЕКСАТА ....................................... 16 1.2.2. ОСОБЕННОСТИ ЭЛИМИНАЦИИ ВЫСОКИХ ДОЗ МЕТОТРЕКСАТА ............................................18 1.3. ПОНЯТИЕ О ТОКСИКОКИНЕТИКЕ .................................................................................................23 1.3.1. ОСНОВНЫЕ ФАРМАКОКИНЕТИЧЕСКИЕ/ТОКСИКОКИНЕТИЧЕСКИЕ ПОКАЗАТЕЛИ ........................ 25 1.4.СПЕЦИФИЧЕСКИЙ МАРКЕР ТОКСИЧНОСТИ МЕТОТРЕКСАТА– ГОМОЦИСТЕИН ..........................29 1.4.1. МЕТАБОЛИЗМ ГОМОЦИСТЕИНА ....................................................................................................... 30 1.4.2. ВЛИЯНИЕ ВЫСОКИХ ДОЗ МЕТОТРЕКСАТА НА МЕТАБОЛИЗМ ГОМОЦИСТЕИНА .............................. 32 1.5. ТОКСИЧНОСТЬ ВЫСОКИХ ДОЗ МЕТОТРЕКСАТА ..........................................................................35 1.5.1. ОСНОВНОЙ МЕТАБОЛИТ МЕТОТРЕКСАТА – .................................................................................. 38 7-ГИДРОКСИМЕТОТРЕКСАТ ........................................................................................................................ 38 ЗАКЛЮЧЕНИЕ ПО ГЛАВЕ 1 .......................................................................................................................40 ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ.............................................................................................. 42 2.1. ОБЩАЯ ХАРАКТЕРИСТИКА НАБЛЮДАЕМЫХ БОЛЬНЫХ ...............................................................42 2.2. СХЕМА ПРОВЕДЕНИЯ ХИМИОТЕРАПИИ БОЛЬНЫМ ОСТЕОСАРКОМОЙ........................................43 2.3. ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ МЕТОТРЕКСАТА .....................................45 2.5. ОПРЕДЕЛЕНИЕ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ КРОВИ ПРИ ВЫСОКОДОЗНОЙ ХИМИОТЕРАПИИ ОСТЕОСАРКОМЫ У ДЕТЕЙ..........................................................................................50 2.6. СТАТИСТИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ ..............................................................................52 ГЛАВА 3. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ ................................................ 54 3 3.1. КОЛИЧЕСТВЕННАЯ ОЦЕНКА ТОКСИКОКИНЕТИКИ ТЕРАПИИ ВЫСОКИМИ ДОЗАМИ МЕТОТРЕКСАТА ................................................................................................................ 54 3.2. ГОМОЦИСТЕИН – ПОТЕНЦИАЛЬНЫЙ МАРКЕР ФАРМАКОДИНАМИЧЕСКОГО ЭФФЕКТА МЕТОТРЕКСАТА .........................................................................................................................................69 3.3. БИОКИНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА ПОКАЗАТЕЛЕЙ ГЕПАТОТОКСИЧНОСТИ ......................77 3.4. БИОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА НЕФРОТОКСИЧНОСТИ .....................................................83 3.5. ОЦЕНКА МЕТАБОЛИЗМА MTX ПРИ ТЕРАПИИ ВД MTX ОСТЕОСАРКОМЫ У ДЕТЕЙ...................87 ГЛАВА 4. ОБСУЖДЕНИЕ .................................................................................................................... 92 ВЫВОДЫ .................................................................................................................................................. 92 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ............................................................................................ 105 CПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ ......................................................................... 106 4 СПИСОК СОКРАЩЕНИЙ 5,10-МТHF - 5,10- метилентетрагидрофолат 5-МТHF – метилентетрагидрофолат 7-OH-Мtx – 7-гидроксиметотрексат AUC – площадь под фармакокинетической кривой CL – клиренс DHF – дигидрофолат Hcy - гомоцистеин Met – метионин Mtx – метотрексат MТГФР – метилентетрагидрофолатредуктаза SAH - S–аденозилгомоцистеин SAM - S–аденозилметионин THF – тетрагидрофолат γ-ГТ – гамма- глутамилтрансфераза АЛТ - аланинаминотрансфераза АО – альдегидоксидаза АСТ - аспартатаминотрансфераза БРВ – безрецидивная выживаемость ВД – высокие дозы ВЭЖХ – высокоэффективная жидкостная хроматография ГГЦ – гипергомоцистеинемия ДГФР - дигидрофолатредуктаза ДМПА - 4-дезокси-4-амино-N10-метилптериновая кислота ЛВ – лекарственное вещество ЛДГ – лактатдегидрогеназа ЛМ – лекарственный мониторинг ЛП – лекарственный препарат НХЛ – неходжкинская лимфома 5 ОВ – общая выживаемость ОЛЛ – острый лимфобластный лейкоз ОС - остеосаркома ПХТ – полихимиотерапия ССЗ – сердечно-сосудистые заболевания ФПИА - флуоресцентно поляризационный иммуноанализ ЩФ – щелочная фосфатаза 6 Введение Актуальность темы исследования В настоящее время в программном лечении онкологических заболеваний у детей применяются высокие дозы (ВД) противоопухолевых препаратов. В лечебной практике разработаны протоколы лечения онкологических заболеваний с максимальными дозами противоопухолевых препаратов, строго регламентированными периодами их проведения. Высокие дозы метотрексата (ВД Mtx) в детской онкологии применяются для лечения остеосаркомы (ОС), острого лимфобластного лейкоза, неходжскинской лимфомы, и других типов опухолей. У пациентов с ОС это позволило достичь безрецидивной выживаемости до 80%. Однако проблема высокой экстра- и интраидивидуальной изменчивости в фармакокинетике Mtx остается нерешенной, в 10% случаев возникает угрожающее жизни замедленное выведение Mtx [105]. Высокая отсроченная токсичность Mtx является серьезным ограничением в достижении максимального лечебного действия, что в большинстве случаев обусловливает возникновение у больных серьезных побочных эффектов со стороны различных органов и систем. Лечение должно проводиться под строгим контролем лабораторных показателей, в первую очередь терапевтического лекарственного мониторинга (ТЛМ) концентрации Mtx. Характер и время проявления побочных реакций, а также скорость их устранения зависят не только от дозы Mtx, его концентрации и длительности нахождения в организме, но и от состояния ферментных систем организма, функциональной полноценности выделительных органов. Оценка воздействия ВД Mtx на организм ребенка требует серьезного теоретического анализа и исследования с помощью новых биохимических маркеров, которые могли бы показать и предсказать токсичность Mtx ранее других биохимических показателей. К таким маркерам можно отнести гомоцистеин (Hcy). Это – серосодержащая аминокислота, не поступающая с 7 пищей. В метаболизме Hcy принимает участие метионинсинтетаза, фермент также незаменимый в метаболизме фолатов и ингибирующийся при использовании ВД Mtx [167]. Общая картина воздействия Mtx на организм зависит от того, какие метаболиты образуются в результате его трансформации – в первую очередь его основного метаболита 7-гидроксиметотрексата (7-OH-Mtx). Долгое время считалось, что он вносит основной вклад в токсичность Mtx, однако в настоящее время это мнение подвергается сомнению [99]. В то же время изучение скорости метаболизма и ее особенностей является важнейшим фактором комплексной оценки воздействия препарата на организм. Изучение взаимосвязи между всеми вышеназванными условиями проведения терапии, то есть ТЛМ, широкий фармакокинетический/фармакодинамический анализ, выявление нарушений метаболизма позволят проводить лечение ВД Mtx безопасно. Таким образом, разработка методологических подходов к прогностической биохимической диагностике токсичности ВД Mtx на основе комплекса фармакокинетических и фармакодинамических методов исследования, контроль «спасительного» действия («resque» - спасение) препаратами фолатов проводимой терапии на основе биокинетического подхода является одной из актуальных задач онкологии. Следует отметить, что в отечественной литературе отсутствуют работы, посвященные изучению фармакокинетических и фармакодинамических маркеров токсичности ВД Mtx, не разработан алгоритм контроля метаболизма Mtx в условиях клиники при проведении ВД Mtx. В этом аспекте очевидна актуальность проводимого комплексного исследования. Цель исследования: Изучить фармакокинетические и биохимические особенности терапии высокими дозами метотрексата детей с остеосаркомой. 8 Задачи исследования: 1. Изучить фармакокинетические особенности выведения метотрексата при применении его в высоких доза у детей, больных остеосаркомой. Рассчитать фармакокинетические параметры метотрексата – площадь под фармакокинетической кривой, клиренс метотрексата, общее время выведения, период полувыведения и др. 2. Отработать методику определения в крови гомоцистеина как фармакодинамического маркера терапии высокими дозами у детей, больных остеосаркомой. 3. Изучить корреляционную взаимосвязь изменений концентраций гомоцистеина и метотрексата при терапии высокими дозами метотрексат детей с остеосаркомой. 4. Рассчитать биокинетические параметры восстановления биохимических показателей на основе их длительного мониторинга при лечении высокими дозами метотрексата детей с остеосаркомой. 5. Изучить особенности метаболизма метотрексата при превращении его в 7-гидроксиметотрексат при применении высоких доз метотрексата у детей с остеосаркомой. Научная новизна В результате проведенного исследования: 1. Выявлены различные типы фармакокинетики метотрексата при применении его в высоких дозах у детей с остеосаркомой. 2. Оценена взаимосвязь между нарушением метаболизма и элиминации метотрексата у детей с остеосаркомой. 3. Определены новые прогностические биохимические критерии токсичности метотрексата. 4. Отработана методика определения гомоцистеина как токсичности высоких доз метотрексата у детей с остеосаркомой. маркера 9 5. Изучена взаимосвязь между биохимическими показателями элиминацией метотрексата с гепатотоксичности, нефротоксичности у детей с ОС. 6. Определены фармакокинетические особенности 7- гидроксиметотрексата при использовании высоких доз метотрексата. Научно-практическая значимость 1. Внедрен терапевтический лекарственный мониторинг метотрексата детям, больным остеосаркомой, получающим высокие дозы метотрексата. 2. Налажено определение гомоцистеина при терапевтическом лекарственном мониторинге высоких доз метотрексата. Определение уровня гомоцистеина является важным показателем эффективности действия метотрексата и может служить для предсказания его клинической токсичности. 3. Определение гомоцистеина также может служить мерой эффективности воздействия метотрексата на метаболизм фолатов, и, следовательно, его эффективности. 4. Метод количественного определения концентраций метотрексата и его основного метаболита 7-гидроксиметотрексата высокоэффективной жидкостной хроматографии с помощью в сыворотке крови позволит проводить оценку токсических проявлений метотрексата. 10 ГЛАВА 1. Обзор литературы 1.1. Метотрексат фолиевой кислоты. Общая характеристика метотрексата препарат из группы антиметаболитов – аналогов Используемые дозы Mtx в соответствии со схемами терапии делятся на низкие (или обычные) (разовая доза (РД) менее 100 мг/м2), средние (РД составляет 100–1000 мг/м2) и высокие (РД более 1000 мг/м2) [2]. В низких дозах используется для лечения ревматоидного артрита, рефрактерного псориаза. В высоких дозах применяется в качестве противоопухолевого препарата. В детской онкологии Mtx применяется при ОС, ОЛЛ, НХЛ и ряде других опухолей в режиме «терапии высокими дозами Mtx под защитой лейковорина» [5, 15]. После приема внутрь в дозе 30 мг/м2 полностью всасывается из ЖКТ (биодоступность около 60%). Показатель абсорбции колеблется от 23 до 95%, причем является дозозависимым – в дозе до 30 мг/м2 составляет около 40%, более 30 мг/м2 – 18%, что объясняет предпочтительность использования внутривенного введения [18]. Максимальная концентрация при пероральном введении (Cmax) достигается через 1–2 ч и через 30–60 мин при в/м введении. Прием с пищей замедляет время, необходимое для достижения Сmax, примерно на 30 мин, но уровень абсорбции и биодоступность не меняются. После внутривенного введения Mtx быстро распределяется в пределах объема, эквивалентного общему объему жидкостей организма. 20–50% циркулирующего в сосудистом русле Mtx связано с белками (главным образом с альбумином), связи с белком слабые [47]. Период полувыведения (t1/2) при использовании низких доз препарата составляет использовании малых доз. составляет 8–15 ч . Конечный t1/2 при введении 3-10 ч при высоких доз 11 1.1.1. Метаболизм метотрексата Существуют три пути метаболизма Mtx. Первый путь – это окисление Mtx c помощью фермента альдегидоксидазы в 7-OH-Mtx в печени. Это основной метаболит Mtx, цирулирующий в крови, он начинает появляться в крови вскоре после введения Mtx (см. рис.3). 7-OH-Mtx обладает очень слабой способностью к ингибированию фермента ДГФР. Если сравнивать их относительную активность, то она у 7OH-Mtx в 100 раз ниже, чем у Mtx. Растворимость в воде при рН 5 – 0,13 г/мл, при рН 7 – 1,55 г/мл. Для Mtx -0,44 г/мл и 8,90 г/мл соответственно [41, 63, 109]. Являясь плохо растворимым метаболитом, 7-ОН-Мtx преципитируется на эпителии почечных канальцев, обеспечивая т.н. прямой токсический эффект на гломерулярную систему [53]. Помимо печеночного, существует также внутриклеточный и кишечный метаболизм Mtx. Первый протекает внутри тканевых клеток, где Mtx под действием фермента фолиполиглутамат синтетазы превращается в полиглутамат (Mtx[glu]n), активность которого по отношению к ДГФР обуславливает механизм действия Mtx [128]. В дальнейшем Mtx[glu]n превращается в моноглутаматы, которые выводятся из клетки активным транспортом. В кишечнике (при приеме внутрь) распад Mtx происходит за счет бактериального гидролиза, в результате, которого Mtx переходит в 4-дезокси-4-амино-N10-метилптериновую (ДМПА) и глютаминовую кислоты. ДМПА является слабоактивным метаболитом, её способность к ингибированию ДГФР в 200 раз ниже аналогичной способности Mtx. В плазме крови этот метаболит не обнаруживается [111]. 12 a альдегидоксидаза Фолиполиглутамат синтетаза b Распад в кишечнике c ДМПА Рис. 1. Метаболизм Mtx. (а) до 7-OH-Mtx в печени (b), Mtx[glu]n внутри клеток и 4-дезокси-4-амино-N10-метилптериновой (ДМПА) и глютаминовой кислоты под действием бактерий кишечника (c). 1.1.2. Механизм действия метотрексата Как хорошо известно, дигидрофолатредуктаза основной мишенью Mtx является (EC 1.5.1.3) (ДГФР)— ключевой фермент фолатного обмена (см. рис.1). Функцией этой редуктазы является синтез и поддержание внутриклеточного пула тетрагидрофолатов — активных форм физиологических фолатов. Mtx в свободной форме является ингибитором этого фермента, однако его полиглютаминовые формы обладают еще более сильными ингибирующими свойствами [8]. Аффинность Mtx к ДГФР приблизительно в 10000 раз выше в сравнении с физиологическими фолатами. [97]. 13 Рис. 2. Механизм действия метотрексата На рис. 2 показаны точки действия Mtx и полиглутамата Mtx (Mtx[glu]n). Mtx проникает в клетки с помощью пассивного транспорта (1) или с помощью белков-переносчиков, конкурируя с фолиевой кислотой (2); после проникновения в клетку Mtx под действием фермента фолиполиглутамат синтетазы превращается в Mtx полиглутамат (Mtx[glu]n) ; Mtx[glu]n является очень сильным ингибитором дигидрофолат редуктазы (ДГФР) (3), в результате чего нарушается регенерация тетрагидрофолата (THF) из дигидрофолата (DHF); Mtx[glu]n гидролизуется в Mtx в лизосомах ферментом γ-глутамил гидролазой (GGH) (4). В активно пролиферирующих клетках ингибирование ДГФР Mtx ведет к блокированию синтеза тетрагидрофолатов (THF) и накоплению 14 неактивных дигидрофолатов (DHF). THF необходимы для синтеза пуринов и пиримидинов. Таким образом, Mtx блокирует клеточный цикл. Помимо истощения пула тетрагидрофолатов полиглютаминовые формы Mtx также ингибируют рибонуклеотидтрансформилазу, карбоксамидрибонуклеотидтрансформилазу и 5-аминоимидазол-4тимидилатсинтетазу, катализирующие реакции, необходимые для синтеза и репарации ДНК [98]. В итоге совокупность изменений приводит клетку к гибели, реализуя, таким образом, противоопухолевый эффект Mtx. 1.2. Терапия высокими дозами метотрексата Как было сказано выше, в детской онкологии Mtx используется для лечения ОС, ОЛЛ и ряда других опухолей. Это стало возможным после разработки метода применения Mtx, позволяющего преодолеть быстро развивающуюся резистентность к Mtx. Существует несколько внутриклеточных механизмов развития резистентности опухолевых клеток к Mtx [100, 136]: 1. Нарушение транспорта метотрексата в клетку. 2. Мутация гена дигидрофолат редуктазы обрывает связи с Mtx. При нормальных биохимических процессах с ферментом взаимодействует фолиевая кислота и ее полиглутамированные производные. При этом сродство их к ДГФР тем выше, чем больше остатков глутаминовой кислоты присоединено к фолату. 3. Нарушение образования полиглутаматов Mtx или увеличение сродства фермента к полиглутаминовым производным приводит к тому, что цитостатик не может участвовать в биохимических процессах клетки; 4. Увеличение уровня экспрессии ДГФР вследствие амплификации гена, кодирующего фермент. Это позволяет клетке поддерживать синтез восстановленных фолатов на достаточном уровне при инактивации части фермента Mtx. 15 Преодолеть эти формы резистентности опухолевых клеток к цитостатику можно, резко увеличив концентрацию Mtx в плазме крови. В этом случае препарат начинает проникать в клетки не только по специфическим транспортным системам, но и пассивной диффузией, а также связываясь с низкоспецифичными переносчиками, что приводит к резкому увеличению концентрации Mtx в опухоли. Описанные выше явления наблюдаются при концентрации Mtx в сыворотке крови свыше 1 мкмоль/л [59], что в 100 раз выше ее же при лечении низкими дозами Mtx. Такие дозы препарата высокотоксичны. Применение ВД стало возможным после того, как был создан режим применения препарата, получивший название «Высокодозная терапия Mtx под защитой (rescue) лейковорина». Однозначного перевода слова rescue в качестве медицинского термина в русском языке нет. Дословно этот термин означает спасение, т.е. преодоление токсичности посредством введения антидота Mtx – лейковорина [15]. Лейковорин восстановленной (кальция формы фолинат) фолиевой кислоты, – соль кислоты производного фолиновой. Лейковорин снижает токсичность Mtx, восполняя дефицит фолиевой кислоты и тем самым возобновляя процесс биосинтеза пиримидинов и пуринов. Mtx, введенный в ВД, проникает во все клетки, в том числе и в опухолевые, но для достаточного проникновения через стенку опухолевой клетки необходима высокая концентрация препарата. Лейковорин вводится в относительно низких дозах, достаточных для проникновения в здоровые клетки, где он нарушает действие Mtx. В опухолевые клетки лейковорин изза недостаточной межклеточной концентрации не попадает. При таком режиме применения препаратов отмечается защитное действие лейковорина только на нормальные ткани организма и появляется возможность увеличить дозу Mtx токсичности. в 100 раз и более без резкого повышения его 16 Используются следующие режимы введения Mtx: 0,5 за 24 ч, 1 г за 24 ч, 1 г за 36 ч, 5 г за 24 ч, 8 г за 4 ч и 12 г за 4 ч, как в виде моно-, так и полихимиотерапии. Для лечения ОС применятся введение в форме 12 г за 4 ч на неоадъювантном этапе 8 г за 4 ч в адъювантном этапе [16]. В связи с опасностью проводимой терапии, общее состоянии пациента должно соответствовать следующим обязательным условиям. Удовлетворительное общее состояние, отсутствие поражения слизистых оболочек и инфекционных поражений. Нормальная функция почек, определяемая по уровню гломерулярной фильтрации, уровни АЛТ/АСТ в сыворотке крови не более пяти возрастных норм, билирубина – не более трех возрастных норм Нормальные гематологические показатели. Отсутствие плеврального выпота, асцита, выпотного перикардита и пр. Терапия ВД Mtx проводится при обязательном защелачивании мочи, и последующем измерении рН каждой ее порции. кислотой, обладающей плохой Mtx является слабой водорастворимостью. Алкализация является часто используемым методом, позволяющим улучшить выведение слабых кислот - их объем распределения уменьшается при снижении кислотности. Перед началом инфузии метотрексата с целью установления стабильного диуреза с щелочной реакцией мочи (рН более 7,0) назначают инфузионный раствор. В связи с высокой интра- и экстраиндивидуальной изменчивостью фармакокинетики Mtx необходимо проводить концентрации в сыворотке крови. 1.2.1. ТЛМ метотрексата мониторинг его 17 Определение концентрации препарата согласно заранее описанному протоколу, основанному на токсикокинетических параметрах ЛП, называется терапевтический лекарственный мониторинг (ТЛМ) [24]. ТЛМ – одно из самых современных направлений в области клинической биохимии. Цели ТЛМ - определение правильного режима и дозировки лекарства; выявление наиболее эффективной концентрации ЛП для достижения успешного лечения; предупреждение развития токсических эффектов; контроль происходящих изменений в каждый период лечения с возможностью менять дозировку препаратов в зависимости от состояния пациентов; изучение взаимозависимости различных факторов при назначенной терапии [11]. В связи с вышесказанным, дети, страдающие злокачественными опухолями, особенно нуждаются в ТЛМ. ТЛМ основан на определении концентрации ЛП, его метаболитов или других биологически активных веществ в плазме крови или других тканях организма в различные промежутки времени после введения в организм в целях установления соответствия ее терапевтическому диапазону и выработки рекомендаций по коррекции режима дозирования [20]. Существует множество факторов, определяющих возрастные особенности фармакокинетики, что требует корректировки режима дозирования с учетом возрастных особенностей организма. ТЛМ Mtx необходим в первую очередь для расчета его точной дозы его фармакологического антидота – лейковорина. Согласно литературе, лейковорин назначают внутривенно струйно каждый 6 часов. При замедленном выведении Mtx и проявлениях его токсичности (тошнота, рвота, задержка мочи, гиперемия кожи и слизистых, головные боли, расстройства со стороны ЦНС, нарушение выведения Mtx, повышение уровня трансаминаз, билирубина, мочевины, креатинина на 50% и более по сравнению с исходными значениями) дозу лейковорина повышают (см. формулу 1) и проводят форсированный алкалический диурез 18 до 4,5л/ м2. Уровень Mtx в этом случае определяется каждые 6 часов по формуле: Лейковорин (мг)= [Mtx]*Вес пациента (кг) (1) 1.2.2. Особенности элиминации высоких доз метотрексата Как было сказано выше, при использовании ВД, Mtx начинает проникать в клетку не только по специфическим переносчикам, но и с помощью пассивной диффузии. На этом этапе описано множество случаев конкурентного лекарственного взаимодействия Mtx c другимим ЛП (салицилаты, хлорамфинекол, тетрациклины). Долгое время считалось, что вызываемая совместным приемом ЛП токсичность обусловлена в первую очередь вытеснением Mtx из его связи с белками плазмы. Однако у Mtx не высокий уровень связи с ними (47-50%) [43]. При этом было обнаружено, что Mtx конкурирует амоксициллином, с НПВС (кептопрофен), пеницилином, ингибиторами протонной помпы (омепразол) и рядом других препаратов за трансмембранные белки-переносчики. Таким образом, конкурентное вытеснение происходит не на уровне плазмы, а при переносе через клеточную мембрану. Это приводит к усилению токсичности Mtx, а также к нарушению его элиминации, т.к. в этот процесс активно вовлечены и белки-переносчики в почках [46]. Токсичность Mtx проявляется в первую очередь как раз при нарушениях его элиминации, которая включает в себя метаболизм и экскрецию ЛП - в понятие элиминации включаются все процессы, приводящие к снижению содержания чужеродного вещества в организме. Самым опасным явлением при терапии ВД Mtx является т.н. «отсроченная экскреция Mtx», «замедленное выведение Mtx». Их развитие многофакторное и непредсказуемое [106]. Точно установлено, что причинами развития тяжелых форм нарушений элиминации Mtx являются (см. рис.3): 19 отеки – экстра- и интрастициальные [106] применение несовместимых лекарственных препаратов[65, 66, 68, 155] генетические особенности пациента [119, 127] сопутствующие заболевания [125] неадекватный режим введения [161 ] Рис. 3. Причины замедленного выведения метотрексата В литературе описано около 60 клинических случаев за период с 1980 по 2013 год, посвященных этому явлению, у взрослых и у детей, с различными нозологиями, в том числе смертельные. Они развиваются скоротечно, иногда в первые 24 часа протекают бессимптомно, и характеризуются развитием острой почечной недостаточности. Как у взрослых, так и у детей для спасения пациента требовалось использование экстренных мер – гемодиализ, гемофильтрация, применения антидота 20 самого Mtx – карбоксипептидазы (фермента, G2 непосредственно разрушающего Mtx) [57, 160]. Ниже представлены некоторые из них. Peyriere H. et al. [146] описан курс лечения высокими дозами Mtx мальчика с ОС. В течение одного из шести циклов ВД Mtx наблюдалась тяжелая интоксикация при высокой концентрации Mtx в сыворотке крови, острая почечная недостаточность и лекарственный гепатит, сопровождающиеся мукозитом и умеренной миелосупрессией. Усиление защелачивания мочи и увеличение дозы лейковорина не уменьшило концентрацию Mtx в сыворотке крови и не предотвратило системной интоксикации. Карбоксипептидаза G2 и аминофилин использовали в качестве препаратов второго плана. Нормализация биохимических отклонений и купирование клинических симптомов была достигнута через две недели. Проведенная операция по сохранению конечностей позволила классифицировать пациента как высоко чувствительного к Mtx. В последствие лечение Mtx было успешно завершено и привело к выздоровлению пациента. Данное наблюдение показывает, что тяжелые осложнения, выявленные в течение одного курса лечения высокими дозами Mtx, не являются основанием для прекращения дальнейшего использования Mtx. Оптимальная терапия таких осложнений требует дальнейшего изучения аспектов действия препарата. Острая почечная недостаточность, вызванная Mtx, может быть смертельна, а универсальный метод, способный ускорять элиминацию Mtx, пока не определен. Применение гемодиализа для удаления Mtx у пациента с ОС представлено в работе Cecyn K. et al. [60]: 13-летняя девочка с ОС, получила ВД Mtx. Никаких побочных эффектов после 2 циклов ВД Mtx не отмечалось, однако, на третьем цикле наблюдалось замедленное выведение Mtx, сопровождаемое нефротоксичностью. Через 40 часов после начала инфузии Mtx концентрация Mtx в сыворотке крови составила 5,39 мкмоль/л. Лечение было основано на симптоматических мерах, таких как гипергидратация, форсированный щелочной диурез и парентеральное 21 введение лейковорина. Дополнительно, чтобы ускорить элиминацию Mtx и уменьшить его токсичность, проводился гемодиализ. Через 24 дня пациентка была выписана с постепенно восстановившейся почечной функцией. Как и в предыдущем случае, Saland. J.M. et al. [160], сообщили о выведении Mtx посредством использования гемодиализа потока высокой интенсивности у трех пациентов c почечной токсичностью, вызванной задежкой выведения Mtx при лечении ОС. Пациенты были успешно излечены с помощью гемодиализа потока высокой интенсивности, однако в двух случаях также применялась карбоксипептидаза G2. Авторы рекомендуют раннее и агрессивное лечение данного осложнения при применении ВД Mtx терапии. Titier K. et al. [172], описали случай взаимодействия между ВД Mtx и оксациллином. Пациент восемнадцати лет получил два цикла ВД Mtx при лечении ОС. Ему вводилось по 15 гр Mtx за шесть часов. Во время второго цикла, в результате перорального приема оксациллина (1г каждые 8 часов) отмечено значительное увеличение концентрации Mtx в плазме. Развилась тяжелая недостаточностью, токсичность, которая миелосупрессией, сопровождалась мукозитом, почечной лихорадкой и дерматологическими отклонениями. Несмотря на начальное улучшение при применении спасения лейковорином и гемодиализа пациент умер. Авторы сделали вывод, что оксациллин может приостановить выведение Mtx из организма. Также описаны случаи задержки выведения Mtx, протекавшие с тяжелыми проявлениями токсичности при одновременном использовании высоких доз Mtx и ципрофлоксацина [65, 66], а также при сочетании с омепрозолом [45, 48, 155] и другими ЛП. В 2011 году группой ученых из Южной Кореи, Сеул, были описаны два клинических случая замедленного выведения Mtx при применении его ВД для лечения ОС – у мальчика 4 лет и девочки 7 лет. Это самый маленький возраст пациентов, у которых развились подобные нарушения. У 22 мальчика наблюдалось резкое увеличение концентрации Mtx, с последующим постепенным выведением, занявшим 240 часов. У девочки наблюдалось увеличение концентрации Mtx и отсутствие его снижения (плато) в течение 96 часов. Общее время выведения заняло 348 часов. Выведения Mtx добились только интенсификацией терапии лейковорином и гидратацией, без использования гемофильтрации и карбоксипептидазы G2 [115]. Таким образом, становится ясно, что замедленное выведение без проведения ТЛМ Mtx было бы обнаружено с большим опозданием и шансы на выживание пациента существенно снижены. Функция ВД Mtx обеспечивается за счет изменения механизма проникновения в клетку Mtx путем многократного увеличения концентрации – в 100 раз выше высшей разовой дозы препарата. При этом усиливается не только его терапевтический, но и токсический эффект. Во всех случаях назначения ВД возникают побочные эффекты со стороны различных органов и систем, ограничивающие применение эффективной терапии. Порой токсичность приводит к необходимости прекращения лечения. Это существенно снижает шансы пациента на выздоровление. Комплекс этих факторов предполагает рассмотрение особенностей терапии ВД Mtx с точки зрения токсикокинетики. Понимание фармакокинетических и фармакодинамических принципов является необходимой частью оптимальной оценки и лечения пациентов, получающих токсические вещества. Эти принципы позволяют использовать фармакокинетические данные для быстрого принятия решения о лечении отравлений лекарственными препаратами (ЛП), улучшении выведения агентов, меняющих распределение веществ, и оптимальном подборе антидотной терапии – все это требует знаний о принципах клинической фармакологии и о том, как изменяется токсикокинетика при передозировке препарата. 23 1.3. Понятие о токсикокинетике Токсикокинетика - раздел токсикологии, в рамках которого изучаются закономерности абсорбции, распределения, биотрансформации ксенобиотиков в организме и их элиминации. С позиций токсикокинетики организм представляет собой сложную гетерогенную систему, состоящую из большого числа компартментов (камер) - функционально обособленных тканей. Эта теория основывается на разных уровнях и скоростях перфузии в ткани, проницаемости мембран клеток и распределением вещества между 0тканями и центральной камерой (плазмой) [25]. По существующим представлениям сила действия вещества на организм является функцией его концентрации в месте взаимодействия со структурой-мишенью, что в свою очередь определяется не только дозой, но и токсикокинетическими параметрами ксенобиотика [17, 20]. Абсорбция описывает прохождение яда извне организма через биологические барьеры в кровь, где оно становится системно доступным. Чтобы оказать системную токсичность, ЛП должен быть абсорбирован. Как правила, абсорбция быстрее элиминации и занимает 1-2 часа. Время, за которое была достигнута максимальная концентрация, называется tmax, после чего элиминация начинает снижать концентрацию вещества. Tmax может быть значительно увеличено при передозировке, когда абсорбция также увеличена. Некоторые факторы также могут влиять на кинетику абсорбции, к примеру, изменение рН [28]. Распределение яда из циркулирующей крови в периферические ткани проходит между абсорбцией и элиминацией. Т.к. уровень распределения различается для разных камер, это также отражается на токсическом эффекте. Если «камера токсического эффекта» расположена «близко» к плазме, то и эффект будет развиваться быстро. Если же «камера токсического эффекта» происходить медленее. расположена периферически, то процессы будут 24 Кровь может осуществлять транспорт веществ в свободной и связанной форме. В связанном виде препараты не активны и не оказывают фармакологического действия. При этом многие вещества могут конкурировать за связь с белками. Способность вещества вытеснять другие препараты из комплексов с белком увеличивается по мере возрастания его концентрации и сродства к альбуминам. Вытеснение из связи с белками во много раз увеличивает концентрацию препарата в крови, и, следовательно, его токсический эффект. К примеру, салицилаты потенцируют действие Mtx. Скорость, с которой ЛП распределяется из центральной камеры, зависит и от его особенностей – размера молекулы, липофильности, химических свойств, связывания с белками. На распределение может также влиять рН крови – к примеру, слабые кислоты с маленькой константой диссоциации активнее распределяются в случае ацидемии крови. Элиминация включает в себя биотрансформацию и экскрецию вещества. Основной метаболизм лекарств происходит в печени. Она не является единственным органом, где протекают процессы превращения веществ, но основным для большинства токсикантов. Метаболизм можно классифицировать как ограниченный перфузией, и зависящий от скорости кровотока в печени, и ограниченный функцией – способностью к превращению вещества. Экскреция отражает метаболита от организма. удаление токсического вещества или ЛП почечно выделяется или пассивной фильтрацией в клубочке или активной секрецией в проксимальном канальце, также встречаются и активной и пассивной реабсорбцией из канальца и редко активной реабсорбцией. Пассивная реабсорбция может меняться в зависимости от pH фактора фильтрата. К примеру, в случае слабых кислот, алкализация увеличивает пропорцию вещества в мочевом фильтрате. Невозможно интерпретировать клиническую информацию без определения и понимания кинетики яда, точно так же, как и понимания 25 процессов, его сопровождающих – абсорбции, распределения, выведения, а также их особенностей. В больших концентрациях – дозах - кинетика cущественно изменяется многих ЛП - это явление называется дозозависимой кинетикой. При этом также изменяется их эффект на органы и ткани. Это явление лежит в основе использования положительного терапевтического эффекта сверхвысоких доз химиотерапевтических препаратов. Ярким примером этого явления является терапия ВД Mtx. 1.3.1. Основные фармакокинетические/токсикокинетические показатели Для описания филиологических процессов и математического их описания в виде зависимостей концентрации вещества от времени обычно используется ряд кинетических параметров. Важнейшим этапом изучения токсикокинетики ксенобиотика является определение количественных характеристик процессов Процессы, происходящие абсорбции, распределения, элиминации [17]. с ЛП в организме, количественно характеризуются рядом фармакокинетических параметров – площадь под кривой «концентрация-время» - (AUC), общий клиренс препарата (Cl) , период полувыведения (t1/2), объем распределения, Сmax. Площадь под кривой «концентрация-время» (синоним – площадь под фармакокинетической кривой; обозначаемая AUC. Размерность – ммоль*ч*л-1, ммоль*мин*л-1, и пр) – на графике в координатах «концентрация препарата в плазме (сыворотке) крови – время после введения препарата», площадь фигуры, ограниченной фармакокинетической кривой и осями координат. Математически равна интегралу функции С=f(t) от нуля до бесконечности (по времени). При внутривенном введении в рамках одночастевой модели AUC=C0/kel где С0 – максимальная концентрация вещества (кажущаяся начальная), kel – константа элиминации. (2) 26 AUC связана с другими фармакокинетическими параметрами – объемом распределения, а также обратно пропорциональна общему клиренсу препарата. При линейности кинетики препарата в организме AUC пропорциональна общему количеству (дозе) препарата, попавшего в организм. Часто пользуются площадью не под всей кривой, а частью кривой – от нуля до некоторого времени t (AUCt). Упомянутый общий клиренс препарата – параметр, характеризующий скорость «очищения» соответствует (условно) организма от той объема распределения, части лекарственного препарата, которая очищается от препарата за единицу времени. Связан с AUC следующей формулой (3): Сl=Vd*kel=D/AUC где D – доза, Vd – объем распределения, kel – Объём распределения (3) константа элиминации («кажущийся» объем распределения лекарственного средства) — условный объём жидкости, необходимый для растворения всей дозы введенного лекарственного средства до концентрации, обнаруживаемой в крови в момент исследования. Vd = D / С0 (4) где D – доза, С0 – начальная концентрация вещества Кажущаяся начальная концентрация препарата (C0, Cmax ммоль/л, мкг/мл и т.д.) – условный параметр, равный той концентрации, которая получилась бы в плазме крови при условии введения препарата в кровь и мгновенного распределения его по органам и тканям (при анализе одночастевой модели) или в объеме центральной камеры (при анализе многочастевых моделей). Величина C0 при линейной кинетике препарата в организме прямо пропорциональная дозе препарата. Период полуэлиминации (полувыведения) (t1/2) – время, за которое концентрация вещества в камере снижается на 50%. Он связан с константой скорости элиминации следующим соотношением: t1/2 = ln 2 / kel = 0,693/kel (5) 27 где kel – константа элиминации. Объем распределения и период полуэлиминации связаны следующей формулой: t1/2= 0,693 • Vd/Cl (6) Во многих случаях изменение концентрации ЛП подчиняется определенному закону, который графически можно представить кривыми (см. рис.4). Любая прямая может быть представлена уравнением y=a±bx. При приведении значения концентрации к натуральному логарифму, подобные данные могут быть представлены в координатах «lnC-t». Данный метод называется линеаризацией, и широко распространен в фармакокинетическом анализе. Подставив изучаемые величины, получаем lnC=lnC0 – kel *t . С t Рис.4. Элиминация вещества, соответствующая кинетике первого порядка Для описания динамики концентрации препарата в сыворотке/плазме крови используют математические модели фармакокинетики. Модель называется линейной, если все формализуемые ею процессы описываются кинетическим уравнением 1 порядка. В фармакокинетике в качестве единиц системы – организма - принято выделять камеры, это чисто условное название, за которым не скрывается анатомического смысла. Ее можно определить как часть системы, в которую равномерно распределен препарат. Объем камеры предполагается практически постоянным и не меняющимся с течением времени, также считается, что вещество поступает в камеру одномоментно. 28 Самая простая модель называется однокамерной. Эта модель рассматривает организм как единое целое – камера - и уменьшение концентрации ЛП в крови описывает с помощью kel –константы элиминации. вещества После распределения в объеме камеры концентрация постепенно снижается при участии двух процессов – биотрансформации и экскреции. Оба эти процесса объединяются термином элиминация. Скорость элиминации пропорциональна количеству вещества, находящегося в данный момент в камере, то есть соответствует кинетике первого порядка. В соответствии с законами линейной кинетики скоростью уменьшения количества препарата в единственной камере одночастевой модели (-dC/dt) пропорциональна его количеству в камере (С): dC dt = -kel C (1) (7) Решением дифференциального уравнения является уравнение lnC=lnC0 – kel *t (8) которое может быть записано в форме экспоненты. С=С0 e-kel*t (9) где С0 – начальная концентрация вещества, С – концентрация вещества в данный момент времени. Полученное экспоненциальное уравнение позволяет решать множество задач фармакокинетики. Расчет любого из этих параметров требует точного измерения концентрации в строго определенные часы, иначе воспроизведение и сопоставление токсикокинетического профиля становится невозможным. Целью изучения токсикокинетики должно быть лучшее описание и понимание комплексного взаимодействия между изменениями концентрации в крови и клинического исхода – кинетическая/динамическая взаимосвязь. 29 Однако, в некоторых случаях, кинетическо/динамические данные приводят к выводу, что для полного понимания процесса требуется изучение дополнительных маркеров. Более того, для потребностей современной медицины, стремящейся к индивидуализации терапии, требуется разработка новых маркеров, которые будут отвечать потребностям предиктивной медицины. В идеале такой маркер является критерием токсичности и/или эффективности. Для их поиска необходимо глубокое понимание биохимических процессов, происходящих в организме при терапии ВД Mtx. Для этого в исследование, помимо изучения фармакокинетики Mtx, и его метаболизма, было включено изучение влияния Mtx на аминокислоту гомоцистеин (Hcy), чей метаболизм является мишенью воздействия Mtx, а также изучение метаболизма самого Mtx. 1.4.Специфический маркер токсичности метотрексата– гомоцистеин Несмотря на то, что гомоцистеин впервые описали еще в 1932 году, основные публикации о связи повышенного содержания гомоцистеина с патологическими состояниями человека заболеваниями, патологиями расстройствами) появились только в последние десятилетия. Тогда же стали проводиться беременности, (сердечно–сосудистыми популяционные нервно–психическими исследования, связанные с гипергомоцистеинемией [54, 55, 61, 67, 78,123, 144,148]. Гомоцистеин (Hcy) – природная серосодержащая аминокислота, не встречающаяся в белках. Hcy – продукт метаболизма метионина (Met) – одной из 8 незаменимых аминокислот организма. В плазме крови свободный (восстановленный) Hcy присутствует в небольших количествах 1-2%. Примерно 20% находится в окисленном состоянии, преимущественно в виде смешанного дисульфида цистеинил гомоцистеина 30 и гомоцистина. Около 80% Hcy связывается с белками плазмы крови, в основном с альбумином, образуя дисульфидную связь с цистеином [59]. В норме уровень Hcy в плазме крови у взрослых составляет 5–15 мкмоль/л. В течение жизни средний уровень Hcy увеличивается на 3–5 мкмоль/л, и он несколько выше у мужчин, чем у женщин [61]. Концентрация Hcy в крови у детей незначительно отличается от таковой у взрослых и равна в среднем 5,21 - 8,84 мкмоль/л. С мочой в норме выделяется от 3,0 до 9,5 мкмоль гомоцистеина в сутки (в среднем 6 мкмоль/сут), что составляет лишь 0,3% отфильтрованного гомоцистеина. Остальная его метаболизируется часть, в поступившая клетках в канальцев почки, в реабсорбируется основном по и пути транссульфирования с образованием цистатионина [120]. 1.4.1. Метаболизм гомоцистеина Метаболизм гомоцистеина (рис. 5) происходит с участием ряда ферментов, основные из которых: метилентетрагидрофолатредуктаза (МТГФР) и цистатион–β–синтетаза (ЦВС). Помимо ферментов, важную роль в метаболизме гомоцистеина выполняют витамины В6, В12 и фолиевая кислота. Mетионин (Met) преобразуется в S–аденозилметионин (SAM) при участии фермента метионинаденозилтрансферазы. В результате реакций метилирования, осуществляемых метилтрансферазами, SAM превращается в S–аденозилгомоцистеин (SAH). В дальнейшем SAH подвергается гидролизу посредством SAH–гидролазы с образованием Hcy и аденозина. Этот каскад ферментативных реакций, обозначаемый как трансметилирование, происходит почти во всех клетках человеческого организма. Существует несколько путей трансформации Hcy в организме человека - фолат-зависимый, бетаиновый, цистатионовый (рис. 6) [144]. В первом из них в качестве донора метильной группы, необходимой для превращения Hcy в Met, используется 5-МТHF, активная форма 31 фолиевой кислоты. Катализирует данную реакцию фермент метионинсинтетаза, а в качестве кофермента при этом выступает витамин В12. Во втором случае в качестве донора метильной группы используется бетаин, и реакцию превращения гомоцистеина в Met катализирует фермент бетаингомоцистеин-метил-трансфераза. Реметилирование по первому, фолат-зависимому, пути происходит во всех тканях организма человека, в то время как ферменты бетаин-зависимой и цистатионовой реакции сосредоточены в печени и почках. В процессе транссульфирования фермент цистатионин-β-синтетаза катализирует превращение гомоцистеина и серина в цистатионин, который затем подвергается гидролизу с образованием цистеина и α-кетобутирата под влиянием фермента цистатионазы. Рис. 5. Метаболизм гомоцистеина 32 При этом в качестве кофермента в обеих реакциях используется витамин В6. Излишек цистеина окисляется до таурина и неорганических сульфатов или выделяется с мочой [154]. При нарушении внутриклеточного метаболизма «лишний» Hcy выводится из клетки во внеклеточное пространство и далее в кровь. Это приводит к возникновению гипергомоцистеинемии и, следовательно, токсическому воздействию на клетки эндотелия [157]. 1.4.2. Влияние высоких доз метотрексата на метаболизм гомоцистеина Hcy не поступает в организм с пищей, а является продуктом трансметилирования, в дальнейшем превращающийся в Met. Внутриклеточный Hcy – продукт S-аденозилметионин-зависимых реакций трансметилирования. Продуктом ее дальнейшего метаболизма является метионин. 33 Рис. 6. Влияние Mtx на метаболизм гомоцистеина. В большинстве тканей эта реакция катализируется метионинсинтетазой, которая требует 5-ТHF в качестве метильного донора, и, следовательно, применение Mtx, будет оказывать влияние на его содержание в крови пациентов. Безусловно показательно это при ВД Mtx (рис. 6). В конце 80-х годов одними из первых изучением взаимосвязи Mtx и Hcy занимались Refsum H. et al. В 1986 году они провели исследование пациентов, получавших дозы ВД Mtx в концентрации 2-3,8 г/м3. Было выявлено, что после скрытого периода 4-6 ч, уровень Hcy начинал резко повышаться (20-100%) и достигал максимума к 24 часу, после чего снижался. На 24 час пациенты начинали получать терапию лейковорином, и в течение следующих 24-72 часов уровень Hcy начинал снижаться, и часто достигал концентраций ниже первоначальных значений. У большинства пациентов уровень Hcy как в крови снижался с каждым новым курсом Mtx, вплоть до отсутствия изменений его концентрации у некоторых пациентов [153]. Они же в 1991 году исследовали группу детей, получавших ВД Mtx для лечения ОЛЛ и получили сходные результаты – уровень Hcy резко повышался, пока не начиналось введение лейковорина, затем постепенно снижался, и на начальных курсах это различие было более выраженным, чем на последних [152]. В 1989 году Broxon E. et al проводили исследование изменений концентрации Hcy и Met у детей, получающих высокодозную терапию Mtx по поводу ОЛЛ или ОС (33,6 г/м2и 8 г/м2), и наблюдали максимальное повышение Hcy на 36 и 24 час после начала введения Mtx, уровень аналита возвращался к нормальным значениям уже к 48 часу введения Mtx. Снижение метионина в плазме начиналось на 4±0,5 час после начала инфузии, и уровень этого аналита возвращался к норме примерно к 24 часу [56]. 34 Peyriere H. et al в 2004 году опубликовали данные о пациенте (мальчик, 14 лет), получавшем ВД Mtx по поводу ОС бедренной кости. Во время шестого курса ВД Mtx у ребенка развилась задежка выведения Mtx, вызвавшая острую почечную недостаточность и потребовавшая гемодиализа и применения карбоксипептидазы G2. Уровень Hcy в данном случае держался выше нормы более 330 часов, а пик его концентрации вместо 24 часа, не смотря на введение лейковорина, наблюдался на 48 час [146]. Начиная с 2004 года Valik D.et al проводили исследования изменения концентраций Hcy у детей с ОЛЛ и НХЛ. Помимо определения концентрации Hcy они определяли уровень содержания фолатов перед началом курса ВД Mtx. Согласно рассматриваемому ими протоколу лечения, лейковорин начинал применяться на 42 час. Уровень Hcy возрастал, начиная от введения Mtx и до введения лейковорина (42 час), и в дальнейшем снижался. Они установили, что у пациентов с низкими значениями фолатов в крови на начало лечения повышение концентрации Hcy было более значимым, чем для пациентов, у которых наблюдались высокие концентрации фолатов до начала лечения [177]. Valik D. et al также был описан клинический случай тяжелой нейротоксичности у пациента, проходившего первый курс ВД Мtx по поводу ОЛЛ и не имевшего дополнительных патологий. На 71 часу ВД Mtx ребенок (9 лет) впал в кому, длившуюся 30 часов. Второй курс он перенес без осложнений. AUC гомоцистеина для первого, токсичного курса, в итоге была в 5,5 раз больше, чем для второго. Уровень фолатов до начала курса составил 4,5 мкмоль/л и 45 мкмоль/л, соответственно [178]. 35 Токсичность высоких доз метотрексата 1.5. Терапия ВД Mtx высокоэффективна, но при этом является крайне токсичной. Особенности фармакокинетики Mtx таковы, что предсказать колебания концентрации Mtx в циркулирующей крови как у разных пациентов, так и между курсами у одного и того же больного практически невозможно. К тому же существует множество экзо- и эндогенных факторов, которые могут спровоцировать нарушение выведения Mtx из организма (cм. рис. 3). В литературе, посвященной применению ВД Mtx, значительное место отводится изучению токсичности данного метода лечения – так или иначе вопрос затрагивается почти во всех работах, посвященных данной проблеме. Токсичность Mtx часто связывают с возрастом пациентов. Bacci G. et al [34-38], ретроспективно изучили 790 случаев заболевания ОС пациентов, прошедших неоадъювантную химиотерапию в период с 1983 по 2000 г. Замедленное выведение Mtx в большей мере была связано с возрастом пациента (16% для пациентов старше 20 лет против 6% более молодых пациентов, p=0,0001). В нашей стране ученые также занимались данной проблемой. В качестве детерминанты токсичности возраст выявлен в работах Копосова П.В. [16]. Mtx применялся в высоких дозах для лечения опухолей ЦНС и ОЛЛ. ВД Mtx (5 г/м2) удовлетворительно переносились детьми грудного возраста (от 6 до 12 мес.), толерантность к Mtx была выше, чем у детей более старшего возраста, без выраженной токсичности или отсроченной Mtx экскреции. При этом считается, что Mtx – слабоэметогенный препарат. Стоматиты и диарея отмечаются через 4-7 дней после начала курса терапии. Лейко- и тромбоцитопения возникают на 10 день после введения препарата. Обычно не глубоки. При применении ВД возможно развитие почечной токсичности, для ее профилактики требуется гипергидратация и 36 ощелачиваение мочи [2]. При ОС самыми распространенными видами токсичности при ВД Mtx являются гепатотоксичность, гематотоксичность, панкреопатии, и др. Международным Обществом Детских Онкологов (SIOP) предложены критерии гепатотоксичности для оценки побочного действия цитостатических лекарственных средств (см. табл. 1). Таблица 1 Оценка нарушения функции печени в соответствии со стандартными биохимическими критериями (SIOP) Степень нарушения Лабораторные показатели АЛТ, АСТ Незначительная Общий билирубин N*-2,5N N*-2,5N Умеренная 2,5N-10N 2,5N-5N Тяжелая >10N >5N Где N* – верхняя граница нормы; АЛТ, АСТ - 40 ед/л; билирубин - 20,5 мкмоль/л. Биохимические тесты выявляют осложнения, к которым может привести лечение, и широко используются для скрининга возможной токсичности лекарственных препаратов [2]. При выборе теста или тестов важно определить, какого рода информация требуется и может ли анализ быть ее отражением. Печень, ввиду своих функций, является высокочувствительной к токсическим воздействиям, и потому определение степени ее повреждения очень важно при проведении терапии, в особенности противоопухолевой. Биохимическая диагностика поражений печени 37 заключается в определении активности ряда ферментов (АЛТ, АСТ, ЛДГ, γГТ, ЩФ), показателей пигментного обмена – билирубина, а также концентрации белка и альбумина в сыворотке крови [10]. Наиболее распространенными лабораторными показателями диагностики состояния почек являются креатинин и мочевина, являющиеся показателями азотистого обмена [11]. Многие исследователи устанавливают взаимосвязь между замедлением выведения Mtx и развитием гепато- и нефротоксичности [35, 99, 128]. При увеличении концентрации Mtx увеличивается и значение активности АЛТ, АСТ, ЛДГ – эта тенденция характерна для всех нозологий, при которых применяется терапия ВД Mtx. Некоторые исследователи также выделяют увеличение активности γ-ГТ относительно нормального выведения при замедленном выведении Mtx [67]. Widemann B.C. и Adamson P., подробно изучили развитие нефротоксичности при терапии ВД Mtx. Исследователи указывают, что предсказать развитие почечной токсичности в данном случае практически невозможно, она часто начинается бессимптомно. Ими была выявлена взаимосвязь между увеличением концентрации Mtx и концентрацией креатинина [181]. Кошечкин К.В. [18] в своей работе при исследовании широкого спектра определяемых биохимических показателей выявил наиболее значимые для оценки гепатотоксичности, вызванной ВД Mtx, примененной для лечения ОС у детей – показатели антиоксидантной активности, АЛТ, АСТ, ЛДГ. Также им было проведено сравнение сроков восстановления биохимических показателей до нормы у детей, получавших препараты адеметионина для купирования гепатотоксичности при ВД Mtx. Установлено сокращение сроков восстановления уровня ферментов печени: АЛТ в 3,2 раза, АСТ в 2,7 раза, ЛДГ в 2 раза [9, 22]. Для вычисления кинетических характеристик (константы скоростей, периоды полувосстановления, максимальные концентрации) 38 биохимических показателей крови также можно использовать биокинетический подход, основанный на методе линеаризации. Для некоторых биохимических показателей крови известно, что график их восстановления до нормальной концентрации соответствует экспоненте (АЛТ, АСТ, ЛДГ, г-ГТ). Полученные значения позволяют оценить скорость и время полного восстановления их нормальной концентрации в крови [3, 22]. 1.5.1. Основной метаболит метотрексата – 7-гидроксиметотрексат Mtx в печени оксиляется до 7-ОН-Mtx с помощью фермента альдегидоксидазы. Альдегидроксидаза (АО) (ЕС 1.2.3.1)— цитозольный молибдензависимый фермент, относится к классу флавопротеинов. По своей структуре напоминает ксантиноксидазу—ксантиндегидрогеназу, однако не является альтернативой последней, так как не участвует в транспорте электронов в исключительно восстановленного дегидрогеназно-оксидазном в окисленной субстрата форме, (флавин) цикле. электроны [149]. АО существует получает Экспрессируется АО от в различных органах и тканях животных и человека. В организме человека ее распространение несколько ограничено и включает, практически, только печень, а следовые количества наблюдаются в почках и сердечной мышце. АО в процессе каталитического акта генерирует активные формы кислорода, участвующие в реакциях с ацетальдегидом и образующие при этом соответствующие радикалы, катализирует превращение альдегидов и гетероциклов ксенобиотиков в присутствии кислорода с образованием пероксида водорода [184]. Доказанным ингибитором является эстриол и эстрадиол [43]. В настоящее время роль альдегидоксидазы в механизмах детоксикации 39 лекарственных препаратов приравнивается к значению цитохрома Р450. Альдегиодкосидаза вносит различных препаратов, существенный вклад в фармакокинетику окисляя многие из них в печени. Изучение альдегиодксидазы в данный момент времени является важным направлением для фармацевтической индустрии [166]. Являясь плохо растворимым метаболитом, 7-ОН-Мtx, как и Mtx, в кислой среде преципитируется на эпителии почечных канальцев, обеспечивая т.н. прямой токсический эффект на гломерулярную систему. Эта ситуация для клиницистов представляет большую опасность, так как очень часто является фатальной для больного. Однако она предотвратима обильной гидратацией и алкализацией мочи. В нескольких современных работах отражается высокая корреляция между 7-ОН-Мtx и высоким содержанием креатинина [130, 160]. Существует множество противоречивых данных о взаимосвязи 7OH-Mtx с токсичностью терапии ВД Mtx. Более того, в течение долгого времени он считался единственным возможным маркером нарушений обмена Mtx, однако четкой и стабильной картины корреляции не выявлено. К примеру, Ertmann et al. сообщили, что концентрация 7-OHMtx уменьшается с увеличением номера курса при ОС пациенты, Borsi et al. описали, что увеличение номера курса не затрагивает концентрацию 7-OHMtx у детей с ОЛЛ [96]. Согласно литературным источникам, исследования по данному вопросу были почти прекращены в течение последних пятнадцати лет, однако не так давно, в связи с появлением новых технологий и развитием индивидуализации терапии, интерес к обмену Mtx возобновился. Hlomboe L. et al. в 2012 гг. свидетельствую о двухфазной тенденции обмена 7-OHMtx у детей с ОС. По их данным, от первого к четвертому циклу 7-OH-Mtx концентрация увеличивалась значительно, но после пятого цикла концентрации 7-OH-Mtx снижалась. Ученые предполагают, что это могло быть вызвано увеличением активности почечных и печеночных АТФ- 40 связывающих белков-переносчиков. Также ими было установлено, что у пациентов с высокими концентрациями 7-OH-Mtx уровень гепатотоксичности был значительно выше по показателю АЛТ. Чаще всего это были пациенты женского пола и младшего возраста. На данном этапе это единственное исследование, связывающее токсичность и половозрастные признаки [99]. Csordas K. Et al. выполнили подробное сравнительное исследование фармакокинетики и токсичности Mtx и 7-OH-Mtx после ВД Mtx у детей ОЛЛ. Были проанализированы в общей сложности 583 курса ВД Mtx. Было определено, что повторное назначение Mtx не влияет на его концентрацию, и на уровень 7-OH-MTX. Однако концентрация 7-OH-Mtx коррелирует с нефротоксичностью, (р=0,031). Исследователи пришли к выводу, что контроль концентрации 7-OH-Mtx может быть полезен для предсказания токсичности [94]. Заключение по главе 1 В обзоре литературы представлена терапия ВД Mtx c позиции токсикокинетики. Описаны основные фармакокинетические параметры и дана токсикокинетическая характеристика Mtx, покзана важность ТЛМ Mtx, являющегося необходимым звеном терапии ВД Mtx в связи с часто возникающими нарушениями его элиминации. Соответственно, были представлены причины изменений фармакокинетики Mtx. Показано, что без ТЛМ нарушения элиминации ЛП были бы обнаружены с большим опозданием, что значительно снижало шансы на выживание пациентов. Причиной токсичности Mtx могут являться нарушения его метаболизма. Описаны исследования, посвященные его основному метаболиту – 7-ОН-Mtx и его фармакокинетике в условиях ВД Mtx. Терапия ВД Mtx остается крайне опасной и токсичной. Именно поэтому поиск новых 41 маркеров токсичности и эффективности Mtx крайне актуален в настоящий момент. Биохимический анализ крови является одним из методов, с помощью которых можно контролировать состояние, как отдельных органов, так и организма в целом, однако классические показатели гепатои нефротоксичности не являются специфическими, и не отражают всех требований современной медицины. Mtx нарушает метаболизм фолиевой кислоты в организме, в связи с этим описан данный метаболический цикл и выявлено соединение–аминокислота Hcy, накопление которой может являться показателем эффективности Mtx. Описаны литературные данные по данной проблеме при терапии ВД Mtx различных нозологий в детской онкологии – ОЛЛ, НХЛ, ОС. Все исследователи сошлись во мнении, что Hcy может стать полезным маркером токсичности ВД Mtx, а также свидетельствовать об эффективности препарата, а также позволять предсказывать развитие токсичности и нарушения элиминации Mtx. 42 Глава 2. МАТЕРИАЛЫ И МЕТОДЫ 2.1. Общая характеристика наблюдаемых больных В настоящую исследовательскую работу был включены данные о 246 детях в возрасте от 5 до 16 лет с ОС (средний возраст 12,2 лет), которые находились на лечении в НИИ ДОГ ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН с 2006 по 2013 гг. Дети получали лечение согласно протоколу комплексной химиотерапии ОС «ОС-2006», разработанному и утвержденному в НИИ ДОГ. Соотношение пациентов по полу составило 1,03:1 (мальчиков –125 , девочек –121). Всего проведено 1137 курса ВД Mtx. Анализ зависимости частоты ОС от возраста показал, что основной пик заболеваемости приходился на возраст 13-15 лет (n=119, 48,4%). Наименьшая частота заболеваемости детей в возрасте до 7 лет составила 3,2% (n=8), а в возрасте старше 15 лет — 7,7% (n=19) (см. табл.2). Таблица 2 Распределение детей по возрастным группам Возраст (лет) 5-7 7-9 9-11 11-13 13-15 Старше 15(15-17) Всего Абсолютное и относительное количество детей n % 8 14 27 59 119 19 246 3,2 5,8 11,0 23,9 48,4 7,7 100,0 Больным было проведено от 1 до 8 курсов ВД Mtx, в дозе 8 или 12 г/м2. Средняя доза Mtx составила 18,96±5,2 г, вводимых за 4 часа инфузии на фоне щелочной прегидратации. Лейковорин назначался внутривенно, 43 через каждые 6 часов, начиная с 24 часа от начала инфузии Mtx. При замедленном выведении Mtx лейковорин вводят по формуле: лейковорин (мг)= [Mtx]*Вес пациента (кг). 2.2. Схема проведения химиотерапии больным остеосаркомой В исследованной применением ВД Mtx, группе больных во избежание усиления терапевтического эффекта, проводилось лечение с опухолевой резистентности и лейковорин применялся для снятия токсичности от ВД Mtx. Рис.7. Протокол лечения остеосаркомы у детей (ОС-2006) Протокол лечения остеосаркомы (ОС-2006) (см.рис.7), разработанный в НИИ ДОГ ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН включал: 1 этап - 4 курса неоадъювантной полихимиотерапии (ПХТ): 44 Блок А: цисплатин 50 мг/м2 1; 2 дни; адриамицин 45 мг/м2 3,4 дни. Блок В: Mtx 12 гр/м2 1- 8 дни; лейковорин 15 мг/м2 12 введений; ифосфамид 3 гр/м2 15-17 дни; этопозид 150 мг/м2 15-17 дни. Блок С: Mtx 12 гр/м2 1- 8 дни; лейковорин 15 мг/м2 12 введений; цисплатин 50 мг/м2 15,16 дни; адриамицин 45 мг/м2 17,18 дни). Блок D: цисплатин 50 мг/м2 1,2 дни; ифосфамид 3 гр/м2 3-5 дни. 2 этап - Хирургическое лечение 3 этап - 5 адъювантных курсов ПХТ. В послеоперационном периоде стратегия проведения курсов ПХТ зависела от степени лечебного патоморфоза удаленной опухоли. До получения гистологического заключения проводился курс ПХТ по схеме: Блок Е (ифосфамид 3 гр/м2 1-3 дни; этопозид 150 мг/м2 1-3 дни). После получения гистологического диагноза проводилось: А - При I-II степени лечебного патоморфоза 4 блока ПХТ по схеме: этопозид 100 мг/м2 1-5 дни; циклофосфамид 400 мг/м2 в день 1-5 дни; карбоплатин 500 мг/м2 в день; В - При III-IV степени лечебного патоморфоза проводилась ПХТ по следующей схеме: Блок АА Mtx 8 гр/м2 1,8 дни; лейковорин 15 мг/м2 12 введений; цисплатин 50 мг/м2 15,16 дни; адриамицин 45 мг/м2 17,18 дни. Блок ВВ ифосфамид 3 гр/м2 1-3 дни; этопозид 150 мг/м2 1-3 дни). Блок СС Mtx 8 гр/м2 1-8 дни; лейковорин 15 мг/м2 12 введений; ифосфамид 3 гр/м2 15-17 дни; этопозид 150 мг/м2 15-17 дни. Блок DD цисплатин 50 мг/м2 1,2 дни; ифосфамид 3 гр/м2 3-5 дни. Лейковорин назначается внутривенно, струйно 15мг/м2 через каждые 6 часов, начиная с 24 часа от начала инфузии Mtx до его полного выведения. При замедленном выведении Mtx и проявления его токсичности дозу лейковорина повышают, рассчитывая ее по формуле: лейковорин (мг)= [Mtx]*Вес пациента (кг) (1). 45 2.3. Терапевтический лекарственный мониторинг метотрексата Ключевые часы определения Mtx при лечении ОС и оптимальный диапазом концентрация представлены на рис.8. Рис.8. Схема проведения ТЛМ Mtx согласно протоколу ОС-2006 Кровь из вены забиралась на 0; 4; 24; 42; 48; 72 и далее до полного выведения Mtx, в вакуумные пробирки марки Sarstedt, тип «monovette®» объемом 7,5 мл. В случаях осложненного выведения Mtx кровь забиралась чаще. В качестве нормального выведения были концентрации на ключевых часах ТЛМ Mtx: на приняты следующие 4 час - менее 1800 мкмоль/л; на 24 час - менее 10 мкмоль/л; на 42 час - менее 1,0 мкмоль/л; на 48 час - менее 0,25 мкмоль/л; на 72 час – менее 0,05 мкмоль/л; на 96 час - менее 0,02 мкмоль/л [26 ]. Кровь центрифугировали в течение 10 мин при 3000 оборотах на центрифуге Elmi CM 6M. ТЛМ Mtx проводили методом флуоресцентнополяризацонного имунно-анализа (ФПИА) на анализаторе TdxFlx («Abbott», США). ФПИА - гомогенный конкурентный метод иммунного анализа, основанный на двух принципах: конкурентного связывания белков и флуоресцентной поляризации. 46 Набор состоял из пакета реагентов, 0,1 М фосфатного буфера (рН=7,4) для анализа с добавлением бычьего γ- глобулина (1 г/л) и азида натрия (1 г/л), а также стандартных растворов Mtx. Для проведения этого анализа используется метка – флуоресцеин, который поглощает голубой свет и флуоресцирует зеленым в возбу- жденном состоянии примерно в течение 4 наносекунд (4.10-9 сек). Пакет реагентов включал в себя четыре маркированных флакона - W, S, T, Р реактивы. Реактив W - моющий раствор и растворитель (4,0 мл); S раствор моноклональных мышиных антител к Mtx, процентное содержание которых не превышает 0,01%, буфера и стабилизатора белка (4,0 мл); T флуоресцирующая метка, буфер и стабилизатор белков (3,5 мл); P - буфер и белковый стабилизатор (3,5 мл). Калибровка проводилась по 6 точкам (рис. 9), по оси абсцисс – концентрация Mtx, мкмоль/л; по оси ординат – значения поляризации, мП. 200 194,39 180,92 160 154,89 119,23 120 Р 80 63,86 40 0 -2,22E-16 33,52 0,2 0,4 0,6 0,8 1 1,2 мкМ/л Рис.9. Калибровочная кривая метотрексата в методе ФПИА. Для определения концентрации Mtx и 7-ОН-Mtx использовалась ВЭЖХ, проведенная по следующей методике. Пробоподготовка: 47 В пробирку типа моновет с активатором свертывания отбирали кровь у пациента. Центрифугировали в течение 10 мин при 3000 об/мин, центрифуга Elmi CM 6M. В стеклянные пробирки на 3 мл отбирали 400 мкл сыворотки крови, которую осаждали двумя объемами ацетонитрила (800 мкл). Пробирки закрывали и интенсивно встряхивали на вортексе 30 секунд, затем центрифугировали (3 мин, 3000 об/мин, центрифуга Elmi CM 6M). Надосадочную жидкость переливали и добавляли к ней четыре объёма хлороформа (1,6 мл). Пробирки закрывали и 30 секунд интенсивно встряхивали на вортексе, затем центрифугировали (8 мин, 3000 об/мин, центрифуга Eppendorf 5702R с охлаждением). Одновременное охлаждение при центрифугировании позволяло обеспечить большую чистоту образцов. Для хроматографии отбирали 100 мкл супернатанта. Условия хроматографии: определение Mtx проводилось на хроматографе Hewlett-Packard (HP) 1050; хроматографе Metrhom, УФ-детектор HP с переменной длиной волны; интегратор HP 3396 А. Для хроматографии использовалась колонка Hipersil ODSC18 5 мкм, 200 х 4,6 мм. Температура колонки 40 0С, длина волны детекции 302 нм. Подвижная фаза состояла из смеси фосфатного буфера, ацетонитрила и 0,1 % раствора трифторуксусной кислоты. Для выполнения анализа использовались следующие реагенты: натрия дигидрофосфат и ацетонитрил фирмы Merk (Германия), трифторуксусная кислота, а также стандарт Mtx с содержанием примесей 0,4 %, фирмы «Sigma» (США). Приготовление подвижной фазы: к 450 мл 0,05 М раствора NaH2PO4 добавляют 65 мл ацетонитрила и 0,5 мл трифторуксусной кислоты. Длина петли 20 мкл. Скорость потока 1,2 мл/мин. Специфичность метода была подтверждена при анализе шести образцов плазмы взятых у здоровых доноров (рис.10). Хроматограммы этих чистых образцов плазмы сравнили с хроматограммами, полученными после добавления к этим образцам стандарта Mtx (рис. 11), для того чтобы 48 удостоверится, что эндогенные вещества не дают перекрестной реакции с интересующим аналитом. Рис. 10. Сыворотка крови без Mtx Время удерживания стандартного раствора Mtx в сыворотке крови 5,41 +/- 0,25 минут (рис. 11). Рис. 11. Стандарт Mtx 49 Рис. 12. Лейковорин, метотрексат, 7-ОН-Метотрексат в сыворотке крови пациента Т.Н. на 24 ч терапии ВД Mtx Фактор симметрии стандартного раствора Mtx составил 1,07. Эффективность колонки и очевидное число теоретических тарелок составило 44 344. Оценка воспроизводимости проводилась на высокой (2500 нг/мл) и низкой (27,5 нг/мл) концентрациях; выражалась как процент стандартного отклонения последовательной серии измерений референсного раствора и составила 2,77 и 17,11 %, соответственно. Экстракция Mtx из сыворотки крови составила 85 %. Концентрация Mtx определялась методом абсолютной калибровки. Стандартные растворы готовили следующим образом: точную навеску (1,85 мг) Mtx стандарта растворили в 4,0 мл подвижной фазы, из полученного стандартного раствора приготовили 6 калибровочных концентраций, путем добавления различных объёмов стандартного раствора к 400 мкл чистой сыворотки. Концентрации растворов Mtx для построения калибровочной кривой были следующие: C1 = 2965,4; C2 = 1584,25; C3 = 660,86C4 = 257; C5 = 50 136,1; C6 = 25,7 нг/мл. Затем строили калибровочную кривую зависимости площади пика от концентрации Mtx (рис.13). Образцы для построения калибровочной кривой и анализируемые образцы сыворотки крови больных обрабатывались идентично. Площадь пика мкг/мл Рис. 13. Калибровочная кривая Mtx. Угол наклона калибровочной кривой составил 794,34 В связи с недоступностью коммерческого образца метаболита Mtx (7-OH-Mtx) его концентрацию определяли по калибровочной кривой Mtx, считая коэффициент мольного поглощения равным 1,0, по отношению к Mtx. Идентификация метаболита 7-OH-Mtx проводилась по литературным данным, согласно порядку выхода соединений (1 – Mtx, 2 – 7-OH-Mtx) в работах реализующих аналогичный обратно-фазный метод определения [ ] Все больные получали лейковорин, который не мешал определению Mtx. 2.5. Определение биохимических показателей крови при высокодозной химиотерапии остеосаркомы у детей Для мониторинга биохимических показателей кровь из вены забиралась в соответствии с протоколом ОС-2006 на 0; 24; 42; 48; 72 и далее до полного выведения Mtx, в вакуумные пробирки марки Sarstedt, тип 51 «monovette®» объемом 7,5 мл. Кровь центрифугировали в течение 10 мин при 3000 оборотах на центрифуге Elmi CM 6M. Определение гомоцистеина Определение Hcy проводили на 0; 4; 24; 42; 48; 72, 96 ч от начала введения Mtx на анализаторе VITROS 5.1 FS («OrthoclinicalDiagnostics», США). Количественное определение Hcy выполняют с помощью регента « Гомоцистеин VITROS Кемистри Продактс» в комплексе с «VITROS Кемистри Продактс» набором калибраторов на анализаторе VITROS 5.1 FS. «Гомоцистеин VITROS Кемистри Продактс» реагент для определения Hcy представляет собой двухкамерную упаковку, содержащую жидкие реагенты готовые к использованию. Молекулы Hcy, связанные дисульфидной связью (окисленная форма) гидрохлоридом с восстанавливаются образованием трис-(2-карбоксиэтил)-фосфин восстановленной формы Hcy. Восстановленный гомоцистеин реагирует с серином в присутствии цистоционин β-синтазы с образованием L-цистоционина. L-цистоционин реагирует с цистоционин-β-лиазой с образованием гомоцистеина, пирувата и аммиака. Пируват восстанавливается с участием ЛДГ и НАДН в качестве кофермента. Концентрация Hcy прямо пропорциональна количеству НАДН, превращенного в НАД+, и измеряется спектрофотометрическим методом при 340 нм. После калибровки каждой серии реагента, концентрацию Hcy в каждом неизвестном образце определяют, используя сохраненную калибровочную кривую значений оптической плотности, полученных во время количественного определения образца. 52 Таблица 3 Значения биохимических показателей сыворотки крови у детей контрольной группы (n = 30) Биохимические показатели Билирубин (мкмоль/л) АЛТ (ед/л) АСТ (ед/л) ЛДГ ед/л) ЩФ (ед/л) γ - ГТ (ед/л) гомоцистеин Креатинин (мкмоль/л) Мочевина (мкмоль/л) Средние значения в контрольной группе 6,8 1,0 23,3 4,2 28,8 1,8 490 25 663 52 11,8 1,3 5,6 1,7 56,2 12,1 2,1 1,2 Референтные значения лаборатории 3,4-17,1 <40 <38 226-451 <645 <50 4,7-6,2 27 - 105 1,7 – 7,5 Определение биохимических показателей (АЛТ, АСТ, ЛДГ, общий билирубин, ЩФ, ГГТ) проводили на автоматическом анализаторе Pentra 400 («Horiba ABX», Франция) с диапазоном длин волн от 190 нм до 1100 нм. В качестве биохимических критериев нарушения функции печени использовали пороговые значения АЛТ, АСТ, ЛДГ, Г-ГТ, общего билирубина, креатинина, мочевины, установленные нами в контрольной группе практически здоровых детей (см. табл.3). 2.6. Статистическая обработка результатов Для статистической обработки результатов исследования были использованы процедуры математической статистики, реализованные в программе SPSS 11.0 forWindows, MedCalc 12, Origin 6.1, MSExcel 2007. Расчет фармакокинетических параметров (площадь под кривой, клиренс Mtx) проводился с помощью программы MedCalc 11.6.10. 53 Определение кинетических параметров восстановления показателей гепатотоксичности осуществляли в программе «Origin 40». Уравнение прямой вида y=a-bx (lnC=lnC0-kt) сопровождалось указанием значений коэффициентов a и b. Это не требовало дополнительных расчетов константы скорости (k=-b). 54 ГЛАВА 3. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ 3.1. Количественная оценка токсикокинетики терапии высокими дозами метотрексата Метотрексат относится к группе антиметаболитов – антагонистов фолиевой кислоты. В дозах менее 20 мг/м2 быстро всасывается с помощью транспортной системы, с максимальной концентрацией 0,3-2,2 ммоль/л, и периодом полувыведения 4-6 часов, основная часть выведения приходится на почечную экскрецию. Высокие дозы Mtx, более 1,0 г/м2, применяемые под защитой лейковорина, позволяют обойти возникающую резистентность к лечению. Как для низких, так и для высоких доз Mtx характерна высокая вариабельность фармакокинетики. При терапии больных ОС ВД Mtx (8; 12 г/м2) происходит изменение фармакокинетических и фармакодинамических показателей. При получении ВД Mtx больными детьми ОС было выявлено нормальное и замедленное выведение Mtx. Полученные результаты представлены в таблице 4. Как следует из таблицы 4, при нормальном выведении Mtx концентрация на ключевых часах ТЛМ не превышала принятых в литературе [16]. В качестве нормального выведения были получены и приняты следующие концентрации на ключевых часах ТЛМ Mtx: на 4 час - менее 1800 мкмоль/л; на 24 час - менее 10 мкмоль/л; на 42 час - менее 1,0 мкмоль/л; на 48 час - менее 0,25 мкмоль/л; на 72 час – менее 0,05 мкмоль/л; на 96 час - менее 0,02 мкмоль/л. Общее время выведения Mtx составило 96±24 ч. Период полувыведения (t ½) 7,7±0,7 ч. Площадь под фармакокинетической кривой Mtx (MtxAUC) - 11791±500 мкмоль/л*-1*ч-1. Mtx AUC характеризует общее количество воздействовавшего на организм препарата и время контакта с ним. Клиренс Mtx (CLmtx) – скорость очищения организма от препарата, при нормальном выведении составил 3,7±1,3 л*ч-1. 55 Таблица 4. Фармакокинетические характеристики Mtx при применении его в ВД для лечения ОС у детей Параметр Доза Площадь поверхности тела Общая средняя доза Концентрация 4 час метотексата в 24 час крови 42 час 48 час 72 час 96 час Общее время выведения Ttotal Площадь под кривой ( мtx AUC) Клиренс Mtx (CLmtx) Период полувыведения (t ½) Размерность Нормальное выведение 2 г/м 8; 12 2 М 1,58±0,21 г 18,96±5,2 мкмоль/л 1109±283 мкмоль/л 4,67±0,95 мкмоль/л 0,38± 0,16 мкмоль/л 0,23±0,04 мкмоль/л 0,07±0,03 мкмоль/л 0,03± 0,01 ч 96±24 Замедленное выведение 8; 12 1,57±0,22 19,96±6,2 1830±450 61,2±53,6 15,3±14,3 7,2±5,7 4,3 ±4,1 4,3±4,2 208±120 мкмоль/л1*ч-1 л*ч-1 ч 11791±500 16611±10231 3,7±1,3 7,7±0,7 2,5±1,5 11,5±10,7 Рис. 14. Кривая нормального выведения Mtx Нормальное выведение Mtx характеризуется тем, что после достижения максимальной концентрации на 4 час подчиняется экспоненциальной зависимости и может быть описано уравнением вида 56 С=Сmaxе-kt (где Сmax –максимальная концентрация вещества, k – константа элиминации вещества, t – время от начала введения) (см. рис. 14). Для наглядности и удобства воспроизведения от максимальных концентраций до минимальных ось ординат на графиках представлена в виде логарифмической шкалы (рис.15). Тип нормальной фармакокинетики наблюдался при 1050 курсах выведения ВД Mtx. Рис.15. Кривая нормального выведения Mtx – ось ординат в виде логарифмической шкалы Пациентам было проведено от 1 до 8 курсов ВД Mtx. В табл.5 представлены изменения концентрации Mtx у пациентов с ОС на различных курсах проведения высокодозного лечения. Как следует из таблицы, особенных различий в концентрации Mtx по часам на различных курсах проведения высокодозного лечения не выявлено, но наблюдалась тенденция уменьшения концентрации Mtx на ключевых часах от курса к курсу. Заслуживают внимания различия между первым и восьмым курсами ВД Mtx. Получена статистически достоверная разница в концентрации Mtx на 4 час от начала введения Mtx. 57 Таблица 5 Номер курса Концентрация Mtx в зависимости от курса терапии ВД Mtx у больных с нормальным выведением Mtx Час от начала введения Mtx 4ч 24 ч 42 ч 48 ч 72 ч 96 ч Концентрация Mtx в сыворотке крови, мкмоль/л 1340,44 4,53 0,45 0,27 0,06 0,02 1 ±230,3 ±0,46 ±0,11 ±0,01 ±0,01 ±0,003 1230,22 5,26 0,52 0,29 0,07 0,03 2 ±130,4 ±0,16 ±0,01 ±0,02 ±0,01 ±0,006 1331,44 4,96 0,50 0,26 0,09± 0,03± 3 ±323,66 ±1,07 ±0,11 ±0,03 0,01 0,006 1290,21 4,57 0,31 0,24 0,06± 0,02 4 ±450,11 ±0,45 ±0,03 ±0,04 0,002 ±0,002 990,01 3,24 0,27 0,21 0,07 0,03 5 ±170,21 ±0,10 ±0,03 ±0,04 ±0,018 ±0,001 1040,12 3,66 0,24 0,14 0,04± 0,02 6 ±412,06 ±0,03 ±0,01 ±0,01 0,008 ±0,002 880,11 4,17 0,23 0,15 0,04± 0,02 7 ±300,18 ±0,35 ±0,02 ±0,01 0,003 ±0,002 770,12 3,36 0,53 0,11 0,02± 0,01 8 ±258,22* ±0,21 ±0,10 ±0,02 0,003 ±0,003 * - статистическая достоверность между 1 и 8 курсами ВД Mtx (P<0,05) Таблица 6 Значения площади под фармакокинетической кривой ТЛМ ВД Mtx Площадь под кривой Р<0,05 с 1м курсом Номер курса ТЛМ ВД метотрексата 1 2 3 4 5 6 7 8 12891 ±523 - 11639 ±617 0,025 11595 ±568 0,006 11789 ±612 0,06 11692 ±610 0,002 12781 ±534 0,003 11989 ±470 0,043 12678 ±497 0,004 При подсчете площади под фармакокинетической кривой (MtxAUC) на разных курсах ВД Mtx при нормальном выведении Mtx статистически достоверной разницы также не было отмечено между курсами (p=0,051), но наблюдались статистически достоверные (р<0,05) различия всех курсов с первым курсом (см. табл. 6). Вторую группу пациентов представляли пациенты с замедленным выведением Mtx (табл.4), где было отмечено повышение концентрации 58 Mtx в среднем на каждом из определяемых часов, увеличение Ttotal до 360 часов, период полувыведения составил в среднем 11,5±10,7 и 16611±10231, Mtx AUC - а также снижение CLmtx по сравнению с нормальным выведением 2,5±1,5. Замедленное выведение выявлено при 87 курсах ВД Mtx, что составило 7,6% от всех исследуемых курсов ВД Mtx. По всем измеряемым параметрам: концентрации выведения Mtx по часам выведения, Ttotal, периоду полувыведения (t½), Mtx AUC, CLmtx, - получены статистически достоверные различия между нормальным и замедленным выведением Mtx. Как следует из таблицы 4, при замедленном выведении Mtx получен большой количественный разброс необходимость их систематизации. показателей, поэтому Все пациенты с измененным, замедленным выведением Mtx были условно разделены подгруппы, в которых были возникла посчитаны все нами на 3 вышеназванные фармакокинетические показатели. В 1 подгруппу (табл. 7) отнесены задержки выведения Mtx у пациентов, описываемые в литературе словом «жесткие», острые. Они характеризуются быстро нарастающей концентрацией Mtx, начиная с 4 часа инфузии. Происходят коренные изменения в фармакокинетике Mtx – она перестает подчиняться уравнению первого порядка; характерны резкие увеличения концентрации Mtx и затем фактически отсутствие выведения Mtx в течение длительного времени, что графически выражается как возникновение дополнительных пиков и плато (см. рис. 16-19). Они характеризуются быстро нарастающей гепатотоксичностью и развитием острой почечной недостаточности. Общее время выведения составляло в среднем 360 часов, t1/2 23,0±7,1 ч, 1,2±0,4 л*ч-1, . Mtx AUC 27231±6214 мкмоль/л-1*ч-1 , Сlmtx 59 Таблица 7 Фармакокинетические характеристики подгрупп замедленного выведения метотрексата метотрексата в крови, мкмоль/л Концентрация Параметр Подгруппа 1 Подгруппа 2 Подгруппа Нормальн. 3 выведение 4ч 1730±260 1500±340 1360±312 1300±210 24 ч 430±230 36,3±5,1 6,63±4,5 4,67±0,95 42 ч 260,0±100,2 10,0±6,7 0,58±0,34 0,38± 0,16 48 ч 70,0±10,1 1,26±0,6 0,44±0,07 0,23±0,04 72 ч 14,1±2,0 0,42±0,05 0,15±0,05 0,07±0,03 96 ч 7,1±4,2 0,25±0,02 0,06±0,04 0,03±0,01 120 ч 0,45±0,25 0,16±0,01 0,03±0,01 - 144 ч 0,24±0,11 0,11±0,01 0,02±0,02 - 192 ч 0,14±0,10 0,06±0,01 - - 240 ч 0,04±0,02 0,03±0,01 - - 360 ч 0,02±0,01 0,01±0,01 - - AUC, мкмоль/л-1*ч-1 27231±6214* 15695±275* 13908±311* 1,2±0,4* 2,5±0,2* 3,0±0,2 Clmtx , л*м-2*ч-1 360 360 144 Общее время выведения Ttotal , ч 23,0±7,1* 10,8±2,7 9,6±2,1 t ½, ч * - статистически достоверные результаты 11791±500 3,7±0,3 96±24 7,7±1,5 За время нашего наблюдения было 4 подобных случая – 0,35% от общего число курсов: в 2 из них для спасения пациента потребовалось применение гемофильтрации. Данный вид замедленного выведения может быть связан с генетическими особенностями организма. Если бы патология выведения не была выявлена, а лечение не назначено своевременно, весьма вероятно, что эти случаи были бы смертельными. Учитывая важность и редкость этого явления, приводим все наблюдаемые нами случаи острых задержек выведения Mtx. У пациентки М.Е. на 5 курсе ВД Mtx значение Mtx на 24 час составляло 12,7 мкмоль/л при норме 10 мкмоль/л, к 42 часу достигло 0,2 мкмоль/л, однако, к 48 часу начало резко возрастать (см. рис.16) и к 60 60 часу мониторинга концентрация Mtx достигла уже 21 мкмоль/л. Были применены срочные меры по коррекции дозы лейковорина, введению альбумина и т.п. В итоге, с нарушенной фармакокинетикой Mtx удалось справиться. Причем, общее время выведения составило 337 часов и сопровождалось нефротоксичностью и гепатотоксичностью IV степени. Девочка удачно справилась с таким замедленным выведением Mtx без применения гемодиализа, обошлись только многократным увеличением дозы лейковорина, альбумина, гидратации и лазикса. Причиной развития нарущения элиминации Mtx cтал отек инфекционного генеза, и произошло, соответственно, перераспределение Mtx из центральной в периферическую камеру. Эта ситуация наглядно доказывает необходимость ТЛМ на всех ключевых часах ВД Mtx, т.к. нарушение элиминации Mtx развилась уже после того, как на 24 и 42 часы были получены укладывающиеся в норму значения. Рис.16. Кинетическая кривая выведения Mtx из циркулирующей крови у больной М.Е., осложненного отеком инфекционного генеза. 61 У пациентки М.Л, несмотря на гидратацию и алкализацию с исходно нормальной функцией печени и почек с первых суток после введения Mtx отмечалась почечная и печеночная токсичность. Концентрация Mtx в сыворотке крови через 24 часа после начала введения составила 37 мкмоль/л, у больной отмечалось потемнение в глазах, головокружение, повышение температуры тела до 380 С, рвота до 5 раз, имелись явления стоматита. Назначение гептрала, гордокса привело к снижению концентрации аминотрансфераз и ЛДГ в циркулирующей крови. Несмотря на гиперинфузию в сыворотке крови нарастала концентрация креатинина и мочевины, и ко вторым суткам составляли 183 мкмоль/л и 13,9 ммоль/л соответственно. Снижению этих показателей и концентрации Mtx в сыворотке крови способствовало назначение гипергидратации, форсированного диуреза, назначение лейковорина в дозе 500 мг 8 раз в сутки и альбумина 20 %. При этом снижение уровня Mtx в сыворотке крови до 0,01 мкмоль/л удалось добиться лишь на 480 ч от введения Mtx (см. рис.17). Этиология этого случая нарушения выведения Mtx неизвестна. Рис.17. Кинетическая кривая выведения Mtx из циркулирующей крови у больной М.Л. 62 За время наблюдения было два случая, когда для спасения пациента понадобилось проведение гемофильтрации. У пациента А.В. на первом курсе ВД Mtx с 24 по 32 час уровень Mtx возрос с 430 мкмоль/л до 710 мкмоль/л, что в десятки раз превышает норму (см. рис 18А). Химиотерапевтическое лечение: метотрексат 12г/м2 (РД=16гр). После введения первого блока отмечалось замедленное выведение метотрексата. Mtx 24 час – 430 мкмоль/л., решено провести гемофильтрацию до снижения концентрации метотрексата менее 1 мкмоль/л на фоне инфузионной терапии 4.5л/м2, введением лейковорина исходя из формулы: концентрация Mtx * массу тела каждые 6 часов, антибиотики, гепатопротекторы, трансфузии препаратов крови. Проведено 6 сеансов гемофильтрации. Mtx 48 час – 70 мкмоль/л, 72 час – 14 мкмоль/л, 312 час – 0,04 мкмоль/л. Мукозида, стоматита не отмечалось. Курс перенес на фоне гематологической токсичности III степени, гепатотоксичности IV степени (АЛТ max 2100 Ед/л, АСТ 1720 Ед/л, ЛДГ 6280 Ед/л). У больного развилась острая почечная недостаточность (на 24 час концентрация мочевины составила - 7,1 ммоль/л, креатинина - 207,2 мкмоль/л). Примечательно, что клинических проявлений у мальчика не отмечалось никаких метотрексатовой токсичности, нарушение элиминации проходило бессимптомно – за первые 24 часа после введения Mtx не было отмечено ни боли, ни рвоты, ни неврологических нарушений. В данной ситуации для выведения Mtx потребовалось 6 курсов гемофильтрации, и в результате время выведения составило 350 часов (см.рис.18Б). Несмотря на тяжелые осложнения, у пациента развился лекарственный патомофоз III степени. Впоследствии ему была проведена органосохраняющая операция. Этиология развития «задержки выведения Mtx» в данном случае осталась неизвестной – несовместимых лекарственных средств, инфекций и отеков, нарушений введения препарата у пациента не было. Весьма вероятна генетическая патология в связи с этническими особенностями пациента, однако она не была установлена. 63 А Б Рис. 18. Кинетическая кривая выведения Mtx из циркулирующей крови у больного А.В. с 24 по 74 час (А); с 4 часа до полного выведения Mtx, представлена в логарифмических координатах (Б) В феврале 2013 года у пациентки М.Э., 13 лет, также при первом курсе ВД Mtx, на 24 ч определяемая в крови концентрация Mtx соответствовала 200 мкмоль/л, что сопровождалось острой почечной токсичностью. Концентрация мочевины в крови за сутки выросла с 3,5 ммоль/л до 5,59 ммоль/л, а креатинина – с 70 мкмоль/л до 109 мкмоль/л. Для спасения пациентки понадобилось проведение 6 курсов гемофильтрации. Mtx 35 ч – 130 мкмоль/л, 42 ч – 60 мкмоль/л, 48 – 29 64 мкмоль/л, 72 ч - 8,7 мкмоль/л, 294 ч – 0,01 мкмоль/л. У пациентки, в отличие от других пациентов из этой группы, не возникало резких волнообразных изменений концентрации ВД Mtx, однако увеличение концентрации Mtx после более низких значений было выявлено несколько раз (см. рис.19). Отсутствие явных колебаний концентрации Mtx связано со своевременно назначенной гемофильтрацией, однако факт увеличения концентрации после указанной терапевтической процедуры доказывает факт выхода Mtx из тканей в центральную камеру . За центральную камеру чаще всего принимают плазму крови. Центральная камера единственная из теоретических токсикокинетичех камер, это доступная для процедур усиления элиминации – в данном случае гемофильтрации. Рис. 19. Кинетическая кривая циркулирующей крови у больной М. Э. Эффективность выведения ЛП из выведения организма Mtx зависит из от физикохимических свойств ЛП, количества его в крови и скорости выхода из периферических отделов тела. Если скорость выхода из периферических камер медленнее по сравнению с клиренсом из центральной камеры с усиленным выведением, то после того, как воздействие (в данном случае 65 гемофильтрация) прекращается, перераспределение будет продолжаться до тех пор, пока не будет достигнуто равновесие между камерами. При этом наблюдается «возврат» перераспределяется, в концентрации когда гемодиализ ЛП в плазме, она прекращается и даже может увеличиваться, что объясняется выходом ЛП из тканей (периферичеких камер) в плазму (центральную камеру). Именно такая ситуация была выявлена у пациентки. После завершения курса гемофильтарции концентрации Mtx снизилась со 180 мкмоль/л до 100 мкмоль/л ( с 30 по 36 час ТЛМ Mtx), однако затем без проведения гемофильтрации концентрации Mtx изменялась очень медленно. На 72 часу, после завершения 4 курса гемофильрации на 66 час ТЛМ Mtx и достижения концентрации Mtx 7,0 мкмоль/л, концентрация Mtx и вовсе увеличиалсь до 8,7 мкмоль/л. Во 2 подгруппу замедленного выведения Mtx (табл.7) были отнесены курсы ВД Mtx, где на всех концентрации Mtx выше, чем для группы ключевых часах значение нормы (p=0,035), однако фармакокинетическая кривая выведения Mtx соответствует экспоненте. Рис.20. Выведение Mtx у пациентов со сниженой элиминацией Mtx (подгруппа 2) 66 Общее время выведения Mtx увеличено до 240±24 ч, т.е на 96±24 ч больше нормального выведения (см. рис.20), t ½ 10,8±2,7 ч, Mtx AUC 15695±275 мкмоль/л-1*ч-1, Clmtx 2,5±0,2 л*ч-1. В их число вошли 23 курса ВД Mtx, всего 2% от общего числа курсов. Для этих пациентов характерно развитие сильной гепатотоксичности; не характеризуется острой почечной токсичностью и не требует гемодиализа или других мер срочной детоксикации Mtx, достаточна только коррекция дозы лейковорина по формуле: лейковорин (мг)= [Mtx]*вес пациента (кг). Чаще всего данный тип нарушений развивался у одних и тех же пациентов на 2 и 3 курсе терапии (p=0,08). Развитие данной ситуации на 1 курсе ВД Mtx не является показанием к отмене дальнейшей терапии, однако она должна проводиться с большой осторожностью. Требуется установление причин развития нарушения выведения Mtx (воспаление, отеки, инфекции и т.п.) К 3 подгруппе замедленного выведения Mtx (табл. 7) отнесены пациенты, у которых наблюдались повышения концентрации Mtx на какойто из часов ТЛМ относительно стандартных для мониторинга значений. Таких выделили 60 курсов, что составляет 5,2% от всех изученных курсов ВД Mtx. Рис.21. Кривая выведения Mtx для пациента, отнесенного к 3 подгруппе 67 Для них характерна следующая картина - на какой-то из часов ТЛМ концентрация Mtx укладывается в принятые в протоколе значения, в то время, как все остальные выше (см.рис.21). Время выведения также увеличено – 144±24 ч, t½ 9,6±2,1 ч, Mtx AUC 13908±311мкмоль/л-1*ч-1, Clmtx 3,0±0,2 л*ч-1. Причиной данных нарушений выведения Mtx могут быть некоторые отклонения процедуры проведения гидратации и защелачивания мочи, что несет значительную опасность для почечной функции. Среди этого типа задержек выведения Mtx у 35,1% курсов наблюдается повышение концентрации Mtx на 24 час, и только у 7,54% - на 42 час. По 38,7% занимают задержки выведения Mtx на 48 и 72 час. Полное выведение Mtx во время таких курсов требует в среднем 144±24 ч. Также среди этих задержек выведения Mtx 18,7% занимают те, у которых повышение концентрации Mtx наблюдается только на какой-то одной ключевой точке мониторинга. В основном это 24 часы, но существуют единичные случаи и для 48 и 72 часа. Четко выраженной картины, на каких именно ключевых точках или группах ключевых точек обнаруживаются задержки выведения Mtx, установить не удалось. Чаще всего это 24, 48,72, и 48,72,96, но это объясняется временем возникновения задержки выведения Mtx и лечебной реакцией на нее. Между всеми подгруппами замедленного выведения относительно нормального выведения Mtx, а также подгрупп замедленного выведения относительно друг друга, определена статистически достоверная разница (см. табл.8). Наиболее значима разница с 1-ой подгруппой. 68 Таблица 8 Статистическая достоверность по концентрации Mtx на ключевых часах между нормальным и замедленным выведением в подгруппах, а также между подгруппами. Статистическая достоверность между группами (P<0,05) Достоверность (р) между нормальным выведением и подгруппой: Достоверность (р) между подгруппами: Час ТЛМ Mtx от начала введения №1 №2 4 0,003 0,005 24 0,001 0,003 42 0,003 0,006 48 0,006 0,008 72 0,003 0,004 96 0,004 0,006 №3 1и2 1и3 2и3 0,021 0,001 0,002 0,004 0,031 0,003 0,003 0,003 0,034 0,006 0,001 0,001 0,027 0,008 0,002 0,002 0,035 0,004 0,002 0,002 0,021 0,006 0,002 0,002 Рассчитанные значения Mtx AUC характеризуют как степень фармакологического эффекта, так и степень токсичности, возрастающие пропорционально друг другу (см. табл.7). У 1 подгруппы замедленного выведения Mtx AUC возрастает в 2-4 раза относительно нормального выведения, в 1,5 раза – во второй подгруппе задержек, и в 1,2 – в третьей, что говорит о том, что даже самое незначительное нарушение выведения Mtx оказывает токсический эффект. Различия по сравнению с нормальным выведением Mtx статистически достоверны во всех 3-х подгруппах. Для 1 подгруппы замедленного выведения Mtx Mtx AUC сильно различалась – в случае с пациентом А.В., она составила 43881 мкмоль/л*l1 *ч, а для пациента М.Е. – «всего» 16331 мкмоль/л, что примерно равно Mtx AUC для подгруппы 2. Полученные значения AUC позволили рассчитать клиренс Mtx (СlMtx.). В 3 подгруппе CLMtx снижен в 1,2 раза, во 2 – в 1,5 раз, а в 1 – в 3 раза, однако следует учитывать, что для лечения пациентов 1 подгруппы применялась гемофильтрация, а значит, CLMtx бы еще ниже. С помощью СlMtx можно вычислить t1/2, характеризующий время, за которое концентрация вещества в плазме должна снизится вдвое (см. формулу (8). 69 В нашем иследовании для нормального выведения Mtx объем распеределения был равен Vd = 36,6 л Чем ниже ClMtx, тем сильнее увеличивается t1/2 - в 3; 1,5 и 1,2 раза относительно нормы для 1; 2; 3 подгрупп соответственно. Все три типа замедленного выведения Mtx чаще всего наблюдались у пациентов женского пола, коэффициент корреляции составил 0,75 (p=0,041). Часто связывают снижение элиминации Mtx с возрастом – как с младшим возрастом пациентов (до 6 лет), так и старшим (больше 16). Однако у нас такой зависимости не выявлено. Замедленно выведение Mtx у пациентов старшего возраста связано с изменением обмена Mtx у взрослых. Также не было выявлено взаимосвязи между стадией заболевания и развитием замедленного выведения Mtx (локализованная – 75%, диссеминированная – 35%, у 4 достоверно развились метастазы в легких уже после завершения лечения). Причины замедленного выведения Mtx – это прежде всего генетические нарушения, отклонения от процедуры ведения протокола, когда при высоком pH мочи Mtx может кристаллизоваться в почечных канальцах; отеки разной природы, инфекции, нарушения ферментной системы обмена фолатов и метаболизма Mtx. 3.2. Гомоцистеин – потенциальный маркер фармакодинамического эффекта метотрексата Для возможности оценки как степени эффективности подавления образования фолатов, так и степени фармакодинамический токсичности Mtx был предложен критерий – уровень содержания аминокислоты гомоцистеина (Hcy). Hcy не поступает в организм с пищей, являясь продуктом трансметилирования - в каскаде реакций он образуется из аминокислоты метионина (Met), а затем при участии тетрагидрофолата (THF) превращается обратно в метионин (см. рис. 6), образуя замкнутый цикл. 70 При ВД Mtx вводят в виде 4 часовой инфузии. Как следует из таблицы 10 концентрация сывороточного Hcy быстро возрастает за первые 4 часа Таблица 9 Концентрация гомоцистеина и метотрексата с 0 по 96 час ВД Mtx Конценрация, Мкмоль/л Hcy (нормальное выведение Mtx) Hcy (замедленное выведение Mtx) Час от начала введения метотрексата 0 4 24 42 48 5,4 9,5 15,6 11,6 8,8 ±1,5 ±3,2 ±5,5 ±3,4 ±3,2 72 5,9 ±1,3 96 4,7 ±1,3 6,7 ±2,5 8,3 ±2,1 7,1 ±1,2 10,2 ±4,4 16,1 ±3,8 20,5 ±4,1 15,4 ±3,2 терапии (в среднем с 5,4±2 мкмоль/л до 7,7±2,2 мкмоль/л). После окончания инфузии Mtx концентрация Hcy продолжает возрастать, в среднем к началу 24 часа достигая значения 9 мкмоль/л. На 24 час начинается введение антидота Mtx – лейковорина. Рис.22. Динамика изменения концентрации Hcy в крови пациентов при ВД Mtx. 71 Начиная с этого момента, концентрация Hcy начинает снижаться. К 42 часу она равна 6,6±3 мкмоль/л, к 48 – 5,7±2 мкмоль/л. К 72 часу концентрация Hcy достигает значений 4,9±1,2 мкмоль/л, т.е. становится ниже концентрации до начала терапии в среднем на 1,5 мкмоль/л (см. рис.22, см. табл.9). Коэффициент корреляции между концентрацией Mtx и Hcy составил r=0,87, p=0,0031. C каждым последующим курсом ВД Mtx у пациентов наблюдается точно такая же тенденция – концентрация Hcy быстро увеличивается до 24 часа, а затем снижается после введения лейковорина. При последовательном измерении Hcy на разных курсах ВД Mtx была выявлена особенность, что с каждым последующим курсом наблюдаемые пики становятся все менее выраженными. При этом каждый последующий курс ВД Mtx начинается с более низкого значения Hcy, чем предыдущий (см. табл.10). Причиной этого может быть снижение активности трансформации фолатов, активация альтернативных путей метаболизма Нcy, или их комбинация. Таблица 10 Концентрация Hcy на ключевых часах ТЛМ ВД Mtx в течение 8 курсов Час 1 2 3 4 0 час 6,4 ±2,1 11,9 ±2,2 19,1 ±4,3 14,1 ±2,4 11,2 ±3,2 8,3 ±1,2 5,7 ±0,6 5,5 ±2,2 11,1 ±3,1 17,5 ±3,4 13,1 ±2,3 10,3 ±3,1 7,4 ±2,5 4,7 ±0,7 4,7 ±1,6 9,5 ±2,1 16,2 ±4,2 11,6 ±2,1 8,8 ±4,2 5,9 ±1,4 3,5 ±0,6 2,7 ±1,1 7,5 ±2,2 13,6 ±3,1 9,6 ±2,1 6,8 ±2,2 3,9 ±0,8 1,5 ±0,6 4 час 24 час 42 час 48 час 72 час 96 час Номер курса 5 6 4,4 ±1,2 9,9 ±2,3 15,4 ±4,4 12,2 ±1,6 9,2 ±2,3 6,3 ±1,5 3,7 ±2,4 3,5 ±2,2 7,1 ±1,1 11,2 ±2,1 9,1 ±3,1 7,2 ±2,1 5,3 ±1,3 2,9 ±0,5 7 8 2,7 ±0,5 6,2 ±1,2 8,5 ±2,1 7,3 ±3,2 5,4 ±1,2 3,9 ±0,9 1,5 ±0,6 0,6 ±0,3 4,1 ±2,1 7,1 ±2,3 5,3 ±1,2 3,5 ±0,4 1,9 ±0,3 0,6 ±0,2 72 При изучении изменения концентрации Hcy c 1 по 8 курс ВД Mtx был выявлен ряд особенностей. Наиболее выраженный ответ наблюдался на 1 курсе ВД Mtx у первичных пациентов – концентрация Hcy к 24 часу ВД Mtx достигала 20,3±5,1 мкмоль/л. При последовательном измерении Hcy на разных курсах ВД Mtx было выявлено, что с ростом номера курса наблюдаемые изменения концентрации становятся все менее выраженными – концентрация Hcy на каждый час ТЛМ Mtx ниже, чем в предыдущем курсе (см рис.23.); каждый последующий курс ВД Mtx начинался с более низкого значения Hcy, чем предыдущий. Причиной этого может быть остаточное действие лейковорина, а также активация альтернативных путей метаболизма (бетаинового и цистетионового путей, который преимущественно развит в почках). Статистически достоверная разница в образовании Hcy была выявлена между 1 и 4; 6; 7; 8 курсами, а также между 5 и 7; 8 курсами. Было обнаружено, что в течение первых 4 курсов ВД Mtx концентрация Hcy снижалась. 5 курс имел особенности: характеризовался большими значениями (чем во 2,3,4 курсах) концентрации Hcy на всех часах мониторинга в среднем на 2,3 мкмоль/л, но не достигал значений концентрации Hcy 1 курса. Рис. 23. Динамика изменения концентрации Hcy в крови пациентов при ВД Mtx c 1 по 8 курс ВД Mtx. 73 6, 7, 8 курсы ВД Mtx также характеризовались последовательным снижением концентрации Hcy на ключевых часах мониторинга. Выброс концентрации Hcy можно объяснить перерывами в высокодозной терапии, которые обусловлены хирургическим этапом лечения, а также невозможностью проведения курса лечения из-за физиологического состояния больного А Б Рис. 24. (А) изменение концентрации Hcy c 1 по 4 курс (Б) изменение концентрации Hcy c 5 по 8 курс ВД Mtx. 74 Hcy AUC также показала тенденцию к снижению от курса к курсу. Это отражает снижение накопления Hcy в ответ на последовательное проведение курсов ВД Mtx (cм. табл. 11). После перерыва в терапии значение Hcy AUC увеличивается, не достигая изначальных значений, а затем постепенно снижается. При этом Mtx AUC от курса к курсу остается неизменной, свидетельствуя, что общее воздействие препарата на организм количественно не изменялось. Эти данные свидетельствуют о том, что общее накопление Hcy (HcyAUC) является фармакодинамическим показателем, который линейно увеличивается в ответ на введение Mtx, и эта тенденция прекращается введением лейковорина. Таблица 11 Площади под кривой концентраций Hcy и Mtx на разных курсах ВД Mtx Номер курса ВД Mtx Площадь под кривой Гомоцистеина мкмоль*л-1*ч-1 Площадь под кривой Метотрексата мкмоль*л-1*ч-1 1 курс 812,2±70,4 11791±500 2 курс 689,5±67,6 11678±478 3 курс 518,3±53,8 11349±613 4 курс 428,3±47,2 11200±413 5 курс 718,9±55,1 11791±500 6 курс 578,1±45,1 11678±478 7 курс 318,7±56,1 11340±513 8 курс 228,3±47,2 11999±413 C другой стороны, площадь под кривой для Mtx от курса к курсу остается неизменной, отражая то, что общее воздействие препарата на организм количественно не изменялось. Эти данные говорят о том, что общее накопление Hcy (HcyAUC) является фармакодинамическим 75 показателем, который линейно увеличивается в ответ на введение Mtx, и эта тенденция мгновенно прекращается введением лейковорина. Одновременно с мониторингом Hcy и Mtx проводился мониторинг других биохимических показателей токсичности – АЛТ, АСТ, ЛДГ, общий билирубин, ЩФ, γ-ГТ, креатинин, мочевина. Для них также были подсчитаны корреляции с Hcy для средних значений и по номерам курсов ВД Mtx, однако статистически значимые корреляции выявлены для Hcy и АСТ, АЛТ, ЛДГ и ЩФ – 0,98; 0,86, 0,95, 0,54 соответственно (см. табл.12). Таблица 12 Корреляционная зависимость между Hcy и другими показателями Определяемый показатель Hcy:Mtx Hcy:АЛТ Hcy:АСТ Hcy:ЛДГ Hcy:ЩФ Коэффициент Корреляции Стат. Достоверность р <0,05 0,87 0,031 0,98 0,047 0,95 0,025 0,54 0,032 0,87 0,04 При подсчете коэффициента корреляции на разных курсах для АЛТ, АСТ и ЛДГ и Hcy была выявлена тесная зависимость для всех трех показателей с 1 по 3 курс. Для АСТ она такой остается на протяжении всех 8 курсов, для АЛТ на 4 курсе =0,37, и с 5 по 8 курс держится в пределах r=0,69±0,02. Тенденция постепенного снижения корреляционной зависимости характера и для ЛДГ (см. табл. 13). Таблица 13 Корреляционная зависимость между Hcy и другими биохимическими показателями на разных курсах терапии ВД Mtx Номер курса ВД метотрексата Коэффициент корреляции 1 2 3 4 5 6 7 8 0.84 0.93 0.83 0.37 0.67 0.73 0.66 0.68 Нcy:AЛТ 0.91 0.92 0.97 0.98 0.96 0.96 0.94 0.99 Нcy:АСТ 0.84 0.67 0.98 0.86 0.51 0.44 0.51 0.32 Hcy:ЛДГ * p <0,05, для всех случаев коэффициенты корреляции достоверны У пациентов с замедленным выведением Mtx (2 группа, табл. 7) были выявлены следующие особенности в образовании Hcy. Концентрация Hcy 76 возрастала у них больше, чем у пациентов с нормальным выведением Mtx – за первые 24 часа достигая значения 24,7±10 мкмоль/л (р=0,0045). После введения лейковорина на 24 час снижения концентрации Hcy не наступало, она продолжала расти и к 42 часу достигала в среднем значений 20,5±5,1 мкмоль/л. После 42 часа концентрация Hcy постепенно снижалась, однако для ее восстановления требовалось гораздо больше времени, чем при нормальном выведении Mtx (см.рис.26). Различия в концентрации Hcy между нормальным и замедленным выведением статистически достоверны р= 0,034, т.е.p<0,05. Рис.26. Изменение концентрации Hcy в крови при замедленном выведении Mtx (подгруппа 2) Таким образом, Hcy метаболически взаимосвязан с Mtx – чем выше концентрация Mtx, тем большее количество Hcy выбрасывается в кровь. Hcy имеет тесную взаимосвязь с Mtx. Он может служить маркером эффективности подавления трансформации фолатов. При замедленном выведении Mtx Hcy значительно повышается в крови, что также свидетельствует, что он может служить маркером фармакодинамического 77 воздействия ВД Mtx. С каждым последующим курсом ВД Mtx выброс Hcy в сыворотку снижается. Можно предположить, что Hcy начинает утилизироваться по другим метаболическим путям – бетаиновому, цистатионовому, и за счет этот вносит свой вклад в токсичность Mtx. Также применение Mtx приводит к тому, что после завершения лечения уровень Hcy стабильно держится ниже нормы. 3.3. Биокинетическая характеристика показателей гепатотоксичности Проведение мониторинга биохимических показателей позволило выявить следующие особенности. При нормальном выведении Mtx (группа 1) к 24 часу от начала ВД Mtx наблюдалось увеличение активности АЛТ до 500 Ед/л (см. табл.14). Таблица 14 АЛТ 24 518 ±118,6 48 408 ±121,4 АСТ 32 ±9,3 525 ±110,1 254 ±116,1 173 ±70,1 93 ±20,1 ЛДГ 226 ±90,1 1309 ±120,3 659 ±120,1 595 ±130,1 АЛТ 37 ±11,4 1581* ±185,7 1431* ±625,1 АСТ Нормально Показатель Замедленно 0 37 ± 10,3 Час ВД Mtx 72 96 236 110 ±80,4 ±55,4 33 ±12,1 1691* ±175,1 ЛДГ Изменение активности ферментов цитолиза в течение ТЛМ Mtx при нормальном и замедленном выведении 226 ±83,1 4795* ±423,5 196 240 - - 44 ±12,2 - - 466 ±110,1 245 ±56,8 - - 1131* ±518,2 555* ±187,7 436* ±67,9 182* ±47,2 58 ±10,2 1247* ±523 614 ±200,4 248 ±40,1 218* ±34,1 176* ±23,4 54 ±11,2 3388* ±215,1 1113* ±200,4 635 ±144,1 410 ±56,1 347 ±45,1 329 ±123,2 * - статистически достоверная разница внутри показателя 120 55 ±11,5 78 С этого момента активность АЛТ снижалась, к 96 часу значения достигали в среднем 210,1±105,4 Ед/л, то есть полностью восстанавливались не во всех случаях. Аналогично развивалось изменение активности АСТ и ЛДГ – резко возрастало к 24 часу терапии, затем постепенно уменьшалось, не достигая к моменту полного выведения Mtx значений нормы (см. рис. 27, табл.14). Рис. 27. Изменение активности АЛТ при нормальном и при замедленном выведении метотрексата У пациентов с замедленным выведением Мtx к 24 ч уровень АЛТ достигал в среднем 1581 Ед/л, АСТ – 1691 Ед/л, а ЛДГ – 4795 Ед/л, то есть превышал норму в десятки раз. Снижение активности АЛТ наблюдалось в среднем на 72 – 96 часу после введения Мtx. Однако даже к моменту полного выведения Mtx уровень ферментов оставался в 2,5 – 7,5 раз выше нормы и достигал ее в среднем лишь к 12-13 суткам (см. рис.27). складывалась и для АСТ и ЛДГ (см. табл. 14). Аналогичная ситуация 79 А В С Рис. 28.Изменение активности А – АЛТ, В – АСТ, С – ЛДГ по средним значениям концентрации в зависимости от курса ВД Mtx. Нами был проведен анализ значений средних показателей уровня АЛТ, АСТ, ЛДГ в зависимости от порядкового номера курса терапии и суток 80 относительно введения препарата (рис.28). Полученные результаты свидетельствуют, что степень изменения активности фермента после введения Mtx при увеличении номера курса уменьшается. Для случаев нормального выведения Mtx и замедленного выведения Mtx были посчитаны корреляции между активностью ферментов и Mtx (см. табл. 15). Полученные результаты свидетельствуют о сильной взаимосвязи между гепатотоксичностью и воздействием Mtx. Гепатотоксичность в данном случае зависит от концентрации ЛП в плазме и времени его экспозици. Таблица 15 Корреляционная зависимость между Mtx и гепатотоксичности Коэффициент Mtx :АЛТ Mtx:АСТ корреляции с Mtx 0,73 0,94 Нормальное выведение 0,79 0,88 Замедленное выведение показателями Mtx: ЛДГ 0,96 0,86 Для оценки как степени повреждения, так и скорости восстановления печени может применяться биокинетический подход. Он позволяет вычислять кинетические характеристики (константы скоростей (k), периоды полувосстановления (t1/2), максимальные концентрации (C0) биохимических показателей крови. Они позволяют оценить скорость и время полного восстановления их нормальной концентрации. Организм при этом рассматривается как однокамерная модель. Полученные результаты представлены в таблице 16. 81 Таблица 16. Кинетические характеристики показателей состояния печени после Показатель введения Mtx АЛТ АСТ ЛДГ Кинетические параметры Константа скорости Период полувосста- Максимальная -1) (k, сут новления ( t1/2, сут) концентрация (С0) Нормально Замедленно Нормально Замедленно Нормально Замедленно 0,24 ±0,05 0,90 ±0,05 0,22 ±0,04 4,89 ±0,05 4,22 ±0,05 9,62 ±0,04 2,20 0,147 1,58 0,164 3,15 0,694 240,3 ±50,6 285,2 ±47,6 721,6 ±93,5 1286 ±100 926 ±150 2320 ±311 Изменение концентрации АЛТ, АСТ, ЛДГ изменяется, подчиняясь экспоненциальному С=С0e-kel*t закону, . Далее, используя метод линеаризации, то есть приведения к натуральному логарифму, было получено уравнение вида lnC=lnC0 – kel *t , где С0 – начальная концентрация вещества (максимальная концентрация), С – концентрация вещества в данный момент времени. Данные свидетельствуют о том, что при нормальном выведении Mtx величина t1/2 увеличивается в ряду с АСТ>АЛТ>ЛДГ. Константа скорости падала в ряду АСТ<АЛТ<ЛДГ - было выявлено, что быстрее всего до нормальных значений восстанавливается активность АСТ. Вычисленные максимальные концентрации ферментов (С0) позволяют предполагать, каких значений при нормальном выведении Mtx они могут достигать на 24 час терапии. Значения концентрации АЛТ, АСТ, ЛДГ выше указанных в табл. 17 могут является предметом врачебной настороженности. При вычислении биокинетических параметров с 1 по 8 курс ВД Mtx было выявлено, что константа скорости (k) для АЛТ растет с ростом номера курса ВД Mtx - на 0,1 сут-1 в среднем, достигая значения до 0,40±0,1 сут-1. Для ЛДГ значения k колеблются в интервале 0,25±0,05 сут-1, снижаясь 82 с ростом номера курса. Для АСТ не было обнаружено зависимости k от курса терапии (см. табл. 17, рис. 29). Таблица 17. Значение константы скорости восстановления ферментов на ключевых часах ВД Mtx c 1 по 8 курс Показатель АЛТ АСТ ЛДГ 1 0,31 ±0,06 0,50 ±0,04 0,25 ±0,05 2 0,32 ±0,05 0,51 ±0,04 0,90 ±0,05 3 0,32 ±0,04 0,50 ±0,04 0,90 ±0,05 Номер курса ВД Mtx 4 5 6 0,34 0,35 0,36 ±0,05 ±0,05 ±0,05 0,52 0,50 0,50 ±0,03 ±0,04 ±0,04 0,90 0,90 0,90 ±0,05 ±0,05 ±0,05 активности 7 0,37 ±0,05 0,50 ±0,04 0,90 ±0,05 8 0,39 ±0,058 0,50 ±0,04 0,90 ±0,05 Рис. 29. Кинетика восстановления уровня АЛТ - изменение константы скорости первого порядка В случаях замедленного выведения Mtx (группа 2) кинетика восстановления биохимических показателей имеет ряд особенностей (см. табл. 18). Значение k было больше нормального в 12,5 раз для АЛТ, в 10 раз для АСТ и в 60 раз для ЛДГ, падало в ряду ЛДГ<АСТ<АЛТ, т.е. при замедленном выведении Mtx быстрее восстанавливалась ЛДГ. При этом 83 значения t1/2 биохимических показателей значительно сокращалось – в 12 раз для АЛТ, 11 для АСТ и 6,8 раз для ЛДГ. С0 была для АЛТ в 5,3 раза больше нормы, в 3,3 и 3,2 для АСТ и ЛДГ соответственно. Сокращение t1/2 в данном случае обусловлено увеличением k – величины взаимосвязаны формулой t1/2 =0,693/k. Огромное значение С0 указывает на тот факт, что даже без возникновения острой задержки с нарушением фармакокинетической кривой Mtx, процесс восстановления гепатоцитов нарушается и риск повреждения печени и невозможности перейти к следующему курсу лечения значительно увеличивается. 3.4. Биохимическая характеристика нефротоксичности Известно, что одним из наиболее надежных показателей повреждения почек является креатинин. Его накопление в сыворотке крови при токсической нагрузке возрастает быстрее, чем содержание мочевины. Рис.30. Динамика изменения содержания креатинина у больных, получающих ВД Mtx 84 В среднем у больных в течение не осложненного курса ВД Mtx концентрация креатинина поднималась в среднем на 10±5 мкмль/л (с 30±15 мкмоль/л до 40±12 мкмоль/л), колебалась в течение курса, но всегда оставалась в пределах нормы (см. рис. 30). Для мочевины изменение ее содержания в сыворотке практические не наблюдается – не зависимо от индивидуальных колебаний у каждого пациента, она остается в пределах нормы, не имея даже характерного для большинства показателей повышения от 0 к 24 часу (см. табл. 18). Таблица 18 Час Концентрация мочевины и креатинина на ключевых часах ТЛМ ВД Mtx у детей с ОС ТЛМ Нормальное выведение Mtx Замедленное выведение Мtx метотрексата 0 24 48 72 96 120 240 Мочевина Креатинин Мочевина Креатинин Ммоль/л Мкмоль/л Ммоль/л Мкмоль/л 3,7 50,1 3,5 59,7 ±1,1 ±11,3 ±1,0 ±5,6 4,29 65,5 7,4 201,4 ±1,0 ±13,2 ±5,2 ±11,8 3,2 63,2 7,9 197,5 ±0,8 ±12,1 ±3,3 ±12,4 3,1 59,4 5,7 146,5 ±0,7 ±12,1 ±1,2 ±15,2 2,9 68,9 5,6 125,1 ±0,8 ±20,2 ±1,4 ±9,3 4,5 83,4 ±0,6 ±5,4 4,3 69,7 ±0,9 ±4,7 - - - - 85 Совсем другая картина наблюдается при развитии острых задержек выведения Mtx и почечной токсичности. Мы наблюдали четыре случая острой задержки выведения Mtx – подгруппа 1. В двух случаях удалось справиться с токсичностью с помощью интенсификации терапии лейковорином, альбумином, форсированной гидратацией и диурезом, в одном был применен метод гемофильтрации. Во всех случаях уровень сывороточного креатинина резко поднимался за первые 24 часа терапии – в среднем на 100 мкмоль/л, затем в ответ на терапевтические методы начиналось его снижение, однако нормального уровня он достигал только после полного выведения Mtx из организма пациента (см. рис. 31, табл. 19). 250 пациент А.В. пациентка М.Л. креатинин, мкмоль/л 200 пациентка М.Е. граница нормы 150 100 50 0 0 50 100 150 200 250 300 350 400 время,ч Рис.31. Динамика изменения содержания креатинина у больных с замедленным выведением метотрексата (подгруппа 1) При этом концентрация мочевины превысила норму только в двух из трех случаев. В случае, потребовавшем гемофильтрации, она оставалась в пределах нормы. Однако во всех трех случаях ее уровень возрастал с 0 часа до 24 часа терапии в среднем на 8 ммоль/л. (см. рис. 32). 86 16 пациент А.В 14 пациентка М.Л пациентка М.Е. 12 границы нормы 10 8 6 4 2 0 0 50 100 150 200 250 300 350 400 Рис.32. Динамика изменения содержания мочевины у больных с замедленным выведением Mtx (подгруппа 1) Мочевина и креатинин отражают взаимосвязь с возникновением почечной токсичности и развитие задержек выведения Mtx. Острые нарушения выведения Mtx вызывают сильное повышение уровня сывороточного креатинина, сопровождающее весь период дальнейшее выведение Mtx. При этом для мочевины повышение уровня выше нормальных значений не является обязательным и не может являться маркером токсичности. Наблюдение за уровнем мочевины показательно только в динамике. Таким образом, при проведении ВД Mtx необходим тщательный мониторинг биохимических показателей крови. Это позволяет определить состояние и степень повреждения того или иного органа, дать качественную оценку токсичности препарата и планировать адекватную сопроводительную терапию. Биохимический анализ крови является одним из методов, с помощью которых можно контролировать состояние, как отдельных органов, так и организма в целом. 87 Токсичность ВД Mtx проявляется у подавляющего большинства пациентов. Однако традиционные показатели токсичности недостаточны для полной оценки воздействия Mtx на организм, и не информативны с точки зрения прогноза развития задержек Mtx. Поэтому так необходима разработка ранних маркеров токсичности Mtx, которым может являться аминокислота гомоцистеин. 3.5. Оценка метаболизма Mtx при терапии ВД Mtx остеосаркомы у детей Нарушения фармакокинетики Mtx, безусловно, могут быть обусловлены изменениями в его метаболизме. Для подтверждения этого предположения было проведено изучение изменений в концентрации его основного циркулирующего в крови метаболита – 7-ОН-Mtx. Для выявления метаболических особенностей превращения в печени Mtx в 7-ОН-Mtx при применении ВД Mtx крови использовали метод ВЭЖХ [63]. Исследование образцов проводилось на хроматографе Metrohm 844 UV/VIS Compact IC (Швейцария). Использовалась хроматографическая колонка PRONTOSIL С18 ace-EPS 5µ 150х4,6 (США). Подвижная фаза состояла из смеси фосфатного буфера, ацетонитрила и 0,1 % раствора трифторуксусной кислоты. Время выхода Mtx – 5 мин, 7-ОН-Mtx – 6 мин. Измерение проводили так же, как и Mtx – на 4; 24; 42; 48; 72; 96 ч ТЛМ Mtx (см. табл. 19). Концентрация 7-ОН-Mtx быстро возрастала за первые 4 часа терапии – до окончания инфузии. С 4 часа начиналось постепенное снижение концентрации 7-ОН-Mtx. Снижение концентрации 7ОН-Mtx происходит медленнее, чем для Mtx – на 96 час концентрация 7ОН-Mtx еще составляла 5±2,6 мкмоль/л (см. рис. 33А). Тем не менее между Mtx и 7-ОН-Mtx существует тесная взаимосвязь – коэффициент корреляции равен 0,89 (р=0,0034). При изучении концентрации 7-ОН-Mtx c 1 по 8 курс терапии ВД Mtx была выявлена следующая особенность. С 1 по 4 курс концентрация 7-ОН-Mtx на всех часах мониторинга значимо возрастала, но 88 после 5 курса начала снижаться. Предположительно, это может быть результатом увеличившейся активности почечных и печеночных АТФсвязывающих белков-транспортеров, приводящая к усилению элиминации 7-ОН-Mtx. Таблица 19 Фармакокинетические характеристики 7-ОН-Mtx Концентрация 7-ОНMtx (мкмоль/л) Нормальное выведение Mtx Замедленное выведение Mtx AUC норм. выведения (мкмоль/л*l-1*ч-1) AUC замедл. выведения (мкмоль/л*l-1*ч-1) Час от начала введения метотрексата 4 час 24 час 42 час 48 час 72 час 80,1 ±15 90,2 ±20,1 830 ± 67 30,2 ±6, 45,2 ±11,1 9,4 ±3,2 30,1 ±10,5 5,3 ±2,2 20,1 ±4,0 3,2 ±1,2 10,1 ±5, 96 час 1,1 ±0,5 5,2 ±2,6 1259 + 275 II I Вещество tR Sпика I)Mtx II) 7-OH-Mtx 4,86 5,71 58257 176947 Рис. 32. Хроматограмма Mtx и 7-OH-Mtx у больного Т.А. 10 л, нормальным выведением Mtx на 48 час ТЛМ Mtx с 89 Для наглядности приводим полученную хроматограмму (рис. 32) больного З.Г, 10 лет, 2 курс ВД Mtx. Как видно на хроматограмме, пик I – соответствует Mtx, пик II – 7-ОН-Mtx. Время выхода Mtx – 5 мин., время выхода 7-ОН- Mtx – 6 мин. При замедленном выведении Mtx концентрация 7-ОН-Mtx возрастала на всех ключевых часах мониторинга, и для его полного выведения требовалось больше времени (см. рис. 33Б). А Б Рис.33. Концентрация 7-ОН-Mtx в крови пациентов (А - с нормальным выведением Mtx , Б - с замедленным выведением Mtx). 90 Полученные данные согласуются с законами ферментативной кинетики. Согласно основному уравнению ферментативной кинетики по зависимости скорости реакции от концентрации субстрата, , (8) превращения субстрата S, где Vmax – максимальная скорость Кm –константа Михаэлиса, S- концентрация субстрата. Ферментативный метаболизм ЛП может быть «насыщаемым» и зависимым от дозы, и потому известен как метаболизм с ограниченной способностью. Отношения между концентрацией яда и активностью фермента описываются уравнением Михаэлиса-Ментена. Когда концентрация субстрата меньше, чем константа Михаэлиса (К м), тогда метаболизм может быть описан уравнением первого порядка (уровень метаболизма пропорционален концентрации). С дальнейшим увеличением концентрации субстрата наблюдается прогрессивное уменьшение в темпе увеличения метаболизма, пока фермент не насыщается полностью. В этом точке метаболизм максимален, и элиминация равно нулю и называется «независимая концентрация». Ограниченный метаболизм не наблюдается при терапевтических концентрациях большинства ЛП. При передозировке метаболизм с ограниченной способностью, как и следовало ожидать, продлевает элиминацию [158]. Если концентрация субстрата меньше константы Михаэлиса Km (S<<Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок). Если концентрация субстрата значительно больше Km (S>>Km), тo увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не 91 зависит от концентрации субстрата. Таким образом, при нормальном выведении Mtx не была достигнута максимальная скорость реакции. При замедленном выведении Mtx достигается Vmax при окислении Mtx в 7-ОНMtx. По всей видимости, возникновение «плато» при замедленном выведении Mtx объясняются не только липофильным депонированием Mtx в различных органах, но и предельным достижением активности фермента АО. Скорость превращения Mtx в 7-ОH-Mtx зависит от активности фермента альдегидоксидаза. По тем или иным причинам альдегиодоксидаза может не справляться с возросшим объемом воздействия на нее – к примеру, сниженная функциональная активность печени может являться причиной низкой активности альдегидоксидазы. Также доказано, что эстриол и эстрадиол являются ингибиторами альдегиодкосидазы. 75% случаев замедленного выведения Mtx возникали у пациентов женского пола. Возможно, указанные факторы снижают скорость окисления Mtx в 7ОН-Мtx. Использованная нами методика определения 7-ОН-Mtx позволяет быстро выявить особенности метаболизма Mtx. Таким образом, 7-ОН-Mtx может применяться как критерий активности метаболизма Mtx и возможности оценки токсического поражения печени. 92 ГЛАВА 4. ОБСУЖДЕНИЕ Понимание фармакокинетических и фармакодинамических принципов является необходимостью для оптимального проведения пациентов, получающих высокотоксические вещества. позволяют использовать фармакокинетические принятия решения о лечении данные терапии у Эти принципы для быстрого токсических воздействий, оптимальном подборе антидотной терапии. При применении ВД Мtx необходимо решить большой ряд проблем, затрагивающих многие дисциплины. Мы знаем, что любое вещество, имеющее или не имеющее аналогов в организме, относится к категории токсикантов или ксенбиотиков, т.е. веществам, поступающим в организм из вне, они не могут быть получены биосинтетическим путем и они, в конечном итоге должны подвергаться деградации и выведению из организма. В общей характеристике поведения токсикантов в организме необходимо ответить на вопросы о том: как экзогенное вещество воздействует на функциональные свойства организма в целом или на отдельные его части и как организм реагирует на внесенное в него соединение. Первое относится к эффектам фармакодинамическим, второе – к фармакокинетическим, биологические поскольку эффекты фармакодинамика введенного препарата и рассматривает механизмы его биологического действия, фармакокинетика исследует основные проблемы, связанные с всасыванием, распределением, депонированием, метаболизмом и выведением токсикантов. Фармакокинетические эффекты оказывают решающее влияние на интенсивность и продолжительность эффектов фармакодинамических. Необходимо отметить, что поскольку метаболизм приводит к новым соединениям, неизбежно обладающим собственными биологическими эффектами, общая картина воздействия токсиканта на организм зависит от того, какие метаболиты образуются в результате биотрансформации. Следовательно, фармакокинетические и фармакодинамические эффекты находятся в тесной взаимосвязи, и оценка 93 этой взаимозависимости требовала серьезного теоретического анализа и экспериментального исследования. В настоящее время мало полноценных работ, включающих данные о фармакологических, биологических свойствах противоопухолевых препаратов, их фармакокинетике и метаболизме в организме, современном взгляде на механизм их действия. Сведения о применяемых противоопухолевых препаратах чаще всего разрознены, представлены в отдельных небольших статьях, сборниках, отчетах и тезисах, что не дает возможности онкологу-исследователю и особенно врачу-онкологу составить полное представление о применяемом лекарственном препарате. Успехи, достигнутые в последние годы в химиотерапии ряда злокачественных опухолей у детей (появление новых схем и дозировок полихимиотерапии при лечении гемобластозов и остеосарком) обусловило необходимость данной работы. Механизмы фармакодинамики/фармакокинетики существенно изменяются при использовании препаратов в больших концентрациях. Фармакокинетика ВД многих веществ серьезно изменяется, проявляется т.н. дозозависимая кинетика, и вместе с ней изменяется влияние их на органы. В таком случае ЛП могут рассматриваться как токсические агенты. Сопряженная с высокой токсичностью терапия ВД Mtx также должна изучаться в таком ключе, учитывая тот факт, что в основе ее лежит как раз изменение кинетики препарата – при применении ВД Mtx переносится в клетку не с помощью белка-переносчика, а пассивной диффузией. Нами были описаны различные кинетические варианты элиминации ВД Mtx и выявлены 2 типа фармакокинетики Mtx – нормальное выведение и замедленное выведение. Кривая изменения концентрации Mtx при нормальном выведении после достижения Сmax, соответсвует экспоненте, подчиняется первому порядку, общее время выведения составляет в среднем 96±24 часа. 94 Общий процент случаев замедленного выведения Mtx составил 7,6% от всех исследуемых курсов. Эти данные сопоставимы с мировыми - средним значением считается 10% [40]. Не до конца ясно, что же именно считается замедленным выведением Mtx – только случаи с явным нарушением фармакокинетики, формированием «плато» и пр (у нас т.н. 1 подгруппа). Таких случаев в период с 1980 по 2013 описано около 50 для взрослых и детей [43]. Учитывая, что у НИИ ДОГ за период с 2007 по 2013 год было 4 подобных случая, скорее всего в мире их было больше. Некоторые исследователи в качестве примеров токсичности Mtx учитывают только их, некоторые же уделяют внимание случаям без отклонения от кривой первого порядка [99,103,128]. В группе замедленного выведении нами было условно выделено 3 подгруппы нарушений элиминации Mtx. Они были определены в зависимости от типа фармакокинетической кривой (описывается или нет уравнением первого порядка), а также концентрации Mtx на ключевых часах. Был сделан вывод, что любые, даже самые незначительные изменения в фармакокинетике препарата потенцируют его токсическое воздействие при острых задержках выведения MtxAUC возрастает в 2-4 раза относительно нормального выведения (p=0,011), в 1,5 – при втором типе задержек, (p=0,021), и в 1,2– при третьем (p=0,047). Это подтверждает тот факт, что любое нарушение элиминации увеличивает общее количество воздействия ЛП на организм, и тем самым потенцирует его токсичность. Отклонения от протокола лечения при проведении терапии ВД Mtx недопустимы, т.к. предсказать возникновение нарушения элиминации Mtx практически невозможно. иллюстрирующие В нашем практически замедленного выведения Mtx. Это все исследовании типы отеки, описаны случаи, причин возникновения инфекции, изменения при алкализации, снижение почечной функции, и, весьма вероятно, генетические особенности. 95 При этом некоторые ученые считают, что увеличение концентрации Mtx относительно протокола на ключевых часах выживаемости. ТЛМ способствует лучшей К примеру, Bacci G. et al. выдвигают теорию, что превышение принятой в протоколе концентрации на 42 ч способствует увеличению 5-летней безрецидивной выживаемости. В нашем исследовании таких данных получено не было. Среди тех пациентов, чьи истории болезни удалось проследить, у 5 развилось метастазирование в легких уже после завершения лечения, потребовалась резекция легкого. Точно установлено развитие множественных рецидивов у двух пациенток. У многих из описанных пациентов нарушения выведения Mtx возникали на 2-3 курс ВД Mtx, после чего они хорошо переносили последующие курсы. В то же время у пациента А.В., проходившего в 2009 НИИ ДОГ лечение по поводу ОС правой плечевой кости, в течение первого курса ВД Mtx развилось острое снижение клиренса Mtx. Как было описано в результатах, пациента удалось спасти применением гемофильтрации. Было принято решение о дальнейшей отмене терапии ВД Mtx. У пациента развился лекарственный патоморфоз III степени, и была проведена операция по удалению опухоли и установке эндопротеза. В 2013 году пациент возвращался на обследование, состояние его удовлетворительное. Здесь представлен случай, когда огромное токсическое воздействие Mtx, вызванное его замедленным выведением, выразилось в лечебный эффект. Тот факт, что причина замедленного выведения Mtx не была установлена, привел к тому, что эффективное лечение было прекращено. В литературе описано несколько случаев, когда пациенты успешно продолжали лечение уже после того, как ими был перенесена «острая задержка выведения Mtx» [115]. Последующие курсы ВД Mtx проходили без развития токсических осложнений. У нас дальнейшее лечение было предпринято для пациентов, у которых развивалось нарушение элиминации Mtx без отклонения от уравнения первого порядка для кривой выведения. 96 Считается, что основным ограничением терапии ВД Mtx является возраст [15, 40]. Переносимость Mtx снижается с возрастом, он плохо переносится взрослыми, старше 22 лет, лучше – младше 3 лет. В нашем случае в связи с небольшим разбросом в группе исследуемых больных (средний возраст 13,3 лет), эта особенность не была характерной. Была выявлена следующая закономерность – замедленное выведение Mtx наблюдалось в 75% случаев у пациентов женского пола. Возможно, это связано с тем, что доказанными ингибиторами альдегиодоксидазы, окисляющей Mtx в печени, являются эстриол и эстрадиол [82]. До недавнего времени токсичность ВД Mtx не связывали с полом, однако в 2012 году такие данные опубликовали Holmboe E. et al, позиционируя себя как первое сообщение на данную тему. Были определены закономерности окисления Mtx в 7-OH-Mtx при нормальном выведении и при нарушениях его элиминации. Mtx окисляется ферментом АО, процесс происходит в печени. Метаболизм Mtx и 7-ОН- Mtx в случае использования ВД Mtx представляет вариант метаболизма с ограниченной функцией. Увеличение концентрации Mtx, вызванное нарушением его элиминации – по тем или иным причинам, является увеличением концентрации субстрата для АО. При нормальном выведении превращение Mtx в 7-ОН-Mtx подчиняется уравнению первого порядка (V = Vmax[S]/Km). При замедленном выведении Mtx наблюдается увеличением количества субстрата (собственно, Mtx). В таком случае уравнение подчиняется нулевому порядку (V = Vmax). Концентрация 7-OH-Mtx увеличивается, и длительное время имеет одно и то же значение, однако не увеличивается более 100 мкмоль/л не зависимо от концентрации Mtx. Это говорит о том, что произошло насыщение фермента. Оценка активности дозозависимого метаболизма полезна для оценки степени риска терапии. Увеличенное выведение ЛП индукцией фермента может быть теоретически полезным; однако пока не разработан метод активации метаболизма в пределах полезного периода при развитии 97 токсической реакции при применении ВД Mtx. Возможно, применение гепатопротекторов, направленных на коррекцию гепатотоксичности, может также поддерживать и функциональные свойства печени, угнетаемые токсическим действием Mtx, а печень, в свою очередь, будет иметь возможность метаболизировать большее количество Mtx. В таком случае, актуальной остается проблема гепатотоксичности терапии ВД Mtx. Не смотря на большое число исследований по данному вопросу, вопрос об оптимальном диапазоне времени введения Mtx, а также скорость восстановления функции печени остается нерешенным. При этом исследователи сходятся во мнении, что токсичность Mtx коррелирует с развитием у пациентов нарушений элиминации. К примеру, Bacci et al. указывают, что с ростом времени экспозиции Mtx в крови растет и активность АЛТ, АСТ, ЛДГ и др. – следовательно, гепатотоксичность увеличивается при замедленном выведении Mtx. Hlomboe et al описывают также это явления для γ-ГТ. Такую же зависимость наблюдали и мы. Повышение концентрации Mtx ведет к многократному усилению гепатотоксичности (коэффициент корреляции 0,83 для Mtx:АЛТ) – концентрация АЛТ на 24 час с 350±50 Ед/л при нормальном выведении 300 Ед/л увеличивается до 3000±531 Ед/л. Таким образом, в механизме развития гепатотоксичности Mtx проявляет себя как токсический агент с дозозависимой степенью токсичности. Таким образом, в нашей работе прослеживается следующая тенденция – введение высоких доз Мtx подчиняется законам, принятым в токсикологии: «При повторных введениях токсического вещества его воздействия результируются в многофазный процесс, зависящий от характера токсиканта, интенсивности воздействия (доза, концентрация, эффект, время), изучаемого показателя, зависящего от уровня организации биологической системы». Это мы наблюдали для всех определяемых показателей. Как следует из фактического материала, мы наблюдали изменения активностей АЛТ, АСТ, ЛДГ от курса к курсу. Та же тенденция прослеживалась в 98 концентрациях в крови гомоцистеина и 7-ОН-Mtx. Следовательно, введение ВД Мtx повторяющимися курсами (до 8) подчиняется единому механизму процессов приспособления организма к повторяющемуся химическому воздействию, который формально характеризуется наличием на первоначальных этапах колебаний различных показателей с затуханием от курса к курсу ВД Mtx, определенными периодом колебаний и стремлением переходного процесса приспособления с течением времени к некоторому уровню адаптации (Рис 34) . Поскольку значительная роль в приспособлении организма повторяющимся преимущественно воздействиям в этом токсикантов органе принадлежит осуществляется печени, к и биотрансформация экзогенных соединений, поэтому именно гепатотоксичность характерна для терапии ВД Mtx. Как известно, характерной особенностью печени является наличие существенного структурно-функционального резерва – гепатоцитов, находящихся в состоянии функционального покоя. Наличие такого резерва позволяет организму реализовать первичный кратковременный и наиболее доступный механизм адаптации.. Естественно, что объем подключаемого резерва печени зависит от дозы или концентрации токсиканта. Поэтому динамика адаптационных процессов при воздействии ВД Mtx, уровня воздействия и показателей, по которому оценивается действие Mtx характеризуется затухающей колебательной кривой (рис.34). 99 А Б В Рис. 34. Динамика измененения концентраций А- гомоцистеина, Б – 7ОН-Mtx В- активностей ЛДГ, АЛТ, АСТ на 8 курсах ВД лечения Mtx. Таким образом, характер изменения адаптационной способности организма при ВД Mtx не является случайным и единичным, а является универсальным и обусловлен причинно-следственной связью между токсикантом и определенной совокупностью внутренних свойств биосистем. 100 Этиология Mtx-опосредованной почечной токсичности обусловлена преципитацией Mtx и его метаболитов на почечных канальцах или же прямым токсическим воздействием Mtx на клетки эпителия почечных канальцев. Более 90% Mtx выделяется через почки. Mtx слабо растворим в щелочной среде, и его метаболиты, 7-0Н-Mtx и ДМПА в шесть и десять раз менее растворимы, чем Mtx, соответственно. Увеличение pН мочи с 6,0 до 7,0 характеризуется увеличением растворимости Mtx и его метаболитов в 58 раз. С увеличением почечной токсичности связывают воздействие нескольких ЛП, вызывающих ее при одновременном приеме с Mtx, и конкурирующих с ним за почечную секрецию. Вызванная Mtx почечная дисфункция приводит к устойчивому повышению концентрации Mtx в плазме, что обусловливает неэффективность терапии лейковорином и значительное увеличение всех видов токсичности Mtx. Резкий подъем плазменного креатинина в течение или сразу же после инфузии Mtx отражает развитие почечной дисфункции и может привести к повышению уровня Mtx в плазме. Именно на этом утверждении основано понятие о концентрации Mtx на определенные часы мониторинга, превышение которых является показателем риска развития токсичности. При этом отмечается, что развитие сильной печеночной токсичности связано с введением Mtx, но может не иметь взаимосвязи с развитием почечной токсичности – то есть развитие одной токсичности возможно без другой. Многие исследователи (Slorsal L. et al, Borsi et al) указывают на взаимосвязь между повышенной концентрацией креатинина и замедленным выведением Mtx. Csordás K. et al. указывают на коррреляцию между 7-ОН-Mtx и нефротоксичностью. Однако у наблюдаемых нами пациентов концентрация креатинина не увеличивалась значимо при нормальном выведении Mtx, не всегда изменялась при замедленном выведении Mtx 2 подгруппы, и даже при острых случаях реакция развивается не срезу. Поэтому более актуальной для 101 своевременной диагностики вероятности развития замедленного выведения Mtx и ее силы может стать мониторинг не только Mtx, но и 7-ОН-Mtx, который появляется в крови вскоре после начала ВД Mtx. Часто для оценки воздействия ЛП кинетических данных становится недостаточно, и тогда возникает дополнительных критериев. необходимость в разработке Несмотря на большой прогресс, полученный в терапии рака на геномном, протеомном и метаболическом уровне за последние годы, все еще часто игнорируются индивидуальные особенности пациента. Токсикокинетика может значительно различаться у пациентов независимо от дозы - и вызванных ядом ранее изменений. Изменчивость может возникать из-за экологических, генетических и пр. различий. Большинство ЛП не было изучено идентифицировать клиническую достаточно глубоко, чтобы важность этих фармакогенетических изменений с точки зрения токсикокинетики. Поэтому поиски биомаркеров продолжаются и ускорились в последние годы с появлением фармакогеномики и прогностической онкологии. Биомаркеры должны быть идентифицируемы в легко доступных биожидкостях, таких как моча или кровь. Биомаркеры могут использоваться для контроля терапии рака, определения эффективности препарата и отличия респондентов от нереспондентов. Во многих случаях биомаркеры могут обеспечить механистическое понимание патогенеза болезни, a определенный метаболит или метаболиты указывать на активированные метаболические процессы. В оптимальных условиях, маркер биологической чувствительности (ответа) на введенный препарат должен априори быть предиктором токсичности и/или эффективности, или и того, и другого. Гомоцистеин – биомолекула, потенциально выполняющая эти условия. В самом деле, доказано, что антифолаты влияют на изменение концентрации гомоцистеина, что показано как в клеточных линиях, так и у пациентов, получающих Mtx. Исследования взаимосвязи изменения 102 концентрации Hcy при терапии ВД Mtx начаты в 1989 году в США под руководством Broxon H. В качестве модели они использовали пациентов, получавших 33 г/м2 Mtx для лечения ОЛЛ. Ими было выявлено, что концентрация Hcy увеличивается в ответ на введение Mtx, а затем планомерно снижается. При этом концентрация других аминокислот остается неизменной. Также ими было отмечено снижение концентрации Hcy с каждым последующим курсов. Число пациентов не позволило выявить какие-либо стабильные закономерности. Однако ими была выдвинута идея о возможности использования Hcy в качестве критерия оценки фармакодинамического воздействия Mtx. Было представлено еще несколько работ, но интерес к теме возник вновь уже в 2000-х годах, вместе с новыми подходами к индивидуализации терапии. В 2004 году группа чешских ученых Sterba J. el al. из Масариковского университета уже позиционировали Hcy как маркер фармакодинамического эффекта. Исследование проводилось на примере ОЛЛ у детей. Многие ученые докладывают о том, что отдаленным последствием терапии ВД Mtx является стойкое снижение концентрации Hcy в крови, а не только с каждым последующим курсом ВД Mtx, которое мы получили в наших результатах. Учитывая, что Hcy является токсичной высоко активной молекулой, вызывающей при высокой концентрации развитие большого числа патологических процессов, этот факт не может не считаться клинически важным при лечении опухолей. Однако нами было выявлено, что амплитуда повышения концентрации Hcy в сыворотке крови в течение курса ВД Mtx снижается с каждым последующим курсом. После перерыва в терапии – к примеру, на проведение хирургического вмешательства, то есть после завершения адъювантного лечения, с началом неоадъювантного периода терапии, концентрация Hcy как на нулевой час, так и общая амплитуда его выброса, частично восстанавливается. Это приводит к следующим выводам. Если Hcy, как предполагается некоторыми авторами [120], начинает метаболизироваться по цистатиновому 103 метаболическому пути, преимущественно активному в почках, то активация этого процесса является обратимой, и для дезактивации требуется не более 2 недель. Это позволяет сделать вывод о снижении фармакодинамической эффективности каждого последующего курса ВД Mtx, o чем также свидетельствовали в своих работах Sterba et al. Это не говорит о том, что их необходимо отменить, но указывает, что многочисленные повторяющиеся курсы ВД Mtx, не всегда могут быть эффективны. Возможно, дальнейшая разработка этой проблемы поможет не только в оценке эффективности терапии, но и позволит иначе отнестись к дозированию Mtx. Hcy может использоваться для оценки воздействия Mtx на организм, однако не характеризует процессы, происходящие с самим Mtx в организме. Peyriere H., а также Valik J. et al сообщают, что при замедленном выведении Mtx максимальная концентрация Hcy приходится не на 24, а на 48 час от начала инфузии ВД Mtx, и значимо превышала концентрацию Hcy для нормального выведения на ключевых часах ТЛМ. Такие же данные были получены и в нашей работе, что подтверждает глубокую взаимосвязь между метаболизмом Hcy и Mtx. Возможно, при разработке норм для концентрации Hcy в сыворотке пациентов в течение курса ВД Mtx она может быть использована в качестве критерия развития замедленного выведения Mtx. Терапия ВД Mtx является c биохимической и фармакокинетической точки зрения токсическим процессом. Рассмотрение ее с этой позиции может пролить свет на многие еще не решенные проблемы, не смотря на активное внедрение этого вида терапии в практику, и обеспечить лучшее проведение лечения, и, в итоге, лучшую выживаемость пациентов. 104 Выводы 1. Проведено 1137 курсов ТЛМ Mtx методом ФПИА. Выявлено 87 курсов замедленного выведения Mtx, что составляет 7,6% от всех курсов. 2. Рассчитаны выведения, фармакокинетические Mtx AUC, Сl mtx) показатели (общее время для нормального выведения Mtx и при замедленном выведении Mtx. Для нормального выведения AUC составила 11791±500 мкмоль/л-1*ч-1. Значения площади под кривой возрастают пропорционально степени замедления выведения Mtx. У 1-ой подгруппы замедленного выведения Mtx AUC возрастает в 2-4 раза относительно нормального выведения, в 1,5 раза – во второй подгруппе задержек, и в 1,2 – в третьей. В 1-ой подгруппе CLmtx снижен – в 1,6 раза относительно нормального выведения, во 2-ой – в 1,2 раза, в 3 подгруппе - в 1,1 раз. 3. Отработана методика мониторинга Hcy в сыворотке крови в течение курса ВД Mtx. Изучены изменения концентрации в сыворотке крови при нормальном выведении Mtx и при задержках выведения Mtx. Расчитанная Hcy AUC показала тенденцию к снижению от курса к курсу ВД Mtx. При этом Mtx AUC от курса к курсу остается неизменной. Эти данные свидетельствуют о том, что общее накопление Hcy (HcyAUC) является фармакодинамическим показателем, который линейно увеличивается в ответ на введение Mtx. При замедленном выведении Mtx концентрация Hcy увеличивалась в среднем в 1,7 раз. Повышение концентрации Hcy в сыворотке крови детей с ОС указывает на высокую вероятность развития у них осложнений. 4. Методом корреляционного анализа выявлена тесная взаимосвязь динамики Hcy и следующих показателей: Hcy : Mtx (r=0,83, р=0,033), Hcy : АЛТ (r=0,86, p=0,04), Hcy : ЛДГ (r=0,95, p=0,025). Изучена биокинетика биохимических показателей в процессе химиотерапии детей с ОС. Скорость восстановления показателей до нормы падает в ряду 105 АСТ>АЛТ>ЛДГ. С ростом номера курса ВД Mtx скорость восстановления до нормы АЛТ увеличивается, достигая 0,40 сут-1, для других показателей такая зависимость не обнаружена. 6. Налажен метод количественного определения Mtx и его основного метаболита 7-OH-Mtx в сыворотке крови больных с помощью ВЭЖХ (предел обнаружения Mtx 0,8 10-3 мг/мл) 7. Установлено, что при замедленном выведении Mtx происходит изменение его метаболизма, которое выражается в увеличении концентрации 7-ОН-Mtx в сыворотке крови относительно нормального выведении на всех ключевых часах ТЛМ в 1,6 раз и замедлении выведения его из организма. Практические рекомендации Рекомендуется определение концентрации Hcy до и в течение курса ВД Mtx c целью прогнозирования развития задержек и их предупреждения, а также дополнительного источника определения эффективности терапии. Рекомендуется определение концентрации гомоцистеина до начала терапии – также с целью определения вероятности возникновения задержек выведения Mtx. Рекомендуется определение соотношения концентраций Mtx/7-OHMtx пациентам с нарушениями фармакокинетики Mtx для определения их причин. 106 Cписок использованной литературы 1. Байкова В.Н., Стрижевская А.М., Лебедева А.В. Детская онкология. Национальное руководство. – глава 4. Биохимические исследования. – стр. 89-99. 2. Гарин А.М. Место и значение антиметаболитов в химиотерапии злокачественных опухолей 3. Денисова Н. А., Плетенева Т. В., Байкова В. Н., Березов Т. Т. Кинетические характеристики биохимических показателей при приеме препарата «Консупрен» после аллогенной трансплантации почки // Бюллетень экспериментальной биологии и медицины. – 2003. – №3. – С. 44-49. 4. Дурнов Л.А., Голдобенко Г.В., Курмашов В.И. Детская онкология. - М.: Литера, 1997. – С. 37 – 41. 5. Дурнов Л.А., Голдобенко Г.В., Сигал Ст.Э. Настольная книга детского онколога. - М.: Параллель, 1994. – С. 57 – 63. 6. Иванов А.В. Химико-фармацевтический анализ метотрексата и изучение его токсичности при гемобластозах у детей // Диссертация к. ф. н. – М., 2005 7. Иванов А.В. Химико-фармацевтический анализ метотрексата и изучение его токсичности при гемобластозах у детей. Автореферат к.ф.н. – М., 2005. 8. Иванов А.В., Байкова В.Н., Родионова Г.М., Арзамасцев А.П. Сравнительная оценка методов определения концентрации метотрексата в сыворотке крови// XI Российский национальный конгресс «Человек и лекарство», М., 2004, с. 871. 9. Иванов А.В., Курмуков И.А., Будько А.П., Кошечкин К.А., Громова Е.Г., Кузнецова Л.С., Байкова В.Н., Маякова С.А. / Особенности метаболизма и элиминации метотрексата при проведении высокодозной 107 терапии у детей и взрослых с гематобластозами // Детская онкология. М. 2006 г. - № 2-3, С. 19-24 10. Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике. - Минск: «Беларусь», 2000. – 560 с. 11. Кишкун А.А., Назаренко Г.И. Клиническая оценка результатов лабораторных исследований. – М.: Медицина, 2002. – С. 136 – 138. 12. Клинико-лабораторные аналитические технологии и оборудование. Под редакцией В. В. Меньшикова./ - Академия. -2005. – с 240 - 654 13. Клиническая оценка результатов лабораторных исследований. Назаренко Г.И., Кишкун А.А./ - М.: «Медицина», 2000. С. 118 – 242. 14. Клиническая фармакокинетика Руководство Л. Е. Холодов, В. П. Яковлев. М. Медицина 1985 463 с. 15. Копосов П. В., Ковалев В. И., Ковалев Д. В. Профилактика и лечение осложнений химиотерапии злокачественных опухолей у детей: современные подходы. Руководство для врачей. - М.: ООО «Клевер Принт», 2002. - С. 73 – 78. 16. Копосов П.В. «Сопроводительная терапия цитостатического лечения системных заболеваний в педиатрии на модели солидных опухолей у детей»Автореферат д.м.н. –Санкт-Петербург, 2009 17. Кукес В.Г. Клиническая фармакокинетика –основа лабораторного мониторинга - лекарственных средств//Клиническая лабораторная диагностика. -1998. –N 3. -С. -25 – 28 18. Любимова Н.В., Аббасова А.Г., Курмашов В.И., Киселев А.В., Кушлинский Н.Е. / Токсическое поражение печени при программном лечении мБФМ-90 детей с гемобластозами. // Новое в онкологии. – 2001. - С. 37 – 44. 19. Мирошниченко И.И., Птицына С.Н., Кузнецова Н.Н., Калмыков Ю.М. Гомоцистеин — предиктор патологических изменений в организме человека // Российский медицинский журнал. — 2009. — Т. 17, № 4. — С. 24-28. 108 20. Основы токсикокологии. Куценко С.А. Санкт-Петербург, 2002 г. ТОМ 4, СТ. 119 21. Планирование и проведение клинических исследований. Под ред. Ю. Б. Белоусова. — М.: Издательство общества клинических исследователей, 2000. — с.300-584. 22. Плетенева Т. В., Степанова Н. С., Байкова В. Н., Кошечкин К. А. Биокинетические параметры показателей токсичности высоких доз метотрексата // Вестник Российского университета дружбы народов. – 2008. – № 3. – С. 10–14. 23. Подымова С.Д. Болезни печени. Руководство для врачей. – М.: «Медицина». – 1993. – 144 с. 24. Соколов А.В. Терапевтический лекарственный мониторинг// Качественная клиническая практика, 2002 г., №1, стр. 78-88 25. Соловьев В.Н., Фирсов А.А., Филов В.А. Фармакокинетика: Руководство. - М.: Медицина. - 1980. - 423 с. 26. Хазанов А.И. Функциональная диагностика заболеваний печени. – М.: «Медицина». - 1988. - 261с 27. Харкевич Д.А. Фармакология.-М.: «ГЭОТАР Медицина», 2000. – С. 585 – 587. 28. Холодов Л.E., Яковлев В. П., Клиническая фармакокинетика. M., 1985. 29. Шатц В.Д., хроматография: Сахартова Основы О.В. теории. Высокоэффективная Методология. жидкостная Применение в лекарственной химии. – Рига: Зинатне, 1988. – С. 81 – 8 30. Amador E., Dorfman L.E. Serum lactic dehydrohenase: An analytical assessment of current assays// Clin. Chem. – 1963. – Vol. 9. – P. 391. 31. Aquerreta I., Aldaz A., Giraldez J. et al. Methotrexate pharmacokinetics and survival in osteosarcoma // Pediatr. Blood. Cancer. – 2004. – Vol. 42. – N 1. – P. 52–58. 109 32. Arkin H., Ohnuma T., Kamen B. Multidrug rеsistаnсе in a human leukemic cell line selected for rеsistanсе to trimеtrехаtе // Cancer Rеs. – 1989. – Vоl. 49. – P. 6556–6561. 33. Aung L., Gorlick R., Healey J. Metachronous Skeletal Osteosarcoma in Patients Treated with Adjuvant and Neoadjuvant Chemotherapy for NonmetastaticOsteosarcoma // J. Clin. Onc. - 2003. – Vol. 21, №2. – Р. 342– 348. 34. Bacci G, Briccoli A, Ferrari S. et al. Neoadjuvant chemotherapy for osteosarcoma of the extremities with synchronous lung metastases: treatment with cisplatin, adriamycin and high dose of methotrexate and ifosfamide // Oncol Rep. - 2000- Vol. 7, № 2 – р.339-346. 35. Bacci G, Ferrari S, Bertoni F et al. Long-term outcome for patients with nonmetastatic osteosarcoma of the extremity treated at the istituto ortopedico rizzoli according to the istituto ortopedico rizzoli/osteosarcoma-2 protocol: an updated report // J Clin Oncol. - 2000 –Vol. 18, № 24.-Р.4016-4027. 36. Bacci G, Mercuri M, Briccoli A et al. Osteogenic sarcoma of the extremity with detectable lung metastases at presentation. Results of treatment of 23 patients with chemotherapy followed by simultaneous resection of primary and metastatic lesions // Cancer/ - 1997. –Vol. 79, №2 –Р.245-254. 37. Bacci G., Briccoli A., Longhi A. et al. Treatment and outcome of recurrent osteosarcoma: Experience atRizzoli in 235 patients initially treated with neoadjuvant chemotherapy // Acta Oncologica. – 2005. – Vol. 44. – Р. 748– 755. 38. Bacci G., Briccoli A., Rocca M. et al.Neoadjuvant chemotherapy for osteosarcoma of the extremities with metastases at presentation: recent experience at the Rizzoli Institute in 57 patients treated with cisplatin, doxorubicin, and a high dose of methotrexate and ifosfamide // Ann. Oncol. – 2003. – Vol. 14. – P. 1126–1134. 110 39. Bacci G., Ferrari S., Bertoni F., et al. Histologic response of high-grade nonmetastatic osteosarcoma of the extremity to chemotherapy // Clin. Orthop. - 2001- Vol. 386 –P.186-196. 40. Bacci G., Ferrari S., Longhi A. et al.. Delayed methotrexate clearance in osteosarcoma patients treated with multiagentregimens of neoadjuvant chemotherapy // Oncol. Rep. – 2003. – Vol. 10, N 4. – P. 851–857. 41. Baggott J., Morgan S. Methotrexate Catabolism to 7-Hydroxymethotrexate in Rheumatoid Arthritis Alters Drug Efficacy and Retention and Is Reduced by Folic Acid Supplementation// Artritis & rheumatism. - Vol. 60, № 8. - 2009 - p. 2257–2261 42. Bannwarth B, Péhourcq F, Schaeverbeke T. et al. Clinical pharmacokinetics of low-dose pulse methotrexate in rheumatoid arthritis// Clin Pharmacokinet. – 1996. - Vol 30, N.3. – p. 194-210. 43. Barr J.T., Jones J. Inhibition of Human Liver Aldehyde Oxidase: Implications for Potential Drug-Drug Interactions // Drug Met ans Disp/ 2011. - Vol. 39, N. 12 - p -2381-2386 44. Baum E., Gaynon P., Greenberg L. et al. Phase II study of cisdiсhlоrоdiаmminерlаtinum (П) in chilhood osteosarcoma: children’s cancer study group report // Cancer Treatm. Rep. – 1979. – Vol. 63. – Р. 1621–1625. 45. Bauters TG, Verlooy J, Robays H, Laureys G. Interaction between methotrexate and omeprazole in an adolescent with leukemia: a case report// Pharm World Sci. – 2008. – Vol 30, N.4 – p. 316-318. 46. Beaudin A.E., Stover P.J. Folate–mediated one–carbon metabolism and neural tube defects: balancing genome synthesis and gene expression// Birth. Defects Res. C. Embryo Today. - 2007. - Vol. 81 - p. 183–203. 47. Benet L., Hoener B.-A. Changes in plasma protein binding have little clinical relevance// Clinical pharmacology and therapeutics. -2002. – Vol.71, № 3. – p.115-121 111 48. Beorlegui B., Aldaz A., Ortega A. et al. Potential interaction between methotrexate and omeprazole // Ann Pharmacother. - 2000 – Vol.34, № 9, Р. 1024-1027. 49. Bernbeck B, Mauz-Korholz C, Zotz RB, Gobel U.Methylenetetrahydrofolate reductase gene polymorphism and glucocorticoid intake in children with ALL and aseptic osteonecrosis// Klin Padiatr. Nov-2003. – Vol. 215, №6.- Р. 327331. 50. Bertino J.A., Mini E., Sobrero A. et al. Methotrexate rеsistаnt сеlls as targets for selective chemotherapy // Adv. Enzyme Regul. – 1986. – Vоl. 24, N 1. – P. 3–11. 51. Bielack SS, Kempf-Bielack B, Delling Get al. Prognostic factors in highgrade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols //J Clin Oncol. -2002 – Vol. 20, №3. - P. 776-90. 52. Bielack SS, Marina N, Ferrari S. et al. Osteosarcoma: the same old drugs or more?// J Clin Oncol. -2008. - Vol. 26, №18. - P.3102-3103; 53. Borsi JD, Sagen E, Romslo I, Moe PJ. Comparative study on the pharmacokinetics of 7-hydroxy-methotrexate after administration of methotrexate in the dose range of 0.5-33.6 g/m2 to children with acute lymphoblastic leukemia // Med Pediatr Oncol.- 1990. – Vol.18, N.3., - p.217224. 54. Bostom A.G., Culleton B.F. Hyperhomocysteinemia in chronic renal disease//J. Am.Soc. Nephrol. – 1999. - Vol. 10 - P. 891–900. 55. Bostom A.G., Kronenberg F., Schwenger V. et al. Proteinuria and total plasma homocysteine levels in chronic renal disease patients with a normal range serum creatinine: Critical impact of true GFR// J. Am. Soc. Nephrol.2000 – Vol. 11 -P. 305–310. 56. Broxson E., Stork L., Allen R. et al. Changes in Plasma Methionine and Total Homocysteine Levels in Patients Receiving Methotrexate Infusions//Cancer Research.- 1989. – Vol.49. – P. 5879-5883 112 57. Buchen S, Ngampolo D, Melton RG et al. Carboxypeptidase G2 rescue in patients with methotrexate intoxication and renal failure// Br. J. Cancer – 2005. – Vol.92 - p 480–487 . 58. Buice RG, Evans WE, Karas J, et al. Evaluation of enzyme immunoassay, radioassay, and radioimmunoassay of serum methotrexate, as compared with liquid chromatography// J. Clin. Chem. Oct- 1982. – Vol. 20, № 10.- P. 765772 59. Cappuccio F., Bell R., Perry I., Refsum H. el al. Homocysteine levels in men and women of different ethnic and cultural background living in England// Atherosclerosis. -2002. – Vol.164.- p.95-102 60. Cecyn K.Z., Lee J., Oguro T. et al. Use of plasma exchange in methotrexate removal in a patient with osteosarcoma and acute renal insufficiency// Am J Hematol. – 2003. – Vol. 72, №3. –P. 209-211. 61. Ciaccio M., Bivona G., Bellia C. Therapeutical approach to plasma homocysteine and cardiovascular risk reduction// Therap. and Clin. Risk Manag. - 2008 – Vol. 4 - Р. 219–224. 62. Cichowicz D.J., Shane B. Mammalian folylpoly-g-glutamate synthetase: 1. Purification and general properties of the hog liver enzyme// Biochemistry. – 1987. – Vol 26 – P.504-512 63. Cociglio M., Hillaire-Buys D., Alric C. Determination of methotrexate and 7hydroxymethotrexate by liquid chromatography for routine monitoring of plasma levels//J. Chromatogr. – 1995. - Vol. 674 – P. 101-10. 64. Crews K.R., Liu T., Rodriguez-Galindo C. et al. High-dose methotrexate pharmacokinetics and outcome of children and young adults with osteosarcoma // Cancer. – 2004. –Vol. 100, №8. – P. 1724–1733. 65. Dalle J.H., Auvrignon A., Vassal G. et al. Interaction between methotrexate and ciprofloxacin// J Pediatr Hematol Oncol. – 2002. - Vol. 24, № 4. – P. 321-322. 113 66. Dalle J.H., Auvrignon A., Vassal G. et al. Methotrexate-ciprofloxacin interaction: report of two cases of severe intoxication// Arch Pediatr.- 2001 Vol. 8, №10. – P. 1078-1081. 67. Daly S., Cotter A., Molloy A.E., Scott J. Homocysteine and folic acid: implications for pregnancy//Semin. Vasc. Med., 2005,v. 5, p. 190–200. 68. Dao K, Ivanyuk A, Buclin T, Beck-Popovic M, Diezi M. et al. Pharmacokinetic Interaction Between Methotrexate and Chloral Hydrate// Pediatr Blood Cancer- 2013. – Vol.60. – p.518–520 69. Delepine N., Alkallaf S., Cornille H. et al. Progress and stagnation in chemotherapy protocols for primary osteosarcoma // Ann. Med. Interne (Paris). – 2003. – Vol. 154, №1. – P. 12–24. 70. Distel L, Neubauer S, Varon R, et al. Fatal toxicity following radio- and chemotherapy of medulloblastoma in a child with unrecognized Nijmegen breakage syndrome//Med Pediatr Oncol. – 2003. – Vol. 41, №1. - P. 44-48. 71. Eksborg S., Albertioni F., Rask C., Beck O., Palm C., Schroeder H., Peterson C. Methotrexate plasma pharmacokinetics: importance of assay method//Cancer. Lett. – 1996. – Vol.108. – P. 163 – 169. 72. Elshorbagy A. et al. Plasma creatinine as a determinant of plasma total homocysteine concentrations in the Hordaland Homocysteine Study: use of statistical modeling to determine reference limits// Clinical Biochemistry. 2007. – Vol. 40- p. 1209–1218 73. Ferrari S, Palmerini E. Adjuvant and neoadjuvant combination chemotherapy for osteogenic sarcoma // Curr. Opin. Oncol. – 2007– Vol. 19, №4. – P. 341– 346. 74. Ferrari S, Smeland S, Mercuri M et al. Neoadjuvant chemotherapy with highdose Ifosfamide, high-dose methotrexate, cisplatin, and doxorubicin for patients with localized osteosarcoma of the extremity: a joint study by the Italian and Scandinavian Sarcoma Groups // J Clin Oncol. – 2005. - Vol.1, № 34. - P.8845-8852 114 75. Ferrua B, Milano G, Ly B, et al.: An enzyme immunoassay design using labelled antibodies for the determination of haptens. Application to methotrexate assay// J. Immunol Methods. – 1983. – Vol. 60, №1-2. – P. 257268 76. Frei E., Jaffe N., Gerо M. et al. Adjuvant Chemotherapy of Osteogenic Sarcoma: Progress and Perspectives // J. Nat. Cancer Inst. –1978. – Vol. 60, №1. – Р. 3–10. 77. Frei E., Jаffе N., Таttеrsаll M.H.N. et. al. New approaches to cancer chemotherapy with methotrexate // New Engl. J. Mеd. – 1975. – Vоl. 292. – P. 846. 78. Friedman A.N., Bostom A.G., Selhub J. et al. The kidney and homocysteine metabolism// J.Am Soc. Nephrol., - 2001. - Vоl. 12. - Р. 2181–2189. 79. Friedman M.A., Carter S.K. The therapy of Osteogenic sarcoma current status and Thoughts for the futurе // J. Surg. Oncol. – 1971. – Vol. 4. – Р. 482–510. 80. Fukuhara K, Ikawa K, Morikawa N,Kumagai K. Population pharmacokinetics of high-dose methotrexate in Japanese adult patients with malignancies: a concurrent analysis of the serum and urine concentration data // J. Clin. Pharm. Ther. –2008. - Vol.33, - p . 677–684 ( 81. FyfеN.J., Goldman I.D. Characteristics of the vincristine - induced augmentation of methotrexate uptake in Ehrlich ascites tumor cells // J. Biol. Chem. – 1974. – Vol. 248. – Р. 50–67. 82. Garattini E., Terao M. The role of aldehyde oxidase in drug metabolism Expert Opin// Drug Metab. Toxicol. – 2012. - Vol 8, №4 - p487-503 83. Gebhardt M.C. Bone Tumors in children. Differential characteristics and treatment // Postgrad. Med. – 1984. – Vol. 76. – N 4. – P. 87–96. 84. Giacomini KM, Huang S-M, Tweedie DJ et al.; for the the International Transporter Consortium. Membrane transporters in drug development// Nat. Rev. Drug Discover. – 2010. – Vol.9 - p 215–236. 115 85. Goorin AM, Harris MB, Bernstein M et al. Phase II/III trial of etoposide and high-dose ifosfamide in newly diagnosed metastatic osteosarcoma: a pediatric oncology group trial // J Clin Oncol.- 2002- Vol. 15, №20 – P. 426-433. 86. Goorin AM, Schwartzentruber DJ, Devidas M. et al. Pediatric Oncology Group. Presurgical chemotherapy compared with immediate surgery and adjuvant chemotherapy for nonmetastatic osteosarcoma: Pediatric Oncology Group Study POG-8651//J Clin Oncol. - 2003 – Vol. 15, №21. - P.15741580. 87. Gurney J.G., Severson R.K., Davis S. et al. Incidence of cancer in children in the United States. Sex-, race-, and 1-year age-specific rates by histologic type // Cancer. - 1995.- Vol.15, № 8- p. 2186-195. 88. Gurney JG, van Wijngaarden E. Extremely low frequency electromagnetic fields (EMF) and brain cancer in adults and children: review and comment // Neuro Oncol.- 1999 – Vol.1, №3- p.212-220. 89. Guttormsen A.,, Ueland M., Lønning E., Refsum. Kinetics of Plasma Total Homocysteine in Patients Receiving High-Dose Methotrexate Therapy// Clinical Chemistry. –1998. -Vol. 44, № 9 –p.50-54 90. Gоldmаn I.D. The сhагасtеristiсs of membrane transport of amethopterin and the naturally occurring folates // Ann. NY Acad. Sсi.– 1971.– Vоl. 186. – P. 400–422. 91. Gоldmаn I.D., Matherly L.H. The сеllulаr pharmacology of methotrexate // Pharmac. Ther. – 1985. – Vol. 28. – P. 77–102. 92. Harris MB, Gieser P, Goorin AM Treatment of metastatic osteosarcoma at diagnosis: a Pediatric Oncology Group Study // J Clin Oncol. – 1998. – Vol.16, №11. - P. 3641-3648. 93. Hauke Ru¨ hs1, Achim Becker1, Anne Drescher1, John C. Panetta2, ChingHon Pui3, Mary V. Relling2, Ulrich Jaehde. Population PK/PD Model of Homocysteine Concentrations after High-Dose Methotrexate Treatment in Patients with Acute Lymphoblastic Leukemia//PLOS ONE. -2012. – Vol. 7 – №. 9 –p.46-55. 116 94. Hegyi M, Gulácsi A, Cságoly E, Csordás K. Clinical relations of methotrexate pharmacokinetics in the treatment for pediatric osteosarcoma.// J Cancer Res Clin Oncol. -2012 – Vol 138, №10 – p. 1697-702. 95. Hegyi M. Lautner-Csorba O, Semsei AF Associations of novel genetic variations in the folate-related and ARID5B genes with the pharmacokinetics and toxicity of high-dose methotrexate in paediatric acute lymphoblastic leukaemia.// Br J Haematol. – 2014- Vol 9.- p 100-101 96. Hegyi M., Semsei A., Csґagoly E., ., The glucocorticoid receptor gene polymorphism N363S predisposes to more severe toxic side effects during pediatric acute lymphoblastic leukemia (ALL) therapy// Int J Hematol.- 2013 -Vol97, №2 - p:216-22. 97. Hempel L, Misselwitz J, Fleck C, et al.: Influence of high-dose methotrexate therapy (HD-MTX) on glomerular and tubular kidney function// Med Pediatr Oncol. - 2003. – Vol. 40, №6.-P. 348- 354. 98. Holland J. Adriamycin and amputation in primary osteogenic sarcoma study group // J.Nat.Cancer Inst. –1974. – Vol. 52. – P. 12–13. 99. Holmboe L. et al. High dose methotrexate chemotherapy: pharmacokinetics, folate and toxicity in osteosarcoma patients //British Journal of Clinical. - Br J Clin Pharmacol. - 73:1 -106-114. 100. Hooijberg JH, Broxterman HJ, Kool M et al. Antifolate resistance mediated by the multidrug resistance proteins MRP1 and MRP2.// Cancer Res. – 1999 Vol.59 – p/ 2532–2535 101. Huvos A.G. Bone Tumors, Diagnosis, Treatment and Prognosis .– Montreal etc.: W.B. Saunders, 1991. 102. Inoue K, Yuasa H. Molecular basis for pharmacokinetics and pharmacodynamics of methotrexate in rheumatoid arthritis therapy//. Drug Metab Pharmacokinet. -2013- v 26. 103. Jaffe N., Frei E. 3rd, Traggis D. et al. Adjuvant methotrexate and citrovorum-factor treatment of osteogenic sarcoma //N Engl J Med. – 1974.Vol. 7, № 291. – P.994-997. 117 104. Jaffe N., Frei Е., Watts H. High-dose methotrexate in osteogenic sarcoma: a 5-year experience // Cancer Treat. Repts. – 1978. – Vol. 62, № 2. – Р. 259– 264. 105. Jaffe N., Goorin A., Link M. et. al. High-dose methotrexate in osteogenic sarcoma: Adjuvant chemotherapy and limb salvage, Results // Cancer Treat. Rep. –1981. – Vol. 65. (Suррl) – Р. 99–106. 106. Jaffe N., Gorlick R. High-Dose Methotrexate in Osteosarcoma: Let the Questions Surcease—Time for Final Acceptance// J. of Clin.Onc. – 2008. - – Vol. 28. – N. 27. – p. 4365 – 4366 107. Jamison R.L., Hartigan P., Kaufman J.S. et al. Effect of Homocysteine Lowering on Mortality and Vascular Disease in Advanced Chronic Kidney Disease and End–stage Renal Disease. A Randomized Controlled Trial// JAMA. - 2007. -Vol. 298 - P. 1163–1170. 108. Janinis J., McTiernan A., Driver D. et al.A pilot study of short-course intensive multiagent chemotherapyin metastatic and axial skeletal osteosarcoma // Annals of Oncology. – 2002.– Vol.13. – Р. 1935–1944. 109. Joerger M, Huitema A, Van den Bongard H et al. Determinants of the elimination of methotrexate and 7-hydroxy-methotrexate following high-dose infusional therapy to cancer patients //Br. J. Clin. Pharmacol.- 2005 - Vol. 62 – p. 71–80 110. Joerger M. el at. Determinants of the elimination of methotrexate and 7hydroxy-methotrexate following high-dose infusional therapy to cancer patients. British Journal of Clinical Pharmacology. -2005 – Vol.62, №1 – p. 71–80 111. Joerger M., Huitema A., van den Bongard H. Determinants of the elimination of methotrexate and 7-hydroxy-methotrexate following high-dose infusional therapy to cancer patients// Br J Clin Pharmacol. – 2006- Vol. 62, №.1 -p. 71–80 118 112. Jolley M.E. Fluorescence polarization immunoassay for the determination of therapeutic drug levels in human plasma// Journal of Analytical Toxicity. – 1981. – Vol. 5. – P. 228 – 232. 113. Jurgens Н., Соbеl V., Nirenberg A. et al. Cisplatinum bei fortgeschritlenem metastasiertem osteosarkom. //Baselе.- 1980. – Р. 112–115. 114. Kager L, Zoubek A, Pötschger U. et al. Primary metastatic osteosarcoma: presentation and outcome of patients treated on neoadjuvant Cooperative Osteosarcoma Study Group protocols // J Clin Oncol.- 2003- Vol. 21, №10. –P. 2011-2018. 115. Kang Min Lee et al. Two Pediatric Osteosarcoma Cases with Delayed Methotrexate Excretion: Its Clinical Course and Management.// Cancer Res Treat. – 2011 – Vol.43, N1 – p.67-70 116. Kidd P.M. Alzheimer’s disease, amnestic mild cognitive impairment, and age–associated memory impairment: current understanding and progress toward integrative prevention// Altern. Med. Rev. - 2008, - Vol. 13 - P. 85– 115. 117. Kishi S, Griener J, Cheng C, Das S, Cook EH, Pei D, Hudson M, Rubnitz J, Sandlund JT, Pui CH, Relling MV. Homocysteine, pharmacogenetics, and neurotoxicity in children with leukemia // J Clin Oncol.- 2003. –Vol 21. – P. 3084-3091. 118. Knight J.A., Haymond R.E. γ-glutamyltransferase and alkaline phosphatase activities compared in serum of normal children and children with liver disease// Clin. Chem. – 1981. – Vol. 27. – P. 48. 119. Koomdee N, Hongeng S, Apibal S, et al. Association between polymorphisms of dihydrofolate reductase and gamma glutamyl hydrolase genes and toxicity of high dose methotrexate in children with acute lymphoblastic leukemia// Asian Pac J Cancer Prev.-2012. – Vol.13 – N.7 3461-3464. 120. Kraus J.P. Biochemistry and molecular genetics of cystathionine beta– synthase deficiency// Eur. J. Pediatr. – 1998. - Vol. 157. - P. 50–53. 119 121. Lange J., Blatt J., Sather N., Meadows T. Randomized comparison of moderate-dose methotrexate infusions to oral methotrexate in children with intermediate risk acute lymphoblastic leukemia: a Childrens Cancer Group study// Med. Pediatr. Oncol. – 1996.– Vol.27. – P. 15 – 20. 122. Lennard L. Therapeutic drug monitoring of antimetabolic cytotxic drugs // Brit. J. Clin. Pharmacol. – 1999. - Vol. 47, №2. - P. 131-143. 123. Lentz S.R., Haynes W.G. Homocysteine: Is it a clinically important cardiovascular risk factor? //Clev. Clin. J. Med. - 2000.- Vol. 71 - P. 729– 734. 124. Levêque D. et al. Pharmacokinetic drug–drug interactions with methotrexate in oncology// Expert Rev. Clin. Pharmacol. – 2011. – Vol.4, №6. – p. 743–750 125. Lingg R. M., Hempel G., Rots M. G. et al. Effects and interaction of 7- hydroxy methotrexate and methotrexate in leukaemic cells ex vivo measured by the thymidylate synthase inhibition assay. - 2003.- Vol. 65 - P. 345–378. 126. Lippens R.J., Winograd B.M. Methotrexate concentration levels in the cerebrospinal fluid during high-dose methotrexate infusions: an unreliable prediction// Pediatr. Hematol. Oncol. – 1988. – Vol.249. – P. 249. 127. Mahadeo K.M, Dhall G, Panigrahy A, Lastra C, Ettinger LJ. Subacute methotrexate neurotoxicity and cerebral venous sinus thrombosis in a 12year-old with acute lymphoblastic leukemia and methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism: homocysteine-mediated methotrexate neurotoxicity via direct endothelial injury // Pediatr Hematol Oncol. – 2010. – Vol. 27, N.1. –p.46-52. 128. Mao J, Zhang L, Shen H, Tang Y, Song H, Zhao F, Xu W. Creatinine clearance rate and serum creatinine concentration are related to delayed methotrexate elimination in children with lymphoblastic malignancies. Neoplasma. 2014;61(1):77-82. 129. McCrudden E.A., Tett S.E. Improved high-performance liquid chromatography determination of methotrexate and its major metabolite in 120 plasma using a poly(styrene-divinylbenzene) column// J. Chromatogr, - 1999. - Vol. 721. - P. 87 – 92. 130. Mikkelsen TS, Mamoudou AD, Tuckuviene R, Wehner PS, Schroeder H. Extended duration of prehydration does not prevent nephrotoxicity or delayed drug elimination in high-dose methotrexate infusions: a prospectively randomized cross-over study. Pediatr Blood Cancer. -2014- Vol.61, №2– p.297-301 131. Mittal R, Mottl H, Nemec J. Acute transient cerebral toxicity associated with administration of high-dose methotrexate// Med Princ Pract. – 2005. Vol. 14, № 3. – P.202-204. 132. Moat S.J. Plasma total homocysteine: instigator or indicator of cardiovascular disease?// Ann. Clin. Biochem. – 2008.- Vol. 45. -Р. 345– 348. 133. Moe P.J., Holen A.S. High-dose methotrexate in childhood all// Pediatr. Hematol. Oncol.–2000. – Vol 17. – P. 615-22. 134. Müller J, Kralovánszky J, Adleff V, et al. Toxic encephalopathy and delayed MTX clearance after high-dose methotrexate therapy in a child homozygous for the MTHFR C677T polymorphism// Anticancer Res. - 2008. – Vol.28 – N.5B –P. 3051-3054. 135. Naess I.A., ChristiansenS.C., Romundstad P.R. et al. Prospective study of homocysteine and MTHFR 677TT genotype and risk for venous thrombosis in a general population—results from the HUNT 2 study// Br. J. Haematol. – 2008. - Vol.141. - P. 529–535. 136. Nevozhaj D.V., . Budzynskaya R, Kan'skaya U,. Yagello M. Modern Ideas about the mechanism of antineoplactic action of methotrexate and resistance to it// Pacific Medical Journal. - 2006. - Vol. 4. - P. 12-16. 137. Nicoara A., Duffaud F., Guillet P., Pignon T., Catalin J., Durand A., Favre R. Individual dose adjustment of high-dose methotrexate in clinical practice// Rev. Med. Intern. – 1996. – Vol.17. – P. 689-98. 121 138. Niyikiza C., Sharyn D. Baker, David E. Seitz, et al.Homocysteine and Methylmalonic Acid: Markers to Predict and Avoid Toxicity from Pemetrexed Therapy //Mol Cancer Ther - 2004.- Vol.1- P. 545-552. 139. Nozaki Y, Kusuhara H, Kondo T et al. Species differences in the inhibitory effect of nonsteroidal anti-inflammatory drugs on the uptake of methotrexate by human kidney slices.// J. Pharmacol. Exp. Ther – 2007. – Vol.322, p1162– 1170 140. O'Marcaigh AS, Johnson CM, SmithsonWA, et al.: Successful treatment of intrathecal methotrexate overdose by using ventriculolumbar perfusion and intrathecal instillation of carboxypeptidase G2// Mayo Clin Proc. – 1996. Vol. 71, №2 – P.161-165 141. Ongaro A, De Mattei M, Porta M, et al. Gene polymorphisms in folate metabolizing enzymes in adult acute lymphoblastic leukemia: effects on methotrexate-related toxicity and survival// Haematologica. - 2009. – Vol. 94, №.10 – Р. 1391-1398 142. Pauley J.L, Panetta J.C, Crews K.R. el al. Between-course targeting of methotrexate exposure using pharmacokinetically guided dosage adjustments. Cancer Chemother Pharmacol. – 2013- Vol 72, №2 – p.369-78 143. Paxton J.W. The protein binding and elimination of methotrexate after intravenous infusion in cancer // Clinical and Experimental Pharmacology & Physiology -1982-Vol. 9- p. 225-234 144. Perna A., Ingrosso D., Lombardi C. et al. Possible mechanisms of homocysteine toxicity// Kidney International.-2003. - Vol. 63, № 84 -P. S137–S140 145. Pesce M.A., Bodourian S.H. Evaluation of a fluorescence polarization immunoassay procedure for quantitation of methotrexate// The Drug Monit. – 1986. – Vol.8 – P.115-21. 146. Peyriere H. et al. Optimal Management of Methotrexate Intoxication in a Child with Osteosarcoma// American Journal of Kidney Diseases.-2009.-Vol. 53, № 5. –P. 871-874 122 147. Popelka S.R., Miller D.M., Holen J.T. and Kelso D.M. Fluorescence polarization immunoassay. Analizer for the rapid and precise measurement of fluorescence polarization using disposable cuvettes// Clin Chem. – 1981. – Vol. 27. – P. 1198 – 1201. 148. Potter K. Homocysteine and cardiovascular disease: should we treat?// Clin. Biochem. Rev. - 2008. – Vol. 29. -Р. 27–30. 149. Pryde DC, Dalvie D, Hu Q, Jones P, Obach RS, Tran TD Aldehyde oxidase: an enzyme of emerging importance in drug discovery//. J Med Chem -2010 – Vol 53, -p. 8441–8460. 150. Prytz S., PettersenI., Aarbakke J. Methotrexate measurements in plasma: comparison of enzyme multiplied immunoassay technique, TDx fluorescence polarization immunoassay, and high pressure liquid chromatography// The Drug Monit. – 1986 – Vol. 8 – P. 368-72. 151. Pui C.H, Boyett J.M, Relling MV. et al. Sex differences in prognosis for children with acute lymphoblastic leukemia// J Clin Oncol. -1999. – Vol. 17, №3 – Р. 818-824. 152. Refsum H. el al. Plasma Homocysteine in Children with Acute Lymphoblastic Leukemia: Changes during a Chemotherapeutic Regimen Including Methotrexate// Cancer research.-1991. - Vol. 51. – P. 828-835 153. Refsum H., Ueland P., S. Kvinnsland. Acute and Long-Term Effects of High-Dose Methotrexate Treatment on Homocysteine in Plasma and Urine//Cancer research. -1986. – Vol. 46. - P. 5385-5391 154. Refsum. H. et al. Homocysteine Determinations: An Expert Opinion//Clinical Chemistry. –– 2004.- V. 50, №1. -Р. 3–32. 155. Reid T, Yuen A, Catolico M, Carlson RW. Impact of omeprazole on the plasma clearance of methotrexate// Cancer Chemother Pharmacol. - 1993. – Vol. 33, №1. –Р.82-84. 156. Rhee M.S., Galivan J. Conversion of methotrexate to 7-hydroxymethotrexate polyglutamates in cultured rat hepatic cells// Cancer Res. - 1986 – Vol. 46- P. 379 -383 123 157. Richard S. Lord, Fitzgerald K. Significance of Low Plasma Homocysteine// Metametrix, Inc. -2010.- Vol.5 158. Roberts D., Buckley N. Pharmacokinetic Considerations in Clinical Toxicology. //Clin Pharmacokinet – 2007 – Vol,46, № 11. – p. 897-939 159. Reeves DJ. Bain E1, Birhiray RE. Drug-drug interaction between methotrexate and levetiracetam resulting in delayed methotrexate elimination. Ann Pharmacother. 2014 – Vol.48, №2 - p:292-6 160. Saland J.M, Leavey P.J, Bash R.O, et al. Effective removal of methotrexate by high-flux hemodialysis// Pediatr Nephrol. – 2002 – Vol.17, №10. – P.825829 161. Santucci R, Levêque D, Herbrecht R. Cola beverage and delayed elimination of methotrexate. Br J Clin Pharmacol. 2010 – Vol 70, №5 p:762-4. 162. Santucci R, Levêque D, Lescoute A, Kemmel V, Herbrecht R. Delayed elimination of methotrexate associated with co-administration of proton pump inhibitors//. Anticancer Res. –2010 - vol.30, - p3807–3810 163. Schafer J.H., Glass T.A., Bolla K.I. et al. Homocysteine and Cognitive Function in a Population–based Study of Older Adults// J. Am. Geriatr. Soc.2005. - Vol. 53, - P. 381–388. 164. Scott JR1, Ward DA, Crews KR et al. Hypersensitivity reaction to highdose methotrexate and successful rechallenge in a pediatric patient with osteosarcoma// Pediatr Blood Cancer. – 2014 – Vol 61, №2 - p:373-5 165. Shigeyuki K., Kazumi S., Keiko N, et al. Variation of Hepatic Methotrexate 7-Hydroxylase Activity in Animals and Human // IUBMB Life. – 1999. – Vol. 48. – Р. 607–611. 166. Slordal L., Kolmannskog S., Prytz P. Pharmacokinetics of methotrexate and 7-hydroxymethotrexate after high-dose methotrexate therapy// Pediatric Hematology and Oncology. – 1986 - Vol. 3. - Р. 127- 134 167. Sterba J. et al. Pretreatment Plasma Folate Modulates the Pharmacodynamic Effect of High-Dose Methotrexate in Children with Acute 124 Lymphoblastic Leukemia and Non-Hodgkin Lymphoma: “Folate Overrescue” Concept Revisited// Clinical Chemistry – 2006.- Vol. 52:4 – P.692–700 168. Suzuki K, Doki K, Homma M et al. Co-administration of proton pump inhibitors delays elimination of plasma methotrexate in high-dose methotrexate therapy// Br. J. Clin. Pharmacol. -2009 - Vol67, p 44–49 169. Suzuki K, Doki K, Homma M, Tamaki H, Hori S, Ohtani H, Sawada Y, Kohda Y. Co-administration of proton pump inhibitors delays elimination of plasma methotrexate in high-dose methotrexate therapy// Br J Clin Pharmacol - 2009.- Vol. 67, №1.- P.44-94 170. Szegedi S.S., Castro C.C., Koutmos M., Garrow T.A. Betaine– homocysteine s–methyltransferase–2 is an s–methylmethionine– homocysteine methyltransferase // J. Biol. Chem. -2008. - Vol. 283. - P. 8939–8945. 171. Thyss A, Milano G, Kubar J, Namer M, Schneider M. Clinical and pharmacokinetic evidence of a life-threatening interaction between methotrexate and ketoprofen. // Lancet 1, - 1986 - vol1 - p256–258. 172. Titier K., Lagrange F., Pehourcq F. . et al. Pharmacokinetic interaction between high-dose methotrexate and oxacillin// Ther Drug Monit. - 2002 Vol. 24, №4. - P. 570-572. 173. Tolmunen T., Hintikka J., Voutilainen S. et al. Association between depressive symptoms and serum concentrations of homocysteine in men: a population study//Am. J. Clin. Nutr. - 2004. - Vol. 80. -P. 1574–1578. 174. Trabetti E. Homocysteine, MTHFR gene polymorphisms, and cardio– cerebrovascular risk// J. Appl. Genet.- 2008. - Vol. 49,- P. 267–282. 175. Trevino LR, Shimasaki N, Yang W et al. Germline genetic variation in an organic anion transporter polypeptide associated with methotrexate pharmacokinetics and clinical effects//. J. Clin. Oncol. – Vol.27 - p 5972– 5978 125 176. Turello R, Rentsch K, Di Paolo E, et al. Renal failure after high-dose methotrexate in a child homozygous for MTHFR C677T polymorphism// Pediatr Blood Cancer. -2008. - Vol. 50 – N.1 -154-156. 177. Valik D, Sterba J, Bajciova V, Demlova R. Severe encephalopathy induced by the first but not the second course of high-dose methotrexate mirrored by plasma homocysteine elevations and preceded by extreme differences in pretreatment plasma folate// Oncology. -2005. – Vol.69, №. 3. -Р.269-72. 178. Valik D., Radina M., Sterba J., Vojtesek B. Homocysteine: exploring its potential as a pharmacodynamic biomarker of antifolate chemotherapy // Pharmacogenomics. - 2004.- Vol. 5, № 8. - P 1151-62. 179. Virtanen J.K., Voutilainen S., Alfthan G. Homocysteine as a risk factor for CVD mortality in men with other CVD risk factors: the Kuopio Ischaemic Heart Disease Risk Factors (KIHD) Study// J. Intl. Med. – 2005. - Vol. 257 Р. 255–262. 180. Wangm Y.M., Fujimoto T.V. Clinical pharmacokinetics of methotrexate in children// Clin. Pharmacokinet. – 1993. – Vol. 48. – P. 335. 181. Widemann BC, Adamson PC. Understanding and managing methotrexate nephrotoxicity. Oncologist.- 2006 - Vol;11, №6 - p:694-703. 182. Wehner PS, Schroeder H.et al. Extended duration of prehydration does not prevent nephrotoxicity or delayed drug elimination in high-dose methotrexate infusions: a prospectively randomized cross-over study // Pediatr Blood Cancer. - 2014 – Vol 61, №2 - p297-301 183. Yamada K, Takahashi M, Yoshida M. A case of subacute transient cerebral dysfunction in a osteosarcoma patient following high-dose methotrexate// Gan To Kagaku Ryoho. – 2002. – Vol. 29, №3. - P.469-72. 184. Yamamoto K, Sawada Y, Matsushita Y, Moriwaki K, Bessho F, Iga T. Delayed elimination of methotrexate associated with piperacillin administration// Ann. Pharmacother. -1997 – Vol 31 - p 1261–1262 185. Zarychanski R, Wlodarczyk K, Ariano R, Bow E. Pharmacokinetic interaction between methotrexate and piperacillin/tazobactam resulting in 126 prolonged toxic concentrations of methotrexate// J. Antimicrob. Chemother. – 2006. - Vol58 - p 228–230 186. Zelcer S, Kellick M, MemorialSloanKetteringCancerCenter Wexler experience LHet with al. The outpatient administration of high dose methotrexate with leucovorin rescue // Pediatr Blood Cancer.- 2008. - Vol. 50. – N 6. - 1176-1180. 187. Zelcer S., Kellick M., Wexler L.H. et al. Methotrexate levels and outcome in osteosarcoma // Pediatr. Blood Cancer. – 2005. – Vol. 44, №7. – P. 638– 642. 188. Zientek M., Ying J., Youdim K. et al. In Vitro-In Vivo Correlation for Intrinsic Clearance for Drugs Metabolized by Human Aldehyde Oxidase// Drug metabolism and disposition. – 2010. - Vol. 38, №. 8. – p.1322 -1327 189. Ziółkowska H, Kisiel A, Leszczyńska B. et al. Continuous veno-venous hemodiafiltration in methotrexate intoxication //Med Wieku Rozwoj.- 2013 – Vol 17, №4 – p.347-54.